Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
1Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310;
2David Ben-Gurion University in Negev.8410501, Israel, Be'er Sheva.
Summary
The actuality of the problem of neurodegenerative diseases, such as Alzheimer's disease, Parkinson's disease, Lewy body dementia, fronto-temporal dementia and others, has been steadily increasing in recent decades. It is mostly due to the global trend towards an increase in life expectancy, leading to the aging of general population (an increase in the proportion of elderly and senile people in it). Other factors also might play a role, such as environmental pollution in many countries of the world (an increase in the incidence of Parkinson’s disease is associated, in particular, with the influence of some neurotoxins deriving in our organism from some pesticides, and an increase in the incidence of Alzheimer’s disease some specialists link to environmental pollution with aluminium salts).
In such patients, the adequate and timely use of drugs that possibly can not just relieve or reduce some symptoms associated with neurodegeneration, but also slow down or even partially reverse neurodegenerative processes in the CNS, and can exert a true neuroprotective effect is of particular relevance. One of the most proven drugs in this regard is memantine, an uncompetitive antagonist (more precisely, a negative allosteric modulator) of the magnesium site of NMDA glutamatergic receptors. Several of our other articles have already been devoted to this drug.
This article is devoted to a review of the latest (over the past 5 years) data on the efficacy and safety of using memantine in сlinical practice, with special emphasis on its use in neurodegenerative diseases.
Keywords: memantine, NMDA receptor, glutamatergic neurotransmission, neurodegeneration, neurotoxicity, neuroprotection, Alzheimer's disease, Parkinson's disease, frontal-temporal dementia, Lewy body dementia, vascular dementia
For citation: Yu.V. Bykov, R.A. Bekker. A review of the evidence regarding efficacy and safety of memantine in сlinical practice: a focus on neurodegenerative diseases. Psychiatry and psychopharmacotherapy. 2021; 2: 17–28.
Нейродегенеративные заболевания ЦНС являются большой проблемой не только для самих пациентов и для членов их семей или работников по уходу за ними, но и для всей медицинской системы, всего общества и экономики всех стран мира. Общемировые затраты на лечение и уход за такими пациентами оцениваются приблизительно в 1 триллион долларов США ежегодно [C. Patterson, 2018].
Как известно, на сегодняшний день основными причинами заболеваемости, инвалидности и преждевременной смертности в популяции, согласно статистике ВОЗ, являются хронические сердечно-сосудистые заболевания (ССЗ), такие как ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ) и др. А наиболее частыми непосредственными причинами преждевременной инвалидизации или преждевременной смертности — являются связанные с наличием хронических ССЗ такие острые сосудистые катастрофы, как острый инфаркт миокарда (ОИМ), острое нарушение мозгового кровообращения (ОНМК) в виде ишемического или геморрагического инсульта [D. Mitrečić et al, 2020].
Вместе с тем хронические нейродегенеративные заболевания ЦНС, особенно те из них, которые постепенно приводят к развитию деменции, — являются одним из наиболее тяжелых обременений как для членов семьи пациента, так и для систем здравоохранения и социального обеспечения, для экономики и общества в целом [D. Mitrečić et al, 2020].
Термин «деменция» является зонтичным. Он применяется к целому ряду неврологических расстройств (преимущественно из числа нейродегенеративных заболеваний, но не только), для которых характерна способность вызывать прогрессирующее снижение когнитивных функций. В частности, сюда относится деменция при болезни Паркинсона (БП), болезни Хантингтона (БХ), болезни Альцгеймера (БА), деменция с тельцами Леви (ДТЛ), лобно-височная деменция (ЛВД), сосудистая деменция (СД), мультиинфарктная деменция и др. [E. L. Cunningham et al, 2015; T. K. Thakur et al, 2016].
Среди всех упомянутых нейродегенеративных заболеваний наиболее частой причиной деменции является БА. Именно на это заболевание, согласно статистике, приходится от 70% до 80% всех выявленных случаев деменции. При этом БА имеет две формы — спорадическую и семейно-наследственную. Вторая, семейно-наследственная, форма БА часто манифестирует относительно рано и может протекать особенно тяжело, с быстрым прогрессированием когнитивных нарушений (КН) и быстрой инвалидизацией пациента [A. S. Schachter, K. L. Davis, 2000].
Случаи же СД составляют от 5% до 10% от всех выявленных случаев деменции. Заболеваемость СД повышается с возрастом: на каждые 5 лет возраста она удваивается [O. Uwagbai, 2020].
Частота встречаемости ДТЛ, согласно статистике, составляет тоже от 5% до 10% от всех выявленных случаев деменции. Однако эпидемиологические данные, касающиеся распространенности ДТЛ в популяции, могут быть не совсем точными, потому что диагноз ДТЛ часто упускается из виду при жизни пациента. Эта болезнь при жизни пациента может длительное время неверно диагностироваться как БА (при преобладании когнитивных нарушений) или же как БП (при преобладании двигательных нарушений). Нередко правильный диагноз — ДТЛ — ставится таким пациентам лишь посмертно, когда в мозгу обнаруживаются характерные именно для ДТЛ патоморфологические и патогистологические изменения, в частности патогномоничные для ДТЛ включения в нейронах — так называемые «тельца Леви» [J. M. P. Kane et al, 2018].
Что же касается ЛВД, то это заболевание является второй по частоте, после БА, причиной развития деменции у пациентов моложе 65 лет. Не является редкостью развитие ЛВД и у пациентов более пожилого возраста. Среди пациентов старше 65 лет — 25% (то есть ¼) от всех выявленных случаев деменции связаны именно с ЛВД [J. J. Young et al 2018].
Случаи, когда развитие дементного состояния связано с наличием у пациента одновременно двух или нескольких нейродегенеративных заболеваний, или иных заболеваний, способных привести к деменции, обозначаются как случаи «деменции смешанного типа». Среди деменций смешанного типа наиболее часто встречаются случаи коморбидности БА и БП, а также случаи коморбидности одной из них (БА или БП) с СД, и случаи коморбидности какой-либо другой деменции нейродегенеративного типа (ДТЛ, ЛВД) с СД [N. Custodio et al, 2017].
Между тем достаточно давно известно, что глутамат является основным и наиболее распространенным возбуждающим нейромедиатором в ЦНС. Также хорошо известно, что адекватная глутаматергическая нейропередача критически важна для реализации таких ключевых для функционирования ЦНС процессов, как долговременная потенциация (long-term potentiation — LTP) или, напротив, долговременное угнетение (long-term depression — LTD), синаптическая пластичность и синаптогенез или, напротив, элиминация ненужных и избыточных синапсов. Известно и то, что наиболее важную роль в регуляции этих процессов играют именно те подвиды глутаматергической нейропередачи, которые опосредуются через ионотропные NMDA и AMPA (α-амино-3-гидрокси-5-метил-4-изоксазол-пропионовой кислоты) подтипы глутаматергических рецепторов [B. Kuns et al, 2020].
В свою очередь, вышеупомянутые процессы долговременной потенциации и долговременного угнетения, синаптогенеза и синаптической пластичности или, напротив, элиминации избыточных глутаматергических синапсов — играют важнейшую роль в регуляции таких процессов, как обучение, запоминание и воспроизведение нужной информации или, напротив, забывание ненужной информации [B. Kuns et al, 2020].
Глутаматергический рецептор подтипа NMDA представляет собой вольтаж-зависимый (или, другими словами, потенциал-зависимый) катионный канал в мембране нервной клетки. В своем открытом, или активированном, состоянии этот ионный канал способен пропускать в одну сторону (из внешней среды — внутрь клетки) некоторые одновалентные и двухвалентные катионы. Этот ионный канал отдает селективное предпочтение катионам кальция (Ca2+), но может пропускать также катионы натрия (Na+). Однако в физиологических условиях бóльшую часть времени NMDA рецептор находится в «заблокированном» состоянии. В этом состоянии сама возможность открытия встроенного в NMDA рецептор ионного канала, даже при выполнении двух других обязательных условий для активации этого рецептора — при одновременном связывании глутамата с «основным» (глутаматным) сайтом NMDA рецептора, а глицина — с его глициновым сайтом, — заблокирована катионом магния (Mg2+), который связывается со специальным так называемым «магниевым сайтом» NMDA рецептора. Таким образом, катион Mg2+ в нормальных физиологических условиях является негативным аллостерическим модулятором (или, де-факто, даже блокатором) активности NMDA рецептора [P. Xia et al, 2010; B. Kuns et al, 2020].
Уменьшение по абсолютной величине имеющегося в норме отрицательного потенциала клеточной мембраны (ее деполяризация) при возбуждении нервной клетки (например, через воздействие на какие-то другие клеточные рецепторы) приводит к высвобождению ионов магния из связи с этим аллостерическим сайтом на NMDA рецепторе. Это открывает возможность для активации NMDA рецептора при одновременном воздействии на него глутамата и глицина, и, соответственно, для открытия встроенного в NMDA рецептор ионного канала. А это, в свою очередь, вызывает входящий приток ионов Ca2+ и, в меньшей степени, ионов Na+ внутрь клетки, и усиление деполяризации мембраны (дальнейшее уменьшение по модулю ее отрицательного потенциала), то есть — дальнейшее усиление возбуждения уже возбужденной нервной клетки [P. Xia et al, 2010; B. Kuns et al, 2020].
В нормальных физиологических условиях такое усиление, или потенцирование возбуждения изначально уже возбужденной нервной клетки с помощью опосредованной NMDA рецепторами глутаматергической нейропередачи — ограничивается «сверху» другими механизмами. Это не позволяет развиться эксайтотоксичности (чрезмерному возбуждению нервной клетки из-за самораскручивающейся спирали положительной обратной связи). Само же существование этого механизма положительной обратной связи по NMDA рецепторам — как раз и играет важную роль в процессах долговременной потенциации, синаптогенеза и синаптической пластичности [P. Xia et al, 2010; B. Kuns et al, 2020].
Однако при некоторых патологических состояниях (например, возникающих из-за дефицита в ЦНС ионов Mg2+, являющихся негативными аллостерическими модуляторами NMDA рецепторов, или из-за образования в ЦНС избытка некоторых других двухвалентных катионов, которые могут являться, напротив, позитивными аллостерическими модуляторами этих рецепторов, таких как Fe2+, Zn2+, Cu2+, Mn2+, или из-за избыточного высвобождения глутамата во внеклеточную среду и нарушения его катаболизма или его обратного захвата, или из-за повышенного содержания во внеклеточной среде ионов Ca2+ и нарушения его внутриклеточного гомеостаза) — этот механизм приводит к чрезмерной активации NMDA рецепторов и, как следствие, к избыточному входящему току ионов Ca2+ и Na+ из внешней среды внутрь перевозбужденных нервных клеток [P. Xia et al, 2010; S. M. Stahl, 2013; K. J. Barnham, A. I. Bush, 2014; M. A. Santos et al, 2016; B. Kuns et al, 2020].
В свою очередь, гиперактивация NMDA рецепторов и избыточный входящий ток ионов Ca2+ и Na+ в нейронах и клетках нейроглии запускает несколько других патофизиологических механизмов, таких как эксайтотоксичность, связанные с ней оксидативный и нитрозативный стресс и свободнорадикальное повреждение нейронов и клеток нейроглии, воспалительная активация нейроглии, гиперсекреция воспалительных цитокинов (нейровоспаление), переключение катаболизма L-триптофана на кинурениновый путь с накоплением токсичных метаболитов кинуреновой кислоты, патологическая агрегация важных нейронных белков, таких как β-амилоид, и, в конечном итоге, апоптотическая гибель нервных клеток и клеток нейроглии [M. A. Rogawski, G. L. Wenk, 2003; S. A. Lipton, 2008; T. Nakamura, S. A. Lipton, 2010; S. Tu et al, 2014; E. J. Kodis et al, 2018; B. Kuns et al, 2020].
Этот опосредованный гиперактивацией NMDA рецепторов каскад патофизиологических событий, как ныне установлено, является своего рода «универсальной патологической гиперергической реакцией ЦНС на различные неблагоприятные воздействия». Он является одним из звеньев патогенеза, общих для целого ряда совершенно разных психических и неврологических расстройств, в том числе — для являющихся основной темой нашей сегодняшней статьи нейродегенеративных заболеваний (включая разнообразные деменции), последствий черепно-мозговых травм (ЧМТ) и др., а также для аффективных и тревожных расстройств, шизофрении и др. [P. Xia et al, 2010; Беккер РА, Быков ЮВ, 2016; 2017; B. Kuns et al, 2020].
Установление этого факта логически подводит нас к мысли о целесообразности использования для лечения всех этих расстройств антагонистов NMDA рецепторов. Однако попытки «лобового» использования при этих расстройствах таких «грубых» и неселективных антагонистов так называемого «дизоцилпинового сайта» NMDA рецепторов, как, например, кетамин или декстрометорфан, наталкиваются на тот факт, что нормальная, физиологическая степень активации NMDA рецепторов критически необходима для нормального функционирования ЦНС, и, в частности, для нормального протекания процессов обучения, запоминания и воспроизведения информации. Поэтому такого рода препараты, как правило, имеют выраженные когнитивные и психические побочные эффекты (ПЭ), вплоть до галлюциногенных или диссоциативных свойств [S. M. Stahl, 2013].
В противоположность таким препаратам, как вышеупомянутые кетамин и декстрометорфан, герой нашего сегодняшнего обзора — мемантин — связывается не с дизоцилпиновым, а с магниевым сайтом NMDA рецептора, причем исключительно с его «открытой», или активной конфигурацией. Кроме того, мемантин связывается с NMDA рецепторами с довольно низким аффинитетом, и связывание это является кратковременным и обратимым (он быстро и легко высвобождается из связи с NMDA рецептором). Благодаря такой своеобразной кинетике взаимодействия с NMDA рецепторами, мемантин, в отличие от, например, кетамина или декстрометорфана, предотвращает чрезмерную активацию NMDA рецепторов, но не препятствует проявлению их нормальной, физиологической активности [H. S. Chen, S. A. Lipton, 2006; S. A. Lipton, 2007; S. M. Stahl, 2013; H. Takahashi et al, 2015].
Мемантин предпочтительно связывается с NMDA рецепторами именно в тех областях мозга, где имеет место быть чрезмерное по количеству и/или чрезмерно длительное высвобождение глутамата, и/или недостаточное содержание ионов Mg2+ (синтетическим «аналогом» или своего рода «заменителем» которых он и является), и/или избыточное содержание ионов Ca2+ и некоторых других двухвалентных катионов во внеклеточной среде — то есть как раз в тех областях мозга, где происходит активное повреждение и гибель нейронов с высвобождением этих веществ. Кроме того, мемантин преимущественно воздействует на внесинаптические, тонически активируемые NMDA рецепторы, не препятствуя при этом фазной активации внутрисинаптических NMDA рецепторов и, тем самым, реализации процессов долговременной потенциации, синаптогенеза и синаптической пластичности [H. S. Chen, S. A. Lipton, 2006; S. A. Lipton, 2007; S. M. Stahl, 2013; H. Takahashi et al, 2015].
Этот специфический профиль взаимодействия мемантина с NMDA рецепторами обеспечивает, с одной стороны, эффективное противодействие опосредованной гиперактивностью NMDA рецепторов эксайтотоксичности (которая играет важную роль в патогенезе БА, БП и других нейродегенеративных заболеваний, а также целого ряда психических расстройств), а с другой — его хорошую переносимость в клинической практике, малое количество ПЭ и, в частности, отсутствие у него свойственных «грубым» и неселективным NMDA антагонистам типа кетамина или декстрометорфана психических и когнитивных ПЭ [R. Cacabelos et al, 1999; M. A. Rogawski, G. L. Wenk, 2003; S. A. Lipton, 2006; K. H. Wong et al, 2019].
Кроме того, мемантин также является селективным и обратимым антагонистом α7 подтипа никотиновых ацетилхолиновых рецепторов (Н-холинорецепторов, или, в англоязычной литературе, nAchR — nicotinic acetylcholinergic receptor). Этот подтип Н-холинорецепторов также представляет собой ионные каналы, которые в активированном состоянии становятся проницаемыми для входящего тока ионов Ca2+ в клетку. Они играют важную роль в регуляции когнитивных функций, внимания и памяти, настроения и др. [P. D. Maskell et al, 2003; M. Talantova et al, 2013; S. M. Stahl, 2013].
Важно, что фрагмент амилоида Aβ1-42, который избыточно накапливается в мозговой ткани при БА, обладает способностью активировать этот подтип Н-холинорецепторов на мембранах астроцитов. Это приводит к активации входящего тока ионов Ca2+ в астроцит и к его возбуждению. Это, в свою очередь, приводит к усилению высвобождения глутамата из активированных астроцитов. Избыточное высвобождение глутамата во внеклеточную среду стимулирует продукцию нейронами одной из изоформ синтазы оксида азота (II), так называемой «нейрональной синтазы оксида азота (II)» (nNOS). Это, в свою очередь, приводит к избыточной генерации нейронами оксида азота (II) и, как следствие, к усилению оксидативного и нитрозативного стресса и свободнорадикального повреждения нейронов и клеток нейроглии, поскольку оксид азота (II) является высокоактивным свободным радикалом, сильным окислителем и нитрозилирующим агентом [P. D. Maskell et al, 2003; M. Talantova et al, 2013; S. M. Stahl, 2013].
Таким образом, мемантин, блокируя α7 подтип Н-холинорецепторов астроцитов, косвенным механизмом уменьшает высвобождение глутамата из астроцитов и весь последующий каскад патофизиологических событий, включая чрезмерную активацию нейрональной NO-синтазы, избыточное образование оксида азота (II) и связанное с ним усиление оксидативного и нитрозативного стресса и свободнорадикального повреждения нейронов и глиальных клеток [P. D. Maskell et al, 2003; M. Talantova et al, 2013; S. M. Stahl, 2013].
Мемантин имеет и некоторые другие клинически важные рецепторные свойства. В частности, он является селективным антагонистом серотонинергических рецепторов 3-го подтипа (5-HT3). Благодаря этому рецепторному свойству, он, подобно таким препаратам с 5-HT3 антагонистической активностью и достоверно установленными прокогнитивными свойствами, как вортиоксетин, обладает способностью косвенным механизмом повышать уровень дофамина, норадреналина, гистамина и ацетилхолина в префронтальной коре. Это свойство мемантина, как предполагается, тоже вносит вклад в его общую прокогнитивную и антидепрессивную активность [M. A. Rogawski, G. L. Wenk, 2003; S. M. Stahl, 2013].
 Кроме того, мемантин, подобно уже упоминавшимся ранее кетамину и декстрометорфану, также является слабым агонистом сигма-1 рецепторов (S1R) и слабым ингибитором обратного захвата (ОЗ) всех трех моноаминов — серотонина, норадреналина и дофамина. Эти его рецепторные свойства тоже могут вносить вклад в его общую прокогнитивную, антидепрессивную и анксиолитическую активность. Агонизм мемантина к S1R может также способствовать нейропротекции, так как S1R является важным защитным белком-шапероном нервных клеток, а его активация запускает целый каскад событий, препятствующих апоптозу и улучшающих выживаемость нейронов в неблагоприятных условиях [S. M. Stahl, 2013; Беккер РА, Быков ЮВ, 2016; 2017].
Кроме того, мемантин, подобно уже упоминавшимся ранее кетамину и декстрометорфану, также является слабым агонистом сигма-1 рецепторов (S1R) и слабым ингибитором обратного захвата (ОЗ) всех трех моноаминов — серотонина, норадреналина и дофамина. Эти его рецепторные свойства тоже могут вносить вклад в его общую прокогнитивную, антидепрессивную и анксиолитическую активность. Агонизм мемантина к S1R может также способствовать нейропротекции, так как S1R является важным защитным белком-шапероном нервных клеток, а его активация запускает целый каскад событий, препятствующих апоптозу и улучшающих выживаемость нейронов в неблагоприятных условиях [S. M. Stahl, 2013; Беккер РА, Быков ЮВ, 2016; 2017].
Кроме описываемых выше рецепторных свойств, мемантин не обладает клинически значимой активностью в отношении каких бы то ни было других рецепторов в ЦНС. В частности, он не связывается с рецепторами ГАМК, бензодиазепиновыми, дофаминергическими, адренергическими, гистаминовыми, серотониновыми (кроме 5-HT3 подтипа), мускариновыми холинергическими, глициновыми рецепторами. Он также не связывается с какими-либо ионными каналами клеток, включая потенциал-зависимые натриевые, калиевые или кальциевые каналы. Высокая рецепторная специфичность мемантина, отсутствие у него клинически значимого связывания с «посторонними» для реализации его прокогнитивного действия типами рецепторов обуславливает отсутствие у него off-target рецепторных эффектов, низкий уровень ПЭ и хорошую его переносимость в клинической практике [M. A. Rogawski, G. L. Wenk, 2003; S. M. Stahl, 2013].
Механизм действия мемантина при дементных состояниях отличается от механизма действия также применяемых для их лечения ингибиторов ацетилхолинэстеразы (ИАХЭ), таких как донепезил, ривастигмин, галантамин. Важную роль в механизме действия мемантина при дементных состояниях и в целом при нейродегенеративных заболеваниях играет его нейропротективная активность, то есть его способность тормозить или предотвращать апоптоз нервных клеток и прогрессирование нейродегенеративных изменений вследствие NMDA-опосредованной эксайтотоксичности, оксидативного и нитрозативного стресса, свободнорадикального повреждения клеток и нейровоспаления [C. G. Parsons et al, 2013; S. M. Stahl, 2013; B. Kuns et al, 2020].
Вместе с тем механизмы действия мемантина и ИАХЭ при дементных состояниях являются взаимодополняющими, поскольку все больше данных указывает на тесную взаимосвязь и взаимодействие между глутаматергической и холинергической системами мозга. Обе эти нейромедиаторные системы критически важны для когнитивного функционирования. Нарушения в любой из них оказывают сильное негативное влияние на когнитивные функции. Это дает теоретические основания для комбинирования мемантина с ИАХЭ при лечении дементных состояний, в тех случаях, когда такое комбинирование показано и хорошо переносится [C. G. Parsons et al, 2013; S. M. Stahl, 2013; B. Kuns et al, 2020].
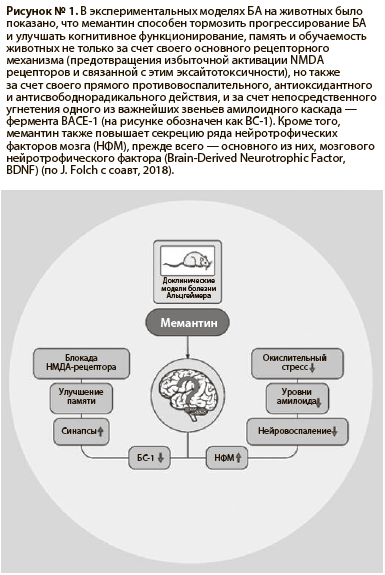
В экспериментальных моделях БА на животных мемантин оказался способен не только тормозить нарастание нейродегенеративных изменений и оказывать нейропротективное действие за счет своего основного рецепторного механизма — уменьшения избыточной активации NMDA рецепторов, но и оказывать прямое противовоспалительное, антиоксидантное и антисвободнорадикальное действие, тормозить высвобождение воспалительных цитокинов и воспалительную активацию нейроглии, уменьшать оксидативный и нитрозативный стресс и свободнорадикальное повреждение нейронов и клеток нейроглии [J. Folch et al, 2018].
Кроме того, было показано также, что применение мемантина в экспериментальных моделях БА на животных приводит к развитию у них потенциально клинически значимого уровня блокады фермента BACE-1 (Beta-amyloid cleavage enzyme-1; ниже на рис. 1 обозначен как BC-1) —
одного из ключевых ферментов в каскаде амилоидогенеза, который патологически гиперактивен при БА. Таким образом, мемантин может непосредственно тормозить избыточное накопление β-амилоида, образование амилоидных бляшек и фибрилл и прогрессирование БА [J. Folch et al, 2018].
Применение мемантина в экспериментальных моделях БА ассоциировалось также с повышением уровней различных нейротрофических факторов мозга (ниже на рис.1 обозначены как НФМ), прежде всего — основного из них, так называемого мозгового нейротрофического фактора (Brain-Derived Neurotrophic Factor — BDNF) в плазме крови и в мозговой ткани животных, с активацией нейрогенеза и синаптогенеза, улучшением процессов синаптической пластичности. Все это, вместе взятое, транслировалось в улучшение когнитивных функций, памяти и обучаемости экспериментальных животных [J. Folch et al, 2018].
Новейшие доказательные данные об эффективности и безопасности мемантина при различных нейродегенеративных заболеваниях
В ЕС мемантин впервые получил одобрение Европейского агентства по оценке медицинских продуктов (European Medical Evaluation Agency — EMEA) для лечения БА в феврале 2002 года, но только при умеренной степени выраженности БА. При легкой степени выраженности БА, и тем более при состоянии «легких когнитивных нарушений» (mild cognitive impairment — MCI), не дающих пока оснований для диагноза соответствующей формы деменции (БА), применение мемантина на тот момент считалось преждевременным и не показанным. На тот момент считалось, что потенциальный риск применения мемантина и связанных с этим ПЭ может превышать потенциальную пользу от его применения у пациентов с легкой формой БА или с субклинической степенью КН (т.е. с состоянием MCI). В то же время применение мемантина у пациентов с тяжелой степенью БА на тот момент также считалось не показанным, поскольку на тот момент, с точки зрения EMEA, отсутствовали убедительные доказательства его эффективности при тяжелых степенях БА [EMEA, 2004].
Четырьмя годами спустя, уже в 2006 году, после получения новых данных двойных слепых рандомизированных клинических испытаний (РКИ), убедительно показавших эффективность мемантина во всем диапазоне степеней тяжести БА, EMEA официально расширило показания к применению мемантина при БА, разрешив его применение как при легких, так и при среднетяжелых (умеренно выраженных) и тяжелых степенях БА [EMEA, 2006].
Основанием для принятия обоими авторитетными контролирующими органами (FDA и EMEA) подобного решения по мемантину стало то, что в клинических испытаниях III фазы, посвященных изучению его эффективности и безопасности при лечении БА, было показано, что мемантин оказывает положительное влияние на повседневную активность, когнитивное функционирование и общее качество жизни пациентов с БА, а также на общее клиническое впечатление от них (измеренное по шкале GCI — Global Clinical Impression), как при легкой и умеренной степенях выраженности БА, так и при тяжелой ее степени. Эффективность и безопасность мемантина при лечении БА во всем диапазоне степеней ее тяжести была продемонстрирована как при его использовании в монотерапии, так и в комбинации с ИАХЭ центрального действия донепезилом [B. Reisberg et al, 2003; P. N. Tariot et al, 2004].
Опубликованный в 2005 году систематический обзор и метаанализ РКИ, посвященных изучению эффективности и безопасности мемантина при лечении БА, показал, что лечение мемантином пациентов с БА легкой, умеренной и тяжелой степеней ассоциируется с положительным фармакоэкономическим эффектом (со снижением общих затрат на их лечение, социальную поддержку и уход за ними), с более длительным сохранением трудоспособности работающих пациентов с легкой степенью БА или с субклиническими КН (с состоянием MCI), с более длительным сроком до вынужденного помещения пациентов в интернат для психохроников или в дом престарелых, а также с улучшением общего качества жизни пациентов и с увеличением ожидаемой продолжительности их жизни (включая поправку на качество жизни) [L. Jonsson, 2005].
В 2007 году был опубликован метаанализ, в котором было показано, что лечение мемантином ассоциируется со значительным улучшением повседневного бытового функционирования (daily functioning), общего качества жизни, различных субдоменов когнитивных функций (памяти, обучаемости, концентрации внимания, исполнительных функций), а также способности к самообслуживанию, по сравнению с применением плацебо, как у пациентов с легкой и умеренной, так и с тяжелой степенью БА [R. S. Doody et al, 2007].
В 2008 году был опубликован еще один метаанализ, в котором было показано, что мемантин может быть полезен при лечении агрессивности и психомоторного возбуждения на фоне деменции, связанной с БА. По данным авторов этого метаанализа, разница между мемантином и плацебо в отношении уровня агрессивности и возбуждения становится очевидной уже через 12 недель лечения. Вместе с тем более поздний метаанализ от 2009 года пришел к выводу, что положительное влияние мемантина на уровень агрессивности и возбуждения при БА может развиваться более медленно. Разница между мемантином и плацебо по влиянию на эти параметры, по данным авторов второго метаанализа (от 2009 года), становится статистически значимой только после 6 месяцев лечения [G. K. Wilcock et al, 2008; G. T. Grossberg et al, 2009].
В июне 2008 года EMEA выдало лицензию на новый режим дозирования мемантина при лечении БА — 20 мг один раз в сутки (наряду с лицензированным ранее режимом его применения — 10 мг утром и в обед). Это важно в свете того, что пациенты с БА страдают забывчивостью, в том числе и в приеме лекарств. Однократный в сутки прием мемантина для многих из них удобнее и обеспечивает более высокую их приверженность лечению [EMEA, 2008].
В одном исследовании от 2009 года было показано, что у пациентов с тяжелыми формами БА применение мемантина может способствовать уменьшению выраженности некоторых психических и поведенческих симптомов деменции (ППСД), особенно — проявлений агрессивности, раздражительности, психомоторного возбуждения. Это привело к увеличению срока до вынужденной институционализации таких пациентов в учреждения долгосрочного ухода (интернаты для психохроников или дома престарелых). Вместе с тем положительное влияние мемантина на проявления ППСД у пациентов с более легкими формами БА в этом исследовании оказалось менее выраженным, и не достигло порога статистической значимости [S. J. Thomas, G. T. Grossberg, 2009].
В США сравнительно недавно была лицензирована FDA новая форма выпуска мемантина — в виде таблеток с длительным контролируемым высвобождением по 28 мг. Эти таблетки не только позволяют однократный их прием в сутки, но и обеспечивают более стабильный уровень мемантина в плазме крови в течение суток, чем ранее одобренная FDA «обычная» (с немедленным высвобождением) форма выпуска мемантина в таблетках [MM Koola, AK Parsaik, 2018].
Как уже упоминалось нами ранее, механизмы действия мемантина и одобренных наряду с ним для лечения БА центрально действующих ИАХЭ (донепезила, ривастигмина и галантамина) различаются, но являются взаимно дополняющими. Поэтому мемантин можно (а иногда и нужно) при лечении БА комбинировать с одним из этих трех ИАХЭ [J. Folch et al, 2018; A. Atri, 2019].
Комбинация мемантина с одним из вышеупомянутых трех ИАХЭ обычно приводит к суммации или взаимному потенцированию их прокогнитивного действия, и обычно не приводит к сколько-нибудь существенному увеличению риска развития ПЭ, по сравнению с монотерапией только мемантином или только ИАХЭ. Поэтому такая комбинация способна принести дополнительную пользу многим пациентам с БА [R. Howard et al, 2015; N. Kishita et al, 2019].
Так, в 2012 году в двойном слепом сравнительном РКИ было показано, что одновременное применение мемантина с ИАХЭ галантамином дает значительное преимущество в отношении улучшения когнитивного функционирования пациентов с БА, измеренного по шкале Montreal Cognitive Impairment (MCI), по сравнению с монотерапией любым из них [O. Peters et al, 2012].
В нескольких публикациях, вышедших в мировой научной прессе в период 2013–2015 годов, констатировалось, что обнадеживающие результаты исследований эффективности и безопасности применения мемантина для купирования или уменьшения психомоторного возбуждения и агрессивности у пациентов с БА могут позволить снизить частоту назначения и используемые дозы антипсихотиков (АП), а в некоторых случаях даже полностью избежать использования АП для этих целей у данной категории пациентов (по крайней мере, у той части их, которая положительно отреагирует на применение мемантина) [N. Suzuki et al, 2013; E. Cumbo, L. D. Ligori, 2014; N. Zhang et al, 2015].
А это, в свою очередь, может позволить снизить вероятность возникновения, или даже полностью избежать возникновения таких особо нежелательных и опасных у пожилых дементных пациентов ПЭ от применения АП, как экстрапирамидный синдром (ЭПС), сердечно-сосудистые и метаболические ПЭ, и уменьшить или полностью избежать риска неблагоприятного влияния АП на ожидаемую продолжительность жизни этих пациентов (риска преждевременной смертности, связанной с применением АП) [N. Suzuki et al, 2013; E. Cumbo, L. D. Ligori, 2014; N. Zhang et al, 2015].
В период 2014–2015 годов были опубликованы два новых метаанализа, в которых была продемонстрирована эффективность и безопасность применения мемантина как при легкой и умеренной, так и при тяжелой степени БА, а также значительное улучшение когнитивного функционирования пациентов с этой болезнью под влиянием лечения мемантином [C. C. Tan et al, 2014; S. Matsunaga et al, 2015].
В 2019-м году было проведено еще одно двойное слепое плацебо-контролируемое РКИ, посвященное изучению эффективности и безопасности применения монотерапии мемантином при лечении БА легкой, умеренной и тяжелой степеней. Результаты этого РКИ продемонстрировали, что монотерапия мемантином обеспечивает как краткосрочное, так и долгосрочное положительное влияние на целый ряд изучавшихся параметров, таких как повседневная бытовая активность пациентов, их когнитивное функционирование (память, обучаемость, концентрация внимания, исполнительные функции), общее качество их жизни, а также уменьшает выраженность психических и поведенческих симптомов деменции (включая психомоторное возбуждение и агрессивность) и способствует уменьшению выраженности сопутствующей депрессии и тревоги [A. C. Tricco et al, 2019].
В том же 2019-м году был опубликован еще один большой метаанализ, посвященный изучению сравнительной эффективности и безопасности мемантина и ИАХЭ в качестве средств лечения КН, развивающихся при таких нейродегенеративных заболеваниях, как БП, БА или ДТЛ. В этот метаанализ вошли 15 РКИ. По данным авторов этого метаанализа, мемантин оказывал в среднем более выраженное, чем ИАХЭ, краткосрочное (в масштабах месяцев или первых лет болезни) положительное влияние на концентрацию внимания, скорость психомоторных реакций и обработки информации, а также на исполнительные функции у этих пациентов. Вместе с тем авторы этого метаанализа также пришли к выводу о том, что ни мемантин, ни ИАХЭ, по-видимому, не способны сколько-нибудь существенно предотвратить или затормозить дальнейшее снижение когнитивных функций при длительном, многолетнем наблюдении [Y. H. Meng et al, 2019].
В 2020-м году было опубликовано одно из крупнейших на сегодняшний день натуралистических исследований эффективности применения мемантина и ИАХЭ для симптоматического лечения деменций (прежде всего БА) в реальной повседневной клинической практике. Авторы этого исследования показали, что у 68% пациентов с дементными состояниями различного генеза (и прежде всего при БА, как одной из наиболее распространенных форм деменции) применение мемантина и/или ИАХЭ приводит к значительному улучшению когнитивного функционирования или, по крайней мере, к его стабилизации (то есть к предотвращению или замедлению дальнейшего прогрессирования КН) на срок не менее 2-5 месяцев, а порой и на значительно больший срок [N. Vaci et al, 2020].
Еще одно исследование, посвященное изучению эффективности и безопасности применения мемантина для лечения БА, осложнившегося коморбидной депрессией, тоже относится к 2020-му году. По своему дизайну это исследование представляет собой 6-месячное двойное слепое плацебо-контролируемое сравнительное РКИ. В нем сопоставлялась эффективность и безопасность комбинации эсциталопрама с мемантином, и комбинации эсциталопрама с плацебо, при лечении пожилых пациентов с БА и коморбидной депрессией позднего возраста [H. Lavretsky et al, 2020].
Использованные в этом РКИ дозировки эсциталопрама составляли в среднем 11,1 мг/сут, а дозировки мемантина — в среднем 19,3 мг/сут. Авторами было показано, что комбинация эсциталопрама и мемантина была значительно эффективнее, чем комбинация эсциталопрама и плацебо, в лечении депрессий позднего возраста, коморбидных с БА. Преимущество такой комбинации было выявлено не только в отношении влияния на депрессивную и тревожную симптоматику, но и в отношении влияния на когнитивные функции пациентов. Более того, статистически достоверное преимущество во влиянии комбинации эсциталопрама и мемантина перед комбинацией эсциталопрама и плацебо на когнитивные функции пациентов сохранялось и через 12 месяцев от начала исследования, то есть уже после завершения курса лечения этими комбинациями. Это можно объяснить долгосрочным нейропротективным эффектом мемантина [H. Lavretsky et al, 2020].
Большой интерес к исследованию эффективности и безопасности мемантина при лечении БА проявляют также российские исследователи. Так, в 2008 году И. В. Колыхалов провел исследование эффективности и безопасности применения мемантина в лечении психических и поведенческих симптомов деменции (ППСД) при легкой степени БА. В этом исследовании участвовали 38 пациентов с легкими степенями БА. Автор приводит подробные клинические описания своих пациентов, а также статистические данные о частоте возникновения ППСД при разных степенях БА. Кроме того, он подчеркивает, что выраженные ППСД, включая психотическую (параноидную) симптоматику типа «бреда малого масштаба», бреда преследования или ущерба, а также нарушения сна и циркадианных ритмов (вплоть до их полного извращения — дневная сонливость и ночная бессонница), агрессивность, повышенную раздражительность, тревожность, нервозность, неясное чувство тревоги, беспокойства, страха, плаксивость или сниженное настроение, могут наблюдаться уже при легких степенях БА, со сравнительно небольшой выраженностью КН [И. В. Колыхалов, 2008].
Автором цитируемого исследования было показано, что лечение мемантином пациентов с легкой степенью БА и с наличием явных ППСД приводит к статистически достоверному уменьшению выраженности у них проявлений ППСД, в частности таких, как нарушения сна и циркадианных ритмов, плаксивость, сниженное настроение, тревожность, страхи, беспокойство, а также к улучшению их когнитивного функционирования [И. В. Колыхалов, 2008].
Автор вышеупомянутого исследования также показал, что лечение мемантином другой группы из 25 пациентов с тяжелыми степенями БА тоже приводит к значительной редукции ассоциированных с БА психических и поведенческих нарушений, прежде всего — агрессивности, раздражительности, апатии, психомоторного возбуждения, извращения циркадианных ритмов. Это привело к уменьшению уровня субъективного дистресса, испытываемого лицами, осуществляющими уход за этими пациентами [И. В. Колыхалов, 2008].
В 2010-м году О. Левин с соавторами показали, что применение мемантина в монотерапии при БА на их выборке в 40% случаев приводило к клиническому улучшению, которое было расценено авторами этого исследования как «значительное» или «очень значительное». Еще у 35% пролеченных таким образом пациентов с БА авторы констатировали «умеренное, но тем не менее клинически значимое улучшение» показателей когнитивного функционирования, повседневной бытовой активности, способности к самообслуживанию, симптомов ППСД [O. Levin et al, 2010].
Так, еще в 2009-м году Д. Аарсланд с соавторами провели первое в истории двойное слепое плацебо-контролируемое РКИ, посвященное изучению эффективности и безопасности применения мемантина при двух разных по своему патогенезу нейродегенеративных заболеваниях, сопровождающихся одновременно как деменцией (или выраженными КН), так и экстрапирамидными нарушениями (паркинсонизмом, акатизией) — при БП и при ДТЛ. Общее количество пациентов с ДТЛ или БП, принявших участие в этом РКИ, составило 72 человека. Применявшаяся в этом исследовании доза мемантина была фиксированной — 20 мг/сут [D. Aarsland et al, 2009].
Авторам этого РКИ удалось показать, что применение мемантина в их выборке пациентов привело к статистически достоверному улучшению показателей шкалы общего клинического впечатления (Clinical Global Impression — CGI) через 24 недели, по сравнению с применением плацебо, как у пациентов с БП, так и у пациентов с ДТЛ. При этом значительное улучшение наблюдалось как в отношении когнитивного функционирования, так и в отношении двигательных функций, нормализации поведения, уменьшения сопутствующей депрессии, улучшения способности пациентов к самообслуживанию [D. Aarsland et al, 2009].
В 2010-м году другая группа авторов, руководимая М. Emre, решила попытаться воспроизвести либо опровергнуть результаты, полученные ранее группой Д. Аарсланда. С этой целью они провели более крупное (199 участников), также 24-недельное, двойное слепое плацебо-контролируемое РКИ по изучению эффективности и безопасности применения мемантина в лечении пациентов с БП или ДТЛ. Как и в исследовании Д. Аарсланда с соавторами, эта группа авторов использовала фиксированную дозу мемантина — 20 мг/сут [M. Emre et al, 2010].
Результаты этого РКИ несколько отличаются от результатов, полученных чуть ранее, в 2009-м году, группой Д. Аарсланда при изучении того же вопроса. А именно, эти авторы показали, что, по крайней мере на выборке из их исследования, применение мемантина приводит к значительному улучшению показателей шкалы общего клинического впечатления (CGI), по сравнению с применением плацебо, только у пациентов с ДТЛ, но не у пациентов с БП и деменцией, вызванной наличием БП [M. Emre et al, 2010].
Кроме того, M. Emre с соавторами показали также, что у пациентов с ДТЛ, получавших мемантин, наблюдалось выраженное уменьшение проявлений ППСД, по сравнению с пациентами с этой болезнью, которые получали плацебо (-4,3 балла против +1,7 балла по шкале NPI-12;
p=0,041). В то же время они не обнаружили каких-либо существенных улучшений психического статуса или поведения у пациентов с БП и деменцией, вызванной наличием БП, получавших мемантин, по сравнению с такими же пациентами получавшими плацебо [M. Emre et al, 2010].
Между тем, в исследовании Д. Аарсланда с соавторами, как мы уже упоминали выше, констатировалась эффективность мемантина при обоих типах дементирующих нейродегенеративных заболеваний — как при ДТЛ, так и при БП [D. Aarsland et al, 2009].
Такое расхождение в полученных этими двумя исследовательскими группами результатах может объясняться какими-то особенностями выборки пациентов в обоих этих РКИ (например, тем, что в исследование M. Emre с соавторами могли попасть в среднем более тяжелые пациенты с БП, и поэтому они не отметили особенного эффекта от применения мемантина при БП, но отметили его при ДТЛ) [M. Emre et al, 2010].
Значительное внимание уделяли исследованию эффективности и безопасности применения мемантина при лечении ДТЛ также и российские исследователи. Так, в 2018-м году Е. В. Васенина с соавторами провели обследование 38 пациентов с клинически диагностированной ДТЛ. В течение последующих 6 месяцев все эти пациенты получали монотерапию ИАХЭ центрального действия — галантамином в дозе 16 мг/сут. Девятнадцати из этих 38 пациентов, у которых монотерапия галантамином в дозе 16 мг/сут на протяжении 6 месяцев не привела к достаточному улучшению клинического состояния, к терапии был добавлен мемантин в дозе 10-20 мг/сут (в зависимости от индивидуальной переносимости) [Е. Е. Васенина с соавт, 2018].
Авторы этого исследования показали, что на фоне применения комбинации галантамина 16 мг/сут и мемантина 10-20 мг/сут отмечается более значительное улучшение концентрации внимания, памяти, речевых функций, а также поведения пациентов с ДТЛ, частично резистентных к монотерапии галантамином, по сравнению с предшествующим периодом монотерапии галантамином [Е. Е. Васенина с соавт, 2018].
Годом позже, уже в 2019-м году, О. С. Левин с соавторами опубликовали результаты проведенного ими открытого контролируемого исследования эффективности и безопасности применения мемантина в лечении пациентов с клинически диагностированной ДТЛ. Это исследование проводилось на протяжении 16 недель. В нем приняли участие в общей сложности 23 пациента с ДТЛ. Все они были разделены на две группы. При этом 14 пациентов составили группу активного лечения. Всем им был назначен мемантин в фиксированной дозе 20 мг/сут. Еще 9 пациентов составили контрольную группу, которая получала плацебо [О. С. Левин с соавт, 2019].
Авторы этого исследования продемонстрировали, что применение мемантина при ДТЛ оказывает выраженное положительное влияние на общее психическое состояние и неврологический (двигательный) статус пациентов с ДТЛ, на их способность к самообслуживанию и на их повседневную активность, а также на их когнитивное функционирование, по сравнению с применением плацебо [О. С. Левин с соавт, 2019].
Кроме того, этими авторами отмечена также своеобразная стабилизация психического состояния пациентов с ДТЛ под влиянием лечения мемантином, по сравнению с применением плацебо. А именно, под влиянием мемантина значительно уменьшались флуктуации психического состояния и уровня бодрствования этих пациентов в течение дня и ото дня ко дню, а также флуктуации уровня их повседневной бытовой активности ото дня ко дню. Наблюдалось также уменьшение под влиянием мемантина проявлений агрессивности, раздражительности, неуместной двигательной, речевой или сексуальной расторможенности у пациентов с ДТЛ [О. С. Левин с соавт, 2019].
Исследований, в которых бы прицельно изучалась эффективность и безопасность применения мемантина именно при ЛВД, в мировой научной литературе сравнительно немного (меньше, чем при БА или ДТЛ), но они есть. Так, в 2007-м году была опубликована статья, описывающая небольшую серию клинических случаев ЛВД, при которых применение мемантина оказало положительное влияние на психическое состояние и когнитивное функционирование пациентов. Это проявилось, в частности, в улучшении общего балла по шкале комплексного нейропсихиатрического исследования (Neuropsychiatric Interview — NPI) и по шкале общего клинического впечатления (Clinical Global Impression — CGI). Особенно выраженным было положительное влияние мемантина на подшкалы апатии, психомоторного возбуждения, тревоги и беспокойства NPI [M. M. Swanberg, 2007].
Немного позднее, уже в 2009-м году, другая группа авторов опубликовала результаты пилотного открытого исследования эффективности и безопасности применения мемантина при лечении ЛВД. Эти авторы также констатировали временное улучшение общих показателей по шкалам NPI и CGI под влиянием мемантина. Особенно выраженной редукции, опять-таки, подвергались симптомы апатии, тревоги, беспокойства и психомоторного возбуждения. Авторы этого исследования констатировали, что мемантин является перспективным и заслуживающим дальнейшего изучения в формате двойных слепых плацебо-контролируемых РКИ средством лечения пациентов с ЛВД, и что он может способствовать значительному улучшению общего качества жизни как самих пациентов с ЛВД, так и членов их семей или других лиц, осуществляющих уход за ними [A. L. Boxer et al, 2009].
В 2013-м году было опубликовано сообщение об еще одном клиническом случае пациента с ЛВД, у которого симптомы апатии уменьшились под влиянием лечения мемантином [K. A. Links et al, 2013].
Нейровизуализационные исследования (функциональная магнито-резонансная томография (фМРТ), а также позитронно-эмиссионная томография (ПЭТ) с меченной радиоактивным фтором-18 (18F) фтордезоксиглюкозой) показали, что применение мемантина у пациентов с ЛВД приводит к повышению патологически сниженной при этой болезни метаболической активности префронтальной и височной долей коры больших полушарий головного мозга, а также в узловых точках так называемой «сети покоящегося режима» (default mode network). Это может указывать на потенциальную клиническую эффективность мемантина при ЛВД [T. W. Chow et al, 2011; 2013].
В этом РКИ в подгруппе пациентов с БП и деменцией, обусловленной наличием БП, которая получала мемантин, у 27% участников через 24 недели лечения наблюдалось улучшение когнитивного и двигательного функционирования, варьировавшее у разных пациентов от «умеренного» до «значительного» или «очень значительного». В то же время ни один из тех пациентов с БП и деменцией, связанной с БП, которые в этом РКИ получали плацебо, не сообщал о каком-либо улучшении, которое можно было бы квалифицировать больше, чем «легкое» или «незначительное» [D. Aarsland et al, 2009].
В 2009-м году И. Лерой с соавторами в другом интересном РКИ продемонстрировали, что отмена мемантина у пациентов с БП и деменцией на фоне БП приводит к более выраженному ухудшению когнитивного и двигательного функционирования, чем отмена плацебо. Это исследование проводилось на протяжении 22 недель. Первая фаза его состояла в двойном слепом плацебо-контролируемом исследовании эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП на протяжении 16 недель. Вторая же фаза состояла в «слепой» отмене получаемого пациентом препарата (будь то мемантин или плацебо) [I. Leroi et al, 2009].
После окончания 7-дневного периода «вымывания» мемантина из крови, а также через 6 недель после этого, пациенты подвергались повторному исследованию их когнитивных и двигательных функций. Авторы этого РКИ отметили, что клинически значимое ухудшение общего психического состояния, уровня когнитивного функционирования, двигательных функций и способности к самообслуживанию — гораздо чаще наблюдалось в группе пациентов, которые до отмены получали мемантин (70% случаев ухудшения, расцененного как клинически значимое), чем в группе пациентов, которые до отмены получали плацебо (29% случаев ухудшения, расцененного как клинически значимое). Кроме того, в группе мемантина ухудшение по данным показателям было в среднем более выраженным, чем в группе плацебо. По мнению авторов этого РКИ, данный факт (ухудшение при отмене мемантина) убедительно демонстрирует, что мемантин эффективен в лечении БП и деменции на фоне БП, даже если этот факт не кажется столь уж очевидным при прямом сравнении мемантина и плацебо, как в первой фазе исследования [I. Leroi et al, 2009].
В 2011-м году были опубликованы результаты еще одного двойного слепого плацебо-контролируемого РКИ, посвященного изучению эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП. В этом РКИ использовался дизайн, похожий на тот, что был использован в 2009-м году И. Лероем с соавторами, — со «слепой» отменой мемантина или плацебо после завершения основной части исследования. Основная фаза исследования длилась на протяжении 24 недель. Авторы этого РКИ тоже показали, что после отмены мемантина клинически значимое ухудшение когнитивных и двигательных функций, а также психического состояния пациентов с БП и деменцией на фоне БП наблюдается гораздо чаще, чем после отмены плацебо. При этом, по их данным, на скорость «истощения» лечебного эффекта мемантина после его отмены больше всего влияет быстрое возвращение или усиление сопутствующей тревожной и депрессивной симптоматики (такое наблюдалось у 9% пациентов). Показатели по шкале общего клинического впечатления (CGI) также значительно ухудшились в группе отмены мемантина, по сравнению с группой отмены плацебо [C. Johansson et al, 2011].
В еще одном 24-недельном двойном слепом плацебо-контролируемом РКИ, тоже от 2011 года, изучали влияние применения мемантина у пациентов с БП и деменцией на фоне БП на общее качество жизни пациентов, в сопоставлении с применением плацебо. Авторами этого РКИ было показано, что в группе пациентов, которая получала мемантин, средний балл по шкале субъективной оценки общего качества жизни (Quality of Life — QoL) повысился на 42%, в то время как в группе пациентов, получавшей плацебо, этот показатель повысился всего на 15%. Кроме того, в группе мемантина также было больше пациентов, сообщавших о «значительном» или «очень значительном» улучшении общего качества жизни, по сравнению с группой плацебо [V. Larsson et al, 2011].
Не обделили вниманием вопрос об эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП также и российские исследователи
[М. Н. Лузин с соавт, 2007; О. С. Левин, Л. А. Батукаева, 2008].
Так, в 2007-м году М. Н. Лузин с соавторами обследовали и отобрали для участия в своем исследовании 38 пациентов с БП и деменцией, развившейся на фоне БП, из них 20 мужчин и 18 женщин. Все они на момент начала исследования уже принимали препараты леводопы. Всем им, на фоне продолжения лечения препаратами леводопы, был дополнительно назначен мемантин по следующей схеме: 1-я неделя — 5 мг утром, 2-я неделя — 5 мг утром и 5 мг в обед (10 мг/сут), а с 3-й недели и далее — 10 мг утром и 10 мг в обед (20 мг/сут). Общая длительность лечения мемантином в их исследовании составляла 6 месяцев [М. Н. Лузин с соавт, 2007].
Авторы этого исследования показали, что адъювантное применение мемантина в дополнение к препаратам леводопы у пациентов с БП и деменцией на фоне БП приводит к статистически достоверному уменьшению выраженности не только типичных для БП двигательных нарушений (гипокинезии, брадикинезии, тремора, гипертонуса мышц и мышечной ригидности), но и к статистически достоверному улучшению показателей вербальной и зрительной памяти, речевых функций, логики и мышления, а также к улучшению настроения и общего самочувствия пациентов, к уменьшению их апатии, уменьшению выраженности сопутствующей депрессивной и тревожной симптоматики, и к повышению их повседневной активности и способности к самообслуживанию [М. Н. Лузин с соавт, 2007].
Годом позже, уже в 2008-м году, О. С. Левин и Л. А. Батукаева опубликовали результаты своего исследования, тоже посвященного изучению вопроса об эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП. В их исследовании приняли участие 15 пациентов с БП и деменцией, развившейся на фоне БП. Всем участникам исследования его авторы назначали мемантин по следующей схеме: первая неделя — 5 мг один раз в сутки утром, 2-я неделя — 5 мг утром и 5 мг в обед (10 мг/сут), 3-я неделя — 10 мг утром и 5 мг в обед (15 мг/сут), а с 4-й недели и далее — 10 мг утром и 10 мг в обед (20 мг/сут). Общая продолжительность лечения мемантином в этом исследовании составляла 24 недели [О. С. Левин, Л. А. Батукаева, 2008].
Авторы этого исследования показали, что применение мемантина при лечении БП и деменции на фоне БП — эффективно и безопасно. Мемантин вызывал у их пациентов стабильное улучшение психического состояния, настроения, самочувствия, повседневной активности, параметров когнитивного и двигательного функционирования и способности к самообслуживанию. При этом препарат хорошо переносился пациентами с этой болезнью. Ни в одном случае авторами не было отмечено развития каких-либо существенных ПЭ на фоне лечения мемантином. Ими не было также зарегистрировано отказов пациентов от продолжения лечения этим препаратом по любой причине. По их наблюдениям, эффективность мемантина при деменциях на фоне БП, по крайней мере в их сравнительно небольшой выборке из 15 пациентов, была сопоставима с эффективностью мемантина при БА (его основном — и пока единственном официально зарегистрированном FDA и EMEA — показании к применению) [О. С. Левин, Л. А. Батукаева, 2008].
Наконец, последнее из российских исследований, посвященных изучению эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП, датируется 2010-м годом. Его авторами являются И. В. Литвиненко с соавторами. По своему дизайну оно является долгосрочным (52 недели) открытым РКИ с небольшой выборкой. Авторы этого исследования сумели показать, что пациенты с БП и деменцией на фоне БП, получавшие мемантин, к сроку 24 недели продемонстрировали значительное и статистически достоверное улучшение показателей когнитивного функционирования по таким стандартным шкалам, как MMSE (p <0,05), ADAS-cog (p <0,05), тест рисования часов (p <0,05) и тест FAB (p <0,01), по сравнению с контрольной группой, получавшей плацебо [I. V. Litvinenko et al, 2010].
Кроме того, авторы цитируемого исследования также сумели показать, что к моменту завершения их исследования (то есть к сроку 52 недели) у пациентов, получавших мемантин, наблюдалось значительное улучшение показателей общего психического статуса и когнитивного функционирования по 12-пунктовой шкале нейропсихиатрического исследования (NPI), по сравнению с исходными их показателями по этой шкале (p <0,05) [I. V. Litvinenko et al, 2010].
В 2007-м году был опубликован систематический обзор и метаанализ, посвященный изучению и обобщению данных о сравнительной эффективности, безопасности и переносимости применения мемантина и различных ИАХЭ при лечении СД. В этот метаанализ вошли данные трех двойных слепых плацебо-контролируемых РКИ, посвященных применению при лечении СД донепезила, двух — по применению при этой патологии галантамина, одного — по применению при ней ривастигмина, и двух — по применению мемантина [H. Kavirajan, L. S. Schneider, 2007].
Авторы этого метаанализа констатировали, что при лечении пациентов с СД легкой и умеренной степени выраженности мемантин, по-видимому, более эффективен в отношении улучшения когнитивных функций, чем любой из упомянутых трех ИАХЭ [H. Kavirajan, L. S. Schneider, 2007].
Кроме того, они также констатировали, что применение ИАХЭ для лечения пациентов с СД ассоциируется с большей вероятностью отсева (отказа от продолжения лечения или от участия в исследовании) и с большей вероятностью развития ПЭ [H. Kavirajan, L. S. Schneider, 2007].
В 2011-м году японские исследователи показали эффективность применения мемантина при подкорковой форме СД [H. Tomimoto, 2011].
Активно изучали применение мемантина для лечения СД и смешанных форм деменций также исследователи из России, Украины и других стран СНГ [Е. Б. Любов с соавт, 2010; N. Iu. Bachyns’ka, 2013].
Так, в 2010-м году Е. Б. Любов с соавторами опубликовали результаты проведенного ими 6-месячного проспективного натуралистического исследования, посвященного сравнению эффективности различных подходов к лечению СД в реальной повседневной клинической практике. Этой группе авторов удалось показать, что применение мемантина при лечении СД имеет значительное преимущество в клинической эффективности перед «традиционным» для РФ лечением этой патологии, имеющим слабую доказательную базу с точки зрения современной науки («сосудистые», «нейрометаболические» и «ноотропные» препараты) [Е. Б. Любов с соавт, 2010].
Это преимущество мемантина над «традиционным лечением» СД проявлялось в таких доменах, как коррекция нежелательного поведения дементных пациентов (в частности, проявлений агрессивности, раздражительности, психомоторного возбуждения, неуместной двигательной, речевой или сексуальной расторможенности), уменьшение или контроль психопатологической симптоматики (проявлений психоза, депрессии или тревоги, беспокойства, ночной бессонницы и дневной сонливости, апатии), уменьшение выраженности КН, улучшение повседневной активности и социального функционирования пациентов с СД, снижение нагрузки на формальных и неформальных опекунов пациентов [Е. Б. Любов с соавт, 2010].
Чуть позднее, уже в 2013-м году, украинский исследователь Н. Ю. Бачинская провела комплексное неврологическое, экспериментально-психологическое и нейрофизиологическое обследование 33-х пациентов с легкими и умеренными степенями БА и/или СД до начала лечения мемантином и спустя 3 месяца после начала лечения [N. Iu. Bachyns’ka, 2013].
Ей удалось показать, что лечение пациентов с БА и/или СД мемантином в дозе 5–10 мг/сут на протяжении 3-х месяцев приводит к значительному снижению выраженности исходно имевшихся у этих пациентов КН, к улучшению показателей биоэлектрической активности мозга пациентов по сравнению с исходным их уровнем (до начала лечения), а также к улучшению общего психического состояния, настроения и поведения пациентов, к уменьшению проявлений агрессивности, раздражительности, девиантного поведения, психомоторного возбуждения. Это способствовало снижению стрессовой нагрузки на лиц, осуществляющих уход за такими пациентами [N. Iu. Bachyns’ka, 2013].
Наконец, в 2020-м году группа китайских исследователей опубликовала статью, в которой продемонстрировала эффективность сочетанного применения мемантина и электроакупунктуры волосистой части головы (скальпа) при лечении КН, ассоциированных с СД [A. Yue et al, 2020].
Весьма важно то, что мемантин не просто приносит пациентам с этими заболеваниями симптоматическое улучшение, но и оказывает истинный нейропротективный эффект, то есть тормозит нарастание патологических изменений в ЦНС, связанных с нейродегенерацией.
Мемантин хорошо переносится пациентами с нейродегенеративными заболеваниями, в том числе пациентами пожилого и старческого возраста, отягощенными наличием многих сопутствующих соматических заболеваний. Побочные эффекты при его применении возникают редко, и обычно они слабо или незначительно выражены, и не препятствуют продолжению терапии им.
Помимо улучшения когнитивных функций, способности к повседневному обслуживанию и общего качества жизни пациентов с нейродегенеративными заболеваниями, мемантин также способствует улучшению их психического состояния, в частности, уменьшению проявлений коморбидной депрессии и тревоги, уменьшению агрессивности и раздражительности. У пациентов с БП, ДТЛ и БХ мемантин также способствует улучшению двигательных функций, уменьшению проявлений паркинсонизма, акатизии, гиперкинезов.
Одним из препаратов мемантина, доступным в России, является Тингрекс® (АО «Гриндекс», Латвия). В открытом рандомизированном проводимом в два этапа перекрестном исследовании биоэквивалентности препаратов Тингрекс®, таблетки, покрытые пленочной оболочкой, 10 мг и оригинального препарата мемантин, таблетки, покрытые пленочной оболочкой, 10 мг, с однократным приемом натощак у здоровых добровольцев, было продемонстрировано полное совпадение средних фармакокинетических профилей. Таким образом установлено, что
Тингрекс® и оригинальный мемантин биоэквивалентны [83].
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2021
Обзор эффективности и безопасности применения мемантина в клинической практике: фокус на нейродегенеративных заболеваниях №02 2021
Номера страниц в выпуске:17-28
Резюме
Актуальность проблемы нейродегенеративных заболеваний, таких как болезнь Альцгеймера (БА), болезнь Паркинсона (БП), деменция с тельцами Леви (ДТЛ), лобно-височная деменция (ЛВД) и другие, — в последние десятилетия неуклонно повышается, в связи с общемировой тенденцией к повышению ожидаемой продолжительности жизни, старением популяции (увеличением удельного веса людей пожилого и старческого возраста в ней) и другими факторами, такими как экологически неблагоприятная обстановка во многих странах мира. Так, повышение заболеваемости БП связывают, в частности, с влиянием нейротоксинов типа МФТП, которые способны образовываться в нашем организме из некоторых пестицидов, а повышение заболеваемости БА — среди прочего, с загрязнением почвы и воды солями алюминия.
В свете этого особую актуальность приобретает своевременное использование у таких пациентов лекарств, способных не только снимать или уменьшать симптомы, связанные с нейродегенерацией, но и затормозить или частично обратить вспять нейродегенеративные процессы в ЦНС, оказывать нейропротективное действие. Одним из наиболее доказанных в этом отношении препаратов является мемантин — бесконкурентный антагонист (точнее, негативный аллостерический модулятор) магниевого сайта NMDA глутаматергических рецепторов. Этому препарату ранее уже были посвящены несколько других наших статей.
Данная же статья посвящена обзору новейших (за последние 5 лет) данных об эффективности и безопасности применения мемантина в клинической практике, с особым упором на его применение именно при нейродегенеративных заболеваниях.
Ключевые слова: мемантин, NMDA рецептор, глутаматергическая нейропередача, нейродегенерация, нейротоксичность, нейропротекция, болезнь Альцгеймера, болезнь Паркинсона, лобно-височная деменция, деменция с тельцами Леви, сосудистая деменция.
Для цитирования: Быков Ю.В., Беккер Р.А. Обзор эффективности и безопасности применения мемантина в клинической практике: фокус на нейро-дегенеративных заболеваниях. 2021; 2: 17–28.
Актуальность проблемы нейродегенеративных заболеваний, таких как болезнь Альцгеймера (БА), болезнь Паркинсона (БП), деменция с тельцами Леви (ДТЛ), лобно-височная деменция (ЛВД) и другие, — в последние десятилетия неуклонно повышается, в связи с общемировой тенденцией к повышению ожидаемой продолжительности жизни, старением популяции (увеличением удельного веса людей пожилого и старческого возраста в ней) и другими факторами, такими как экологически неблагоприятная обстановка во многих странах мира. Так, повышение заболеваемости БП связывают, в частности, с влиянием нейротоксинов типа МФТП, которые способны образовываться в нашем организме из некоторых пестицидов, а повышение заболеваемости БА — среди прочего, с загрязнением почвы и воды солями алюминия.
В свете этого особую актуальность приобретает своевременное использование у таких пациентов лекарств, способных не только снимать или уменьшать симптомы, связанные с нейродегенерацией, но и затормозить или частично обратить вспять нейродегенеративные процессы в ЦНС, оказывать нейропротективное действие. Одним из наиболее доказанных в этом отношении препаратов является мемантин — бесконкурентный антагонист (точнее, негативный аллостерический модулятор) магниевого сайта NMDA глутаматергических рецепторов. Этому препарату ранее уже были посвящены несколько других наших статей.
Данная же статья посвящена обзору новейших (за последние 5 лет) данных об эффективности и безопасности применения мемантина в клинической практике, с особым упором на его применение именно при нейродегенеративных заболеваниях.
Ключевые слова: мемантин, NMDA рецептор, глутаматергическая нейропередача, нейродегенерация, нейротоксичность, нейропротекция, болезнь Альцгеймера, болезнь Паркинсона, лобно-височная деменция, деменция с тельцами Леви, сосудистая деменция.
Для цитирования: Быков Ю.В., Беккер Р.А. Обзор эффективности и безопасности применения мемантина в клинической практике: фокус на нейро-дегенеративных заболеваниях. 2021; 2: 17–28.
A review of the evidence regarding efficacy and safety of memantine in сlinical practice: a focus on neurodegenerative diseases
Yu.V. Bykov1, R.A. Bekker21Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310;
2David Ben-Gurion University in Negev.8410501, Israel, Be'er Sheva.
Summary
The actuality of the problem of neurodegenerative diseases, such as Alzheimer's disease, Parkinson's disease, Lewy body dementia, fronto-temporal dementia and others, has been steadily increasing in recent decades. It is mostly due to the global trend towards an increase in life expectancy, leading to the aging of general population (an increase in the proportion of elderly and senile people in it). Other factors also might play a role, such as environmental pollution in many countries of the world (an increase in the incidence of Parkinson’s disease is associated, in particular, with the influence of some neurotoxins deriving in our organism from some pesticides, and an increase in the incidence of Alzheimer’s disease some specialists link to environmental pollution with aluminium salts).
In such patients, the adequate and timely use of drugs that possibly can not just relieve or reduce some symptoms associated with neurodegeneration, but also slow down or even partially reverse neurodegenerative processes in the CNS, and can exert a true neuroprotective effect is of particular relevance. One of the most proven drugs in this regard is memantine, an uncompetitive antagonist (more precisely, a negative allosteric modulator) of the magnesium site of NMDA glutamatergic receptors. Several of our other articles have already been devoted to this drug.
This article is devoted to a review of the latest (over the past 5 years) data on the efficacy and safety of using memantine in сlinical practice, with special emphasis on its use in neurodegenerative diseases.
Keywords: memantine, NMDA receptor, glutamatergic neurotransmission, neurodegeneration, neurotoxicity, neuroprotection, Alzheimer's disease, Parkinson's disease, frontal-temporal dementia, Lewy body dementia, vascular dementia
For citation: Yu.V. Bykov, R.A. Bekker. A review of the evidence regarding efficacy and safety of memantine in сlinical practice: a focus on neurodegenerative diseases. Psychiatry and psychopharmacotherapy. 2021; 2: 17–28.
Введение
Как показывает современная статистика заболеваемости, собранная ВОЗ, на сегодняшний день около 50 миллионов человек по всему миру страдают теми или иными нейродегенеративными заболеваниями ЦНС. Экстраполяция сегодняшних тенденций роста заболеваемости позволяет предположить, что к 2050-му году общее количество таких людей в мире может увеличиться до 152 миллионов человек. Эта проблема может стать тяжелым грузом для экономики и общества, особенно в странах с низким или средним уровнем доходов на душу населения. Между тем именно в этих странах проживает около двух третей от общемирового количества пациентов с нейродегенеративными заболеваниями ЦНС [C. Patterson, 2018].Нейродегенеративные заболевания ЦНС являются большой проблемой не только для самих пациентов и для членов их семей или работников по уходу за ними, но и для всей медицинской системы, всего общества и экономики всех стран мира. Общемировые затраты на лечение и уход за такими пациентами оцениваются приблизительно в 1 триллион долларов США ежегодно [C. Patterson, 2018].
Как известно, на сегодняшний день основными причинами заболеваемости, инвалидности и преждевременной смертности в популяции, согласно статистике ВОЗ, являются хронические сердечно-сосудистые заболевания (ССЗ), такие как ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ) и др. А наиболее частыми непосредственными причинами преждевременной инвалидизации или преждевременной смертности — являются связанные с наличием хронических ССЗ такие острые сосудистые катастрофы, как острый инфаркт миокарда (ОИМ), острое нарушение мозгового кровообращения (ОНМК) в виде ишемического или геморрагического инсульта [D. Mitrečić et al, 2020].
Вместе с тем хронические нейродегенеративные заболевания ЦНС, особенно те из них, которые постепенно приводят к развитию деменции, — являются одним из наиболее тяжелых обременений как для членов семьи пациента, так и для систем здравоохранения и социального обеспечения, для экономики и общества в целом [D. Mitrečić et al, 2020].
Термин «деменция» является зонтичным. Он применяется к целому ряду неврологических расстройств (преимущественно из числа нейродегенеративных заболеваний, но не только), для которых характерна способность вызывать прогрессирующее снижение когнитивных функций. В частности, сюда относится деменция при болезни Паркинсона (БП), болезни Хантингтона (БХ), болезни Альцгеймера (БА), деменция с тельцами Леви (ДТЛ), лобно-височная деменция (ЛВД), сосудистая деменция (СД), мультиинфарктная деменция и др. [E. L. Cunningham et al, 2015; T. K. Thakur et al, 2016].
Среди всех упомянутых нейродегенеративных заболеваний наиболее частой причиной деменции является БА. Именно на это заболевание, согласно статистике, приходится от 70% до 80% всех выявленных случаев деменции. При этом БА имеет две формы — спорадическую и семейно-наследственную. Вторая, семейно-наследственная, форма БА часто манифестирует относительно рано и может протекать особенно тяжело, с быстрым прогрессированием когнитивных нарушений (КН) и быстрой инвалидизацией пациента [A. S. Schachter, K. L. Davis, 2000].
Случаи же СД составляют от 5% до 10% от всех выявленных случаев деменции. Заболеваемость СД повышается с возрастом: на каждые 5 лет возраста она удваивается [O. Uwagbai, 2020].
Частота встречаемости ДТЛ, согласно статистике, составляет тоже от 5% до 10% от всех выявленных случаев деменции. Однако эпидемиологические данные, касающиеся распространенности ДТЛ в популяции, могут быть не совсем точными, потому что диагноз ДТЛ часто упускается из виду при жизни пациента. Эта болезнь при жизни пациента может длительное время неверно диагностироваться как БА (при преобладании когнитивных нарушений) или же как БП (при преобладании двигательных нарушений). Нередко правильный диагноз — ДТЛ — ставится таким пациентам лишь посмертно, когда в мозгу обнаруживаются характерные именно для ДТЛ патоморфологические и патогистологические изменения, в частности патогномоничные для ДТЛ включения в нейронах — так называемые «тельца Леви» [J. M. P. Kane et al, 2018].
Что же касается ЛВД, то это заболевание является второй по частоте, после БА, причиной развития деменции у пациентов моложе 65 лет. Не является редкостью развитие ЛВД и у пациентов более пожилого возраста. Среди пациентов старше 65 лет — 25% (то есть ¼) от всех выявленных случаев деменции связаны именно с ЛВД [J. J. Young et al 2018].
Случаи, когда развитие дементного состояния связано с наличием у пациента одновременно двух или нескольких нейродегенеративных заболеваний, или иных заболеваний, способных привести к деменции, обозначаются как случаи «деменции смешанного типа». Среди деменций смешанного типа наиболее часто встречаются случаи коморбидности БА и БП, а также случаи коморбидности одной из них (БА или БП) с СД, и случаи коморбидности какой-либо другой деменции нейродегенеративного типа (ДТЛ, ЛВД) с СД [N. Custodio et al, 2017].
Теоретическое обоснование для применения мемантина при нейродегенеративных заболеваниях
Как мы уже неоднократно писали в предыдущих наших статьях, посвященных мемантину, с фармакологической точки зрения этот препарат является, прежде всего, бесконкурентным (uncompetitive) антагонистом (точнее, негативным аллостерическим модулятором) магниевого сайта NMDA (N-метил-D-аспартатного) подтипа глутаматергических рецепторов, хотя он имеет и некоторые другие клинически значимые рецепторные свойства [Беккер РА, Быков ЮВ, 2016; 2017].Между тем достаточно давно известно, что глутамат является основным и наиболее распространенным возбуждающим нейромедиатором в ЦНС. Также хорошо известно, что адекватная глутаматергическая нейропередача критически важна для реализации таких ключевых для функционирования ЦНС процессов, как долговременная потенциация (long-term potentiation — LTP) или, напротив, долговременное угнетение (long-term depression — LTD), синаптическая пластичность и синаптогенез или, напротив, элиминация ненужных и избыточных синапсов. Известно и то, что наиболее важную роль в регуляции этих процессов играют именно те подвиды глутаматергической нейропередачи, которые опосредуются через ионотропные NMDA и AMPA (α-амино-3-гидрокси-5-метил-4-изоксазол-пропионовой кислоты) подтипы глутаматергических рецепторов [B. Kuns et al, 2020].
В свою очередь, вышеупомянутые процессы долговременной потенциации и долговременного угнетения, синаптогенеза и синаптической пластичности или, напротив, элиминации избыточных глутаматергических синапсов — играют важнейшую роль в регуляции таких процессов, как обучение, запоминание и воспроизведение нужной информации или, напротив, забывание ненужной информации [B. Kuns et al, 2020].
Глутаматергический рецептор подтипа NMDA представляет собой вольтаж-зависимый (или, другими словами, потенциал-зависимый) катионный канал в мембране нервной клетки. В своем открытом, или активированном, состоянии этот ионный канал способен пропускать в одну сторону (из внешней среды — внутрь клетки) некоторые одновалентные и двухвалентные катионы. Этот ионный канал отдает селективное предпочтение катионам кальция (Ca2+), но может пропускать также катионы натрия (Na+). Однако в физиологических условиях бóльшую часть времени NMDA рецептор находится в «заблокированном» состоянии. В этом состоянии сама возможность открытия встроенного в NMDA рецептор ионного канала, даже при выполнении двух других обязательных условий для активации этого рецептора — при одновременном связывании глутамата с «основным» (глутаматным) сайтом NMDA рецептора, а глицина — с его глициновым сайтом, — заблокирована катионом магния (Mg2+), который связывается со специальным так называемым «магниевым сайтом» NMDA рецептора. Таким образом, катион Mg2+ в нормальных физиологических условиях является негативным аллостерическим модулятором (или, де-факто, даже блокатором) активности NMDA рецептора [P. Xia et al, 2010; B. Kuns et al, 2020].
Уменьшение по абсолютной величине имеющегося в норме отрицательного потенциала клеточной мембраны (ее деполяризация) при возбуждении нервной клетки (например, через воздействие на какие-то другие клеточные рецепторы) приводит к высвобождению ионов магния из связи с этим аллостерическим сайтом на NMDA рецепторе. Это открывает возможность для активации NMDA рецептора при одновременном воздействии на него глутамата и глицина, и, соответственно, для открытия встроенного в NMDA рецептор ионного канала. А это, в свою очередь, вызывает входящий приток ионов Ca2+ и, в меньшей степени, ионов Na+ внутрь клетки, и усиление деполяризации мембраны (дальнейшее уменьшение по модулю ее отрицательного потенциала), то есть — дальнейшее усиление возбуждения уже возбужденной нервной клетки [P. Xia et al, 2010; B. Kuns et al, 2020].
В нормальных физиологических условиях такое усиление, или потенцирование возбуждения изначально уже возбужденной нервной клетки с помощью опосредованной NMDA рецепторами глутаматергической нейропередачи — ограничивается «сверху» другими механизмами. Это не позволяет развиться эксайтотоксичности (чрезмерному возбуждению нервной клетки из-за самораскручивающейся спирали положительной обратной связи). Само же существование этого механизма положительной обратной связи по NMDA рецепторам — как раз и играет важную роль в процессах долговременной потенциации, синаптогенеза и синаптической пластичности [P. Xia et al, 2010; B. Kuns et al, 2020].
Однако при некоторых патологических состояниях (например, возникающих из-за дефицита в ЦНС ионов Mg2+, являющихся негативными аллостерическими модуляторами NMDA рецепторов, или из-за образования в ЦНС избытка некоторых других двухвалентных катионов, которые могут являться, напротив, позитивными аллостерическими модуляторами этих рецепторов, таких как Fe2+, Zn2+, Cu2+, Mn2+, или из-за избыточного высвобождения глутамата во внеклеточную среду и нарушения его катаболизма или его обратного захвата, или из-за повышенного содержания во внеклеточной среде ионов Ca2+ и нарушения его внутриклеточного гомеостаза) — этот механизм приводит к чрезмерной активации NMDA рецепторов и, как следствие, к избыточному входящему току ионов Ca2+ и Na+ из внешней среды внутрь перевозбужденных нервных клеток [P. Xia et al, 2010; S. M. Stahl, 2013; K. J. Barnham, A. I. Bush, 2014; M. A. Santos et al, 2016; B. Kuns et al, 2020].
В свою очередь, гиперактивация NMDA рецепторов и избыточный входящий ток ионов Ca2+ и Na+ в нейронах и клетках нейроглии запускает несколько других патофизиологических механизмов, таких как эксайтотоксичность, связанные с ней оксидативный и нитрозативный стресс и свободнорадикальное повреждение нейронов и клеток нейроглии, воспалительная активация нейроглии, гиперсекреция воспалительных цитокинов (нейровоспаление), переключение катаболизма L-триптофана на кинурениновый путь с накоплением токсичных метаболитов кинуреновой кислоты, патологическая агрегация важных нейронных белков, таких как β-амилоид, и, в конечном итоге, апоптотическая гибель нервных клеток и клеток нейроглии [M. A. Rogawski, G. L. Wenk, 2003; S. A. Lipton, 2008; T. Nakamura, S. A. Lipton, 2010; S. Tu et al, 2014; E. J. Kodis et al, 2018; B. Kuns et al, 2020].
Этот опосредованный гиперактивацией NMDA рецепторов каскад патофизиологических событий, как ныне установлено, является своего рода «универсальной патологической гиперергической реакцией ЦНС на различные неблагоприятные воздействия». Он является одним из звеньев патогенеза, общих для целого ряда совершенно разных психических и неврологических расстройств, в том числе — для являющихся основной темой нашей сегодняшней статьи нейродегенеративных заболеваний (включая разнообразные деменции), последствий черепно-мозговых травм (ЧМТ) и др., а также для аффективных и тревожных расстройств, шизофрении и др. [P. Xia et al, 2010; Беккер РА, Быков ЮВ, 2016; 2017; B. Kuns et al, 2020].
Установление этого факта логически подводит нас к мысли о целесообразности использования для лечения всех этих расстройств антагонистов NMDA рецепторов. Однако попытки «лобового» использования при этих расстройствах таких «грубых» и неселективных антагонистов так называемого «дизоцилпинового сайта» NMDA рецепторов, как, например, кетамин или декстрометорфан, наталкиваются на тот факт, что нормальная, физиологическая степень активации NMDA рецепторов критически необходима для нормального функционирования ЦНС, и, в частности, для нормального протекания процессов обучения, запоминания и воспроизведения информации. Поэтому такого рода препараты, как правило, имеют выраженные когнитивные и психические побочные эффекты (ПЭ), вплоть до галлюциногенных или диссоциативных свойств [S. M. Stahl, 2013].
В противоположность таким препаратам, как вышеупомянутые кетамин и декстрометорфан, герой нашего сегодняшнего обзора — мемантин — связывается не с дизоцилпиновым, а с магниевым сайтом NMDA рецептора, причем исключительно с его «открытой», или активной конфигурацией. Кроме того, мемантин связывается с NMDA рецепторами с довольно низким аффинитетом, и связывание это является кратковременным и обратимым (он быстро и легко высвобождается из связи с NMDA рецептором). Благодаря такой своеобразной кинетике взаимодействия с NMDA рецепторами, мемантин, в отличие от, например, кетамина или декстрометорфана, предотвращает чрезмерную активацию NMDA рецепторов, но не препятствует проявлению их нормальной, физиологической активности [H. S. Chen, S. A. Lipton, 2006; S. A. Lipton, 2007; S. M. Stahl, 2013; H. Takahashi et al, 2015].
Мемантин предпочтительно связывается с NMDA рецепторами именно в тех областях мозга, где имеет место быть чрезмерное по количеству и/или чрезмерно длительное высвобождение глутамата, и/или недостаточное содержание ионов Mg2+ (синтетическим «аналогом» или своего рода «заменителем» которых он и является), и/или избыточное содержание ионов Ca2+ и некоторых других двухвалентных катионов во внеклеточной среде — то есть как раз в тех областях мозга, где происходит активное повреждение и гибель нейронов с высвобождением этих веществ. Кроме того, мемантин преимущественно воздействует на внесинаптические, тонически активируемые NMDA рецепторы, не препятствуя при этом фазной активации внутрисинаптических NMDA рецепторов и, тем самым, реализации процессов долговременной потенциации, синаптогенеза и синаптической пластичности [H. S. Chen, S. A. Lipton, 2006; S. A. Lipton, 2007; S. M. Stahl, 2013; H. Takahashi et al, 2015].
Этот специфический профиль взаимодействия мемантина с NMDA рецепторами обеспечивает, с одной стороны, эффективное противодействие опосредованной гиперактивностью NMDA рецепторов эксайтотоксичности (которая играет важную роль в патогенезе БА, БП и других нейродегенеративных заболеваний, а также целого ряда психических расстройств), а с другой — его хорошую переносимость в клинической практике, малое количество ПЭ и, в частности, отсутствие у него свойственных «грубым» и неселективным NMDA антагонистам типа кетамина или декстрометорфана психических и когнитивных ПЭ [R. Cacabelos et al, 1999; M. A. Rogawski, G. L. Wenk, 2003; S. A. Lipton, 2006; K. H. Wong et al, 2019].
Кроме того, мемантин также является селективным и обратимым антагонистом α7 подтипа никотиновых ацетилхолиновых рецепторов (Н-холинорецепторов, или, в англоязычной литературе, nAchR — nicotinic acetylcholinergic receptor). Этот подтип Н-холинорецепторов также представляет собой ионные каналы, которые в активированном состоянии становятся проницаемыми для входящего тока ионов Ca2+ в клетку. Они играют важную роль в регуляции когнитивных функций, внимания и памяти, настроения и др. [P. D. Maskell et al, 2003; M. Talantova et al, 2013; S. M. Stahl, 2013].
Важно, что фрагмент амилоида Aβ1-42, который избыточно накапливается в мозговой ткани при БА, обладает способностью активировать этот подтип Н-холинорецепторов на мембранах астроцитов. Это приводит к активации входящего тока ионов Ca2+ в астроцит и к его возбуждению. Это, в свою очередь, приводит к усилению высвобождения глутамата из активированных астроцитов. Избыточное высвобождение глутамата во внеклеточную среду стимулирует продукцию нейронами одной из изоформ синтазы оксида азота (II), так называемой «нейрональной синтазы оксида азота (II)» (nNOS). Это, в свою очередь, приводит к избыточной генерации нейронами оксида азота (II) и, как следствие, к усилению оксидативного и нитрозативного стресса и свободнорадикального повреждения нейронов и клеток нейроглии, поскольку оксид азота (II) является высокоактивным свободным радикалом, сильным окислителем и нитрозилирующим агентом [P. D. Maskell et al, 2003; M. Talantova et al, 2013; S. M. Stahl, 2013].
Таким образом, мемантин, блокируя α7 подтип Н-холинорецепторов астроцитов, косвенным механизмом уменьшает высвобождение глутамата из астроцитов и весь последующий каскад патофизиологических событий, включая чрезмерную активацию нейрональной NO-синтазы, избыточное образование оксида азота (II) и связанное с ним усиление оксидативного и нитрозативного стресса и свободнорадикального повреждения нейронов и глиальных клеток [P. D. Maskell et al, 2003; M. Talantova et al, 2013; S. M. Stahl, 2013].
Мемантин имеет и некоторые другие клинически важные рецепторные свойства. В частности, он является селективным антагонистом серотонинергических рецепторов 3-го подтипа (5-HT3). Благодаря этому рецепторному свойству, он, подобно таким препаратам с 5-HT3 антагонистической активностью и достоверно установленными прокогнитивными свойствами, как вортиоксетин, обладает способностью косвенным механизмом повышать уровень дофамина, норадреналина, гистамина и ацетилхолина в префронтальной коре. Это свойство мемантина, как предполагается, тоже вносит вклад в его общую прокогнитивную и антидепрессивную активность [M. A. Rogawski, G. L. Wenk, 2003; S. M. Stahl, 2013].
 Кроме того, мемантин, подобно уже упоминавшимся ранее кетамину и декстрометорфану, также является слабым агонистом сигма-1 рецепторов (S1R) и слабым ингибитором обратного захвата (ОЗ) всех трех моноаминов — серотонина, норадреналина и дофамина. Эти его рецепторные свойства тоже могут вносить вклад в его общую прокогнитивную, антидепрессивную и анксиолитическую активность. Агонизм мемантина к S1R может также способствовать нейропротекции, так как S1R является важным защитным белком-шапероном нервных клеток, а его активация запускает целый каскад событий, препятствующих апоптозу и улучшающих выживаемость нейронов в неблагоприятных условиях [S. M. Stahl, 2013; Беккер РА, Быков ЮВ, 2016; 2017].
Кроме того, мемантин, подобно уже упоминавшимся ранее кетамину и декстрометорфану, также является слабым агонистом сигма-1 рецепторов (S1R) и слабым ингибитором обратного захвата (ОЗ) всех трех моноаминов — серотонина, норадреналина и дофамина. Эти его рецепторные свойства тоже могут вносить вклад в его общую прокогнитивную, антидепрессивную и анксиолитическую активность. Агонизм мемантина к S1R может также способствовать нейропротекции, так как S1R является важным защитным белком-шапероном нервных клеток, а его активация запускает целый каскад событий, препятствующих апоптозу и улучшающих выживаемость нейронов в неблагоприятных условиях [S. M. Stahl, 2013; Беккер РА, Быков ЮВ, 2016; 2017].Кроме описываемых выше рецепторных свойств, мемантин не обладает клинически значимой активностью в отношении каких бы то ни было других рецепторов в ЦНС. В частности, он не связывается с рецепторами ГАМК, бензодиазепиновыми, дофаминергическими, адренергическими, гистаминовыми, серотониновыми (кроме 5-HT3 подтипа), мускариновыми холинергическими, глициновыми рецепторами. Он также не связывается с какими-либо ионными каналами клеток, включая потенциал-зависимые натриевые, калиевые или кальциевые каналы. Высокая рецепторная специфичность мемантина, отсутствие у него клинически значимого связывания с «посторонними» для реализации его прокогнитивного действия типами рецепторов обуславливает отсутствие у него off-target рецепторных эффектов, низкий уровень ПЭ и хорошую его переносимость в клинической практике [M. A. Rogawski, G. L. Wenk, 2003; S. M. Stahl, 2013].
Механизм действия мемантина при дементных состояниях отличается от механизма действия также применяемых для их лечения ингибиторов ацетилхолинэстеразы (ИАХЭ), таких как донепезил, ривастигмин, галантамин. Важную роль в механизме действия мемантина при дементных состояниях и в целом при нейродегенеративных заболеваниях играет его нейропротективная активность, то есть его способность тормозить или предотвращать апоптоз нервных клеток и прогрессирование нейродегенеративных изменений вследствие NMDA-опосредованной эксайтотоксичности, оксидативного и нитрозативного стресса, свободнорадикального повреждения клеток и нейровоспаления [C. G. Parsons et al, 2013; S. M. Stahl, 2013; B. Kuns et al, 2020].
Вместе с тем механизмы действия мемантина и ИАХЭ при дементных состояниях являются взаимодополняющими, поскольку все больше данных указывает на тесную взаимосвязь и взаимодействие между глутаматергической и холинергической системами мозга. Обе эти нейромедиаторные системы критически важны для когнитивного функционирования. Нарушения в любой из них оказывают сильное негативное влияние на когнитивные функции. Это дает теоретические основания для комбинирования мемантина с ИАХЭ при лечении дементных состояний, в тех случаях, когда такое комбинирование показано и хорошо переносится [C. G. Parsons et al, 2013; S. M. Stahl, 2013; B. Kuns et al, 2020].
В экспериментальных моделях БА на животных мемантин оказался способен не только тормозить нарастание нейродегенеративных изменений и оказывать нейропротективное действие за счет своего основного рецепторного механизма — уменьшения избыточной активации NMDA рецепторов, но и оказывать прямое противовоспалительное, антиоксидантное и антисвободнорадикальное действие, тормозить высвобождение воспалительных цитокинов и воспалительную активацию нейроглии, уменьшать оксидативный и нитрозативный стресс и свободнорадикальное повреждение нейронов и клеток нейроглии [J. Folch et al, 2018].
Кроме того, было показано также, что применение мемантина в экспериментальных моделях БА на животных приводит к развитию у них потенциально клинически значимого уровня блокады фермента BACE-1 (Beta-amyloid cleavage enzyme-1; ниже на рис. 1 обозначен как BC-1) —
одного из ключевых ферментов в каскаде амилоидогенеза, который патологически гиперактивен при БА. Таким образом, мемантин может непосредственно тормозить избыточное накопление β-амилоида, образование амилоидных бляшек и фибрилл и прогрессирование БА [J. Folch et al, 2018].
Применение мемантина в экспериментальных моделях БА ассоциировалось также с повышением уровней различных нейротрофических факторов мозга (ниже на рис.1 обозначены как НФМ), прежде всего — основного из них, так называемого мозгового нейротрофического фактора (Brain-Derived Neurotrophic Factor — BDNF) в плазме крови и в мозговой ткани животных, с активацией нейрогенеза и синаптогенеза, улучшением процессов синаптической пластичности. Все это, вместе взятое, транслировалось в улучшение когнитивных функций, памяти и обучаемости экспериментальных животных [J. Folch et al, 2018].
Новейшие доказательные данные об эффективности и безопасности мемантина при различных нейродегенеративных заболеваниях
Болезнь Альцгеймера
До настоящего времени мемантин, наряду с тремя уже упоминавшимися ИАХЭ (донепезилом, ривастигмином и галантамином), является одним из всего четырех препаратов, официально одобренных американским Управлением по контролю за качеством пищевых продуктов и лекарств (US Food and Drug Administration — US FDA) именно для лечения БА [S. M. Stahl, 2013].В ЕС мемантин впервые получил одобрение Европейского агентства по оценке медицинских продуктов (European Medical Evaluation Agency — EMEA) для лечения БА в феврале 2002 года, но только при умеренной степени выраженности БА. При легкой степени выраженности БА, и тем более при состоянии «легких когнитивных нарушений» (mild cognitive impairment — MCI), не дающих пока оснований для диагноза соответствующей формы деменции (БА), применение мемантина на тот момент считалось преждевременным и не показанным. На тот момент считалось, что потенциальный риск применения мемантина и связанных с этим ПЭ может превышать потенциальную пользу от его применения у пациентов с легкой формой БА или с субклинической степенью КН (т.е. с состоянием MCI). В то же время применение мемантина у пациентов с тяжелой степенью БА на тот момент также считалось не показанным, поскольку на тот момент, с точки зрения EMEA, отсутствовали убедительные доказательства его эффективности при тяжелых степенях БА [EMEA, 2004].
Четырьмя годами спустя, уже в 2006 году, после получения новых данных двойных слепых рандомизированных клинических испытаний (РКИ), убедительно показавших эффективность мемантина во всем диапазоне степеней тяжести БА, EMEA официально расширило показания к применению мемантина при БА, разрешив его применение как при легких, так и при среднетяжелых (умеренно выраженных) и тяжелых степенях БА [EMEA, 2006].
Основанием для принятия обоими авторитетными контролирующими органами (FDA и EMEA) подобного решения по мемантину стало то, что в клинических испытаниях III фазы, посвященных изучению его эффективности и безопасности при лечении БА, было показано, что мемантин оказывает положительное влияние на повседневную активность, когнитивное функционирование и общее качество жизни пациентов с БА, а также на общее клиническое впечатление от них (измеренное по шкале GCI — Global Clinical Impression), как при легкой и умеренной степенях выраженности БА, так и при тяжелой ее степени. Эффективность и безопасность мемантина при лечении БА во всем диапазоне степеней ее тяжести была продемонстрирована как при его использовании в монотерапии, так и в комбинации с ИАХЭ центрального действия донепезилом [B. Reisberg et al, 2003; P. N. Tariot et al, 2004].
Опубликованный в 2005 году систематический обзор и метаанализ РКИ, посвященных изучению эффективности и безопасности мемантина при лечении БА, показал, что лечение мемантином пациентов с БА легкой, умеренной и тяжелой степеней ассоциируется с положительным фармакоэкономическим эффектом (со снижением общих затрат на их лечение, социальную поддержку и уход за ними), с более длительным сохранением трудоспособности работающих пациентов с легкой степенью БА или с субклиническими КН (с состоянием MCI), с более длительным сроком до вынужденного помещения пациентов в интернат для психохроников или в дом престарелых, а также с улучшением общего качества жизни пациентов и с увеличением ожидаемой продолжительности их жизни (включая поправку на качество жизни) [L. Jonsson, 2005].
В 2007 году был опубликован метаанализ, в котором было показано, что лечение мемантином ассоциируется со значительным улучшением повседневного бытового функционирования (daily functioning), общего качества жизни, различных субдоменов когнитивных функций (памяти, обучаемости, концентрации внимания, исполнительных функций), а также способности к самообслуживанию, по сравнению с применением плацебо, как у пациентов с легкой и умеренной, так и с тяжелой степенью БА [R. S. Doody et al, 2007].
В 2008 году был опубликован еще один метаанализ, в котором было показано, что мемантин может быть полезен при лечении агрессивности и психомоторного возбуждения на фоне деменции, связанной с БА. По данным авторов этого метаанализа, разница между мемантином и плацебо в отношении уровня агрессивности и возбуждения становится очевидной уже через 12 недель лечения. Вместе с тем более поздний метаанализ от 2009 года пришел к выводу, что положительное влияние мемантина на уровень агрессивности и возбуждения при БА может развиваться более медленно. Разница между мемантином и плацебо по влиянию на эти параметры, по данным авторов второго метаанализа (от 2009 года), становится статистически значимой только после 6 месяцев лечения [G. K. Wilcock et al, 2008; G. T. Grossberg et al, 2009].
В июне 2008 года EMEA выдало лицензию на новый режим дозирования мемантина при лечении БА — 20 мг один раз в сутки (наряду с лицензированным ранее режимом его применения — 10 мг утром и в обед). Это важно в свете того, что пациенты с БА страдают забывчивостью, в том числе и в приеме лекарств. Однократный в сутки прием мемантина для многих из них удобнее и обеспечивает более высокую их приверженность лечению [EMEA, 2008].
В одном исследовании от 2009 года было показано, что у пациентов с тяжелыми формами БА применение мемантина может способствовать уменьшению выраженности некоторых психических и поведенческих симптомов деменции (ППСД), особенно — проявлений агрессивности, раздражительности, психомоторного возбуждения. Это привело к увеличению срока до вынужденной институционализации таких пациентов в учреждения долгосрочного ухода (интернаты для психохроников или дома престарелых). Вместе с тем положительное влияние мемантина на проявления ППСД у пациентов с более легкими формами БА в этом исследовании оказалось менее выраженным, и не достигло порога статистической значимости [S. J. Thomas, G. T. Grossberg, 2009].
В США сравнительно недавно была лицензирована FDA новая форма выпуска мемантина — в виде таблеток с длительным контролируемым высвобождением по 28 мг. Эти таблетки не только позволяют однократный их прием в сутки, но и обеспечивают более стабильный уровень мемантина в плазме крови в течение суток, чем ранее одобренная FDA «обычная» (с немедленным высвобождением) форма выпуска мемантина в таблетках [MM Koola, AK Parsaik, 2018].
Как уже упоминалось нами ранее, механизмы действия мемантина и одобренных наряду с ним для лечения БА центрально действующих ИАХЭ (донепезила, ривастигмина и галантамина) различаются, но являются взаимно дополняющими. Поэтому мемантин можно (а иногда и нужно) при лечении БА комбинировать с одним из этих трех ИАХЭ [J. Folch et al, 2018; A. Atri, 2019].
Комбинация мемантина с одним из вышеупомянутых трех ИАХЭ обычно приводит к суммации или взаимному потенцированию их прокогнитивного действия, и обычно не приводит к сколько-нибудь существенному увеличению риска развития ПЭ, по сравнению с монотерапией только мемантином или только ИАХЭ. Поэтому такая комбинация способна принести дополнительную пользу многим пациентам с БА [R. Howard et al, 2015; N. Kishita et al, 2019].
Так, в 2012 году в двойном слепом сравнительном РКИ было показано, что одновременное применение мемантина с ИАХЭ галантамином дает значительное преимущество в отношении улучшения когнитивного функционирования пациентов с БА, измеренного по шкале Montreal Cognitive Impairment (MCI), по сравнению с монотерапией любым из них [O. Peters et al, 2012].
В нескольких публикациях, вышедших в мировой научной прессе в период 2013–2015 годов, констатировалось, что обнадеживающие результаты исследований эффективности и безопасности применения мемантина для купирования или уменьшения психомоторного возбуждения и агрессивности у пациентов с БА могут позволить снизить частоту назначения и используемые дозы антипсихотиков (АП), а в некоторых случаях даже полностью избежать использования АП для этих целей у данной категории пациентов (по крайней мере, у той части их, которая положительно отреагирует на применение мемантина) [N. Suzuki et al, 2013; E. Cumbo, L. D. Ligori, 2014; N. Zhang et al, 2015].
А это, в свою очередь, может позволить снизить вероятность возникновения, или даже полностью избежать возникновения таких особо нежелательных и опасных у пожилых дементных пациентов ПЭ от применения АП, как экстрапирамидный синдром (ЭПС), сердечно-сосудистые и метаболические ПЭ, и уменьшить или полностью избежать риска неблагоприятного влияния АП на ожидаемую продолжительность жизни этих пациентов (риска преждевременной смертности, связанной с применением АП) [N. Suzuki et al, 2013; E. Cumbo, L. D. Ligori, 2014; N. Zhang et al, 2015].
В период 2014–2015 годов были опубликованы два новых метаанализа, в которых была продемонстрирована эффективность и безопасность применения мемантина как при легкой и умеренной, так и при тяжелой степени БА, а также значительное улучшение когнитивного функционирования пациентов с этой болезнью под влиянием лечения мемантином [C. C. Tan et al, 2014; S. Matsunaga et al, 2015].
В 2019-м году было проведено еще одно двойное слепое плацебо-контролируемое РКИ, посвященное изучению эффективности и безопасности применения монотерапии мемантином при лечении БА легкой, умеренной и тяжелой степеней. Результаты этого РКИ продемонстрировали, что монотерапия мемантином обеспечивает как краткосрочное, так и долгосрочное положительное влияние на целый ряд изучавшихся параметров, таких как повседневная бытовая активность пациентов, их когнитивное функционирование (память, обучаемость, концентрация внимания, исполнительные функции), общее качество их жизни, а также уменьшает выраженность психических и поведенческих симптомов деменции (включая психомоторное возбуждение и агрессивность) и способствует уменьшению выраженности сопутствующей депрессии и тревоги [A. C. Tricco et al, 2019].
В том же 2019-м году был опубликован еще один большой метаанализ, посвященный изучению сравнительной эффективности и безопасности мемантина и ИАХЭ в качестве средств лечения КН, развивающихся при таких нейродегенеративных заболеваниях, как БП, БА или ДТЛ. В этот метаанализ вошли 15 РКИ. По данным авторов этого метаанализа, мемантин оказывал в среднем более выраженное, чем ИАХЭ, краткосрочное (в масштабах месяцев или первых лет болезни) положительное влияние на концентрацию внимания, скорость психомоторных реакций и обработки информации, а также на исполнительные функции у этих пациентов. Вместе с тем авторы этого метаанализа также пришли к выводу о том, что ни мемантин, ни ИАХЭ, по-видимому, не способны сколько-нибудь существенно предотвратить или затормозить дальнейшее снижение когнитивных функций при длительном, многолетнем наблюдении [Y. H. Meng et al, 2019].
В 2020-м году было опубликовано одно из крупнейших на сегодняшний день натуралистических исследований эффективности применения мемантина и ИАХЭ для симптоматического лечения деменций (прежде всего БА) в реальной повседневной клинической практике. Авторы этого исследования показали, что у 68% пациентов с дементными состояниями различного генеза (и прежде всего при БА, как одной из наиболее распространенных форм деменции) применение мемантина и/или ИАХЭ приводит к значительному улучшению когнитивного функционирования или, по крайней мере, к его стабилизации (то есть к предотвращению или замедлению дальнейшего прогрессирования КН) на срок не менее 2-5 месяцев, а порой и на значительно больший срок [N. Vaci et al, 2020].
Еще одно исследование, посвященное изучению эффективности и безопасности применения мемантина для лечения БА, осложнившегося коморбидной депрессией, тоже относится к 2020-му году. По своему дизайну это исследование представляет собой 6-месячное двойное слепое плацебо-контролируемое сравнительное РКИ. В нем сопоставлялась эффективность и безопасность комбинации эсциталопрама с мемантином, и комбинации эсциталопрама с плацебо, при лечении пожилых пациентов с БА и коморбидной депрессией позднего возраста [H. Lavretsky et al, 2020].
Использованные в этом РКИ дозировки эсциталопрама составляли в среднем 11,1 мг/сут, а дозировки мемантина — в среднем 19,3 мг/сут. Авторами было показано, что комбинация эсциталопрама и мемантина была значительно эффективнее, чем комбинация эсциталопрама и плацебо, в лечении депрессий позднего возраста, коморбидных с БА. Преимущество такой комбинации было выявлено не только в отношении влияния на депрессивную и тревожную симптоматику, но и в отношении влияния на когнитивные функции пациентов. Более того, статистически достоверное преимущество во влиянии комбинации эсциталопрама и мемантина перед комбинацией эсциталопрама и плацебо на когнитивные функции пациентов сохранялось и через 12 месяцев от начала исследования, то есть уже после завершения курса лечения этими комбинациями. Это можно объяснить долгосрочным нейропротективным эффектом мемантина [H. Lavretsky et al, 2020].
Большой интерес к исследованию эффективности и безопасности мемантина при лечении БА проявляют также российские исследователи. Так, в 2008 году И. В. Колыхалов провел исследование эффективности и безопасности применения мемантина в лечении психических и поведенческих симптомов деменции (ППСД) при легкой степени БА. В этом исследовании участвовали 38 пациентов с легкими степенями БА. Автор приводит подробные клинические описания своих пациентов, а также статистические данные о частоте возникновения ППСД при разных степенях БА. Кроме того, он подчеркивает, что выраженные ППСД, включая психотическую (параноидную) симптоматику типа «бреда малого масштаба», бреда преследования или ущерба, а также нарушения сна и циркадианных ритмов (вплоть до их полного извращения — дневная сонливость и ночная бессонница), агрессивность, повышенную раздражительность, тревожность, нервозность, неясное чувство тревоги, беспокойства, страха, плаксивость или сниженное настроение, могут наблюдаться уже при легких степенях БА, со сравнительно небольшой выраженностью КН [И. В. Колыхалов, 2008].
Автором цитируемого исследования было показано, что лечение мемантином пациентов с легкой степенью БА и с наличием явных ППСД приводит к статистически достоверному уменьшению выраженности у них проявлений ППСД, в частности таких, как нарушения сна и циркадианных ритмов, плаксивость, сниженное настроение, тревожность, страхи, беспокойство, а также к улучшению их когнитивного функционирования [И. В. Колыхалов, 2008].
Автор вышеупомянутого исследования также показал, что лечение мемантином другой группы из 25 пациентов с тяжелыми степенями БА тоже приводит к значительной редукции ассоциированных с БА психических и поведенческих нарушений, прежде всего — агрессивности, раздражительности, апатии, психомоторного возбуждения, извращения циркадианных ритмов. Это привело к уменьшению уровня субъективного дистресса, испытываемого лицами, осуществляющими уход за этими пациентами [И. В. Колыхалов, 2008].
В 2010-м году О. Левин с соавторами показали, что применение мемантина в монотерапии при БА на их выборке в 40% случаев приводило к клиническому улучшению, которое было расценено авторами этого исследования как «значительное» или «очень значительное». Еще у 35% пролеченных таким образом пациентов с БА авторы констатировали «умеренное, но тем не менее клинически значимое улучшение» показателей когнитивного функционирования, повседневной бытовой активности, способности к самообслуживанию, симптомов ППСД [O. Levin et al, 2010].
Деменция с тельцами Леви
Клинических исследований, посвященных изучению эффективности и безопасности применения мемантина при ДТЛ, в мировой научной литературе в целом находится меньше, чем исследований, посвященных изучению этого же препарата при БА (основном его показании к применению, и пока что единственном официально зарегистрированном FDA и EMEA), но больше, чем при ЛВД.Так, еще в 2009-м году Д. Аарсланд с соавторами провели первое в истории двойное слепое плацебо-контролируемое РКИ, посвященное изучению эффективности и безопасности применения мемантина при двух разных по своему патогенезу нейродегенеративных заболеваниях, сопровождающихся одновременно как деменцией (или выраженными КН), так и экстрапирамидными нарушениями (паркинсонизмом, акатизией) — при БП и при ДТЛ. Общее количество пациентов с ДТЛ или БП, принявших участие в этом РКИ, составило 72 человека. Применявшаяся в этом исследовании доза мемантина была фиксированной — 20 мг/сут [D. Aarsland et al, 2009].
Авторам этого РКИ удалось показать, что применение мемантина в их выборке пациентов привело к статистически достоверному улучшению показателей шкалы общего клинического впечатления (Clinical Global Impression — CGI) через 24 недели, по сравнению с применением плацебо, как у пациентов с БП, так и у пациентов с ДТЛ. При этом значительное улучшение наблюдалось как в отношении когнитивного функционирования, так и в отношении двигательных функций, нормализации поведения, уменьшения сопутствующей депрессии, улучшения способности пациентов к самообслуживанию [D. Aarsland et al, 2009].
В 2010-м году другая группа авторов, руководимая М. Emre, решила попытаться воспроизвести либо опровергнуть результаты, полученные ранее группой Д. Аарсланда. С этой целью они провели более крупное (199 участников), также 24-недельное, двойное слепое плацебо-контролируемое РКИ по изучению эффективности и безопасности применения мемантина в лечении пациентов с БП или ДТЛ. Как и в исследовании Д. Аарсланда с соавторами, эта группа авторов использовала фиксированную дозу мемантина — 20 мг/сут [M. Emre et al, 2010].
Результаты этого РКИ несколько отличаются от результатов, полученных чуть ранее, в 2009-м году, группой Д. Аарсланда при изучении того же вопроса. А именно, эти авторы показали, что, по крайней мере на выборке из их исследования, применение мемантина приводит к значительному улучшению показателей шкалы общего клинического впечатления (CGI), по сравнению с применением плацебо, только у пациентов с ДТЛ, но не у пациентов с БП и деменцией, вызванной наличием БП [M. Emre et al, 2010].
Кроме того, M. Emre с соавторами показали также, что у пациентов с ДТЛ, получавших мемантин, наблюдалось выраженное уменьшение проявлений ППСД, по сравнению с пациентами с этой болезнью, которые получали плацебо (-4,3 балла против +1,7 балла по шкале NPI-12;
p=0,041). В то же время они не обнаружили каких-либо существенных улучшений психического статуса или поведения у пациентов с БП и деменцией, вызванной наличием БП, получавших мемантин, по сравнению с такими же пациентами получавшими плацебо [M. Emre et al, 2010].
Между тем, в исследовании Д. Аарсланда с соавторами, как мы уже упоминали выше, констатировалась эффективность мемантина при обоих типах дементирующих нейродегенеративных заболеваний — как при ДТЛ, так и при БП [D. Aarsland et al, 2009].
Такое расхождение в полученных этими двумя исследовательскими группами результатах может объясняться какими-то особенностями выборки пациентов в обоих этих РКИ (например, тем, что в исследование M. Emre с соавторами могли попасть в среднем более тяжелые пациенты с БП, и поэтому они не отметили особенного эффекта от применения мемантина при БП, но отметили его при ДТЛ) [M. Emre et al, 2010].
Значительное внимание уделяли исследованию эффективности и безопасности применения мемантина при лечении ДТЛ также и российские исследователи. Так, в 2018-м году Е. В. Васенина с соавторами провели обследование 38 пациентов с клинически диагностированной ДТЛ. В течение последующих 6 месяцев все эти пациенты получали монотерапию ИАХЭ центрального действия — галантамином в дозе 16 мг/сут. Девятнадцати из этих 38 пациентов, у которых монотерапия галантамином в дозе 16 мг/сут на протяжении 6 месяцев не привела к достаточному улучшению клинического состояния, к терапии был добавлен мемантин в дозе 10-20 мг/сут (в зависимости от индивидуальной переносимости) [Е. Е. Васенина с соавт, 2018].
Авторы этого исследования показали, что на фоне применения комбинации галантамина 16 мг/сут и мемантина 10-20 мг/сут отмечается более значительное улучшение концентрации внимания, памяти, речевых функций, а также поведения пациентов с ДТЛ, частично резистентных к монотерапии галантамином, по сравнению с предшествующим периодом монотерапии галантамином [Е. Е. Васенина с соавт, 2018].
Годом позже, уже в 2019-м году, О. С. Левин с соавторами опубликовали результаты проведенного ими открытого контролируемого исследования эффективности и безопасности применения мемантина в лечении пациентов с клинически диагностированной ДТЛ. Это исследование проводилось на протяжении 16 недель. В нем приняли участие в общей сложности 23 пациента с ДТЛ. Все они были разделены на две группы. При этом 14 пациентов составили группу активного лечения. Всем им был назначен мемантин в фиксированной дозе 20 мг/сут. Еще 9 пациентов составили контрольную группу, которая получала плацебо [О. С. Левин с соавт, 2019].
Авторы этого исследования продемонстрировали, что применение мемантина при ДТЛ оказывает выраженное положительное влияние на общее психическое состояние и неврологический (двигательный) статус пациентов с ДТЛ, на их способность к самообслуживанию и на их повседневную активность, а также на их когнитивное функционирование, по сравнению с применением плацебо [О. С. Левин с соавт, 2019].
Кроме того, этими авторами отмечена также своеобразная стабилизация психического состояния пациентов с ДТЛ под влиянием лечения мемантином, по сравнению с применением плацебо. А именно, под влиянием мемантина значительно уменьшались флуктуации психического состояния и уровня бодрствования этих пациентов в течение дня и ото дня ко дню, а также флуктуации уровня их повседневной бытовой активности ото дня ко дню. Наблюдалось также уменьшение под влиянием мемантина проявлений агрессивности, раздражительности, неуместной двигательной, речевой или сексуальной расторможенности у пациентов с ДТЛ [О. С. Левин с соавт, 2019].
Лобно-височная деменция
По данным патоморфологических исследований, для ЛВД характерно снижение общего количества и плотности NMDA глутаматергических рецепторов в пораженных зонах коры больших полушарий головного мозга (прежде всего — в лобной и височной ее долях, что и дало название этой болезни) [A. W. Procter et al, 1999].Исследований, в которых бы прицельно изучалась эффективность и безопасность применения мемантина именно при ЛВД, в мировой научной литературе сравнительно немного (меньше, чем при БА или ДТЛ), но они есть. Так, в 2007-м году была опубликована статья, описывающая небольшую серию клинических случаев ЛВД, при которых применение мемантина оказало положительное влияние на психическое состояние и когнитивное функционирование пациентов. Это проявилось, в частности, в улучшении общего балла по шкале комплексного нейропсихиатрического исследования (Neuropsychiatric Interview — NPI) и по шкале общего клинического впечатления (Clinical Global Impression — CGI). Особенно выраженным было положительное влияние мемантина на подшкалы апатии, психомоторного возбуждения, тревоги и беспокойства NPI [M. M. Swanberg, 2007].
Немного позднее, уже в 2009-м году, другая группа авторов опубликовала результаты пилотного открытого исследования эффективности и безопасности применения мемантина при лечении ЛВД. Эти авторы также констатировали временное улучшение общих показателей по шкалам NPI и CGI под влиянием мемантина. Особенно выраженной редукции, опять-таки, подвергались симптомы апатии, тревоги, беспокойства и психомоторного возбуждения. Авторы этого исследования констатировали, что мемантин является перспективным и заслуживающим дальнейшего изучения в формате двойных слепых плацебо-контролируемых РКИ средством лечения пациентов с ЛВД, и что он может способствовать значительному улучшению общего качества жизни как самих пациентов с ЛВД, так и членов их семей или других лиц, осуществляющих уход за ними [A. L. Boxer et al, 2009].
В 2013-м году было опубликовано сообщение об еще одном клиническом случае пациента с ЛВД, у которого симптомы апатии уменьшились под влиянием лечения мемантином [K. A. Links et al, 2013].
Нейровизуализационные исследования (функциональная магнито-резонансная томография (фМРТ), а также позитронно-эмиссионная томография (ПЭТ) с меченной радиоактивным фтором-18 (18F) фтордезоксиглюкозой) показали, что применение мемантина у пациентов с ЛВД приводит к повышению патологически сниженной при этой болезни метаболической активности префронтальной и височной долей коры больших полушарий головного мозга, а также в узловых точках так называемой «сети покоящегося режима» (default mode network). Это может указывать на потенциальную клиническую эффективность мемантина при ЛВД [T. W. Chow et al, 2011; 2013].
Деменция, связанная с болезнью Паркинсона
Как мы уже упоминали ранее в разделе, посвященном описанию доказательной базы для применения мемантина в лечении ДТЛ, еще в 2009-м году группа Д. Аарсланда в первом двойном слепом плацебо-контролируемом РКИ по применению мемантина для лечения ДТЛ или деменции, связанной с БП, показала, что применение мемантина при лечении деменции, связанной с БП, приводит к небольшому, но все же клинически значимому улучшению когнитивного и двигательного функционирования пациентов с БП и деменцией спустя 24 недели лечения. Для оценки когнитивного функционирования в этом РКИ использовалась шкала Mini Mental State Examination (MMSE), а для оценки двигательных нарушений — шкала выраженности экстрапирамидных симптомов (Extrapyramidal Symptom Scale — EPSS) [D. Aarsland et al, 2009].В этом РКИ в подгруппе пациентов с БП и деменцией, обусловленной наличием БП, которая получала мемантин, у 27% участников через 24 недели лечения наблюдалось улучшение когнитивного и двигательного функционирования, варьировавшее у разных пациентов от «умеренного» до «значительного» или «очень значительного». В то же время ни один из тех пациентов с БП и деменцией, связанной с БП, которые в этом РКИ получали плацебо, не сообщал о каком-либо улучшении, которое можно было бы квалифицировать больше, чем «легкое» или «незначительное» [D. Aarsland et al, 2009].
В 2009-м году И. Лерой с соавторами в другом интересном РКИ продемонстрировали, что отмена мемантина у пациентов с БП и деменцией на фоне БП приводит к более выраженному ухудшению когнитивного и двигательного функционирования, чем отмена плацебо. Это исследование проводилось на протяжении 22 недель. Первая фаза его состояла в двойном слепом плацебо-контролируемом исследовании эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП на протяжении 16 недель. Вторая же фаза состояла в «слепой» отмене получаемого пациентом препарата (будь то мемантин или плацебо) [I. Leroi et al, 2009].
После окончания 7-дневного периода «вымывания» мемантина из крови, а также через 6 недель после этого, пациенты подвергались повторному исследованию их когнитивных и двигательных функций. Авторы этого РКИ отметили, что клинически значимое ухудшение общего психического состояния, уровня когнитивного функционирования, двигательных функций и способности к самообслуживанию — гораздо чаще наблюдалось в группе пациентов, которые до отмены получали мемантин (70% случаев ухудшения, расцененного как клинически значимое), чем в группе пациентов, которые до отмены получали плацебо (29% случаев ухудшения, расцененного как клинически значимое). Кроме того, в группе мемантина ухудшение по данным показателям было в среднем более выраженным, чем в группе плацебо. По мнению авторов этого РКИ, данный факт (ухудшение при отмене мемантина) убедительно демонстрирует, что мемантин эффективен в лечении БП и деменции на фоне БП, даже если этот факт не кажется столь уж очевидным при прямом сравнении мемантина и плацебо, как в первой фазе исследования [I. Leroi et al, 2009].
В 2011-м году были опубликованы результаты еще одного двойного слепого плацебо-контролируемого РКИ, посвященного изучению эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП. В этом РКИ использовался дизайн, похожий на тот, что был использован в 2009-м году И. Лероем с соавторами, — со «слепой» отменой мемантина или плацебо после завершения основной части исследования. Основная фаза исследования длилась на протяжении 24 недель. Авторы этого РКИ тоже показали, что после отмены мемантина клинически значимое ухудшение когнитивных и двигательных функций, а также психического состояния пациентов с БП и деменцией на фоне БП наблюдается гораздо чаще, чем после отмены плацебо. При этом, по их данным, на скорость «истощения» лечебного эффекта мемантина после его отмены больше всего влияет быстрое возвращение или усиление сопутствующей тревожной и депрессивной симптоматики (такое наблюдалось у 9% пациентов). Показатели по шкале общего клинического впечатления (CGI) также значительно ухудшились в группе отмены мемантина, по сравнению с группой отмены плацебо [C. Johansson et al, 2011].
В еще одном 24-недельном двойном слепом плацебо-контролируемом РКИ, тоже от 2011 года, изучали влияние применения мемантина у пациентов с БП и деменцией на фоне БП на общее качество жизни пациентов, в сопоставлении с применением плацебо. Авторами этого РКИ было показано, что в группе пациентов, которая получала мемантин, средний балл по шкале субъективной оценки общего качества жизни (Quality of Life — QoL) повысился на 42%, в то время как в группе пациентов, получавшей плацебо, этот показатель повысился всего на 15%. Кроме того, в группе мемантина также было больше пациентов, сообщавших о «значительном» или «очень значительном» улучшении общего качества жизни, по сравнению с группой плацебо [V. Larsson et al, 2011].
Не обделили вниманием вопрос об эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП также и российские исследователи
[М. Н. Лузин с соавт, 2007; О. С. Левин, Л. А. Батукаева, 2008].
Так, в 2007-м году М. Н. Лузин с соавторами обследовали и отобрали для участия в своем исследовании 38 пациентов с БП и деменцией, развившейся на фоне БП, из них 20 мужчин и 18 женщин. Все они на момент начала исследования уже принимали препараты леводопы. Всем им, на фоне продолжения лечения препаратами леводопы, был дополнительно назначен мемантин по следующей схеме: 1-я неделя — 5 мг утром, 2-я неделя — 5 мг утром и 5 мг в обед (10 мг/сут), а с 3-й недели и далее — 10 мг утром и 10 мг в обед (20 мг/сут). Общая длительность лечения мемантином в их исследовании составляла 6 месяцев [М. Н. Лузин с соавт, 2007].
Авторы этого исследования показали, что адъювантное применение мемантина в дополнение к препаратам леводопы у пациентов с БП и деменцией на фоне БП приводит к статистически достоверному уменьшению выраженности не только типичных для БП двигательных нарушений (гипокинезии, брадикинезии, тремора, гипертонуса мышц и мышечной ригидности), но и к статистически достоверному улучшению показателей вербальной и зрительной памяти, речевых функций, логики и мышления, а также к улучшению настроения и общего самочувствия пациентов, к уменьшению их апатии, уменьшению выраженности сопутствующей депрессивной и тревожной симптоматики, и к повышению их повседневной активности и способности к самообслуживанию [М. Н. Лузин с соавт, 2007].
Годом позже, уже в 2008-м году, О. С. Левин и Л. А. Батукаева опубликовали результаты своего исследования, тоже посвященного изучению вопроса об эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП. В их исследовании приняли участие 15 пациентов с БП и деменцией, развившейся на фоне БП. Всем участникам исследования его авторы назначали мемантин по следующей схеме: первая неделя — 5 мг один раз в сутки утром, 2-я неделя — 5 мг утром и 5 мг в обед (10 мг/сут), 3-я неделя — 10 мг утром и 5 мг в обед (15 мг/сут), а с 4-й недели и далее — 10 мг утром и 10 мг в обед (20 мг/сут). Общая продолжительность лечения мемантином в этом исследовании составляла 24 недели [О. С. Левин, Л. А. Батукаева, 2008].
Авторы этого исследования показали, что применение мемантина при лечении БП и деменции на фоне БП — эффективно и безопасно. Мемантин вызывал у их пациентов стабильное улучшение психического состояния, настроения, самочувствия, повседневной активности, параметров когнитивного и двигательного функционирования и способности к самообслуживанию. При этом препарат хорошо переносился пациентами с этой болезнью. Ни в одном случае авторами не было отмечено развития каких-либо существенных ПЭ на фоне лечения мемантином. Ими не было также зарегистрировано отказов пациентов от продолжения лечения этим препаратом по любой причине. По их наблюдениям, эффективность мемантина при деменциях на фоне БП, по крайней мере в их сравнительно небольшой выборке из 15 пациентов, была сопоставима с эффективностью мемантина при БА (его основном — и пока единственном официально зарегистрированном FDA и EMEA — показании к применению) [О. С. Левин, Л. А. Батукаева, 2008].
Наконец, последнее из российских исследований, посвященных изучению эффективности и безопасности применения мемантина в лечении БП и деменции на фоне БП, датируется 2010-м годом. Его авторами являются И. В. Литвиненко с соавторами. По своему дизайну оно является долгосрочным (52 недели) открытым РКИ с небольшой выборкой. Авторы этого исследования сумели показать, что пациенты с БП и деменцией на фоне БП, получавшие мемантин, к сроку 24 недели продемонстрировали значительное и статистически достоверное улучшение показателей когнитивного функционирования по таким стандартным шкалам, как MMSE (p <0,05), ADAS-cog (p <0,05), тест рисования часов (p <0,05) и тест FAB (p <0,01), по сравнению с контрольной группой, получавшей плацебо [I. V. Litvinenko et al, 2010].
Кроме того, авторы цитируемого исследования также сумели показать, что к моменту завершения их исследования (то есть к сроку 52 недели) у пациентов, получавших мемантин, наблюдалось значительное улучшение показателей общего психического статуса и когнитивного функционирования по 12-пунктовой шкале нейропсихиатрического исследования (NPI), по сравнению с исходными их показателями по этой шкале (p <0,05) [I. V. Litvinenko et al, 2010].
Сосудистая деменция
Еще в самом начале клинического изучения мемантина делались попытки его применения для лечения СД, наряду с его официально лицензированным FDA и EMEA применением для лечения деменции на фоне БА. Так, в ряде двойных слепых плацебо-контролируемых РКИ, проведенных еще в период 2002–2003 годов, мемантин был признан эффективным, безопасным и хорошо переносимым препаратом для лечения СД разной степени выраженности — от легкой до умеренной и даже тяжелой [J. M. Orgogozo et al, 2002; G. Wilcock et al, 2002; H. J. Mobius, A. Stoffler, 2003].В 2007-м году был опубликован систематический обзор и метаанализ, посвященный изучению и обобщению данных о сравнительной эффективности, безопасности и переносимости применения мемантина и различных ИАХЭ при лечении СД. В этот метаанализ вошли данные трех двойных слепых плацебо-контролируемых РКИ, посвященных применению при лечении СД донепезила, двух — по применению при этой патологии галантамина, одного — по применению при ней ривастигмина, и двух — по применению мемантина [H. Kavirajan, L. S. Schneider, 2007].
Авторы этого метаанализа констатировали, что при лечении пациентов с СД легкой и умеренной степени выраженности мемантин, по-видимому, более эффективен в отношении улучшения когнитивных функций, чем любой из упомянутых трех ИАХЭ [H. Kavirajan, L. S. Schneider, 2007].
Кроме того, они также констатировали, что применение ИАХЭ для лечения пациентов с СД ассоциируется с большей вероятностью отсева (отказа от продолжения лечения или от участия в исследовании) и с большей вероятностью развития ПЭ [H. Kavirajan, L. S. Schneider, 2007].
В 2011-м году японские исследователи показали эффективность применения мемантина при подкорковой форме СД [H. Tomimoto, 2011].
Активно изучали применение мемантина для лечения СД и смешанных форм деменций также исследователи из России, Украины и других стран СНГ [Е. Б. Любов с соавт, 2010; N. Iu. Bachyns’ka, 2013].
Так, в 2010-м году Е. Б. Любов с соавторами опубликовали результаты проведенного ими 6-месячного проспективного натуралистического исследования, посвященного сравнению эффективности различных подходов к лечению СД в реальной повседневной клинической практике. Этой группе авторов удалось показать, что применение мемантина при лечении СД имеет значительное преимущество в клинической эффективности перед «традиционным» для РФ лечением этой патологии, имеющим слабую доказательную базу с точки зрения современной науки («сосудистые», «нейрометаболические» и «ноотропные» препараты) [Е. Б. Любов с соавт, 2010].
Это преимущество мемантина над «традиционным лечением» СД проявлялось в таких доменах, как коррекция нежелательного поведения дементных пациентов (в частности, проявлений агрессивности, раздражительности, психомоторного возбуждения, неуместной двигательной, речевой или сексуальной расторможенности), уменьшение или контроль психопатологической симптоматики (проявлений психоза, депрессии или тревоги, беспокойства, ночной бессонницы и дневной сонливости, апатии), уменьшение выраженности КН, улучшение повседневной активности и социального функционирования пациентов с СД, снижение нагрузки на формальных и неформальных опекунов пациентов [Е. Б. Любов с соавт, 2010].
Чуть позднее, уже в 2013-м году, украинский исследователь Н. Ю. Бачинская провела комплексное неврологическое, экспериментально-психологическое и нейрофизиологическое обследование 33-х пациентов с легкими и умеренными степенями БА и/или СД до начала лечения мемантином и спустя 3 месяца после начала лечения [N. Iu. Bachyns’ka, 2013].
Ей удалось показать, что лечение пациентов с БА и/или СД мемантином в дозе 5–10 мг/сут на протяжении 3-х месяцев приводит к значительному снижению выраженности исходно имевшихся у этих пациентов КН, к улучшению показателей биоэлектрической активности мозга пациентов по сравнению с исходным их уровнем (до начала лечения), а также к улучшению общего психического состояния, настроения и поведения пациентов, к уменьшению проявлений агрессивности, раздражительности, девиантного поведения, психомоторного возбуждения. Это способствовало снижению стрессовой нагрузки на лиц, осуществляющих уход за такими пациентами [N. Iu. Bachyns’ka, 2013].
Наконец, в 2020-м году группа китайских исследователей опубликовала статью, в которой продемонстрировала эффективность сочетанного применения мемантина и электроакупунктуры волосистой части головы (скальпа) при лечении КН, ассоциированных с СД [A. Yue et al, 2020].
Заключение
Как видно из приведенных нами данных литературы за последние 5-10 лет, результаты новейших исследований в очередной раз подтверждают, что мемантин является эффективным и безопасным средством лечения нейродегенеративных заболеваний, таких, как БА, БП, ДТЛ, ЛВД, СД и другие.Весьма важно то, что мемантин не просто приносит пациентам с этими заболеваниями симптоматическое улучшение, но и оказывает истинный нейропротективный эффект, то есть тормозит нарастание патологических изменений в ЦНС, связанных с нейродегенерацией.
Мемантин хорошо переносится пациентами с нейродегенеративными заболеваниями, в том числе пациентами пожилого и старческого возраста, отягощенными наличием многих сопутствующих соматических заболеваний. Побочные эффекты при его применении возникают редко, и обычно они слабо или незначительно выражены, и не препятствуют продолжению терапии им.
Помимо улучшения когнитивных функций, способности к повседневному обслуживанию и общего качества жизни пациентов с нейродегенеративными заболеваниями, мемантин также способствует улучшению их психического состояния, в частности, уменьшению проявлений коморбидной депрессии и тревоги, уменьшению агрессивности и раздражительности. У пациентов с БП, ДТЛ и БХ мемантин также способствует улучшению двигательных функций, уменьшению проявлений паркинсонизма, акатизии, гиперкинезов.
Одним из препаратов мемантина, доступным в России, является Тингрекс® (АО «Гриндекс», Латвия). В открытом рандомизированном проводимом в два этапа перекрестном исследовании биоэквивалентности препаратов Тингрекс®, таблетки, покрытые пленочной оболочкой, 10 мг и оригинального препарата мемантин, таблетки, покрытые пленочной оболочкой, 10 мг, с однократным приемом натощак у здоровых добровольцев, было продемонстрировано полное совпадение средних фармакокинетических профилей. Таким образом установлено, что
Тингрекс® и оригинальный мемантин биоэквивалентны [83].
Список исп. литературыСкрыть список1. Беккер РА, Быков ЮВ. Мемантин: возможности и перспективы применения в психиатрии (Обзор современных данных) //Психиатрия и психофармакотерапия. 2016;4(18):42-51.
2. Беккер РА, Быков ЮВ. Мемантин: обзор применения в неврологии //Психиатрия и психофармакотерапия. 2017;1(9):34-43.
3. Васенина ЕЕ, Ганькина ОА, Левин ОС. Добавление мемантина к галантамину повышает эффективность лечения у пациентов с умеренной степенью тяжести деменции с тельцами Леви //Журнал неврологии и психиатрии им. C.C. Корсакова. 2018. Т. 118. № 6-2. С. 32-36.
4. Колыхалов И.В. Поведенческие и антипсихотические эффекты мемантина у пациентов с деменцией //Психиатрия. 2008. № 4-6 (34-36). С. 65-69.
5. Левин ОС, Батукаева ЛА, Смоленцева ИГ, Амосова НА. Эффективность и безопасность мемантина при деменции с тельцами Леви //Журнал неврологии и психиатрии им. C.C. Корсакова. 2008. Т. 108. № 5. С. 39-46.
6. Левин ОС, Батукаева ЛА. Эффективность мемантина при болезни Паркинсона с деменцией //Журнал неврологии и психиатрии им. C.C. Корсакова. 2008. Т. 108. № 12. С. 16-24.
7. Лузин МН, Кривонос ОВ, Кожевникова ЖВ. Акатинол мемантин в терапии когнитивных расстройств при болезни Паркинсона //Журнал неврологии и психиатрии им. C.C. Корсакова. 2007. Т. 107. № 1. С. 26-30.
8. Любов ЕБ, Митина ЮВ, Сюмкина ОВ и др. Клинико-функциональный и ресурсосберегающий эффекты лечения мемантином деменции Альцгеймеровского типа и сосудистой деменции //Социальная и клиническая психиатрия. 2010. Т. 20. № 1. С. 43-51.
9. Aarsland D, Ballard C, Walker Z et al. Memantine in patients with Parkinson’s disease dementia or dementia with Lewy bodies: a double-blind, placebo-controlled, multi-centre trial. Lancet Neurol. 2009;8:613–618.
10. Atri A. Current and future treatments in Alzheimer’s disease. Semin Neurol. 2019;39:227-240.
11. Bachyns'ka NIu, Rozheliuk IF, Polietaieva KM, Kholin VO. [Use of memantine for elderly patients in the mild stage of Alzheimer's and vascular dementia]. [Article in Ukrainian]. Lik Sprava. 2013;(7):80-96.
12. Barnham KJ, Bush AI. Biological metals and metal-targeting compounds in major neurodegenerative diseases. Chem. Soc. Rev. 2014;43:6727–6749.
13. Boxer AL, Lipton AM, Womack K et al. An open-label study of memantine treatment in 3 subtypes of frontotemporal lobar degeneration. Alzheimer Dis Assoc Disord. 2009;23:211–217.
14. Cacabelos R, Takeda M, Winblad B. The glutamatergic system and neurodegeneration in dementia: preventive strategies in Alzheimer's disease. Int J Geriatr Psychiatry. 1999;14(1):3-47.
15. Chen HS, Lipton SA. The chemical biology of clinically tolerated NMDA receptor antagonists. Neurochem. 2006;97:1611–1626.
16. Chow TW, Fam D, Graff-Guerrero A et al. Fluorodeoxyglucose positron emission tomography in semantic dementia after 6 months of memantine: An open-label pilot study. Int J Geriatr Psychiatry. 2013;28:319–325.
17. Chow TW, Graff-Guerrero A, Verhoeff NP et al. Open-label study of the short-term effects of memantine on FDG-PET in frontotemporal dementia. Neuropsychiatr Dis Treat. 2011;7:415–424.
18. Cumbo E, Ligori LD. Differential effects of current specific treatments on behavioral and psychological symptoms in patients with Alzheimer’s disease: A 12-month, randomized, open-label trial. J Alzheimers Dis 2014;39:477–485.
19. Cunningham EL, McGuinness B, Herron B, Passmore AP. Dementia. Ulster Med. J. 2015;84:79–87.
20. Custodio N, Montesinos R, Lira D et al. Mixed dementia: A review of the evidence. Dement Neuropsychol. 2017;11(4):364-370.
21. Doody RS, Tariot PN, Pfeiffer E et al. Meta-analysis of six-month memantine trials in Alzheimer’s disease. Alzheimers Dement. 2007;3:7–17.
22. EMEA Committee for Medicinal products for Human Use. Plenary meeting monthly report. 17‐11‐2005. October 2005 Vol. http://www.emea. europa.eu/pdfs/human/press/pr/36234805en.pdf.
23. Emre M, Tsolaki M, Bonucelli U et al. Memantine for patients with Parkinson’s disease dementia or dementia with Lewy bodies: a randomized, double-blind, placebo-controlled trial. Lancet Neurol. 2010;9(10):969–977.
24. European Commission. Memantine receives European‐wide approval for once‐daily dosing. http://www.alzheimer‐europe.org/?content=shnw& shnwid=5976E167EBBA.
25. European Medicines Agency. Ebixa. European Public Assessment Report. www.emea.eu.int/humandocs/Humans/EPAR/ebixa/ebixa.htm 2004.
26. FDA approves Namenda(TM) (Memantine HCl) for the treatment of moderate to severe Alzheimer's disease. http://ir.frx.com/phoenix.zhtml?c= 83198&p=irol‐newsArticle&ID=459801&highlight=..
27. Folch J, Busquets O, Ettcheto M. Memantine for the Treatment of Dementia: A Review on its Current and Future Applications. J Alzheimers Dis. 2018;62(3):1223–1240.
28. Grossberg GT, Pejović V, Miller ML et al. Memantine therapy of behavioral symptoms in community-dwelling patients with moderate to severe Alzheimer’s disease. Dement Geriatr Cogn Disord.2009;27:164–172.
29. Howard R, McShane R, Lindesay J, et al. Nursing home placement in the donepezil and memantine in moderate to severe Alzheimer’s disease (DOMINO-AD) trial: secondary and post-hoc analyses. Lancet Neurol. 2015;14:1171-1181.
30. Johansson C, Ballard C, Hansson O et al. Efficacy of memantine in PDD and DLB: an extension study including washout and open-label treatment. Int. J. Geriatr. Psychiatry. 2011;26:206–213.
31. Jonsson L. Cost-effectiveness of memantine for moderate to severe Alzheimer’s disease in Sweden. Am J Geriatr Pharmacother. 2005;3:77–86.
32. Kane JPM, Surendranathan A, Bentley A et al. Clinical prevalence of Lewy body dementia. Alzheimers Res Ther. 2018;10(1):19.
33. Kavirajan H, Schneider LS. Efficacy and adverse effects of cholinesterase inhibitors and memantine in vascular dementia: a meta-analysis of randomised controlled trials. Lancet Neurol. 2007;6:782–792.
34. Kishita N, Backhouse T, Mioshi E. Nonpharmacological interventions to improve depression, anxiety, and quality of life (QoL) in people with dementia: an overview of systematic reviews. J Geriatr Psychiatry Neurol. 2019;33:28-41.
35. Kodis EJ, Choi S, Swanson E et al. N-methyl-D-aspartate receptor-mediated calcium influx connects amyloid-β oligomers to ectopic neuronal cell cycle reentry in Alzheimer’s disease. Alzheimer’s Dement. 2018;14:1302–1312.
36. Koola MM, Parsaik AK. Galantamine-memantine combination effective in dementia: Translate to dementia praecox? Schizophr Res Cogn. 2018;12:8-10.
37. Kuns B, Rosani A, Varghese D. Memantine. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020.
38. Larsson V, Engedal K, Aarsland D et al. Quality of life and the effect of memantine in dementia with Lewy bodies and Parkinson’s disease dementia. Dement. Geriatr. Cogn. Disord. 2011;32:227–234.
39. Lavretsky H, Laird KT, Krause-Sorio B et al. A Randomized Double-Blind Placebo-Controlled Trial of Combined Escitalopram and Memantine for Older Adults With Major Depression and Subjective Memory Complaints. Am J Geriatr Psychiatry. 2020;28(2):178-190.
40. Leroi I, Overshott R, Byrne EJ et al. Randomized controlled trial of memantine in dementia associated with Parkinson’s disease. Mov. Disord. 2009;24:1217–1221.
41. Levin O, Yunishchenko N, Dudarova M. Efficacy of akatinol memantine in moderate cognitive impairments. Neurosci Behav Physiol. 2010;40:926–933.
42. Links KA, Black SE, Graff-Guerrero A et al. A case of apathy due to frontotemporal dementia responsive to memantine. Neurocase. 2013;19:256–261.
43. Lipton S. NMDA receptor activity regulates transcription of antioxidant pathways. Nat. Neurosci. 2008;11:381–382.
44. Lipton SA. Paradigm shift in neuroprotection by NMDA receptor blockade: Memantine and beyond. Nat. Rev. Drug Discov. 2006;5:160–170.
45. Lipton SA. Pathologically activated therapeutics for neuroprotection. Nat. Rev. Neurosci. 2007;8:803–808.
46. Litvinenko IV, Odinak MM, Mogil’naya VI, Perstnev SV. Use of memantine (akatinol) for the correction of cognitive impairments in Parkinson’s disease complicated by dementia. Neurosci Behav Physiol. 2010;40(2):149–55.
47. Maskell PD, Speder P, Newberry NR, Bermudez I. Inhibition of human α7 nicotinic acetylcholine receptors by open channel blockers of N-methyl-D-aspartate receptors. Br J Pharmacol. 2003;140:1313–1319.
48. Matsunaga S, Kishi T, Iwata N. Memantine monotherapy for Alzheimer’s disease: A systematic review and meta-analysis. 2015;PLoS One 10:e0123289.
49. Meng YH, Wang PP, Song YX, Wang JH. Cholinesterase inhibitors and memantine for Parkinson's disease dementia and Lewy body dementia: A meta-analysis. Exp Ther Med. 2019;17(3):1611-1624.
50. Mitrečić D, Petrović DJ, Stančin P et al. How to face the aging world - lessons from dementia research. Croat Med J. 2020;61(2):139-146.
51. Mobius HJ, Stoffler A. Memantine in vascular dementia. Int Psychogeriatr. 2003;15(1):207–213.
52. Nakamura T, Lipton SA. Preventing Ca2+-mediated nitrosative stress in neurodegenerative diseases: Possible pharmacological strategies. Cell Calcium. 2010;47:190–197.
53. Orgogozo JM, Rigaud AS, Stoffler A et al. Efficacy and safety of memantine in patients with mild to moderate vascular dementia: a randomized, placebo-controlled trial (MMM 300) Stroke. 2002;33(7):1834–1839.
54. Parsons CG, Danysz W, Dekundy A, Pulte I. Memantine and cholinesterase inhibitors: Complementary mechanisms in the treatment of Alzheimer’s disease. Neurotox. Res. 2013;24:358–369.
55. Patterson C. Alzheimer's Disease International; London: 2018. World Alzheimer report 2018.
56. Peters O, Lorenz D, Fesche A et al. A combination of galantamine and memantine modifies cognitive function in subjects with amnestic MCI. J Nutr Health Aging. 2012;16:544–548.
57. Procter AW, Qurne M, Francis PT. Neurochemical features of fronto-temporal dementia. Dement Geriatr Cogn Disord. 1999;10(Suppl. 1):80–84.
58. Reisberg B, Doody R, Stoffler A et al. Memantine in moderate-to-severe Alzheimer’s disease. N Engl J Med. 2003;348:1333–1341.
59. Rogawski MA, Wenk GL. The neuropharmacological basis for the use of memantine in the treatment of Alzheimer's disease. CNS Drug Rev. 2003;9(3):275-308.
60. Santos MA, Chand K, Chaves S. Recent progress in multifunctional metal chelators as potential drugs for Alzheimer’s disease. Coord. Chem. Rev. 2016;327–328:287–303.
61. Schachter AS, Davis KL. Alzheimer's disease. Dialogues Clin Neurosci. 2000;2(2):91-100.
62. Stahl SM. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. Cambridge university press, 2013. 626 p. ISBN 978-1107686465.
63. Suzuki H, Inoue Y, Nishiyama A et al. Clinical efficacy and changes in the dosages of concomitantly used psychotropic drugs in memantine therapy in Alzheimer’s disease with behavioral and psychological symptoms on dementia. Ther Adv Psychopharmacol.2013;3:123–128.
64. Swanberg MM. Memantine for behavioral disturbances in frontotemporal dementia: A case series. Alzheimer Dis Assoc Disord. 2007;21:164–166.
65. Takahashi H, Xia P, Cui J et al. Pharmacologically targeted NMDA receptor antagonism by NitroMemantine for cerebrovascular disease. Sci. Rep. 2015;5:14781. doi: 10.1038/srep14781.
66. Talantova M., Sanz-Blasco S., Zhang, Xia P et al. Aβ induces astrocytic glutamate release, extrasynaptic NMDA receptor activation, and synaptic loss. Proc Natl Acad Sci U S A. 2013;110:E2518–E2527.
67. Tan CC, Yu JT, Wang HF et al. Efficacy and safety of donepezil, galantamine, rivastigmine, and memantine for the treatment of Alzheimer’s disease: A systematic review and meta-analysis. J Alzheimers Dis. 2014;41:615–631.
68. Tariot PN, Farlow MR, Grossberg GT et al. Memantine treatment in patients with moderate to severe Alzheimer disease already receiving donepezil: A randomized controlled trial. JAMA.2004;291:317–324.
69. Thakur TK, Albanese E, Giannakopoulos P et al. In: Neurological disorders. Mental, Neurological, and Substance Use Disorders: Disease Control Priorities. 3rd ed. Patel V, Chisholm D, Dua T, Laxminarayan R, Medina M, editors. The International Bank for Reconstruction and Development/The World Bank; Washington, DC, USA: 2016.
70. Thomas SJ, Grossberg GT. Memantine: a review of studies into its safety and efficacy in treating Alzheimer's disease and other dementias. Clin Interv Aging. 2009;4:367.
71. Tomimoto H. [Subcortical vascular dementia: significance in the differential diagnosis of dementia]. [Article in Japanese]. Rinsho Shinkeigaku. 2011;51(11):940-2.
72. Tricco AC, Ashoor HM, Soobiah C et al. Comparative effectiveness and safety of cognitive enhancers for treating Alzheimer’s disease: systematic review and network metaanalysis. J Am Geriatr Soc. 2018;66:
170-178.
73. Tu S, Okamoto S, Lipton SA, Xu H. Oligomeric Aβ-induced synaptic dysfunction in Alzheimer’s disease. Mol. Neurodegener. 2014;9:48.
74. Uwagbai O, Kalish VB. StatPearls [Internet]. StatPearls Publishing; Treasure Island (FL): Mar 24, 2020. Vascular Dementia.
75. Vaci N, Koychev I, Kim CH. Real-world effectiveness, its predictors and onset of action of cholinesterase inhibitors and memantine in dementia: retrospective health record study. Br J Psychiatry. 2020;1-7.
76. Wilcock G, Mobius HJ, Stoffler A. A double-blind, placebo-controlled multicentre study of memantine in mild to moderate vascular dementia (MMM500) Int Clin Psychopharmacol. 2002;17(6):297–305.
77. Wilcock GK, Ballard CG, Cooper JA et al. Memantine for agitation/aggression and psychosis in moderately severe to severe Alzheimer’s disease: A pooled analysis of 3 studies. J Clin Psychiatry. 2008;69:341–348.
78. Wong KH, Riaz MK, Xie Y et al. Review of Current Strategies for Delivering Alzheimer's Disease Drugs across the Blood-Brain Barrier. Int J Mol Sci. 2019;20(2).
79. Xia P, Chen HS, Zhang D, Lipton SA. Memantine preferentially blocks extrasynaptic over synaptic NMDA receptor currents in hippocampal autapses. J. Neurosci. 2010;30:11246–11250.
80. Young JJ, Lavakumar M, Tampi D et al. Frontotemporal dementia: latest evidence and clinical implications. Ther Adv Psychopharmacol. 2018;8(1):33-48.
81. Yue A, Han X, Mao E et al. The effect of scalp electroacupuncture combined with Memantine in patients with vascular dementia: A retrospective study. Medicine (Baltimore). 2020;99(33):e21242.
82. Zhang N, Wei C, Du H et al. The effect of memantine on cognitive function and behavioral and psychological symptoms in mild-to-moderate Alzheimer’s disease patients. Dement Geriatr Cogn Disord. 2015;40:85–93.
83. EudraCT No.: 2013-003408-38 - Bioequivalence study on memantine preparations TINGREKS 10 mg film-coated tablets (JSC Grindeks, Latvia) versus Ebixa 10 mg film-coated tablets (H. Lundbeck A/S, Denmark) in healthy volunteers under fasting conditions, 2013.
28 мая 2021
Количество просмотров: 1894


