Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
1Department of Psychiatry and Addictive Disorders, Riga University Stradynia, Riga, Latvia;
2medical department of Gedeon Richter OJSC, Budapest, Hungary, and representative office of Gedeon Richter OJSC in Latvia, Marupe, Latvia.
For citation: E. Rancans, Z. Borbála Dombi, P. Mátrai, Á. Barabássy, B. Sebe, I. Skrivelec и G. Németh. The efficacy and safety of cariprazine for the treatment of schizophrenia with negative symptoms with insufficient effectiveness of the previous antipsychotic therapy: observational research (extended abstract). Psychiatry and psychopharmacotherapy. 2021; 2: 42–29.
Негативные симптомы гетерогенны и существенно отличаются не только этиологией, но и ответом на то или иное вмешательство (Galderisi et al., 2017; Galderisi et al., 2018). Например, вторичные негативные симптомы могут быть следствием позитивных симптомов, депрессии или двигательных расстройств и, следовательно, не относятся к первичным проявлениям основной симптоматики (Galderisi et al., 2017; Kirschner et al., 2017; Galderisi et al., 2018). Сходным образом, когнитивные нарушения взаимосвязаны с негативными симптомами и усугубляются при наличии последних (Luther et al., 2020). Такая гетерогенность делает затруднительным не только лечение (Stahl and Buckley, 2007; Galderisi et al., 2018), но и оценку негативных симптомов (Marder et al., 2013; Galderisi et al., 2018). Galderisi и соавт. (2018) в недавнем обзоре подтвердили, что, несмотря на совершенствование инструментов оценки негативных симптомов (Daniel, 2013), подобные шкалы используются преимущественно в исследованиях и вызывают серьезные сложности в повседневной клинической практике. Что касается диагностики и лечения шизофрении, только 6,5% врачей используют клинические шкалы в ежедневной работе (Gilbody et al., 2002). В частности, многие клиницисты считают стандартизированные оценки трудновыполнимыми, клинически нецелесообразными и ресурсоемкими, особенно с точки зрения администрирования (Gilbody et al., 2002; Zimmerman and McGlinchey, 2008).
Карипразин представляет собой нейролептик третьего поколения, который недавно был зарегистрирован для лечения шизофрении (Németh et al., 2017; Krause et al., 2018; Cerveri et al., 2019). Он отличается от других антипсихотических препаратов тем, что его аффинность к дофаминовым D3-рецепторам in vitro в 10 раз превышает аффинность к D2-рецепторам (Kiss et al., 2010). Кроме того, он обладает высокой и сбалансированной активностью в отношении D3- и D2-рецепторов in vivo (Slifstein et al., 2013). Результаты краткосрочных и долгосрочных двойных слепых плацебо-контролируемых исследований подтвердили гипотезу о том, что карипразин — безопасное и эффективное средство лечения шизофрении (Durgam et al., 2014, 2015, 2016; Kane et al., 2015). В отличие от других современных нейролептиков, карипразин характеризуется высокой эффективностью при лечении пациентов с преобладающими негативными симптомами (Németh et al., 2017; Earley et al., 2019). В ходе рандомизированного двойного слепого исследования Németh и соавт. (2017) отметили, что изменение факторной оценки негативных симптомов по шкале позитивных и негативных синдромов (PANSS-FSNS) через 26 недель относительно исходного показателя было более выраженным при применении каприпразина, чем при применении рисперидона (Németh et al., 2017).
Рандомизированные контролируемые исследования (РКИ) считаются «золотым стандартом» клинических исследований благодаря возможности получения высококачественных данных по эффективности, однако существует настоятельная необходимость проведения исследований по оценке эффективности и характеристик фармацевтических субстанций в условиях повседневной клинической практики (Malm et al., 2009). Наблюдательные исследования позволяют получить важную информацию о безопасности, эффективности и надлежащем применении лекарственных препаратов в рутинной практике врача (Van Vollenhoven and Severens, 2011). Несмотря на то что исследования этого типа считаются в целом менее качественными вследствие неконтролируемого характера и систематической ошибки отбора, важно отметить, что их основная задача состоит не в доказательстве эффективности препарата, а в получении дополнительных данных об эффективности в повседневной клинической практике уже после того, как эффективность была установлена (Dreyer et al., 2010; Van Vollenhoven and Severens, 2011). Таким образом, цель настоящего исследования заключалась в определении эффективности и безопасности карипразина вне клинических исследований.
Это открытое наблюдательное исследование по оценке применения карипразина длительностью 16 недель с гибким подбором доз было проведено в девяти психиатрических больницах Латвии и включало 116 амбулаторных пациентов.
6 баллов (не наблюдается; минимальная степень; легкая степень; средняя степень; среднетяжелая степень; тяжелая степень; крайне тяжелая степень). Подобная система оценивания применяется и в краткой шкале оценки негативных симптомов (BNSS) (Kirkpatrick et al., 2011).
В основе опросника SAND лежит пятифакторная модель негативных симптомов шизофрении (Ahmed et al., 2019).
В отличие от других валидированных инструментов, применение которых занимает от 15 до 40 минут (Daniel, 2013), SAND — простой и быстрый метод анализа негативных симптомов, облегчающий диагностику и последующее наблюдение в повседневной клинической практике. Более того, он включает два наиболее значимых позитивных симптома (галлюцинации и бред), которые нередко обуславливают развитие негативных симптомов, вторичных по отношению к позитивным симптомам (Galderisi et al., 2018). Несмотря на то что опросник SAND не валидирован, его можно рассматривать как модифицированную и комбинированную версию двух валидированных инструментов оценки — шкал BNSS и CGI-SCH (Haro, Kamath et al., 2003). В последней, как и в опроснике SAND, тяжесть симптомов оценивается по семибалльной шкале (Haro, Kamath et al., 2003). Важно отметить, что шкала CGI-SCH широко используется во всем мире при проведении крупномасштабных исследований в условиях повседневной клинической практики (Haro et al., 2003; Suarez and Haro, 2008; Karagianis et al., 2009).
Дополнительные конечные точки включали оценки улучшения состояния и степени тяжести по шкале общего клинического впечатления — CGI-I и CGI-S соответственно (Guy, 1976).
Помимо спонтанных сообщений о нежелательных явлениях, при оценке безопасности особое внимание уделяли экстрапирамидным побочным эффектам, таким как острая дистония, паркинсонизм, акатизия и поздняя дискинезия, а также изменениям массы тела. Все указанные явления оценивали проспективно в ходе клинических интервью, для чего использовали 5-балльную шкалу Лайкерта с оценками от «отсутствия симптома» до «тяжелой степени».
Измерения проводили на 0, 2, 6, 10 и 16-й неделях и/или в день досрочного выбывания из исследования. Оценки по опроснику SAND и шкалам CGI-I и CGI-S проводил тот же дипломированный психиатр, который оценивал состояние пациента при включении в исследование.
В конце исследования психиатрам предлагали оценить общее впечатление об эффективности и переносимости терапии по пятибалльной шкале Лайкерта (полностью удовлетворен; удовлетворен; отношусь нейтрально; не удовлетворен; крайне не удовлетворен).
Средние изменения показателей эффективности относительно исходного уровня на всех визитах анализировали в модели со смешанными эффектами для повторных измерений. Изменения относительно исходного уровня, наблюдаемые на последнем визите, указывали как скорректированные средние значения, рассчитанные методом наименьших квадратов. Для оценки изменений на последнем визите относительно исходного уровня дополнительно выполняли дисперсионный анализ (ANOVA) с подстановкой отсутствующих значений методом переноса вперед данных последнего наблюдения (LOCF). Эту процедуру использовали в качестве анализа чувствительности.
Перед проведением анализа зарегистрированные нежелательные явления кодировали по предпочтительному термину согласно MedDRA (версия 23.0). Самые частые нежелательные явления (наблюдаемые с частотой >2%) указывали для исходного визита (ранее диагностированные нежелательные явления) и последнего визита. Дополнительно систематизировали данные о самых частых (>2%) нежелательных явлениях, возникших во время лечения (НЯВЛ, которые отсутствовали на исходном визите, но отмечались на любом последующем визите, или нежелательные явления, которые наблюдались на исходном визите, но стали более выраженными на любом последующем визите).
Сопутствующие лекарственные препараты, которые пациенты принимали в течение 1 месяца до начала и во время исследования, кодировали при помощи справочника лекарственных препаратов ВОЗ (версия WHO Drug Global от 1 марта 2020 г.) и подразделяли на следующие категории: антидепрессанты, нейролептики, бензодиазепины, препараты для лечения экстрапирамидных симптомов (ЭПС), нормотимики, снотворные или другие.
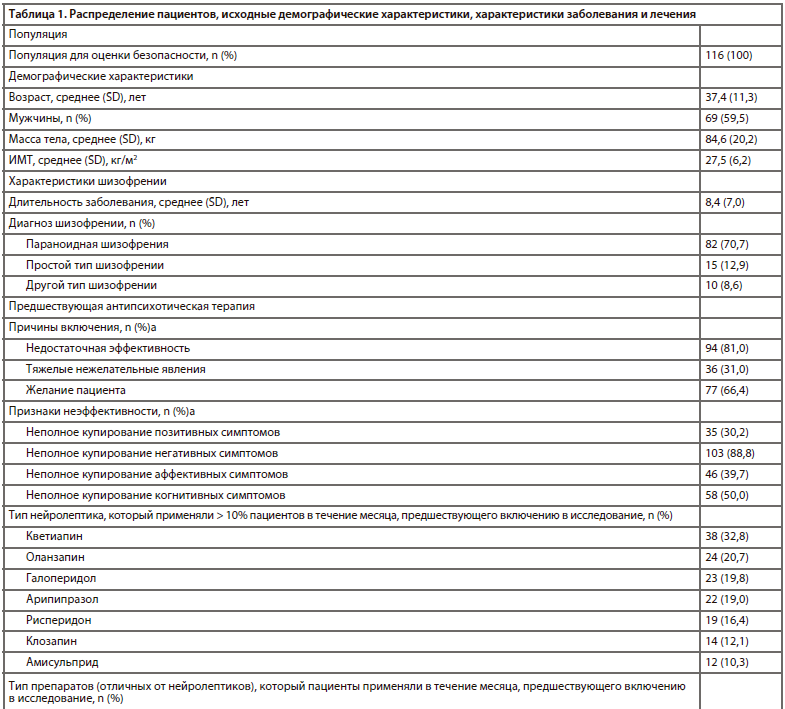
В общей сложности в исследование были включены 116 пациентов. Данные об их распределении, исходных демографических характеристиках и характеристиках заболевания представлены в таблице 1. Средний возраст пациентов составлял приблизительно 37 лет; более половины (60%) участников были мужчинами. У 71% пациентов была диагностирована параноидная шизофрения (код по МКБ-10: F20.0), у 13% — простой тип шизофрении (код по МКБ-10: F20.6), и у 9% — другой тип шизофрении (код по МКБ-10: F20.8). Приблизительно 83% пациентов завершили программу исследования. Наиболее частыми причинами досрочного выбывания были отзыв согласия на участие (50%) и развитие НЯВЛ (45%). Необходимо отметить, что большинство случаев досрочного выбывания наблюдалось на раннем этапе исследования, то есть пациенты с удовлетворительным начальным ответом на лечение карипразином продолжали участие в исследовании.
Сведения о предшествующей антипсихотической терапии и лечении карипразином также указаны в таблице 1. Самой частой причиной включения в исследование была недостаточная эффективность предшествующей антипсихотической терапии, которая наблюдалась у 81% пациентов. В основном такая неэффективность была обусловлена негативными симптомами (89%), когнитивными нарушениями (50%) и аффективными симптомами (40%). К нейролептикам, которые пациенты чаще всего принимали в течение 1 месяца до включения в исследование, относились кветиапин (33%), оланзапин (21%), галоперидол (20%) и арипипразол (19%). Смена терапии преимущественно осуществлялась методом перекрестного титрования (61%). Применение большинства предшествующих нейролептиков было прекращено ко 2-й неделе. Помимо нейролептиков, в течение месяца до включения в исследование около половины пациентов принимали препараты для лечения ЭПС (49%), антидепрессанты (40%) или бензодиазепины (28%). Большинство пациентов (87%) начали лечение карипразином в дозе 1,5 мг/сут, однако в некоторых случаях начальная доза составляла 3,0, 4,5 или даже 6,0 мг/сут. Чаще всего при завершении исследования использовались дозы 6,0 (30%) и 4,5 мг (28%), а также 3,0 мг (28%).

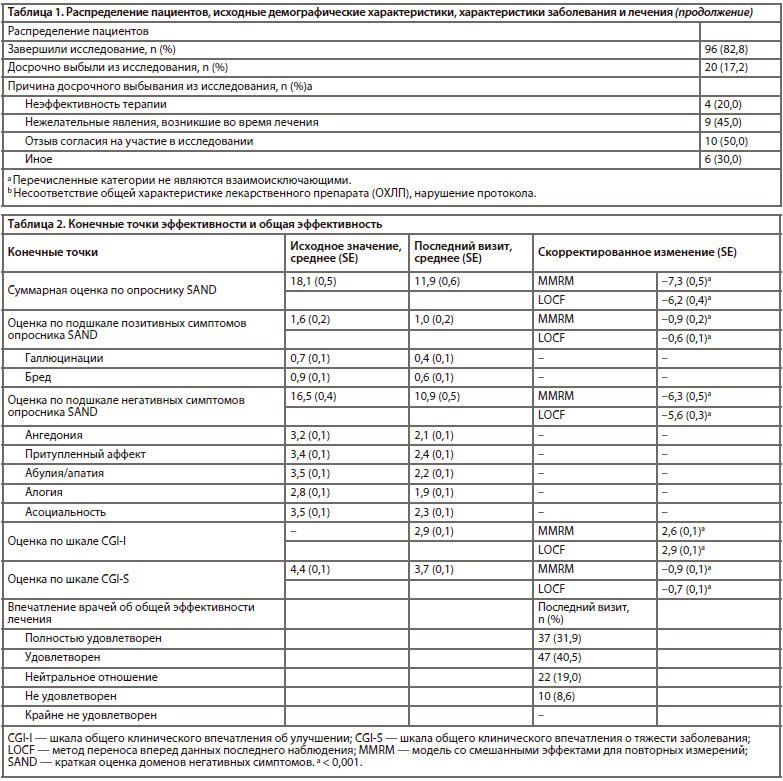
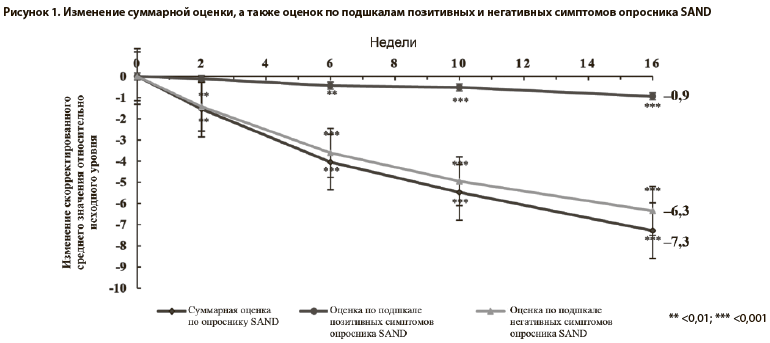
Было обнаружено статистически значимое улучшение оценки по шкале CGI-I — скорректированное среднее значение на последнем визите составило 2,6 (95% ДИ: 2,4–2,8; p<0,001), указывая на то, что у пациентов в среднем отмечалось минимальное/выраженное улучшение (таблица 2). Так, на последнем визите выраженное улучшение было выявлено у 38% пациентов, минимальное улучшение — у 35% пациентов, и отсутствие улучшения — у 11% пациентов (таблица 3).
Средняя исходная оценка по шкале CGI-S составила 4,4 балла, свидетельствуя о том, что в исследуемой популяции заболевание было умеренно выраженным. На последнем визите наблюдалось статистически значимое изменение оценок по шкале CGI-S на −0,9 балла (95% ДИ: от −1,0 до −0,7; p<0,001) (таблица 2). Это подтверждает общее снижение тяжести заболевания с выраженного/умеренно выраженного до умеренно выраженного/слабовыраженного. На последнем визите у 36% пациентов заболевание носило умеренно выраженный характер (по сравнению с 45% на первом визите), у 35% — слабовыраженный характер (по сравнению с 11% на первом визите), и у 10% — пограничный характер (по сравнению с 0% на первом визите) (таблица 3).
Общее впечатление об эффективности лечения карипразином соответствовало оценкам «удовлетворен» (41% психиатров) и «полностью удовлетворен» (32% психиатров [22 врача]; таблица 2).
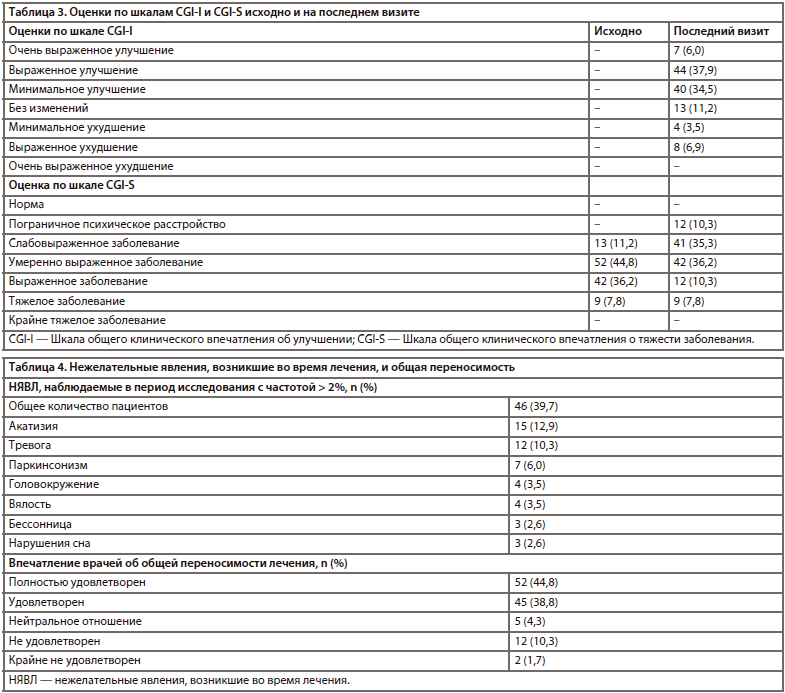
Результаты анализа безопасности карипразина на основе объединенных данных краткосрочных и долгосрочных рандомизированных клинических исследований уже опубликованы в научной литературе (Earley et al., 2017; Nasrallah et al., 2017). Следует отметить, что в настоящем исследовании был установлен аналогичный профиль безопасности; более 80% врачей были «удовлетворены» или «полностью удовлетворены» переносимостью карипразина. Это объясняется тем, что, несмотря на развитие некоторых НЯВЛ в период исследования, их количество и степень тяжести были ниже, чем при приеме предшествующих нейролептиков. Наконец, число пациентов, отказавшихся от приема сопутствующих препаратов, было больше, чем число пациентов, начавших их принимать. Следовательно, потребность в лекарственных средствах для лечения ЭПС, нормотимиках и бензодиазепинах во время лечения карипразином уменьшилась.
Результаты этого исследования дополнительно подтверждают представление о карипразине как об эффективном и безопасном препарате для лечения шизофрении с негативными симптомами (Németh et al., 2017; Fleischhacker et al., 2019). На протяжении 16 недель лечения отмечалось статистически значимое снижение тяжести не только негативных симптомов, но и галлюцинаций и бредовых идей, которые зачастую служат причиной развития вторичных негативных симптомов (Galderisi et al., 2017; Kirschner et al., 2017; Galderisi et al., 2018). Помимо эффективности, карипразин характеризовался определенными преимуществами с точки зрения безопасности, поскольку около трети пациентов были включены в исследование в связи с тяжелыми нежелательными явлениями, вызванными приемом предшествующего нейролептика; однако только 8% участников прекратили применение карипразина по той же причине. Кроме того, необходимо отметить, что результаты были получены в условиях повседневной клинической практики, и хотя они не исключают возможности систематической ошибки, но обладают более высокой внешней валидностью, чем результаты РКИ (Cohen et al., 2015).
Настоящее исследование трудно сопоставить с данными научной литературы, так как до сих пор не было проведено ни одного наблюдательного исследования по оценке применения карипразина у пациентов с негативными симптомами. Тем не менее результаты настоящего исследования во многом согласуются с данными двойного слепого рандомизированного сравнительного исследования с применением карипразина (Németh et al., 2017). Благодаря сходству критериев включения в двух исследованиях (пациенты с шизофренией в возрасте 18 лет и старше с преобладающими негативными симптомами и слабовыраженными позитивными симптомами), исходные характеристики исследуемых популяций можно считать сопоставимыми. К сожалению, конечные точки исследований различаются, поэтому возможно сравнение только тех данных, которые были получены с помощью шкал CGI-S и CGI-I. Так, к концу периода лечения в исследовании Németh (26-я неделя) средняя оценка по шкале CGI-I составляла 2,5 балла (Németh et al., 2017). Сходным образом, тот же показатель на 16-й неделе данного исследования равнялся 2,5 балла. Исходные оценки по шкале CGI-S незначительно отличались; тем не менее средние изменения относительно исходного уровня были аналогичны: −0,9 балла на 16-й неделе настоящего исследования и −0,95 балла на 26-й неделе исследования (Németh et al., 2017). Таким образом, можно заключить, что результаты, полученные в условиях повседневной клинической практики, согласуются с данными РКИ.
В то же время следует признать, что представленное исследование имеет ограничения. Во-первых, учитывая дизайн исследования (наблюдательный), результаты необходимо интерпретировать с осторожностью, поскольку для подобных исследований характерна ограниченная внутренняя валидность, связанная с вероятной систематической ошибкой отбора или информационной ошибкой (Cohen et al., 2015). Внутренняя валидность важна при определении эффективности. Иными словами, она подтверждает, что наблюдаемые эффекты обусловлены лечением, а не другими факторами (Cohen et al., 2015). Однако цель настоящего исследования заключалась не в доказательстве эффективности, которую можно установить в РКИ, а в определении истинных преимуществ для пациентов в условиях рутинной клинической практики (Cohen et al., 2015). В действительности настоящее исследование позволило частично воспроизвести результаты исследования Németh и, таким образом, доказать их распространимость на другие популяции пациентов. Во-вторых, первичная конечная точка (оценка по опроснику SAND) не валидирована. Учитывая ограниченность объективных методов обследования в психиатрии (например, МРТ), очень важно использовать надежные и валидированные опросники, которые обеспечивают объективность и сопоставимость данных с другими исследованиями (Bolarinwa, 2015). Однако зачастую использование стандартизированных опросников в условиях клинической практики невозможно (Gilbody et al., 2002; Zimmerman and McGlinchey, 2008). Учитывая вышесказанное, для имитации оценки изменений негативных симптомов в условиях повседневной клинической практики был разработан краткий опросник SAND, основу которого составляет пятифакторная модель негативных симптомов шизофрении (Kirkpatrick et al., 2006). Несмотря на то что опросник не валидирован, он имеет большое сходство с другими стандартизированными инструментами, такими как BNSS, CGI-SCH и PANSS-FSNS. Третье ограничение заключается в применении сопутствующей терапии (например, антидепрессантов) на протяжении всего периода исследования, что повышает риск влияния вмешивающихся факторов на результаты (Viswanathan et al., 2013). Тем не менее применение других лекарственных препаратов при лечении шизофрении широко распространено в клинической практике (Correll et al., 2017), и в ходе настоящего исследования статистически значимых изменений сопутствующей терапии не наблюдалось. Напротив, пациенты чаще отказывались от приема таких препаратов. Наконец, что касается позитивных симптомов, исходные показатели приближались к минимуму. Иными словами, оценки в большей степени соответствовали нижнему краю шкалы, что ограничивает возможность оценки результатов.
Для данной статьи доступно вспомогательное цифровое приложение. В печатной статье содержатся прямые ссылки, которые также представлены в HTML- и PDF-версиях данной статьи, опубликованных на вебсайте журнала (www.intclinpsychopharm.com).
Эта статья находится в открытом доступе и распространяется в соответствии с условиями лицензии Creative Commons Attribution-Non Commercial-No Derivatives 4.0 (с указанием авторства, некоммерческая, без производных) (CCBY- NC-ND), которая допускает скачивание и распространение при условии надлежащего указания авторства. Документ не может подвергаться каким-либо изменениям или использоваться в коммерческих целях без разрешения журнала.
0268-1315 © Коллектив авторов, 2021 Опубликовано издательством «Уолтерс Клувер Хелс Инк.» (Wolters Kluwer Health, Inc.)
DOI: 10.1097/YIC.0000000000000351
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2021
Эффективность и безопасность карипразина для лечения шизофрении с негативными симптомами при недостаточной эффективности предшествующей антипсихотической терапии: наблюдательное исследование (расширенный реферат) №02 2021
Номера страниц в выпуске:42-49
Для цитирования: E. Rancans, Z. Borbála Dombi, P. Mátrai, Á. Barabássy, B. Sebe, I. Skrivelec и G. Németh. Эффективность и безопасность карипразина для лечения шизофрении с негативными симптомами при недостаточной эффективности предшествующей антипсихотической терапии: наблюдательное исследование (расширенный реферат). Психиатрия и психофармакотерапия. 2021; 2: 42–49.
The efficacy and safety of cariprazine for the treatment of schizophrenia with negative symptoms with insufficient effectiveness of the previousantipsychotic therapy: observational research (extended abstract)
E. Rancans1, Z. Borbála Dombi2, P. Mátrai2, Á. Barabássy2, B. Sebeb, I. Skrivelec, G. Németh21Department of Psychiatry and Addictive Disorders, Riga University Stradynia, Riga, Latvia;
2medical department of Gedeon Richter OJSC, Budapest, Hungary, and representative office of Gedeon Richter OJSC in Latvia, Marupe, Latvia.
For citation: E. Rancans, Z. Borbála Dombi, P. Mátrai, Á. Barabássy, B. Sebe, I. Skrivelec и G. Németh. The efficacy and safety of cariprazine for the treatment of schizophrenia with negative symptoms with insufficient effectiveness of the previous antipsychotic therapy: observational research (extended abstract). Psychiatry and psychopharmacotherapy. 2021; 2: 42–29.
Введение
Шизофрения — это хроническое психотическое расстройство, которым страдают около 20 миллионов людей во всем мире (James et al., 2018). Заболевание характеризуется выраженными нарушениями мышления и восприятия, которые включают три домена симптомов: позитивные, негативные и когнитивные (WHO, 2015, 2016). Шизофрения преимущественно связана с развитием позитивных симптомов, которые играют важную роль в диагностике заболевания (Feighner et al., 1972; APA, 2013; WHO, 2016), однако негативные симптомы, такие как ангедония, абулия, асоциальность, алогия и притупленный аффект, считаются основной клинической дименсией шизофрении (Bleuler, 1950; Bucci and Galderisi, 2017). Нейролептики, составляющие первую линию терапии, нацелены преимущественно на купирование позитивных симптомов, поэтому лечение негативных симптомов остается важнейшей нерешенной задачей психиатрии, особенно в контексте полноценного восстановления пациента (Erhart et al., 2006; Stahl and Buckley, 2007). Недостаточная эффективность антипсихотической терапии в присутствии негативных симптомов неоднократно освещалась в клинических исследованиях и метаанализах (Leucht, Corves et al., 2009; Leucht, Komossa et al., 2009; Fusar-Poli et al., 2015; Iasevoli et al., 2018; Huhn et al., 2019).Негативные симптомы гетерогенны и существенно отличаются не только этиологией, но и ответом на то или иное вмешательство (Galderisi et al., 2017; Galderisi et al., 2018). Например, вторичные негативные симптомы могут быть следствием позитивных симптомов, депрессии или двигательных расстройств и, следовательно, не относятся к первичным проявлениям основной симптоматики (Galderisi et al., 2017; Kirschner et al., 2017; Galderisi et al., 2018). Сходным образом, когнитивные нарушения взаимосвязаны с негативными симптомами и усугубляются при наличии последних (Luther et al., 2020). Такая гетерогенность делает затруднительным не только лечение (Stahl and Buckley, 2007; Galderisi et al., 2018), но и оценку негативных симптомов (Marder et al., 2013; Galderisi et al., 2018). Galderisi и соавт. (2018) в недавнем обзоре подтвердили, что, несмотря на совершенствование инструментов оценки негативных симптомов (Daniel, 2013), подобные шкалы используются преимущественно в исследованиях и вызывают серьезные сложности в повседневной клинической практике. Что касается диагностики и лечения шизофрении, только 6,5% врачей используют клинические шкалы в ежедневной работе (Gilbody et al., 2002). В частности, многие клиницисты считают стандартизированные оценки трудновыполнимыми, клинически нецелесообразными и ресурсоемкими, особенно с точки зрения администрирования (Gilbody et al., 2002; Zimmerman and McGlinchey, 2008).
Карипразин представляет собой нейролептик третьего поколения, который недавно был зарегистрирован для лечения шизофрении (Németh et al., 2017; Krause et al., 2018; Cerveri et al., 2019). Он отличается от других антипсихотических препаратов тем, что его аффинность к дофаминовым D3-рецепторам in vitro в 10 раз превышает аффинность к D2-рецепторам (Kiss et al., 2010). Кроме того, он обладает высокой и сбалансированной активностью в отношении D3- и D2-рецепторов in vivo (Slifstein et al., 2013). Результаты краткосрочных и долгосрочных двойных слепых плацебо-контролируемых исследований подтвердили гипотезу о том, что карипразин — безопасное и эффективное средство лечения шизофрении (Durgam et al., 2014, 2015, 2016; Kane et al., 2015). В отличие от других современных нейролептиков, карипразин характеризуется высокой эффективностью при лечении пациентов с преобладающими негативными симптомами (Németh et al., 2017; Earley et al., 2019). В ходе рандомизированного двойного слепого исследования Németh и соавт. (2017) отметили, что изменение факторной оценки негативных симптомов по шкале позитивных и негативных синдромов (PANSS-FSNS) через 26 недель относительно исходного показателя было более выраженным при применении каприпразина, чем при применении рисперидона (Németh et al., 2017).
Рандомизированные контролируемые исследования (РКИ) считаются «золотым стандартом» клинических исследований благодаря возможности получения высококачественных данных по эффективности, однако существует настоятельная необходимость проведения исследований по оценке эффективности и характеристик фармацевтических субстанций в условиях повседневной клинической практики (Malm et al., 2009). Наблюдательные исследования позволяют получить важную информацию о безопасности, эффективности и надлежащем применении лекарственных препаратов в рутинной практике врача (Van Vollenhoven and Severens, 2011). Несмотря на то что исследования этого типа считаются в целом менее качественными вследствие неконтролируемого характера и систематической ошибки отбора, важно отметить, что их основная задача состоит не в доказательстве эффективности препарата, а в получении дополнительных данных об эффективности в повседневной клинической практике уже после того, как эффективность была установлена (Dreyer et al., 2010; Van Vollenhoven and Severens, 2011). Таким образом, цель настоящего исследования заключалась в определении эффективности и безопасности карипразина вне клинических исследований.
Методы
Дизайн и условия проведения исследованияЭто открытое наблюдательное исследование по оценке применения карипразина длительностью 16 недель с гибким подбором доз было проведено в девяти психиатрических больницах Латвии и включало 116 амбулаторных пациентов.
Этические аспекты
Протокол исследования был утвержден Этическим комитетом Рижского университета им. Страдыня (27 сентября 2018 г.; № 6-2/2). Государственное агентство лекарственных средств Республики Латвия опубликовало разрешение на своем официальном вебсайте (02 ноября 2018 г.). Все пациенты предоставили письменное согласие на участие в исследовании.Пациенты
К участию в исследовании допускались взрослые пациенты (в возрасте 18 лет и старше) при соблюдении следующих условий: диагноз шизофрении, установленный в соответствии с критериями международной классификации болезней 10-го пересмотра (МКБ-10); наличие негативных симптомов, подтвержденное клиническим заключением; как минимум слабовыраженное заболевание согласно оценкам по шкале общего клинического впечатления о тяжести заболевания (CGI-S); отсутствие предшествующей терапии карипразином. Кроме того, участвовать в исследовании могли только те пациенты, у которых предшествующая антипсихотическая терапия, нацеленная на лечение различных симптомов, была недостаточно эффективной, либо наблюдались побочные эффекты такой терапии и/или стремление сменить лекарственный препарат. При подтвержденном синдроме зависимости от бензодиазепинов или алкоголя, применении нейролептиков пролонгированного действия в течение предыдущих 42 дней, наличии серьезного и нестабильного соматического заболевания, беременности или несоответствии требованиям к применению карипразина, указанным в общей характеристике лекарственного препарата (ОХЛП), пациентов исключали из исследования.Лечение
Пациенты получали карипразин в соответствии с рекомендациями, изложенными в ОХЛП. Надлежащую дозу (1,5, 3, 4,5 или 6 мг) выбирали лечащие врачи на основании клинической оценки. В период перекрестного титрования допускался сопутствующий прием лекарственных средств, включая антипсихотические препараты. Данные о таких препаратах вносили в документацию. Прекращение приема карипразина разрешалось в любое время по просьбе пациента, а также при развитии серьезных нежелательных реакций, несоответствии требованиям ОХЛП и/или на основании клинически обоснованного решения.Исходы
Учитывая наблюдательный характер исследования, в качестве инструмента для анализа основной конечной точки была выбрана совокупность клинических вопросов на основе анамнеза с оценкой по семибалльной рейтинговой шкале, называемая «краткой оценкой доменов негативных симптомов» (SAND). Она разработана одним из авторов исследования (E. Rancans) и базируется на тех же принципах, что и шкала общего клинического впечатления для оценки шизофрении (CGI-SCH), которую использовали для анализа исходов в одном из крупнейших наблюдательных исследований SOHO (Schizophrenia Outpatient Health Outcome, «исходы у амбулаторных пациентов с шизофренией») (Haro, Edgell et al., 2003). Опросник SAND включает семь пунктов, два из которых предназначены для оценки позитивных симптомов (бреда и галлюцинаций) и пять — для оценки негативных симптомов (ангедонии, притупленного аффекта, абулии, алогии и асоциальности); см. дополнительную таблицу во вспомогательном цифровом приложении № 1, http://links.lww.com/ ICP/A81. Каждый пункт в опроснике SAND оценивается по шкале от 0 до6 баллов (не наблюдается; минимальная степень; легкая степень; средняя степень; среднетяжелая степень; тяжелая степень; крайне тяжелая степень). Подобная система оценивания применяется и в краткой шкале оценки негативных симптомов (BNSS) (Kirkpatrick et al., 2011).
В основе опросника SAND лежит пятифакторная модель негативных симптомов шизофрении (Ahmed et al., 2019).
В отличие от других валидированных инструментов, применение которых занимает от 15 до 40 минут (Daniel, 2013), SAND — простой и быстрый метод анализа негативных симптомов, облегчающий диагностику и последующее наблюдение в повседневной клинической практике. Более того, он включает два наиболее значимых позитивных симптома (галлюцинации и бред), которые нередко обуславливают развитие негативных симптомов, вторичных по отношению к позитивным симптомам (Galderisi et al., 2018). Несмотря на то что опросник SAND не валидирован, его можно рассматривать как модифицированную и комбинированную версию двух валидированных инструментов оценки — шкал BNSS и CGI-SCH (Haro, Kamath et al., 2003). В последней, как и в опроснике SAND, тяжесть симптомов оценивается по семибалльной шкале (Haro, Kamath et al., 2003). Важно отметить, что шкала CGI-SCH широко используется во всем мире при проведении крупномасштабных исследований в условиях повседневной клинической практики (Haro et al., 2003; Suarez and Haro, 2008; Karagianis et al., 2009).
Дополнительные конечные точки включали оценки улучшения состояния и степени тяжести по шкале общего клинического впечатления — CGI-I и CGI-S соответственно (Guy, 1976).
Помимо спонтанных сообщений о нежелательных явлениях, при оценке безопасности особое внимание уделяли экстрапирамидным побочным эффектам, таким как острая дистония, паркинсонизм, акатизия и поздняя дискинезия, а также изменениям массы тела. Все указанные явления оценивали проспективно в ходе клинических интервью, для чего использовали 5-балльную шкалу Лайкерта с оценками от «отсутствия симптома» до «тяжелой степени».
Измерения проводили на 0, 2, 6, 10 и 16-й неделях и/или в день досрочного выбывания из исследования. Оценки по опроснику SAND и шкалам CGI-I и CGI-S проводил тот же дипломированный психиатр, который оценивал состояние пациента при включении в исследование.
В конце исследования психиатрам предлагали оценить общее впечатление об эффективности и переносимости терапии по пятибалльной шкале Лайкерта (полностью удовлетворен; удовлетворен; отношусь нейтрально; не удовлетворен; крайне не удовлетворен).
Статистический анализ
Статистический анализ выполняли в полной выборке для анализа, включавшей всех пациентов, которые в период исследования приняли как минимум одну дозу карипразина. Исходные и демографические характеристики пациентов систематизировали описательно с использованием процентных показателей, средних значений и показателей стандартного отклонения или стандартных ошибок.Средние изменения показателей эффективности относительно исходного уровня на всех визитах анализировали в модели со смешанными эффектами для повторных измерений. Изменения относительно исходного уровня, наблюдаемые на последнем визите, указывали как скорректированные средние значения, рассчитанные методом наименьших квадратов. Для оценки изменений на последнем визите относительно исходного уровня дополнительно выполняли дисперсионный анализ (ANOVA) с подстановкой отсутствующих значений методом переноса вперед данных последнего наблюдения (LOCF). Эту процедуру использовали в качестве анализа чувствительности.
Перед проведением анализа зарегистрированные нежелательные явления кодировали по предпочтительному термину согласно MedDRA (версия 23.0). Самые частые нежелательные явления (наблюдаемые с частотой >2%) указывали для исходного визита (ранее диагностированные нежелательные явления) и последнего визита. Дополнительно систематизировали данные о самых частых (>2%) нежелательных явлениях, возникших во время лечения (НЯВЛ, которые отсутствовали на исходном визите, но отмечались на любом последующем визите, или нежелательные явления, которые наблюдались на исходном визите, но стали более выраженными на любом последующем визите).
Сопутствующие лекарственные препараты, которые пациенты принимали в течение 1 месяца до начала и во время исследования, кодировали при помощи справочника лекарственных препаратов ВОЗ (версия WHO Drug Global от 1 марта 2020 г.) и подразделяли на следующие категории: антидепрессанты, нейролептики, бензодиазепины, препараты для лечения экстрапирамидных симптомов (ЭПС), нормотимики, снотворные или другие.
Результаты
Характеристики пациентов и применяемого леченияВ общей сложности в исследование были включены 116 пациентов. Данные об их распределении, исходных демографических характеристиках и характеристиках заболевания представлены в таблице 1. Средний возраст пациентов составлял приблизительно 37 лет; более половины (60%) участников были мужчинами. У 71% пациентов была диагностирована параноидная шизофрения (код по МКБ-10: F20.0), у 13% — простой тип шизофрении (код по МКБ-10: F20.6), и у 9% — другой тип шизофрении (код по МКБ-10: F20.8). Приблизительно 83% пациентов завершили программу исследования. Наиболее частыми причинами досрочного выбывания были отзыв согласия на участие (50%) и развитие НЯВЛ (45%). Необходимо отметить, что большинство случаев досрочного выбывания наблюдалось на раннем этапе исследования, то есть пациенты с удовлетворительным начальным ответом на лечение карипразином продолжали участие в исследовании.
Сведения о предшествующей антипсихотической терапии и лечении карипразином также указаны в таблице 1. Самой частой причиной включения в исследование была недостаточная эффективность предшествующей антипсихотической терапии, которая наблюдалась у 81% пациентов. В основном такая неэффективность была обусловлена негативными симптомами (89%), когнитивными нарушениями (50%) и аффективными симптомами (40%). К нейролептикам, которые пациенты чаще всего принимали в течение 1 месяца до включения в исследование, относились кветиапин (33%), оланзапин (21%), галоперидол (20%) и арипипразол (19%). Смена терапии преимущественно осуществлялась методом перекрестного титрования (61%). Применение большинства предшествующих нейролептиков было прекращено ко 2-й неделе. Помимо нейролептиков, в течение месяца до включения в исследование около половины пациентов принимали препараты для лечения ЭПС (49%), антидепрессанты (40%) или бензодиазепины (28%). Большинство пациентов (87%) начали лечение карипразином в дозе 1,5 мг/сут, однако в некоторых случаях начальная доза составляла 3,0, 4,5 или даже 6,0 мг/сут. Чаще всего при завершении исследования использовались дозы 6,0 (30%) и 4,5 мг (28%), а также 3,0 мг (28%).



Анализ эффективности
Средняя исходная оценка по опроснику SAND равнялась 18,1 (из 42 баллов). Отмечалось существенное различие между оценкой по подшкале позитивных симптомов (1,6 из 12 баллов) и оценкой по подшкале негативных симптомов (16,5 из 30 баллов) (таблица 2). Изменение скорректированного среднего значения для общей оценки по опроснику SAND на последнем визите (16-я неделя или дата выбывания из исследования) относительно исходного уровня составляло −7,3 (95% ДИ: от −8,3 до −6,2; p<0,001); указанная величина была статистически значимой начиная со 2-й недели и далее (рисунок 1). При анализе оценок по подшкалам негативных и позитивных симптомов были выявлены статистически значимые изменения (последний визит: −6,3, 95% ДИ: от −7,3 до −5,4, p<0,001 и −0,9, 95% ДИ: от −1,2 до −0,6, p<0,001 соответственно), которые наблюдались начиная со 2-й и 6-й недели и далее. Устойчивость анализа первичной конечной точки подтверждалась результатами анализа чувствительности, который был выполнен для суммарной оценки по опроснику SAND с использованием метода LOCF (−6,2; p<0,001), а также для оценок по подшкалам негативных (−5,6; p< 0,001) и позитивных симптомов (−0,6; p<0,001).Было обнаружено статистически значимое улучшение оценки по шкале CGI-I — скорректированное среднее значение на последнем визите составило 2,6 (95% ДИ: 2,4–2,8; p<0,001), указывая на то, что у пациентов в среднем отмечалось минимальное/выраженное улучшение (таблица 2). Так, на последнем визите выраженное улучшение было выявлено у 38% пациентов, минимальное улучшение — у 35% пациентов, и отсутствие улучшения — у 11% пациентов (таблица 3).
Средняя исходная оценка по шкале CGI-S составила 4,4 балла, свидетельствуя о том, что в исследуемой популяции заболевание было умеренно выраженным. На последнем визите наблюдалось статистически значимое изменение оценок по шкале CGI-S на −0,9 балла (95% ДИ: от −1,0 до −0,7; p<0,001) (таблица 2). Это подтверждает общее снижение тяжести заболевания с выраженного/умеренно выраженного до умеренно выраженного/слабовыраженного. На последнем визите у 36% пациентов заболевание носило умеренно выраженный характер (по сравнению с 45% на первом визите), у 35% — слабовыраженный характер (по сравнению с 11% на первом визите), и у 10% — пограничный характер (по сравнению с 0% на первом визите) (таблица 3).
Общее впечатление об эффективности лечения карипразином соответствовало оценкам «удовлетворен» (41% психиатров) и «полностью удовлетворен» (32% психиатров [22 врача]; таблица 2).

Анализ безопасности
Сводные данные о нежелательных явлениях, а также впечатлении психиатров о переносимости карипразина представлены в таблице 4. На момент включения в исследование у 44% пациентов наблюдались ранее диагностированные нежелательные явления, связанные с предшествующей антипсихотической терапией (акатизия [23%], паркинсонизм [16%] и гиперпролактинемия [8%]). У 40% участников в период лечения карипразином развились НЯВЛ. Средняя масса тела исходно равнялась 84,6 кг (ИМТ 27,5); среднее различие между исходным значением и значением, наблюдаемым в конце исследования, составило –0,3 кг. Характеризуя общую переносимость лечения, 45% психиатров указали оценку «полностью удовлетворен» и 39% — «удовлетворен».
Сопутствующая терапия
В течение 1 месяца, предшествующего включению в исследование, наряду с нейролептиками 49% пациентов принимали препараты для лечения ЭПС, 40% — антидепрессанты, 28% — бензодиазепины и 20% — нормотимики (таблица 1). Напротив, на последнем визите число участников, применяющих сопутствующие препараты, снизилось (41% пациентов принимали препараты для лечения ЭПС, 36% — антидепрессанты, 28% — бензодиазепины, и 14% — нормотимики). Таким образом, во время лечения карипразином количество пациентов, нуждавшихся в сопутствующей терапии, уменьшилось. Фактически от применения препаратов для лечения ЭПС отказались 14% пациентов, от антидепрессантов и нормотимиков — 5%, и от бендодиазепинов — 3%. В то же время только 7% пациентов начали прием препаратов для лечения ЭПС, 5% — антидепрессантов и бензодиазепинов, и 2% — снотворных. Кроме того, важно отметить, что около половины пациентов продолжали принимать антипсихотические препараты вместе с карипразином, который применялся дополнительно к их предыдущему нейролептику.Обсуждение
Это исследование было первым наблюдательным исследованием по оценке эффективности и безопасности карипразина в условиях повседневной клинической практики. Полученные результаты свидетельствуют о том, что терапия карипразином сопровождалась статистически значимым улучшением состояния пациентов с шизофренией, которые ранее безуспешно лечились антипсихотическими препаратами. Статистически значимое благоприятное изменение суммарной оценки по опроснику SAND наблюдалось уже на второй неделе исследования. Аналогичное изменение оценок по подшкалам негативных и позитивных симптомов отмечалось начиная со 2-й и 6-й недель соответственно. Описываемое улучшение дополнительно подтверждается изменением средних оценок по шкалам CGI-I и CGI-S, которое составило 2,6 и 1 балл соответственно, указывая на то, что улучшение у пациентов носило минимальный либо выраженный характер, а тяжесть их состояния снизилась с умеренно выраженной до слабовыраженной. Поэтому неудивительно, что более 70% врачей были «удовлетворены» или «полностью удовлетворены» эффективностью карипразина.Результаты анализа безопасности карипразина на основе объединенных данных краткосрочных и долгосрочных рандомизированных клинических исследований уже опубликованы в научной литературе (Earley et al., 2017; Nasrallah et al., 2017). Следует отметить, что в настоящем исследовании был установлен аналогичный профиль безопасности; более 80% врачей были «удовлетворены» или «полностью удовлетворены» переносимостью карипразина. Это объясняется тем, что, несмотря на развитие некоторых НЯВЛ в период исследования, их количество и степень тяжести были ниже, чем при приеме предшествующих нейролептиков. Наконец, число пациентов, отказавшихся от приема сопутствующих препаратов, было больше, чем число пациентов, начавших их принимать. Следовательно, потребность в лекарственных средствах для лечения ЭПС, нормотимиках и бензодиазепинах во время лечения карипразином уменьшилась.
Результаты этого исследования дополнительно подтверждают представление о карипразине как об эффективном и безопасном препарате для лечения шизофрении с негативными симптомами (Németh et al., 2017; Fleischhacker et al., 2019). На протяжении 16 недель лечения отмечалось статистически значимое снижение тяжести не только негативных симптомов, но и галлюцинаций и бредовых идей, которые зачастую служат причиной развития вторичных негативных симптомов (Galderisi et al., 2017; Kirschner et al., 2017; Galderisi et al., 2018). Помимо эффективности, карипразин характеризовался определенными преимуществами с точки зрения безопасности, поскольку около трети пациентов были включены в исследование в связи с тяжелыми нежелательными явлениями, вызванными приемом предшествующего нейролептика; однако только 8% участников прекратили применение карипразина по той же причине. Кроме того, необходимо отметить, что результаты были получены в условиях повседневной клинической практики, и хотя они не исключают возможности систематической ошибки, но обладают более высокой внешней валидностью, чем результаты РКИ (Cohen et al., 2015).
Настоящее исследование трудно сопоставить с данными научной литературы, так как до сих пор не было проведено ни одного наблюдательного исследования по оценке применения карипразина у пациентов с негативными симптомами. Тем не менее результаты настоящего исследования во многом согласуются с данными двойного слепого рандомизированного сравнительного исследования с применением карипразина (Németh et al., 2017). Благодаря сходству критериев включения в двух исследованиях (пациенты с шизофренией в возрасте 18 лет и старше с преобладающими негативными симптомами и слабовыраженными позитивными симптомами), исходные характеристики исследуемых популяций можно считать сопоставимыми. К сожалению, конечные точки исследований различаются, поэтому возможно сравнение только тех данных, которые были получены с помощью шкал CGI-S и CGI-I. Так, к концу периода лечения в исследовании Németh (26-я неделя) средняя оценка по шкале CGI-I составляла 2,5 балла (Németh et al., 2017). Сходным образом, тот же показатель на 16-й неделе данного исследования равнялся 2,5 балла. Исходные оценки по шкале CGI-S незначительно отличались; тем не менее средние изменения относительно исходного уровня были аналогичны: −0,9 балла на 16-й неделе настоящего исследования и −0,95 балла на 26-й неделе исследования (Németh et al., 2017). Таким образом, можно заключить, что результаты, полученные в условиях повседневной клинической практики, согласуются с данными РКИ.
В то же время следует признать, что представленное исследование имеет ограничения. Во-первых, учитывая дизайн исследования (наблюдательный), результаты необходимо интерпретировать с осторожностью, поскольку для подобных исследований характерна ограниченная внутренняя валидность, связанная с вероятной систематической ошибкой отбора или информационной ошибкой (Cohen et al., 2015). Внутренняя валидность важна при определении эффективности. Иными словами, она подтверждает, что наблюдаемые эффекты обусловлены лечением, а не другими факторами (Cohen et al., 2015). Однако цель настоящего исследования заключалась не в доказательстве эффективности, которую можно установить в РКИ, а в определении истинных преимуществ для пациентов в условиях рутинной клинической практики (Cohen et al., 2015). В действительности настоящее исследование позволило частично воспроизвести результаты исследования Németh и, таким образом, доказать их распространимость на другие популяции пациентов. Во-вторых, первичная конечная точка (оценка по опроснику SAND) не валидирована. Учитывая ограниченность объективных методов обследования в психиатрии (например, МРТ), очень важно использовать надежные и валидированные опросники, которые обеспечивают объективность и сопоставимость данных с другими исследованиями (Bolarinwa, 2015). Однако зачастую использование стандартизированных опросников в условиях клинической практики невозможно (Gilbody et al., 2002; Zimmerman and McGlinchey, 2008). Учитывая вышесказанное, для имитации оценки изменений негативных симптомов в условиях повседневной клинической практики был разработан краткий опросник SAND, основу которого составляет пятифакторная модель негативных симптомов шизофрении (Kirkpatrick et al., 2006). Несмотря на то что опросник не валидирован, он имеет большое сходство с другими стандартизированными инструментами, такими как BNSS, CGI-SCH и PANSS-FSNS. Третье ограничение заключается в применении сопутствующей терапии (например, антидепрессантов) на протяжении всего периода исследования, что повышает риск влияния вмешивающихся факторов на результаты (Viswanathan et al., 2013). Тем не менее применение других лекарственных препаратов при лечении шизофрении широко распространено в клинической практике (Correll et al., 2017), и в ходе настоящего исследования статистически значимых изменений сопутствующей терапии не наблюдалось. Напротив, пациенты чаще отказывались от приема таких препаратов. Наконец, что касается позитивных симптомов, исходные показатели приближались к минимуму. Иными словами, оценки в большей степени соответствовали нижнему краю шкалы, что ограничивает возможность оценки результатов.
Заключение
Карипразин — это новый нейролептик с уникальным профилем аффинности к дофаминовым D3- и D2-рецепторам, который был разработан для лечения шизофрении и обладает особым свойством снижать тяжесть преобладающих негативных симптомов (Zimnisky et al., 2013; Németh et al., 2017). Цель настоящего наблюдательного исследования заключалась в изучении этого свойства в условиях реальной клинической практики в популяции пациентов с негативными симптомами, у которых предшествующая антипсихотическая терапия оказалась неэффективной. Результаты указывают на благоприятные исходы терапии карипразином: на протяжении периода лечения длительностью 16 недель тяжесть негативных симптомов статистически значимо снизилась. Важно, что результаты исследования согласуются с данными предыдущего РКИ (Németh et al., 2017) и подтверждают их применимость к условиям повседневной клинической практики. Дальнейшие исследования с использованием валидированных опросников должны быть сосредоточены на получении более обширных данных о применении препарата в психиатрических клиниках и изучении его влияния на качество жизни пациентов.Для данной статьи доступно вспомогательное цифровое приложение. В печатной статье содержатся прямые ссылки, которые также представлены в HTML- и PDF-версиях данной статьи, опубликованных на вебсайте журнала (www.intclinpsychopharm.com).
Эта статья находится в открытом доступе и распространяется в соответствии с условиями лицензии Creative Commons Attribution-Non Commercial-No Derivatives 4.0 (с указанием авторства, некоммерческая, без производных) (CCBY- NC-ND), которая допускает скачивание и распространение при условии надлежащего указания авторства. Документ не может подвергаться каким-либо изменениям или использоваться в коммерческих целях без разрешения журнала.
0268-1315 © Коллектив авторов, 2021 Опубликовано издательством «Уолтерс Клувер Хелс Инк.» (Wolters Kluwer Health, Inc.)
DOI: 10.1097/YIC.0000000000000351


