Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2022
Корректоры лекарственно-индуцированных экстрапирамидных расстройств в России, в современной клинической практике врача-психиатра. Вопросы прикладного практического применения №01 2022
Абстракт
Статья о настоящем положении дел с корректорами лекарственно-индуцированных экстрапирамидных расстройств в клинической практике врача-психиатра в России. Рассматриваются актуальные вопросы прикладного применения препаратов, их особенностей, тактик назначения.
Ключевые слова: корректоры ЭПР, корректоры НЛО, нейролепсия, акатизия, острая дистония, лекарственный паркинсонизм, злокачественный нейролептический синдром, ЗНС, поздняя дискинезия.
Для цитирования: К.А. Маслов. Корректоры лекарственно-индуцированных экстрапирамидных расстройств в России, в современной клинической практике врача-психиатра. Вопросы прикладного практического применения. Психиатрия и психофармакотерапия. 2022; 1: 26–32.
Статья о настоящем положении дел с корректорами лекарственно-индуцированных экстрапирамидных расстройств в клинической практике врача-психиатра в России. Рассматриваются актуальные вопросы прикладного применения препаратов, их особенностей, тактик назначения.
Ключевые слова: корректоры ЭПР, корректоры НЛО, нейролепсия, акатизия, острая дистония, лекарственный паркинсонизм, злокачественный нейролептический синдром, ЗНС, поздняя дискинезия.
Для цитирования: К.А. Маслов. Корректоры лекарственно-индуцированных экстрапирамидных расстройств в России, в современной клинической практике врача-психиатра. Вопросы прикладного практического применения. Психиатрия и психофармакотерапия. 2022; 1: 26–32.
Correctors of drug-induced extrapyramidal side effects in Russia, in modern clinical practice of the psychiatrist. Questions of applied practical application
K.A. Maslov
K.R. Evgrafov Mental Hospital. 440026, Russian Federation, Penza, ul. Lermontova, d. 28. skrembler@mail.ru
Abstract
An article on the current state of affairs with correctors of drug-induced extrapyramidal side effects in the clinical practice of a psychiatrist in Russia. Topical issues of the applied use of drugs, their characteristics, prescription tactics are considered.
Keywords: extrapyramidal side effects (EPSE) correctors, extrapyramidal symptoms (EPS) correctors, neurolepsy, akathisia, acute dystonia, drug-induced parkinsonism, neuroleptic malignant syndrome, NMS, tardive dyskinesia.
For citation: K.A. Maslov. Correctors of drug-induced extrapyramidal side effects in Russia, in modern clinical practice of the psychiatrist. Questions of applied practical application. Psychiatry and psychopharmacotherapy. 2022; 1: 26–32.
Введение
Экстрапирамидные симптомы (далее – ЭПС) (экстрапирамидная симптоматика, (экстрапирамидный синдром, экстрапирамидные расстройства) – комплекс двигательных нарушений, возникающих в результате нарушения функции, преимущественно базальных ганглиев. Корректоры лекарственно-индуцированных ЭПС (далее – корректоры) (в различных источниках – корректоры экстрапирамидных побочных эффектов, корректоры нейролепсии, корректоры нейролептиков, корректоры побочных действий нейролептиков, корректоры нейролептической терапии, корректоры нейролептических нарушений/ осложнений/расстройств, корректоры экстрапирамидных нарушений/осложнений/расстройств, корректоры экстрапирамидных нейролептических синдромов, корректоры экстрапирамидных нейролептических осложнений и др.) – группа препаратов, которая применяется для коррекции лекарственно-индуцированных (вызванных чаще всего антипсихотическими препаратами) двигательных расстройств. Указанные двигательные расстройства являются вторичными, поскольку обусловлены побочным действием лекарственных препаратов [1], в настоящей статье будут рассматриваться лишь вторичные расстройства (преимущественно обусловленные применением антипсихотиков). Согласно международной (рекомендованной Всемирной организацией здравоохранения, далее – ВОЗ) анатомо-терапевтическо-химической классификации (далее – АТХ), отдельной группы таких препаратов, как «корректоры лекраственно-индуцированных экстрапирамидных расстройств», не выделяют, прежде всего к ним относят антихолинергические препараты (которые относятся к группе АТХ – N04 Противопаркинсонические препараты), такие как тригексифенидил, бипериден и амантадин, однако в этих же целях могут использоваться и препараты других групп (бензодиазепиновые транквилизаторы, бета-адреноблокаторы, антигистаминные средства, дофаминстимуляторы и др.). Многие корректоры из группы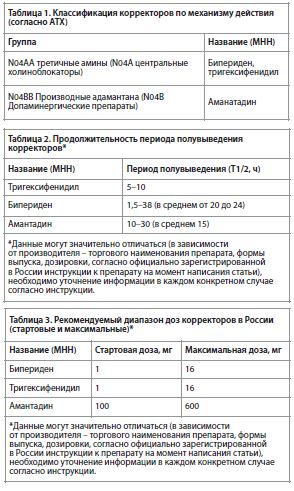 противопаркинсонических препаратов, широко применяющиеся в других странах, в настоящее время в России не зарегистрированы (например, проциклидин, профенамин, бенактизин, орфенадрин и др.) [2].
противопаркинсонических препаратов, широко применяющиеся в других странах, в настоящее время в России не зарегистрированы (например, проциклидин, профенамин, бенактизин, орфенадрин и др.) [2].
Механизм действия противопаркинсонических препаратов заключается в центральном и периферическом холиноблокирующем действии (бипериден, тригексифенидил) и повышении внеклеточной концентрации дофамина, посредством как интенсификации его выработки, так и блокады обратного захвата допамина пресинаптическими нейронами (амантадин). Препараты других химических групп, несмотря на основные различные механизмы действия, все же имеют общее (как прямое, так и опосредованное) воздействие как на дофаминопередачу, так и на холиноблокаду [2].
Краткая история корректоров
Как противопаркинсонические препараты корректоры широко стали использоваться в мировой клинической практике почти параллельно с антипсихотиками: тригексифенидил с 1951 года, бипериден с 1953, амантадин (как противопаркинсонический препарат) с 1973 года. Классификации корректоров
Существует несколько классификаций корректоров, которые представлены в ряде указанных ниже таблиц.
Классификация по механизму действия (согласно АТХ) [3] (из зарегистрированных в настоящее время в России) представлена в табл. 1. Необходимо также отметить важный фармакокинетический параметр корректоров – продолжительность действия (период полувыведения препарата и его активных метаболитов) [2], который представлен в табл. 2.
Диапазон доз корректоров (разрешенный к применению в России в настоящее время) представлен в табл. 3.
Лекарственно-индуцированные ЭПС Развитие лекарственно-индуцированной экстрапирамидной симптоматики наблюдается вследствие блокады дофаминергической нейропередачи в нигростриальной системе [1, 4].
Механизм действия антихолинергических корректоров на экстрапирамидную симптоматику обусловлен преимущественно блокадой центральных ацетилхолиновых рецепторов [5]. Поскольку дофамин замедляет высвобождение ацетилхолина в нигростриальном пути, применение большинства антипсихотиков, блокирующих дофаминовую передачу, влечет за собой увеличение высвобождения ацетилхолина в нигростриальном пути, что нарушает баланс ацетилхолина и дофамина и является причиной развития экстрапирамидных расстройств. Развитие лекарственно-индуцированных ЭПС связано с блокадой дофаминовых рецепторов в нигростриальном пути головного мозга (и в меньшей степени в
 мезокортикальном и мезолимбическом) [6], собственно говоря, главное отличие между первым и вторым поколением антипсихотиков (типичными и атипичными) проходит по
мезокортикальном и мезолимбическом) [6], собственно говоря, главное отличие между первым и вторым поколением антипсихотиков (типичными и атипичными) проходит по  вероятности вызывать указанные эффекты [7]. Антипсихотики второго и последующих поколений обладают избирательным действием на мезолимбический и мезокортикальный пути головного мозга и менее выраженным влиянием на нигростриальный, а также они обладают свойством блокады 5НТ2-рецепторов, которая вызывает компенсаторное повышение концентрации дофамина в нигростриальном пути и уменьшает выраженность ЭПС [8].
вероятности вызывать указанные эффекты [7]. Антипсихотики второго и последующих поколений обладают избирательным действием на мезолимбический и мезокортикальный пути головного мозга и менее выраженным влиянием на нигростриальный, а также они обладают свойством блокады 5НТ2-рецепторов, которая вызывает компенсаторное повышение концентрации дофамина в нигростриальном пути и уменьшает выраженность ЭПС [8].
 Часто лекарственно-индуцированные ЭПС могут ошибочно расцениваться как психотические проявления [9-13], [14].
Часто лекарственно-индуцированные ЭПС могут ошибочно расцениваться как психотические проявления [9-13], [14].
Существует несколько классификаций лекарственно-индуцированных ЭПС, которые представлены в ряде указанных ниже таблиц.
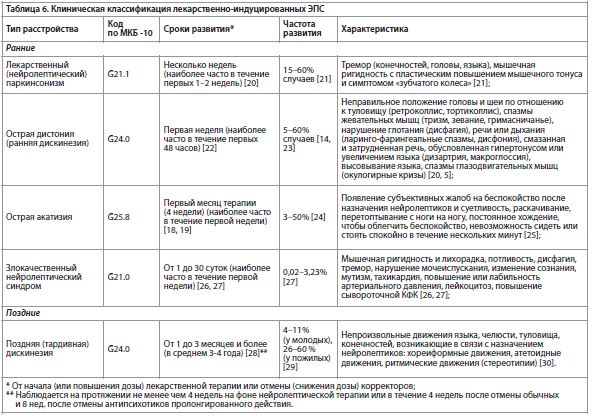
Классификация по клиническим проявлениям представлена в табл. 4. Классификация по времени возникновения в табл. 5.
Для практического применения в настоящее время наиболее распространенной является клиническая классификация наиболее распространенных лекарственно-индуцированных ЭПС, представленная в табл. 6.
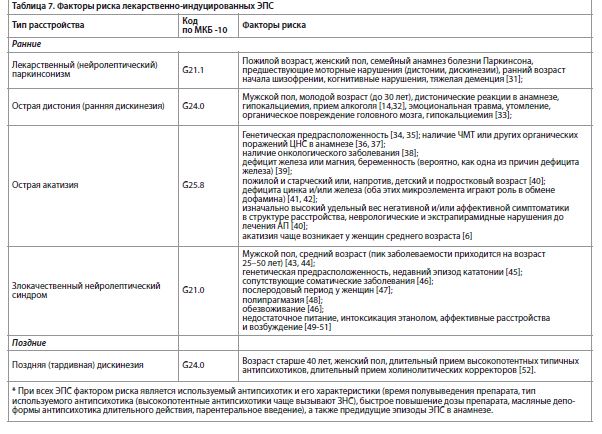
Значимым моментом является оценка факторов риска развития лекарственно-индуцированных ЭПС, которые перечислены в табл. 7.
Тактика применения
С учетом официально зарегистрированных инструкций по применению лекарственных препаратов, в настоящее время в России применяется следующая тактика применения корректоров.
1 шаг - рассмотрение вопроса перевода пациента на лечение антипсихотиком с меньшей частотой развития лекарственно-индуцированных ЭПС (предпочтительны атипичные антипсихотики). Из антипсихотиков первого поколения в наименьшее степени вызывают риск развития лекарственно-индуцированных ЭПС – хлорпромазин, тиоридазин, из атипичных антипсихотиков – клозапин, оланзапин, кветиапин [53, 54].
 2 шаг - назначение корректоров начиная со стартовой дозы и титруя до минимальной эффективной терапевтической дозы, до наступления клинического эффекта (исчезновение ЭПС), с последующим длительным приемом (при отсутствии побочных эффектов), в случае стойкой медикаментозной ремиссии по основному заболеванию, возможна попытка постепенного снижения дозировок и последующей отмены корректора (не ранее, чем через
2 шаг - назначение корректоров начиная со стартовой дозы и титруя до минимальной эффективной терапевтической дозы, до наступления клинического эффекта (исчезновение ЭПС), с последующим длительным приемом (при отсутствии побочных эффектов), в случае стойкой медикаментозной ремиссии по основному заболеванию, возможна попытка постепенного снижения дозировок и последующей отмены корректора (не ранее, чем через
3 месяца от начала приема корректоров) [14], однако наиболее предпочтительной тактикой является перевод пациента на прием лекарственных препаратов, в меньшей степени вызывающих лекарственно-индуцированные ЭПС и не требующих назначения корректоров. В случае терапии острых состояний (некоторые случаи острой дистонии и злокачественный нейролептический синдром) применяются корректоры для парентерального введения сразу со среднетерапевтических дозировок, с последующим переходом на прием таблетированных форм либо постепенно отменой, в зависимости от клинической ситуации (обычно коротким курсом до 2-3 недель) [9].
При нейролептическом паркинсонизме и острой дистонии наиболее эффективные корректоры из группы противопаркинсонических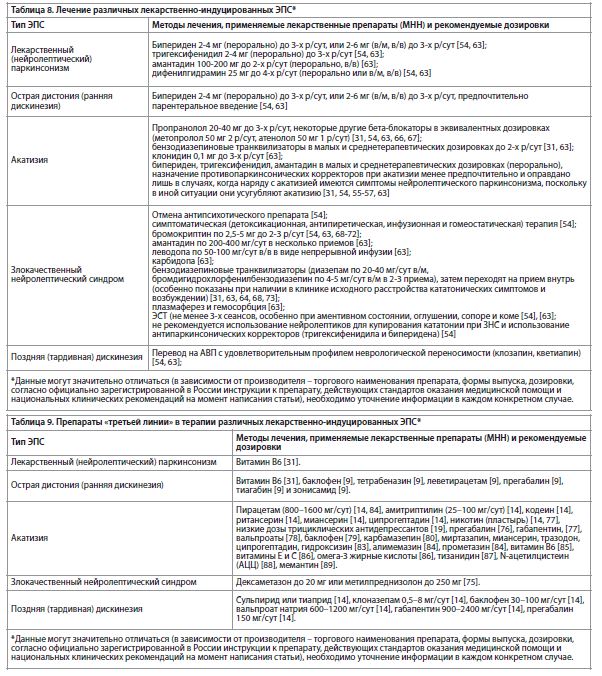 препаратов (тригексифенидил, бипериден, амантадин), при акатизии они показаны в меньшей степени (только в случаях, когда наряду с акатизией имеются симптомы нейролептического паркинсонизма), при поздней дискинезии применение корректоров из группы противопаркинсонических препаратов противопоказано [55-57].
препаратов (тригексифенидил, бипериден, амантадин), при акатизии они показаны в меньшей степени (только в случаях, когда наряду с акатизией имеются симптомы нейролептического паркинсонизма), при поздней дискинезии применение корректоров из группы противопаркинсонических препаратов противопоказано [55-57].
Нужно принимать во внимание, что к таким препаратам, как тригексифенидил, возможно развитие зависимости [58].
Некоторые корректоры (в частности амантадин) за счет своего механизма действия могут вызывать усугубление психотической симптоматики, а также ослабление антипсихотического эффекта применяемых антипсихотиков, хотя описаны случаи, когда пациенты с резистентными психозами выходили в ремиссию именно после добавления дофаминергических препаратов (амантадин) [59].
Необходимо отдельно остановиться на инъекционных лекарственных формах корректоров, а именно: бипериден (раствор для внутривенного и внутримышечного введения) и амантадин (раствор для инфузий), которые применяются в терапии острых состояний (некоторые случаи острой дистонии и злокачественный нейролептический синдром). В настоящее время в России (по некоторым оценкам) [60-62] из группы корректоров наиболее популярным в клинической практике является бипериден, затем (с небольшим отрывом): тригексифенидил и амантадин.
Лечебные и побочные эффекты корректоров лекарственно-индуцированных ЭПС
Грубо обобщая, можно сказать, что корректоры (из группы противопаркинсонических препаратов) по механизму действия являются антиподами антипсихотических препаратов, соответственно механизм действия корректоров обусловлен, в первую очередь, преимущественно влиянием на активацию дофаминовых (в первую очередь D2-типа) рецепторов в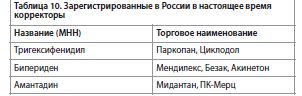 дофаминергических путях (главным образом в нигростриальном пути) и влиянием на другие рецепторы (5-HT2A рецепторы, α-адренорецепторы, м-холинорецепторы, H1-гистаминорецепторы и др.) в ЦНС и на периферии. Как и во всех остальных случаях, обратной стороной лечебных эффектов и механизма действия препарата становятся побочные эффекты и осложнения терапии, наиболее частые из которых – риски развития лекарственной зависимости, когнитивных нарушений, уменьшение антипсихотического эффекта (т. н. «пропсихотический эффект»), риск развития поздней дискинезии (при длительном приеме) [31].
дофаминергических путях (главным образом в нигростриальном пути) и влиянием на другие рецепторы (5-HT2A рецепторы, α-адренорецепторы, м-холинорецепторы, H1-гистаминорецепторы и др.) в ЦНС и на периферии. Как и во всех остальных случаях, обратной стороной лечебных эффектов и механизма действия препарата становятся побочные эффекты и осложнения терапии, наиболее частые из которых – риски развития лекарственной зависимости, когнитивных нарушений, уменьшение антипсихотического эффекта (т. н. «пропсихотический эффект»), риск развития поздней дискинезии (при длительном приеме) [31].
Необходимо помнить, что острые (ранние) лекарственно-индуцированные ЭПС иногда могут возникать в связи с отменой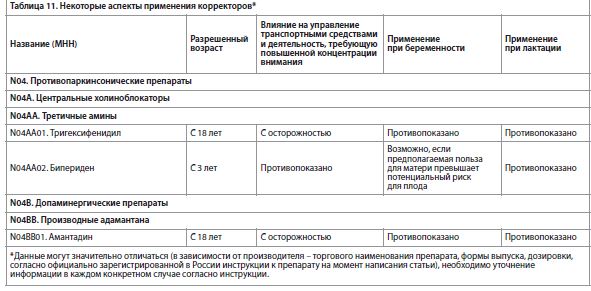 корректора или переключением с перорального пути введения нейролептика на парентеральный, антипсихотические препараты-депо, вводимые внутримышечно, значительно чаще вызывают данные осложнения, чем пероральные средства. У молодых пациентов ЭПС могут развиться даже после однократного приема антипсихотического препарата.
корректора или переключением с перорального пути введения нейролептика на парентеральный, антипсихотические препараты-депо, вводимые внутримышечно, значительно чаще вызывают данные осложнения, чем пероральные средства. У молодых пациентов ЭПС могут развиться даже после однократного приема антипсихотического препарата.
Помимо антипсихотических препаратов, лекарственно-индуцированные ЭПС также может вызывать метоклопрамид, а также (в гораздо меньшей степени) – некоторые другие психотропные препараты (некоторые антидепрессанты, противосудорожные средства, препараты лития и др.) [63].
Помимо противопаркинсонических препаратов, с целью коррекции лекарственно-индуцированных ЭПС применяются некоторые препараты других групп, в частности бензодиазепиновые транквилизаторы, бета-адреноблокаторы, антигистаминные препараты, дофаминомиметики и другие (клозапин, буспирон, витамин Е, клозапин, клонидин), хотя в настоящее время данные показания официально не зарегистрированы в инструкции к препаратам, кроме противопаркинсонических, а частично прописаны в национальных клинических рекомендациях [54] и аналогичных зарубежных протоколах, а также в публикациях результатов научных исследований [63].
За рубежом для коррекции различных лекарственно-индуцированных ЭПС также используют бензотропин, проциклидин, дантролен, орфенадрин (которые в настоящее время в России не зарегистрированы) [63].
При медикаментозной терапии лекарственно-индуцированных ЭПС возможна комбинация корректоров разных фармакологических групп, например бензодиазепиновые транквилизаторы и бета-блокаторы (при акатизии) и т. д.
Главный момент, о котором нужно помнить, что при проведении антипсихотической терапии нужно стремиться к предупреждению и профилактике развития лекарственно-индуцированных ЭПС, принимая во внимание факторы риска, чем их в последующем лечить [52].
При лечении и оценке риска развития лекарственно-индуцированных ЭПС важно обратить внимание на дефицит железа, цинка и магния [19, 40-42].
Методы лечения, применяемые препараты и рекомендуемые дозировки для лечения наиболее распространенных в клинической практике лекарственно-индуцированных ЭПС представлены в табл. 8.
Препараты т. н. «третьей линии» (лекарственные препараты, применяемые не в первую и не во вторую очередь, с уровнем доказательности не выше III, но клинически доказанными эффективностью и безопасностью) в лечении лекарственно-индуцированных ЭПС представлены в табл. 9. Из всех существующих корректоров лекарственно-индуцированных ЭПС из группы противопаркинсонических препаратов (по данным Государственного реестра лекарственных средств) [2] зарегистрировано 3 наименования, не считая препаратов «второй» и «третьей» линии, которые по классификации являются препаратами из других групп, например бензодиазепины, бета-блокаторы и др. Зарегистрированные в России в настоящее время корректоры, с учетом торговых наименований представлены в табл. 10 (за исключением торговых наименований, формы «МНН», «МНН-фирма-производитель» или «МНН-лекарственная форма») [2, 60].
Помимо химической структуры, длительности (период полувыведения) действия, важными параметрами для клинической практики являются цена и доступность препарата (законодательное регулирование льготного лекарственного обеспечения, политика аптечных сетей), но они в значительной степени подвержены изменениям (изменение цен, законодательная практика национальной системы здравоохранения), окончательное же решение о назначении того или иного препарата принимает лечащий врач с учетом показаний, противопоказаний, клинического профиля препарата, его фармакодинамики, фармакокинетики, индивидуальных особенностей пациента и вышеуказанных параметров. Важными аспектами применения корректоров является возраст, с которого они разрешены к применению, влияние на управление транспортными средствами и деятельность, требующую повышенной концентрации внимания, а также применение при беременности и лактации (согласно официальным инструкциям к лекарственным средствам) [2, 60], и указанные аспекты (согласно инструкциям по применению) [2, 60] несколько отличаются у различных корректоров, они представлены в табл. 11.
Заключение
Корректоры – группа препаратов, основной целью назначения которой является не терапия основного заболевания, а коррекция побочных эффектов, возникающих в результате лечения основного заболевания. Хотя в современной практике и следует избегать ситуаций, когда необходимо назначение корректоров, но все же в полной мере без них обойтись пока невозможно, поскольку они в значительной степени влияют на такие параметры психофармакотерапии, как качество жизни, переносимость и приверженность пациентов к терапии. Корректоры имеют богатую историю применения во всем мире (в том числе в России), достаточно изучены и являются, в значительной части случаев, необходимой, хотя, возможно, и несколько недооцененной группой препаратов-спутников рациональной психофармакотерапии психотических расстройств на различных этапах.
Сведения об авторе:
Маслов Константин Андреевич, врач-психиатр ГБУЗ ОПБ им. К.Р. Евграфова (г. Пенза), skrembler@mail.ru.
K.A. Maslov
K.R. Evgrafov Mental Hospital. 440026, Russian Federation, Penza, ul. Lermontova, d. 28. skrembler@mail.ru
Abstract
An article on the current state of affairs with correctors of drug-induced extrapyramidal side effects in the clinical practice of a psychiatrist in Russia. Topical issues of the applied use of drugs, their characteristics, prescription tactics are considered.
Keywords: extrapyramidal side effects (EPSE) correctors, extrapyramidal symptoms (EPS) correctors, neurolepsy, akathisia, acute dystonia, drug-induced parkinsonism, neuroleptic malignant syndrome, NMS, tardive dyskinesia.
For citation: K.A. Maslov. Correctors of drug-induced extrapyramidal side effects in Russia, in modern clinical practice of the psychiatrist. Questions of applied practical application. Psychiatry and psychopharmacotherapy. 2022; 1: 26–32.
Введение
Экстрапирамидные симптомы (далее – ЭПС) (экстрапирамидная симптоматика, (экстрапирамидный синдром, экстрапирамидные расстройства) – комплекс двигательных нарушений, возникающих в результате нарушения функции, преимущественно базальных ганглиев. Корректоры лекарственно-индуцированных ЭПС (далее – корректоры) (в различных источниках – корректоры экстрапирамидных побочных эффектов, корректоры нейролепсии, корректоры нейролептиков, корректоры побочных действий нейролептиков, корректоры нейролептической терапии, корректоры нейролептических нарушений/ осложнений/расстройств, корректоры экстрапирамидных нарушений/осложнений/расстройств, корректоры экстрапирамидных нейролептических синдромов, корректоры экстрапирамидных нейролептических осложнений и др.) – группа препаратов, которая применяется для коррекции лекарственно-индуцированных (вызванных чаще всего антипсихотическими препаратами) двигательных расстройств. Указанные двигательные расстройства являются вторичными, поскольку обусловлены побочным действием лекарственных препаратов [1], в настоящей статье будут рассматриваться лишь вторичные расстройства (преимущественно обусловленные применением антипсихотиков). Согласно международной (рекомендованной Всемирной организацией здравоохранения, далее – ВОЗ) анатомо-терапевтическо-химической классификации (далее – АТХ), отдельной группы таких препаратов, как «корректоры лекраственно-индуцированных экстрапирамидных расстройств», не выделяют, прежде всего к ним относят антихолинергические препараты (которые относятся к группе АТХ – N04 Противопаркинсонические препараты), такие как тригексифенидил, бипериден и амантадин, однако в этих же целях могут использоваться и препараты других групп (бензодиазепиновые транквилизаторы, бета-адреноблокаторы, антигистаминные средства, дофаминстимуляторы и др.). Многие корректоры из группы
Механизм действия противопаркинсонических препаратов заключается в центральном и периферическом холиноблокирующем действии (бипериден, тригексифенидил) и повышении внеклеточной концентрации дофамина, посредством как интенсификации его выработки, так и блокады обратного захвата допамина пресинаптическими нейронами (амантадин). Препараты других химических групп, несмотря на основные различные механизмы действия, все же имеют общее (как прямое, так и опосредованное) воздействие как на дофаминопередачу, так и на холиноблокаду [2].
Краткая история корректоров
Как противопаркинсонические препараты корректоры широко стали использоваться в мировой клинической практике почти параллельно с антипсихотиками: тригексифенидил с 1951 года, бипериден с 1953, амантадин (как противопаркинсонический препарат) с 1973 года. Классификации корректоров
Существует несколько классификаций корректоров, которые представлены в ряде указанных ниже таблиц.
Классификация по механизму действия (согласно АТХ) [3] (из зарегистрированных в настоящее время в России) представлена в табл. 1. Необходимо также отметить важный фармакокинетический параметр корректоров – продолжительность действия (период полувыведения препарата и его активных метаболитов) [2], который представлен в табл. 2.
Диапазон доз корректоров (разрешенный к применению в России в настоящее время) представлен в табл. 3.
Лекарственно-индуцированные ЭПС Развитие лекарственно-индуцированной экстрапирамидной симптоматики наблюдается вследствие блокады дофаминергической нейропередачи в нигростриальной системе [1, 4].
Механизм действия антихолинергических корректоров на экстрапирамидную симптоматику обусловлен преимущественно блокадой центральных ацетилхолиновых рецепторов [5]. Поскольку дофамин замедляет высвобождение ацетилхолина в нигростриальном пути, применение большинства антипсихотиков, блокирующих дофаминовую передачу, влечет за собой увеличение высвобождения ацетилхолина в нигростриальном пути, что нарушает баланс ацетилхолина и дофамина и является причиной развития экстрапирамидных расстройств. Развитие лекарственно-индуцированных ЭПС связано с блокадой дофаминовых рецепторов в нигростриальном пути головного мозга (и в меньшей степени в
Существует несколько классификаций лекарственно-индуцированных ЭПС, которые представлены в ряде указанных ниже таблиц.
Классификация по клиническим проявлениям представлена в табл. 4. Классификация по времени возникновения в табл. 5.
Для практического применения в настоящее время наиболее распространенной является клиническая классификация наиболее распространенных лекарственно-индуцированных ЭПС, представленная в табл. 6.
Значимым моментом является оценка факторов риска развития лекарственно-индуцированных ЭПС, которые перечислены в табл. 7.
Тактика применения
С учетом официально зарегистрированных инструкций по применению лекарственных препаратов, в настоящее время в России применяется следующая тактика применения корректоров.
1 шаг - рассмотрение вопроса перевода пациента на лечение антипсихотиком с меньшей частотой развития лекарственно-индуцированных ЭПС (предпочтительны атипичные антипсихотики). Из антипсихотиков первого поколения в наименьшее степени вызывают риск развития лекарственно-индуцированных ЭПС – хлорпромазин, тиоридазин, из атипичных антипсихотиков – клозапин, оланзапин, кветиапин [53, 54].
3 месяца от начала приема корректоров) [14], однако наиболее предпочтительной тактикой является перевод пациента на прием лекарственных препаратов, в меньшей степени вызывающих лекарственно-индуцированные ЭПС и не требующих назначения корректоров. В случае терапии острых состояний (некоторые случаи острой дистонии и злокачественный нейролептический синдром) применяются корректоры для парентерального введения сразу со среднетерапевтических дозировок, с последующим переходом на прием таблетированных форм либо постепенно отменой, в зависимости от клинической ситуации (обычно коротким курсом до 2-3 недель) [9].
При нейролептическом паркинсонизме и острой дистонии наиболее эффективные корректоры из группы противопаркинсонических
Нужно принимать во внимание, что к таким препаратам, как тригексифенидил, возможно развитие зависимости [58].
Некоторые корректоры (в частности амантадин) за счет своего механизма действия могут вызывать усугубление психотической симптоматики, а также ослабление антипсихотического эффекта применяемых антипсихотиков, хотя описаны случаи, когда пациенты с резистентными психозами выходили в ремиссию именно после добавления дофаминергических препаратов (амантадин) [59].
Необходимо отдельно остановиться на инъекционных лекарственных формах корректоров, а именно: бипериден (раствор для внутривенного и внутримышечного введения) и амантадин (раствор для инфузий), которые применяются в терапии острых состояний (некоторые случаи острой дистонии и злокачественный нейролептический синдром). В настоящее время в России (по некоторым оценкам) [60-62] из группы корректоров наиболее популярным в клинической практике является бипериден, затем (с небольшим отрывом): тригексифенидил и амантадин.
Лечебные и побочные эффекты корректоров лекарственно-индуцированных ЭПС
Грубо обобщая, можно сказать, что корректоры (из группы противопаркинсонических препаратов) по механизму действия являются антиподами антипсихотических препаратов, соответственно механизм действия корректоров обусловлен, в первую очередь, преимущественно влиянием на активацию дофаминовых (в первую очередь D2-типа) рецепторов в
Необходимо помнить, что острые (ранние) лекарственно-индуцированные ЭПС иногда могут возникать в связи с отменой
Помимо антипсихотических препаратов, лекарственно-индуцированные ЭПС также может вызывать метоклопрамид, а также (в гораздо меньшей степени) – некоторые другие психотропные препараты (некоторые антидепрессанты, противосудорожные средства, препараты лития и др.) [63].
Помимо противопаркинсонических препаратов, с целью коррекции лекарственно-индуцированных ЭПС применяются некоторые препараты других групп, в частности бензодиазепиновые транквилизаторы, бета-адреноблокаторы, антигистаминные препараты, дофаминомиметики и другие (клозапин, буспирон, витамин Е, клозапин, клонидин), хотя в настоящее время данные показания официально не зарегистрированы в инструкции к препаратам, кроме противопаркинсонических, а частично прописаны в национальных клинических рекомендациях [54] и аналогичных зарубежных протоколах, а также в публикациях результатов научных исследований [63].
За рубежом для коррекции различных лекарственно-индуцированных ЭПС также используют бензотропин, проциклидин, дантролен, орфенадрин (которые в настоящее время в России не зарегистрированы) [63].
При медикаментозной терапии лекарственно-индуцированных ЭПС возможна комбинация корректоров разных фармакологических групп, например бензодиазепиновые транквилизаторы и бета-блокаторы (при акатизии) и т. д.
Главный момент, о котором нужно помнить, что при проведении антипсихотической терапии нужно стремиться к предупреждению и профилактике развития лекарственно-индуцированных ЭПС, принимая во внимание факторы риска, чем их в последующем лечить [52].
При лечении и оценке риска развития лекарственно-индуцированных ЭПС важно обратить внимание на дефицит железа, цинка и магния [19, 40-42].
Методы лечения, применяемые препараты и рекомендуемые дозировки для лечения наиболее распространенных в клинической практике лекарственно-индуцированных ЭПС представлены в табл. 8.
Препараты т. н. «третьей линии» (лекарственные препараты, применяемые не в первую и не во вторую очередь, с уровнем доказательности не выше III, но клинически доказанными эффективностью и безопасностью) в лечении лекарственно-индуцированных ЭПС представлены в табл. 9. Из всех существующих корректоров лекарственно-индуцированных ЭПС из группы противопаркинсонических препаратов (по данным Государственного реестра лекарственных средств) [2] зарегистрировано 3 наименования, не считая препаратов «второй» и «третьей» линии, которые по классификации являются препаратами из других групп, например бензодиазепины, бета-блокаторы и др. Зарегистрированные в России в настоящее время корректоры, с учетом торговых наименований представлены в табл. 10 (за исключением торговых наименований, формы «МНН», «МНН-фирма-производитель» или «МНН-лекарственная форма») [2, 60].
Помимо химической структуры, длительности (период полувыведения) действия, важными параметрами для клинической практики являются цена и доступность препарата (законодательное регулирование льготного лекарственного обеспечения, политика аптечных сетей), но они в значительной степени подвержены изменениям (изменение цен, законодательная практика национальной системы здравоохранения), окончательное же решение о назначении того или иного препарата принимает лечащий врач с учетом показаний, противопоказаний, клинического профиля препарата, его фармакодинамики, фармакокинетики, индивидуальных особенностей пациента и вышеуказанных параметров. Важными аспектами применения корректоров является возраст, с которого они разрешены к применению, влияние на управление транспортными средствами и деятельность, требующую повышенной концентрации внимания, а также применение при беременности и лактации (согласно официальным инструкциям к лекарственным средствам) [2, 60], и указанные аспекты (согласно инструкциям по применению) [2, 60] несколько отличаются у различных корректоров, они представлены в табл. 11.
Заключение
Корректоры – группа препаратов, основной целью назначения которой является не терапия основного заболевания, а коррекция побочных эффектов, возникающих в результате лечения основного заболевания. Хотя в современной практике и следует избегать ситуаций, когда необходимо назначение корректоров, но все же в полной мере без них обойтись пока невозможно, поскольку они в значительной степени влияют на такие параметры психофармакотерапии, как качество жизни, переносимость и приверженность пациентов к терапии. Корректоры имеют богатую историю применения во всем мире (в том числе в России), достаточно изучены и являются, в значительной части случаев, необходимой, хотя, возможно, и несколько недооцененной группой препаратов-спутников рациональной психофармакотерапии психотических расстройств на различных этапах.
Сведения об авторе:
Маслов Константин Андреевич, врач-психиатр ГБУЗ ОПБ им. К.Р. Евграфова (г. Пенза), skrembler@mail.ru.

