Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
On the efficacy and safety of quetiapine in the treatment of bipolar spectrum disorders
R.A. Bekker1, Yu.V. Bykov2, A.Yu. Bykova2, P.V. Morozov3
Abstract
Expansion and softening of the formal diagnostic criteria for bipolar affective disorder type 2 and for cyclothymia, as well as the introduction of the concept of «bipolar spectrum disorders», including mild and subclinical forms of these, led to a significant increase in the frequency of de novo diagnosis of bipolar disorder type 2, cyclothymia and «bipolar disorder not otherwise specified» in recent decades. It also led to the reclassification of a significant proportion of patients, which were previously considered to suffer from unipolar depressive disorders, to the category of bipolar disorder type 2, or to any of the «soft / mild bipolar spectrum» disorder subtypes. This, naturally, caused an increase in the interest of both pharmaceutical companies and the general medical community in the search for new drugs and methods of treating bipolar affective disorder and bipolar spectrum disorders, as well as an increase in the interest in research of the efficacy and safety in this regard of a number of already existing drugs, which were previously introduced to the market for other purposes. Examples are some atypical antipsychotics, and some newer anticonvulsants, such as lamotrigine. On the other hand, objective difficulties in the differential diagnosis between schizophrenia, schizoaffective disorder and bipolar disorder, along with some other factors, caused an increase in interest in the use of drugs that can simultaneously have a positive effect on both psychotic and affective (depressive, manic and / or dysphoric), as well as anxious and dyssomnic symptoms. In this article, we show why quetiapine is one of the drugs of choice for the treatment of bipolar affective disorder and bipolar spectrum disorders, both in acute episodes (bipolar depression, bipolar mania or hypomania, bipolar mixed states), and as maintenance therapy to prevent relapses of affective episodes of both types, as well as mixed episodes. We also discuss in detail the evidence base for the above statements.
Keywords: quetiapine, bipolar affective disorder, bipolar spectrum disorders, schizophrenia, schizoaffective disorder, bipolar depression, manic state, mixed state.
For citation: R.A. Bekker, Yu.V. Bykov, A.Yu. Bykova, P.V. Morozov. On the efficacy and safety of quetiapine in the treatment of bipolar spectrum disorders. Psychiatry and psychopharmacotherapy. 2022; 2: 46–66.
Введение
Вплоть до последних нескольких десятилетий биполярное аффективное расстройство (БАР), традиционно определявшееся в «жёстком», дихотомическом, крепелинском смысле (как современный аналог введённой Эмилем Крепелиным концепции «маниакально-депрессивного психоза» – МДП), считалось состоянием, которое достаточно редко встречается как в общей популяции (включающей не диагностированных и/или не обращавшихся к врачу потенциальных пациентов), так и в повседневной клинической практике (то есть среди пациентов, уже попавших под наблюдение врачей) [Mitchell PB, 2012; Stahl SM, 2013].
Однако, начиная с 1990-х, а особенно с 2000-х годов, изначальная диагностическая концепция БАР претерпела значительное расширение. В эти годы была предложена новая концепция расстройств биполярного спектра (РБС). В рамках этой концепции некоторые довольно обычные и не так уж редко встречающиеся симптомы и проявления депрессии, например, такие как выраженная раздражительность, дисфоричность, агрессивность, выраженная аффективная неустойчивость (нестабильность настроения, аффекта), психомоторное возбуждение (ажитация) или тревога, выраженная бессонница со снижением потребности во сне (а не с ощущением «невыспанности», как обычно при депрессиях), резко выраженные суточные колебания настроения, а также проявления «реакции активации» в ответ на применение антидепрессантов (АД), – стали трактоваться как возможные проявления «смешанного состояния», или, вернее, как возможные проявления «маниакальной стороны болезни» в данном депрессивном эпизоде. Сами же такие пациенты стали рассматриваться как подозрительные на возможную «биполярность», или даже как явно принадлежащие к «мягкой» части спектра РБС [Mitchell PB, 2012; Stahl SM, 2013].
 Аналогичным образом, наличие у пациента с депрессией в анамнезе даже коротких (от 2 до 4 дней) и стёртых и, следовательно, подпороговых, субклинических по ныне действующим официальным диагностическим критериям DSM-5 и МКБ-11 гипоманиакальных состояний, или наличие у него в анамнезе или в текущем депрессивном эпизоде признаков инверсии знака эпизода в ответ на применение АД – также стали рассматриваться как указание на принадлежность пациента к «мягкой» части спектра РБС. Так, например, для тех депрессивных пациентов, у которых случилась инверсия знака эпизода при применении АД, был предложен термин «БАР 3-го типа», а для пациентов, у которых депрессии сочетаются с субклиническими гипоманиями, – термин «БАР 2 ½-го типа» [Mitchell PB, 2012; Stahl SM, 2013].
Аналогичным образом, наличие у пациента с депрессией в анамнезе даже коротких (от 2 до 4 дней) и стёртых и, следовательно, подпороговых, субклинических по ныне действующим официальным диагностическим критериям DSM-5 и МКБ-11 гипоманиакальных состояний, или наличие у него в анамнезе или в текущем депрессивном эпизоде признаков инверсии знака эпизода в ответ на применение АД – также стали рассматриваться как указание на принадлежность пациента к «мягкой» части спектра РБС. Так, например, для тех депрессивных пациентов, у которых случилась инверсия знака эпизода при применении АД, был предложен термин «БАР 3-го типа», а для пациентов, у которых депрессии сочетаются с субклиническими гипоманиями, – термин «БАР 2 ½-го типа» [Mitchell PB, 2012; Stahl SM, 2013].
В общей сложности, известный исследователь аффективных расстройств Хагоп Акискал предложил подобным образом ввести 7 подтипов «мягких форм» БАР или РБС. На их детальном описании мы здесь не будем останавливаться, и отправим интересующегося этим вопросом читателя к отличной книге профессора Стивена Шталя «Essential Psychopharmacology: Neuroscientific Basis and Practical Applications». В главе об аффективных расстройствах этой книги данная концепция Х. Акискала излагается весьма детально и полно [Stahl SM, 2013].
Вполне естественно, что такое расширение диагностических критериев БАР и РБС повлекло за собой диагностическую переквалификацию значительного количества пациентов, которые ранее считались страдающими униполярным большим депрессивным расстройством (БДР) или униполярным рекуррентным депрессивным расстройством (РДР), – в категорию страдающих той или иной «мягкой формой» БАР или РБС. Оно также закономерно повлекло за собой значительное увеличение количества выставляемых de novo (т. е. первичным, ранее не обращавшимся к врачу, пациентам) диагнозов БАР [Mitchell PB, 2012].
Такое увеличение частоты диагностирования БАР произошло в основном за счёт увеличения частоты выставления диагноза БАР 2-го типа, для которого в DSM-5 диагностические критерии были значительно смягчены и расширены по сравнению с диагностическими критериями, предусмотренными DSM-IV-TR и МКБ-10, а также за счёт увеличения частоты выставления диагноза «другое и неуточнённое БАР», которым кодируются по DSM или МКБ «мягкие» подтипы БАР, введённые Х. Акискалом, но пока отсутствующие в официальных диагностических классификациях DSM и МКБ. В то же время частота диагностирования БАР 1-го типа (т. е. «классического БАР», примерного аналога МДП Э. Крепелина) подверглась значительно меньшим изменениям за последние десятилетия [Mitchell PB, 2012; Stahl SM, 2013].
Традиционно было принято считать, что общая распространённость БАР в популяции составляет всего лишь около 1% (разные оценки дают разброс распространённости БАР от 0,5% до 1,5-2%). Однако более поздние эпидемиологические исследования показывают, что общая распространённость БАР и РБС в популяции, с учётом существования их «мягких» и даже подпороговых, субклинических форм, – значительно выше. Она может достигать
5-10%, в зависимости от того, какие диагностические критерии использовать и насколько расширительно (или, наоборот, рестриктивно) их трактовать [Ghouse AA et al, 2013; Stahl SM, 2013].
Расширение и смягчение критериев диагностики БАР и РБС и вызванное этим увеличение количества ежегодно выявляемых de novo или переклассифицируемых из униполярных БДР и РДР случаев БАР и РБС – закономерно вызвали повышение интереса самых разных фармацевтических компаний как к разработке новых лекарств, потенциально могущих оказаться эффективными и безопасными средствами для лечения БАР и РБС, так и к исследованию потенциальной эффективности и безопасности при БАР и РБС уже присутствующих на рынке, ранее уже выпущенных этими компаниями психотропных и нейротропных лекарств, изначально имевших другое предназначение – например, атипичных антипсихотиков (ААП), изначально предназначавшихся для лечения шизофрении, или новых антиконвульсантов (АК), изначально предназначавшихся для лечения эпилепсии, таких, например, как ламотриджин [Mitchell PB, 2012; Stahl SM, 2013].
Касается это и героя нашего нынешнего обзора – ААП кветиапина [Stahl SM, 2013].
Проблема возможной гипердиагностики расстройств биполярного спектра и гиподиагностики шизофрении и шизоаффективного расстройства в ряде стран мира
Так же как и для всех остальных психических расстройств, для БАР и для РБС до настоящего времени пока не найдены какие-либо объективные и достоверные биохимические, электро-нейрофизиологические, нейровизуализационные или генетические методы диагностики, которые бы позволяли с достаточной степенью чувствительности и специфичности подтвердить или, наоборот, опровергнуть диагноз БАР или РБС [Iordache I, Low NC, 2010].
Между тем во всех остальных областях медицины объективные инструментальные и лабораторные методы диагностики и дифференциальной диагностики самых различных заболеваний уже давно стали не просто «общим местом», но «золотым стандартом» в диагностической работе врачей соответствующих специальностей [Iordache I, Low NC, 2010].
Таким образом, сегодня, как и столетие назад, во времена Э. Крепелина, диагноз БАР или РБС ставится преимущественно клинически – на основании наблюдения за поведением пациента (то есть за внешними проявлениями его болезни), на основании клинической беседы или расспроса пациента о его/её жалобах, о беспокоящих его или её симптомах болезни, опроса третьих лиц (родственников и близких) о поведении пациента, а также на основании тщательного сбора и оценки личного и семейного анамнеза, включая анамнез болезни, анамнез жизни и развития пациента, лекарственный анамнез, и последующего использования формальных диагностических критериев DSM или МКБ для БАР, а также использования стандартизованных рейтинговых диагностических шкал или структурированных опросников для оценки симптомов болезни и динамики её течения [Iordache I, Low NC, 2010].
Между тем уже достаточно давно было показано, что при любой, даже самой высокой степени тщательности подхода к сбору и оценке личного и семейного анамнеза, к единообразному у разных врачей применению формальных диагностических критериев DSM или МКБ, к рутинному применению стандартизованных диагностических шкал и структурированных опросников для оценки симптомов тех или иных болезней – в современной психиатрической диагностике, в том числе и в вопросах диагностики БАР и РБС, всё равно остаётся значительная доля субъективизма и ненадёжности [Iordache I, Low NC, 2010].
Это обуславливает значительные различия в частоте выставления тех или иных диагнозов разными врачами-психиатрами, даже при виде одного и того же пациента (inter-rater variability) [Iordache I, Low NC, 2010].
С другой же стороны, повышение осведомлённости как врачей, так и широкой общественности о БАР и РБС во многих странах повлияло на повышение склонности врачей к диагностике БАР и РБС и создало условия для возможного расцвета гипердиагностики этих расстройств в данных странах, в том числе – за счёт возможного снижения частоты диагностирования в этих странах других психических расстройств, например, таких, как униполярное БДР и РДР, синдром дефицита внимания и гиперактивности (СДВГ), пограничное расстройство личности (ПРЛ), шизофрения и шизоаффективное расстройство (ШАР) и др. [Zimmerman M et al, 2008].
Действительно, не всегда легко провести чёткую дифференциально-диагностическую грань между такими психическими расстройствами, как униполярное БДР или РДР, с одной стороны, – и ≪мягкие формы≫ БАР/РБС, с другой, или как ПРЛ с выраженными аффективными проявлениями, с одной стороны, – и БАР/РБС, с другой, или как ШАР, БАР и шизофрения с выраженными аффективными проявлениями (о последней проблеме мы ещё будем отдельно говорить ниже). У детей и подростков также часто вызывает трудности дифференциальная диагностика БАР/РБС и проявлений СДВГ, тем более что они часто бывают коморбидны [Zimmerman M et al, 2008; Stahl SM, 2013; 2015; Ruiz P et al, 2017].
Проблема необоснованной гипердиагностики БАР и РБС у детей и подростков с самыми различными аффективными нарушениями, часто вообще не укладывающимися или плохо укладывающимися в «классическую» картину БАР или РБС (что нередко списывают на «особенности течения БАР/РБС в детском или подростковом возрасте», или на возможную «коморбидность с СДВГ»), – стала настолько острой в ряде стран, что это вызвало даже необходимость введения в DSM-5 специальной диагностической категории «дизрегулятивное расстройство настроения детского возраста» (disruptive mood dysregulation disorder of childhood) – введённой специально для того, чтобы таким детям и подросткам не ставили необоснованно диагнозы БАР или РБС [Stahl SM, 2013; Ruiz P, 2017].
Ещё один любопытный аспект данной проблемы состоит в том, что на фоне общемировой тенденции к снижению стигматизации пациентов с БАР и РБС в последние десятилетия, во многих странах и во многих субкультурах проявилась тенденция к необоснованной романтизации и поэтизации диагноза БАР [Stahl SM, 2015].
Как указывает проф. Стивен М. Шталь в описании одного из клинических случаев в своей книге Case Studies II, диагноз БАР 2-го типа стал в последние десятилетия, в некотором роде, «модным» в определённых кругах, особенно среди молодёжи – вплоть до того, что некоторые современные молодые люди, никогда в реальности не обращавшиеся к врачу и не получающие никакого официального лечения (и объективно не нуждающиеся в лечении, и не испытывающие в нём никакой субъективной потребности), – сами себе безосновательно ставят диагноз БАР 2-го типа, а затем бравируют или хвастаются им перед друзьями и близкими [Stahl SM, 2015].
Некоторые же пациенты, страдающие внешне в чём-то сходными психическими расстройствами, например, униполярным БДР, РДР, ПРЛ или СДВГ, могут добиваться – и часто успешно добиваются – формально «более тяжёлого» диагноза БАР 2-го типа с целью получения финансовых выгод, инвалидности, социальной помощи и т.п., или с целью получения более интенсивного лечения, порой даже прибегая к симуляции или аггравации симптомов смешанного или гипоманиакального состояния ради получения такого диагноза [Stahl SM, 2015].
Всё это, разумеется, тоже вносит свой вклад в копилку нынешней тенденции к гипердиагностике БАР и РБС в ряде стран [Stahl SM, 2015].
С другой же стороны, диагностический термин «шизофрения» и любые другие диагностические термины с корнем «шизо-» (включая термин ШАР), в отличие от диагностических терминов БАР и РБС, по сей день воспринимаются в общественном сознании как стигматизирующие, дискриминационные и даже пейоративные (оскорбительные) термины. Диагноз шизофрении, в отличие от диагноза БАР, не только не подвергся романтизации и поэтизации в общественном сознании последних десятилетий, но, напротив, до сих пор остаётся одним из самых страшных, непонятных и пугающих для простых обывателей – настолько, что лиссофобия (страх сойти с ума) у пациентов с тревожными расстройствами часто принимает специфическую форму именно шизофобии (страха заболеть именно шизофренией, а не чем-либо другим) [Bergsholm P, 2016].
На основании этих данных в некоторых странах, например в Японии в 2002-м году и в Южной Корее в 2012-м году, шизофрения была официально переименована. Более поздние исследования показали, что это переименование вовсе не было простой формальностью или «данью политкорректности», и что оно объективно способствовало снижению стигматизации и дискриминации пациентов с данным заболеванием, а также улучшению коммуникации пациентов с врачами и повышению их комплаентности к лечению [Lee YS et al, 2014].
Так, было показано, что в сознании молодых японцев термин «шизофрения» раньше прочно ассоциировался с представлениями об априорной агрессивности, априорно неадекватном поведении, априорной склонности к насилию и к совершению общественно-опасных преступлений такими людьми – хотя специалисты знают, что такое представление, в общем и целом, лишено оснований, и что на самом деле лишь малая часть пациентов с шизофренией совершает уголовно наказуемые деяния. После же официального переименования шизофрении в Японии восприятие пациентов с этой болезнью в сознании молодых японцев значительно улучшилось [Takahashi H et al, 2009].
Многие западные специалисты, вслед за японцами и южнокорейцами, сегодня тоже полагают, что шизофрения – термин устаревший и научно некорректный, и что настало, наконец, время для поиска адекватной замены этому термину – не в последнюю очередь потому, что сам термин «шизофрения», на их взгляд, уводит мысль врача в сторону от других аспектов диагностики состояния пациента с этим диагнозом, кроме оценки наличия или отсутствия у него психотических симптомов, и от других аспектов лечения пациента с этим диагнозом, помимо применения антипсихотиков (АП) [Lasalvia A et al, 2015].
Как указывает ряд авторов, это особенно касается лечения аффективных расстройств (или аффективной симптоматики в рамках всё той же шизофрении), поскольку аффективная симптоматика может маскироваться – и часто маскируется – наличием выраженной психотической симптоматики. А это потенциально может приводить к ошибкам и в диагностике, и в лечебной тактике [Stahl SM, 2013; 2015]
Между тем, как указывает проф. Стивен М. Шталь, грубой врачебной ошибкой является как недостаточное внимание или невнимание к выявлению и устранению аффективной и тревожной симптоматики у пациентов с психозами (т. е. неназначение или недостаточно активное назначение им АД, анксиолитиков (АЛ) и/или нормотимиков (НТ) там, где они объективно показаны), так и обратное – недостаточное внимание или невнимание к выявлению и устранению психотической симптоматики у пациентов с аффективными расстройствами (т. е. неназначение или недостаточно активное назначение им АП, в первую очередь ААП, там, где они объективно показаны) [Stahl SM, 2013; 2015].
Настроение и мышление – очень тесно связаны. Тревожная и аффективная (в первую очередь – депрессивная) симптоматика часто встречается при шизофрении. И напротив, психотическая симптоматика часто встречается при аффективных расстройствах обоего знака, особенно при тяжёлых их формах [Bergsholm P, 2016; Ruiz P et al, 2017].
Депрессивная симптоматика сегодня рассматривается как один из очень важных, едва ли не центральных субдоменов шизофренического психоза – настолько, что входящая как в субдомен депрессивной симптоматики, так и в субдомен негативной симптоматики ангедония (утрата или снижение способности испытывать радость и удовольствие от жизни) – сегодня считается частью «эндофенотипа» шизофрении, одним из её ключевых, ядерных симптомов [Bergsholm P, 2016; Ruiz P et al, 2017].
Как указывает П. Бергсхольм, со временем само понятие шизофрении может исчезнуть. По его мнению, диагноз шизофренического психоза может быть со временем охарактеризован как устаревший, научно некорректный и в целом неудачный [Bergsholm P, 2016].
Ряд авторов, таких как проф. Стивен М. Шталь или С. М. Шварц с Э. Шортером, также указывают, что хроническое, тяжёлое или психотическое аффективное расстройство зачастую бывает внешне трудно отличимо или вообще неотличимо от шизофрении или какого-либо другого параноидного психоза, особенно в тех, к сожалению, нередких случаях, когда эти пациенты длительное время не получают оптимального лечения [Swartz CM, Shorter E, 2007; Stahl SM, 2013; 2015].
Вместе с тем большая сложность, гетерогенность и полиморфность клинических симптомов как аффективных расстройств, так и, в особенности, шизофрении и ШАР, а также значительные межиндивидуальные различия в степени тяжести симптоматики, в длительности течения расстройства, в уровне интеллекта и образования, в личном и семейном бэкграунде и в реакции на пробное лечение – могут очень сильно затруднять правильную дифференциальную диагностику того или иного из этих расстройств. Кроме того, многие пациенты как с аффективными расстройствами, так и с шизофренией и ШАР, на самом деле довольно сильно «не вписываются» в строгие формальные диагностические критерии для того или иного из этих расстройств. Особенно часто такое бывает в начале болезни (при более длительном наблюдении многое может стать яснее) [Stock EM et al, 2018].
Ошибки в дифференциальной диагностике между шизофренией, ШАР и БАР могут быть результатом большой гетерогенности, полиморфизма и разнообразия клинических проявлений всех трёх этих расстройств, при том, что многие из их симптомов частично перекрываются между собой [Blow FC et al, 2004].
Расплывчатость диагностических критериев, определяющих как шизофрению и ШАР, так и аффективные расстройства, несоответствие этих критериев в разных диагностических системах, а также различия в их субъективной трактовке разными специалистами, по сей день продолжают создавать серьёзные проблемы для оценки относительной и абсолютной распространённости в популяции как шизофрении и ШАР, так и аффективных расстройств [Tandon R et al, 2008].
Проблема дифференциальной диагностики шизофрении, ШАР и БАР (и вообще аффективных расстройств) осложняется ещё и тем, что, по-видимому, никаких трёх отдельных, дискретных диагностических категорий для шизофрении, ШАР и БАР не существует в клинической реальности (т. е. что это в действительности не более чем удобные, но не очень отражающие реальность ярлыки). По-видимому, в действительности более верным является представление о шизофрении, ШАР и аффективных расстройствах как о некоем непрерывном шизо-биполярном спектре, а не как о трёх отдельных диагностических категориях. Об этом, в частности, говорит растущее количество данных продольных и семейных генетических исследований, которые показывают, что гены, создающие предрасположенность к шизофрении, ШАР и аффективным расстройствам, в значительной степени перекрываются [Zimmermann P et al, 2009; Stahl SM, 2013; 2015; Ruiz P et al, 2017].
Иллюстрируя трудности дифференциальной диагностики между шизофренией, ШАР и БАР, проф. Стивен М. Шталь в своей книге Case Studies II описывает женщину, у которой за 20 лет болезни диагноз циклически менялся между этими тремя сущностями 20 раз (!), причём иногда разные диагнозы в разных эпизодах болезни ей ставил один и тот же психиатр. При этом автор указывает, что лечить надо не болезнь или формальный диагностический ярлык, а пациента, и что следует использовать синдромальный подход к лечению, независимо от текущего диагноза. В рамках этого подхода нужно стремиться устранить как аффективную и тревожную, так и психотическую симптоматику, а не тратить время на попытки выставить как можно более точный диагностический ярлык [Stahl SM, 2015].
Все эти соображения, вместе взятые, – желание избежать излишней стигматизации и дискриминации психиатрического пациента при постановке ему диагноза шизофрении или ШАР, объективные трудности в дифференциальной диагностике между шизофренией, ШАР и БАР и страх врача ошибиться в диагнозе и причинить тем самым вред пациенту, представление (достаточно обоснованное) об устарелости и научной некорректности диагноза шизофрении, а также своеобразное моральное или политическое давление как внешней социокультурной, так и внутренней профессиональной среды в пользу более частого выставления диагноза БАР, а не шизофрении или ШАР, – привели к значительному снижению частоты диагностики шизофрении и ШАР, в пользу диагноза БАР, в последние десятилетия в ряде стран Запада, а также в Японии и Южной Корее [Swartz CM, Shorter E, 2007; Bergsholm P, 2016].
Это снижение частоты диагностики шизофрении и ШАР в пользу БАР в ряде стран оказалось настолько резким и выраженным, что те же самые специалисты, которые говорили и продолжают говорить об устарелости и научной некорректности диагноза шизофрении, – заговорили об опасности «выплеснуть с водой и ребёнка», об опасности удариться в гиподиагностику шизофрении и ШАР в пользу гипердиагностики БАР, или даже о том, что такой перекос в этих странах имеет место быть уже сейчас [Swartz CM, Shorter E, 2007; Bergsholm P, 2016].
Обратная проблема – тенденция к гипердиагностике расстройств шизофренического спектра и недостаточной диагностике аффективных и тревожных расстройств в постсоветских странах
Согласно обнародованной совсем недавно, в 2016 году, статистике за 2013 год, диагноз БАР в России ставится в 0,008% всех случаев обращения за психиатрической помощью [Казаковцев БА, 2016].
Между тем общемировая статистика свидетельствует о том, что БАР, даже по строгим критериям, встречается в популяции с частотой около 1,2% [Clemente AS, 2015]. Таким образом, расхождение между российской статистикой заболеваемости БАР и общемировой – составляет ни много ни мало 150 (сто пятьдесят!) раз.
Аналогичным образом, российские статистические данные за 2010 год свидетельствуют о том, что диагнозы из группы униполярных депрессивных расстройств непсихотического уровня (большой депрессивный эпизод (БДЭ) без психотических симптомов, дистимия, рекуррентное депрессивное расстройство (РДР)) в России выставляются лишь у 0,078% обратившихся за психиатрической помощью [Демчева НК, 2012].
Общемировая же статистика даёт для распространённости униполярных депрессий непсихотического уровня цифру около 4,7% в среднем, причём в Восточной Европе распространённость выше – 5,1% [Ferrari A, 2013]. Таким образом, расхождение между российской статистикой заболеваемости униполярными депрессиями и общемировой – составляет 60 (шестьдесят!) раз.
Детальной статистики по разным подгруппам тревожных расстройств в России не ведётся вообще. Однако из статистики за 2013 год известно, что вся подгруппа F4x.xx – подгруппа «тревожных, невротических и связанных со стрессом расстройств» – составляла лишь 0,3% от общего числа обратившихся за психиатрической помощью [Казаковцев БА, 2016].
В то же время общемировая статистика даёт для распространённости всех тревожных расстройств, вместе взятых, оценку около 6,7% [Steel Z, 2014]. Таким образом, расхождение здесь составляет более 60 раз! Для такой гиподиагностики аффективных и тревожных расстройств в России есть множество причин. Одной из них является как раз гипердиагностика шизофрении (F20.xx), а также ШАР (F25.xx), шизотипического расстройства (ШТР, F21.xx) и других расстройств шизофренического спектра (РШС, F2x.xx). Она связана с целым рядом причин, например с социальными причинами (диагноз из группы F2x.xx позволяет получить инвалидность легче, чем большинство других психиатрических диагнозов), с традициями психиатрического образования в России и др. Очень часто диагнозы из этой категории выставляются, в частности, как раз пациентам с БАР, реже – с униполярным БДР или РДР (особенно – осложнившимися синдромом деперсонализации-дереализации, ДП/ДР), с ОКР, некоторыми другими тревожными расстройствами, например с социальным тревожным расстройством (СТР).
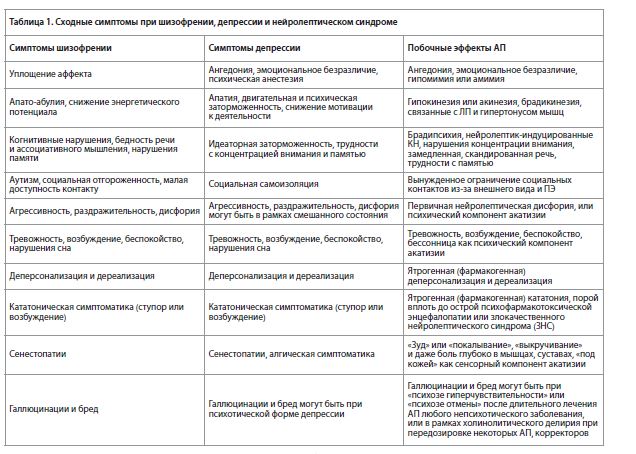
Проблема гипердиагностики шизофрении и РШС и недостаточной диагностики аффективных и тревожных расстройств в России и странах СНГ связана также и с объективными трудностями в дифференциальной диагностике шизофрении и аффективных расстройств (особенно их психотических форм), а также с тем, что побочные эффекты (ПЭ), возникающие при применении АП, вносят свой вклад в затушёвывание общей картины и в затруднение диагностики. Эти трудности иллюстрируются Таблицей 1.
Вместе с тем не вызывает никакого сомнения то, что если психиатрия в России и странах СНГ слепо последует по пути стран Запада, Японии и Южной Кореи, то рано или поздно в России и странах СНГ проявится опасность впасть в ту же ошибку, в которую уже впали указанные страны, – в ошибку гипердиагностики БАР и РБС, в ущерб диагностике шизофрении и ШАР. Конечно, если судить по сегодняшней российской статистике, до этого ещё весьма далеко. Но, как говорится, «бережёного Бог бережёт», и иметь в виду такую опасность тоже нужно.
В свете этого нам бы хотелось призвать коллег к умеренности, осторожности и взвешенности в диагностических подходах, к отказу от обеих крайностей – как от слепого подражания западным коллегам в их неумеренной и безбрежной гипердиагностике БАР и РБС, в том числе в ущерб диагностике шизофрении и ШАР, что характерно для современных западных стран, Японии и Южной Кореи, так и от традиционной в СССР гипердиагностики шизофрении и ШАР в ущерб диагностике аффективных и тревожных расстройств (в том числе БАР и РБС), что, к сожалению, пока ещё характерно для России и стран СНГ. Применение ААП с попутными нормотимическими, антидепрессивными и/или антиманиакальными свойствами для лечения как шизофрении и ШАР, так и БАР и РБС имеет то преимущество, что позволяет одновременно воздействовать как на психотическую, так и на аффективную (депрессивную и/или маниакальную) симптоматику в рамках болезни, вне зависимости от формального диагностического ярлыка, наклеенного на пациента в рамках текущей классификации. Справедливо это и для героя нашего нынешнего обзора – кветиапина [Stahl SM, 2013; 2015].
Некоторые специалисты даже полагают, что, возможно, механизм действия ААП лежит ближе к общему ядру патогенеза всех трёх этих заболеваний, чем механизм действия «классических» НТ (лития или АК), «классических» АД или типичных антипсихотиков (ТАП) [Stahl SM, 2013; 2015].
Кветиапин: общая характеристика
Кветиапин – это ААП, разработанный в 1985 году учёными компании «AstraZeneca (ранее „Zeneca“) Pharmaceuticals» [Riedel M et al, 2007].
В сентябре 1997 года кветиапин получил официальное одобрение Управления по контролю за качеством пищевых продуктов и медикаментов США (US Food and Drug Administration, US FDA), первоначально только для лечения шизофрении. В настоящее время кветиапин используется для лечения различных психических расстройств более чем в 70 странах мира, включая США, Канаду, большинство стран Западной Европы, Россию и Японию [Riedel M et al, 2007].
С химической точки зрения кветиапин представляет собой производное тиенобензодиазепина [Suttajit S et al, 2014].
 После получения убедительных данных двойных слепых плацебо-контролируемых рандомизированных клинических исследований (РКИ) об эффективности и безопасности, кветиапин был одобрен FDA также в качестве препарата первой линии для лечения острой биполярной депрессии (депрессии в рамках БАР), для купирования острых маниакальных, гипоманиакальных и смешанных состояний в рамках БАР, и для поддерживающего лечения БАР (для профилактики аффективных эпизодов обоего знака), как в монотерапии, так и в качестве дополнения к другой психофармакотерапии (ПФТ) [Grunze H et al, 2010; Sanford M, 2011; Yatham LN et al, 2013].
После получения убедительных данных двойных слепых плацебо-контролируемых рандомизированных клинических исследований (РКИ) об эффективности и безопасности, кветиапин был одобрен FDA также в качестве препарата первой линии для лечения острой биполярной депрессии (депрессии в рамках БАР), для купирования острых маниакальных, гипоманиакальных и смешанных состояний в рамках БАР, и для поддерживающего лечения БАР (для профилактики аффективных эпизодов обоего знака), как в монотерапии, так и в качестве дополнения к другой психофармакотерапии (ПФТ) [Grunze H et al, 2010; Sanford M, 2011; Yatham LN et al, 2013].
Кроме того, кветиапин также получил официальное одобрение FDA для применения в качестве средства первой линии для лечения и профилактики рецидивов при униполярном БДР или РДР (как в монотерапии, так и в комбинации с другой ПФТ), и в качестве потенцирующего агента (аугментатора) к АД при терапевтически резистентных униполярных депрессиях (ТРД) [Sanford M, 2011].
По статистике, на сегодняшний день кветиапин является одним из наиболее часто назначаемых препаратов для лечения БАР. Он используется на всех этапах лечения этого расстройства, как в острых состояниях, так и для поддерживающей терапии [Plosker GL, 2012].
Накоплен также большой положительный опыт использования кветиапина для лечения целого ряда других психических патологий, в частности диссомнических и тревожных расстройств, расстройств аутистического спектра, делириозных состояний, нарушений поведения у пациентов с деменцией и др. [Hawkins SB et al, 2013].
Фармакодинамика
Поскольку кветиапин имеет широкую доказательную базу по эффективности при лечении как расстройств психотического спектра (РПС), так и при лечении аффективных, тревожных и диссомнических расстройств, то формальное причисление кветиапина к группе ААП является не совсем верным. Возможно, такое определение для кветиапина даже следовало бы признать научно некорректным. Более корректным было бы называть кветиапин многофункциональным психотропным препаратом, обладающим широким спектром фармакологического действия и дозозависимой фармакологией [Stahl SM, 2013; Muneer A, 2015].
В малых дозах (от 25 до 100–200 мг/сут) кветиапин оказывает преимущественно снотворно-седативное действие. Это обусловлено, в первую очередь, высоким сродством кветиапина к гистаминовым H1 рецепторам, для которых он является полным антагонистом [Altamura AC et al, 2012; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
В средних дозах (от 100–150 до 300 мг/сут) кветиапин оказывает выраженное (и увеличивающееся с увеличением дозы в этом диапазоне) антидепрессивное и анксиолитическое действие. Это его действие сохраняется и в более высоком (антипсихотическом) диапазоне доз, по крайней мере вплоть до дозы 600 мг/сут (более высокие дозы при биполярных и униполярных депрессиях не исследовались и официально не рекомендованы производителем) [Altamura AC et al, 2012; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
Механизм антидепрессивного и анксиолитического действия кветиапина – сложный и полирецепторный. В нём, по-видимому, играют роль как парциальный агонизм кветиапина и его основного активного метаболита – норкветиапина (N-дезметилкветиапина) – к серотониновым рецепторам 5-HT1A подтипа (по аналогии с буспироном, гепироном, вортиоксетином, вилазодоном, тразодоном, у которых тоже есть этот механизм), так и антагонизм кветиапина и особенно норкветиапина к ряду других подтипов серотониновых рецепторов – 5-HT2A и 5-HT2C, 5-HT3, 5-HT7, 5-HT6 (в порядке убывания аффинитета и клинической значимости; механизм действия здесь подобен таковому у ряда других ААП), и их антагонизм к α2 адренорецепторам (механизм действия здесь подобен таковому у миртазапина и миансерина), а также то, что норкветиапин является довольно сильным ингибитором обратного захвата норадреналина (ИОЗН; здесь механизм действия подобен таковому у ребоксетина) [Yatham LN et al, 2005; Jensen NH et al, 2008; Altamura AC et al, 2012; Silverstone PH et al, 2012; Rasmussen H et al, 2013; Björkholm C et al, 2013; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
В более высоких дозах (400–600–800 мг/сут) – кветиапин оказывает достаточно выраженное (и нарастающее с увеличением дозы в указанном диапазоне) антипсихотическое и антиманиакальное действие [Altamura AC et al, 2012; Stahl SM, 2013; 2015; 2017; Suttajit S et al, 2014; Srinivas S et al, 2020].
Так же, как и для всех остальных АП, механизм антипсихотического и антиманиакального действия кветиапина, как принято считать, связан с блокадой им D2 подтипа дофаминовых рецепторов мезолимбического пути [Altamura AC et al, 2012; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
Однако кветиапин и клозапин отличаются от всех остальных ныне известных АП тем, что имеют довольно низкое сродство к D2 подтипу дофаминовых рецепторов – настолько низкое, что даже при максимальных рекомендованных дозах кветиапина или клозапина процент занятости D2 рецепторов стриатума не превышает 50–55%, в то время как «антипсихотический порог», установленный в экспериментах с другими АП, составляет не менее 60–65%. Это заставило ряд специалистов постулировать, что кветиапин и клозапин, по-видимому, обладают также какими-то дополнительными, не связанными с D2 блокирующей активностью, механизмами антипсихотического действия. Возможно, эти механизмы и у кветиапина, и у клозапина связаны с их взаимодействием с NMDA подтипом глутаматергических рецепторов [Al Jurdi RK et al, 2010; Stahl SM, 2013; Muneer A, 2015].
Низкое сродство кветиапина и норкветиапина к D2 подтипу дофаминовых рецепторов, в сочетании с быстрой кинетикой освобождения ими рецептора (быстрой их диссоциацией из связи с этим рецептором), а также наличием у них таких дополнительных рецепторных свойств, как парциальный 5-HT1A агонизм, антагонизм к 5-HT2A,
5-HT2C, 5-HT7 подтипам серотониновых рецепторов (что приводит к реципрокному повышению уровней дофамина и норадреналина в ряде областей мозга, в частности в префронтальной коре, в нигростриарной системе), – обуславливает очень низкий уровень гиперпролактинемии при лечении им, а также низкий уровень проявления экстрапирамидного синдрома (ЭПС), в частности, лекарственного паркинсонизма (ЛП), акатизии, острых дискинезий (ОД), и низкий риск развития злокачественного нейролептического синдрома (ЗНС) при лечении кветиапином. По этим параметрам кветиапин уступает только клозапину [Kapur S et al, 2000; Mundo E et al, 2006; Stahl SM, 2013].
Эти же рецепторные свойства кветиапина обуславливают низкий риск развития при лечении им проявлений нейролептической депрессии, нейролептик-индуцированного дефицитарного синдрома (НИДС), нейролептик-индуцированных когнитивных нарушений (КН). Напротив, по данным РКИ, кветиапин способен оказывать выраженное антинегативное действие (уменьшать первичную негативную симптоматику шизофрении) и улучшать когнитивное функционирование больных, как с шизофренией и ШАР, так и с аффективными расстройствами [Stahl SM, 2013].
В отличие от всех других известных на сегодняшний день АП, кветиапин и клозапин не вызывают развития феномена апрегуляции и сенситизации (повышения количества и чувствительности) дофаминовых D2 рецепторов стриатума при длительном лечении ими. Поэтому кветиапин и клозапин практически не вызывают развития поздних дискинезий (ПД) и поздних психозов гиперчувствительности (ППГ) при длительном лечении. Более того, все описанные на сегодняшний день случаи развития ПД на фоне лечения кветиапином или клозапином являются редчайшей казуистикой, и во всех этих случаях пациенты ранее длительно получали другие АП, так что связь развития ПД с применением клозапина или кветиапина представляется сомнительной. То же самое можно сказать и о редких казуистических случаях возникновения ЗНС на фоне терапии клозапином или кветиапином [Kapur S et al, 2000; Stahl SM, 2013].
В контексте лечения депрессивных состояний весьма важно то, что кветиапин обладает уникально широким спектром нейрохимического действия, включающим в себя положительное воздействие не только на серотонинергическую и/или норадренергическую системы мозга (как у большинства традиционных АД), но также и на дофаминергическую и NMDA-глутаматергическую системы. Между тем хорошо известно, что многие симптомы депрессии, такие как ангедония, психомоторная заторможенность, социальная самоизоляция, снижение или утрата мотивации, апатия, выраженные КН, – связаны со снижением дофаминергической нейротрансмиссии в префронтальной коре (ПФК) [Stahl SM, 2013; Muneer A, 2015].
Особое значение эта уникальная широта нейрохимического действия кветиапина приобретает при терапевтически резистентных депрессиях (ТРД), многие из которых являются «дофамин-зависимыми», а также при психотических формах депрессий и при «смешанных депрессиях», при которых важно, что кветиапин гармонично сочетает в себе антипсихотическое, антиманиакальное и антидепрессивное действие [Stahl SM, 2013; Muneer A, 2015].
Парциальный агонизм норкветиапина к 5-HT1A подтипу серотониновых рецепторов гиппокампа приводит к увеличению секреции ряда трофических факторов, таких как мозговой нейротрофический фактор (Brain Derived Neurotrophic Factor, BDNF). Это, в свою очередь, влечёт за собой стимуляцию нейрогенеза, торможение апоптоза нейронов гиппокампа, накопление фосфолипидов в их мембранах и повышение пластичности и устойчивости мембран нервных клеток (и клеток в целом как таковых) к вредным воздействиям [Sümegi A, 2008; Stahl SM, 2013; Muneer A, 2015].
Высокое сродство норкветиапина к 5-HT7 подтипу серотониновых рецепторов обуславливает прокогнитивное действие кветиапина, а также способствует нормализации циркадных ритмов и архитектоники (фазовой структуры) сна. Это его рецепторное свойство также вносит вклад в общую антидепрессивную и анксиолитическую активность кветиапина. Участие 5-HT7 подтипа серотониновых рецепторов в патогенезе как самой по себе депрессии, так и, в особенности, связанных с ней КН, нарушений циркадных ритмов, нарушений фазовой структуры сна – было документировано экспериментально [Stahl SM, 2013; Muneer A, 2015].
Сильное анальгетическое действие кветиапина тоже связывают с его 5-HT7 блокирующей активностью и с модуляцией им активности NMDA рецепторов, а также с ИОЗН активностью его метаболита норкветиапина. В сумме это приводит к активации нисходящих антиноцицептивных серотонинергических и норадренергических путей от таламуса к спинному мозгу. Это свойство кветиапина может быть весьма полезным в лечении депрессий, сопровождающихся алгической симптоматикой [Stahl SM, 2013].
Кветиапин также оказывает мощное противовоспалительное действие, как за счёт влияния на гистаминовые H1 рецепторы и на ряд подтипов серотониновых рецепторов на поверхности иммунокомпетентных клеток, включая клетки микроглии, так и за счёт того, что норкветиапин является сильным ИОЗН и стимулирует адренергические рецепторы на их поверхности. Подавление секреции воспалительных цитокинов и угнетение агрессивности микроглии при применении кветиапина тоже вносит свой вклад в его общую антидепрессивную активность [Al Jurdi RK et al, 2010; Stahl SM, 2013].
Сильный антагонизм кветиапина к α1 подтипу адренергических рецепторов обуславливает такие его побочные эффекты (ПЭ), обычно преходящие и наблюдаемые только в начале терапии, как ортостатическая гипотензия (ОГ), рефлекторная тахикардия, головокружение, физическая слабость. В то же время это его свойство приводит к реципрокному повышению уровня дофамина в стриатуме, что дополнительно уменьшает риск развития ЭПС и акатизии при лечении им (по аналогии с илоперидоном). Наличие у кветиапина этого ПЭ требует принятия мер предосторожности против ОГ (таких, как увеличение потребления воды и соли, приподнятый головной конец кровати, инструктирование пациента не менять резко положение тела и т. д.) в начале терапии им, а также плавного и постепенного наращивания его доз [Al Jurdi RK et al, 2010; Stahl SM, 2013].
Сильный антагонизм кветиапина к H1 подтипу гистаминовых рецепторов обуславливает другой его частый начальный ПЭ – чрезмерную сонливость и седацию, обычно тоже преходящие по мере адаптации к препарату. Любопытно отметить, что этот ПЭ, в отличие от ОГ, является обратно дозозависимым, и реже встречается при более высоких дозах кветиапина, начиная от 200–300 мг/сут (вероятно, вследствие того, что при этих дозах начинают играть роль ИОЗН активность норкветиапина и другие «стимулирующие» рецепторные эффекты). Такая же обратная дозозависимость уровня седации от дозы характерна и для клозапина, и для миртазапина [Stahl SM, 2013].
Сочетание H1, 5-HT2C и 5-HT3 антагонизма у кветиапина и норкветиапина приводит к повышению аппетита и прибавке массы тела, и может способствовать развитию метаболических нарушений (гипергликемии, гиперхолестеринемии, дислипидемии) [Stahl SM, 2013].
Фармакокинетика
Кветиапин метаболизируется в печени в основном при участии изофермента цитохрома CYP450 3A4 до своего активного метаболита – норкветиапина (N-дезметилкветиапина) [López-Muñoz F, Alamo C, 2013].
Небольшая часть введённой дозы кветиапина метаболизируется в печени изоферментом цитохрома CYP450 2D6 в 7-гидроксикветиапин, который не обладает фармакологической активностью. Только около 1% от всей введённой дозы кветиапина выводится в неизменённом виде с мочой [López-Muñoz F, Alamo C, 2013].
Начиная с 2006 года, на Западе кветиапин доступен в формах с немедленным высвобождением (Seroquel IR) и с пролонгированным высвобождением (Seroquel XR).
В России пролонгированный препарат кветиапина появился несколько позже. Обе формы выпуска кветиапина имеют одинаковую биодоступность. Однако кветиапин в пролонгированной форме поддерживает равномерную стабильную концентрацию в плазме крови на протяжении суток. Это позволяет назначать его один раз в сутки, что более удобно для пациентов [López-Muñoz F, Alamo C, 2013; Stahl SM, 2013].
Кроме того, при применении пролонгированной формы кветиапина отсутствует резкий пик его концентрации в крови вскоре после приёма. Это уменьшает риск проявления избыточной дневной сонливости и седации, ОГ, тахикардии, головокружения или слабости на пике концентрации кветиапина в крови при лечении его пролонгированной формой [López-Muñoz F, Alamo C, 2013; Stahl SM, 2013].
Максимальная концентрация (Cmax) кветиапина в плазме крови при приёме пролонгированной его формы достигается через 6 часов. Поэтому пролонгированную форму кветиапина не следует применять в качестве снотворного на ночь, или в качестве «скоропомощного» АЛ для купирования острой тревоги (для этого годится только кветиапин с немедленным высвобождением, в малых дозах; при лечении кветиапином в пролонгированной форме можно добавлять малую его дозу (25–50–100 мг) в форме с непосредственным высвобождением на ночь в качестве снотворного, или же можно использовать дробно кветиапин с немедленным высвобождением по 25–50 мг днём при возникновении необходимости в экстренном анксиолизисе, в дополнение к регулярному приёму пролонгированного препарата) [López-Muñoz F, Alamo C, 2013; Stahl SM, 2013].
Кветиапин в форме с немедленным высвобождением – короткодействующий (T1/2 около 7 часов). Максимальная концентрация (Cmax) его в крови достигается в среднем через 2 часа. Поэтому, по крайней мере для лечения психозов и маниакальных состояний, его необходимо назначать 2 раза в сутки. В то же время РКИ показывают, что при лечении депрессий может быть эффективным – и позволить избежать чрезмерной дневной сонливости и седации (которая часто наблюдается при двукратном в сутки приёме формы с немедленным высвобождением, реже встречается, но также возможна и при применении пролонга) – однократный приём формы с немедленным высвобождением только на ночь [Bui K et al, 2013; Stahl SM, 2013; Muneer A, 2015].
В каждом конкретном случае лечения депрессии вопрос о кратности применения кветиапина и о выборе простой или пролонгированной его формы следует решать индивидуально. Скажем, при лечении ажитированных или психотических форм депрессий, смешанных депрессий – тоже лучше использовать пролонг или двукратный в сутки приём непролонга, не ограничиваясь применением непролонгированного препарата только на ночь [Bui K et al, 2013; Stahl SM, 2013; Muneer A, 2015].
Короткий T1/2 непролонгированного кветиапина, примерно соответствующий длительности нормального ночного сна (6-7 часов), делает удобным его применение в малых дозах в качестве снотворного на ночь, без риска избыточной сонливости и седации наутро [Stahl SM, 2013].
Режим дозирования
Поскольку кветиапин обладает выраженной дозовой зависимостью фармакологических эффектов и своеобразной «ступенчатостью» их включения на разных дозах, то рекомендуемый диапазон его конечных доз сильно зависит от того, какой именно эффект мы желаем получить от его применения – неспецифический снотворно-седативный, неспецифический анксиолитический и нормализующий циркадные ритмы, или антидепрессивный и специфический анксиолитический, или же антиманиакальный и антипсихотический, а также от того, какую именно психическую патологию и в какой именно фазе мы лечим с применением кветиапина [Stahl SM, 2013; Muneer A, 2015].
Рекомендуемая скорость наращивания доз кветиапина и конечные его дозы также сильно зависят от вида психической патологии, фазы лечения, от остроты и тяжести клинической ситуации, от того, насколько быстро необходимо достичь терапевтического эффекта, от индивидуальной переносимости и чувствительности к препарату, от возраста пациента и его соматического состояния, и от того, производится ли наращивание доз кветиапина амбулаторно или в стационаре [Stahl SM, 2013; Muneer A, 2015].
Так, при лечении униполярных и биполярных депрессий, а также при лечении тревожных расстройств обычно рекомендуют достаточно осторожное и постепенное начало и плавное наращивание доз кветиапина: старт с 50 мг/сут в 1-й день, со 2-го дня – 100 мг/сут, с 3-го дня – 200 мг/сут, с 4-го дня – 300 мг/сут. Рекомендуемый при этом конечный диапазон доз – 150–300 мг/сут. Допустимо, при наличии на то особенных показаний (например, при психотической форме депрессии, при ажитированных депрессиях, при смешанных депрессиях), повышать дозу и далее, до 400–600 мг/сут. Эффективность и безопасность доз выше 600 мг/сут при лечении биполярных и униполярных депрессий не исследовалась, и превышать эту дозу без особой необходимости при лечении депрессий не рекомендуется [Stahl SM, 2013; 2017; Muneer A, 2015; Ruiz P, 2017].
У пожилых и соматически ослабленных депрессивных пациентов, а также при плохой переносимости седативного и гипотензивного действия кветиапина рекомендуется наращивать его дозу медленнее, начинать с меньшей его начальной дозы (например, 25 мг/сут, а не 50 мг/сут) и ограничиваться меньшей его конечной дозой (например, 150–200 мг/сут, а не 300 мг/сут). В то же время при необходимости быстрого эффекта и при хорошей переносимости у сравнительно молодых, соматически здоровых пациентов с депрессией допустимо стартовать кветиапин сразу со 100–200 мг/сут. Такой же подход может быть применен при ажитированных депрессиях и при смешанных депрессиях, так как переносимость кветиапина достаточно сильно зависит от исходного уровня возбуждения ЦНС [Stahl SM, 2013; 2017; Muneer A, 2015; Ruiz P, 2017].
Напротив, при купирующем лечении острых маниакальных и смешанных состояний, а также острых психозов можно начинать кветиапин с более высоких начальных доз и наращивать его дозу быстрее, а конечный диапазон его доз должен быть выше, чтобы обеспечить достаточный антиманиакальный и антипсихотический эффект. Инструкция производителя рекомендует назначать при купировании острой биполярной мании в 1-й день
300 мг/сут, со 2-го дня можно при необходимости давать 400–600 мг/сут, с 3-го дня – при необходимости до
800 мг/сут. Рекомендуемый диапазон доз кветиапина при купирующем лечении острых маниакальных и смешанных состояний, а также острых психозов – 400-600-800 мг/сут [Locklear JC et al, 2013; Stahl SM, 2013; 2017; Ruiz P, 2017].
Опять-таки, если ситуация менее острая (например, если мы имеем дело с гипоманией, а не с полномасштабной, развёрнутой манией), а также у пожилых, соматически ослабленных пациентов или при плохой переносимости кветиапина, дозу его следует наращивать медленнее, начинать с меньшей дозы, и ограничиваться меньшей конечной дозой. Ориентирами здесь должен быть разум и клинический опыт врача, адекватная оценка остроты и тяжести состояния пациента и индивидуальной переносимости им препарата [Stahl SM, 2013; 2017; Ruiz P, 2017].
Для поддерживающего лечения БАР и РБС (т. е. для профилактики рецидивов аффективных эпизодов обоего знака) диапазон рекомендованных доз составляет 400–
800 мг/сут, как в монотерапии, так и в комбинациях с другими НТ (литием, вальпроатом, ламотриджином) [Muneer A, 2015; Stahl SM, 2013; 2017; Ruiz P, 2017].
Для лечения униполярных депрессий (как в монотерапии, так и в комбинации с АД) и для потенцирования эффекта АД при лечении ТРД применяется приблизительно тот же подход к дозированию кветиапина, что и при лечении биполярных депрессий. Рекомендуемые начальные дозы кветиапина при этом составляют 50 мг/сут в первые 2 дня, с увеличением до 150 мг/сут начиная с 3-4-го дня терапии [Bortnick B et al, 2011; Stahl SM, 2013; 2017; Ruiz P, 2017].
Рекомендованный для лечения униполярных депрессивных состояний диапазон конечных доз кветиапина составляет 150–300 мг/сут, как и в случае биполярных депрессий. При наличии особенных к тому показаний (психотическая форма депрессии, ажитированная депрессия, смешанная депрессия) доза кветиапина может быть увеличена и далее до 400–600 мг/сут (более высокие дозы не исследовались в этом контексте и не рекомендуются). Опять-таки, оговорки про возраст, соматическое состояние и индивидуальную переносимость применимы и здесь [Bortnick B et al, 2011; Stahl SM, 2013; 2017; Ruiz P, 2017].
Для получения анальгетического эффекта при лечении таких, например, нередко коморбидных с депрессией болевых синдромов, как глоссалгия, синдром жжения в полости рта (burning mouth syndrome), хронические головные боли напряжения, мигрень, – также рекомендуется выходить на дозу кветиапина порядка 150–300 мг/сут, при которой начинает играть существенную роль 5-HT7 блокада, а также ИОЗН активность норкветиапина [Stahl SM, 2013; 2017; Ruiz P, 2017].
Параметры эффективности и безопасности кветиапина в лечении расстройств биполярного спектра
Как известно, ААП первоначально были введены в клиническую практику прежде всего для лечения психотических расстройств, таких как шизофрения. При этом ААП показали сопоставимую с ТАП эффективность в устранении продуктивной психопатологической симптоматики (бреда, галлюцинаций, грубых нарушений поведения). Однако они оказались более эффективны, чем ТАП, в устранении негативной, когнитивной и аффективной (прежде всего депрессивной), а также тревожной симптоматики в рамках шизофрении [Meltzer HY, 2013; Stahl SM, 2013; 2017; Muneer A, 2015].
Кроме того, было также показано, что применение ААП для лечения шизофрении ассоциируется с меньшей частотой и меньшей тяжестью ЭПС и акатизии, меньшим риском развития ЗНС, меньшим риском возникновения ПД при длительной терапии, меньшим риском развития НИДС, нейролептических депрессий, нейролептик-индуцированных КН [Meltzer HY, 2013; Stahl SM, 2013; 2017; Muneer A, 2015].
Всё вышесказанное в полной мере справедливо и для кветиапина. Так, систематический обзор эффективности кветиапина при шизофрении показал, что кветиапин столь же эффективен, сколь и стандартный ТАП (галоперидол) в отношении устранения продуктивной психопатологической симптоматики шизофрении, но при этом гораздо лучше переносится, вызывает гораздо меньше ЭПС, акатизии, гиперпролактинемии, нарушений сердечного ритма на электрокардиограмме (ЭКГ), реже вызывает прибавку массы тела, намного реже галоперидола вызывает НИДС, нейролептические депрессии, и имеет преимущество в отношении устранения негативной, когнитивной, аффективной и тревожной симптоматики шизофрении [Suttajit S et al, 2013].
Вскоре после внедрения ААП в повседневную практику лечения шизофрении, предварительные клинические данные указали на то, что положительное действие ААП на аффективную и тревожную симптоматику и на когнитивное функционирование пациентов, по-видимому, проявляется вовсе не только при шизофрении и других психотических расстройствах, но также и при различных аффективных и тревожных расстройствах (включая БАР, РБС, униполярные депрессивные состояния, в частности ТРД) [Stahl SM, 2013; Gao K et al, 2014; Ruiz P, 2017].
Последовавшие за этими первыми клиническими наблюдениями многочисленные двойные слепые плацебо-контролируемые РКИ подтвердили эти предположения в отношении целого ряда ААП [Stahl SM, 2013; Gao K et al, 2014; Ruiz P, 2017].
По мере того, как о нейрохимических механизмах действия и о рецепторном профиле и фармакодинамике разных ААП стало известно больше, стало понятно, что они действительно могут обладать эффективностью в отношении различных аффективных и тревожных расстройств. В частности, было выдвинуто предположение, что высокое сродство всех известных ААП к различным подтипам серотониновых (5-HT) рецепторов ЦНС, превышающее их же сродство к D2 подтипу дофаминовых рецепторов, играет решающую роль не только в уменьшении риска возникновения ЭПС, НИДС и акатизии при лечении ими, по сравнению с лечением ТАП, но и в развитии их антидепрессивного, анксиолитического, прокогнитивного и нормотимического (тимостабилизирующего) эффекта [Yatham LN et al, 2005; Stahl SM, 2013].
При этом, однако, обнаружилось, что, в отличие от ситуации с лечением шизофрении и других расстройств шизофренического спектра, где разные ААП (за исключением «стоящего особняком» клозапина, который в этом контексте систематически оказывается эффективнее всех прочих АП, как ААП, так и ТАП) проявляют примерно сопоставимую эффективность и отличаются в основном профилем переносимости и ПЭ, – при лечении БАР и РБС разные ААП проявляют дифференциальную эффективность в отношении купирования разных типов аффективных эпизодов и в отношении поддерживающего профилактического лечения [Singh J et al, 2012; Stahl SM, 2013; Ruiz P, 2017].
Так, например, для луразидона показана эффективность при лечении и профилактике рецидивов биполярной депрессии, но (возможно, пока?) нет данных об его эффективности в купировании и профилактике биполярной мании. Для рисперидона, напротив, показана эффективность в купирующем лечении острых маниакальных эпизодов и в профилактике рецидивов мании. Но, например, в контексте лечения ТРД рисперидон в качестве потенцирующего агента в дополнение к АД оказался эффективным только на коротких промежутках времени, измеряемых несколькими неделями, но не показал способности длительно поддерживать достигнутый эффект – наоборот, при длительном применении рисперидон при ТРД оказался скорее депрессогенным (вероятно, за счёт высокой частоты гиперпролактинемии, ЭПС и акатизии при его применении) [Stahl SM, 2013; Ruiz P, 2017].
А, например, оланзапин эффективен как в монотерапии, так и в комбинациях с НТ (литием, вальпроатом) при купировании острой биполярной мании, а также при профилактике рецидивов аффективных эпизодов обоего знака (особенно маний). Но он оказался недостаточно эффективным в монотерапии при купирующем лечении острой биполярной депрессии (эффективность строго доказана в этом контексте только для комбинации оланзапин + флуоксетин) [Sanford M, Keating GM, 2012; Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
И только кветиапин, из всех известных на сегодняшний день ААП, оказался подлинно универсальным препаратом для лечения аффективных расстройств (в частности, БАР и РБС) на всех этапах болезни, как в купирующем лечении острых маниакальных, гипоманиакальных и смешанных состояний, так и в купирующем лечении острых биполярных и даже униполярных депрессий, и в профилактике рецидивов аффективных эпизодов обоего знака, как в монотерапии, так и в комбинациях с другими НТ, а также в качестве потенцирующего агента в дополнение к АД при ТРД. Именно эта универсальность кветиапина при лечении БАР и РБС, наряду с его хорошей переносимостью, вызвала к нему особый интерес и сделала его одним из самых популярных и часто назначаемых препаратов для лечения расстройств аффективной сферы [Stahl SM, 2013; Ruiz P, 2017].
Здесь стоит отметить, что применение ТАП для лечения острых маниакальных, гипоманиакальных и смешанных состояний, как в монотерапии, так и в комбинациях с «классическими» НТ (литием, вальпроатом, карбамазепином) – имеет давнюю историю, и действительно было эффективным. Оно способствует более быстрому началу терапевтического эффекта, лучшему контролю психомоторного возбуждения, агрессивности и психотической симптоматики, по сравнению с монотерапией этих состояний только классическими НТ. Однако ТАП в этом контексте не только хуже переносятся, чем ААП, из-за более высокого уровня ЭПС, НИДС и акатизии, вторичной депрессивной симптоматики («нейролептических депрессий»), но и чаще ААП способствуют истинной инверсии знака эпизода из мании или гипомании в депрессию. Они также, подобно классическим АД (которые, наоборот, склонны инвертировать из депрессии в манию или гипоманию), могут способствовать долгосрочному ухудшению течения БАР («раскачке маятника», учащению и утяжелению фаз, формированию быстрого цикла) [Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
Некоторые ТАП также могут обладать «встроенной» антидепрессивной активностью, связанной с индивидуальными отличиями в их рецепторном профиле или в строении молекулы («правильные для трициклика углы между тремя кольцами в молекуле») от всех прочих ТАП. В первую очередь здесь можно вспомнить, например, левомепромазин или хлорпротиксен. Препараты группы ТАП также могут быть полезными в дополнение к АД при ТРД или при психотических формах депрессии. Однако их антидепрессивная активность в любом случае достаточно ограничена и уступает таковой у современных ААП, а их длительное применение ассоциируется с частым возникновением ЭПС, НИДС и акатизии, вторичной депрессивной и негативной симптоматики, вторичных нейролептик-индуцированных КН [Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
По всем вышеописанным причинам применение ТАП в лечении БАР и РБС на Западе сегодня практически полностью уступило дорогу применению ААП, в частности кветиапина [Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
Кветиапин как почти идеальный нормотимик (стабилизатор настроения)
В идеале, успешное фармакологическое лечение БАР и РБС ставит перед собой задачу достижения одновременно всех следующих терапевтических целей [Muneer A, 2015]:
• Успешный контроль или быстрое купирование симптоматики маниакальных, гипоманиакальных и смешанных эпизодов;
• Успешное лечение как развёрнутых, полномасштабных депрессивных эпизодов, так и нередко сохраняющихся в межэпизодном периоде (в интермиссиях) субклинических, подпороговых депрессивных симптомов;
• Нейропротекция, улучшение когнитивного функционирования пациентов как в острых аффективных эпизодах, так и в межэпизодном периоде (в интермиссиях), предотвращение нарастания кумулятивной когнитивной токсичности по ходу течения болезни;
• Предотвращение или снижение вероятности инверсии знака эпизода из депрессии в манию, гипоманию или в смешанное состояние при вынужденном применении АД (например, из-за того, что монотерапия литием, ламотриджином или ААП оказалась неэффективной в данном конкретном эпизоде биполярной депрессии);
• Торможение прогрессирования болезни, нарастания частоты и тяжести аффективных эпизодов, предотвращение формирования быстрого цикла или континуального (непрерывного) течения болезни;
• Стабилизация настроения в интермиссиях, предотвращение или хотя бы снижение частоты, продолжительности и тяжести аффективных эпизодов обоего знака;
• Нормализация фазовой структуры сна и циркадных ритмов, которые нередко оказываются нарушенными у таких пациентов даже в интермиссиях;
• Успешный контроль или устранение нередко сопутствующих или коморбидных симптомов тревожности;
• Предотвращение или снижение вероятности суицида, купирование суицидальных тенденций.
Традиционные НТ (стабилизаторы настроения), такие как литий и некоторые АК (вальпроаты, карбамазепин, ламотриджин), обычно называют в качестве препаратов первой линии для достижения если не всех, то, во всяком случае, большинства из вышеперечисленных целей. Однако они, к сожалению, имеют целый ряд имманентно присущих им, неустранимых недостатков [Stahl SM, 2013; Muneer A, 2015].
Так, в частности, классические НТ обладают ограниченной клинической эффективностью при лечении тяжёлых маниакальных и смешанных эпизодов, при быстроциклическом или континуальном течении БАР, при терапии биполярных депрессий (особенно тяжёлых или протекающих с психотической симптоматикой), а также при профилактике аффективных эпизодов обоего знака [Stahl SM, 2013; Muneer A, 2015].
При этом важно отметить, что, скажем, литий и особенно карбамазепин и вальпроаты имеют существенный перекос в сторону лучшего подавления маний и гипоманий, чем депрессий, а ламотриджин – наоборот. Это часто вынуждает практикующего врача комбинировать 2 и даже
3 или более НТ для достижения наилучшего терапевтического эффекта. А это не всегда удобно. Это также значительно снижает комплаентность пациентов с БАР и РБС к лечению и повышает риск развития ПЭ и нежелательных межлекарственных взаимодействий [Stahl SM, 2013; Muneer A, 2015].
Из всех классических НТ только вальпроат обладает собственной анксиолитической и снотворно-седативной активностью (хотя литий может косвенно нормализовать сон и циркадные ритмы) [Stahl SM, 2013; Muneer A, 2015].
Ещё одним важным недостатком почти всех классических НТ является их узкий терапевтический диапазон и необходимость частого определения их концентрации в плазме крови, для того, чтобы избежать как неэффективности, так и проявлений ПЭ или признаков токсичности. Особенно это справедливо для лития, в меньшей мере – для карбамазепина и ещё в меньшей – для вальпроатов и ламотриджина, терапевтический диапазон которых шире, чем у лития и карбамазепина [Malhi GS, Tanious M, 2011; Stahl SM, 2013].
Неприятным аспектом лечения рядом классических НТ является также их органная токсичность (нефро- и тиреоидная токсичность у лития, гемато- и гепатотоксичность у карбамазепина, гемато-, гепато-, гастро- и панкреатическая токсичность вальпроатов, дерматотоксичность у ламотриджина). Особенно неприятно то, что в ряде случаев эта органная токсичность носит не идиосинкразический, а неизбежно кумулятивный характер (как в случае с влиянием лития на почки и щитовидную железу) [Malhi GS, Tanious M, 2011; Stahl SM, 2013].
Напротив, кветиапин демонстрирует прогресс в каждой из этих областей, по сравнению с классическими НТ. Он оказался успешным в лечении и профилактике рецидивов как тяжёлых маниакальных и смешанных состояний, так и биполярных депрессий, включая тяжёлые и психотические их формы. Он также обладает выраженной собственной анксиолитической и снотворно-седативной активностью, способствует нормализации фазовой структуры сна и циркадных ритмов, улучшению когнитивного функционирования пациентов. Он хорошо переносится и практически не обладает клинически значимой органной токсичностью [Woodward TC et al, 2010; Stahl SM, 2013].
Вся эта совокупность свойств в сочетании делает кветиапин почти идеальным НТ. Это вывело его из второй-третьей в первую линию терапии БАР на всех этапах болезни, и поставило его здесь наравне с классическими НТ (литием, вальпроатом, ламотриджином) [Woodward TC et al, 2010; Stahl SM, 2013].
Доказательная база по эффективности
и безопасности кветиапина при купирующем лечении острых маниакальных, гипоманиакальных и смешанных состояний
В 2005-м году были опубликованы данные двойного слепого плацебо-контролируемого сравнительного РКИ, посвящённого сопоставлению эффективности и безопасности монотерапии кветиапином, галоперидолом или плацебо при купировании острых маниакальных и смешанных эпизодов. В этом РКИ приняли участие 302 пациента с острым маниакальным или смешанным эпизодом, возникшим в рамках БАР 1-го типа. Все они были рандомизированы к получению либо кветиапина, либо галоперидола, либо плацебо в качестве монотерапии [McIntyre RS et al, 2005].
Авторы этого РКИ сумели показать, что уже к сроку 3 недели (21 день) кветиапин статистически достоверно отличался от плацебо по снижению общего балла шкалы оценки мании Янга YMRS (-12,29 в группе кветиапина против -8,32 в группе плацебо; p < 0,01). Антиманиакальный эффект кветиапина продолжал развёртываться и далее, и к сроку 12 недель (84 дня) разница между кветиапином и плацебо по шкале YMRS стала ещё заметнее (-17,52 балла в группе кветиапина против -9,48 баллов в группе плацебо; p < 0,001) [McIntyre RS et al, 2005].
Сходная степень редукции общего балла по шкале YMRS отмечалась и при применении галоперидола. Однако в группе галоперидола был выше общий уровень ПЭ и уровень отказов от продолжения лечения. Кроме того, в группе кветиапина редукции подвергались как баллы по шкале YMRS, так и баллы по Госпитальной шкале тревоги и депрессии (HADS), тогда как в группе галоперидола этого не наблюдалось (напротив, средний балл по шкале HADS в этой подгруппе к концу исследования увеличился). Авторы сделали вывод, что ААП кветиапин и ТАП галоперидол обладают сопоставимой эффективностью в купирующем лечении острых маниакальных и смешанных состояний в рамках БАР 1-го типа, но при этом кветиапин, во-первых, лучше переносится, а во-вторых, в отличие от галоперидола способен положительно влиять также и на депрессивную и тревожную симптоматику при смешанных состояниях [McIntyre RS et al, 2005].
Основными ПЭ, наблюдавшимися в группе кветиапина, были чрезмерная дневная сонливость и седация, ОГ, тахикардия, сухость во рту, головокружение, головная боль, в то время как в группе галоперидола наиболее частыми ПЭ были проявления ЭПС и акатизии, вторичная депрессивная симптоматика, а сонливость, ОГ и тахикардия наблюдались реже, чем у кветиапина [McIntyre RS et al, 2005].
В другом двойном слепом плацебо-контролируемом РКИ с аналогичным дизайном, также от 2005 года, сопоставляли эффективность и безопасность кветиапина, лития и плацебо при купирующем лечении острых маниакальных и смешанных состояний, возникающих в рамках БАР 1-го типа. Авторы этого РКИ показали, что кветиапин и литий оба обладают сопоставимой эффективностью в купировании этих состояний, оцененных по шкале YMRS, и оба значительно эффективнее плацебо. Переносимость также оказалась сопоставимой, с некоторым преимуществом в пользу кветиапина. В группе кветиапина наиболее частыми ПЭ были чрезмерная дневная сонливость, седативный эффект, сухость во рту, ОГ, тахикардия, запоры, головокружение и головные боли, а в группе лития – повышенная жажда, полиурия, мышечные подёргивания, мелкий тремор пальцев рук, тошнота и рвота, понос [Bowden CL et al, 2005].
В том же 2005 году был опубликован ретроспективный комбинированный анализ двух крупных международных двойных слепых плацебо-контролируемых РКИ, посвящённых изучению эффективности и безопасности монотерапии кветиапином у пациентов с острыми маниакальными или смешанными состояниями, возникшими в рамках БАР 1-го типа. В обоих вошедших в этот анализ РКИ пациенты рандомизировались к получению либо кветиапина (в дозах до 800 мг/сут), либо плацебо в монотерапии на протяжении 12 недель. Первичной конечной точкой эффективности в обоих РКИ было принято изменение среднего балла по шкале оценки мании Янга (YMRS), по сравнению с исходным уровнем, к сроку 21 день (3 недели) лечения [Vieta E et al, 2005].
Вторичные конечные точки в обоих вошедших в этот анализ РКИ включали в себя такие параметры, как изменение среднего балла по шкале YMRS по сравнению с исходным уровнем к сроку 84 дня (12 недель), частота положительных ответов на лечение (определяемых как редукция общего балла по шкале YMRS на 50% или более от исходного уровня), частота достижения ремиссии маниакального состояния (определяемой как нормализация показателей шкалы YMRS), а также изменения от исходного уровня к срокам 21 и 84 дня показателей по таким шкалам, как шкала депрессии Монтгомери-Асберга, шкала общего клинического впечатления CGI, её вариант для БАР (CGI-BP), шкала позитивных и негативных симптомов психоза (PANSS) и шкала тревоги Гамильтона (HAM-A) [Vieta E et al, 2005].
Авторы этого анализа показали, что статистически достоверное и значительное преимущество лечения кветиапином перед лечением плацебо по всем изучаемым показателям проявлялось уже на 21-й день терапии (p<0,001) и продолжало развёртываться до конца исследования, до 84-го дня терапии (p<0,001). При этом пациенты, получавшие кветиапин, также статистически достоверно значительно чаще, чем пациенты, получавшие плацебо, достигали клинического ответа (редукции общего балла по шкале YMRS более чем на 50% от исходного уровня) или ремиссии маниакального состояния (полной нормализации показателей по шкале YMRS) [Vieta E et al, 2005].
Данные этого комбинированного анализа подтвердили результаты ранее проведённых отдельных исследований и доказали, что монотерапия кветиапином высокоэффективна в отношении широкого круга аффективных (как маниакальных, так и депрессивных), тревожных и психотических симптомов, возникающих в рамках маниакальных и смешанных эпизодов при БАР 1-го типа, и что кветиапин при этих состояниях действует быстро, имеет хорошие показатели безопасности и переносимости [Vieta E et al, 2005].
В ещё одной, более поздней, работе от 2007 года авторы решили изучить эффективность и безопасность применения кветиапина в монотерапии или в комбинации с литием либо вальпроатом, в сопоставлении с плацебо, для лечения острых маниакальных и смешанных состояний в рамках БАР 1-го типа применительно к одному специфическому субдомену маниакальной симптоматики – а именно агрессивности и психомоторного возбуждения [Buckley PF et al, 2007].
В этом РКИ 407 пациентов с острым маниакальным или смешанным эпизодом, возникшим в рамках БАР 1-го типа, были рандомизированы к получению либо монотерапии кветиапином (в дозах от 200 до 800 мг/сут), либо монотерапии плацебо на протяжении 12 недель. Ещё 402 пациента с такими же состояниями были рандомизированы к получению либо комбинации литий/вальпроат + плацебо, либо комбинации литий/вальпроат + кветиапин (тоже в дозах от 200 до 800 мг/сут) на протяжении 3 или 6 недель [Buckley PF et al, 2007].
Авторы этого исследования показали, что кветиапин в монотерапии начинает численно отличаться от плацебо по подшкалам активации (то есть психомоторного возбуждения) и риска дополнительного проявления агрессивного поведения шкалы PANSS (PANSS Activation и PANSS Supplemental Aggression Risk) уже на 4-й день лечения [Buckley PF et al, 2007].
К сроку 21 день (3 недели) снижение показателей по подшкале активации (психомоторного возбуждения) шкалы PANSS было статистически достоверно значительно больше в группе монотерапии кветиапином, по сравнению с группой монотерапии плацебо. Это улучшение продолжало развёртываться и далее, и стало ещё более значительным к сроку 84 дня (12 недель) [Buckley PF et al, 2007].
Статистически достоверное значительное улучшение показателей по подшкале риска дополнительной агрессии шкалы PANSS при монотерапии кветиапином, по сравнению с монотерапией плацебо, было выявлено ещё раньше – уже на 14-й день (2 недели) терапии, и продолжало развёртываться и далее, в частности к контрольным срокам
21 день (3 недели) и 84 дня (12 недель) [Buckley PF et al, 2007].
С другой же стороны, при комбинированной терапии кветиапином в сочетании с литием или вальпроатом, дополнительная клиническая польза от добавления кветиапина к одному из этих НТ была менее очевидной. Среднее улучшение оценки по подшкале активации (психомоторного возбуждения) шкалы PANSS к сроку 21 день (3 недели) численно, но незначительно отличалось в пользу подгруппы «литий/вальпроат + кветиапин», по сравнению с подгруппой «литий/вальпроат + плацебо». Среднее улучшение оценки по подшкале риска дополнительной агрессии шкалы PANSS было статистически достоверно более значительным в подгруппе «литий/вальпроат + кветиапин», по сравнению с подгруппой «литий/вальпроат + плацебо» к сроку 21 день, но эта разница была менее разительна, чем при сравнении монотерапии кветиапином и монотерапии плацебо [Buckley PF et al, 2007].
В то же время при стратификации и раздельном анализе подгрупп пациентов с разной исходной степенью общей тяжести маниакального или смешанного состояния, с разной исходной выраженностью психотической симптоматики, агрессивности и возбуждения, обнаружилось, что добавление кветиапина к литию или вальпроату приносит особенно большую пользу пациентам с тяжёлым маниакальным состоянием, с выраженным психомоторным возбуждением, выраженной агрессивностью, яркой психотической или кататонической симптоматикой [Buckley PF et al, 2007].
Авторы этого исследования заключили, что кветиапин в монотерапии или в комбинации с литием либо вальпроатом, в дозах от 400 до 800 мг/сут, является надёжным, быстродействующим, эффективным и безопасным методом лечения острого психомоторного возбуждения и агрессивности, связанных с маниакальными или смешанными эпизодами в рамках БАР 1-го типа. Они также констатировали, что добавление кветиапина к литию или вальпроату особенно показано пациентам с тяжёлыми маниакальными или смешанными состояниями, с выраженным возбуждением, выраженной агрессивностью, с наличием яркой психотической или кататонической симптоматики в картине эпизода [Buckley PF et al, 2007].
В 2011-м году были опубликованы результаты 3-недельного двойного слепого плацебо-контролируемого предрегистрационного РКИ фазы III, в котором изучалась эффективность и безопасность применения новой пролонгированной формы кветиапина (Seroquel XR) один раз в сутки при купирующем лечении острых маниакальных и смешанных состояний, возникающих в рамках БАР 1-го типа, в сопоставлении с плацебо, у взрослых от 18 до 65 лет [Cutler AJ et al, 2011].
Все вошедшие в это исследование пациенты были рандомизированы к получению либо плацебо (159 человек), либо кветиапина XR (149 человек). Кветиапин назначался один раз в сутки (начальная доза – 300 мг/сут в первый день, затем 600 мг/сут на 2-й день, затем гибкая индивидуально подобранная доза от 400 до 800 мг/сут на период с
3-го по 22-й день лечения). Средняя доза кветиапина XR составила 604 мг/сут [Cutler AJ et al, 2011].
Авторы этого РКИ сумели показать, что применение кветиапина XR приводит к значительному численному тренду на улучшение симптомов острой мании по шкале YMRS, по сравнению с применением плацебо, уже начиная с 4-го дня лечения, и что это улучшение продолжает развёртываться и становится статистически достоверным к концу исследования (то есть к сроку 3 недели лечения). Кроме того, к сроку 3 недели в группе кветиапина XR частота клинического ответа (редукции показателей шкалы YMRS на 50% и более от исходного уровня) и частота достижения ремиссии маниакального состояния (нормализации показателей шкалы YMRS) также были статистически достоверно значительно выше, чем в группе плацебо [Cutler AJ et al, 2011].
Применение кветиапина XR также привело к статистически достоверному значительному улучшению показателей шкалы общего клинического впечатления CGI и её биполярного варианта (CGI-BP), в особенности подшкал CGI-BP-S (Severity, тяжесть состояния) и CGI-BP-С (Cognition, выраженность КН), а также шкал депрессии MADRS и тревоги HAM-A, по сравнению с плацебо. При этом кветиапин XR хорошо переносился пациентами с острой манией или острым смешанным состоянием. ПЭ возникали редко и были небольшой или умеренной интенсивности, а наиболее частыми из них были седативный эффект, сухость во рту и сонливость [Cutler AJ et al, 2011].
В 2013-м году были опубликованы данные 3-недельного двойного слепого плацебо-контролируемого многоцентрового РКИ, посвящённого изучению эффективности и безопасности монотерапии кветиапином при купирующем лечении острых маниакальных и острых смешанных состояний в рамках БАР 1-го типа у детей и подростков в возрасте от 10 до 17 лет [Pathak S et al, 2013].
Основными критериями для включения в это исследование были наличие верифицированного диагноза «БАР 1-го типа, текущий острый маниакальный эпизод» или «БАР 1-го типа, текущий острый смешанный эпизод» согласно диагностическим критериям DSM-5, а также исходный общий балл по шкале оценки мании Янга (YMRS) не менее 20 баллов. Всего были отобраны 277 пациентов из 34 центров США. Все они были рандомизированы к получению либо одной из фиксированных доз кветиапина (400 или 600 мг/сут), либо плацебо на протяжении 3 недель лечения [Pathak S et al, 2013].
Авторы этого РКИ сумели показать, что у детей и подростков в возрастной категории от 10 до 17 лет с БАР 1-го типа и текущим острым маниакальным или острым смешанным эпизодом, так же как и у взрослых, кветиапин в обеих исследованных дозах (как в дозе 400 мг/сут, так и в дозе 600 мг/сут) статистически достоверно эффективнее плацебо в устранении маниакальных симптомов, измеренных по шкале YMRS, к сроку 3 недели. Среднее изменение общего балла по шкале YMRS к этому сроку от исходного уровня составило -14,25, -15,60 и -9,04 баллов в группах кветиапина 400 мг/сут, кветиапина 600 мг/сут и плацебо соответственно. Лечение кветиапином в обеих исследованных дозах в данной возрастной категории в целом было безопасным и хорошо переносилось, а профиль ПЭ кветиапина соответствовал таковому у взрослых с БАР 1-го типа и аналогичным состоянием [Pathak S et al, 2013].
На основании данных этого РКИ кветиапин получил официальное одобрение FDA для купирующего лечения острых маниакальных, гипоманиакальных и смешанных эпизодов в рамках БАР не только у взрослых (от 18 лет), но также у детей и подростков в возрасте от 10 до 17 лет. Рекомендованный диапазон доз кветиапина для них тот же, что и для взрослых (400-600-800 мг/сут) [Srinivas S et al, 2020].
Доказательная база по эффективности и безопасности применения кветиапина при купирующем лечении острой биполярной депрессии
В 2010-м году были опубликованы результаты двойного слепого многоцентрового плацебо-контролируемого сравнительного РКИ под кодовым названием EMBOLDEN I, в котором сравнивалась эффективность, безопасность и переносимость монотерапии кветиапином, монотерапии литием и монотерапии плацебо при купирующем лечении острой биполярной депрессии, возникающей в рамках БАР 1-го или 2-го типов [Young AH et al, 2010].
В общей сложности в это РКИ вошли 802 пациента с острой биполярной депрессией, возникшей в рамках БАР 1-го или 2-го типов. Все они были рандомизированы к получению либо кветиапина 300 мг/сут (265 человек), либо кветиапина 600 мг/сут (268 человек), либо лития карбоната в гибкой, индивидуально подобранной дозе (от 600 до 1800 мг/сут, диапазон концентраций в плазме крови от 0,33 до 1,12 ммоль/л; 136 человек), либо плацебо (133 человека) на протяжении 8 недель лечения [Young AH et al, 2010].
Авторы этого исследования сумели показать, что монотерапия кветиапином в обеих исследованных дозах, особенно в дозе 600 мг/сут, статистически достоверно эффективнее и плацебо, и монотерапии литием в уменьшении депрессивной симптоматики у пациентов с острой биполярной депрессией к сроку 8 недель лечения (p<0,05). Среднее изменение общего балла по шкале депрессии Монтгомери-Асберга (MADRS) к этому сроку составило ь-15,4 балла в группе кветиапина 300 мг/сут, -16,1 балла в группе кветиапина 600 мг/сут, -13,6 баллов в группе гибких доз лития и -11,8 баллов в группе плацебо. Монотерапия литием, как и ожидалось из данных более ранних исследований, тоже оказалась статистически достоверно более эффективной, чем плацебо, в купирующем лечении острой биполярной депрессии (в редукции среднего балла по шкале MADRS), но явно уступала по эффективности монотерапии кветиапином [Young AH et al, 2010].
Более высокая эффективность монотерапии кветиапином, по сравнению с монотерапией литием, в купирующем лечении острой биполярной депрессии проявилась не только в более выраженной редукции среднего балла по шкале MADRS в обеих дозовых группах кветиапина, по сравнению с группой лития. Пациенты, получавшие кветиапин в обеих исследованных дозах, но не пациенты, получавшие литий, показали к сроку 8 недель лечения статистически достоверное значительное улучшение также по таким параметрам, как частота достижения клинического ответа (редукции общего балла по шкале MADRS на 50% и более от исходного уровня), частота достижения ремиссии депрессивной симптоматики (нормализации показателей шкалы MADRS), уменьшение тяжести состояния по шкале общего клинического впечатления (CGI) и её подшкалам, по шкале Гамильтона для оценки симптомов депрессии (HRSD), и по шкале Гамильтона для оценки симптомов тревоги (HAM-A) [Young AH et al, 2010].
Кроме того, кветиапин в дозе 600 мг/сут также более эффективно, чем кветиапин в дозе 300 мг/сут или литий, устранял сопутствующую маниакальную симптоматику, измеренную по шкале YMRS, и сопутствующую психотическую симптоматику, измеренную по шкале PANSS. Авторы этого РКИ пришли к выводу, что монотерапия кветиапином в обеих исследованных дозах (300 или 600 мг/сут) статистически достоверно эффективнее и плацебо, и монотерапии литием в купирующем лечении острой биполярной депрессии, и что при наличии сопутствующей маниакальной (смешанной) или психотической симптоматики доза кветиапина 600 мг/сут более эффективна и, вероятно, более показана, чем доза кветиапина 300 мг/сут. Они также констатировали, что монотерапия кветиапином в обеих исследованных дозах (как в дозе 300 мг/сут, так и в дозе 600 мг/сут) безопасна и хорошо переносится при купирующем лечении острой биполярной депрессии [Young AH et al, 2010].
В другом двойном слепом многоцентровом плацебо-контролируемом сравнительном РКИ под кодовым названием EMBOLDEN II, также опубликованном в 2010 году, изучали эффективность и безопасность монотерапии кветиапином (тоже в двух фиксированных дозах – 300 и 600 мг/сут), в сопоставлении с монотерапией пароксетином (в фиксированной дозе 20 мг/сут) и с плацебо при купирующем лечении острой биполярной депрессии, возникшей в рамках БАР 1-го или 2-го типов [McElroy SL et al, 2010].
В это РКИ вошли в общей сложности 740 пациентов с БАР, из них 478 человек с БАР 1-го типа и 262 человека с БАР 2-го типа и текущим большим депрессивным эпизодом (БДЭ), диагностированным согласно критериям DSM-IV-TR. Все они были рандомизированы к получению либо кветиапина в дозе 300 мг/сут (245 человек), либо кветиапина в дозе 600 мг/сут (247 человек), либо пароксетина в дозе 20 мг/сут (122 человека), либо плацебо (126 человек) на протяжении 8 недель лечения [McElroy SL et al, 2010].
Авторы этого РКИ показали, что обе дозы кветиапина (как 300 мг/сут, так и 600 мг/сут) статистически достоверно эффективнее и плацебо, и пароксетина в устранении депрессивной симптоматики, измеренной по шкалам MADRS и HRSD, у пациентов с острой биполярной депрессией в рамках БАР 1-го или 2-го типов к сроку 8 недель. Среднее изменение общего балла по шкале MADRS от исходного уровня к этому сроку составило -16,19 баллов в группе кветиапина 300 мг/сут, -16,31 баллов в группе кветиапина 600 мг/сут, -13,76 баллов в группе пароксетина и -12,60 баллов в группе плацебо соответственно [McElroy SL et al, 2010].
Кроме того, пациенты в обеих дозовых группах кветиапина (как в группе 300 мг/сут, так и в группе 600 мг/сут) к сроку 8 недель лечения показали статистически достоверно значительно большее (p < 0,05) улучшение почти по всем вторичным критериям оценки, по сравнению как с плацебо, так и с пароксетином [McElroy SL et al, 2010].
Интересно отметить, что в этом РКИ пароксетин вообще не показал статистически достоверного отличия от плацебо по уменьшению депрессивной симптоматики, измеренной по шкалам MADRS или HRSD, но статистически достоверно значительно уменьшал показатели тревожности, измеренной по шкале HAM-A (p < 0,05). Кветиапин в обеих изученных дозах тоже, подобно пароксетину, был статистически достоверно эффективнее плацебо в редукции симптомов тревожности. Однако при этом кветиапин также одновременно редуцировал депрессивную симптоматику и сопутствующие смешанные (маниакальные) или психотические симптомы, чего не наблюдалось в группе пароксетина [McElroy SL et al, 2010].
Это, в целом, соответствует ранее уже известным фактам о низкой или нулевой эффективности монотерапии «классическими АД» при лечении биполярных депрессий (в отличие от ситуации с лечением униполярных депрессий), и о том, что «классические АД» в монотерапии (без добавления НТ и/или ААП с доказанными нормотимическими свойствами) у пациентов с биполярной депрессией в рамках БАР, если вообще дают какой-либо эффект, чаще склонны давать инверсию знака эпизода в манию или гипоманию или развитие смешанного состояния, чем истинный антидепрессивный эффект. Авторы этого РКИ сделали вывод, что кветиапин в обоих изученных дозовых режимах (как 300, так и 600 мг/сут), но не пароксетин, эффективен в купирующем лечении острой биполярной депрессии в рамках БАР 1-го и 2-го типов. Лечение кветиапином в обеих изученных дозах имело хорошие показатели безопасности и переносимости, уровень ПЭ и отказов от лечения был низким [McElroy SL et al, 2010].
В другом двойном слепом плацебо-контролируемом РКИ, также опубликованном в 2010-м году, сравнивали эффективность и безопасность новой пролонгированной формы выпуска кветиапина (Seroquel XR), назначаемой один раз в сутки, и плацебо при купирующем лечении острой биполярной депрессии, возникшей в рамках БАР 1-го или 2-го типа, у взрослых. В этом РКИ приняли участие 270 взрослых пациентов с диагнозом БАР 1-го или 2-го типа и текущим диагнозом БДЭ (то есть с острой биполярной депрессией), согласно диагностическим критериям DSM-IV-TR. Стоит особо отметить, что в этом исследовании, в отличие от ряда других подобных РКИ, наличие диагноза быстроциклического течения БАР (4 и более очерченных эпизода любого знака за год) не было критерием исключения из исследования. Между тем хорошо известно, что многие «классические НТ», особенно соли лития, недостаточно эффективны при быстроциклическом течении БАР [Suppes T et al, 2010].
Все вошедшие в данное исследование пациенты были рандомизированы к получению либо пролонгированной формы кветиапина (Seroquel XR) в дозе 300 мг/сут один раз в сутки (133 человека), либо плацебо (137 человек) на протяжении 8 недель лечения [Suppes T et al, 2010].
Авторам этого РКИ удалось показать, что применение кветиапина в пролонгированной форме в дозе 300 мг/сут приводит к статистически достоверно значительно большей редукции среднего балла по шкале MADRS, по сравнению с применением плацебо, во всех контрольных точках исследования, уже начиная с 1-й по 8-ю неделю лечения. Частота положительных ответов на лечение (частота редукции общего балла по шкале MADRS на 50% и более от исходного уровня) и частота достижения клинической ремиссии депрессивного состояния (достижения уровня по шкале MADRS 12 баллов и менее) к сроку 8 недель лечения также были статистически достоверно значительно выше в группе пролонгированной формы кветиапина, по сравнению с группой плацебо [Suppes T et al, 2010].
Кроме того, применение пролонгированной формы кветиапина в этом РКИ приводило также к статистически достоверному значительному улучшению баллов по шкале общего клинического впечатления (CGI), к снижению показателей тревожности по шкале HAM-A, маниакальных симптомов по шкале YMRS и психотической симптоматики по шкале PANSS. Переносимость кветиапина в пролонгированной форме была очень хорошей (лучшей, чем известные из предыдущих РКИ данные по кветиапину немедленного высвобождения, который сам по себе достаточно хорошо переносится), а уровень ПЭ и отказов от лечения был низким [Suppes T et al, 2010].
Авторы цитируемого нами здесь исследования сделали вывод, что монотерапия кветиапином в пролонгированной форме в дозе 300 мг/сут, назначаемой один раз в сутки, является высокоэффективным, безопасным и хорошо переносимым методом лечения острой биполярной депрессии, развивающейся в рамках БАР 1-го и 2-го типов, включая случаи с быстроциклическим течением БАР. Они также особо отметили, что антидепрессивный эффект кветиапина в этом контексте наступал быстро, и начинал статистически достоверно отличаться от плацебо уже на 7-й день лечения, и что кветиапин попутно проявлял эффективность в отношении широкого круга прочих симптомов БАР – тревожных, маниакальных (смешанных) и психотических [Suppes T et al, 2010].
В 2014-м году были опубликованы данные большого ретроспективного метаанализа, посвящённого изучению эффективности и безопасности применения кветиапина (как в монотерапии, так и в комбинациях с другими психотропными препаратами – АД и/или НТ) в купирующем лечении острой биполярной депрессии, возникающей в рамках БАР 1-го или 2-го типа. В этот метаанализ вошли 11 двойных слепых РКИ. Общее количество пациентов в совокупной выборке из всех этих исследований составило 3488 человек. Авторы включили в свой метаанализ все найденные ими двойные слепые РКИ, в которых кветиапин (как в монотерапии, так и в комбинациях с АД и/или с НТ) сравнивался с какими-либо другими препаратами, включая сравнение кветиапина с плацебо (или сравнение комбинации кветиапина и второго препарата с комбинацией второго препарата и плацебо) при лечении острой биполярной депрессии (БДЭ), возникающей в рамках БАР 1-го или 2-го типов [Suttajit S et al, 2014].
Авторы данного метаанализа показали, что применение кветиапина, как в монотерапии, так и в комбинациях с АД или со стандартными НТ (литием, вальпроатом), приводит к статистически достоверному уменьшению тяжести острой биполярной депрессии по шкале MADRS к сроку
8 недель лечения, по сравнению с применением плацебо, а также к статистически достоверно более частому, по сравнению с плацебо, достижению удовлетворительного клинического ответа (редукции общего балла по MADRS на 50% и более от исходного уровня) или полной клинической ремиссии депрессии (нормализации показателей шкалы MADRS до 12 баллов и ниже) [Suttajit S et al, 2014].
Кроме того, лечение острой биполярной депрессии кветиапином ассоциировалось со значительно более низким процентом отказов от лечения из-за неэффективности, чем плацебо или монотерапия литием/вальпроатом. Лечение кветиапином (как в монотерапии, так и в комбинациях с АД и/или НТ) ассоциировалось также с более низким уровнем инверсии знака эпизода в манию/гипоманию или в смешанное состояние, с улучшением общего качества жизни по шкале QoL, с улучшением качества сна, со снижением уровня тревожности, измеренной по шкале HAM-A, с попутным купированием маниакальной (смешанной) симптоматики, измеренной по шкале YMRS, психотической симптоматики, измеренной по шкале PANSS, и с улучшением показателей общего клинического впечатления, социального и когнитивного функционирования пациентов [Suttajit S et al, 2014].
Согласно выводам авторов данного метаанализа, лечение кветиапином (как в монотерапии, так и в комбинациях с АД и/или НТ) при острой биполярной депрессии высокоэффективно в отношении широкого круга её симптомов (не только собственно депрессивных, но и тревожных, маниакальных/смешанных, психотических, когнитивных), и при этом безопасно и хорошо переносится. Уровень ПЭ и отказов от лечения из-за наличия ПЭ был низким во всех 11 изученных авторами РКИ, а сами ПЭ обычно ограничивались лёгкой или умеренной степенью выраженности. Наиболее частыми ПЭ при лечении кветиапином острой биполярной депрессии, согласно данным этого метаанализа, были сонливость и седация, ОГ, тахикардия, чувство усталости или физическая слабость, головокружение, головные боли, запоры, сухость во рту, повышение аппетита и прибавка массы тела, иногда – нерезко выраженные ЭПС (обычно в виде акатизии или тремора, реже – и в основном у пожилых – в виде нетяжёлого ЛП) [Suttajit S et al, 2014].
Доказательная база по эффективности и безопасности кветиапина при профилактике рецидивов аффективных расстройств обоего знака
В 2011-м году были опубликованы данные длительного (104 недели) двойного слепого сравнительного плацебо-контролируемого РКИ, в котором изучалась эффективность поддерживающей монотерапии кветиапином (в гибких, индивидуально подобранных дозах от 300 до 800 мг/сут) у взрослых (18 лет и старше) пациентов с БАР 1-го типа, диагностированным согласно критериям DSM-IV-TR, и с недавним маниакальным, депрессивным или смешанным эпизодом, у которых кветиапин ранее оказался эффективным в «остром», купирующем лечении данного эпизода – в сопоставлении со стандартной профилактической монотерапией литием или с плацебо-профилактикой [Weisler RH et al, 2011].
До начала двойной слепой фазы данного исследования все пациенты получали в открытом режиме кветиапин в гибких, индивидуально подобранных дозах (от 300 до 800 мг/сут) с целью острого, купирующего лечения аффективного эпизода, в течение некоторого срока (от 4 до 24 недель), и должны были достигнуть клинической стабилизации или ремиссии аффективного эпизода. Всего таких пациентов было 2438 человек. Из них 1126 человек (50,3%) дали предварительное согласие на участие в двойной слепой фазе данного РКИ, и 1226 человек (95,6% от давших предварительное согласие и нацеленных на продолжение профилактического лечения) – фактически начали исследование [Weisler RH et al, 2011].
В двойной слепой фазе данного РКИ все эти пациенты были рандомизированы либо к продолжению приёма кветиапина в прежней дозе, либо к переводу на приём лития (с достижением концентрации в плазме крови от 0,6 до 1,2 ммоль/л), либо к переводу на приём плацебо на срок до 104 недель [Weisler RH et al, 2011].
Авторы этого РКИ показали, что как кветиапин, так и литий статистически достоверно значительно увеличивают продолжительность интермиссии при БАР 1-го типа и удлиняют время до наступления рецидива аффективного эпизода любого знака, по сравнению с плацебо (отношение рисков (OR) в случае кветиапина составило 0,29, доверительный интервал 95% от 0,23 до 0,38; p<0,0001, а в случае лития OR составил 0,46; доверительный интервал 95% от 0,36 до 0,59; p<0,0001) [Weisler RH et al, 2011].
Профилактическая эффективность кветиапина как в отношении маниакальных, гипоманиакальных и смешанных эпизодов, так и в отношении депрессивных эпизодов в этой когорте пациентов оказалась сопоставимой с таковой у лития (традиционно считающегося средством 1-й линии для поддерживающей терапии БАР 1-го типа), и в обоих случаях значительно отличалась от плацебо. Авторы данного РКИ пришли к выводу, что, по крайней мере у тех пациентов с БАР 1-го типа, у которых кветиапин был эффективен в остром купирующем лечении аффективного эпизода любого знака, кветиапин является также и эффективным средством длительной профилактики рецидивов, не уступает по эффективности литию и сохраняет свою эффективность, по крайней мере, на протяжении 104 недель (до конца исследования). Профилактическое лечение кветиапином было безопасным и хорошо переносилось, уровень ПЭ был в среднем ниже, чем в группе лития (особенно в сравнении с пациентами, вынужденными поддерживать концентрацию лития 0,9 ммоль/л и выше) [Weisler RH et al, 2011].
В другом, тоже длительном (тоже 104 недели) двойном слепом сравнительном плацебо-контролируемом РКИ, опубликованном в 2012-м году, изучали эффективность и безопасность длительной комбинированной профилактики кветиапином в сочетании со стандартным НТ (литием или вальпроатом), в сопоставлении с профилактикой стандартным НТ (литием или вальпроатом) плюс плацебо, у пациентов с БАР 1-го типа со смешанными симптомами. Здесь стоит отметить, что смешанные эпизоды БАР традиционно представляют особые трудности для лечения, как по сравнению с «чистыми» депрессивными или субдепрессивными, так и по сравнению с «чистыми» маниакальными или гипоманиакальными эпизодами [Vieta E et al, 2012].
В этом РКИ все пациенты сначала получали в открытом режиме стандартный НТ (литий или вальпроат) в сочетании с кветиапином в гибких, индивидуально подобранных дозах (от 400 до 800 мг/сут) на протяжении, по крайней мере, 12 недель. Те из них, которые на фоне этого лечения достигли клинической стабильности или ремиссии, были рандомизированы либо к продолжению приёма той же комбинации, либо к приёму того же стандартного НТ (лития или вальпроата) плюс плацебо, на срок до 104 недель [Vieta E et al, 2012].
Авторы этого РКИ сумели показать, что комбинация кветиапина (400–800 мг/сут) со стандартным НТ (литием или вальпроатом) статистически достоверно значительно удлиняет время до рецидива аффективного эпизода любого знака или смешанного эпизода, по сравнению с монотерапией стандартным НТ (литием или вальпроатом) плюс плацебо, у пациентов с БАР 1-го типа со смешанными симптомами, у которых такая комбинация ранее оказалась эффективной в остром купирующем лечении, и что профилактическая эффективность этой комбинации сохраняется по крайней мере на протяжении 104 недель лечения (то есть до конца исследования). Комбинация кветиапина с литием или вальпроатом в целом хорошо переносилась пациентами [Vieta E et al, 2012].
Более детальный апостериорный анализ данных этого РКИ показал также, что особую клиническую пользу от комбинированного профилактического лечения (кветиапин + литий или вальпроат), по сравнению с профилактической монотерапией стандартным НТ, получают пациенты с более тяжёлым течением БАР, с тенденцией к формированию быстрого цикла или континуального течения БАР, к усложнению симптоматики аффективных фаз за счёт большего их «смешивания» или присоединения психотической симптоматики [Vieta E et al, 2012].
В 2013-м году были опубликованы данные ретроспективного метаанализа двух крупных многоцентровых двойных слепых плацебо-контролируемых РКИ, в которых изучался тот же вопрос, что и в описанном нами выше исследовании, – вопрос об эффективности и безопасности комбинированной профилактики стандартным НТ (литий или вальпроат) в сочетании с кветиапином (400–800 мг/сут), в сопоставлении с монотерапией стандартным НТ (литий или вальпроат) плюс плацебо в отношении предотвращения рецидивов аффективных эпизодов любого знака у пациентов с БАР 1-го типа. Отличие от описанного нами выше исследования 2012 года состоит в том, что в этой выборке от пациентов не требовалось соответствия критериям смешанного эпизода (то есть в это РКИ включались и те пациенты с БАР 1-го типа, у которых имелись только «чистые» депрессивные и/или «чистые» маниакальные эпизоды) [Suppes T et al, 2013].
Как и описанное нами ранее исследование от 2012 года, это РКИ проводилось на протяжении 104 недель. Сначала в открытой фазе исследования пациенты получали комбинацию лития или вальпроата с кветиапином в гибкой, индивидуально подобранной дозе (от 400 до 800 мг/сут) на протяжении 12 недель, с целью купирующего лечения текущего аффективного эпизода любого знака. Те из них, которые на таком лечении достигли к сроку 12 недель клинической стабильности или ремиссии, были затем рандомизированы либо к продолжению приёма этой же комбинации в прежних дозах, либо к получению комбинации «литий или вальпроат в прежней дозе плюс плацебо» на срок до 104 недель [Suppes T et al, 2013].
Авторы этого РКИ сумели показать, что комбинированная терапия кветиапином (400–800 мг/сут) в сочетании со стандартным НТ (литием или вальпроатом) статистически достоверно значительно эффективнее в отношении профилактики рецидивов аффективных эпизодов любого знака, по сравнению с монотерапией только стандартным НТ (литием или вальпроатом) плюс плацебо, у пациентов с БАР 1-го типа, у которых эта комбинация ранее оказалась эффективной в остром купирующем лечении. Комбинированное лечение сохраняло свою эффективность, было безопасным и хорошо переносилось на сроках до 104 недель. Как и в предыдущем РКИ от 2012 года, наибольшую клиническую пользу от комбинированного лечения получали пациенты с более тяжёлым течением БАР, с тенденцией к развитию быстрого цикла или континуального течения БАР, с тенденцией к развитию смешанных состояний или психотических форм аффективных эпизодов [Suppes T et al, 2013].
Кроме того, авторы этого РКИ также обнаружили, что разные монотерапии имеют дифференциальную эффективность в отношении подавления аффективных эпизодов разных типов: монотерапия вальпроатом оказалась значительно эффективнее монотерапии литием в предотвращении рецидивов мании или смешанного состояния, а также в профилактике и купировании быстрого цикла и в редукции симптомов тревоги и паники, но не в отношении профилактики рецидивов депрессии [Suppes T et al, 2013].
Напротив, монотерапия литием в этом РКИ хорошо предотвращала рецидивы аффективных эпизодов обоего знака и сильнее, чем монотерапия вальпроатом, влияла на суицидальные тенденции, но была недостаточно эффективна при тенденции к развитию смешанных состояний или быстрой цикличности настроения [Suppes T et al, 2013].
В 2014-м году были опубликованы данные ретроспективного метаанализа, который мы подробно описывали в предыдущем разделе, посвящённом обсуждению эффективности и безопасности применения кветиапина для купирующего лечения острой биполярной депрессии. Среди прочих фактов, которые были установлены в этом метаанализе, авторы показали, что кветиапин в обеих исследованных дозах (300 и 600 мг/сут), но особенно в дозе 600 мг/сут, обладает способностью профилактировать инверсию знака эпизода из депрессии в манию, гипоманию или смешанное состояние, а также развитие быстрого цикла на фоне параллельного применения АД [Suttajit S et al, 2014].
Это имеет важное значение для планирования лечения, поскольку БАР, особенно 1-го типа, ассоциируется с высокой частотой инверсии знака эпизода или развития быстрого цикла на фоне монотерапии разными АД (в частности, селективными ингибиторами обратного захвата серотонина – СИОЗС, но особенно – мощными селективными ингибиторами обратного захвата серотонина и норадреналина (СИОЗСиН) и ещё в большей мере – трициклическими антидепрессантами (ТЦА)) [Suttajit S et al, 2014].
В том же 2014 году были опубликованы данные долгосрочного двойного слепого плацебо-контролируемого РКИ, посвящённого изучению эффективности и безопасности длительной поддерживающей монотерапии кветиапином (в дозах 300 или 600 мг/сут) в качестве средства профилактики аффективных эпизодов обоего знака в объединённой выборке пациентов, принимавших участие в «острой» фазе исследований EMBOLDEN I или II, и получавших эффективное для них лечение кветиапином в указанных дозах по поводу острой биполярной депрессии, в сравнении с плацебо-профилактикой [Young AH et al, 2014].
В общей сложности в эту выборку вошли 584 человека с БАР 1-го или 2-го типов, у которых последний зарегистрированный эпизод был депрессивным, и которые в ходе «острой» фазы исследований EMBOLDEN I или II вошли в ремиссию по линии депрессивной симптоматики после
8 недель лечения кветиапином в дозе 300 или 600 мг/сут. Все они были рандомизированы к получению либо кветиапина в прежней дозе, либо плацебо, на протяжении длительного времени (от 26 до 52 недель) [Young AH et al, 2014].
Авторы этого РКИ сумели показать, что длительное поддерживающее лечение кветиапином в обеих исследованных дозах (300 или 600 мг/сут) у пациентов с БАР 1-го или 2-го типов, у которых кветиапин ранее оказался эффективным в купировании острой биполярной депрессии, эффективно и безопасно в отношении профилактики аффективных эпизодов обоего знака, особенно – депрессивных и субдепрессивных эпизодов, в меньшей мере – маниакальных, гипоманиакальных и смешанных эпизодов, и что эта эффективность у кветиапина сохраняется как минимум до 52 недель, то есть до конца исследования [Young AH et al, 2014]
Профилактическая эффективность дозы 600 мг/сут в отношении маний, гипоманий и смешанных состояний оказалась выше, чем эффективность дозы 300 мг/сут, тогда как в отношении профилактики депрессий значимых различий между дозами обнаружено не было. Кветиапин в обоих изученных дозовых режимах в целом хорошо переносился даже при длительной терапии, по крайней мере на сроках до 52 недель [Young AH et al, 2014].
Заключение
Как видно из приведённых нами данных литературы, произошедшее в последние десятилетия существенное расширение и смягчение критериев диагностики БАР 2-го типа и циклотимии, в сочетании с введением концепции РБС, включая «мягкие», стёртые и даже субклинические формы РБС, вызвали значительное повышение частоты диагностики БАР 2-го типа, циклотимии и «другого и неуточнённого БАР», а также переклассификацию значительной части пациентов, ранее считавшихся униполярными депрессивными, в категорию страдающих тем или иным РБС (БАР 2-го типа, циклотимией или «другим и неуточнённым БАР»). Это, в свою очередь, вызвало значительное повышение интереса как фармацевтических компаний, так и широкой медицинской общественности к поиску и разработке новых средств и методов лечения БАР и РБС, а также к исследованию эффективности и безопасности применения в лечении БАР и РБС уже существующих, ранее выведенных на рынок по другим показаниям лекарств – в частности, ряда новых ААП, некоторых новых АК, таких как ламотриджин.
С другой же стороны, объективные трудности в дифференциальной диагностике между шизофренией, ШАР и БАР, растущее понимание того, что эти три клинические сущности представляют собой не три принципиально различные категории, а некий непрерывный шизо-биполярный спектр, а также разногласия между специалистами из разных научных школ по поводу диагностических критериев ШАР и по поводу правомерности отнесения самой категории ШАР к шизофреническому или же к аффективному спектру (здесь существует два противоположных диагностических подхода – согласно одному взгляду на эти вещи, «даже намёк на шизофрению есть шизофрения», согласно другому – «даже намёк на БАР есть БАР», как пишет Стивен М. Шталь) – объективно порождают запрос на расширение применения психотропных препаратов, способных оказать положительное воздействие одновременно и на психотическую, и на аффективную (депрессивную, маниакальную и дисфорическую), и на тревожную и диссомническую симптоматику. К таким универсальным препаратам относятся некоторые из современных ААП. Исторически первым ААП, убедительно показавшим подобную универсальность действия, был герой нашего сегодняшнего обзора – кветиапин. По сей день он остаётся одним из самых популярных и часто назначаемых препаратов для лечения БАР и РБС. Он может применяться – и широко применяется – во всех фазах лечения БАР и РБС – как для купирующего лечения острых биполярных депрессий, для купирования острых маниакальных, гипоманиакальных и смешанных состояний, так и для профилактики рецидивов аффективных эпизодов обоего знака, как в монотерапии, так и в комбинациях с другой ПФТ. Так же, как это было со всеми прочими АП, первоначально кветиапин получил одобрение FDA только для купирующего лечения острой шизофрении и для профилактики рецидивов шизофрении. Однако позже, на основании многочисленных данных двойных слепых плацебо-контролируемых РКИ, было убедительно показано, что кветиапин достоверно эффективен и безопасен как в купирующем лечении острых биполярных депрессий, острых маниакальных, гипоманиакальных и смешанных состояний, так и в поддерживающем лечении БАР (в профилактике рецидивов аффективных эпизодов обоего знака), как в монотерапии, так и в комбинациях с другой ПФТ. Это привело к официальному утверждению FDA данного расширения списка показаний. Подобно ряду других ААП, кветиапин также показал хорошие данные по эффективности и безопасности для потенцирования (аугментации) эффекта АД при униполярных ТРД. Он имеет официальное утверждение FDA и по этому показанию.
Кроме того, кветиапин – один из немногих среди ААП, который показал себя также эффективным и безопасным монотерапевтическим средством как для острого (купирующего), так и для профилактического лечения униполярных депрессивных расстройств (БДР и РДР), в том числе – он показал свою пригодность при униполярных депрессиях в качестве первой линии терапии. Это – большая редкость среди ААП (навскидку можно вспомнить только доказанную эффективность монотерапии малыми дозами сульпирида или амисульприда при дистимиях и униполярных депрессиях лёгкой и средней степени тяжести). Накоплены многочисленные данные о положительном влиянии кветиапина также на течение тревожных и диссомнических расстройств. Это тоже имеет важное значение в контексте выбора оптимальной стратегии лечения БАР и РБС, так как эти расстройства часто сопровождаются симптомами тревоги, нарушениями сна, или даже оказываются коморбидны с теми или иными полносиндромными тревожными расстройствами и/или с первичными диссомническими расстройствами.
Важным преимуществом применения кветиапина для лечения БАР и РБС перед рядом альтернативных опций является его очень хорошая переносимость и хороший профиль безопасности. Так, в частности, кветиапин, в отличие от лития, не обладает кумулятивной нефро- и тиреоидной токсичностью. В отличие от карбамазепина и вальпроатов, кветиапин не обладает клинически значимой гемато-, гепато- или панкреатической токсичностью, не вызывает раздражения желудка или лекарственных гастропатий, не ухудшает состояния волос, кожи, ногтей.
Также кветиапин в гораздо меньшей мере, чем большинство других ААП (исключая «стоящий особняком» клозапин), склонен вызывать проявления ЭПС и акатизии. Он крайне редко вызывает развитие ЗНС (все описанные в литературе случаи ЗНС на кветиапине являются редкой казуистикой, причём все эти пациенты до кветиапина получали другие АП, в силу чего достоверно установить, что причиной развития ЗНС был именно кветиапин, а не ранее назначенный АП, ни в одном из этих случаев не представляется возможным). Он не вызывает развития феномена гиперчувствительности стриатальных D2 рецепторов и поэтому имеет очень низкий риск развития ПД при длительной терапии (опять-таки, все описанные случаи возникновения ПД на кветиапине являются казуистическими, и во всех этих случаях пациенты раньше получали другие АП, так что связь ПД с применением кветиапина неясна).
Это весьма важно с учётом того, что пациенты с БАР и РБС в большей мере, чем пациенты с расстройствами психотического спектра (например, с шизофренией и ШАР), склонны к развитию ЭПС и акатизии при терапии АП, и имеют более высокий, по сравнению с психотическими пациентами, риск развития ЗНС и риск развития ПД при длительной терапии АП.
Тот факт, что кветиапин является сравнительно низкопотентным ААП (его рабочие дозы измеряются сотнями миллиграммов, а не единицами или десятками, как у ряда других ААП), наряду с выраженной дозовой зависимостью его фармакологических эффектов (в малых дозах кветиапин оказывает преимущественно снотворно-седативное действие, в средних – антидепрессивное и анксиолитическое, в более высоких – антипсихотическое и антиманиакальное) – позволяет очень гибко индивидуально подбирать дозу кветиапина для каждого пациента с БАР или РБС и варьировать её сообразно динамике течения болезни, в соответствии с тем, какой эффект от кветиапина нужен именно в данный момент времени.
Кветиапин менее склонен вызывать метаболические ПЭ (ожирение, гиперхолестеринемию, дислипидемию, гипергликемию), чем, например, оланзапин или клозапин. Однако, поскольку этот риск при применении кветиапина существует, необходимо следить за динамикой массы тела пациента, его липидным и гликемическим профилем, и своевременно предпринимать меры по профилактике и коррекции метаболических ПЭ (диета, физическая активность, адъювантное назначение метформина и т. д.). Резюмируя всё вышесказанное, можно сказать, что кветиапин заслуживает гораздо более широкого, чем сегодня, применения в лечении аффективных расстройств (в первую очередь, конечно, БАР и РБС, но также и униполярных депрессий) на просторах СНГ и России. В этой области стоит позаимствовать опыт наших западных коллег.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2022
Эффективность и безопасность кветиапина в лечении расстройств биполярного спектра №02 2022
Абстракт
Расширение и смягчение диагностических критериев биполярного аффективного расстройства (БАР) 2-го типа и циклотимии, а также введение концепции «расстройств биполярного спектра» (РБС), включая «мягкие», стёртые и субклинические формы РБС, привели к значительному повышению частоты диагностики БАР 2-го типа, циклотимии и «другого и неуточнённого БАР» в последние десятилетия, а также к переклассификации значительной части пациентов, ранее считавшихся униполярными депрессивными, в категорию страдающих БАР 2-го типа или каким-либо из РБС.Это закономерно вызвало повышение интереса как фармацевтических компаний, так и широкой медицинской общественности к поиску новых средств и методов лечения БАР и РБС и к исследованию эффективности и безопасности для лечения БАР и РБС ряда уже существующих, ранее выведенных на рынок препаратов – например, некоторых атипичных антипсихотиков (ААП), или некоторых новых антиконвульсантов (АК), таких как ламотриджин. С другой же стороны, объективные трудности в дифференциальной диагностике между шизофренией, шизоаффективным расстройством (ШАР) и БАР, наряду с некоторыми другими факторами, – вызвали повышение интереса к использованию препаратов, способных одновременно оказать положительное влияние как на психотическую, так и на аффективную (депрессивную, маниакальную и/или дисфорическую), и на тревожную и диссомническую симптоматику. В данной статье мы показываем, почему кветиапин является одним из наиболее оправданных препаратов выбора для лечения БАР и РБС, как в острых эпизодах (купирующее лечение), так и в качестве поддерживающей терапии, для профилактики рецидивов аффективных эпизодов обоего знака, и детально рассматриваем доказательную базу для этих утверждений.
Ключевые слова: кветиапин, биполярное аффективное расстройство, расстройства биполярного спектра, шизофрения, шизоаффективное расстройство, биполярная депрессия, маниакальное состояние, смешанное состояние.
Для цитирования: P.А. Беккер, Ю.В. Быков, А.Ю. Быкова, П.В. Морозов. Эффективность и безопасность кветиапина в лечении расстройств биполярного спектра. Психиатрия и психофармакотерапия. 2022; 2: 46–66.
Расширение и смягчение диагностических критериев биполярного аффективного расстройства (БАР) 2-го типа и циклотимии, а также введение концепции «расстройств биполярного спектра» (РБС), включая «мягкие», стёртые и субклинические формы РБС, привели к значительному повышению частоты диагностики БАР 2-го типа, циклотимии и «другого и неуточнённого БАР» в последние десятилетия, а также к переклассификации значительной части пациентов, ранее считавшихся униполярными депрессивными, в категорию страдающих БАР 2-го типа или каким-либо из РБС.Это закономерно вызвало повышение интереса как фармацевтических компаний, так и широкой медицинской общественности к поиску новых средств и методов лечения БАР и РБС и к исследованию эффективности и безопасности для лечения БАР и РБС ряда уже существующих, ранее выведенных на рынок препаратов – например, некоторых атипичных антипсихотиков (ААП), или некоторых новых антиконвульсантов (АК), таких как ламотриджин. С другой же стороны, объективные трудности в дифференциальной диагностике между шизофренией, шизоаффективным расстройством (ШАР) и БАР, наряду с некоторыми другими факторами, – вызвали повышение интереса к использованию препаратов, способных одновременно оказать положительное влияние как на психотическую, так и на аффективную (депрессивную, маниакальную и/или дисфорическую), и на тревожную и диссомническую симптоматику. В данной статье мы показываем, почему кветиапин является одним из наиболее оправданных препаратов выбора для лечения БАР и РБС, как в острых эпизодах (купирующее лечение), так и в качестве поддерживающей терапии, для профилактики рецидивов аффективных эпизодов обоего знака, и детально рассматриваем доказательную базу для этих утверждений.
Ключевые слова: кветиапин, биполярное аффективное расстройство, расстройства биполярного спектра, шизофрения, шизоаффективное расстройство, биполярная депрессия, маниакальное состояние, смешанное состояние.
Для цитирования: P.А. Беккер, Ю.В. Быков, А.Ю. Быкова, П.В. Морозов. Эффективность и безопасность кветиапина в лечении расстройств биполярного спектра. Психиатрия и психофармакотерапия. 2022; 2: 46–66.
On the efficacy and safety of quetiapine in the treatment of bipolar spectrum disorders
R.A. Bekker1, Yu.V. Bykov2, A.Yu. Bykova2, P.V. Morozov3
Abstract
Expansion and softening of the formal diagnostic criteria for bipolar affective disorder type 2 and for cyclothymia, as well as the introduction of the concept of «bipolar spectrum disorders», including mild and subclinical forms of these, led to a significant increase in the frequency of de novo diagnosis of bipolar disorder type 2, cyclothymia and «bipolar disorder not otherwise specified» in recent decades. It also led to the reclassification of a significant proportion of patients, which were previously considered to suffer from unipolar depressive disorders, to the category of bipolar disorder type 2, or to any of the «soft / mild bipolar spectrum» disorder subtypes. This, naturally, caused an increase in the interest of both pharmaceutical companies and the general medical community in the search for new drugs and methods of treating bipolar affective disorder and bipolar spectrum disorders, as well as an increase in the interest in research of the efficacy and safety in this regard of a number of already existing drugs, which were previously introduced to the market for other purposes. Examples are some atypical antipsychotics, and some newer anticonvulsants, such as lamotrigine. On the other hand, objective difficulties in the differential diagnosis between schizophrenia, schizoaffective disorder and bipolar disorder, along with some other factors, caused an increase in interest in the use of drugs that can simultaneously have a positive effect on both psychotic and affective (depressive, manic and / or dysphoric), as well as anxious and dyssomnic symptoms. In this article, we show why quetiapine is one of the drugs of choice for the treatment of bipolar affective disorder and bipolar spectrum disorders, both in acute episodes (bipolar depression, bipolar mania or hypomania, bipolar mixed states), and as maintenance therapy to prevent relapses of affective episodes of both types, as well as mixed episodes. We also discuss in detail the evidence base for the above statements.
Keywords: quetiapine, bipolar affective disorder, bipolar spectrum disorders, schizophrenia, schizoaffective disorder, bipolar depression, manic state, mixed state.
For citation: R.A. Bekker, Yu.V. Bykov, A.Yu. Bykova, P.V. Morozov. On the efficacy and safety of quetiapine in the treatment of bipolar spectrum disorders. Psychiatry and psychopharmacotherapy. 2022; 2: 46–66.
Введение
Вплоть до последних нескольких десятилетий биполярное аффективное расстройство (БАР), традиционно определявшееся в «жёстком», дихотомическом, крепелинском смысле (как современный аналог введённой Эмилем Крепелиным концепции «маниакально-депрессивного психоза» – МДП), считалось состоянием, которое достаточно редко встречается как в общей популяции (включающей не диагностированных и/или не обращавшихся к врачу потенциальных пациентов), так и в повседневной клинической практике (то есть среди пациентов, уже попавших под наблюдение врачей) [Mitchell PB, 2012; Stahl SM, 2013].
Однако, начиная с 1990-х, а особенно с 2000-х годов, изначальная диагностическая концепция БАР претерпела значительное расширение. В эти годы была предложена новая концепция расстройств биполярного спектра (РБС). В рамках этой концепции некоторые довольно обычные и не так уж редко встречающиеся симптомы и проявления депрессии, например, такие как выраженная раздражительность, дисфоричность, агрессивность, выраженная аффективная неустойчивость (нестабильность настроения, аффекта), психомоторное возбуждение (ажитация) или тревога, выраженная бессонница со снижением потребности во сне (а не с ощущением «невыспанности», как обычно при депрессиях), резко выраженные суточные колебания настроения, а также проявления «реакции активации» в ответ на применение антидепрессантов (АД), – стали трактоваться как возможные проявления «смешанного состояния», или, вернее, как возможные проявления «маниакальной стороны болезни» в данном депрессивном эпизоде. Сами же такие пациенты стали рассматриваться как подозрительные на возможную «биполярность», или даже как явно принадлежащие к «мягкой» части спектра РБС [Mitchell PB, 2012; Stahl SM, 2013].
В общей сложности, известный исследователь аффективных расстройств Хагоп Акискал предложил подобным образом ввести 7 подтипов «мягких форм» БАР или РБС. На их детальном описании мы здесь не будем останавливаться, и отправим интересующегося этим вопросом читателя к отличной книге профессора Стивена Шталя «Essential Psychopharmacology: Neuroscientific Basis and Practical Applications». В главе об аффективных расстройствах этой книги данная концепция Х. Акискала излагается весьма детально и полно [Stahl SM, 2013].
Вполне естественно, что такое расширение диагностических критериев БАР и РБС повлекло за собой диагностическую переквалификацию значительного количества пациентов, которые ранее считались страдающими униполярным большим депрессивным расстройством (БДР) или униполярным рекуррентным депрессивным расстройством (РДР), – в категорию страдающих той или иной «мягкой формой» БАР или РБС. Оно также закономерно повлекло за собой значительное увеличение количества выставляемых de novo (т. е. первичным, ранее не обращавшимся к врачу, пациентам) диагнозов БАР [Mitchell PB, 2012].
Такое увеличение частоты диагностирования БАР произошло в основном за счёт увеличения частоты выставления диагноза БАР 2-го типа, для которого в DSM-5 диагностические критерии были значительно смягчены и расширены по сравнению с диагностическими критериями, предусмотренными DSM-IV-TR и МКБ-10, а также за счёт увеличения частоты выставления диагноза «другое и неуточнённое БАР», которым кодируются по DSM или МКБ «мягкие» подтипы БАР, введённые Х. Акискалом, но пока отсутствующие в официальных диагностических классификациях DSM и МКБ. В то же время частота диагностирования БАР 1-го типа (т. е. «классического БАР», примерного аналога МДП Э. Крепелина) подверглась значительно меньшим изменениям за последние десятилетия [Mitchell PB, 2012; Stahl SM, 2013].
Традиционно было принято считать, что общая распространённость БАР в популяции составляет всего лишь около 1% (разные оценки дают разброс распространённости БАР от 0,5% до 1,5-2%). Однако более поздние эпидемиологические исследования показывают, что общая распространённость БАР и РБС в популяции, с учётом существования их «мягких» и даже подпороговых, субклинических форм, – значительно выше. Она может достигать
5-10%, в зависимости от того, какие диагностические критерии использовать и насколько расширительно (или, наоборот, рестриктивно) их трактовать [Ghouse AA et al, 2013; Stahl SM, 2013].
Расширение и смягчение критериев диагностики БАР и РБС и вызванное этим увеличение количества ежегодно выявляемых de novo или переклассифицируемых из униполярных БДР и РДР случаев БАР и РБС – закономерно вызвали повышение интереса самых разных фармацевтических компаний как к разработке новых лекарств, потенциально могущих оказаться эффективными и безопасными средствами для лечения БАР и РБС, так и к исследованию потенциальной эффективности и безопасности при БАР и РБС уже присутствующих на рынке, ранее уже выпущенных этими компаниями психотропных и нейротропных лекарств, изначально имевших другое предназначение – например, атипичных антипсихотиков (ААП), изначально предназначавшихся для лечения шизофрении, или новых антиконвульсантов (АК), изначально предназначавшихся для лечения эпилепсии, таких, например, как ламотриджин [Mitchell PB, 2012; Stahl SM, 2013].
Касается это и героя нашего нынешнего обзора – ААП кветиапина [Stahl SM, 2013].
Проблема возможной гипердиагностики расстройств биполярного спектра и гиподиагностики шизофрении и шизоаффективного расстройства в ряде стран мира
Так же как и для всех остальных психических расстройств, для БАР и для РБС до настоящего времени пока не найдены какие-либо объективные и достоверные биохимические, электро-нейрофизиологические, нейровизуализационные или генетические методы диагностики, которые бы позволяли с достаточной степенью чувствительности и специфичности подтвердить или, наоборот, опровергнуть диагноз БАР или РБС [Iordache I, Low NC, 2010].
Между тем во всех остальных областях медицины объективные инструментальные и лабораторные методы диагностики и дифференциальной диагностики самых различных заболеваний уже давно стали не просто «общим местом», но «золотым стандартом» в диагностической работе врачей соответствующих специальностей [Iordache I, Low NC, 2010].
Таким образом, сегодня, как и столетие назад, во времена Э. Крепелина, диагноз БАР или РБС ставится преимущественно клинически – на основании наблюдения за поведением пациента (то есть за внешними проявлениями его болезни), на основании клинической беседы или расспроса пациента о его/её жалобах, о беспокоящих его или её симптомах болезни, опроса третьих лиц (родственников и близких) о поведении пациента, а также на основании тщательного сбора и оценки личного и семейного анамнеза, включая анамнез болезни, анамнез жизни и развития пациента, лекарственный анамнез, и последующего использования формальных диагностических критериев DSM или МКБ для БАР, а также использования стандартизованных рейтинговых диагностических шкал или структурированных опросников для оценки симптомов болезни и динамики её течения [Iordache I, Low NC, 2010].
Между тем уже достаточно давно было показано, что при любой, даже самой высокой степени тщательности подхода к сбору и оценке личного и семейного анамнеза, к единообразному у разных врачей применению формальных диагностических критериев DSM или МКБ, к рутинному применению стандартизованных диагностических шкал и структурированных опросников для оценки симптомов тех или иных болезней – в современной психиатрической диагностике, в том числе и в вопросах диагностики БАР и РБС, всё равно остаётся значительная доля субъективизма и ненадёжности [Iordache I, Low NC, 2010].
Это обуславливает значительные различия в частоте выставления тех или иных диагнозов разными врачами-психиатрами, даже при виде одного и того же пациента (inter-rater variability) [Iordache I, Low NC, 2010].
С другой же стороны, повышение осведомлённости как врачей, так и широкой общественности о БАР и РБС во многих странах повлияло на повышение склонности врачей к диагностике БАР и РБС и создало условия для возможного расцвета гипердиагностики этих расстройств в данных странах, в том числе – за счёт возможного снижения частоты диагностирования в этих странах других психических расстройств, например, таких, как униполярное БДР и РДР, синдром дефицита внимания и гиперактивности (СДВГ), пограничное расстройство личности (ПРЛ), шизофрения и шизоаффективное расстройство (ШАР) и др. [Zimmerman M et al, 2008].
Действительно, не всегда легко провести чёткую дифференциально-диагностическую грань между такими психическими расстройствами, как униполярное БДР или РДР, с одной стороны, – и ≪мягкие формы≫ БАР/РБС, с другой, или как ПРЛ с выраженными аффективными проявлениями, с одной стороны, – и БАР/РБС, с другой, или как ШАР, БАР и шизофрения с выраженными аффективными проявлениями (о последней проблеме мы ещё будем отдельно говорить ниже). У детей и подростков также часто вызывает трудности дифференциальная диагностика БАР/РБС и проявлений СДВГ, тем более что они часто бывают коморбидны [Zimmerman M et al, 2008; Stahl SM, 2013; 2015; Ruiz P et al, 2017].
Проблема необоснованной гипердиагностики БАР и РБС у детей и подростков с самыми различными аффективными нарушениями, часто вообще не укладывающимися или плохо укладывающимися в «классическую» картину БАР или РБС (что нередко списывают на «особенности течения БАР/РБС в детском или подростковом возрасте», или на возможную «коморбидность с СДВГ»), – стала настолько острой в ряде стран, что это вызвало даже необходимость введения в DSM-5 специальной диагностической категории «дизрегулятивное расстройство настроения детского возраста» (disruptive mood dysregulation disorder of childhood) – введённой специально для того, чтобы таким детям и подросткам не ставили необоснованно диагнозы БАР или РБС [Stahl SM, 2013; Ruiz P, 2017].
Ещё один любопытный аспект данной проблемы состоит в том, что на фоне общемировой тенденции к снижению стигматизации пациентов с БАР и РБС в последние десятилетия, во многих странах и во многих субкультурах проявилась тенденция к необоснованной романтизации и поэтизации диагноза БАР [Stahl SM, 2015].
Как указывает проф. Стивен М. Шталь в описании одного из клинических случаев в своей книге Case Studies II, диагноз БАР 2-го типа стал в последние десятилетия, в некотором роде, «модным» в определённых кругах, особенно среди молодёжи – вплоть до того, что некоторые современные молодые люди, никогда в реальности не обращавшиеся к врачу и не получающие никакого официального лечения (и объективно не нуждающиеся в лечении, и не испытывающие в нём никакой субъективной потребности), – сами себе безосновательно ставят диагноз БАР 2-го типа, а затем бравируют или хвастаются им перед друзьями и близкими [Stahl SM, 2015].
Некоторые же пациенты, страдающие внешне в чём-то сходными психическими расстройствами, например, униполярным БДР, РДР, ПРЛ или СДВГ, могут добиваться – и часто успешно добиваются – формально «более тяжёлого» диагноза БАР 2-го типа с целью получения финансовых выгод, инвалидности, социальной помощи и т.п., или с целью получения более интенсивного лечения, порой даже прибегая к симуляции или аггравации симптомов смешанного или гипоманиакального состояния ради получения такого диагноза [Stahl SM, 2015].
Всё это, разумеется, тоже вносит свой вклад в копилку нынешней тенденции к гипердиагностике БАР и РБС в ряде стран [Stahl SM, 2015].
С другой же стороны, диагностический термин «шизофрения» и любые другие диагностические термины с корнем «шизо-» (включая термин ШАР), в отличие от диагностических терминов БАР и РБС, по сей день воспринимаются в общественном сознании как стигматизирующие, дискриминационные и даже пейоративные (оскорбительные) термины. Диагноз шизофрении, в отличие от диагноза БАР, не только не подвергся романтизации и поэтизации в общественном сознании последних десятилетий, но, напротив, до сих пор остаётся одним из самых страшных, непонятных и пугающих для простых обывателей – настолько, что лиссофобия (страх сойти с ума) у пациентов с тревожными расстройствами часто принимает специфическую форму именно шизофобии (страха заболеть именно шизофренией, а не чем-либо другим) [Bergsholm P, 2016].
На основании этих данных в некоторых странах, например в Японии в 2002-м году и в Южной Корее в 2012-м году, шизофрения была официально переименована. Более поздние исследования показали, что это переименование вовсе не было простой формальностью или «данью политкорректности», и что оно объективно способствовало снижению стигматизации и дискриминации пациентов с данным заболеванием, а также улучшению коммуникации пациентов с врачами и повышению их комплаентности к лечению [Lee YS et al, 2014].
Так, было показано, что в сознании молодых японцев термин «шизофрения» раньше прочно ассоциировался с представлениями об априорной агрессивности, априорно неадекватном поведении, априорной склонности к насилию и к совершению общественно-опасных преступлений такими людьми – хотя специалисты знают, что такое представление, в общем и целом, лишено оснований, и что на самом деле лишь малая часть пациентов с шизофренией совершает уголовно наказуемые деяния. После же официального переименования шизофрении в Японии восприятие пациентов с этой болезнью в сознании молодых японцев значительно улучшилось [Takahashi H et al, 2009].
Многие западные специалисты, вслед за японцами и южнокорейцами, сегодня тоже полагают, что шизофрения – термин устаревший и научно некорректный, и что настало, наконец, время для поиска адекватной замены этому термину – не в последнюю очередь потому, что сам термин «шизофрения», на их взгляд, уводит мысль врача в сторону от других аспектов диагностики состояния пациента с этим диагнозом, кроме оценки наличия или отсутствия у него психотических симптомов, и от других аспектов лечения пациента с этим диагнозом, помимо применения антипсихотиков (АП) [Lasalvia A et al, 2015].
Как указывает ряд авторов, это особенно касается лечения аффективных расстройств (или аффективной симптоматики в рамках всё той же шизофрении), поскольку аффективная симптоматика может маскироваться – и часто маскируется – наличием выраженной психотической симптоматики. А это потенциально может приводить к ошибкам и в диагностике, и в лечебной тактике [Stahl SM, 2013; 2015]
Между тем, как указывает проф. Стивен М. Шталь, грубой врачебной ошибкой является как недостаточное внимание или невнимание к выявлению и устранению аффективной и тревожной симптоматики у пациентов с психозами (т. е. неназначение или недостаточно активное назначение им АД, анксиолитиков (АЛ) и/или нормотимиков (НТ) там, где они объективно показаны), так и обратное – недостаточное внимание или невнимание к выявлению и устранению психотической симптоматики у пациентов с аффективными расстройствами (т. е. неназначение или недостаточно активное назначение им АП, в первую очередь ААП, там, где они объективно показаны) [Stahl SM, 2013; 2015].
Настроение и мышление – очень тесно связаны. Тревожная и аффективная (в первую очередь – депрессивная) симптоматика часто встречается при шизофрении. И напротив, психотическая симптоматика часто встречается при аффективных расстройствах обоего знака, особенно при тяжёлых их формах [Bergsholm P, 2016; Ruiz P et al, 2017].
Депрессивная симптоматика сегодня рассматривается как один из очень важных, едва ли не центральных субдоменов шизофренического психоза – настолько, что входящая как в субдомен депрессивной симптоматики, так и в субдомен негативной симптоматики ангедония (утрата или снижение способности испытывать радость и удовольствие от жизни) – сегодня считается частью «эндофенотипа» шизофрении, одним из её ключевых, ядерных симптомов [Bergsholm P, 2016; Ruiz P et al, 2017].
Как указывает П. Бергсхольм, со временем само понятие шизофрении может исчезнуть. По его мнению, диагноз шизофренического психоза может быть со временем охарактеризован как устаревший, научно некорректный и в целом неудачный [Bergsholm P, 2016].
Ряд авторов, таких как проф. Стивен М. Шталь или С. М. Шварц с Э. Шортером, также указывают, что хроническое, тяжёлое или психотическое аффективное расстройство зачастую бывает внешне трудно отличимо или вообще неотличимо от шизофрении или какого-либо другого параноидного психоза, особенно в тех, к сожалению, нередких случаях, когда эти пациенты длительное время не получают оптимального лечения [Swartz CM, Shorter E, 2007; Stahl SM, 2013; 2015].
Вместе с тем большая сложность, гетерогенность и полиморфность клинических симптомов как аффективных расстройств, так и, в особенности, шизофрении и ШАР, а также значительные межиндивидуальные различия в степени тяжести симптоматики, в длительности течения расстройства, в уровне интеллекта и образования, в личном и семейном бэкграунде и в реакции на пробное лечение – могут очень сильно затруднять правильную дифференциальную диагностику того или иного из этих расстройств. Кроме того, многие пациенты как с аффективными расстройствами, так и с шизофренией и ШАР, на самом деле довольно сильно «не вписываются» в строгие формальные диагностические критерии для того или иного из этих расстройств. Особенно часто такое бывает в начале болезни (при более длительном наблюдении многое может стать яснее) [Stock EM et al, 2018].
Ошибки в дифференциальной диагностике между шизофренией, ШАР и БАР могут быть результатом большой гетерогенности, полиморфизма и разнообразия клинических проявлений всех трёх этих расстройств, при том, что многие из их симптомов частично перекрываются между собой [Blow FC et al, 2004].
Расплывчатость диагностических критериев, определяющих как шизофрению и ШАР, так и аффективные расстройства, несоответствие этих критериев в разных диагностических системах, а также различия в их субъективной трактовке разными специалистами, по сей день продолжают создавать серьёзные проблемы для оценки относительной и абсолютной распространённости в популяции как шизофрении и ШАР, так и аффективных расстройств [Tandon R et al, 2008].
Проблема дифференциальной диагностики шизофрении, ШАР и БАР (и вообще аффективных расстройств) осложняется ещё и тем, что, по-видимому, никаких трёх отдельных, дискретных диагностических категорий для шизофрении, ШАР и БАР не существует в клинической реальности (т. е. что это в действительности не более чем удобные, но не очень отражающие реальность ярлыки). По-видимому, в действительности более верным является представление о шизофрении, ШАР и аффективных расстройствах как о некоем непрерывном шизо-биполярном спектре, а не как о трёх отдельных диагностических категориях. Об этом, в частности, говорит растущее количество данных продольных и семейных генетических исследований, которые показывают, что гены, создающие предрасположенность к шизофрении, ШАР и аффективным расстройствам, в значительной степени перекрываются [Zimmermann P et al, 2009; Stahl SM, 2013; 2015; Ruiz P et al, 2017].
Иллюстрируя трудности дифференциальной диагностики между шизофренией, ШАР и БАР, проф. Стивен М. Шталь в своей книге Case Studies II описывает женщину, у которой за 20 лет болезни диагноз циклически менялся между этими тремя сущностями 20 раз (!), причём иногда разные диагнозы в разных эпизодах болезни ей ставил один и тот же психиатр. При этом автор указывает, что лечить надо не болезнь или формальный диагностический ярлык, а пациента, и что следует использовать синдромальный подход к лечению, независимо от текущего диагноза. В рамках этого подхода нужно стремиться устранить как аффективную и тревожную, так и психотическую симптоматику, а не тратить время на попытки выставить как можно более точный диагностический ярлык [Stahl SM, 2015].
Все эти соображения, вместе взятые, – желание избежать излишней стигматизации и дискриминации психиатрического пациента при постановке ему диагноза шизофрении или ШАР, объективные трудности в дифференциальной диагностике между шизофренией, ШАР и БАР и страх врача ошибиться в диагнозе и причинить тем самым вред пациенту, представление (достаточно обоснованное) об устарелости и научной некорректности диагноза шизофрении, а также своеобразное моральное или политическое давление как внешней социокультурной, так и внутренней профессиональной среды в пользу более частого выставления диагноза БАР, а не шизофрении или ШАР, – привели к значительному снижению частоты диагностики шизофрении и ШАР, в пользу диагноза БАР, в последние десятилетия в ряде стран Запада, а также в Японии и Южной Корее [Swartz CM, Shorter E, 2007; Bergsholm P, 2016].
Это снижение частоты диагностики шизофрении и ШАР в пользу БАР в ряде стран оказалось настолько резким и выраженным, что те же самые специалисты, которые говорили и продолжают говорить об устарелости и научной некорректности диагноза шизофрении, – заговорили об опасности «выплеснуть с водой и ребёнка», об опасности удариться в гиподиагностику шизофрении и ШАР в пользу гипердиагностики БАР, или даже о том, что такой перекос в этих странах имеет место быть уже сейчас [Swartz CM, Shorter E, 2007; Bergsholm P, 2016].
Обратная проблема – тенденция к гипердиагностике расстройств шизофренического спектра и недостаточной диагностике аффективных и тревожных расстройств в постсоветских странах
Согласно обнародованной совсем недавно, в 2016 году, статистике за 2013 год, диагноз БАР в России ставится в 0,008% всех случаев обращения за психиатрической помощью [Казаковцев БА, 2016].
Между тем общемировая статистика свидетельствует о том, что БАР, даже по строгим критериям, встречается в популяции с частотой около 1,2% [Clemente AS, 2015]. Таким образом, расхождение между российской статистикой заболеваемости БАР и общемировой – составляет ни много ни мало 150 (сто пятьдесят!) раз.
Аналогичным образом, российские статистические данные за 2010 год свидетельствуют о том, что диагнозы из группы униполярных депрессивных расстройств непсихотического уровня (большой депрессивный эпизод (БДЭ) без психотических симптомов, дистимия, рекуррентное депрессивное расстройство (РДР)) в России выставляются лишь у 0,078% обратившихся за психиатрической помощью [Демчева НК, 2012].
Общемировая же статистика даёт для распространённости униполярных депрессий непсихотического уровня цифру около 4,7% в среднем, причём в Восточной Европе распространённость выше – 5,1% [Ferrari A, 2013]. Таким образом, расхождение между российской статистикой заболеваемости униполярными депрессиями и общемировой – составляет 60 (шестьдесят!) раз.
Детальной статистики по разным подгруппам тревожных расстройств в России не ведётся вообще. Однако из статистики за 2013 год известно, что вся подгруппа F4x.xx – подгруппа «тревожных, невротических и связанных со стрессом расстройств» – составляла лишь 0,3% от общего числа обратившихся за психиатрической помощью [Казаковцев БА, 2016].
В то же время общемировая статистика даёт для распространённости всех тревожных расстройств, вместе взятых, оценку около 6,7% [Steel Z, 2014]. Таким образом, расхождение здесь составляет более 60 раз! Для такой гиподиагностики аффективных и тревожных расстройств в России есть множество причин. Одной из них является как раз гипердиагностика шизофрении (F20.xx), а также ШАР (F25.xx), шизотипического расстройства (ШТР, F21.xx) и других расстройств шизофренического спектра (РШС, F2x.xx). Она связана с целым рядом причин, например с социальными причинами (диагноз из группы F2x.xx позволяет получить инвалидность легче, чем большинство других психиатрических диагнозов), с традициями психиатрического образования в России и др. Очень часто диагнозы из этой категории выставляются, в частности, как раз пациентам с БАР, реже – с униполярным БДР или РДР (особенно – осложнившимися синдромом деперсонализации-дереализации, ДП/ДР), с ОКР, некоторыми другими тревожными расстройствами, например с социальным тревожным расстройством (СТР).
Проблема гипердиагностики шизофрении и РШС и недостаточной диагностики аффективных и тревожных расстройств в России и странах СНГ связана также и с объективными трудностями в дифференциальной диагностике шизофрении и аффективных расстройств (особенно их психотических форм), а также с тем, что побочные эффекты (ПЭ), возникающие при применении АП, вносят свой вклад в затушёвывание общей картины и в затруднение диагностики. Эти трудности иллюстрируются Таблицей 1.
Вместе с тем не вызывает никакого сомнения то, что если психиатрия в России и странах СНГ слепо последует по пути стран Запада, Японии и Южной Кореи, то рано или поздно в России и странах СНГ проявится опасность впасть в ту же ошибку, в которую уже впали указанные страны, – в ошибку гипердиагностики БАР и РБС, в ущерб диагностике шизофрении и ШАР. Конечно, если судить по сегодняшней российской статистике, до этого ещё весьма далеко. Но, как говорится, «бережёного Бог бережёт», и иметь в виду такую опасность тоже нужно.
В свете этого нам бы хотелось призвать коллег к умеренности, осторожности и взвешенности в диагностических подходах, к отказу от обеих крайностей – как от слепого подражания западным коллегам в их неумеренной и безбрежной гипердиагностике БАР и РБС, в том числе в ущерб диагностике шизофрении и ШАР, что характерно для современных западных стран, Японии и Южной Кореи, так и от традиционной в СССР гипердиагностики шизофрении и ШАР в ущерб диагностике аффективных и тревожных расстройств (в том числе БАР и РБС), что, к сожалению, пока ещё характерно для России и стран СНГ. Применение ААП с попутными нормотимическими, антидепрессивными и/или антиманиакальными свойствами для лечения как шизофрении и ШАР, так и БАР и РБС имеет то преимущество, что позволяет одновременно воздействовать как на психотическую, так и на аффективную (депрессивную и/или маниакальную) симптоматику в рамках болезни, вне зависимости от формального диагностического ярлыка, наклеенного на пациента в рамках текущей классификации. Справедливо это и для героя нашего нынешнего обзора – кветиапина [Stahl SM, 2013; 2015].
Некоторые специалисты даже полагают, что, возможно, механизм действия ААП лежит ближе к общему ядру патогенеза всех трёх этих заболеваний, чем механизм действия «классических» НТ (лития или АК), «классических» АД или типичных антипсихотиков (ТАП) [Stahl SM, 2013; 2015].
Кветиапин: общая характеристика
Кветиапин – это ААП, разработанный в 1985 году учёными компании «AstraZeneca (ранее „Zeneca“) Pharmaceuticals» [Riedel M et al, 2007].
В сентябре 1997 года кветиапин получил официальное одобрение Управления по контролю за качеством пищевых продуктов и медикаментов США (US Food and Drug Administration, US FDA), первоначально только для лечения шизофрении. В настоящее время кветиапин используется для лечения различных психических расстройств более чем в 70 странах мира, включая США, Канаду, большинство стран Западной Европы, Россию и Японию [Riedel M et al, 2007].
С химической точки зрения кветиапин представляет собой производное тиенобензодиазепина [Suttajit S et al, 2014].
Кроме того, кветиапин также получил официальное одобрение FDA для применения в качестве средства первой линии для лечения и профилактики рецидивов при униполярном БДР или РДР (как в монотерапии, так и в комбинации с другой ПФТ), и в качестве потенцирующего агента (аугментатора) к АД при терапевтически резистентных униполярных депрессиях (ТРД) [Sanford M, 2011].
По статистике, на сегодняшний день кветиапин является одним из наиболее часто назначаемых препаратов для лечения БАР. Он используется на всех этапах лечения этого расстройства, как в острых состояниях, так и для поддерживающей терапии [Plosker GL, 2012].
Накоплен также большой положительный опыт использования кветиапина для лечения целого ряда других психических патологий, в частности диссомнических и тревожных расстройств, расстройств аутистического спектра, делириозных состояний, нарушений поведения у пациентов с деменцией и др. [Hawkins SB et al, 2013].
Фармакодинамика
Поскольку кветиапин имеет широкую доказательную базу по эффективности при лечении как расстройств психотического спектра (РПС), так и при лечении аффективных, тревожных и диссомнических расстройств, то формальное причисление кветиапина к группе ААП является не совсем верным. Возможно, такое определение для кветиапина даже следовало бы признать научно некорректным. Более корректным было бы называть кветиапин многофункциональным психотропным препаратом, обладающим широким спектром фармакологического действия и дозозависимой фармакологией [Stahl SM, 2013; Muneer A, 2015].
В малых дозах (от 25 до 100–200 мг/сут) кветиапин оказывает преимущественно снотворно-седативное действие. Это обусловлено, в первую очередь, высоким сродством кветиапина к гистаминовым H1 рецепторам, для которых он является полным антагонистом [Altamura AC et al, 2012; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
В средних дозах (от 100–150 до 300 мг/сут) кветиапин оказывает выраженное (и увеличивающееся с увеличением дозы в этом диапазоне) антидепрессивное и анксиолитическое действие. Это его действие сохраняется и в более высоком (антипсихотическом) диапазоне доз, по крайней мере вплоть до дозы 600 мг/сут (более высокие дозы при биполярных и униполярных депрессиях не исследовались и официально не рекомендованы производителем) [Altamura AC et al, 2012; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
Механизм антидепрессивного и анксиолитического действия кветиапина – сложный и полирецепторный. В нём, по-видимому, играют роль как парциальный агонизм кветиапина и его основного активного метаболита – норкветиапина (N-дезметилкветиапина) – к серотониновым рецепторам 5-HT1A подтипа (по аналогии с буспироном, гепироном, вортиоксетином, вилазодоном, тразодоном, у которых тоже есть этот механизм), так и антагонизм кветиапина и особенно норкветиапина к ряду других подтипов серотониновых рецепторов – 5-HT2A и 5-HT2C, 5-HT3, 5-HT7, 5-HT6 (в порядке убывания аффинитета и клинической значимости; механизм действия здесь подобен таковому у ряда других ААП), и их антагонизм к α2 адренорецепторам (механизм действия здесь подобен таковому у миртазапина и миансерина), а также то, что норкветиапин является довольно сильным ингибитором обратного захвата норадреналина (ИОЗН; здесь механизм действия подобен таковому у ребоксетина) [Yatham LN et al, 2005; Jensen NH et al, 2008; Altamura AC et al, 2012; Silverstone PH et al, 2012; Rasmussen H et al, 2013; Björkholm C et al, 2013; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
В более высоких дозах (400–600–800 мг/сут) – кветиапин оказывает достаточно выраженное (и нарастающее с увеличением дозы в указанном диапазоне) антипсихотическое и антиманиакальное действие [Altamura AC et al, 2012; Stahl SM, 2013; 2015; 2017; Suttajit S et al, 2014; Srinivas S et al, 2020].
Так же, как и для всех остальных АП, механизм антипсихотического и антиманиакального действия кветиапина, как принято считать, связан с блокадой им D2 подтипа дофаминовых рецепторов мезолимбического пути [Altamura AC et al, 2012; Stahl SM, 2013; Suttajit S et al, 2014; Srinivas S et al, 2020].
Однако кветиапин и клозапин отличаются от всех остальных ныне известных АП тем, что имеют довольно низкое сродство к D2 подтипу дофаминовых рецепторов – настолько низкое, что даже при максимальных рекомендованных дозах кветиапина или клозапина процент занятости D2 рецепторов стриатума не превышает 50–55%, в то время как «антипсихотический порог», установленный в экспериментах с другими АП, составляет не менее 60–65%. Это заставило ряд специалистов постулировать, что кветиапин и клозапин, по-видимому, обладают также какими-то дополнительными, не связанными с D2 блокирующей активностью, механизмами антипсихотического действия. Возможно, эти механизмы и у кветиапина, и у клозапина связаны с их взаимодействием с NMDA подтипом глутаматергических рецепторов [Al Jurdi RK et al, 2010; Stahl SM, 2013; Muneer A, 2015].
Низкое сродство кветиапина и норкветиапина к D2 подтипу дофаминовых рецепторов, в сочетании с быстрой кинетикой освобождения ими рецептора (быстрой их диссоциацией из связи с этим рецептором), а также наличием у них таких дополнительных рецепторных свойств, как парциальный 5-HT1A агонизм, антагонизм к 5-HT2A,
5-HT2C, 5-HT7 подтипам серотониновых рецепторов (что приводит к реципрокному повышению уровней дофамина и норадреналина в ряде областей мозга, в частности в префронтальной коре, в нигростриарной системе), – обуславливает очень низкий уровень гиперпролактинемии при лечении им, а также низкий уровень проявления экстрапирамидного синдрома (ЭПС), в частности, лекарственного паркинсонизма (ЛП), акатизии, острых дискинезий (ОД), и низкий риск развития злокачественного нейролептического синдрома (ЗНС) при лечении кветиапином. По этим параметрам кветиапин уступает только клозапину [Kapur S et al, 2000; Mundo E et al, 2006; Stahl SM, 2013].
Эти же рецепторные свойства кветиапина обуславливают низкий риск развития при лечении им проявлений нейролептической депрессии, нейролептик-индуцированного дефицитарного синдрома (НИДС), нейролептик-индуцированных когнитивных нарушений (КН). Напротив, по данным РКИ, кветиапин способен оказывать выраженное антинегативное действие (уменьшать первичную негативную симптоматику шизофрении) и улучшать когнитивное функционирование больных, как с шизофренией и ШАР, так и с аффективными расстройствами [Stahl SM, 2013].
В отличие от всех других известных на сегодняшний день АП, кветиапин и клозапин не вызывают развития феномена апрегуляции и сенситизации (повышения количества и чувствительности) дофаминовых D2 рецепторов стриатума при длительном лечении ими. Поэтому кветиапин и клозапин практически не вызывают развития поздних дискинезий (ПД) и поздних психозов гиперчувствительности (ППГ) при длительном лечении. Более того, все описанные на сегодняшний день случаи развития ПД на фоне лечения кветиапином или клозапином являются редчайшей казуистикой, и во всех этих случаях пациенты ранее длительно получали другие АП, так что связь развития ПД с применением клозапина или кветиапина представляется сомнительной. То же самое можно сказать и о редких казуистических случаях возникновения ЗНС на фоне терапии клозапином или кветиапином [Kapur S et al, 2000; Stahl SM, 2013].
В контексте лечения депрессивных состояний весьма важно то, что кветиапин обладает уникально широким спектром нейрохимического действия, включающим в себя положительное воздействие не только на серотонинергическую и/или норадренергическую системы мозга (как у большинства традиционных АД), но также и на дофаминергическую и NMDA-глутаматергическую системы. Между тем хорошо известно, что многие симптомы депрессии, такие как ангедония, психомоторная заторможенность, социальная самоизоляция, снижение или утрата мотивации, апатия, выраженные КН, – связаны со снижением дофаминергической нейротрансмиссии в префронтальной коре (ПФК) [Stahl SM, 2013; Muneer A, 2015].
Особое значение эта уникальная широта нейрохимического действия кветиапина приобретает при терапевтически резистентных депрессиях (ТРД), многие из которых являются «дофамин-зависимыми», а также при психотических формах депрессий и при «смешанных депрессиях», при которых важно, что кветиапин гармонично сочетает в себе антипсихотическое, антиманиакальное и антидепрессивное действие [Stahl SM, 2013; Muneer A, 2015].
Парциальный агонизм норкветиапина к 5-HT1A подтипу серотониновых рецепторов гиппокампа приводит к увеличению секреции ряда трофических факторов, таких как мозговой нейротрофический фактор (Brain Derived Neurotrophic Factor, BDNF). Это, в свою очередь, влечёт за собой стимуляцию нейрогенеза, торможение апоптоза нейронов гиппокампа, накопление фосфолипидов в их мембранах и повышение пластичности и устойчивости мембран нервных клеток (и клеток в целом как таковых) к вредным воздействиям [Sümegi A, 2008; Stahl SM, 2013; Muneer A, 2015].
Высокое сродство норкветиапина к 5-HT7 подтипу серотониновых рецепторов обуславливает прокогнитивное действие кветиапина, а также способствует нормализации циркадных ритмов и архитектоники (фазовой структуры) сна. Это его рецепторное свойство также вносит вклад в общую антидепрессивную и анксиолитическую активность кветиапина. Участие 5-HT7 подтипа серотониновых рецепторов в патогенезе как самой по себе депрессии, так и, в особенности, связанных с ней КН, нарушений циркадных ритмов, нарушений фазовой структуры сна – было документировано экспериментально [Stahl SM, 2013; Muneer A, 2015].
Сильное анальгетическое действие кветиапина тоже связывают с его 5-HT7 блокирующей активностью и с модуляцией им активности NMDA рецепторов, а также с ИОЗН активностью его метаболита норкветиапина. В сумме это приводит к активации нисходящих антиноцицептивных серотонинергических и норадренергических путей от таламуса к спинному мозгу. Это свойство кветиапина может быть весьма полезным в лечении депрессий, сопровождающихся алгической симптоматикой [Stahl SM, 2013].
Кветиапин также оказывает мощное противовоспалительное действие, как за счёт влияния на гистаминовые H1 рецепторы и на ряд подтипов серотониновых рецепторов на поверхности иммунокомпетентных клеток, включая клетки микроглии, так и за счёт того, что норкветиапин является сильным ИОЗН и стимулирует адренергические рецепторы на их поверхности. Подавление секреции воспалительных цитокинов и угнетение агрессивности микроглии при применении кветиапина тоже вносит свой вклад в его общую антидепрессивную активность [Al Jurdi RK et al, 2010; Stahl SM, 2013].
Сильный антагонизм кветиапина к α1 подтипу адренергических рецепторов обуславливает такие его побочные эффекты (ПЭ), обычно преходящие и наблюдаемые только в начале терапии, как ортостатическая гипотензия (ОГ), рефлекторная тахикардия, головокружение, физическая слабость. В то же время это его свойство приводит к реципрокному повышению уровня дофамина в стриатуме, что дополнительно уменьшает риск развития ЭПС и акатизии при лечении им (по аналогии с илоперидоном). Наличие у кветиапина этого ПЭ требует принятия мер предосторожности против ОГ (таких, как увеличение потребления воды и соли, приподнятый головной конец кровати, инструктирование пациента не менять резко положение тела и т. д.) в начале терапии им, а также плавного и постепенного наращивания его доз [Al Jurdi RK et al, 2010; Stahl SM, 2013].
Сильный антагонизм кветиапина к H1 подтипу гистаминовых рецепторов обуславливает другой его частый начальный ПЭ – чрезмерную сонливость и седацию, обычно тоже преходящие по мере адаптации к препарату. Любопытно отметить, что этот ПЭ, в отличие от ОГ, является обратно дозозависимым, и реже встречается при более высоких дозах кветиапина, начиная от 200–300 мг/сут (вероятно, вследствие того, что при этих дозах начинают играть роль ИОЗН активность норкветиапина и другие «стимулирующие» рецепторные эффекты). Такая же обратная дозозависимость уровня седации от дозы характерна и для клозапина, и для миртазапина [Stahl SM, 2013].
Сочетание H1, 5-HT2C и 5-HT3 антагонизма у кветиапина и норкветиапина приводит к повышению аппетита и прибавке массы тела, и может способствовать развитию метаболических нарушений (гипергликемии, гиперхолестеринемии, дислипидемии) [Stahl SM, 2013].
Фармакокинетика
Кветиапин метаболизируется в печени в основном при участии изофермента цитохрома CYP450 3A4 до своего активного метаболита – норкветиапина (N-дезметилкветиапина) [López-Muñoz F, Alamo C, 2013].
Небольшая часть введённой дозы кветиапина метаболизируется в печени изоферментом цитохрома CYP450 2D6 в 7-гидроксикветиапин, который не обладает фармакологической активностью. Только около 1% от всей введённой дозы кветиапина выводится в неизменённом виде с мочой [López-Muñoz F, Alamo C, 2013].
Начиная с 2006 года, на Западе кветиапин доступен в формах с немедленным высвобождением (Seroquel IR) и с пролонгированным высвобождением (Seroquel XR).
В России пролонгированный препарат кветиапина появился несколько позже. Обе формы выпуска кветиапина имеют одинаковую биодоступность. Однако кветиапин в пролонгированной форме поддерживает равномерную стабильную концентрацию в плазме крови на протяжении суток. Это позволяет назначать его один раз в сутки, что более удобно для пациентов [López-Muñoz F, Alamo C, 2013; Stahl SM, 2013].
Кроме того, при применении пролонгированной формы кветиапина отсутствует резкий пик его концентрации в крови вскоре после приёма. Это уменьшает риск проявления избыточной дневной сонливости и седации, ОГ, тахикардии, головокружения или слабости на пике концентрации кветиапина в крови при лечении его пролонгированной формой [López-Muñoz F, Alamo C, 2013; Stahl SM, 2013].
Максимальная концентрация (Cmax) кветиапина в плазме крови при приёме пролонгированной его формы достигается через 6 часов. Поэтому пролонгированную форму кветиапина не следует применять в качестве снотворного на ночь, или в качестве «скоропомощного» АЛ для купирования острой тревоги (для этого годится только кветиапин с немедленным высвобождением, в малых дозах; при лечении кветиапином в пролонгированной форме можно добавлять малую его дозу (25–50–100 мг) в форме с непосредственным высвобождением на ночь в качестве снотворного, или же можно использовать дробно кветиапин с немедленным высвобождением по 25–50 мг днём при возникновении необходимости в экстренном анксиолизисе, в дополнение к регулярному приёму пролонгированного препарата) [López-Muñoz F, Alamo C, 2013; Stahl SM, 2013].
Кветиапин в форме с немедленным высвобождением – короткодействующий (T1/2 около 7 часов). Максимальная концентрация (Cmax) его в крови достигается в среднем через 2 часа. Поэтому, по крайней мере для лечения психозов и маниакальных состояний, его необходимо назначать 2 раза в сутки. В то же время РКИ показывают, что при лечении депрессий может быть эффективным – и позволить избежать чрезмерной дневной сонливости и седации (которая часто наблюдается при двукратном в сутки приёме формы с немедленным высвобождением, реже встречается, но также возможна и при применении пролонга) – однократный приём формы с немедленным высвобождением только на ночь [Bui K et al, 2013; Stahl SM, 2013; Muneer A, 2015].
В каждом конкретном случае лечения депрессии вопрос о кратности применения кветиапина и о выборе простой или пролонгированной его формы следует решать индивидуально. Скажем, при лечении ажитированных или психотических форм депрессий, смешанных депрессий – тоже лучше использовать пролонг или двукратный в сутки приём непролонга, не ограничиваясь применением непролонгированного препарата только на ночь [Bui K et al, 2013; Stahl SM, 2013; Muneer A, 2015].
Короткий T1/2 непролонгированного кветиапина, примерно соответствующий длительности нормального ночного сна (6-7 часов), делает удобным его применение в малых дозах в качестве снотворного на ночь, без риска избыточной сонливости и седации наутро [Stahl SM, 2013].
Режим дозирования
Поскольку кветиапин обладает выраженной дозовой зависимостью фармакологических эффектов и своеобразной «ступенчатостью» их включения на разных дозах, то рекомендуемый диапазон его конечных доз сильно зависит от того, какой именно эффект мы желаем получить от его применения – неспецифический снотворно-седативный, неспецифический анксиолитический и нормализующий циркадные ритмы, или антидепрессивный и специфический анксиолитический, или же антиманиакальный и антипсихотический, а также от того, какую именно психическую патологию и в какой именно фазе мы лечим с применением кветиапина [Stahl SM, 2013; Muneer A, 2015].
Рекомендуемая скорость наращивания доз кветиапина и конечные его дозы также сильно зависят от вида психической патологии, фазы лечения, от остроты и тяжести клинической ситуации, от того, насколько быстро необходимо достичь терапевтического эффекта, от индивидуальной переносимости и чувствительности к препарату, от возраста пациента и его соматического состояния, и от того, производится ли наращивание доз кветиапина амбулаторно или в стационаре [Stahl SM, 2013; Muneer A, 2015].
Так, при лечении униполярных и биполярных депрессий, а также при лечении тревожных расстройств обычно рекомендуют достаточно осторожное и постепенное начало и плавное наращивание доз кветиапина: старт с 50 мг/сут в 1-й день, со 2-го дня – 100 мг/сут, с 3-го дня – 200 мг/сут, с 4-го дня – 300 мг/сут. Рекомендуемый при этом конечный диапазон доз – 150–300 мг/сут. Допустимо, при наличии на то особенных показаний (например, при психотической форме депрессии, при ажитированных депрессиях, при смешанных депрессиях), повышать дозу и далее, до 400–600 мг/сут. Эффективность и безопасность доз выше 600 мг/сут при лечении биполярных и униполярных депрессий не исследовалась, и превышать эту дозу без особой необходимости при лечении депрессий не рекомендуется [Stahl SM, 2013; 2017; Muneer A, 2015; Ruiz P, 2017].
У пожилых и соматически ослабленных депрессивных пациентов, а также при плохой переносимости седативного и гипотензивного действия кветиапина рекомендуется наращивать его дозу медленнее, начинать с меньшей его начальной дозы (например, 25 мг/сут, а не 50 мг/сут) и ограничиваться меньшей его конечной дозой (например, 150–200 мг/сут, а не 300 мг/сут). В то же время при необходимости быстрого эффекта и при хорошей переносимости у сравнительно молодых, соматически здоровых пациентов с депрессией допустимо стартовать кветиапин сразу со 100–200 мг/сут. Такой же подход может быть применен при ажитированных депрессиях и при смешанных депрессиях, так как переносимость кветиапина достаточно сильно зависит от исходного уровня возбуждения ЦНС [Stahl SM, 2013; 2017; Muneer A, 2015; Ruiz P, 2017].
Напротив, при купирующем лечении острых маниакальных и смешанных состояний, а также острых психозов можно начинать кветиапин с более высоких начальных доз и наращивать его дозу быстрее, а конечный диапазон его доз должен быть выше, чтобы обеспечить достаточный антиманиакальный и антипсихотический эффект. Инструкция производителя рекомендует назначать при купировании острой биполярной мании в 1-й день
300 мг/сут, со 2-го дня можно при необходимости давать 400–600 мг/сут, с 3-го дня – при необходимости до
800 мг/сут. Рекомендуемый диапазон доз кветиапина при купирующем лечении острых маниакальных и смешанных состояний, а также острых психозов – 400-600-800 мг/сут [Locklear JC et al, 2013; Stahl SM, 2013; 2017; Ruiz P, 2017].
Опять-таки, если ситуация менее острая (например, если мы имеем дело с гипоманией, а не с полномасштабной, развёрнутой манией), а также у пожилых, соматически ослабленных пациентов или при плохой переносимости кветиапина, дозу его следует наращивать медленнее, начинать с меньшей дозы, и ограничиваться меньшей конечной дозой. Ориентирами здесь должен быть разум и клинический опыт врача, адекватная оценка остроты и тяжести состояния пациента и индивидуальной переносимости им препарата [Stahl SM, 2013; 2017; Ruiz P, 2017].
Для поддерживающего лечения БАР и РБС (т. е. для профилактики рецидивов аффективных эпизодов обоего знака) диапазон рекомендованных доз составляет 400–
800 мг/сут, как в монотерапии, так и в комбинациях с другими НТ (литием, вальпроатом, ламотриджином) [Muneer A, 2015; Stahl SM, 2013; 2017; Ruiz P, 2017].
Для лечения униполярных депрессий (как в монотерапии, так и в комбинации с АД) и для потенцирования эффекта АД при лечении ТРД применяется приблизительно тот же подход к дозированию кветиапина, что и при лечении биполярных депрессий. Рекомендуемые начальные дозы кветиапина при этом составляют 50 мг/сут в первые 2 дня, с увеличением до 150 мг/сут начиная с 3-4-го дня терапии [Bortnick B et al, 2011; Stahl SM, 2013; 2017; Ruiz P, 2017].
Рекомендованный для лечения униполярных депрессивных состояний диапазон конечных доз кветиапина составляет 150–300 мг/сут, как и в случае биполярных депрессий. При наличии особенных к тому показаний (психотическая форма депрессии, ажитированная депрессия, смешанная депрессия) доза кветиапина может быть увеличена и далее до 400–600 мг/сут (более высокие дозы не исследовались в этом контексте и не рекомендуются). Опять-таки, оговорки про возраст, соматическое состояние и индивидуальную переносимость применимы и здесь [Bortnick B et al, 2011; Stahl SM, 2013; 2017; Ruiz P, 2017].
Для получения анальгетического эффекта при лечении таких, например, нередко коморбидных с депрессией болевых синдромов, как глоссалгия, синдром жжения в полости рта (burning mouth syndrome), хронические головные боли напряжения, мигрень, – также рекомендуется выходить на дозу кветиапина порядка 150–300 мг/сут, при которой начинает играть существенную роль 5-HT7 блокада, а также ИОЗН активность норкветиапина [Stahl SM, 2013; 2017; Ruiz P, 2017].
Параметры эффективности и безопасности кветиапина в лечении расстройств биполярного спектра
Как известно, ААП первоначально были введены в клиническую практику прежде всего для лечения психотических расстройств, таких как шизофрения. При этом ААП показали сопоставимую с ТАП эффективность в устранении продуктивной психопатологической симптоматики (бреда, галлюцинаций, грубых нарушений поведения). Однако они оказались более эффективны, чем ТАП, в устранении негативной, когнитивной и аффективной (прежде всего депрессивной), а также тревожной симптоматики в рамках шизофрении [Meltzer HY, 2013; Stahl SM, 2013; 2017; Muneer A, 2015].
Кроме того, было также показано, что применение ААП для лечения шизофрении ассоциируется с меньшей частотой и меньшей тяжестью ЭПС и акатизии, меньшим риском развития ЗНС, меньшим риском возникновения ПД при длительной терапии, меньшим риском развития НИДС, нейролептических депрессий, нейролептик-индуцированных КН [Meltzer HY, 2013; Stahl SM, 2013; 2017; Muneer A, 2015].
Всё вышесказанное в полной мере справедливо и для кветиапина. Так, систематический обзор эффективности кветиапина при шизофрении показал, что кветиапин столь же эффективен, сколь и стандартный ТАП (галоперидол) в отношении устранения продуктивной психопатологической симптоматики шизофрении, но при этом гораздо лучше переносится, вызывает гораздо меньше ЭПС, акатизии, гиперпролактинемии, нарушений сердечного ритма на электрокардиограмме (ЭКГ), реже вызывает прибавку массы тела, намного реже галоперидола вызывает НИДС, нейролептические депрессии, и имеет преимущество в отношении устранения негативной, когнитивной, аффективной и тревожной симптоматики шизофрении [Suttajit S et al, 2013].
Вскоре после внедрения ААП в повседневную практику лечения шизофрении, предварительные клинические данные указали на то, что положительное действие ААП на аффективную и тревожную симптоматику и на когнитивное функционирование пациентов, по-видимому, проявляется вовсе не только при шизофрении и других психотических расстройствах, но также и при различных аффективных и тревожных расстройствах (включая БАР, РБС, униполярные депрессивные состояния, в частности ТРД) [Stahl SM, 2013; Gao K et al, 2014; Ruiz P, 2017].
Последовавшие за этими первыми клиническими наблюдениями многочисленные двойные слепые плацебо-контролируемые РКИ подтвердили эти предположения в отношении целого ряда ААП [Stahl SM, 2013; Gao K et al, 2014; Ruiz P, 2017].
По мере того, как о нейрохимических механизмах действия и о рецепторном профиле и фармакодинамике разных ААП стало известно больше, стало понятно, что они действительно могут обладать эффективностью в отношении различных аффективных и тревожных расстройств. В частности, было выдвинуто предположение, что высокое сродство всех известных ААП к различным подтипам серотониновых (5-HT) рецепторов ЦНС, превышающее их же сродство к D2 подтипу дофаминовых рецепторов, играет решающую роль не только в уменьшении риска возникновения ЭПС, НИДС и акатизии при лечении ими, по сравнению с лечением ТАП, но и в развитии их антидепрессивного, анксиолитического, прокогнитивного и нормотимического (тимостабилизирующего) эффекта [Yatham LN et al, 2005; Stahl SM, 2013].
При этом, однако, обнаружилось, что, в отличие от ситуации с лечением шизофрении и других расстройств шизофренического спектра, где разные ААП (за исключением «стоящего особняком» клозапина, который в этом контексте систематически оказывается эффективнее всех прочих АП, как ААП, так и ТАП) проявляют примерно сопоставимую эффективность и отличаются в основном профилем переносимости и ПЭ, – при лечении БАР и РБС разные ААП проявляют дифференциальную эффективность в отношении купирования разных типов аффективных эпизодов и в отношении поддерживающего профилактического лечения [Singh J et al, 2012; Stahl SM, 2013; Ruiz P, 2017].
Так, например, для луразидона показана эффективность при лечении и профилактике рецидивов биполярной депрессии, но (возможно, пока?) нет данных об его эффективности в купировании и профилактике биполярной мании. Для рисперидона, напротив, показана эффективность в купирующем лечении острых маниакальных эпизодов и в профилактике рецидивов мании. Но, например, в контексте лечения ТРД рисперидон в качестве потенцирующего агента в дополнение к АД оказался эффективным только на коротких промежутках времени, измеряемых несколькими неделями, но не показал способности длительно поддерживать достигнутый эффект – наоборот, при длительном применении рисперидон при ТРД оказался скорее депрессогенным (вероятно, за счёт высокой частоты гиперпролактинемии, ЭПС и акатизии при его применении) [Stahl SM, 2013; Ruiz P, 2017].
А, например, оланзапин эффективен как в монотерапии, так и в комбинациях с НТ (литием, вальпроатом) при купировании острой биполярной мании, а также при профилактике рецидивов аффективных эпизодов обоего знака (особенно маний). Но он оказался недостаточно эффективным в монотерапии при купирующем лечении острой биполярной депрессии (эффективность строго доказана в этом контексте только для комбинации оланзапин + флуоксетин) [Sanford M, Keating GM, 2012; Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
И только кветиапин, из всех известных на сегодняшний день ААП, оказался подлинно универсальным препаратом для лечения аффективных расстройств (в частности, БАР и РБС) на всех этапах болезни, как в купирующем лечении острых маниакальных, гипоманиакальных и смешанных состояний, так и в купирующем лечении острых биполярных и даже униполярных депрессий, и в профилактике рецидивов аффективных эпизодов обоего знака, как в монотерапии, так и в комбинациях с другими НТ, а также в качестве потенцирующего агента в дополнение к АД при ТРД. Именно эта универсальность кветиапина при лечении БАР и РБС, наряду с его хорошей переносимостью, вызвала к нему особый интерес и сделала его одним из самых популярных и часто назначаемых препаратов для лечения расстройств аффективной сферы [Stahl SM, 2013; Ruiz P, 2017].
Здесь стоит отметить, что применение ТАП для лечения острых маниакальных, гипоманиакальных и смешанных состояний, как в монотерапии, так и в комбинациях с «классическими» НТ (литием, вальпроатом, карбамазепином) – имеет давнюю историю, и действительно было эффективным. Оно способствует более быстрому началу терапевтического эффекта, лучшему контролю психомоторного возбуждения, агрессивности и психотической симптоматики, по сравнению с монотерапией этих состояний только классическими НТ. Однако ТАП в этом контексте не только хуже переносятся, чем ААП, из-за более высокого уровня ЭПС, НИДС и акатизии, вторичной депрессивной симптоматики («нейролептических депрессий»), но и чаще ААП способствуют истинной инверсии знака эпизода из мании или гипомании в депрессию. Они также, подобно классическим АД (которые, наоборот, склонны инвертировать из депрессии в манию или гипоманию), могут способствовать долгосрочному ухудшению течения БАР («раскачке маятника», учащению и утяжелению фаз, формированию быстрого цикла) [Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
Некоторые ТАП также могут обладать «встроенной» антидепрессивной активностью, связанной с индивидуальными отличиями в их рецепторном профиле или в строении молекулы («правильные для трициклика углы между тремя кольцами в молекуле») от всех прочих ТАП. В первую очередь здесь можно вспомнить, например, левомепромазин или хлорпротиксен. Препараты группы ТАП также могут быть полезными в дополнение к АД при ТРД или при психотических формах депрессии. Однако их антидепрессивная активность в любом случае достаточно ограничена и уступает таковой у современных ААП, а их длительное применение ассоциируется с частым возникновением ЭПС, НИДС и акатизии, вторичной депрессивной и негативной симптоматики, вторичных нейролептик-индуцированных КН [Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
По всем вышеописанным причинам применение ТАП в лечении БАР и РБС на Западе сегодня практически полностью уступило дорогу применению ААП, в частности кветиапина [Stahl SM, 2013; Muneer A, 2015; Ruiz P, 2017].
Кветиапин как почти идеальный нормотимик (стабилизатор настроения)
В идеале, успешное фармакологическое лечение БАР и РБС ставит перед собой задачу достижения одновременно всех следующих терапевтических целей [Muneer A, 2015]:
• Успешный контроль или быстрое купирование симптоматики маниакальных, гипоманиакальных и смешанных эпизодов;
• Успешное лечение как развёрнутых, полномасштабных депрессивных эпизодов, так и нередко сохраняющихся в межэпизодном периоде (в интермиссиях) субклинических, подпороговых депрессивных симптомов;
• Нейропротекция, улучшение когнитивного функционирования пациентов как в острых аффективных эпизодах, так и в межэпизодном периоде (в интермиссиях), предотвращение нарастания кумулятивной когнитивной токсичности по ходу течения болезни;
• Предотвращение или снижение вероятности инверсии знака эпизода из депрессии в манию, гипоманию или в смешанное состояние при вынужденном применении АД (например, из-за того, что монотерапия литием, ламотриджином или ААП оказалась неэффективной в данном конкретном эпизоде биполярной депрессии);
• Торможение прогрессирования болезни, нарастания частоты и тяжести аффективных эпизодов, предотвращение формирования быстрого цикла или континуального (непрерывного) течения болезни;
• Стабилизация настроения в интермиссиях, предотвращение или хотя бы снижение частоты, продолжительности и тяжести аффективных эпизодов обоего знака;
• Нормализация фазовой структуры сна и циркадных ритмов, которые нередко оказываются нарушенными у таких пациентов даже в интермиссиях;
• Успешный контроль или устранение нередко сопутствующих или коморбидных симптомов тревожности;
• Предотвращение или снижение вероятности суицида, купирование суицидальных тенденций.
Традиционные НТ (стабилизаторы настроения), такие как литий и некоторые АК (вальпроаты, карбамазепин, ламотриджин), обычно называют в качестве препаратов первой линии для достижения если не всех, то, во всяком случае, большинства из вышеперечисленных целей. Однако они, к сожалению, имеют целый ряд имманентно присущих им, неустранимых недостатков [Stahl SM, 2013; Muneer A, 2015].
Так, в частности, классические НТ обладают ограниченной клинической эффективностью при лечении тяжёлых маниакальных и смешанных эпизодов, при быстроциклическом или континуальном течении БАР, при терапии биполярных депрессий (особенно тяжёлых или протекающих с психотической симптоматикой), а также при профилактике аффективных эпизодов обоего знака [Stahl SM, 2013; Muneer A, 2015].
При этом важно отметить, что, скажем, литий и особенно карбамазепин и вальпроаты имеют существенный перекос в сторону лучшего подавления маний и гипоманий, чем депрессий, а ламотриджин – наоборот. Это часто вынуждает практикующего врача комбинировать 2 и даже
3 или более НТ для достижения наилучшего терапевтического эффекта. А это не всегда удобно. Это также значительно снижает комплаентность пациентов с БАР и РБС к лечению и повышает риск развития ПЭ и нежелательных межлекарственных взаимодействий [Stahl SM, 2013; Muneer A, 2015].
Из всех классических НТ только вальпроат обладает собственной анксиолитической и снотворно-седативной активностью (хотя литий может косвенно нормализовать сон и циркадные ритмы) [Stahl SM, 2013; Muneer A, 2015].
Ещё одним важным недостатком почти всех классических НТ является их узкий терапевтический диапазон и необходимость частого определения их концентрации в плазме крови, для того, чтобы избежать как неэффективности, так и проявлений ПЭ или признаков токсичности. Особенно это справедливо для лития, в меньшей мере – для карбамазепина и ещё в меньшей – для вальпроатов и ламотриджина, терапевтический диапазон которых шире, чем у лития и карбамазепина [Malhi GS, Tanious M, 2011; Stahl SM, 2013].
Неприятным аспектом лечения рядом классических НТ является также их органная токсичность (нефро- и тиреоидная токсичность у лития, гемато- и гепатотоксичность у карбамазепина, гемато-, гепато-, гастро- и панкреатическая токсичность вальпроатов, дерматотоксичность у ламотриджина). Особенно неприятно то, что в ряде случаев эта органная токсичность носит не идиосинкразический, а неизбежно кумулятивный характер (как в случае с влиянием лития на почки и щитовидную железу) [Malhi GS, Tanious M, 2011; Stahl SM, 2013].
Напротив, кветиапин демонстрирует прогресс в каждой из этих областей, по сравнению с классическими НТ. Он оказался успешным в лечении и профилактике рецидивов как тяжёлых маниакальных и смешанных состояний, так и биполярных депрессий, включая тяжёлые и психотические их формы. Он также обладает выраженной собственной анксиолитической и снотворно-седативной активностью, способствует нормализации фазовой структуры сна и циркадных ритмов, улучшению когнитивного функционирования пациентов. Он хорошо переносится и практически не обладает клинически значимой органной токсичностью [Woodward TC et al, 2010; Stahl SM, 2013].
Вся эта совокупность свойств в сочетании делает кветиапин почти идеальным НТ. Это вывело его из второй-третьей в первую линию терапии БАР на всех этапах болезни, и поставило его здесь наравне с классическими НТ (литием, вальпроатом, ламотриджином) [Woodward TC et al, 2010; Stahl SM, 2013].
Доказательная база по эффективности
и безопасности кветиапина при купирующем лечении острых маниакальных, гипоманиакальных и смешанных состояний
В 2005-м году были опубликованы данные двойного слепого плацебо-контролируемого сравнительного РКИ, посвящённого сопоставлению эффективности и безопасности монотерапии кветиапином, галоперидолом или плацебо при купировании острых маниакальных и смешанных эпизодов. В этом РКИ приняли участие 302 пациента с острым маниакальным или смешанным эпизодом, возникшим в рамках БАР 1-го типа. Все они были рандомизированы к получению либо кветиапина, либо галоперидола, либо плацебо в качестве монотерапии [McIntyre RS et al, 2005].
Авторы этого РКИ сумели показать, что уже к сроку 3 недели (21 день) кветиапин статистически достоверно отличался от плацебо по снижению общего балла шкалы оценки мании Янга YMRS (-12,29 в группе кветиапина против -8,32 в группе плацебо; p < 0,01). Антиманиакальный эффект кветиапина продолжал развёртываться и далее, и к сроку 12 недель (84 дня) разница между кветиапином и плацебо по шкале YMRS стала ещё заметнее (-17,52 балла в группе кветиапина против -9,48 баллов в группе плацебо; p < 0,001) [McIntyre RS et al, 2005].
Сходная степень редукции общего балла по шкале YMRS отмечалась и при применении галоперидола. Однако в группе галоперидола был выше общий уровень ПЭ и уровень отказов от продолжения лечения. Кроме того, в группе кветиапина редукции подвергались как баллы по шкале YMRS, так и баллы по Госпитальной шкале тревоги и депрессии (HADS), тогда как в группе галоперидола этого не наблюдалось (напротив, средний балл по шкале HADS в этой подгруппе к концу исследования увеличился). Авторы сделали вывод, что ААП кветиапин и ТАП галоперидол обладают сопоставимой эффективностью в купирующем лечении острых маниакальных и смешанных состояний в рамках БАР 1-го типа, но при этом кветиапин, во-первых, лучше переносится, а во-вторых, в отличие от галоперидола способен положительно влиять также и на депрессивную и тревожную симптоматику при смешанных состояниях [McIntyre RS et al, 2005].
Основными ПЭ, наблюдавшимися в группе кветиапина, были чрезмерная дневная сонливость и седация, ОГ, тахикардия, сухость во рту, головокружение, головная боль, в то время как в группе галоперидола наиболее частыми ПЭ были проявления ЭПС и акатизии, вторичная депрессивная симптоматика, а сонливость, ОГ и тахикардия наблюдались реже, чем у кветиапина [McIntyre RS et al, 2005].
В другом двойном слепом плацебо-контролируемом РКИ с аналогичным дизайном, также от 2005 года, сопоставляли эффективность и безопасность кветиапина, лития и плацебо при купирующем лечении острых маниакальных и смешанных состояний, возникающих в рамках БАР 1-го типа. Авторы этого РКИ показали, что кветиапин и литий оба обладают сопоставимой эффективностью в купировании этих состояний, оцененных по шкале YMRS, и оба значительно эффективнее плацебо. Переносимость также оказалась сопоставимой, с некоторым преимуществом в пользу кветиапина. В группе кветиапина наиболее частыми ПЭ были чрезмерная дневная сонливость, седативный эффект, сухость во рту, ОГ, тахикардия, запоры, головокружение и головные боли, а в группе лития – повышенная жажда, полиурия, мышечные подёргивания, мелкий тремор пальцев рук, тошнота и рвота, понос [Bowden CL et al, 2005].
В том же 2005 году был опубликован ретроспективный комбинированный анализ двух крупных международных двойных слепых плацебо-контролируемых РКИ, посвящённых изучению эффективности и безопасности монотерапии кветиапином у пациентов с острыми маниакальными или смешанными состояниями, возникшими в рамках БАР 1-го типа. В обоих вошедших в этот анализ РКИ пациенты рандомизировались к получению либо кветиапина (в дозах до 800 мг/сут), либо плацебо в монотерапии на протяжении 12 недель. Первичной конечной точкой эффективности в обоих РКИ было принято изменение среднего балла по шкале оценки мании Янга (YMRS), по сравнению с исходным уровнем, к сроку 21 день (3 недели) лечения [Vieta E et al, 2005].
Вторичные конечные точки в обоих вошедших в этот анализ РКИ включали в себя такие параметры, как изменение среднего балла по шкале YMRS по сравнению с исходным уровнем к сроку 84 дня (12 недель), частота положительных ответов на лечение (определяемых как редукция общего балла по шкале YMRS на 50% или более от исходного уровня), частота достижения ремиссии маниакального состояния (определяемой как нормализация показателей шкалы YMRS), а также изменения от исходного уровня к срокам 21 и 84 дня показателей по таким шкалам, как шкала депрессии Монтгомери-Асберга, шкала общего клинического впечатления CGI, её вариант для БАР (CGI-BP), шкала позитивных и негативных симптомов психоза (PANSS) и шкала тревоги Гамильтона (HAM-A) [Vieta E et al, 2005].
Авторы этого анализа показали, что статистически достоверное и значительное преимущество лечения кветиапином перед лечением плацебо по всем изучаемым показателям проявлялось уже на 21-й день терапии (p<0,001) и продолжало развёртываться до конца исследования, до 84-го дня терапии (p<0,001). При этом пациенты, получавшие кветиапин, также статистически достоверно значительно чаще, чем пациенты, получавшие плацебо, достигали клинического ответа (редукции общего балла по шкале YMRS более чем на 50% от исходного уровня) или ремиссии маниакального состояния (полной нормализации показателей по шкале YMRS) [Vieta E et al, 2005].
Данные этого комбинированного анализа подтвердили результаты ранее проведённых отдельных исследований и доказали, что монотерапия кветиапином высокоэффективна в отношении широкого круга аффективных (как маниакальных, так и депрессивных), тревожных и психотических симптомов, возникающих в рамках маниакальных и смешанных эпизодов при БАР 1-го типа, и что кветиапин при этих состояниях действует быстро, имеет хорошие показатели безопасности и переносимости [Vieta E et al, 2005].
В ещё одной, более поздней, работе от 2007 года авторы решили изучить эффективность и безопасность применения кветиапина в монотерапии или в комбинации с литием либо вальпроатом, в сопоставлении с плацебо, для лечения острых маниакальных и смешанных состояний в рамках БАР 1-го типа применительно к одному специфическому субдомену маниакальной симптоматики – а именно агрессивности и психомоторного возбуждения [Buckley PF et al, 2007].
В этом РКИ 407 пациентов с острым маниакальным или смешанным эпизодом, возникшим в рамках БАР 1-го типа, были рандомизированы к получению либо монотерапии кветиапином (в дозах от 200 до 800 мг/сут), либо монотерапии плацебо на протяжении 12 недель. Ещё 402 пациента с такими же состояниями были рандомизированы к получению либо комбинации литий/вальпроат + плацебо, либо комбинации литий/вальпроат + кветиапин (тоже в дозах от 200 до 800 мг/сут) на протяжении 3 или 6 недель [Buckley PF et al, 2007].
Авторы этого исследования показали, что кветиапин в монотерапии начинает численно отличаться от плацебо по подшкалам активации (то есть психомоторного возбуждения) и риска дополнительного проявления агрессивного поведения шкалы PANSS (PANSS Activation и PANSS Supplemental Aggression Risk) уже на 4-й день лечения [Buckley PF et al, 2007].
К сроку 21 день (3 недели) снижение показателей по подшкале активации (психомоторного возбуждения) шкалы PANSS было статистически достоверно значительно больше в группе монотерапии кветиапином, по сравнению с группой монотерапии плацебо. Это улучшение продолжало развёртываться и далее, и стало ещё более значительным к сроку 84 дня (12 недель) [Buckley PF et al, 2007].
Статистически достоверное значительное улучшение показателей по подшкале риска дополнительной агрессии шкалы PANSS при монотерапии кветиапином, по сравнению с монотерапией плацебо, было выявлено ещё раньше – уже на 14-й день (2 недели) терапии, и продолжало развёртываться и далее, в частности к контрольным срокам
21 день (3 недели) и 84 дня (12 недель) [Buckley PF et al, 2007].
С другой же стороны, при комбинированной терапии кветиапином в сочетании с литием или вальпроатом, дополнительная клиническая польза от добавления кветиапина к одному из этих НТ была менее очевидной. Среднее улучшение оценки по подшкале активации (психомоторного возбуждения) шкалы PANSS к сроку 21 день (3 недели) численно, но незначительно отличалось в пользу подгруппы «литий/вальпроат + кветиапин», по сравнению с подгруппой «литий/вальпроат + плацебо». Среднее улучшение оценки по подшкале риска дополнительной агрессии шкалы PANSS было статистически достоверно более значительным в подгруппе «литий/вальпроат + кветиапин», по сравнению с подгруппой «литий/вальпроат + плацебо» к сроку 21 день, но эта разница была менее разительна, чем при сравнении монотерапии кветиапином и монотерапии плацебо [Buckley PF et al, 2007].
В то же время при стратификации и раздельном анализе подгрупп пациентов с разной исходной степенью общей тяжести маниакального или смешанного состояния, с разной исходной выраженностью психотической симптоматики, агрессивности и возбуждения, обнаружилось, что добавление кветиапина к литию или вальпроату приносит особенно большую пользу пациентам с тяжёлым маниакальным состоянием, с выраженным психомоторным возбуждением, выраженной агрессивностью, яркой психотической или кататонической симптоматикой [Buckley PF et al, 2007].
Авторы этого исследования заключили, что кветиапин в монотерапии или в комбинации с литием либо вальпроатом, в дозах от 400 до 800 мг/сут, является надёжным, быстродействующим, эффективным и безопасным методом лечения острого психомоторного возбуждения и агрессивности, связанных с маниакальными или смешанными эпизодами в рамках БАР 1-го типа. Они также констатировали, что добавление кветиапина к литию или вальпроату особенно показано пациентам с тяжёлыми маниакальными или смешанными состояниями, с выраженным возбуждением, выраженной агрессивностью, с наличием яркой психотической или кататонической симптоматики в картине эпизода [Buckley PF et al, 2007].
В 2011-м году были опубликованы результаты 3-недельного двойного слепого плацебо-контролируемого предрегистрационного РКИ фазы III, в котором изучалась эффективность и безопасность применения новой пролонгированной формы кветиапина (Seroquel XR) один раз в сутки при купирующем лечении острых маниакальных и смешанных состояний, возникающих в рамках БАР 1-го типа, в сопоставлении с плацебо, у взрослых от 18 до 65 лет [Cutler AJ et al, 2011].
Все вошедшие в это исследование пациенты были рандомизированы к получению либо плацебо (159 человек), либо кветиапина XR (149 человек). Кветиапин назначался один раз в сутки (начальная доза – 300 мг/сут в первый день, затем 600 мг/сут на 2-й день, затем гибкая индивидуально подобранная доза от 400 до 800 мг/сут на период с
3-го по 22-й день лечения). Средняя доза кветиапина XR составила 604 мг/сут [Cutler AJ et al, 2011].
Авторы этого РКИ сумели показать, что применение кветиапина XR приводит к значительному численному тренду на улучшение симптомов острой мании по шкале YMRS, по сравнению с применением плацебо, уже начиная с 4-го дня лечения, и что это улучшение продолжает развёртываться и становится статистически достоверным к концу исследования (то есть к сроку 3 недели лечения). Кроме того, к сроку 3 недели в группе кветиапина XR частота клинического ответа (редукции показателей шкалы YMRS на 50% и более от исходного уровня) и частота достижения ремиссии маниакального состояния (нормализации показателей шкалы YMRS) также были статистически достоверно значительно выше, чем в группе плацебо [Cutler AJ et al, 2011].
Применение кветиапина XR также привело к статистически достоверному значительному улучшению показателей шкалы общего клинического впечатления CGI и её биполярного варианта (CGI-BP), в особенности подшкал CGI-BP-S (Severity, тяжесть состояния) и CGI-BP-С (Cognition, выраженность КН), а также шкал депрессии MADRS и тревоги HAM-A, по сравнению с плацебо. При этом кветиапин XR хорошо переносился пациентами с острой манией или острым смешанным состоянием. ПЭ возникали редко и были небольшой или умеренной интенсивности, а наиболее частыми из них были седативный эффект, сухость во рту и сонливость [Cutler AJ et al, 2011].
В 2013-м году были опубликованы данные 3-недельного двойного слепого плацебо-контролируемого многоцентрового РКИ, посвящённого изучению эффективности и безопасности монотерапии кветиапином при купирующем лечении острых маниакальных и острых смешанных состояний в рамках БАР 1-го типа у детей и подростков в возрасте от 10 до 17 лет [Pathak S et al, 2013].
Основными критериями для включения в это исследование были наличие верифицированного диагноза «БАР 1-го типа, текущий острый маниакальный эпизод» или «БАР 1-го типа, текущий острый смешанный эпизод» согласно диагностическим критериям DSM-5, а также исходный общий балл по шкале оценки мании Янга (YMRS) не менее 20 баллов. Всего были отобраны 277 пациентов из 34 центров США. Все они были рандомизированы к получению либо одной из фиксированных доз кветиапина (400 или 600 мг/сут), либо плацебо на протяжении 3 недель лечения [Pathak S et al, 2013].
Авторы этого РКИ сумели показать, что у детей и подростков в возрастной категории от 10 до 17 лет с БАР 1-го типа и текущим острым маниакальным или острым смешанным эпизодом, так же как и у взрослых, кветиапин в обеих исследованных дозах (как в дозе 400 мг/сут, так и в дозе 600 мг/сут) статистически достоверно эффективнее плацебо в устранении маниакальных симптомов, измеренных по шкале YMRS, к сроку 3 недели. Среднее изменение общего балла по шкале YMRS к этому сроку от исходного уровня составило -14,25, -15,60 и -9,04 баллов в группах кветиапина 400 мг/сут, кветиапина 600 мг/сут и плацебо соответственно. Лечение кветиапином в обеих исследованных дозах в данной возрастной категории в целом было безопасным и хорошо переносилось, а профиль ПЭ кветиапина соответствовал таковому у взрослых с БАР 1-го типа и аналогичным состоянием [Pathak S et al, 2013].
На основании данных этого РКИ кветиапин получил официальное одобрение FDA для купирующего лечения острых маниакальных, гипоманиакальных и смешанных эпизодов в рамках БАР не только у взрослых (от 18 лет), но также у детей и подростков в возрасте от 10 до 17 лет. Рекомендованный диапазон доз кветиапина для них тот же, что и для взрослых (400-600-800 мг/сут) [Srinivas S et al, 2020].
Доказательная база по эффективности и безопасности применения кветиапина при купирующем лечении острой биполярной депрессии
В 2010-м году были опубликованы результаты двойного слепого многоцентрового плацебо-контролируемого сравнительного РКИ под кодовым названием EMBOLDEN I, в котором сравнивалась эффективность, безопасность и переносимость монотерапии кветиапином, монотерапии литием и монотерапии плацебо при купирующем лечении острой биполярной депрессии, возникающей в рамках БАР 1-го или 2-го типов [Young AH et al, 2010].
В общей сложности в это РКИ вошли 802 пациента с острой биполярной депрессией, возникшей в рамках БАР 1-го или 2-го типов. Все они были рандомизированы к получению либо кветиапина 300 мг/сут (265 человек), либо кветиапина 600 мг/сут (268 человек), либо лития карбоната в гибкой, индивидуально подобранной дозе (от 600 до 1800 мг/сут, диапазон концентраций в плазме крови от 0,33 до 1,12 ммоль/л; 136 человек), либо плацебо (133 человека) на протяжении 8 недель лечения [Young AH et al, 2010].
Авторы этого исследования сумели показать, что монотерапия кветиапином в обеих исследованных дозах, особенно в дозе 600 мг/сут, статистически достоверно эффективнее и плацебо, и монотерапии литием в уменьшении депрессивной симптоматики у пациентов с острой биполярной депрессией к сроку 8 недель лечения (p<0,05). Среднее изменение общего балла по шкале депрессии Монтгомери-Асберга (MADRS) к этому сроку составило ь-15,4 балла в группе кветиапина 300 мг/сут, -16,1 балла в группе кветиапина 600 мг/сут, -13,6 баллов в группе гибких доз лития и -11,8 баллов в группе плацебо. Монотерапия литием, как и ожидалось из данных более ранних исследований, тоже оказалась статистически достоверно более эффективной, чем плацебо, в купирующем лечении острой биполярной депрессии (в редукции среднего балла по шкале MADRS), но явно уступала по эффективности монотерапии кветиапином [Young AH et al, 2010].
Более высокая эффективность монотерапии кветиапином, по сравнению с монотерапией литием, в купирующем лечении острой биполярной депрессии проявилась не только в более выраженной редукции среднего балла по шкале MADRS в обеих дозовых группах кветиапина, по сравнению с группой лития. Пациенты, получавшие кветиапин в обеих исследованных дозах, но не пациенты, получавшие литий, показали к сроку 8 недель лечения статистически достоверное значительное улучшение также по таким параметрам, как частота достижения клинического ответа (редукции общего балла по шкале MADRS на 50% и более от исходного уровня), частота достижения ремиссии депрессивной симптоматики (нормализации показателей шкалы MADRS), уменьшение тяжести состояния по шкале общего клинического впечатления (CGI) и её подшкалам, по шкале Гамильтона для оценки симптомов депрессии (HRSD), и по шкале Гамильтона для оценки симптомов тревоги (HAM-A) [Young AH et al, 2010].
Кроме того, кветиапин в дозе 600 мг/сут также более эффективно, чем кветиапин в дозе 300 мг/сут или литий, устранял сопутствующую маниакальную симптоматику, измеренную по шкале YMRS, и сопутствующую психотическую симптоматику, измеренную по шкале PANSS. Авторы этого РКИ пришли к выводу, что монотерапия кветиапином в обеих исследованных дозах (300 или 600 мг/сут) статистически достоверно эффективнее и плацебо, и монотерапии литием в купирующем лечении острой биполярной депрессии, и что при наличии сопутствующей маниакальной (смешанной) или психотической симптоматики доза кветиапина 600 мг/сут более эффективна и, вероятно, более показана, чем доза кветиапина 300 мг/сут. Они также констатировали, что монотерапия кветиапином в обеих исследованных дозах (как в дозе 300 мг/сут, так и в дозе 600 мг/сут) безопасна и хорошо переносится при купирующем лечении острой биполярной депрессии [Young AH et al, 2010].
В другом двойном слепом многоцентровом плацебо-контролируемом сравнительном РКИ под кодовым названием EMBOLDEN II, также опубликованном в 2010 году, изучали эффективность и безопасность монотерапии кветиапином (тоже в двух фиксированных дозах – 300 и 600 мг/сут), в сопоставлении с монотерапией пароксетином (в фиксированной дозе 20 мг/сут) и с плацебо при купирующем лечении острой биполярной депрессии, возникшей в рамках БАР 1-го или 2-го типов [McElroy SL et al, 2010].
В это РКИ вошли в общей сложности 740 пациентов с БАР, из них 478 человек с БАР 1-го типа и 262 человека с БАР 2-го типа и текущим большим депрессивным эпизодом (БДЭ), диагностированным согласно критериям DSM-IV-TR. Все они были рандомизированы к получению либо кветиапина в дозе 300 мг/сут (245 человек), либо кветиапина в дозе 600 мг/сут (247 человек), либо пароксетина в дозе 20 мг/сут (122 человека), либо плацебо (126 человек) на протяжении 8 недель лечения [McElroy SL et al, 2010].
Авторы этого РКИ показали, что обе дозы кветиапина (как 300 мг/сут, так и 600 мг/сут) статистически достоверно эффективнее и плацебо, и пароксетина в устранении депрессивной симптоматики, измеренной по шкалам MADRS и HRSD, у пациентов с острой биполярной депрессией в рамках БАР 1-го или 2-го типов к сроку 8 недель. Среднее изменение общего балла по шкале MADRS от исходного уровня к этому сроку составило -16,19 баллов в группе кветиапина 300 мг/сут, -16,31 баллов в группе кветиапина 600 мг/сут, -13,76 баллов в группе пароксетина и -12,60 баллов в группе плацебо соответственно [McElroy SL et al, 2010].
Кроме того, пациенты в обеих дозовых группах кветиапина (как в группе 300 мг/сут, так и в группе 600 мг/сут) к сроку 8 недель лечения показали статистически достоверно значительно большее (p < 0,05) улучшение почти по всем вторичным критериям оценки, по сравнению как с плацебо, так и с пароксетином [McElroy SL et al, 2010].
Интересно отметить, что в этом РКИ пароксетин вообще не показал статистически достоверного отличия от плацебо по уменьшению депрессивной симптоматики, измеренной по шкалам MADRS или HRSD, но статистически достоверно значительно уменьшал показатели тревожности, измеренной по шкале HAM-A (p < 0,05). Кветиапин в обеих изученных дозах тоже, подобно пароксетину, был статистически достоверно эффективнее плацебо в редукции симптомов тревожности. Однако при этом кветиапин также одновременно редуцировал депрессивную симптоматику и сопутствующие смешанные (маниакальные) или психотические симптомы, чего не наблюдалось в группе пароксетина [McElroy SL et al, 2010].
Это, в целом, соответствует ранее уже известным фактам о низкой или нулевой эффективности монотерапии «классическими АД» при лечении биполярных депрессий (в отличие от ситуации с лечением униполярных депрессий), и о том, что «классические АД» в монотерапии (без добавления НТ и/или ААП с доказанными нормотимическими свойствами) у пациентов с биполярной депрессией в рамках БАР, если вообще дают какой-либо эффект, чаще склонны давать инверсию знака эпизода в манию или гипоманию или развитие смешанного состояния, чем истинный антидепрессивный эффект. Авторы этого РКИ сделали вывод, что кветиапин в обоих изученных дозовых режимах (как 300, так и 600 мг/сут), но не пароксетин, эффективен в купирующем лечении острой биполярной депрессии в рамках БАР 1-го и 2-го типов. Лечение кветиапином в обеих изученных дозах имело хорошие показатели безопасности и переносимости, уровень ПЭ и отказов от лечения был низким [McElroy SL et al, 2010].
В другом двойном слепом плацебо-контролируемом РКИ, также опубликованном в 2010-м году, сравнивали эффективность и безопасность новой пролонгированной формы выпуска кветиапина (Seroquel XR), назначаемой один раз в сутки, и плацебо при купирующем лечении острой биполярной депрессии, возникшей в рамках БАР 1-го или 2-го типа, у взрослых. В этом РКИ приняли участие 270 взрослых пациентов с диагнозом БАР 1-го или 2-го типа и текущим диагнозом БДЭ (то есть с острой биполярной депрессией), согласно диагностическим критериям DSM-IV-TR. Стоит особо отметить, что в этом исследовании, в отличие от ряда других подобных РКИ, наличие диагноза быстроциклического течения БАР (4 и более очерченных эпизода любого знака за год) не было критерием исключения из исследования. Между тем хорошо известно, что многие «классические НТ», особенно соли лития, недостаточно эффективны при быстроциклическом течении БАР [Suppes T et al, 2010].
Все вошедшие в данное исследование пациенты были рандомизированы к получению либо пролонгированной формы кветиапина (Seroquel XR) в дозе 300 мг/сут один раз в сутки (133 человека), либо плацебо (137 человек) на протяжении 8 недель лечения [Suppes T et al, 2010].
Авторам этого РКИ удалось показать, что применение кветиапина в пролонгированной форме в дозе 300 мг/сут приводит к статистически достоверно значительно большей редукции среднего балла по шкале MADRS, по сравнению с применением плацебо, во всех контрольных точках исследования, уже начиная с 1-й по 8-ю неделю лечения. Частота положительных ответов на лечение (частота редукции общего балла по шкале MADRS на 50% и более от исходного уровня) и частота достижения клинической ремиссии депрессивного состояния (достижения уровня по шкале MADRS 12 баллов и менее) к сроку 8 недель лечения также были статистически достоверно значительно выше в группе пролонгированной формы кветиапина, по сравнению с группой плацебо [Suppes T et al, 2010].
Кроме того, применение пролонгированной формы кветиапина в этом РКИ приводило также к статистически достоверному значительному улучшению баллов по шкале общего клинического впечатления (CGI), к снижению показателей тревожности по шкале HAM-A, маниакальных симптомов по шкале YMRS и психотической симптоматики по шкале PANSS. Переносимость кветиапина в пролонгированной форме была очень хорошей (лучшей, чем известные из предыдущих РКИ данные по кветиапину немедленного высвобождения, который сам по себе достаточно хорошо переносится), а уровень ПЭ и отказов от лечения был низким [Suppes T et al, 2010].
Авторы цитируемого нами здесь исследования сделали вывод, что монотерапия кветиапином в пролонгированной форме в дозе 300 мг/сут, назначаемой один раз в сутки, является высокоэффективным, безопасным и хорошо переносимым методом лечения острой биполярной депрессии, развивающейся в рамках БАР 1-го и 2-го типов, включая случаи с быстроциклическим течением БАР. Они также особо отметили, что антидепрессивный эффект кветиапина в этом контексте наступал быстро, и начинал статистически достоверно отличаться от плацебо уже на 7-й день лечения, и что кветиапин попутно проявлял эффективность в отношении широкого круга прочих симптомов БАР – тревожных, маниакальных (смешанных) и психотических [Suppes T et al, 2010].
В 2014-м году были опубликованы данные большого ретроспективного метаанализа, посвящённого изучению эффективности и безопасности применения кветиапина (как в монотерапии, так и в комбинациях с другими психотропными препаратами – АД и/или НТ) в купирующем лечении острой биполярной депрессии, возникающей в рамках БАР 1-го или 2-го типа. В этот метаанализ вошли 11 двойных слепых РКИ. Общее количество пациентов в совокупной выборке из всех этих исследований составило 3488 человек. Авторы включили в свой метаанализ все найденные ими двойные слепые РКИ, в которых кветиапин (как в монотерапии, так и в комбинациях с АД и/или с НТ) сравнивался с какими-либо другими препаратами, включая сравнение кветиапина с плацебо (или сравнение комбинации кветиапина и второго препарата с комбинацией второго препарата и плацебо) при лечении острой биполярной депрессии (БДЭ), возникающей в рамках БАР 1-го или 2-го типов [Suttajit S et al, 2014].
Авторы данного метаанализа показали, что применение кветиапина, как в монотерапии, так и в комбинациях с АД или со стандартными НТ (литием, вальпроатом), приводит к статистически достоверному уменьшению тяжести острой биполярной депрессии по шкале MADRS к сроку
8 недель лечения, по сравнению с применением плацебо, а также к статистически достоверно более частому, по сравнению с плацебо, достижению удовлетворительного клинического ответа (редукции общего балла по MADRS на 50% и более от исходного уровня) или полной клинической ремиссии депрессии (нормализации показателей шкалы MADRS до 12 баллов и ниже) [Suttajit S et al, 2014].
Кроме того, лечение острой биполярной депрессии кветиапином ассоциировалось со значительно более низким процентом отказов от лечения из-за неэффективности, чем плацебо или монотерапия литием/вальпроатом. Лечение кветиапином (как в монотерапии, так и в комбинациях с АД и/или НТ) ассоциировалось также с более низким уровнем инверсии знака эпизода в манию/гипоманию или в смешанное состояние, с улучшением общего качества жизни по шкале QoL, с улучшением качества сна, со снижением уровня тревожности, измеренной по шкале HAM-A, с попутным купированием маниакальной (смешанной) симптоматики, измеренной по шкале YMRS, психотической симптоматики, измеренной по шкале PANSS, и с улучшением показателей общего клинического впечатления, социального и когнитивного функционирования пациентов [Suttajit S et al, 2014].
Согласно выводам авторов данного метаанализа, лечение кветиапином (как в монотерапии, так и в комбинациях с АД и/или НТ) при острой биполярной депрессии высокоэффективно в отношении широкого круга её симптомов (не только собственно депрессивных, но и тревожных, маниакальных/смешанных, психотических, когнитивных), и при этом безопасно и хорошо переносится. Уровень ПЭ и отказов от лечения из-за наличия ПЭ был низким во всех 11 изученных авторами РКИ, а сами ПЭ обычно ограничивались лёгкой или умеренной степенью выраженности. Наиболее частыми ПЭ при лечении кветиапином острой биполярной депрессии, согласно данным этого метаанализа, были сонливость и седация, ОГ, тахикардия, чувство усталости или физическая слабость, головокружение, головные боли, запоры, сухость во рту, повышение аппетита и прибавка массы тела, иногда – нерезко выраженные ЭПС (обычно в виде акатизии или тремора, реже – и в основном у пожилых – в виде нетяжёлого ЛП) [Suttajit S et al, 2014].
Доказательная база по эффективности и безопасности кветиапина при профилактике рецидивов аффективных расстройств обоего знака
В 2011-м году были опубликованы данные длительного (104 недели) двойного слепого сравнительного плацебо-контролируемого РКИ, в котором изучалась эффективность поддерживающей монотерапии кветиапином (в гибких, индивидуально подобранных дозах от 300 до 800 мг/сут) у взрослых (18 лет и старше) пациентов с БАР 1-го типа, диагностированным согласно критериям DSM-IV-TR, и с недавним маниакальным, депрессивным или смешанным эпизодом, у которых кветиапин ранее оказался эффективным в «остром», купирующем лечении данного эпизода – в сопоставлении со стандартной профилактической монотерапией литием или с плацебо-профилактикой [Weisler RH et al, 2011].
До начала двойной слепой фазы данного исследования все пациенты получали в открытом режиме кветиапин в гибких, индивидуально подобранных дозах (от 300 до 800 мг/сут) с целью острого, купирующего лечения аффективного эпизода, в течение некоторого срока (от 4 до 24 недель), и должны были достигнуть клинической стабилизации или ремиссии аффективного эпизода. Всего таких пациентов было 2438 человек. Из них 1126 человек (50,3%) дали предварительное согласие на участие в двойной слепой фазе данного РКИ, и 1226 человек (95,6% от давших предварительное согласие и нацеленных на продолжение профилактического лечения) – фактически начали исследование [Weisler RH et al, 2011].
В двойной слепой фазе данного РКИ все эти пациенты были рандомизированы либо к продолжению приёма кветиапина в прежней дозе, либо к переводу на приём лития (с достижением концентрации в плазме крови от 0,6 до 1,2 ммоль/л), либо к переводу на приём плацебо на срок до 104 недель [Weisler RH et al, 2011].
Авторы этого РКИ показали, что как кветиапин, так и литий статистически достоверно значительно увеличивают продолжительность интермиссии при БАР 1-го типа и удлиняют время до наступления рецидива аффективного эпизода любого знака, по сравнению с плацебо (отношение рисков (OR) в случае кветиапина составило 0,29, доверительный интервал 95% от 0,23 до 0,38; p<0,0001, а в случае лития OR составил 0,46; доверительный интервал 95% от 0,36 до 0,59; p<0,0001) [Weisler RH et al, 2011].
Профилактическая эффективность кветиапина как в отношении маниакальных, гипоманиакальных и смешанных эпизодов, так и в отношении депрессивных эпизодов в этой когорте пациентов оказалась сопоставимой с таковой у лития (традиционно считающегося средством 1-й линии для поддерживающей терапии БАР 1-го типа), и в обоих случаях значительно отличалась от плацебо. Авторы данного РКИ пришли к выводу, что, по крайней мере у тех пациентов с БАР 1-го типа, у которых кветиапин был эффективен в остром купирующем лечении аффективного эпизода любого знака, кветиапин является также и эффективным средством длительной профилактики рецидивов, не уступает по эффективности литию и сохраняет свою эффективность, по крайней мере, на протяжении 104 недель (до конца исследования). Профилактическое лечение кветиапином было безопасным и хорошо переносилось, уровень ПЭ был в среднем ниже, чем в группе лития (особенно в сравнении с пациентами, вынужденными поддерживать концентрацию лития 0,9 ммоль/л и выше) [Weisler RH et al, 2011].
В другом, тоже длительном (тоже 104 недели) двойном слепом сравнительном плацебо-контролируемом РКИ, опубликованном в 2012-м году, изучали эффективность и безопасность длительной комбинированной профилактики кветиапином в сочетании со стандартным НТ (литием или вальпроатом), в сопоставлении с профилактикой стандартным НТ (литием или вальпроатом) плюс плацебо, у пациентов с БАР 1-го типа со смешанными симптомами. Здесь стоит отметить, что смешанные эпизоды БАР традиционно представляют особые трудности для лечения, как по сравнению с «чистыми» депрессивными или субдепрессивными, так и по сравнению с «чистыми» маниакальными или гипоманиакальными эпизодами [Vieta E et al, 2012].
В этом РКИ все пациенты сначала получали в открытом режиме стандартный НТ (литий или вальпроат) в сочетании с кветиапином в гибких, индивидуально подобранных дозах (от 400 до 800 мг/сут) на протяжении, по крайней мере, 12 недель. Те из них, которые на фоне этого лечения достигли клинической стабильности или ремиссии, были рандомизированы либо к продолжению приёма той же комбинации, либо к приёму того же стандартного НТ (лития или вальпроата) плюс плацебо, на срок до 104 недель [Vieta E et al, 2012].
Авторы этого РКИ сумели показать, что комбинация кветиапина (400–800 мг/сут) со стандартным НТ (литием или вальпроатом) статистически достоверно значительно удлиняет время до рецидива аффективного эпизода любого знака или смешанного эпизода, по сравнению с монотерапией стандартным НТ (литием или вальпроатом) плюс плацебо, у пациентов с БАР 1-го типа со смешанными симптомами, у которых такая комбинация ранее оказалась эффективной в остром купирующем лечении, и что профилактическая эффективность этой комбинации сохраняется по крайней мере на протяжении 104 недель лечения (то есть до конца исследования). Комбинация кветиапина с литием или вальпроатом в целом хорошо переносилась пациентами [Vieta E et al, 2012].
Более детальный апостериорный анализ данных этого РКИ показал также, что особую клиническую пользу от комбинированного профилактического лечения (кветиапин + литий или вальпроат), по сравнению с профилактической монотерапией стандартным НТ, получают пациенты с более тяжёлым течением БАР, с тенденцией к формированию быстрого цикла или континуального течения БАР, к усложнению симптоматики аффективных фаз за счёт большего их «смешивания» или присоединения психотической симптоматики [Vieta E et al, 2012].
В 2013-м году были опубликованы данные ретроспективного метаанализа двух крупных многоцентровых двойных слепых плацебо-контролируемых РКИ, в которых изучался тот же вопрос, что и в описанном нами выше исследовании, – вопрос об эффективности и безопасности комбинированной профилактики стандартным НТ (литий или вальпроат) в сочетании с кветиапином (400–800 мг/сут), в сопоставлении с монотерапией стандартным НТ (литий или вальпроат) плюс плацебо в отношении предотвращения рецидивов аффективных эпизодов любого знака у пациентов с БАР 1-го типа. Отличие от описанного нами выше исследования 2012 года состоит в том, что в этой выборке от пациентов не требовалось соответствия критериям смешанного эпизода (то есть в это РКИ включались и те пациенты с БАР 1-го типа, у которых имелись только «чистые» депрессивные и/или «чистые» маниакальные эпизоды) [Suppes T et al, 2013].
Как и описанное нами ранее исследование от 2012 года, это РКИ проводилось на протяжении 104 недель. Сначала в открытой фазе исследования пациенты получали комбинацию лития или вальпроата с кветиапином в гибкой, индивидуально подобранной дозе (от 400 до 800 мг/сут) на протяжении 12 недель, с целью купирующего лечения текущего аффективного эпизода любого знака. Те из них, которые на таком лечении достигли к сроку 12 недель клинической стабильности или ремиссии, были затем рандомизированы либо к продолжению приёма этой же комбинации в прежних дозах, либо к получению комбинации «литий или вальпроат в прежней дозе плюс плацебо» на срок до 104 недель [Suppes T et al, 2013].
Авторы этого РКИ сумели показать, что комбинированная терапия кветиапином (400–800 мг/сут) в сочетании со стандартным НТ (литием или вальпроатом) статистически достоверно значительно эффективнее в отношении профилактики рецидивов аффективных эпизодов любого знака, по сравнению с монотерапией только стандартным НТ (литием или вальпроатом) плюс плацебо, у пациентов с БАР 1-го типа, у которых эта комбинация ранее оказалась эффективной в остром купирующем лечении. Комбинированное лечение сохраняло свою эффективность, было безопасным и хорошо переносилось на сроках до 104 недель. Как и в предыдущем РКИ от 2012 года, наибольшую клиническую пользу от комбинированного лечения получали пациенты с более тяжёлым течением БАР, с тенденцией к развитию быстрого цикла или континуального течения БАР, с тенденцией к развитию смешанных состояний или психотических форм аффективных эпизодов [Suppes T et al, 2013].
Кроме того, авторы этого РКИ также обнаружили, что разные монотерапии имеют дифференциальную эффективность в отношении подавления аффективных эпизодов разных типов: монотерапия вальпроатом оказалась значительно эффективнее монотерапии литием в предотвращении рецидивов мании или смешанного состояния, а также в профилактике и купировании быстрого цикла и в редукции симптомов тревоги и паники, но не в отношении профилактики рецидивов депрессии [Suppes T et al, 2013].
Напротив, монотерапия литием в этом РКИ хорошо предотвращала рецидивы аффективных эпизодов обоего знака и сильнее, чем монотерапия вальпроатом, влияла на суицидальные тенденции, но была недостаточно эффективна при тенденции к развитию смешанных состояний или быстрой цикличности настроения [Suppes T et al, 2013].
В 2014-м году были опубликованы данные ретроспективного метаанализа, который мы подробно описывали в предыдущем разделе, посвящённом обсуждению эффективности и безопасности применения кветиапина для купирующего лечения острой биполярной депрессии. Среди прочих фактов, которые были установлены в этом метаанализе, авторы показали, что кветиапин в обеих исследованных дозах (300 и 600 мг/сут), но особенно в дозе 600 мг/сут, обладает способностью профилактировать инверсию знака эпизода из депрессии в манию, гипоманию или смешанное состояние, а также развитие быстрого цикла на фоне параллельного применения АД [Suttajit S et al, 2014].
Это имеет важное значение для планирования лечения, поскольку БАР, особенно 1-го типа, ассоциируется с высокой частотой инверсии знака эпизода или развития быстрого цикла на фоне монотерапии разными АД (в частности, селективными ингибиторами обратного захвата серотонина – СИОЗС, но особенно – мощными селективными ингибиторами обратного захвата серотонина и норадреналина (СИОЗСиН) и ещё в большей мере – трициклическими антидепрессантами (ТЦА)) [Suttajit S et al, 2014].
В том же 2014 году были опубликованы данные долгосрочного двойного слепого плацебо-контролируемого РКИ, посвящённого изучению эффективности и безопасности длительной поддерживающей монотерапии кветиапином (в дозах 300 или 600 мг/сут) в качестве средства профилактики аффективных эпизодов обоего знака в объединённой выборке пациентов, принимавших участие в «острой» фазе исследований EMBOLDEN I или II, и получавших эффективное для них лечение кветиапином в указанных дозах по поводу острой биполярной депрессии, в сравнении с плацебо-профилактикой [Young AH et al, 2014].
В общей сложности в эту выборку вошли 584 человека с БАР 1-го или 2-го типов, у которых последний зарегистрированный эпизод был депрессивным, и которые в ходе «острой» фазы исследований EMBOLDEN I или II вошли в ремиссию по линии депрессивной симптоматики после
8 недель лечения кветиапином в дозе 300 или 600 мг/сут. Все они были рандомизированы к получению либо кветиапина в прежней дозе, либо плацебо, на протяжении длительного времени (от 26 до 52 недель) [Young AH et al, 2014].
Авторы этого РКИ сумели показать, что длительное поддерживающее лечение кветиапином в обеих исследованных дозах (300 или 600 мг/сут) у пациентов с БАР 1-го или 2-го типов, у которых кветиапин ранее оказался эффективным в купировании острой биполярной депрессии, эффективно и безопасно в отношении профилактики аффективных эпизодов обоего знака, особенно – депрессивных и субдепрессивных эпизодов, в меньшей мере – маниакальных, гипоманиакальных и смешанных эпизодов, и что эта эффективность у кветиапина сохраняется как минимум до 52 недель, то есть до конца исследования [Young AH et al, 2014]
Профилактическая эффективность дозы 600 мг/сут в отношении маний, гипоманий и смешанных состояний оказалась выше, чем эффективность дозы 300 мг/сут, тогда как в отношении профилактики депрессий значимых различий между дозами обнаружено не было. Кветиапин в обоих изученных дозовых режимах в целом хорошо переносился даже при длительной терапии, по крайней мере на сроках до 52 недель [Young AH et al, 2014].
Заключение
Как видно из приведённых нами данных литературы, произошедшее в последние десятилетия существенное расширение и смягчение критериев диагностики БАР 2-го типа и циклотимии, в сочетании с введением концепции РБС, включая «мягкие», стёртые и даже субклинические формы РБС, вызвали значительное повышение частоты диагностики БАР 2-го типа, циклотимии и «другого и неуточнённого БАР», а также переклассификацию значительной части пациентов, ранее считавшихся униполярными депрессивными, в категорию страдающих тем или иным РБС (БАР 2-го типа, циклотимией или «другим и неуточнённым БАР»). Это, в свою очередь, вызвало значительное повышение интереса как фармацевтических компаний, так и широкой медицинской общественности к поиску и разработке новых средств и методов лечения БАР и РБС, а также к исследованию эффективности и безопасности применения в лечении БАР и РБС уже существующих, ранее выведенных на рынок по другим показаниям лекарств – в частности, ряда новых ААП, некоторых новых АК, таких как ламотриджин.
С другой же стороны, объективные трудности в дифференциальной диагностике между шизофренией, ШАР и БАР, растущее понимание того, что эти три клинические сущности представляют собой не три принципиально различные категории, а некий непрерывный шизо-биполярный спектр, а также разногласия между специалистами из разных научных школ по поводу диагностических критериев ШАР и по поводу правомерности отнесения самой категории ШАР к шизофреническому или же к аффективному спектру (здесь существует два противоположных диагностических подхода – согласно одному взгляду на эти вещи, «даже намёк на шизофрению есть шизофрения», согласно другому – «даже намёк на БАР есть БАР», как пишет Стивен М. Шталь) – объективно порождают запрос на расширение применения психотропных препаратов, способных оказать положительное воздействие одновременно и на психотическую, и на аффективную (депрессивную, маниакальную и дисфорическую), и на тревожную и диссомническую симптоматику. К таким универсальным препаратам относятся некоторые из современных ААП. Исторически первым ААП, убедительно показавшим подобную универсальность действия, был герой нашего сегодняшнего обзора – кветиапин. По сей день он остаётся одним из самых популярных и часто назначаемых препаратов для лечения БАР и РБС. Он может применяться – и широко применяется – во всех фазах лечения БАР и РБС – как для купирующего лечения острых биполярных депрессий, для купирования острых маниакальных, гипоманиакальных и смешанных состояний, так и для профилактики рецидивов аффективных эпизодов обоего знака, как в монотерапии, так и в комбинациях с другой ПФТ. Так же, как это было со всеми прочими АП, первоначально кветиапин получил одобрение FDA только для купирующего лечения острой шизофрении и для профилактики рецидивов шизофрении. Однако позже, на основании многочисленных данных двойных слепых плацебо-контролируемых РКИ, было убедительно показано, что кветиапин достоверно эффективен и безопасен как в купирующем лечении острых биполярных депрессий, острых маниакальных, гипоманиакальных и смешанных состояний, так и в поддерживающем лечении БАР (в профилактике рецидивов аффективных эпизодов обоего знака), как в монотерапии, так и в комбинациях с другой ПФТ. Это привело к официальному утверждению FDA данного расширения списка показаний. Подобно ряду других ААП, кветиапин также показал хорошие данные по эффективности и безопасности для потенцирования (аугментации) эффекта АД при униполярных ТРД. Он имеет официальное утверждение FDA и по этому показанию.
Кроме того, кветиапин – один из немногих среди ААП, который показал себя также эффективным и безопасным монотерапевтическим средством как для острого (купирующего), так и для профилактического лечения униполярных депрессивных расстройств (БДР и РДР), в том числе – он показал свою пригодность при униполярных депрессиях в качестве первой линии терапии. Это – большая редкость среди ААП (навскидку можно вспомнить только доказанную эффективность монотерапии малыми дозами сульпирида или амисульприда при дистимиях и униполярных депрессиях лёгкой и средней степени тяжести). Накоплены многочисленные данные о положительном влиянии кветиапина также на течение тревожных и диссомнических расстройств. Это тоже имеет важное значение в контексте выбора оптимальной стратегии лечения БАР и РБС, так как эти расстройства часто сопровождаются симптомами тревоги, нарушениями сна, или даже оказываются коморбидны с теми или иными полносиндромными тревожными расстройствами и/или с первичными диссомническими расстройствами.
Важным преимуществом применения кветиапина для лечения БАР и РБС перед рядом альтернативных опций является его очень хорошая переносимость и хороший профиль безопасности. Так, в частности, кветиапин, в отличие от лития, не обладает кумулятивной нефро- и тиреоидной токсичностью. В отличие от карбамазепина и вальпроатов, кветиапин не обладает клинически значимой гемато-, гепато- или панкреатической токсичностью, не вызывает раздражения желудка или лекарственных гастропатий, не ухудшает состояния волос, кожи, ногтей.
Также кветиапин в гораздо меньшей мере, чем большинство других ААП (исключая «стоящий особняком» клозапин), склонен вызывать проявления ЭПС и акатизии. Он крайне редко вызывает развитие ЗНС (все описанные в литературе случаи ЗНС на кветиапине являются редкой казуистикой, причём все эти пациенты до кветиапина получали другие АП, в силу чего достоверно установить, что причиной развития ЗНС был именно кветиапин, а не ранее назначенный АП, ни в одном из этих случаев не представляется возможным). Он не вызывает развития феномена гиперчувствительности стриатальных D2 рецепторов и поэтому имеет очень низкий риск развития ПД при длительной терапии (опять-таки, все описанные случаи возникновения ПД на кветиапине являются казуистическими, и во всех этих случаях пациенты раньше получали другие АП, так что связь ПД с применением кветиапина неясна).
Это весьма важно с учётом того, что пациенты с БАР и РБС в большей мере, чем пациенты с расстройствами психотического спектра (например, с шизофренией и ШАР), склонны к развитию ЭПС и акатизии при терапии АП, и имеют более высокий, по сравнению с психотическими пациентами, риск развития ЗНС и риск развития ПД при длительной терапии АП.
Тот факт, что кветиапин является сравнительно низкопотентным ААП (его рабочие дозы измеряются сотнями миллиграммов, а не единицами или десятками, как у ряда других ААП), наряду с выраженной дозовой зависимостью его фармакологических эффектов (в малых дозах кветиапин оказывает преимущественно снотворно-седативное действие, в средних – антидепрессивное и анксиолитическое, в более высоких – антипсихотическое и антиманиакальное) – позволяет очень гибко индивидуально подбирать дозу кветиапина для каждого пациента с БАР или РБС и варьировать её сообразно динамике течения болезни, в соответствии с тем, какой эффект от кветиапина нужен именно в данный момент времени.
Кветиапин менее склонен вызывать метаболические ПЭ (ожирение, гиперхолестеринемию, дислипидемию, гипергликемию), чем, например, оланзапин или клозапин. Однако, поскольку этот риск при применении кветиапина существует, необходимо следить за динамикой массы тела пациента, его липидным и гликемическим профилем, и своевременно предпринимать меры по профилактике и коррекции метаболических ПЭ (диета, физическая активность, адъювантное назначение метформина и т. д.). Резюмируя всё вышесказанное, можно сказать, что кветиапин заслуживает гораздо более широкого, чем сегодня, применения в лечении аффективных расстройств (в первую очередь, конечно, БАР и РБС, но также и униполярных депрессий) на просторах СНГ и России. В этой области стоит позаимствовать опыт наших западных коллег.
25 марта 2022
Количество просмотров: 1718


