Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2013
Экстрапирамидные расстройства, осложняющие проведение терапии антипсихотическими препаратами (современное понимание вопросов клиники, патогенеза и коррекции) №01 2013
Номера страниц в выпуске:33-41
Обзорная статья посвящена проблеме экстрапирамидных расстройств, возникающих при проведении антипсихотической терапии. Рассмотрена типология этих нарушений, для каждого из вариантов определены предполагаемые патофизиологические механизмы и приведены терапевтические рекомендации
Резюме. Обзорная статья посвящена проблеме экстрапирамидных расстройств, возникающих при проведении антипсихотической терапии. Рассмотрена типология этих нарушений, для каждого из вариантов определены предполагаемые патофизиологические механизмы и приведены терапевтические рекомендации.
Ключевые слова: антипсихотическая терапия, экстрапирамидные расстройства, препараты холинолитического действия, бипериден.
Extrapyramidal disorders complicating antipsychotic therapy: сurrent understanding of their clinical presentation, pathogenesis, and correction
D.V.Yastrebov
V.P.Serbsky social and forensic psychiatry state research centre, Moscow
Summary. The article reviews different forms of EPS – one the most common complications of antipsychotic therapy. The typology of EPS is discussed, the mechanisms and therapeutic recommendations are given.
Key words: antipsychotic therapy, EPS, anticholinergic drugs, biperiden.
Проблема экстрапирамидных расстройств (экстрапирамидная симптоматика – ЭПС), осложняющих терапию с использованием препаратов антипсихотического действия (АП), привлекает внимание исследователей и практических психиатров с момента внедрения этих лекарственных средств. Вопросы распространенности и патофозиологии этих побочных эффектов, а также рационального назначения антипсихотической терапии, позволяющего уменьшить риск их возникновения и интенсивность, а также методов их коррекции, в большинстве своем считаются детально проработанными и неоднократно освещались в печати, в том числе и на страницах нашего журнала (Д.И.Малин, 2001; П.В.Морозов и соавт., 2011).
Результатом многолетнего изучения явилось создание типологии дискинезий и определение патофизиологических механизмов, лежащих в основе их возникновения. Тем не менее исследовательская работа в этом направлении продолжается, благодаря чему до настоящего времени появляются новые данные и уточняются рекомендации по проведению эффективной и безопасной антипсихотической терапии. Необходимость обновления и пересмотра существующих данных объясняется, с одной стороны, углублением понимания вопросов патогенеза рассматриваемых расстройств, а с другой – внедрением в клиническую практику новых АП-препаратов, в значительной степени уменьшивших частоту ЭПС, но не исключивших их полностью, и при этом заметным образом видоизменивших структуру клинических проявлений.
Считается обоснованным предположение о том, что уязвимость в отношении возникновения ЭПС индивидуально детерминирована. Базовыми факторами предиспозиции выделяются возраст и пол пациента. Так, предполагается, что у молодых людей и подростков мужского пола чаще развиваются острые дистонические реакции, в то время как поздний возраст и женский пол в большей степени ассоциированы с паркинсоноподобной симптоматикой. Аналогичным образом указывается, что поздние дискинезии в 5 раз чаще возникают у пациентов позднего возраста, в особенности у женщин. Существенную роль играет наследственная отягощенность экстрапирамидными расстройствами, а также предыдущая история переносимости курсов АП-терапии.
Исторический аспект
Собственно антипсихотическое действие нейролептиков связывается с блокадой D2-дофаминовых рецепторов в мезолимбической и мезокортикальной областях мозга. Наряду с основным терапевтическим действием АП-препараты обладают и рядом побочных эффектов, связанных с блокадой дофаминергической передачи в тех областях, которые отвечают за неврологические и нейроэндокринные эффекты. Так, блокада дофаминовых рецепторов в экстрапирамидной системе ведет к развитию нежелательных эффектов в виде экстрапирамидных расстройств (паркинсонизм, акатизия, повышение мышечного тонуса, острая и поздняя дискинезия), наблюдаемых более чем в 60% случаев при лечении типичными антипсихотиками. Аналогичное действие на тубероинфундибулярные дофаминергические проводящие пути в системе «гипоталамус–гипофиз» приводит к повышению уровня пролактина в крови, что вызывает такие нарушения, как гинекомастия, галакторея, нарушения менструального цикла и половые дисфункции.
В соответствии с такими особенностями действия первоначальная тенденция к назначению нейролептиков в высоких дозах (до 3000 мг в хлорпромазиновом эквиваленте в сутки) приводила к выраженным и разнообразным ЭПС – как в виде осложнений, отмечаемых с самого начала терапии, так и в виде так называемой «поздней» дискинезии, появляющейся отсроченно после длительного курса нейролептической терапии). Для минимизации этих рисков потребовалась разработка оптимальной тактики назначения антипсихотической терапии.
Впервые определение эффективной дозы было дано Х.Хаасе и П.Янссеном, предложившими использовать в качестве базового критерия начала нейролептического действия препарата появление инициальных неврологических симптомов, таких как изменение почерка пациента. Этим было установлено понятие «минимальной эффективной дозы», которая оказывает достаточное терапевтическое воздействие и снижает риск развития развернутых побочных эффектов (Haase, 1965).
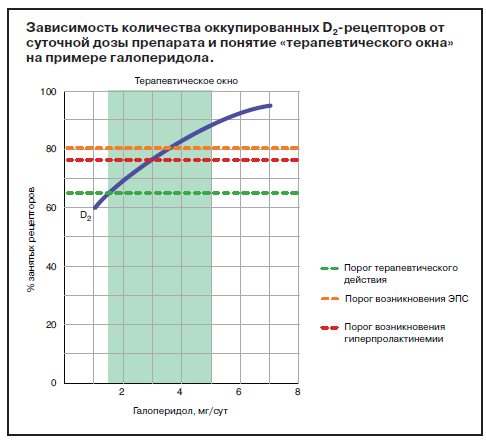 Оправданность такого подхода впоследствии была подтверждена с использованием лабораторных и инструментальных фармакологических методик (Kapur, 1998). Было показано, что для развития антипсихотического действия необходимо достижение уровня блокады дофаминергической активности не менее чем на 60–65% (это касается в первую очередь рецепторов D2-типа). Гиперпролактинемия возникает при блокаде 75% и более рецепторов; экстрапирамидные расстройства – при блокаде 80% и более. Таким образом, получающийся диапазон (блокада 60–80% дофаминовых рецепторов) составляет так называемое «терапевтическое окно», в которое при их назначении необходимо «уложиться» для достижения необходимого действия, с одной стороны, и предотвращения побочных эффектов – с другой (Farde, 1992). Это положение является наиболее актуальным в отношении АП-препаратов I поколения, например галоперидола (см. рисунок).
Оправданность такого подхода впоследствии была подтверждена с использованием лабораторных и инструментальных фармакологических методик (Kapur, 1998). Было показано, что для развития антипсихотического действия необходимо достижение уровня блокады дофаминергической активности не менее чем на 60–65% (это касается в первую очередь рецепторов D2-типа). Гиперпролактинемия возникает при блокаде 75% и более рецепторов; экстрапирамидные расстройства – при блокаде 80% и более. Таким образом, получающийся диапазон (блокада 60–80% дофаминовых рецепторов) составляет так называемое «терапевтическое окно», в которое при их назначении необходимо «уложиться» для достижения необходимого действия, с одной стороны, и предотвращения побочных эффектов – с другой (Farde, 1992). Это положение является наиболее актуальным в отношении АП-препаратов I поколения, например галоперидола (см. рисунок).
Таким образом, первоначальный опыт применения АП-препаратов I поколения (нейролептиков) позволил сформулировать теоретические основы нейролептической терапии (Delay, 1952). При этом ЭПС считались очевидными симптомами, свидетельствующими в числе прочего и о терапевтическом действии препарата. Первоначальное появление первого атипичного антипсихотика (клозапина) вызвало необходимость пересмотра этого мнения в связи с тем, что его высокая антипсихотическая активность не коррелировала с низким уровнем ЭПС (Hippius, 1989).
По мере накопления клинических данных первоначальный оптимизм в отношении ЭПС-осложнений при проведении АП-терапии препаратами II поколения перестал носить абсолютный характер. В ряде исследований показано, что риск развития ЭПС при назначении этих препаратов является хотя и заметно меньшим, но все же достаточно значительным (Leucht, 2003; Kane, 2009). Особенно заметным становится этот факт при изучении ЭПС не в рамках клинических исследований, а при сплошной оценке пациентов, получающих терапию в реальной клинической практике. Именно в таких условиях было обнаружено, что при длительной терапии пациентов с хронической шизофренией частота ЭПС при назначении атипичных препаратов не отличалась от таковой для низких доз типичных нейролептиков – от 5 до 10% вне зависимости от препарата (Miller, 2008). Результаты метаанализа клинических исследований показывают, что общая частота ЭПС при назначении всех АП-препаратов II поколения на 30–50% ниже, чем при использовании типичных нейролептиков (Leucht, 2009). Таким образом, очевидно, что проблема диагностики и коррекции ЭПС, возникающих при проведении АП-терапии, по-прежнему сохраняет свою актуальность.
Клинические варианты экстрапирамидных расстройств
ЭПС – группа наиболее распространенных осложнений АП-терапии, зачастую накладывающих существенные ограничения на ее проведение. Эти расстройства значительно чаще отмечаются при назначении традиционных нейролептиков, хотя смена приоритетов в сторону предпочтительного назначения атипичных АП-препаратов не устранила этой проблемы полностью (табл. 1).
Среди всех атипичных АП-препаратов побочные эффекты в виде ЭПС наиболее характерны для амисульприда и рисперидона. Для таких препаратов, как рисперидон, проявления ЭПС зависят от дозы и обычно наступают при повышении дозировок до 6 мг и более в сутки.
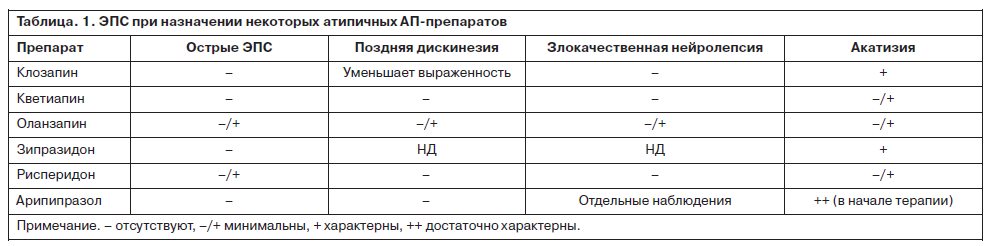
Наиболее редко возникновение ЭПС отмечается при применении клозапина и кветиапина, что связано с наименьшим сродством к D2-рецепторам и, соответственно, с низким уровнем их оккупирования при использовании в терапевтических дозах. Также имеются данные о том, что дальнейшее повышение дозировки этих препаратов приводит к возникновению плато, вследствие чего не возникает увеличения соотношения оккупированных и свободных
D2-рецепторов. Благодаря этому явлению частота ЭПС остается на низком уровне во всем диапазоне доз (Stein, 2007).
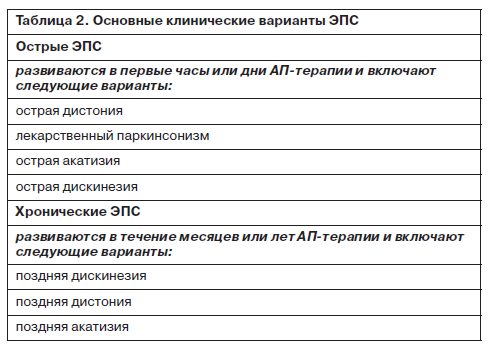
Основные варианты экстрапирамидных расстройств могут быть определены как немедленные («острые») и отсроченные («поздние») – табл. 2. Отсроченные эффекты характеризуются тенденцией к хроническому персистированию и в противоположность острым ЭПС лишь в незначительной степени реагируют на специфическую терапию препаратами-корректорами.
Следует отметить, что изолированное изучение различных вариантов ЭПС как в клиническом, так и патофизиологическом аспекте в достаточной степени затруднено из-за того, что чаще всего эти феномены сосуществуют. Другой проблемой являются трудности изолированного вычленения острых (ранних) и поздних дискинезий. Это связано с тем, что у большинства пациентов имеется предшествующий опыт антипсихотической терапии в анамнезе. Таким образом, в типичном случае происходит «наслоение» эффектов от прежних и текущего курсов терапии.
Острые ЭПС
Острая дистония
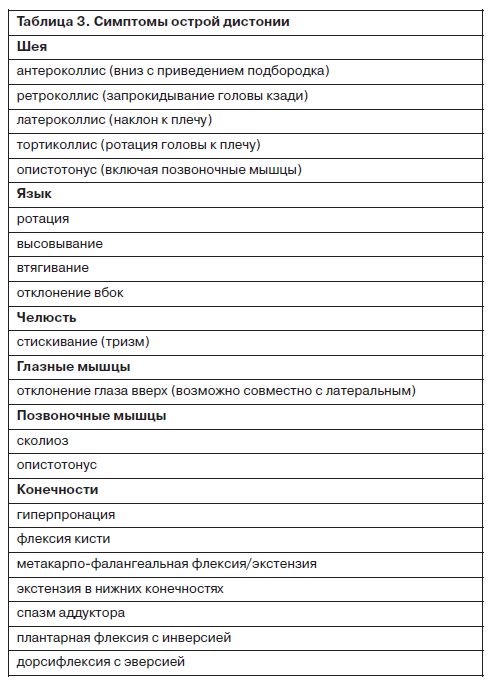
Это расстройство характеризуется непроизвольными движениями в виде спастических сокращений в отдельных мышечных группах по всему телу. Выделяются дистонии фокальные (единственная часть тела, например кривошея), сегментарные (две и более части тела с единой иннервацией) и генерализованные (затрагивающие значительную часть скелетной мускулатуры) – табл. 3.
Дистонические нарушения наиболее часто регистрируются в мышцах головы и шеи и, помимо уже упоминавшейся кривошеи, включают в себя ларингоспазмы, окулогирные кризы и опистотонус. Вовлеченность гортанных и глоточных мышц может приводить к респираторному дистрессу, нарушениям глотания и приступам удушья. Более мягкие формы дистонических расстройств проявляются чувством ригидности или болевыми ощущениями, предъявляемыми в виде одних лишь субъективных жалоб.
Частота дистонических реакций находится на уровне 25–40% (при назначении типичных АП-препаратов в терапевтических дозах), а особенностью их является высокая перекрываемость неврологических симптомов с психопатологическими (например, гримасы и другие лицевые движения, двигательные стереотипии, проявления манерности). В случаях затруднений дифференциации временны́е критерии и определение взаимосвязи выявленных расстройств с проводимой терапией позволяют квалифицировать их как проявления ЭПС.
Факторами риска в отношении развития дистонических осложнений являются: интенсивность проводимой терапии (высокопотентные препараты в высоких дозы), мужской пол, возраст до 40 лет, наличие аналогичных реакций в анамнезе, а также гипотиреоидизм и гипопаратиреоидизм. Одной из причин, по которой это нарушение преимущественно встречается у более молодых мужчин, возможно, является тенденция к проведению именно у этих больных интенсивной парентеральной АП-терапии.
В механизме возникновения острых дистонических реакций существенную роль играет выраженный D2-антагонизм препарата в стриарных отделах, возможно, включающий раннюю физиологически обусловленную адаптивную рецепторную реакцию на фармакологическую блокаду (ускорение оборота дофамина) и развивающуюся гиперчувствительность постсинаптических дофаминовых рецепторов (Stein, 2007).
Экстрапирамидные нарушения, манифестирующие симптомами острой дистонии, большей частью хорошо отвечают на терапию антихолинергическими препаратами. В ряде случаев может потребоваться использование парентеральных форм введения, что позволяет при необходимости достичь быстрого (в течение нескольких минут) эффекта. С учетом высокой частоты этих расстройств, также стоит учитывать возможность профилактического назначения препаратов антихолинергического действия с самого начала терапии, использующей D2-высокопотентные АП, или препараты с меньшим потенциалом, но в высоких дозах. Профилатическое использование таких холинолитиков, как бипериден, позволяет уменьшить частоту дистонических реакций более чем в 2 раза. Другим способом коррекции дистонических реакций является смена АП на препарат с меньшим риском развития ЭПС. При значительной выраженности острой дистонии целесообразно совмещать обе эти методики: антихолинергическая терапия + смена АП (Arana, 1988; Hansen, 1997).
Ключевые признаки, характеризующие паркинсоническую триаду: брадикинезия (акинезия), тремор и мышечная ригидность.
Брадикинезия (замедление моторики) – наиболее частый манифестный признак развивающегося лекарственного паркинсонизма. Подобное замедление может затрагивать и произвольные движения, речь и активность лицевых мимических мыщц (маскообразное лицо). При оценке этих симптомов необходимо учитывать, что некоторые из них также могут перекрываться с негативными симптомами шизофрении (такими, как эмоциональное уплощение и бедность речи).
Тремор первоначально проявляется в виде высокочастотных (до 10–20 в секунду) низкоамплитудных движений, лучше всего заметных в расставленных пальцах вытянутых вперед рук. Впоследствии его сменяет классический паркинсонический тремор меньшей частоты (порядка 5 в секунду) и большей амплитуды, отмечаемый в покое. Неврологическое обследование также обычно выявляет нарушение тонических рефлексов Магнуса–Клейна.
Симптомы мышечной ригидности вызваны нарушением тонуса мышц в покое; его усиление хорошо заметно при пассивных (не задействующих мышцы) движениях. Отличительной особенностью мышечной ригидности от спастических нарушений является постоянство повышения тонуса во всем объеме пассивного движения (подобное пластичному сгибанию/разгибанию отрезка мягкого металла; отсюда название: симптом «свинцовой трубки»). При повторении движения заметно дальнейшее усиление тонуса; такое же усиление регистрируется при произвольном сокращении мышц противоположной конечности. Этот симптом лучше всего заметен при круговых движениях рук. Сочетание мышечной ригидности с тремором приводит к тому, что гипертонус при пассивном движении ощущается равномерно прерывистым (симптом «зубчатого колеса»), что обычно выявляется при пассивных флексионно-экстензионных движениях рук.
Некоторые авторы в структуре лекарственного паркинсонизма отдельно выделяют психопатологические нарушения: депрессивное настроение в сочетании с уплощенными аффективными реакциями и когнитивные нарушения – понятие, перекрывающееся с концепцией так называемых «вторичных негативных симптомов» (Remington, 1996; Arana, 2000).
В типичных случаях лекарственный паркинсонизм развивается в течение 7–10 дней после начала курса АП-терапии. Его механизм состоит в регулярной длительной блокаде нигростриатального дофаминергического пути в сочетании с генетической предрасположенностью.
По мере постепенного вытеснения типичных нейролептических средств препаратами II поколения (атипичными) распространенность лекарственного паркинсонизма в значительной степени снизилась. Основные группы риска в отношении развития этих расстройств в настоящее время: пожилые пациенты, а также пациенты, получающие терапию препаратами пролонгированного действия (включая депонированную форму рисперидона). В зависимости от проводимой терапии тактика купирования паркинсоноподобной симптоматики может подразумевать либо смену терапии, либо назначение антихолинергической корректирующей терапии, длительность которой не должна превышать 4–6 мес.
Острая акатизия
Жалобы на неусидчивость могут возникать у пациентов уже на начальных этапах АП-терапии. Субъективно наиболее тяжелым является чувство внутреннего беспокойства и дискомфорта, напряжения в ногах и невозможности удержать себя в состоянии покоя. Типичным проявлением являются постоянные движения ногами в положении сидя и невозможность находиться в спокойном положении стоя. Менее характерны тянущее чувство или толчки в мышцах, иногда сопровождающиеся парестезиями. Как и при лекарственном паркинсонизме, 80–90% случаев акатизии проявляется в течение первых 2 мес терапии и чаще (примерно в 2 раза) регистрируется у женщин. Из атипичных АП препаратами риска в отношении этого варианта ЭПС являются: рисперидон (в дозах выше 6 мг в сутки), амисульприд (в широком диапазоне доз) и арипипразол (чаще транзиторно, в первые 2 нед терапии).
Одной из причин, по которым именно акатизия зачастую служит причиной отказа от терапии, является характерный для таких состояний дисфорический аффект, в особо выраженных случаях сопровождающийся расстройствами поведения вплоть до суицидального. Именно по этой причине коррекция таких состояний должна быть незамедлительной.
Основным дифференциально-диагностическим вопросом является отделение острой акатизии от состояний психомоторного возбуждения. Проблема состоит в том, что терапия этих двух нарушений является прямо противоположной. В то время как ажитация и возбуждение – показание к увеличению дозы АП-препарата, этот же вариант лечения может вызвать заметное ухудшение у пациента с акатизией.
Механизм возникновения акатизии, возможно, отличается от часто сопровождающего ее паркинсонизма. Предполагается, что эти два состояния обусловливаются дисрегуляцией в разных отделах дофаминергической системы: мезокортикальном в первом случае, нигростриатальном – во втором. Возможное подтверждение этому может быть найдено в том, что разные АП-препараты вызывают различные варианты ЭПС: так, для арипипразола в большей степени характерны именно нарушения по типу изолированной акатизии. Дальнейшее уточнение этого вопроса позволит оптимизировать рекомендации по безопасной АП-терапии.
Другая причина, по которой акатизия занимает особое место среди всех острых ЭПС-осложнений, состоит в том, что эффективность антихолинергических препаратов в отношении рассматриваемых симптомов оказывается ниже. Таким образом, основным способом преодоления ЭПС с явлениями акатизии является титрация дозы АП в сторону уменьшения либо смена препарата. Также существуют данные об эффективности следующих препаратов (в порядке уменьшения доказательной базы): b-блокаторов, бензодиазепинов, антигистаминергических средств, а также 5HT2A-антагонистов (миансерин) (Stanilla, 2009).
Поздние ЭПС
Хронические или поздние варианты ЭПС развиваются в течение нескольких месяцев или лет регулярной АП-терапии, зачастую вне связи с какими-либо изменениями дозировок или сменами препарата. Течение этих расстройств также не обнаруживает корреляций с дозированием АП, а его отмена не обязательно вызывает разрешение ЭПС (иногда, напротив, ухудшение). Основными вариантами таких состояний являются поздняя дискинезия и поздняя дистония.
Поздняя дискинезия
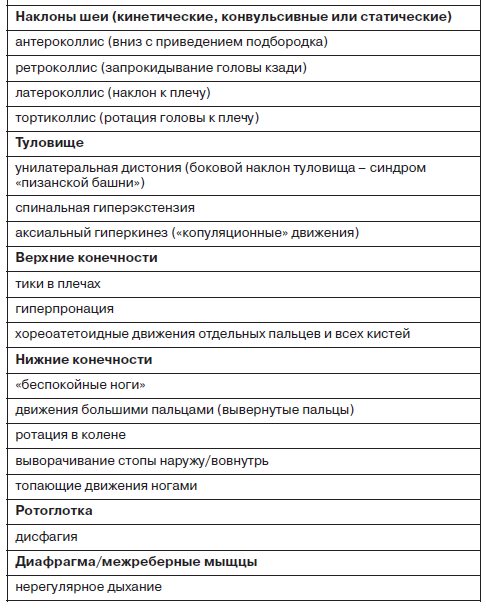
В числе первых работ с клиническим описанием этих состояний были работа немецкого психиатра M.Schonecker (1957 г.) – 3 наблюдения и 2 публикации J.Sigwald и соавт. (1959 г.) – 4 наблюдения. В последующие несколько лет количество таких сообщений последовательно возросло. Так, в работе датских исследователей L.Uhrbrand и A.Faurbye (1960 г.) приводилось систематизированное описание 33 диагностически гетерогенных пациентов с длительным пребыванием в стационаре, которые в числе прочего получали длительную терапию АП-препаратами. Последнее обстоятельство и было определено авторами в качестве основного каузального фактора, а сами состояния были обозначены термином «поздняя дискинезия». Этот термин первое время равномерно сосуществовал с другим («орально-лицевая дискинезия»), до тех пор пока не было обнаружено, что проявления поздних дискинезий не обязательно ограничиваются только лицевой мускулатурой, хотя чаще регистрируются именно в области лица (Waddington, 1995) – табл. 4.
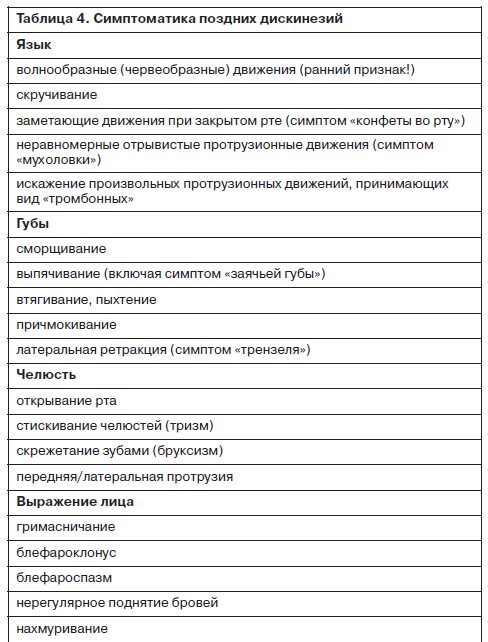
Ранним симптомом поздней дискинезии являются волнообразные или червеобразные движения языком. Диагностическая ценность данного признака, однако, не столь высока, с учетом того факта, что этот симптом регистрируется у 5–15% всех пациентов позднего возраста, включая тех, кто никогда не принимал АП-препараты (Gerlach, 1996). Часто возникает совместное вовлечение оральной и периоральной мускулатуры в составе «букко-лингво-мастикаторной триады». Ее симптомами являются надувание щек, сжимание и наморщивание губ, выпячивание щек с помощью языка и псевдожевательные или сосущие движения. Многие из этих движений у пациентов позднего возраста необходимо дифференцировать с болезненностью или плохой подгонкой зубных протезов.
Несмотря на то что эти движения обычно характеризуются как «хореоатетоидные», обычно они являются комплексными, повторяющимися и достаточно скоординированными в отличие от типичных хореиформных движений. Часто пациент сам не отмечает возникновения рассматриваемых нарушений, и первыми, кто обращает на это внимание, становятся другие люди (например, члены семьи).
Степень выраженности поздней дискинезии в существенной степени зависит от психического состояния пациента. Выраженность дискинезий возрастает при появлении, например, взбудораженности и ослабевает при снижении уровня возбуждения и тревоги. Также эти движения могут произвольным образом подавляться на некоторые периоды времени или вообще исчезать в то время, как пациент, к примеру, концентрируется на выполнении какого-либо задания. Активность в других отделах тела вызывает их активацию. Так, просьба о последовательном прикосновении большими пальцами рук к каждому из остальных пальцев может спровоцировать появление дискинетических движений в области лица. Прием некоторых препаратов других групп (таких, как серотонинергические антидепрессанты – флуоксетин, пароксетин и другие, или метоклопрамид – Церукал) также может приводить к возникновению поздней дискинезии.
Установленными факторами риска в отношении возникновения поздних дискинезий являются: большая продолжительность курса АП-терапии, использование высоких доз препаратов с большой степенью сродства к D2-рецепторам, а также наличие перерывов в терапии длительностью в несколько недель или месяцев с последующим ее возобновлением. Другими факторами риска являются: поздний возраст, болезнь Паркинсона в семейном анамнезе, предшествующие острые формы ЭПС (в особенности паркинсонизм). Для типичных АП-препаратов риск возникновения поздней дискинезии оценивается на уровне 4–10% на год постоянного применения. Для атипичных АП – производных клозапина этот же показатель снижается до 0,5–2% на год терапии (Glazer, 2000; Corell, 2004; Kane, 2004). У пациентов позднего возраста этот риск возрастает в 5–6 раз вне зависимости от категории АП-препарата (Jeste, 1993). Кумулятивная оценка, проведенная в исследовании Quinn и соавт. (2001 г.), показала, что распространенность поздних форм ЭПС на протяжении жизни может приближаться к 100% для групп пациентов, получающих длительную многолетнюю терапию АП I поколения.
Особенностью клозапина и ряда его производных (оланзапин, кветиапин) является способность уменьшать после смены терапии выраженность поздних дискинезий, вызванных другими АП-препаратами, в 40–50% (Lieberman, 1991; Stein, 2007).
Для объяснения возможных механизмов возникновения поздних форм ЭПС было предложено несколько гипотез. Согласно Carlsson (1985 г.) применение антагонистов дофамина приводит к гиперсензитивности дофаминергической системы в стриатуме. В подтверждение этого структурные исследования обнаружили 50% увеличение плотности постсинаптических рецепторов после длительного применения галоперидола в отличие от клозапина.
Как уже упоминалось, в норме моторная деятельность определяется балансом между холинергической и дофаминергической системами в стриатуме; причем паркинсоноподобные расстройства возникают в ответ на снижение активности дофаминергической системы. В соответствии с этой моделью поздние дискинезии могут быть объяснены смещенным в противоположном направлении балансом с развитием гиперчувствительности дофаминергической системы, что приводит к увеличению рецепторного ответа даже на сниженные концентрации дофамина и в результате вызывает появление гиперкинезов.
Поздние дискинезии являются одними из наиболее неблагоприятных форм ЭПС, что связано с трудностями их коррекции. Согласно заключению ряда исследователей, систематически оценивавших различные варианты исходов, в настоящее время не существует единых, четко сформулированных формализованных терапевтических алгоритмов, направленных на редукцию этих симптомов (Kane, 1988; APA, 1992). И хотя распространенность поздних дискинезий в значительной степени уменьшилась после широкого внедрения атипичных АП-препаратов, начиная с появления клозапина (Lieberman, 1991), для многих пациентов с уже развившимися поздними ЭПС эта проблема сохраняет свою актуальность.
Это связано с тем, что смена препарата или прекращение терапии приводит к редукции дискинезии лишь у небольшого числа больных. Аналогичным образом корректирующая терапия с использованием антихолинергических препаратов в большинстве случаев оказывается недостаточно эффективной. Существуют отдельные сообщения о возможности положительного ответа на применение производных бензодиазепина, в особенности клоназепама, в дозах 2–4,5 мг в сутки, что в свою очередь требует использования длительных непрерывных курсов; достигнутый эффект не является стойким и исчезает в течение 4–6 мес регулярного приема, а также после отмены транквилизатора (Thaker, 1990).
Необходимо отдельно упомянуть о проблеме гиподиагностики поздних ЭПС. С одной стороны, уровень знаний пациентов о потенциальной возможности и особенностях этих осложнений остается недостаточным, а с другой – стоит расширение показаний для длительного применения АП-препаратов (в первую очередь I поколения) при отсутствии адекватного мониторинга на протяжении всего курса терапии.
Поздняя дистония
Подобно острым реакциям, стойкие дистонические нарушения с поздним манифестом способны в значительной степени ухудшать общий уровень функционирования. Выделяются: фокальная (локализованная в одном участке), сегментарная (дислоцированная в более широком отделе или нескольких) и унилатеральная аксиальная дистония. Характерные проявления поздней дистонии: фиксированное, застывшее положение конечностей, шеи, туловища или выражение лица.
Общие терапевтические методики в отношении дистонических расстройств достаточно широки и включают в себя как применение препаратов типа ботулинического токсина, так и нейрохирургические методики (глубокая стимуляция мозга). Тем не менее ни одна из них не была опробована и рекомендована пациентам с лекарственными дистониями. В отличие от поздних дискинезий пациенты со стойкими дистоническими расстройствами в значительной степени положительно отвечают на систематическое применение антихолинергических препаратов. Только отдельные случаи поздних дистоний отличаются стойкостью и резистентностью в отношении терапии (Stanilla, 2001; Krauss, 2004).
Поздняя акатизия
Эта группа нарушений сходна по своим клиническим проявлениям с острыми формами акатизий. Единственное отличие затрагивает их временну́ю связь с курсом АП-терапии. Также отмечается, что субъективное чувство беспокойства и дисфория при позднем варианте акатизии менее выражены. Алгоритм коррекции также является общим для всех форм акатизии (Barnes, 1992).
Механизм действия антихолинергических препаратов и вопросы выбора
Действие холинолитических средств на экстрапирамидные расстройства определяется их способностью блокировать центральные ацетилхолиновые мускариновые рецепторы. Ключевой предпосылкой, объясняющей действие антихолинергических средств на ЭПС, вызванные АП-терапией, является концепция взаимного баланса дофаминергической и холинергической систем. Поскольку дофамин тормозит высвобождение ацетилхолина в стриатуме, то назначение АП, обладающих дофаминблокирующими свойствами, приводит к более интенсивному высвобождению ацетилхолина в стриатуме. Это приводит к нарушению баланса ацетилхолина/дофамина, что в свою очередь является ключевым звеном в возникновении ЭПС. Действие антихолинергических препаратов заключается в восстановлении нарушенного баланса. Дополнительными их эффектами являются антигистаминергическое действие и возможная блокада обратного захвата дофамина (Stein, 2007).
Такое теоретическое представление о механизме действия ставит перед исследователем вопрос: насколько двусторонним является этот баланс в плане регуляции? Другими словами, может ли назначение препаратов-корректоров вызвать снижение эффекта на активном этапе базовой АП-терапии или спровоцировать рецидив на этапе терапии поддерживающей? Несмотря на видимую проработанность теории, ответ на него не очевиден. Данные специальных исследований, направленных на прояснение этого вопроса, также не в полной мере соотносятся между собой. Тем не менее попытка выявить некоторые общие закономерности может быть предпринята.
В череде исследований, проводившихся на протяжении почти 30 лет (Gershon, 1960; Haase, 1965; Itil, 1969; Singh, 1979, 1987; Johnstone, 1983, 1988), было показано существование двух основных вариантов действия:
1) обострение психотической симптоматики и 2) ограничение терапевтического действия АП-препаратов на продуктивную симптоматику. Отдельно стоит упомянуть и обратную способность: назначение антихолинергических средств приводит к некоторому улучшению показателей негативной симптоматики даже у пациентов, не получающих АП-терапии, что снова позволяет говорить о влиянии не только на депримирующее действие АП, но также и о прямом воздействии на психопатологическую симптоматику (Tandon, 1990).
C другой стороны, существуют исследования, показывающие, что одновременное или постепенное прекращение приема антихолинергических средств не приводит к значимому сдвигу в показателях, оценивающих выраженность достигнутого антипсихотического эффекта, и лишь в отдельных случаях может быть ассоциировано с ухудшением состояния (Ananth, 1970; McClelland, 1974; Rifkin, 1975; Jellinek, 1981; Manos, 1981).
Таким образом, можно предположить, что понятие баланса системы «дофамин–ацетилхолин» включает в себя не только влияние любой одной из ее составляющих на клинически регистрируемые проявления действия другой, но также и определяет способность этой составляющей изменять выраженность фармакологических эффектов, которым подвергается противоположное плечо системы.
Какие практически ориентированные рекомендации могут быть предложены, исходя из результатов исследований совместного влияния и взаимодействия двух классов препаратов – АП и холинолитиков?
Разработанные на начальных этапах развития психофармакологии стандарты использования холинолитических препаратов подразумевают в ряде случаев их стабильный прием на всем протяжении курса АП-терапии. Такой «сопутствующий» прием холинолитиков преследует две цели: 1) профилактику потенциально возможных ЭП-осложнений и 2) коррекцию уже существующих (Singh, 1979; Manos, 1981; Double, 1993).
По мнению ряда исследователей, существующая дискуссия в отношении оправданности профилактического назначения антихолинергических препаратов не может быть разрешена единым образом, без учета сочетания факторов, уникальных для каждого клинического случая. С одной стороны, профилактическое применение антипаркинсонических средств позволяет снизить частоту острых форм ЭПС и, возможно, предотвратить развития поздних вариантов синдрома, а с другой – назначение холинолитических средств связано с заметными самостоятельными побочными эффектами, включая неблагоприятное влияние на когнитивные функции. С учетом этого факта при назначении препаратов-корректоров необходимо существенное внимание уделять вопросам безопасности. Обоснованный выбор препарата позволяет улучшить суммарную переносимость всей совокупной терапии и сохранить высокий уровень лекарственного комплаенса (Аведисова, 1998).
Первым М1-холинолитиком преимущественно центрального действия был синтетический аналог атропина тригексифенидил, представленный в 1949 г. Благодаря структуре третичного амина тригексифенидил легко проникает сквозь гематоэнцефалический барьер, вследствие чего оказывает преимущественное центральное действие (Brown, 1996). Практически сразу препарат нашел широкое применение при лечении болезни Паркинсона (Doshay, 1954), а с внедрением первых нейролептиков – и для коррекции осложнений нейролептической терапии (Rashkis, 1957).
Бипериден (Акинетон) – антихолинергический препарат, подобно тригексифенидилу обладает избирательным действием на М1-мускариновые и в меньшей степени – на никотиновые ацетилхолиновые рецепторы (Syvalähti, 1987; Eltze, 1988). Также у препарата описан эффект NMDA-антагонизма, что, как предполагается, приводит к более быстрому разрешению ЭПС (Левин, 2012). Его отличительной способностью является меньшая выраженность периферических антихолинергических побочных эффектов (запоры, сухость во рту, нечеткость зрения, задержка мочи, гипотензия) по сравнению с другими препаратами (Avissar, 1989). Обычная суточная доза препарата при лечении различных вариантов ЭПС находится в диапазоне 2–24 мг/сут. В отличие от тригексифенидила к применению доступна инъекционная форма препарата для внутривенного или внутримышечного введения, что позволяет быстро достигнуть пиковой концентрации (Timberlake, 1961). В сравнительных исследованиях было показано, что для биперидена характерна меньшая выраженность и частота расстройств когнитивной сферы, в числе которых стоит назвать функции памяти и внимания (Аведисова, 1998).
В случае, если антихолинергическая терапия проводится с профилактической целью, необходимо учитывать все факторы потенциального риска развития ЭПС (возраст, длительность курса и доза препарата, анамнестические данные и др.) с целью избежать неоправданного назначения в завышенных дозах (Taylor, 1991). Для отмены антихолинергических средств после длительного курса рекомендуется ступенчатая схема с целью минимизации явлений лекарственного рикошета с симптомами в виде тошноты, инсомнии и тревоги (Double, 1993; Ungvari, 1999).
Сведения об авторе
Д.В.Ястребов – ст. науч. сотр. отд-ния новых средств и методов терапии ГНЦ ССП им. В.П.Сербского.
E-mail: dvyastrebov@gmail.com
Ключевые слова: антипсихотическая терапия, экстрапирамидные расстройства, препараты холинолитического действия, бипериден.
Extrapyramidal disorders complicating antipsychotic therapy: сurrent understanding of their clinical presentation, pathogenesis, and correction
D.V.Yastrebov
V.P.Serbsky social and forensic psychiatry state research centre, Moscow
Summary. The article reviews different forms of EPS – one the most common complications of antipsychotic therapy. The typology of EPS is discussed, the mechanisms and therapeutic recommendations are given.
Key words: antipsychotic therapy, EPS, anticholinergic drugs, biperiden.
Проблема экстрапирамидных расстройств (экстрапирамидная симптоматика – ЭПС), осложняющих терапию с использованием препаратов антипсихотического действия (АП), привлекает внимание исследователей и практических психиатров с момента внедрения этих лекарственных средств. Вопросы распространенности и патофозиологии этих побочных эффектов, а также рационального назначения антипсихотической терапии, позволяющего уменьшить риск их возникновения и интенсивность, а также методов их коррекции, в большинстве своем считаются детально проработанными и неоднократно освещались в печати, в том числе и на страницах нашего журнала (Д.И.Малин, 2001; П.В.Морозов и соавт., 2011).
Результатом многолетнего изучения явилось создание типологии дискинезий и определение патофизиологических механизмов, лежащих в основе их возникновения. Тем не менее исследовательская работа в этом направлении продолжается, благодаря чему до настоящего времени появляются новые данные и уточняются рекомендации по проведению эффективной и безопасной антипсихотической терапии. Необходимость обновления и пересмотра существующих данных объясняется, с одной стороны, углублением понимания вопросов патогенеза рассматриваемых расстройств, а с другой – внедрением в клиническую практику новых АП-препаратов, в значительной степени уменьшивших частоту ЭПС, но не исключивших их полностью, и при этом заметным образом видоизменивших структуру клинических проявлений.
Считается обоснованным предположение о том, что уязвимость в отношении возникновения ЭПС индивидуально детерминирована. Базовыми факторами предиспозиции выделяются возраст и пол пациента. Так, предполагается, что у молодых людей и подростков мужского пола чаще развиваются острые дистонические реакции, в то время как поздний возраст и женский пол в большей степени ассоциированы с паркинсоноподобной симптоматикой. Аналогичным образом указывается, что поздние дискинезии в 5 раз чаще возникают у пациентов позднего возраста, в особенности у женщин. Существенную роль играет наследственная отягощенность экстрапирамидными расстройствами, а также предыдущая история переносимости курсов АП-терапии.
Исторический аспект
Собственно антипсихотическое действие нейролептиков связывается с блокадой D2-дофаминовых рецепторов в мезолимбической и мезокортикальной областях мозга. Наряду с основным терапевтическим действием АП-препараты обладают и рядом побочных эффектов, связанных с блокадой дофаминергической передачи в тех областях, которые отвечают за неврологические и нейроэндокринные эффекты. Так, блокада дофаминовых рецепторов в экстрапирамидной системе ведет к развитию нежелательных эффектов в виде экстрапирамидных расстройств (паркинсонизм, акатизия, повышение мышечного тонуса, острая и поздняя дискинезия), наблюдаемых более чем в 60% случаев при лечении типичными антипсихотиками. Аналогичное действие на тубероинфундибулярные дофаминергические проводящие пути в системе «гипоталамус–гипофиз» приводит к повышению уровня пролактина в крови, что вызывает такие нарушения, как гинекомастия, галакторея, нарушения менструального цикла и половые дисфункции.
В соответствии с такими особенностями действия первоначальная тенденция к назначению нейролептиков в высоких дозах (до 3000 мг в хлорпромазиновом эквиваленте в сутки) приводила к выраженным и разнообразным ЭПС – как в виде осложнений, отмечаемых с самого начала терапии, так и в виде так называемой «поздней» дискинезии, появляющейся отсроченно после длительного курса нейролептической терапии). Для минимизации этих рисков потребовалась разработка оптимальной тактики назначения антипсихотической терапии.
Впервые определение эффективной дозы было дано Х.Хаасе и П.Янссеном, предложившими использовать в качестве базового критерия начала нейролептического действия препарата появление инициальных неврологических симптомов, таких как изменение почерка пациента. Этим было установлено понятие «минимальной эффективной дозы», которая оказывает достаточное терапевтическое воздействие и снижает риск развития развернутых побочных эффектов (Haase, 1965).
 Оправданность такого подхода впоследствии была подтверждена с использованием лабораторных и инструментальных фармакологических методик (Kapur, 1998). Было показано, что для развития антипсихотического действия необходимо достижение уровня блокады дофаминергической активности не менее чем на 60–65% (это касается в первую очередь рецепторов D2-типа). Гиперпролактинемия возникает при блокаде 75% и более рецепторов; экстрапирамидные расстройства – при блокаде 80% и более. Таким образом, получающийся диапазон (блокада 60–80% дофаминовых рецепторов) составляет так называемое «терапевтическое окно», в которое при их назначении необходимо «уложиться» для достижения необходимого действия, с одной стороны, и предотвращения побочных эффектов – с другой (Farde, 1992). Это положение является наиболее актуальным в отношении АП-препаратов I поколения, например галоперидола (см. рисунок).
Оправданность такого подхода впоследствии была подтверждена с использованием лабораторных и инструментальных фармакологических методик (Kapur, 1998). Было показано, что для развития антипсихотического действия необходимо достижение уровня блокады дофаминергической активности не менее чем на 60–65% (это касается в первую очередь рецепторов D2-типа). Гиперпролактинемия возникает при блокаде 75% и более рецепторов; экстрапирамидные расстройства – при блокаде 80% и более. Таким образом, получающийся диапазон (блокада 60–80% дофаминовых рецепторов) составляет так называемое «терапевтическое окно», в которое при их назначении необходимо «уложиться» для достижения необходимого действия, с одной стороны, и предотвращения побочных эффектов – с другой (Farde, 1992). Это положение является наиболее актуальным в отношении АП-препаратов I поколения, например галоперидола (см. рисунок).
Таким образом, первоначальный опыт применения АП-препаратов I поколения (нейролептиков) позволил сформулировать теоретические основы нейролептической терапии (Delay, 1952). При этом ЭПС считались очевидными симптомами, свидетельствующими в числе прочего и о терапевтическом действии препарата. Первоначальное появление первого атипичного антипсихотика (клозапина) вызвало необходимость пересмотра этого мнения в связи с тем, что его высокая антипсихотическая активность не коррелировала с низким уровнем ЭПС (Hippius, 1989).
По мере накопления клинических данных первоначальный оптимизм в отношении ЭПС-осложнений при проведении АП-терапии препаратами II поколения перестал носить абсолютный характер. В ряде исследований показано, что риск развития ЭПС при назначении этих препаратов является хотя и заметно меньшим, но все же достаточно значительным (Leucht, 2003; Kane, 2009). Особенно заметным становится этот факт при изучении ЭПС не в рамках клинических исследований, а при сплошной оценке пациентов, получающих терапию в реальной клинической практике. Именно в таких условиях было обнаружено, что при длительной терапии пациентов с хронической шизофренией частота ЭПС при назначении атипичных препаратов не отличалась от таковой для низких доз типичных нейролептиков – от 5 до 10% вне зависимости от препарата (Miller, 2008). Результаты метаанализа клинических исследований показывают, что общая частота ЭПС при назначении всех АП-препаратов II поколения на 30–50% ниже, чем при использовании типичных нейролептиков (Leucht, 2009). Таким образом, очевидно, что проблема диагностики и коррекции ЭПС, возникающих при проведении АП-терапии, по-прежнему сохраняет свою актуальность.
Клинические варианты экстрапирамидных расстройств
ЭПС – группа наиболее распространенных осложнений АП-терапии, зачастую накладывающих существенные ограничения на ее проведение. Эти расстройства значительно чаще отмечаются при назначении традиционных нейролептиков, хотя смена приоритетов в сторону предпочтительного назначения атипичных АП-препаратов не устранила этой проблемы полностью (табл. 1).
Среди всех атипичных АП-препаратов побочные эффекты в виде ЭПС наиболее характерны для амисульприда и рисперидона. Для таких препаратов, как рисперидон, проявления ЭПС зависят от дозы и обычно наступают при повышении дозировок до 6 мг и более в сутки.

Наиболее редко возникновение ЭПС отмечается при применении клозапина и кветиапина, что связано с наименьшим сродством к D2-рецепторам и, соответственно, с низким уровнем их оккупирования при использовании в терапевтических дозах. Также имеются данные о том, что дальнейшее повышение дозировки этих препаратов приводит к возникновению плато, вследствие чего не возникает увеличения соотношения оккупированных и свободных
D2-рецепторов. Благодаря этому явлению частота ЭПС остается на низком уровне во всем диапазоне доз (Stein, 2007).
Основные варианты экстрапирамидных расстройств могут быть определены как немедленные («острые») и отсроченные («поздние») – табл. 2. Отсроченные эффекты характеризуются тенденцией к хроническому персистированию и в противоположность острым ЭПС лишь в незначительной степени реагируют на специфическую терапию препаратами-корректорами.
Следует отметить, что изолированное изучение различных вариантов ЭПС как в клиническом, так и патофизиологическом аспекте в достаточной степени затруднено из-за того, что чаще всего эти феномены сосуществуют. Другой проблемой являются трудности изолированного вычленения острых (ранних) и поздних дискинезий. Это связано с тем, что у большинства пациентов имеется предшествующий опыт антипсихотической терапии в анамнезе. Таким образом, в типичном случае происходит «наслоение» эффектов от прежних и текущего курсов терапии.

Острые ЭПС
Острая дистония
Это расстройство характеризуется непроизвольными движениями в виде спастических сокращений в отдельных мышечных группах по всему телу. Выделяются дистонии фокальные (единственная часть тела, например кривошея), сегментарные (две и более части тела с единой иннервацией) и генерализованные (затрагивающие значительную часть скелетной мускулатуры) – табл. 3.
Дистонические нарушения наиболее часто регистрируются в мышцах головы и шеи и, помимо уже упоминавшейся кривошеи, включают в себя ларингоспазмы, окулогирные кризы и опистотонус. Вовлеченность гортанных и глоточных мышц может приводить к респираторному дистрессу, нарушениям глотания и приступам удушья. Более мягкие формы дистонических расстройств проявляются чувством ригидности или болевыми ощущениями, предъявляемыми в виде одних лишь субъективных жалоб.

Частота дистонических реакций находится на уровне 25–40% (при назначении типичных АП-препаратов в терапевтических дозах), а особенностью их является высокая перекрываемость неврологических симптомов с психопатологическими (например, гримасы и другие лицевые движения, двигательные стереотипии, проявления манерности). В случаях затруднений дифференциации временны́е критерии и определение взаимосвязи выявленных расстройств с проводимой терапией позволяют квалифицировать их как проявления ЭПС.
Факторами риска в отношении развития дистонических осложнений являются: интенсивность проводимой терапии (высокопотентные препараты в высоких дозы), мужской пол, возраст до 40 лет, наличие аналогичных реакций в анамнезе, а также гипотиреоидизм и гипопаратиреоидизм. Одной из причин, по которой это нарушение преимущественно встречается у более молодых мужчин, возможно, является тенденция к проведению именно у этих больных интенсивной парентеральной АП-терапии.
В механизме возникновения острых дистонических реакций существенную роль играет выраженный D2-антагонизм препарата в стриарных отделах, возможно, включающий раннюю физиологически обусловленную адаптивную рецепторную реакцию на фармакологическую блокаду (ускорение оборота дофамина) и развивающуюся гиперчувствительность постсинаптических дофаминовых рецепторов (Stein, 2007).
Экстрапирамидные нарушения, манифестирующие симптомами острой дистонии, большей частью хорошо отвечают на терапию антихолинергическими препаратами. В ряде случаев может потребоваться использование парентеральных форм введения, что позволяет при необходимости достичь быстрого (в течение нескольких минут) эффекта. С учетом высокой частоты этих расстройств, также стоит учитывать возможность профилактического назначения препаратов антихолинергического действия с самого начала терапии, использующей D2-высокопотентные АП, или препараты с меньшим потенциалом, но в высоких дозах. Профилатическое использование таких холинолитиков, как бипериден, позволяет уменьшить частоту дистонических реакций более чем в 2 раза. Другим способом коррекции дистонических реакций является смена АП на препарат с меньшим риском развития ЭПС. При значительной выраженности острой дистонии целесообразно совмещать обе эти методики: антихолинергическая терапия + смена АП (Arana, 1988; Hansen, 1997).
Ключевые признаки, характеризующие паркинсоническую триаду: брадикинезия (акинезия), тремор и мышечная ригидность.
Брадикинезия (замедление моторики) – наиболее частый манифестный признак развивающегося лекарственного паркинсонизма. Подобное замедление может затрагивать и произвольные движения, речь и активность лицевых мимических мыщц (маскообразное лицо). При оценке этих симптомов необходимо учитывать, что некоторые из них также могут перекрываться с негативными симптомами шизофрении (такими, как эмоциональное уплощение и бедность речи).
Тремор первоначально проявляется в виде высокочастотных (до 10–20 в секунду) низкоамплитудных движений, лучше всего заметных в расставленных пальцах вытянутых вперед рук. Впоследствии его сменяет классический паркинсонический тремор меньшей частоты (порядка 5 в секунду) и большей амплитуды, отмечаемый в покое. Неврологическое обследование также обычно выявляет нарушение тонических рефлексов Магнуса–Клейна.
Симптомы мышечной ригидности вызваны нарушением тонуса мышц в покое; его усиление хорошо заметно при пассивных (не задействующих мышцы) движениях. Отличительной особенностью мышечной ригидности от спастических нарушений является постоянство повышения тонуса во всем объеме пассивного движения (подобное пластичному сгибанию/разгибанию отрезка мягкого металла; отсюда название: симптом «свинцовой трубки»). При повторении движения заметно дальнейшее усиление тонуса; такое же усиление регистрируется при произвольном сокращении мышц противоположной конечности. Этот симптом лучше всего заметен при круговых движениях рук. Сочетание мышечной ригидности с тремором приводит к тому, что гипертонус при пассивном движении ощущается равномерно прерывистым (симптом «зубчатого колеса»), что обычно выявляется при пассивных флексионно-экстензионных движениях рук.
Некоторые авторы в структуре лекарственного паркинсонизма отдельно выделяют психопатологические нарушения: депрессивное настроение в сочетании с уплощенными аффективными реакциями и когнитивные нарушения – понятие, перекрывающееся с концепцией так называемых «вторичных негативных симптомов» (Remington, 1996; Arana, 2000).
В типичных случаях лекарственный паркинсонизм развивается в течение 7–10 дней после начала курса АП-терапии. Его механизм состоит в регулярной длительной блокаде нигростриатального дофаминергического пути в сочетании с генетической предрасположенностью.
По мере постепенного вытеснения типичных нейролептических средств препаратами II поколения (атипичными) распространенность лекарственного паркинсонизма в значительной степени снизилась. Основные группы риска в отношении развития этих расстройств в настоящее время: пожилые пациенты, а также пациенты, получающие терапию препаратами пролонгированного действия (включая депонированную форму рисперидона). В зависимости от проводимой терапии тактика купирования паркинсоноподобной симптоматики может подразумевать либо смену терапии, либо назначение антихолинергической корректирующей терапии, длительность которой не должна превышать 4–6 мес.
Острая акатизия
Жалобы на неусидчивость могут возникать у пациентов уже на начальных этапах АП-терапии. Субъективно наиболее тяжелым является чувство внутреннего беспокойства и дискомфорта, напряжения в ногах и невозможности удержать себя в состоянии покоя. Типичным проявлением являются постоянные движения ногами в положении сидя и невозможность находиться в спокойном положении стоя. Менее характерны тянущее чувство или толчки в мышцах, иногда сопровождающиеся парестезиями. Как и при лекарственном паркинсонизме, 80–90% случаев акатизии проявляется в течение первых 2 мес терапии и чаще (примерно в 2 раза) регистрируется у женщин. Из атипичных АП препаратами риска в отношении этого варианта ЭПС являются: рисперидон (в дозах выше 6 мг в сутки), амисульприд (в широком диапазоне доз) и арипипразол (чаще транзиторно, в первые 2 нед терапии).
Одной из причин, по которым именно акатизия зачастую служит причиной отказа от терапии, является характерный для таких состояний дисфорический аффект, в особо выраженных случаях сопровождающийся расстройствами поведения вплоть до суицидального. Именно по этой причине коррекция таких состояний должна быть незамедлительной.
Основным дифференциально-диагностическим вопросом является отделение острой акатизии от состояний психомоторного возбуждения. Проблема состоит в том, что терапия этих двух нарушений является прямо противоположной. В то время как ажитация и возбуждение – показание к увеличению дозы АП-препарата, этот же вариант лечения может вызвать заметное ухудшение у пациента с акатизией.
Механизм возникновения акатизии, возможно, отличается от часто сопровождающего ее паркинсонизма. Предполагается, что эти два состояния обусловливаются дисрегуляцией в разных отделах дофаминергической системы: мезокортикальном в первом случае, нигростриатальном – во втором. Возможное подтверждение этому может быть найдено в том, что разные АП-препараты вызывают различные варианты ЭПС: так, для арипипразола в большей степени характерны именно нарушения по типу изолированной акатизии. Дальнейшее уточнение этого вопроса позволит оптимизировать рекомендации по безопасной АП-терапии.
Другая причина, по которой акатизия занимает особое место среди всех острых ЭПС-осложнений, состоит в том, что эффективность антихолинергических препаратов в отношении рассматриваемых симптомов оказывается ниже. Таким образом, основным способом преодоления ЭПС с явлениями акатизии является титрация дозы АП в сторону уменьшения либо смена препарата. Также существуют данные об эффективности следующих препаратов (в порядке уменьшения доказательной базы): b-блокаторов, бензодиазепинов, антигистаминергических средств, а также 5HT2A-антагонистов (миансерин) (Stanilla, 2009).
Поздние ЭПС
Хронические или поздние варианты ЭПС развиваются в течение нескольких месяцев или лет регулярной АП-терапии, зачастую вне связи с какими-либо изменениями дозировок или сменами препарата. Течение этих расстройств также не обнаруживает корреляций с дозированием АП, а его отмена не обязательно вызывает разрешение ЭПС (иногда, напротив, ухудшение). Основными вариантами таких состояний являются поздняя дискинезия и поздняя дистония.
Поздняя дискинезия
В числе первых работ с клиническим описанием этих состояний были работа немецкого психиатра M.Schonecker (1957 г.) – 3 наблюдения и 2 публикации J.Sigwald и соавт. (1959 г.) – 4 наблюдения. В последующие несколько лет количество таких сообщений последовательно возросло. Так, в работе датских исследователей L.Uhrbrand и A.Faurbye (1960 г.) приводилось систематизированное описание 33 диагностически гетерогенных пациентов с длительным пребыванием в стационаре, которые в числе прочего получали длительную терапию АП-препаратами. Последнее обстоятельство и было определено авторами в качестве основного каузального фактора, а сами состояния были обозначены термином «поздняя дискинезия». Этот термин первое время равномерно сосуществовал с другим («орально-лицевая дискинезия»), до тех пор пока не было обнаружено, что проявления поздних дискинезий не обязательно ограничиваются только лицевой мускулатурой, хотя чаще регистрируются именно в области лица (Waddington, 1995) – табл. 4.


Ранним симптомом поздней дискинезии являются волнообразные или червеобразные движения языком. Диагностическая ценность данного признака, однако, не столь высока, с учетом того факта, что этот симптом регистрируется у 5–15% всех пациентов позднего возраста, включая тех, кто никогда не принимал АП-препараты (Gerlach, 1996). Часто возникает совместное вовлечение оральной и периоральной мускулатуры в составе «букко-лингво-мастикаторной триады». Ее симптомами являются надувание щек, сжимание и наморщивание губ, выпячивание щек с помощью языка и псевдожевательные или сосущие движения. Многие из этих движений у пациентов позднего возраста необходимо дифференцировать с болезненностью или плохой подгонкой зубных протезов.
Несмотря на то что эти движения обычно характеризуются как «хореоатетоидные», обычно они являются комплексными, повторяющимися и достаточно скоординированными в отличие от типичных хореиформных движений. Часто пациент сам не отмечает возникновения рассматриваемых нарушений, и первыми, кто обращает на это внимание, становятся другие люди (например, члены семьи).
Степень выраженности поздней дискинезии в существенной степени зависит от психического состояния пациента. Выраженность дискинезий возрастает при появлении, например, взбудораженности и ослабевает при снижении уровня возбуждения и тревоги. Также эти движения могут произвольным образом подавляться на некоторые периоды времени или вообще исчезать в то время, как пациент, к примеру, концентрируется на выполнении какого-либо задания. Активность в других отделах тела вызывает их активацию. Так, просьба о последовательном прикосновении большими пальцами рук к каждому из остальных пальцев может спровоцировать появление дискинетических движений в области лица. Прием некоторых препаратов других групп (таких, как серотонинергические антидепрессанты – флуоксетин, пароксетин и другие, или метоклопрамид – Церукал) также может приводить к возникновению поздней дискинезии.
Установленными факторами риска в отношении возникновения поздних дискинезий являются: большая продолжительность курса АП-терапии, использование высоких доз препаратов с большой степенью сродства к D2-рецепторам, а также наличие перерывов в терапии длительностью в несколько недель или месяцев с последующим ее возобновлением. Другими факторами риска являются: поздний возраст, болезнь Паркинсона в семейном анамнезе, предшествующие острые формы ЭПС (в особенности паркинсонизм). Для типичных АП-препаратов риск возникновения поздней дискинезии оценивается на уровне 4–10% на год постоянного применения. Для атипичных АП – производных клозапина этот же показатель снижается до 0,5–2% на год терапии (Glazer, 2000; Corell, 2004; Kane, 2004). У пациентов позднего возраста этот риск возрастает в 5–6 раз вне зависимости от категории АП-препарата (Jeste, 1993). Кумулятивная оценка, проведенная в исследовании Quinn и соавт. (2001 г.), показала, что распространенность поздних форм ЭПС на протяжении жизни может приближаться к 100% для групп пациентов, получающих длительную многолетнюю терапию АП I поколения.
Особенностью клозапина и ряда его производных (оланзапин, кветиапин) является способность уменьшать после смены терапии выраженность поздних дискинезий, вызванных другими АП-препаратами, в 40–50% (Lieberman, 1991; Stein, 2007).
Для объяснения возможных механизмов возникновения поздних форм ЭПС было предложено несколько гипотез. Согласно Carlsson (1985 г.) применение антагонистов дофамина приводит к гиперсензитивности дофаминергической системы в стриатуме. В подтверждение этого структурные исследования обнаружили 50% увеличение плотности постсинаптических рецепторов после длительного применения галоперидола в отличие от клозапина.
Как уже упоминалось, в норме моторная деятельность определяется балансом между холинергической и дофаминергической системами в стриатуме; причем паркинсоноподобные расстройства возникают в ответ на снижение активности дофаминергической системы. В соответствии с этой моделью поздние дискинезии могут быть объяснены смещенным в противоположном направлении балансом с развитием гиперчувствительности дофаминергической системы, что приводит к увеличению рецепторного ответа даже на сниженные концентрации дофамина и в результате вызывает появление гиперкинезов.
Поздние дискинезии являются одними из наиболее неблагоприятных форм ЭПС, что связано с трудностями их коррекции. Согласно заключению ряда исследователей, систематически оценивавших различные варианты исходов, в настоящее время не существует единых, четко сформулированных формализованных терапевтических алгоритмов, направленных на редукцию этих симптомов (Kane, 1988; APA, 1992). И хотя распространенность поздних дискинезий в значительной степени уменьшилась после широкого внедрения атипичных АП-препаратов, начиная с появления клозапина (Lieberman, 1991), для многих пациентов с уже развившимися поздними ЭПС эта проблема сохраняет свою актуальность.
Это связано с тем, что смена препарата или прекращение терапии приводит к редукции дискинезии лишь у небольшого числа больных. Аналогичным образом корректирующая терапия с использованием антихолинергических препаратов в большинстве случаев оказывается недостаточно эффективной. Существуют отдельные сообщения о возможности положительного ответа на применение производных бензодиазепина, в особенности клоназепама, в дозах 2–4,5 мг в сутки, что в свою очередь требует использования длительных непрерывных курсов; достигнутый эффект не является стойким и исчезает в течение 4–6 мес регулярного приема, а также после отмены транквилизатора (Thaker, 1990).
Необходимо отдельно упомянуть о проблеме гиподиагностики поздних ЭПС. С одной стороны, уровень знаний пациентов о потенциальной возможности и особенностях этих осложнений остается недостаточным, а с другой – стоит расширение показаний для длительного применения АП-препаратов (в первую очередь I поколения) при отсутствии адекватного мониторинга на протяжении всего курса терапии.
Поздняя дистония
Подобно острым реакциям, стойкие дистонические нарушения с поздним манифестом способны в значительной степени ухудшать общий уровень функционирования. Выделяются: фокальная (локализованная в одном участке), сегментарная (дислоцированная в более широком отделе или нескольких) и унилатеральная аксиальная дистония. Характерные проявления поздней дистонии: фиксированное, застывшее положение конечностей, шеи, туловища или выражение лица.
Общие терапевтические методики в отношении дистонических расстройств достаточно широки и включают в себя как применение препаратов типа ботулинического токсина, так и нейрохирургические методики (глубокая стимуляция мозга). Тем не менее ни одна из них не была опробована и рекомендована пациентам с лекарственными дистониями. В отличие от поздних дискинезий пациенты со стойкими дистоническими расстройствами в значительной степени положительно отвечают на систематическое применение антихолинергических препаратов. Только отдельные случаи поздних дистоний отличаются стойкостью и резистентностью в отношении терапии (Stanilla, 2001; Krauss, 2004).
Поздняя акатизия
Эта группа нарушений сходна по своим клиническим проявлениям с острыми формами акатизий. Единственное отличие затрагивает их временну́ю связь с курсом АП-терапии. Также отмечается, что субъективное чувство беспокойства и дисфория при позднем варианте акатизии менее выражены. Алгоритм коррекции также является общим для всех форм акатизии (Barnes, 1992).
Механизм действия антихолинергических препаратов и вопросы выбора
Действие холинолитических средств на экстрапирамидные расстройства определяется их способностью блокировать центральные ацетилхолиновые мускариновые рецепторы. Ключевой предпосылкой, объясняющей действие антихолинергических средств на ЭПС, вызванные АП-терапией, является концепция взаимного баланса дофаминергической и холинергической систем. Поскольку дофамин тормозит высвобождение ацетилхолина в стриатуме, то назначение АП, обладающих дофаминблокирующими свойствами, приводит к более интенсивному высвобождению ацетилхолина в стриатуме. Это приводит к нарушению баланса ацетилхолина/дофамина, что в свою очередь является ключевым звеном в возникновении ЭПС. Действие антихолинергических препаратов заключается в восстановлении нарушенного баланса. Дополнительными их эффектами являются антигистаминергическое действие и возможная блокада обратного захвата дофамина (Stein, 2007).
Такое теоретическое представление о механизме действия ставит перед исследователем вопрос: насколько двусторонним является этот баланс в плане регуляции? Другими словами, может ли назначение препаратов-корректоров вызвать снижение эффекта на активном этапе базовой АП-терапии или спровоцировать рецидив на этапе терапии поддерживающей? Несмотря на видимую проработанность теории, ответ на него не очевиден. Данные специальных исследований, направленных на прояснение этого вопроса, также не в полной мере соотносятся между собой. Тем не менее попытка выявить некоторые общие закономерности может быть предпринята.
В череде исследований, проводившихся на протяжении почти 30 лет (Gershon, 1960; Haase, 1965; Itil, 1969; Singh, 1979, 1987; Johnstone, 1983, 1988), было показано существование двух основных вариантов действия:
1) обострение психотической симптоматики и 2) ограничение терапевтического действия АП-препаратов на продуктивную симптоматику. Отдельно стоит упомянуть и обратную способность: назначение антихолинергических средств приводит к некоторому улучшению показателей негативной симптоматики даже у пациентов, не получающих АП-терапии, что снова позволяет говорить о влиянии не только на депримирующее действие АП, но также и о прямом воздействии на психопатологическую симптоматику (Tandon, 1990).
C другой стороны, существуют исследования, показывающие, что одновременное или постепенное прекращение приема антихолинергических средств не приводит к значимому сдвигу в показателях, оценивающих выраженность достигнутого антипсихотического эффекта, и лишь в отдельных случаях может быть ассоциировано с ухудшением состояния (Ananth, 1970; McClelland, 1974; Rifkin, 1975; Jellinek, 1981; Manos, 1981).
Таким образом, можно предположить, что понятие баланса системы «дофамин–ацетилхолин» включает в себя не только влияние любой одной из ее составляющих на клинически регистрируемые проявления действия другой, но также и определяет способность этой составляющей изменять выраженность фармакологических эффектов, которым подвергается противоположное плечо системы.
Какие практически ориентированные рекомендации могут быть предложены, исходя из результатов исследований совместного влияния и взаимодействия двух классов препаратов – АП и холинолитиков?
Разработанные на начальных этапах развития психофармакологии стандарты использования холинолитических препаратов подразумевают в ряде случаев их стабильный прием на всем протяжении курса АП-терапии. Такой «сопутствующий» прием холинолитиков преследует две цели: 1) профилактику потенциально возможных ЭП-осложнений и 2) коррекцию уже существующих (Singh, 1979; Manos, 1981; Double, 1993).
По мнению ряда исследователей, существующая дискуссия в отношении оправданности профилактического назначения антихолинергических препаратов не может быть разрешена единым образом, без учета сочетания факторов, уникальных для каждого клинического случая. С одной стороны, профилактическое применение антипаркинсонических средств позволяет снизить частоту острых форм ЭПС и, возможно, предотвратить развития поздних вариантов синдрома, а с другой – назначение холинолитических средств связано с заметными самостоятельными побочными эффектами, включая неблагоприятное влияние на когнитивные функции. С учетом этого факта при назначении препаратов-корректоров необходимо существенное внимание уделять вопросам безопасности. Обоснованный выбор препарата позволяет улучшить суммарную переносимость всей совокупной терапии и сохранить высокий уровень лекарственного комплаенса (Аведисова, 1998).
Первым М1-холинолитиком преимущественно центрального действия был синтетический аналог атропина тригексифенидил, представленный в 1949 г. Благодаря структуре третичного амина тригексифенидил легко проникает сквозь гематоэнцефалический барьер, вследствие чего оказывает преимущественное центральное действие (Brown, 1996). Практически сразу препарат нашел широкое применение при лечении болезни Паркинсона (Doshay, 1954), а с внедрением первых нейролептиков – и для коррекции осложнений нейролептической терапии (Rashkis, 1957).
Бипериден (Акинетон) – антихолинергический препарат, подобно тригексифенидилу обладает избирательным действием на М1-мускариновые и в меньшей степени – на никотиновые ацетилхолиновые рецепторы (Syvalähti, 1987; Eltze, 1988). Также у препарата описан эффект NMDA-антагонизма, что, как предполагается, приводит к более быстрому разрешению ЭПС (Левин, 2012). Его отличительной способностью является меньшая выраженность периферических антихолинергических побочных эффектов (запоры, сухость во рту, нечеткость зрения, задержка мочи, гипотензия) по сравнению с другими препаратами (Avissar, 1989). Обычная суточная доза препарата при лечении различных вариантов ЭПС находится в диапазоне 2–24 мг/сут. В отличие от тригексифенидила к применению доступна инъекционная форма препарата для внутривенного или внутримышечного введения, что позволяет быстро достигнуть пиковой концентрации (Timberlake, 1961). В сравнительных исследованиях было показано, что для биперидена характерна меньшая выраженность и частота расстройств когнитивной сферы, в числе которых стоит назвать функции памяти и внимания (Аведисова, 1998).
В случае, если антихолинергическая терапия проводится с профилактической целью, необходимо учитывать все факторы потенциального риска развития ЭПС (возраст, длительность курса и доза препарата, анамнестические данные и др.) с целью избежать неоправданного назначения в завышенных дозах (Taylor, 1991). Для отмены антихолинергических средств после длительного курса рекомендуется ступенчатая схема с целью минимизации явлений лекарственного рикошета с симптомами в виде тошноты, инсомнии и тревоги (Double, 1993; Ungvari, 1999).
Сведения об авторе
Д.В.Ястребов – ст. науч. сотр. отд-ния новых средств и методов терапии ГНЦ ССП им. В.П.Сербского.
E-mail: dvyastrebov@gmail.com
Список исп. литературыСкрыть список1. Аведисова А.С., Бородин В.И., Чахава В.О. Акинетон или Циклодол? Научно обоснованный выбор. Рос. психиатр. журн. 1998; 6: 4–7.
2. Левин О.С., Шиндряева Н.Н., Аникина М.А. Лекарственный паркинсонизм. Журн. неврол. и психиатр. им. С.С.Корсакова. 2012; 8: 69–74.
3. Малин Д.И., Козырев В.В., Равилов Р.С. Экстрапирамидные побочные эффекты нейролептиков: классификация и современные способы лечения. Психиатр. и психофармакотер. 2001; 3 (6): 12–21.
4. Морозов П.В. Возвращение Акинетона (краткий обзор). Психиатр. и психофармакотер. 2011; 2: 56–8.
5. American Psychiatric Association (APA). Tardive dyskinesia: a task force report of the American Psychiatric Association. Amer Psychiatric Pub 1992.
6. Ananth JV, Horodesky J, Lehmann HE, Ban TA. Effect of withdrawal of antiparkinsonian medication on chronically hospitalized psychiatric patients. Laval Med 1970; 41: 934–8.
7. Arana G. An overview of side effects caused by typical antipsychotics. J Clin Psychiat 2000; 61 (Suppl. 8): 5–11.
8. Avissar S, Schreiber G. Muscarinic receptor subclassification and G-proteins: signify-cance for lithium action in affective disorders and for the treatment of extrapyramidal side effects of neuroleptics. Biolog Psychiat 1989; 26: 113–30.
9. Brown JH. Atropine, scopolamine, and related antimuscarinic drugs. Goodman and Gilman’s. The pharmacological basis of therapeutics. 8th ed. A.Gilman, T.Rall, A.Nies et al. NY, Pergamon 1990;
p. 150–65.
10. Delay J, Deniker P. Trente-huit cas de psychoses traitrées par la cure prolongée et continue de 4560 RP. Léme Congrès des Alién, et Neurol de Langue Française, Luxembourg, 21–27 juillet 1952. (Thirty-eight cases of psychoses treated with a long and continued course of 4560 RP. The Congress of the French Language for Alienists and Neurologists, Luxembourg, 21–27 July 1952.) Paris, Masson et Cie 1952; p. 503–13.
11. Delay J, Deniker P, Harl JM. (Therapeutic method derived from hiberno-therapy in excitation and agitation states) Ann Med Psycholog Paris 1952; 110: 267–73.
12. Doshay LJ, Constable K, Zier A. Five year follow-up of treatment with trihexyphenidyl (Artane): outcome in four hundred and eleven cases of paralysis agitans. JAMA 1954; 154: 1334–6.
13. Barnes TR. Neuromuscular effects of neuroleptics: akathisia. J.Kane, J.Lieberman. Adverse effects of psychotropic drugs. The Guilford Press. NY 1992; p. 201–17.
14. Carlsson A. Pharmacological properties of presynaptic dopamine receptor agonists. Psychopharmacol (Suppl.) 1985; 2: 31–8.
15. Correll CU, Leucht S, Kane JM. Lower risk for tardive dyskinesia associated with second-generation antipsychotics: a systematic review of 1-year studies. Am J Psychiat 2004; 161: 414–25.
16. Double DB, Warren GC, Evans M et al. Efficacy of maintenance use of anticholinergic agents. Acta Psychiat Scand 1993; 88: 381–4.
17. Eltze M, Figala V. Affinity and selectivity of biperiden enantiomers for muscarinic receptor subtypes. Eur J Pharmacol 1988; 158: 11–9.
18. Gerlach J, Lublin H, Peacock L. Extrapyramidal symptoms during long-term treatment with antipsychotics: special focus on clozapine and D1- and D2-dopamine antagonists. Neuropsychopharmacol 1996; 14 (Suppl. 3): s35–9.
19. Gershon S, Olariu J. A new psychotomimetic: its antagonism by tetrahydroaminacrin and its comparison with LSD, mescaline, and sernyl. J Neuropsychiat 1960; 1: 283–92.
20. Glazer WM. Expected incidence of tardive dyskinesia associated with atypical antipsychotics. J Clin Psychiat 2000; 61 (Suppl. 4): 21–6.
21. Glazer WM. Review of incidence studies of tardive dyskinesia associated with typical antipsychotics. J Clin Psychiat 2000; 61 (Suppl. 4): 15–20.
22. Haase HJ, Janssen PA. The action of neuroleptic drugs. Chicago, IL. Year Book Medical 1965.
23. Hansen TE, Casey DE, Hoffman WF. Neuroleptic intolerance. Schizophr Bull 1997; 23: 567–82.
24. Hippius H. The history of clozapine. Psychopharmacol Berl 1999; 99 (Suppl.): s3–5.
25. Itil TM, Keskiner A, Holden JM. The use of LSD and ditran in the treatment of therapy-resistant schizophrenics. Diseases Nervous System 1969; 30: 93–103.
26. Jellinek T, Gardos G, Cole JO. Adverse effects of antiparkinson drug withdrawal. Am J Psychiat 1981; 138: 1567–71.
27. Jeste DV, Caligiuri MP. Tardive dyskinesia. Schizophr Bull 1993; 19: 303–15.
28. Johnstone EC, Crow TJ, Frith CD, Owens DG. Adverse effects of anticholinergic medication on positive schizophrenic symptoms. Psychological Med 1983; 13: 513–27.
29. Johnstone EC, Crow TJ, Frith CD, Owens DG. The northwick park «functional» psychosis study: diagnosis and treatment response. Lancet 1988; 2: 119–25.
30. Kane JM, Woerner M, Lieberman J. Tardive dyskinesia: prevalence, incidence, and risk factors. J Clin Psychopharmacol 1988; 8 (Suppl. 4): s52–6.
31. Kane JM. Tardive dyskinesia rates with atypical antipsychotics in adults: prevalence and incidence. J Clin Psychiat 2004; (65 Suppl. 9): 16–20.
32. Kane JM, Fleischhacker WW, Hansen L et al. Akathisia: an updated review focusing on second-generation antipsychotics. J Clin Psychiat 2009; 70: 627–43.
33. Kapur S, Zipursky RB, Remington G et al. 5HT2- and D2-receptor occupancy of olanzapine in schizophrenia: a PET investigation. Am J Psychiat 1998; 155: 921–8.
34. Krauss JK, Yianni J, Loher TJ, Aziz TZ. Deep brain stimulation for dystonia. Clin Neurophysiol 2004; 21 (1): 18–30.
35. Leucht S, Wahlbeck K, Hamann J, Kissling W. New generation antipsychotics versus low-potency conventional antipsychotics: a systematic review and meta-analysis. Lancet 2003; 361: 1581–9.
36. Leucht S, Corves C, Arbter D et al. Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet 2009; 373: 31–41.
37. Lieberman JA, Saltz BL, Johns CA et al. The effects of clozapine on tardive dyskinesia. Br J Psychiat 1991; 158: 503–10.
38. Manos N, Gkiouzepas J, Tzotzaras T, Tzanetoglou A. Gradual withdrawal of antiparkinson medication in chronic schizophrenics: any better than the abrupt? J Nervous Ment Disease 1981; 169: 659–61.
39. McClelland HA, Blessed G, Bhate S et al. The withdrawal of antiparkinsonian drugs in schizophrenia patients. Br J Psychiat 1974; 124: 151–9.
40. Miller del D, Caroff SN, Davis SM et al. Clinical antipsychotic trials of intervention effectiveness (CATIE) Investigators. Extrapyramidal side-effects of antipsychotics in a randomised trial. Br J Psychiat 2008; 193: 279–88.
41. Quinn J, Meagher D, Murphy P et al. Vulnerability to involuntary movements over a lifetime trajectory of schizophrenia approaches 100%, in association with executive (frontal) dysfunction. Schizophr Res 2001; 49 (1–2): 79–87.
42. Rashkis HA, Smarr ER. Protection against reserpine-induced «parkinsonism» (clinical note). Am J Psychiat 1957; 113: 1116.
43. Remington G, Kapur S. Neuroleptic-induced extrapyramidal symptoms and the role of combined serotonin/dopamine antagonism. J Clin Psychiat Monogr 1996; 14 (1):14–24.
44. Rifkin A, Quitkin F, Klein D. Akinesia: a poorly recognized drug-induced extra-pyramidal behavioral disorder. Arch Gen Psychiat 1975; 32: 672–4.
45. Schonecker M. Paroxysmal dyskinesia as the effect of megaphen. Nervenarzt 1957; 20; 28 (12): 550–3.
46. Sigwald J, Bouttier D, Raymondeaud C, Piot C. 4 cases of facio-bucco-linguo masticatory dyskinesis of prolonged development following treatment with neuroleptics. Rev Neurol Paris 1959; 100: 751–5.
47. Sigwald J, Boutter D, Courvoisier S. Neurological complications of neuroleptic medication. Rev Neurol Paris 1959; 100: 553–95.
48. Singh MM, Kay SR. Therapeutic antagonism between anticholinergic anti-parkinsonism agents and neuroleptics in schizophrenia: implications for a neuropharmacological model. Neuropsychobiol 1979; 5: 74–86.
49. Singh MM, Kay SR, Opler LA. Anticholinergic-neuroleptic antagonism in terms of positive and negative symptoms in schizophrenia: implications for psychobiological typing. Psycholog Med 1987; 17: 39–48.
50. Stanilla JK, Simpson GM. Drugs to treat extrapyramidal side effects. A.Schatzberg, C.Nemeroff. The american psychiatric textbook of psychopharmacology. 4th ed. Am Psychiat Publish Arlington 2009; p. 669–96.
51. Stein G, Wilkinson G. Seminars in General Adult Psychiatry. 2nd ed. The Royal College Psychiatrists. London 2007.
52. Syvalähti EK, Lauren L, Markannen J, Kunelius R. Interaction of psychotropic drugs with brain muscarinic cholinoceptors: similarities of biperiden and pirenzipine in receptor binding properties. Pharmacol Toxicol 1987; 60: 66–9.
53. Tandon R, Mann NA, Eisner WH, Coppard N. Effect of anticholinergic medication on positive and negative symptoms in medication-free schizophrenic patients. Psychiat Res 1990; 31 (3): 235–41.
54. Taylor AE, Lang AE, Saint-Cyr JA et al. Cognitive processes in idiopathic dystonia treated with high-dose anticholinergic therapy: implications for treatment strategies. Clin Neuropharmacol 1991; 14: 62–77.
55. Thaker GK, Nguyen JA, Strauss ME et al. Clonazepam treatment of tardive dyskinesia: a practical GABA mimetic strategy. Am J Psychiat 1990; 147 (4): 445–51.
56. Timberlake WH, Schwab RS, England AC. Biperiden (Akineton) in parkinsonism. Arch Neurol 1961; 5: 560–4.
57. Ungvari GS, Chiu HF, Lam LC et al. Gradual withdrawal of long-term anticholinergic antiparkinson medication in Chinese patients with chronic schizophrenia. J Clin Psychopharmacol 1999; 19: 141–8.
58. Uhrbrand L, Faurbye A. Reversible and irreversible dyskinesia after treatment with perphenazine, chlorpromazine, reserpine and electroconvulsive therapy. Psychopharmacol 1960; 1: 408–18.
59. Waddington JL, O’Callaghan E, Buckley P et al. Tardive dyskinesia in schizophrenia. Relationship to minor physical anomalies, frontal lobe dysfunction and cerebral structure on magnetic resonance imaging. Br J Psychiat 1995; 167 (1): 41–4.
27 марта 2013
Количество просмотров: 3305


