Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2013
Церебролизин в терапии депрессий №01 2013
Номера страниц в выпуске:41-46
Деструктивные процессы в различных отделах головного мозга, отмечающиеся при депрессии, являются частично обратимыми на фоне терапии нейротрофическими и нейропротективными препаратами. Рассматривается возможность использования нейропротектора Церебролизина в рамках комбинированной терапии у пациентов с депрессивными расстройствами, обусловленными и/или коморбидными с соматическими заболеваниями.
Резюме. Деструктивные процессы в различных отделах головного мозга, отмечающиеся при депрессии, являются частично обратимыми на фоне терапии нейротрофическими и нейропротективными препаратами. Рассматривается возможность использования нейропротектора Церебролизина в рамках комбинированной терапии у пациентов с депрессивными расстройствами, обусловленными и/или коморбидными с соматическими заболеваниями.
Ключевые слова: депрессия, терапия, нейропротекторы, Церебролизин.
Cerebrolysin in the treatment of depressions
N.L.Zuykova1, A.Yu.Israelyan1,2, E.V.Gushanskaya1,2, V.E.Medvedev1
1Chair of Psychiatry, Psychotherapy and Psychosomatic Pathology, RUPF
2Psychiatric Hospital №13, Moscow
Summary. Destructive processes in different parts of the brain taking place in depression are partially reversible when treating with neurotrophic and neuroprotective drugs. The possibility of neuroprotector Cerebrolysin administration in combined therapy in patients with depressions due to somatic disorders or comorbid to it is under consideration.
Key words: depression, therapy, neuroprotectors, Сerebrolysin.
Повышение эффективности терапии депрессивных расстройств остается актуальной проблемой современной медицины. Распространенность только большого депрессивного расстройства среди населения развитых стран стабильно составляет 2–7%, а дистимии – около 3%, при этом риск развития депрессии на протяжении жизни среди общей популяции достигает 16% [10, 34, 54]. Особенно важно отметить высокую частоту встречаемости сочетания цереброваскулярной патологии и депрессивных расстройств. По данным отечественных исследований, частота развития постинсультной депрессии достигает 40% с максимальной (до 70% и более) распространенностью в восстановительном периоде инсульта [7, 8].
Наличие у больного первичных депрессивных расстройств, а также развитие депрессии на фоне неврологического и/или сосудистого поражения головного мозга приводит к углублению когнитивных расстройств. Отмечаются замедление скорости психомоторных реакций, трудности концентрации внимания, нарушения памяти.
У больных с постинсультной депрессией в наибольшей степени страдают спонтанная активность, программирование и контроль за выполнением заданий, нейродинамические характеристики [7, 22]. При этом тяжесть когнитивных нарушений во многом зависит от тяжести депрессивного расстройства, возраста больного и сопутствующей церебральной патологии [8].
Генез развития депрессивных расстройств у пожилых и соматически ослабленных больных, как и других форм аффективных нарушений, остается во многом неясным. В ряде исследований с привлечением методов нейровизуализации получены доказательства, что повторяющиеся нарушения настроения у данного контингента могут быть связаны со значительным нарушением нейропластичности, реализующейся снижением объема специфических регионов мозга, числа нейронов и глии, а также рядом патологических нейрофизиологических процессов [50, 65].
Структурные изменения головного мозга при депрессии
Некоторыми исследователями отмечается снижение объема лобной коры, которое в большей степени затрагивает орбитофронтальную и префронтальную области и сопровождается уменьшением плотности и размера нейронов и глиальных клеток. Также при депрессиях отмечается снижение объема гиппокампа, уменьшение размеров и плотности расположения клеток зубчатой извилины и пирамидных нейронов поля СА3 гиппокампа [12, 20, 76].
Достоверное уменьшение объема гиппокампа у пациентов старшего и пожилого возраста с депрессией (по сравнению с группой здоровых исследуемых) уже после первого депрессивного эпизода достигает 11% для серого вещества и до 25% для белого вещества [10, 32, 37, 46, 63]. Данные метаанализа, включающего результаты нейровизуализационного обследования 434 больных депрессией по сравнению с 379 здоровыми лицами, также подтверждают снижение объема гиппокампа и амигдалы [33, 36, 79]. Предполагается, что снижение объема гиппокампа коррелирует с продолжительностью депрессивного эпизода [7, 70–72].
Согласно результатам исследования M.Ballmaier и соавт. (2004 г.) у пациентов с униполярной депрессией определяется уменьшение объема правой и левой орбитофронтальной коры на 12% по сравнению со здоровыми добровольцами; редукция серого вещества левой и правой передней поясной извилины на 18 и 20%, а левой и правой прямой извилины – на 19 и 24% соответственно [29]. По данным J.Bremner и соавт. (2002 г.), объем медиальной орбитофронтальной коры у депрессивных пациентов на 32% меньше, чем у представителей контрольной группы [33].
При депрессии с поздним началом также отмечаются снижение объема базальных ганглиев, увеличение желудочков [8, 9], изменения со стороны амигдалы [40–42, 68]. Разными авторами описываются как снижение объема амигдалы [69, 81], так и увеличение [32, 47]. При этом во время первых депрессивных эпизодов обычно регистрируется гипертрофия миндалевидного тела, которая является транзиторной и в дальнейшем сменяется гипотрофией на стадии более активного течения заболевания [20, 47].
Наконец, получены данные о том, что в развитии депрессии у соматически ослабленных пациентов особо значимую роль играют поражения белого вещества (лейкоареоз). Установлено, что у пожилых больных с депрессией верифицируются более выраженные и распространенные зоны гиперинтенсивности белого вещества [74, 77]. Больные с депрессией имеют несколько зон более выраженного поражения белого вещества, в частности верхний продольный пучок, лобно-затылочный пучок, наружная капсула и нижний продольный пучок [7]. Эти зоны располагаются под областями мозга, связанными с когнитивными и эмоциональными функциями. Предполагается, что стратегическая локализация очагов гиперинтенсивности белого вещества может играть определяющую роль в развитии депрессий позднего возраста [52].
Таким образом, в исследованиях демонстрируется, что нарушение нейрогенеза в определенных регионах головного мозга (табл. 1) у пожилых и страдающих церебро-сосудистыми заболеваниями пациентов относится к облигатным факторам депрессивного состояния. Эти данные соответствуют гипотезе нейропластичности1 [20].
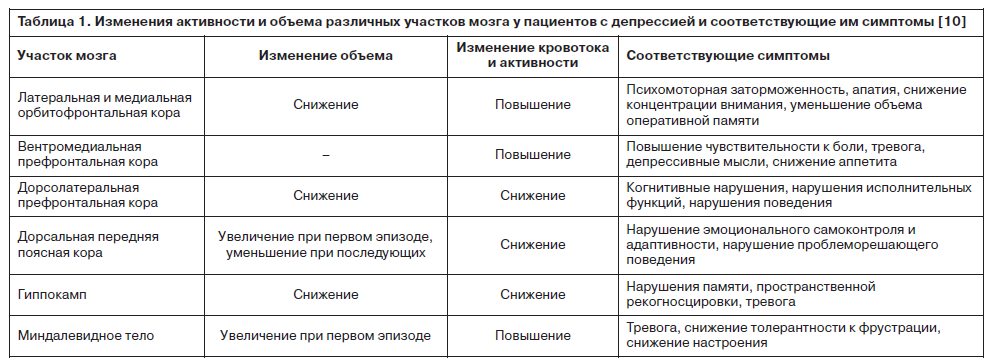
Развитие депрессивной симптоматики связывается исследователями и с изменением активности мозговых структур, ответственных за эмоциональное состояние. Так, у большинства лиц с депрессией на фоне церебрососудистого поражения наблюдаются нейровизуализационные признаки снижения активности дорсолатеральной префронтальной коры в ответ на потенциально депрессогенные стимулы (J.Hooley и соавт., 2005). Эта зона мозга отвечает за сложные когнитивные и исполнительные функции, что наводит на мысль о тесной связи дисфункции нейрональной обработки информации в указанном участке коры и наблюдаемых при депрессии когнитивных нарушений. Подтверждает это предположение и тот факт, что в пожилом возрасте депрессии могут служить ранним предиктором деменции [10, 23].
Выявленные с помощью позитронно-эмиссионной томографии и функциональной магнитно-резонансной томографии изменения активности высших мозговых структур при депрессии включают: усиление кровотока и физиологической активности в латеральной и медиальной орбитофронтальной коре, вентромедиальной префронтальной коре, а также снижение кровотока и метаболизма глюкозы преимущественно в амигдале и гиппокампе [1, 8, 40, 55, 71, 80]. При этом гиперактивность в вентральной медиальной префронтальной коре ассоциирована с повышением чувствительности к боли, тревогой, депрессивными мыслями, снижением аппетита, в то время как гипоактивность в дорсолатеральной префронтальной коре – с психомоторной ретардацией, апатией, снижением внимания и оперативной памяти [10, 59]. Эти же нарушения коррелируют с повреждением соответствующих зон в виде нарушения морфологии и функции дендритов (укорочения, уменьшения числа шипиков и синаптических контактов) и проводящих путей, а также снижения метаболизма и гибели части нервных и глиальных клеток [10, 35, 66].
У пациентов с депрессивным расстройством наблюдается снижение активности и концентрации глутамата в дорсальной передней поясной коре, причем уровень его снижения позитивно коррелирует с тяжестью депрессии [62, 64]. В то же время гиперактивность в ростральной передней поясной коре ассоциирована с хорошим клиническим ответом на терапию и является прогностически благоприятным маркером в отношении выздоровления [28, 64].
По данным функциональной нейровизуализации, у пациентов с депрессией в лимбических структурах (особенно в гиппокампе) и префронтальной коре снижены локальный мозговой кровоток и метаболизм глюкозы.
Роль нейротрофических факторов в регуляции эмоциональной сферы
На сегодняшний день наиболее полно объясняет возникающие при депрессиях морфологические изменения в головном мозге нейротрофическая теория, согласно которой одну из ведущих ролей в этиологии депрессии играют нейротрофические факторы [73] – регуляторные белки нервной ткани, синтезирующиеся в ее клетках и оказывающие сильное влияние на все процессы в нейронах. Любое повреждение ткани мозга приводит к активации механизмов нейропластичности, представляющей собой ответ на патологическое воздействие сохранившихся нейронов и компенсаторно-восстановительные механизмы [60]. Таким образом, процессы нейропротекции и нейропластичности во многом являются последовательными реакциями [7, 9].
К нейротрофинам относят фактор роста нервов NGF, фактор роста, выделенный из головного мозга (BDNF), нейротрофин-3 (NT-3), нейротрофин-4/5 (NT-4/5), нейротрофин-6 (NT-6), нейротрофин-7 (NT-7) [9]. Описана роль нейротрофических факторов в регуляции нейронального роста и дифференциации во время развития, и предполагается их важность в пластичности и выживаемости нейронов и глии [9].
В исследованиях последних десятилетий была выявлена прямая связь между уровнем нейротрофинов и депрессией [85].
Применение нейропротекторов в терапии депрессий
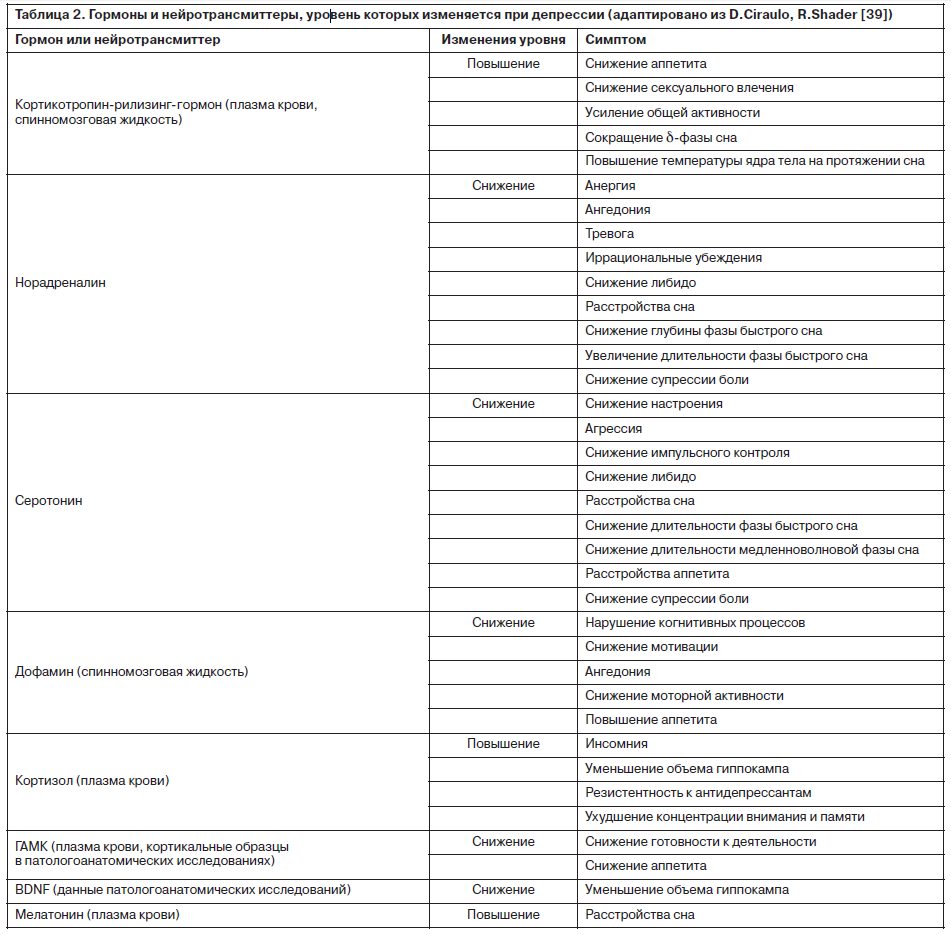
Нормализация трансмиттерных систем, а также активности и микроструктуры многих участков мозга, ассоциированных с развитием депрессии, является первостепенной задачей терапии (табл. 2).
У пациентов с церебрососудистой патологией использование монотерапии антидепрессантами не способно в полной мере справиться с этим в силу низкого или отсутствующего положительного эффекта на процессы нейрогенеза и нейрональной пластичности [2, 7, 30, 35, 44, 45, 57, 58, 66, 70]. Выявленные нарушения нейротрофических факторов при депрессии делают целесообразным использование у этих больных препаратов нейротрофического действия.
Одним из наиболее изученных препаратов с доказанным нейротрофическим действием является препарат Церебролизин (компания «Эвер Нейро Фарма ГмбХ», Австрия). Механизм действия Церебролизина подобен естественным нейротрофическим факторам. По своей структуре Церебролизин представляет собой устойчивый комплекс низкомолекулярных пептидов и аминокислот. При помощи чувствительных иммунологических методов было установлено, что нейропептиды препарата обладают структурным сходством с рядом нейротрофических факторов. Более того, оказалось, что данное структурное сходство связано с функциональным сходством между нейропептидами Церебролизина и естественными нейротрофическими факторами [86].
Основные механизмы действия Церебролизина включают антиапоптотическую активность и предотвращение эксайтотоксичности, модуляцию воспалительной реакции, нейтрализацию свободных радикалов, усиление дифференциации нервных клеток и нейрональный спрутинг. Препарат Церебролизин благодаря своему нейротрофическому действию обеспечивает поддержку важнейших естественных саногенетических процессов нервной ткани – нейропротекции и нейропластичности, способствуя тем самым эффективной терапии депрессии.
Было показано, что у больных эндогенной депрессией терапевтический эффект сочетанного применения антидепрессантов с Церебролизином намного превышает таковой по сравнению с монотерапией антидепрессантами при лечении апато-адинамических депрессий. По сравнению с контрольной группой при назначении антидепрессантов с Церебролизином обнаруживаются более быстрое (на 1–2 нед) наступление и большая степень выраженности терапевтического эффекта в ходе курсового лечения, лучшая переносимость, в 2 раза меньшая частота побочных явлений у каждого больного, а также «нейтрализующее» влияние Церебролизина на психические и соматовегетативные побочные эффекты антидепрессантов [19].
Эффективность и безопасность применения сочетания флувоксамина и Церебролизина была показана у пациентов с депрессивными расстройствами после инсульта. Продемонстрирована высокая степень эффективности комплексной терапии как депрессивных расстройств, так и тревожных нарушений. Общие астенические проявления нормализовались только в результате комплексной терапии с Церебролизином, отмечено более значимое восстановление когнитивных нарушений, особенно улучшение концентрации внимания [16].
При лечении больных на ранних стадиях дисциркуляторной энцефалопатии Церебролизин влиял на настроение больного и снижал тяжесть депрессии, отмечалась значительная стабилизация эмоционального фона больных. Достоверное влияние препарата на балльную оценку по шкале тревоги Спилбергера прослеживалось уже начиная с 7-х суток лечения и достигало статистически достоверного улучшения к 30-м суткам наблюдения. Статистически значимая динамика по шкале депрессии Гамильтона отмечена к 30-м суткам лечения [87].
Таким образом, проведенные в последние годы исследования показали, что депрессия приводит к нарушениям нейропластичности, что, возможно, служит основой для хронизации процесса и перехода его в резистентную форму. Именно поэтому в терапии депрессивных расстройств, в том числе у пациентов с церебрососудистой патологией, целесообразно применение Церебролизина в комплексной терапии с антидепрессантами. Рекомендованные для терапии депрессии дозы Церебролизина: внутривенные инфузии 10 мл курсами 10–15 дней.
Сведения об авторе
Зуйкова Надежда Леонидовна – д-р мед. наук, проф., зав. каф. психиатрии, психотерапии и психосоматической патологии ФПК МР РУДН. E-mail: sar_2003@mail.ru
Ключевые слова: депрессия, терапия, нейропротекторы, Церебролизин.
Cerebrolysin in the treatment of depressions
N.L.Zuykova1, A.Yu.Israelyan1,2, E.V.Gushanskaya1,2, V.E.Medvedev1
1Chair of Psychiatry, Psychotherapy and Psychosomatic Pathology, RUPF
2Psychiatric Hospital №13, Moscow
Summary. Destructive processes in different parts of the brain taking place in depression are partially reversible when treating with neurotrophic and neuroprotective drugs. The possibility of neuroprotector Cerebrolysin administration in combined therapy in patients with depressions due to somatic disorders or comorbid to it is under consideration.
Key words: depression, therapy, neuroprotectors, Сerebrolysin.
Повышение эффективности терапии депрессивных расстройств остается актуальной проблемой современной медицины. Распространенность только большого депрессивного расстройства среди населения развитых стран стабильно составляет 2–7%, а дистимии – около 3%, при этом риск развития депрессии на протяжении жизни среди общей популяции достигает 16% [10, 34, 54]. Особенно важно отметить высокую частоту встречаемости сочетания цереброваскулярной патологии и депрессивных расстройств. По данным отечественных исследований, частота развития постинсультной депрессии достигает 40% с максимальной (до 70% и более) распространенностью в восстановительном периоде инсульта [7, 8].
Наличие у больного первичных депрессивных расстройств, а также развитие депрессии на фоне неврологического и/или сосудистого поражения головного мозга приводит к углублению когнитивных расстройств. Отмечаются замедление скорости психомоторных реакций, трудности концентрации внимания, нарушения памяти.
У больных с постинсультной депрессией в наибольшей степени страдают спонтанная активность, программирование и контроль за выполнением заданий, нейродинамические характеристики [7, 22]. При этом тяжесть когнитивных нарушений во многом зависит от тяжести депрессивного расстройства, возраста больного и сопутствующей церебральной патологии [8].
Генез развития депрессивных расстройств у пожилых и соматически ослабленных больных, как и других форм аффективных нарушений, остается во многом неясным. В ряде исследований с привлечением методов нейровизуализации получены доказательства, что повторяющиеся нарушения настроения у данного контингента могут быть связаны со значительным нарушением нейропластичности, реализующейся снижением объема специфических регионов мозга, числа нейронов и глии, а также рядом патологических нейрофизиологических процессов [50, 65].
Структурные изменения головного мозга при депрессии
Некоторыми исследователями отмечается снижение объема лобной коры, которое в большей степени затрагивает орбитофронтальную и префронтальную области и сопровождается уменьшением плотности и размера нейронов и глиальных клеток. Также при депрессиях отмечается снижение объема гиппокампа, уменьшение размеров и плотности расположения клеток зубчатой извилины и пирамидных нейронов поля СА3 гиппокампа [12, 20, 76].
Достоверное уменьшение объема гиппокампа у пациентов старшего и пожилого возраста с депрессией (по сравнению с группой здоровых исследуемых) уже после первого депрессивного эпизода достигает 11% для серого вещества и до 25% для белого вещества [10, 32, 37, 46, 63]. Данные метаанализа, включающего результаты нейровизуализационного обследования 434 больных депрессией по сравнению с 379 здоровыми лицами, также подтверждают снижение объема гиппокампа и амигдалы [33, 36, 79]. Предполагается, что снижение объема гиппокампа коррелирует с продолжительностью депрессивного эпизода [7, 70–72].
Согласно результатам исследования M.Ballmaier и соавт. (2004 г.) у пациентов с униполярной депрессией определяется уменьшение объема правой и левой орбитофронтальной коры на 12% по сравнению со здоровыми добровольцами; редукция серого вещества левой и правой передней поясной извилины на 18 и 20%, а левой и правой прямой извилины – на 19 и 24% соответственно [29]. По данным J.Bremner и соавт. (2002 г.), объем медиальной орбитофронтальной коры у депрессивных пациентов на 32% меньше, чем у представителей контрольной группы [33].
При депрессии с поздним началом также отмечаются снижение объема базальных ганглиев, увеличение желудочков [8, 9], изменения со стороны амигдалы [40–42, 68]. Разными авторами описываются как снижение объема амигдалы [69, 81], так и увеличение [32, 47]. При этом во время первых депрессивных эпизодов обычно регистрируется гипертрофия миндалевидного тела, которая является транзиторной и в дальнейшем сменяется гипотрофией на стадии более активного течения заболевания [20, 47].
Наконец, получены данные о том, что в развитии депрессии у соматически ослабленных пациентов особо значимую роль играют поражения белого вещества (лейкоареоз). Установлено, что у пожилых больных с депрессией верифицируются более выраженные и распространенные зоны гиперинтенсивности белого вещества [74, 77]. Больные с депрессией имеют несколько зон более выраженного поражения белого вещества, в частности верхний продольный пучок, лобно-затылочный пучок, наружная капсула и нижний продольный пучок [7]. Эти зоны располагаются под областями мозга, связанными с когнитивными и эмоциональными функциями. Предполагается, что стратегическая локализация очагов гиперинтенсивности белого вещества может играть определяющую роль в развитии депрессий позднего возраста [52].
Таким образом, в исследованиях демонстрируется, что нарушение нейрогенеза в определенных регионах головного мозга (табл. 1) у пожилых и страдающих церебро-сосудистыми заболеваниями пациентов относится к облигатным факторам депрессивного состояния. Эти данные соответствуют гипотезе нейропластичности1 [20].

Развитие депрессивной симптоматики связывается исследователями и с изменением активности мозговых структур, ответственных за эмоциональное состояние. Так, у большинства лиц с депрессией на фоне церебрососудистого поражения наблюдаются нейровизуализационные признаки снижения активности дорсолатеральной префронтальной коры в ответ на потенциально депрессогенные стимулы (J.Hooley и соавт., 2005). Эта зона мозга отвечает за сложные когнитивные и исполнительные функции, что наводит на мысль о тесной связи дисфункции нейрональной обработки информации в указанном участке коры и наблюдаемых при депрессии когнитивных нарушений. Подтверждает это предположение и тот факт, что в пожилом возрасте депрессии могут служить ранним предиктором деменции [10, 23].
Выявленные с помощью позитронно-эмиссионной томографии и функциональной магнитно-резонансной томографии изменения активности высших мозговых структур при депрессии включают: усиление кровотока и физиологической активности в латеральной и медиальной орбитофронтальной коре, вентромедиальной префронтальной коре, а также снижение кровотока и метаболизма глюкозы преимущественно в амигдале и гиппокампе [1, 8, 40, 55, 71, 80]. При этом гиперактивность в вентральной медиальной префронтальной коре ассоциирована с повышением чувствительности к боли, тревогой, депрессивными мыслями, снижением аппетита, в то время как гипоактивность в дорсолатеральной префронтальной коре – с психомоторной ретардацией, апатией, снижением внимания и оперативной памяти [10, 59]. Эти же нарушения коррелируют с повреждением соответствующих зон в виде нарушения морфологии и функции дендритов (укорочения, уменьшения числа шипиков и синаптических контактов) и проводящих путей, а также снижения метаболизма и гибели части нервных и глиальных клеток [10, 35, 66].
У пациентов с депрессивным расстройством наблюдается снижение активности и концентрации глутамата в дорсальной передней поясной коре, причем уровень его снижения позитивно коррелирует с тяжестью депрессии [62, 64]. В то же время гиперактивность в ростральной передней поясной коре ассоциирована с хорошим клиническим ответом на терапию и является прогностически благоприятным маркером в отношении выздоровления [28, 64].
По данным функциональной нейровизуализации, у пациентов с депрессией в лимбических структурах (особенно в гиппокампе) и префронтальной коре снижены локальный мозговой кровоток и метаболизм глюкозы.
Роль нейротрофических факторов в регуляции эмоциональной сферы
На сегодняшний день наиболее полно объясняет возникающие при депрессиях морфологические изменения в головном мозге нейротрофическая теория, согласно которой одну из ведущих ролей в этиологии депрессии играют нейротрофические факторы [73] – регуляторные белки нервной ткани, синтезирующиеся в ее клетках и оказывающие сильное влияние на все процессы в нейронах. Любое повреждение ткани мозга приводит к активации механизмов нейропластичности, представляющей собой ответ на патологическое воздействие сохранившихся нейронов и компенсаторно-восстановительные механизмы [60]. Таким образом, процессы нейропротекции и нейропластичности во многом являются последовательными реакциями [7, 9].
К нейротрофинам относят фактор роста нервов NGF, фактор роста, выделенный из головного мозга (BDNF), нейротрофин-3 (NT-3), нейротрофин-4/5 (NT-4/5), нейротрофин-6 (NT-6), нейротрофин-7 (NT-7) [9]. Описана роль нейротрофических факторов в регуляции нейронального роста и дифференциации во время развития, и предполагается их важность в пластичности и выживаемости нейронов и глии [9].
В исследованиях последних десятилетий была выявлена прямая связь между уровнем нейротрофинов и депрессией [85].
Применение нейропротекторов в терапии депрессий
Нормализация трансмиттерных систем, а также активности и микроструктуры многих участков мозга, ассоциированных с развитием депрессии, является первостепенной задачей терапии (табл. 2).
У пациентов с церебрососудистой патологией использование монотерапии антидепрессантами не способно в полной мере справиться с этим в силу низкого или отсутствующего положительного эффекта на процессы нейрогенеза и нейрональной пластичности [2, 7, 30, 35, 44, 45, 57, 58, 66, 70]. Выявленные нарушения нейротрофических факторов при депрессии делают целесообразным использование у этих больных препаратов нейротрофического действия.

Одним из наиболее изученных препаратов с доказанным нейротрофическим действием является препарат Церебролизин (компания «Эвер Нейро Фарма ГмбХ», Австрия). Механизм действия Церебролизина подобен естественным нейротрофическим факторам. По своей структуре Церебролизин представляет собой устойчивый комплекс низкомолекулярных пептидов и аминокислот. При помощи чувствительных иммунологических методов было установлено, что нейропептиды препарата обладают структурным сходством с рядом нейротрофических факторов. Более того, оказалось, что данное структурное сходство связано с функциональным сходством между нейропептидами Церебролизина и естественными нейротрофическими факторами [86].
Основные механизмы действия Церебролизина включают антиапоптотическую активность и предотвращение эксайтотоксичности, модуляцию воспалительной реакции, нейтрализацию свободных радикалов, усиление дифференциации нервных клеток и нейрональный спрутинг. Препарат Церебролизин благодаря своему нейротрофическому действию обеспечивает поддержку важнейших естественных саногенетических процессов нервной ткани – нейропротекции и нейропластичности, способствуя тем самым эффективной терапии депрессии.
Было показано, что у больных эндогенной депрессией терапевтический эффект сочетанного применения антидепрессантов с Церебролизином намного превышает таковой по сравнению с монотерапией антидепрессантами при лечении апато-адинамических депрессий. По сравнению с контрольной группой при назначении антидепрессантов с Церебролизином обнаруживаются более быстрое (на 1–2 нед) наступление и большая степень выраженности терапевтического эффекта в ходе курсового лечения, лучшая переносимость, в 2 раза меньшая частота побочных явлений у каждого больного, а также «нейтрализующее» влияние Церебролизина на психические и соматовегетативные побочные эффекты антидепрессантов [19].
Эффективность и безопасность применения сочетания флувоксамина и Церебролизина была показана у пациентов с депрессивными расстройствами после инсульта. Продемонстрирована высокая степень эффективности комплексной терапии как депрессивных расстройств, так и тревожных нарушений. Общие астенические проявления нормализовались только в результате комплексной терапии с Церебролизином, отмечено более значимое восстановление когнитивных нарушений, особенно улучшение концентрации внимания [16].
При лечении больных на ранних стадиях дисциркуляторной энцефалопатии Церебролизин влиял на настроение больного и снижал тяжесть депрессии, отмечалась значительная стабилизация эмоционального фона больных. Достоверное влияние препарата на балльную оценку по шкале тревоги Спилбергера прослеживалось уже начиная с 7-х суток лечения и достигало статистически достоверного улучшения к 30-м суткам наблюдения. Статистически значимая динамика по шкале депрессии Гамильтона отмечена к 30-м суткам лечения [87].
Таким образом, проведенные в последние годы исследования показали, что депрессия приводит к нарушениям нейропластичности, что, возможно, служит основой для хронизации процесса и перехода его в резистентную форму. Именно поэтому в терапии депрессивных расстройств, в том числе у пациентов с церебрососудистой патологией, целесообразно применение Церебролизина в комплексной терапии с антидепрессантами. Рекомендованные для терапии депрессии дозы Церебролизина: внутривенные инфузии 10 мл курсами 10–15 дней.
Сведения об авторе
Зуйкова Надежда Леонидовна – д-р мед. наук, проф., зав. каф. психиатрии, психотерапии и психосоматической патологии ФПК МР РУДН. E-mail: sar_2003@mail.ru
Список исп. литературыСкрыть список1. Аведисова А.С. Нейропластичность и патогенез депрессии: новые данные. Психиатр. и психофармакотер. 2004; 6: 6.
2. Богдан А.Н., Морозов П.В., Сейку Ю.В. Ноотропные препараты в комплексной патогенетически обоснованной терапии депрессий (обзор литературы). Психич. расстройства в общей медицине. 2011; 3–4.
3. Вальдман А.В., Воронина Т.А. Фармакология ноотропов (экспериментальное и клиническое изучение). Сб. трудов. М., 1989.
4. Верещагин Н.В., Некрасова Е.М., Лебедева Н.В., Суслина З.К. Легкие формы мультифакторной деменции: эффективность Церебролизина. Использование Церебролизина в нейрологической и психологической практике. Сб. статей. Австрия: Унтерах, 1998.
5. Воронина Т.А., Середенин С.Б. Ноотропные препараты, достижения и новые проблемы. Эксперим. и клин. фармакология. 1998; 61 (4): 3–9.
6. Громова О.А., Авдеенко Г.В., Бурцев Е.М. Церебролизин: новые грани воздействия. Использование Церебролизина в нейрологической и психологической практике. Сб. статей. Австрия: Унтерах, 1998; с. 123–9.
7. Гусев Е.И., Боголепова А.Н. Роль процессов нейропластичности в развитии депрессивных расстройств. Трудный пациент. 2010; 10.
8. Гусев Е.И., Боголепова А.Н. Депрессивные расстройства у больных с цереброваскулярной патологией. Методические рекомендации ДЗ г. Москвы. 2008; 35: 28.
9. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М.: Медицина, 2001; 326.
10. Дзюба А.Н., Хаустова Е.А., Безшейко В.Г. Нейропластичность в терапии при депрессивных расстройствах. Украинский мед. журн. 2012; 2: 88.
11. Заваденко Н.Н. Церебролизин: данные новых зарубежных и отечественных исследований. Психиатр. и психофармакотер. 1999; 2: 25–9.
12. Изнак А.Ф. Нейрональная пластичность и терапия аффективных расстройств. Психиатр. и психофармакотер. (Прил.). 2004; 2.
13. Изнак А.Ф. Нейропластичность и нейропротекция в патогенезе и терапии депрессий. Обозрение психиатрии и мед. психологии им. В.М.Бехтерева. 2006; 3: 3.
14. Козлов А.А., Огарь Д.В., Киндрас Г.П. и др. Исследование влияния Церебролизина на психические процессы у детей-инвалидов с умственной отсталостью. Соц. и клин. психиатрия. 2006; 1: 64–9.
15. Красноперова М.Г., Башина В.М., Скворцов И.А. и др. Влияние Церебролизина на когнитивные функции при детском аутизме и синдроме Аспергера. Журн. неврол. и психиатр. 2003; 103 (6): 15–8.
16. Ларикова Т.И., Луканин А.Н., Ужегова И.В., Яковец Ю.Е. Возможности комплексной терапии при реабилитации инсульта. Рус. мед. журн. 2007; 8: 1155–7.
17. Ларикова Т.И., Луканин А.Н., Ужегова И.В. Коррекция постинсультного психовегетативного синдрома. Врач. 2007; 6: 52–4.
18. Ноотропы в когнитивной неврологии детского возраста. Под. ред. Л.М.Кузенковой. М., 2008.
19. Пантелеева Г.П., Артюх В.В., Крылова Е.С. и др. Оптимизации психофармакотерапии эндогенных депрессий с помощью препарата Церебролизин®. Психиатр. и психофармакотер. 2012; 1: 23–9.
20. Поздеева Е.А. Гипотеза аффективных расстройств, основанная на нейропластичности. Новый взгляд на терапию депрессии. Психиатр. и психофармакотер. 2007; 9: 1.
21. Радзивил М.Г. Комбинированная фармакотерапия нарушений психического развития при процессуальном детском аутизме. Психиатрия. 2006; 4–6 (22–24): 50–9.
22. Сорокина И.Б. Постинсультная депрессия. Автореф. дис. … канд. мед. наук. Киев, 2003.
23. Хаустова Е.А., Безшейко В.Г., Клебан К.И. Терапия деменции: от эффективности к повышению качества жизни пациента. Ліки України. 2011; 9 (155): 64–70.
24. Чуканова Е.И. Дисциркуляторная энцефалопатия (диагностика, клиника, лечение). Автореф. дис. … канд. мед. наук, 2005.
25. Чуканова Е.И. Церебролизин в лечении пациентов с синдромом мягкого когнитивного снижения. Трудный пациент. 2008; 6 (2–3): 3–6.
26. Чуканова Е.И. Хроническая цереброваскулярная недостаточность. Возможности лечения и профилактики инсульта. Фарматека. 2007; 12: 66–71.
27. Шахпаронова Н.В., Кадыков А.С. Сосудистая деменция и эффективность применения Церебролизина. Психиатр. и психофармакотер. 2011; 3.
28. Allman JM, Hakeem A, Erwin JM et al. The anterior cingulate cortex. The evolution of an interface between emotion and cognition. Ann NY Acad Sci 2001; 935: 107–17.
29. Ballmaier M, Toga AW, Blanton RE et al. Anterior cingulate, gyrus rectus, and orbitofrontal abnormalities in elderly depressed patients: an MRI-based parcellation of the prefrontal cortex. Am J Psychiat 2004; 161 (1): 99–108.
30. Balu DT, Hoshaw BA, Malberg JE et al. Differential regulation of central BDNF protein levels by antidepressant and non-antidepressant drug treatments. Brain Res 2008; 1211: 37–43.
31. Bondy B. Pathophysiology of depression. Dialogues in clinical neuroscience. 2002; 4 (1): 7–20.
32. Bremner JD, Narayan M, Anderson ER et al. Hippocampal volume reduction in major depression. Am J Psychiat 2000; 157 (1): 115–8.
33. Bremner JD, Vythilingam M, Vermetten E et al. Reduced volume of orbitofrontal cortex in major depression. Biol Psychiat 2002; 51 (4): 273–9.
34. Briley M, Montgomery S. (Eds) Antidepressant therapy at the dawn of the third millennium. Martin Dunitz, London 1998.
35. Brody AL, Saxena S, Stoessel P et al. Regional brain metabolic changes in patients with major depression treated with either paroxetine or interpersonal therapy: preliminary findings. Arch Gen Psychiat 2001; 58 (7): 631–40.
36. Campbell St, Marriott M, Nahmias Cl, MacQueen GM. Lower hippocampal volume in patients suffering from depression: a meta-analysis. Am J Psychiat 2004; 161: 598–607.
37. Canli T, Cooney RE, Goldin P et al. Amygdala reactivity to emotional faces predicts improvement in major depression. Neuroreport 2005; 16 (12): 1267–70.
38. Chen H et al. Trophic factors counteract elevated FGF-2-induced inhibition of adult neurogenesis. Neurobiol Aging 2007; 28 (8): 1148–62.
39. Ciraulo DA, Shader RI. (Eds) Pharmacotherapy of depression. NY, Humana Press 2011.
40. Dreverts WC. Neuroimaging studies of mood disorders. Biol Psychiat 2000; 48: 813–29.
41. Dreverts WC. Neuroimaging and neuropathological studies of depression: implications for the cognitive-emotional features of mood disorsers. Curr Opin Neurobiol 2001; 11: 240–9.
42. Drevets WC. Orbitofrontal cortex function and structure in depression. Ann NY Acad Sci 2007; 1121: 499–527.
43. Duman RS, Malberg J, Thome J. Neural plasticity to stress and antidepressant treatment. Biol Psychiat 1999; 46 (9): 1181–91.
44. Drzyzga ŁR, Marcinowska A, Obuchowicz E. Antiapoptotic and neurotrophic effects of antidepressants: a review of clinical and experimental studies. Brain Res Bull 2009; 79 (5): 248–57.
45. Fales CL, Barch DM, Rundle MM et al. Antidepressant treatment normalizes hypoactivity in dorsolateral prefrontal cortex during emotional interference processing in major depression. J Affect Dis 2009; 112 (1–3): 206–11.
46. Frodl T, Meisenzahl E, Zetzsche T et al. Enlargement of the amygdala in patients with a first episode of major depression. Biol Psychiat 2002; 51 (9): 708–14.
47. Frodl TS, Koutsouleris N, Bottlender R et al. Depression-related variation in brain morphology over 3 years: effects of stress? Arch Gen Psychiat 2008; 65 (10): 1156–65.
48. Fuchs E, Gould E. Mini-review: in vivo neurogenesis in the adult brain, regulation and functional implications. Eur J Neurosci 2000; 12: 2211–4.
49. Hall J, Thomas KL, Everitt BJ. Rapid and selective induction of BDNF expression in the hippocampus during contextual learning. Nat Neurosci 2000; 3 (6): 533–5.
50. Hamidi M, Drevets WC, Price JL. Glial reduction in amygdale in major depressive disorder is due to oligodendrocytes. Biol Psychiat 2004; 55: 563–9.
51. Hooley JM, Gruber SA, Scott LA et al. Activation in dorsolateral prefrontal cortex in response to maternal criticism and praise in recovered depressed and healthy control participants. Biol Psychiat 2005; 57 (7): 809–12.
52. Jacobsen JSt, Reinhart P, Pangalos MN. Current concepts in therapeutic strategies targeting cognitive decline and disease modification in Alzheimer’s disease. J Am Society Experim Neuro Therapeut 2005; 2: 612–26.
53. Jovanovic JN, Czernik AJ, Fienberg AA et al. Synapsins as mediators of BDNF-enhanced neurotransmitter release. Nat Neurosci 2000; 3 (4): 323–9.
54. Kessler RC, Berglund P, Demler O et al. The epidemiology of major depressive disorder: results from the National Comorbidity Survey Replication (NCS-R). JAMA 2003; 289 (23): 3095–105.
55. Kimbrell TA, Ketter TA, George MS et al. Regional cerebral glucose utilization in patients with a range of severities of unipolar depression. Biol Psychiat 2002; 51 (3): 237–52.
56. Konorski J. Conditioned Reflexes and Neuron Organisation. Cambridge University Press 1948.
57. MacQueen GM. Magnetic resonance imaging and prediction of outcome in patients with major depressive disorder. J Psychiat Neurosci 2009; 34 (5): 343–9.
58. MacQueen GM, Yucel K, Taylor VH. Posterior hippocampal volumes are associated with remission rates in patients with major depressive disorder. Biol Psychiat 2008; 64 (10): 880–3.
59. Maletic V, Robinson M, Oakes T et al. Neurobiology of depression: an integrated view of key findings. Int J Clin Pract 2007; 61 (12): 2030–40.
60. Marrone DF, Le Boutillier JC, Petit TL. Changes in synaptic ultra structure during reactive synaptogenesis in the rat dentate gyrus. Brain Research 2004; 1005: 124–36.
61. Martinowich K, Lu B. Interaction between BDNF and serotonin: role in mood disorders. Neuropsychopharmacol 2008; 33 (1): 73–83.
62. Mirza Y, Tang J, Russell A et al. Reduced anterior cingulate cortex glutamatergic concentrations in childhood major depression. J Am Acad Child Adolesc Psychiat 2004; 43 (3): 341–8.
63. Pezawas L, Meyer-Lindenberg A, Drabant E et al. 5HTTLPR polymorphism impacts human cingulate-amygdala interactions: a genetic susceptibility mechanism for depression. Nat Neurosci 2005; 8 (6): 828–34.
64. Pizzagalli D, Pascual-Marqui RD, Nitschke JB et al. Anterior cingulate activity as a predictor of degree of treatment response in major depression: evidence from brain electrical tomography analysis. Am J Psychiat 2001; 158 (3): 405–15.
65. Rajkowska G, Miguel-Hidalgo JJ, Wei J et al. Morphometric evidence for neuronal and glial prefrontal cell pathology in major depression. Biol Psychiat 1999; 45: 1085–98.
66. Sahay A, Hen R. Adult hippocampal neurogenesis in depression. Nat Neurosci 2007; 10 (9): 1110–5.
67. Shakesby AC et al. Overcoming the effects of stress on synaptic plasticity in the intact hippocampus: rapid actions of serotonergic and antidepressant agents. J Neurosci 2002; 22: 3638–44.
68. Sheline YI, Barch DM, Donnelly JM et al. Increased amygdale response to masked emotional faces in depressed subjects resolves with antidepressant treatment: an fMRI study. Biol Psychiat 2001; 50: 651–8.
69. Sheline YI, Gado MH, Price JL. Amygdala core nuclei volumes are decreased in recurrent major depression. Neuroreport 1998; 9: 2023–8.
70. Sheline YI, Mittler BL, Mintun MA. The hippocampus and depression. Eur Psychiat 2002; (Suppl. 3): 300–5.
71. Sheline YI, Sanghavi M, Mintun MA, Gado MH. Depression duration but not age predicts hippocampal volume loss in medically healthy women with recurrent major depression. J Neurosci 1999; 19: 5034–43.
72. Sheline YI, Wang P, Gado MH et al. Hippocampal atrophy in recurrent major depression. Proc Natl Acad Sci USA 1996; 93: 3908–13.
73. Shirayama Y, Chen AC, Nakagawa S et al. Brain-derived neurotrophic factor produces antidepressant effects in behavioral models of depression. J Neurosci 2002; 22: 3251–61.
74. Steffens DC, Bosworth HB, Provenzale JM, MacFall JR. Subcortical white matter lesions and functional impairment in geriatric depression. Depress Anxiety 2002; 15: 23–8.
75. Suggra Y, Kondo T, Kanazawa A et al. The protective effect of cerebrolisyn on delayed neuronal death in the hippocampus and its relationship with OH-radical. J Brain and Nerve 1993; 45 (4): 325–31.
76. Taylor WD, MacFall JR, Payne ME et al. Late-life depression and microstructural abnormalities in dorsolateral prefrontal cortex white matter. Am J Psychiat 2004; 161 (7): 1293–6.
77. Taylor WD, MacFall JR, Payne ME et al. Greater MRI lesion volumes in elderly depressed subjects than in control subjects. Psychiat Res 2005; 139: 1–7.
78. Vaidya VA, Terwilliger RZ, Duman RS. Role of 5HT2A-receptors in the down regulation of BDNF by stress. Neurosci Lett 1999; 287: 1–4.
79. Videbech P, Ravnkilde B. Hippocampal volume and depression: a meta-analysis of MRI studies. Am J Psychiat 2004; 161 (11): 1957–66.
80. Videbech P, Ravnkilde B, Pedersen AR et al. Danish PET/depression project: PET findings in patients with major depression. Psychol Med 2001; 31 (7): 1147–58.
81. von Gunten A, Fox NC, Cipolotti L, Ron MA. A volumetric study of hippocampus and amygdala in depressed patients with subjective memory problems. J Neuropsychiat Clin Neurosci 2000; 12: 493–8.
82. Wang L, Ashley-Koch A, Steffens DC et al. Impact of BDNF Val66Met and 5HTTLPR polymorphism variants on neural substrates related to sadness and executive function. Genes Brain Behav 2012; 11 (3): 352–9.
83. Wayne DC. Neuroplasticity in mood disorders. Dialogues in clinical neuroscience. Neuroplastic 2004; 6: 199–216.
84. Xiao Z, Liu W, Gao K et al. Interaction between CRHR1 and BDNF genes increases the risk of recurrent major depressive disorder in Chinese population. PLoS One 2011; 6 (12): e28733.
85. Eero Castre´n et al. Role of neurotrophic factors in depression. Current Opin Pharmacol 2007; 7: 18–21.
86. Chen H et al. Neurobiol. Aging. 2007; 28 (8): 1148–62.
87. Чуканова Е.И. Автореф. дис. … д-ра мед. наук. М., 2005.

