Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2013
Нейрорецепторные механизмы действия афобазола (реферат)* №01 2013
Номера страниц в выпуске:59-61
Афобазол – оригинальный селективный анксиолитик, разработан и внедрен в медицинскую практику ФГБУ НИИ фармакологии им. В.В.Закусова РАМН в сотрудничестве с ЗАО «Мастер Фарм» (регистрационный номер: ЛС-000861 от 03.11.2005). Механизм анксиолитического действия афобазола основан на его способности предотвращать стрессиндуцированное падение связывания в бензодиазепиновом участке ГАМК-рецептора.
Neuroreceptor mechanisms of afobazole (abstract)*
S.B.Seredenin, M.V.Voronin
V.V.Zakusov Research Institute of Pharmacology, Russian Academy of Medical Sciences
Введение
Афобазол – оригинальный селективный анксиолитик, разработан и внедрен в медицинскую практику ФГБУ НИИ фармакологии им. В.В.Закусова РАМН в сотрудничестве с ЗАО «Мастер Фарм» (регистрационный номер: ЛС-000861 от 03.11.2005). Механизм анксиолитического действия афобазола основан на его способности предотвращать стрессиндуцированное падение связывания в бензодиазепиновом участке ГАМК-рецептора. Вместе с тем попытки обнаружить связывание афобазола с ГАМК-рецепторным комплексом дали отрицательные результаты [б]. Таким образом, восстановление функций указанного рецептора следует рассматривать в качестве результирующего эффекта предшествующих нейрохимических событий.
Не менее важным свойством афобазола оказалось его нейропротекторное действие, установленное в опытах in vitro и in vivo, первичные механизмы которого оставались также невыясненными.
Цель работы – изучение связывания афобазола и его основного метаболита М-11 с рецепторами, отобранными в качестве кандидатов для исследования на основе теоретического анализа фармакологических эффектов препарата. Работа выполнена в компании «Сеrер» (Франция).
Методы исследования
Препараты. Субстанции афобазола и его метаболита М-11 синтезированы в ФГБУ НИИ фармакологии
им. В.В.Закусова РАМН. Препараты исследовали в диапазоне концентраций 10-3–10-9 М.
Проведено изучение способности афобазола и М-11 вытеснять высокоаффинные лиганды широкого круга нейрорецепторов (в том числе аденозиновых, адренергических, бензодиазепиновых, дофаминовых, ГАМК, глутаматных, гистаминовых, липофосфолипидных, мелатониновых, мускариновых, никотиновых, пуриновых, серотониновых, s-рецепторов, ангиотензиновых, холецистокининовых, кортиколибериновых, галаниновых, нейрокининовых, NPY, нейротензиновых, опиоидных, соматостатиновых, вазопрессиновых, глюкокортикоидных, прогестероновых, моноаминоксидазы – МАО, рецепторов кальциевых, калиевых и хлорных каналов, а также рецепторов синаптических транспортеров аденозина, норадреналина, дофамина, ГАМК, холина и серотонина). Радиолигандный анализ связывания с рецепторами проведен в соответствии с протоколами компании «Сеrер».
Результаты и их обсуждение
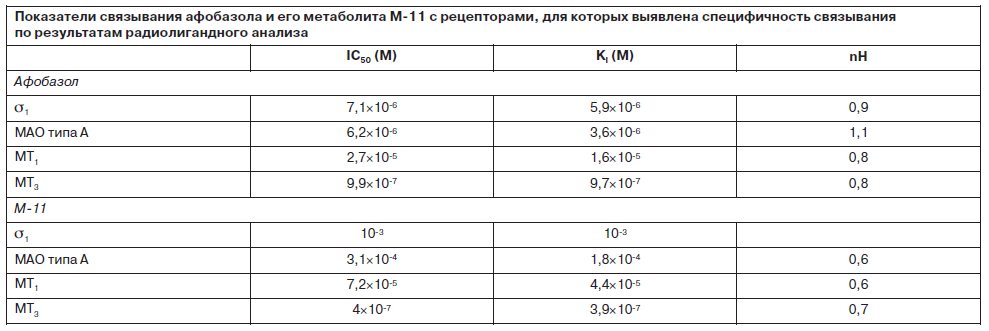
В результате радиолигандного анализа обнаружена группа рецепторов – мишеней афобазола. К их числу относятся s1-рецепторы, мелатониновые МТ1- и MT3-рецепторы и регуляторный участок МАО типа А. Показатели IC50 (концентрация полумаксимального ингибирования), Ki (константа диссоциации) и nH для этих рецепторов при изучении афобазола и его метаболита M-11 представлены в таблице. Основной метаболит афобазола М-11 проявил значимое сродство только к МТ1- и МТ3-рецепторам.
Значение взаимодействия афобазола с s1-рецепторами иллюстрируется следующим экспериментом. В результате иммунофлуоресцентного окрашивания клеток гиппокампа мыши линии НТ-22 антителами к s1 и кальнексину установлено, что введение афобазола в среду культивирования вызывает внутриклеточное перераспределение s1-рецепторов. В контрольных условиях расположение s1-рецепторов и кальнексина (маркера эндоплазматического ретикулума – ЭПР) совпадает и соответствует телам нейронов. Через 30 мин после внесения афобазола в среду культивирования окрашивание, специфичное для s1-рецепторов, наблюдается не только в теле нейронов, но и в аксонах. Через 1 ч после внесения афобазола видно, что данные рецепторы в значительной мере локализованы близ плазматической мембраны клеток, в том числе аксонов, в то время как кальнексин по-прежнему остается ассоциированным с мембраной ЭПР в теле нейронов.
Величины ингибирования МАО типа А головного мозга и печени афобазолом, полученные в серии экспериментов, свидетельствует о том, что препарат проявляет свойства слабого обратимого ингибитора фермента. Характер взаимодействия афобазола с МАО типа А продемонстрирован в исследованиях, проведенных под руководством А.Е.Медведева. В них установлено, что афобазол снижает активность МАО типа А митохондрий головного мозга и печени крыс. При этом преинкубация препарата с митохондриями печени в течение 30 мин не усиливала эффект препарата в опытах на митохондриях печени. А последующая трехкратная отмывка митохондрий приводила к полному восстановлению активности МАО типа А. Отсутствие зависимого от времени увеличения ингибирования МАО типа А и восстановление активности фермента после отмывки свидетельствуют о том, что афобазол обратимо ингибирует фермент.
Проведенное исследование определило в качестве первичных «мишеней» для афобазола s1-, МТ1-, МТ3-рецепторы и МАО типа А. В доступной литературе авторы не обнаружили сообщений о фармакологических препаратах либо химических соединениях с подобным спектром рецепторных взаимодействий. Физиологическая роль выявленных молекулярных образований согласуется с установленными ранее анксиолитическими и нейропротективными эффектами афобазола. В обсуждении более подробно рассмотрен ряд следствий из зарегистрированных фактов связывания афобазола с s1- и МТ3-рецепторами, поскольку свойства МТ1-рецептора и МАО типа А хорошо изучены.
s1-Рецепторы
s1-Рецепторы открыты в 1976 г. Выявление селективных лигандов, клонирование и определение аминокислотной последовательности рецептора позволили исключить его из ряда опиоидных рецепторов, к которым он первоначально был отнесен. Предполагается, что рецептор локализуется преимущественно на ЭПР и имеет два трансмембранных домена. Удивительным и, вероятно, весьма важным свойством s1-рецептора является способность к миграции в область поверхностной мембраны клетки в составе липидных микродоменов (lipidrafts). Липидное окружение s1-рецептора представлено сфинголипидами и холестерином, служащими каркасом для локализованных в наружной мембране белков рецепторов, ионных каналов ферментов. Таким образом, логично полагать, что инициированный афобазолом транспорт s1-рецептора в область наружной мембраны может способствовать восстановлению фосфолипидного состава клеточных мембран, который, как известно, нарушается при патологических процессах в результате усиления перекисных реакций. В свою очередь это должно нивелировать зависимые от перекисного окисления липидов нарушения конформации функционально важных белков и нормализовать их активность, что и было установлено для ГАМКA-рецептора в опытах с афобазолом ex vivo [5].
Далее, s1-рецептор способен к белок-белковым взаимодействиям и рассматривается в ряде случаев в качестве шаперона (белка, задающего правильную пространственную конформацию для других белков). Установлено взаимодействие s1-рецепторов с белком цитоскелетаанкирином, связанным с рецептором инозитол-1,4,5-трифосфата (IP3R), благодаря чему регулируется IРЗ-зависимое высвобождение Са2+ из ЭПР [45]. s1-Рецептор обнаружен также в мембранах ЭПР, ассоциированных с митохондриями, где взаимодействует с белком BiP, пролонгируя выход Са2+ из ЭПР в митохондрии, увеличивая таким образом биоэнергетический потенциал нейронов. Активация s1-рецепторов опосредует регуляцию потенциалзависимых ионных каналов наружной мембраны и транспорт Са2+ через NMDA-рецепторы. s1-Рецептор способен ингибировать пресинаптическое высвобождение глутамата и глутамат-индуцируемую NO синтазу. За счет белок-белковых (шаперонных) взаимодействий s1-рецептора происходит активация фосфолипазы С, каскада IРЗ и диацилглицерола, что в конечном итоге определяет состояние Са2+-зависимых процессов [46]. Известны данные об опосредованном через s1-рецепторы влиянии на дофамин-, серотонин- и холинергические системы, продукцию и функционирование факторов роста нервов, а также экспрессию генов, в том числе регулирующих апоптоз.
С s1-рецептором способны связываться нейростероиды, физиологически активные нейропептиды, нейролептики (галоперидол), антидепрессанты (имипрамин), бензоморфаны и другие соединения. В экспериментальных исследованиях лиганды s1-рецепторов проявили ряд фармакологических свойств, среди которых отмечены анксиолитический и нейропротекторные эффекты, схожие с эффектами афобазола.
Поскольку s1-рецепторы являются высококонсервативными белками, количество и локализация которых практически не изменяются в онтогенезе, вовлечены в разнообразные механизмы, поддерживающие гомеостаз клетки и ее жизнеспособность, отвечают на многие эндогенные соединения, изменения концентрации которых имеют приспособительный характер, можно полагать, что эти белки представляют эволюционные выработанные образования, осуществляющие функции защиты клетки при негативных воздействиях, и служат своеобразным «ремонтным комплектом» клетки. Если данная гипотеза верна, то область применения афобазола в клинической практике может быть значительно расширена. Имеется ряд экспериментальных подтверждений данной гипотезы.
МТ3-рецепторы
Среди рецепторов мелатонина МТ3-тип наименее изучен и имеет ряд свойств, позволяющих выделить его в отдельный класс. МТ3-рецептор представляет регуляторный участок фермента хинонредуктазы 2 (QR2, NQR2 Е. С. 1.10.99.2) и характеризуется быстрой кинетикой процессов ассоциации и диссоциации с лигандами. Аминокислотный состав МТ3-рецептора из ткани почки сирийского хомяка на 95% совпадает с QR2 человека. Привнесение гена QR2 человека в клеточную культуру приводило не только к развитию хинонредуктазной активности, но и к возникновению способности к связыванию MCA-NAT (2-метоксикарбониламино-N-ацетилтриптамин) – наиболее специфического лиганда МТ3-рецептора, что позволило говорить об идентичности молекул фермента и МТ3-рецептора [47]. В более поздних экспериментах это предположение было подтверждено на модели нокаутных мышей по гену NQR2 (NQR2-/-), ткани которых оказались неспособны к специфическому связыванию MCA-NAT.
Хинонредуктаза 2 и родственный фермент хинонредуктаза 1 (QR1) катализируют процессы детоксикации высокореактивных экзогенных хинонов, предохраняя клетки от окислительного стресса. Тем не менее основная биологическая роль QR2 на сегодняшний день до конца не определена. Экспрессия гена QR2 имеет значительные межвидовые различия, однако наибольшее содержание фермента обнаруживается в печени и почках, а в меньших количествах – в головном мозге. Промотор гена QR2 включает копию ARE (antioxidant response element) – последовательности, отвечающей за индукцию экспрессии в ответ на ряд ксенобиотиков и антиоксидантов. Наличие данной последовательности характерно для многих генов ферментов детоксикации. Каталитические участки QR1 и QR2 имеют высокую степень гомологии и обеспечивают восстановление хинонных субстратов с переносом 1, 2 или 4 электронов.
Несмотря на схожесть QR1 и QR2 ферменты используют разные косубстраты и субстраты, а также реагируют на различные ингибиторы. В восстановительных реакциях QR1 участвуют NADH и NADPH, тогда как QR2 использует N-рибозилдегидроникотинамид (NRH) и N-метилдегидроникотинамид (NMH). Известно немного субстратов QR2.
К их числу относят менадион (витамин К3), допахиноны и коэнзим Q0 (убихинон) – единственный известный на сегодняшний день эндогенный субстрат фермента. J.Bourin и соавт. не исключают возможности взаимодействия OR2 с убихинонами с изопрениловыми боковыми цепями различной длины (Q1–Q10). Учитывая способность убихинонов встраиваться в биологические мембраны, в том числе мембраны митохондрий, где они включаются в дыхательную цепь переноса электронов, QR2 может модулировать гомеостаз и энергетический баланс клетки.
В этой связи интересно отметить общие клеточные структуры, участвующие в реализации эффектов афобазола как лиганда s1- и МТ3-рецепторов. Установлено также, что QR2 играет определенную роль в метаболической активации противоопухолевых препаратов из класса хинонов. Несмотря на невысокое содержание фермента в головном мозге, в последнее время особое внимание уделяется его регуляторным функциям в центральной нервной системе. Например, обсуждается влияние полиморфизма промоторной области гена QR2 в регуляции экспрессии и, как следствие, предрасположенности к болезни Паркинсона, а фермент рассматривается в качестве оксидазы токсичных катехоловых хинонов, продуктов окисления дофамина. Фармакологическое значение связывания афобазола с МТ3-типом рецептора должно явиться предметом дальнейших исследований.
MT1-рецептор на сегодняшний день изучен достаточно хорошо. Известно, что данный тип рецептора мелатонина связан с G-белками. Через МТ1-рецептор мелатонин участвует в регуляции циркадных ритмов. Установлено также, что мелатонин играет важную роль в формировании поведенческих реакций, а лиганды МТ1-рецептора обладают антидепрессивным и анксиолитическими свойствами. Не исключено, что анксиолитическое действие афобазола опосредуется и через данный тип рецептора. Мягкий антидепрессивный эффект афобазола может проявляться также посредством ингибирования активности МАО типа А – классической «мишени» для антидепрессантов.
Таким образом, рецепторограммы, полученные в результате исследования взаимодействия афобазола с нейрорецепторами, и результаты иммунофлуоресцентного исследования in vitro внутриклеточной локализации s1-рецептора в ответ на введение афобазола полностью соответствуют установленным фармакологическим эффектам афобазола, раскрывают первичные механизмы его действия как анксиолитика и нейропротектора и определяют дальнейшие перспективы фармакологического изучения и применения в фармакотерапии.
S.B.Seredenin, M.V.Voronin
V.V.Zakusov Research Institute of Pharmacology, Russian Academy of Medical Sciences
Введение
Афобазол – оригинальный селективный анксиолитик, разработан и внедрен в медицинскую практику ФГБУ НИИ фармакологии им. В.В.Закусова РАМН в сотрудничестве с ЗАО «Мастер Фарм» (регистрационный номер: ЛС-000861 от 03.11.2005). Механизм анксиолитического действия афобазола основан на его способности предотвращать стрессиндуцированное падение связывания в бензодиазепиновом участке ГАМК-рецептора. Вместе с тем попытки обнаружить связывание афобазола с ГАМК-рецепторным комплексом дали отрицательные результаты [б]. Таким образом, восстановление функций указанного рецептора следует рассматривать в качестве результирующего эффекта предшествующих нейрохимических событий.
Не менее важным свойством афобазола оказалось его нейропротекторное действие, установленное в опытах in vitro и in vivo, первичные механизмы которого оставались также невыясненными.
Цель работы – изучение связывания афобазола и его основного метаболита М-11 с рецепторами, отобранными в качестве кандидатов для исследования на основе теоретического анализа фармакологических эффектов препарата. Работа выполнена в компании «Сеrер» (Франция).
Методы исследования
Препараты. Субстанции афобазола и его метаболита М-11 синтезированы в ФГБУ НИИ фармакологии
им. В.В.Закусова РАМН. Препараты исследовали в диапазоне концентраций 10-3–10-9 М.
Проведено изучение способности афобазола и М-11 вытеснять высокоаффинные лиганды широкого круга нейрорецепторов (в том числе аденозиновых, адренергических, бензодиазепиновых, дофаминовых, ГАМК, глутаматных, гистаминовых, липофосфолипидных, мелатониновых, мускариновых, никотиновых, пуриновых, серотониновых, s-рецепторов, ангиотензиновых, холецистокининовых, кортиколибериновых, галаниновых, нейрокининовых, NPY, нейротензиновых, опиоидных, соматостатиновых, вазопрессиновых, глюкокортикоидных, прогестероновых, моноаминоксидазы – МАО, рецепторов кальциевых, калиевых и хлорных каналов, а также рецепторов синаптических транспортеров аденозина, норадреналина, дофамина, ГАМК, холина и серотонина). Радиолигандный анализ связывания с рецепторами проведен в соответствии с протоколами компании «Сеrер».
Результаты и их обсуждение
В результате радиолигандного анализа обнаружена группа рецепторов – мишеней афобазола. К их числу относятся s1-рецепторы, мелатониновые МТ1- и MT3-рецепторы и регуляторный участок МАО типа А. Показатели IC50 (концентрация полумаксимального ингибирования), Ki (константа диссоциации) и nH для этих рецепторов при изучении афобазола и его метаболита M-11 представлены в таблице. Основной метаболит афобазола М-11 проявил значимое сродство только к МТ1- и МТ3-рецепторам.

Значение взаимодействия афобазола с s1-рецепторами иллюстрируется следующим экспериментом. В результате иммунофлуоресцентного окрашивания клеток гиппокампа мыши линии НТ-22 антителами к s1 и кальнексину установлено, что введение афобазола в среду культивирования вызывает внутриклеточное перераспределение s1-рецепторов. В контрольных условиях расположение s1-рецепторов и кальнексина (маркера эндоплазматического ретикулума – ЭПР) совпадает и соответствует телам нейронов. Через 30 мин после внесения афобазола в среду культивирования окрашивание, специфичное для s1-рецепторов, наблюдается не только в теле нейронов, но и в аксонах. Через 1 ч после внесения афобазола видно, что данные рецепторы в значительной мере локализованы близ плазматической мембраны клеток, в том числе аксонов, в то время как кальнексин по-прежнему остается ассоциированным с мембраной ЭПР в теле нейронов.
Величины ингибирования МАО типа А головного мозга и печени афобазолом, полученные в серии экспериментов, свидетельствует о том, что препарат проявляет свойства слабого обратимого ингибитора фермента. Характер взаимодействия афобазола с МАО типа А продемонстрирован в исследованиях, проведенных под руководством А.Е.Медведева. В них установлено, что афобазол снижает активность МАО типа А митохондрий головного мозга и печени крыс. При этом преинкубация препарата с митохондриями печени в течение 30 мин не усиливала эффект препарата в опытах на митохондриях печени. А последующая трехкратная отмывка митохондрий приводила к полному восстановлению активности МАО типа А. Отсутствие зависимого от времени увеличения ингибирования МАО типа А и восстановление активности фермента после отмывки свидетельствуют о том, что афобазол обратимо ингибирует фермент.
Проведенное исследование определило в качестве первичных «мишеней» для афобазола s1-, МТ1-, МТ3-рецепторы и МАО типа А. В доступной литературе авторы не обнаружили сообщений о фармакологических препаратах либо химических соединениях с подобным спектром рецепторных взаимодействий. Физиологическая роль выявленных молекулярных образований согласуется с установленными ранее анксиолитическими и нейропротективными эффектами афобазола. В обсуждении более подробно рассмотрен ряд следствий из зарегистрированных фактов связывания афобазола с s1- и МТ3-рецепторами, поскольку свойства МТ1-рецептора и МАО типа А хорошо изучены.
s1-Рецепторы
s1-Рецепторы открыты в 1976 г. Выявление селективных лигандов, клонирование и определение аминокислотной последовательности рецептора позволили исключить его из ряда опиоидных рецепторов, к которым он первоначально был отнесен. Предполагается, что рецептор локализуется преимущественно на ЭПР и имеет два трансмембранных домена. Удивительным и, вероятно, весьма важным свойством s1-рецептора является способность к миграции в область поверхностной мембраны клетки в составе липидных микродоменов (lipidrafts). Липидное окружение s1-рецептора представлено сфинголипидами и холестерином, служащими каркасом для локализованных в наружной мембране белков рецепторов, ионных каналов ферментов. Таким образом, логично полагать, что инициированный афобазолом транспорт s1-рецептора в область наружной мембраны может способствовать восстановлению фосфолипидного состава клеточных мембран, который, как известно, нарушается при патологических процессах в результате усиления перекисных реакций. В свою очередь это должно нивелировать зависимые от перекисного окисления липидов нарушения конформации функционально важных белков и нормализовать их активность, что и было установлено для ГАМКA-рецептора в опытах с афобазолом ex vivo [5].
Далее, s1-рецептор способен к белок-белковым взаимодействиям и рассматривается в ряде случаев в качестве шаперона (белка, задающего правильную пространственную конформацию для других белков). Установлено взаимодействие s1-рецепторов с белком цитоскелетаанкирином, связанным с рецептором инозитол-1,4,5-трифосфата (IP3R), благодаря чему регулируется IРЗ-зависимое высвобождение Са2+ из ЭПР [45]. s1-Рецептор обнаружен также в мембранах ЭПР, ассоциированных с митохондриями, где взаимодействует с белком BiP, пролонгируя выход Са2+ из ЭПР в митохондрии, увеличивая таким образом биоэнергетический потенциал нейронов. Активация s1-рецепторов опосредует регуляцию потенциалзависимых ионных каналов наружной мембраны и транспорт Са2+ через NMDA-рецепторы. s1-Рецептор способен ингибировать пресинаптическое высвобождение глутамата и глутамат-индуцируемую NO синтазу. За счет белок-белковых (шаперонных) взаимодействий s1-рецептора происходит активация фосфолипазы С, каскада IРЗ и диацилглицерола, что в конечном итоге определяет состояние Са2+-зависимых процессов [46]. Известны данные об опосредованном через s1-рецепторы влиянии на дофамин-, серотонин- и холинергические системы, продукцию и функционирование факторов роста нервов, а также экспрессию генов, в том числе регулирующих апоптоз.
С s1-рецептором способны связываться нейростероиды, физиологически активные нейропептиды, нейролептики (галоперидол), антидепрессанты (имипрамин), бензоморфаны и другие соединения. В экспериментальных исследованиях лиганды s1-рецепторов проявили ряд фармакологических свойств, среди которых отмечены анксиолитический и нейропротекторные эффекты, схожие с эффектами афобазола.
Поскольку s1-рецепторы являются высококонсервативными белками, количество и локализация которых практически не изменяются в онтогенезе, вовлечены в разнообразные механизмы, поддерживающие гомеостаз клетки и ее жизнеспособность, отвечают на многие эндогенные соединения, изменения концентрации которых имеют приспособительный характер, можно полагать, что эти белки представляют эволюционные выработанные образования, осуществляющие функции защиты клетки при негативных воздействиях, и служат своеобразным «ремонтным комплектом» клетки. Если данная гипотеза верна, то область применения афобазола в клинической практике может быть значительно расширена. Имеется ряд экспериментальных подтверждений данной гипотезы.
МТ3-рецепторы
Среди рецепторов мелатонина МТ3-тип наименее изучен и имеет ряд свойств, позволяющих выделить его в отдельный класс. МТ3-рецептор представляет регуляторный участок фермента хинонредуктазы 2 (QR2, NQR2 Е. С. 1.10.99.2) и характеризуется быстрой кинетикой процессов ассоциации и диссоциации с лигандами. Аминокислотный состав МТ3-рецептора из ткани почки сирийского хомяка на 95% совпадает с QR2 человека. Привнесение гена QR2 человека в клеточную культуру приводило не только к развитию хинонредуктазной активности, но и к возникновению способности к связыванию MCA-NAT (2-метоксикарбониламино-N-ацетилтриптамин) – наиболее специфического лиганда МТ3-рецептора, что позволило говорить об идентичности молекул фермента и МТ3-рецептора [47]. В более поздних экспериментах это предположение было подтверждено на модели нокаутных мышей по гену NQR2 (NQR2-/-), ткани которых оказались неспособны к специфическому связыванию MCA-NAT.
Хинонредуктаза 2 и родственный фермент хинонредуктаза 1 (QR1) катализируют процессы детоксикации высокореактивных экзогенных хинонов, предохраняя клетки от окислительного стресса. Тем не менее основная биологическая роль QR2 на сегодняшний день до конца не определена. Экспрессия гена QR2 имеет значительные межвидовые различия, однако наибольшее содержание фермента обнаруживается в печени и почках, а в меньших количествах – в головном мозге. Промотор гена QR2 включает копию ARE (antioxidant response element) – последовательности, отвечающей за индукцию экспрессии в ответ на ряд ксенобиотиков и антиоксидантов. Наличие данной последовательности характерно для многих генов ферментов детоксикации. Каталитические участки QR1 и QR2 имеют высокую степень гомологии и обеспечивают восстановление хинонных субстратов с переносом 1, 2 или 4 электронов.
Несмотря на схожесть QR1 и QR2 ферменты используют разные косубстраты и субстраты, а также реагируют на различные ингибиторы. В восстановительных реакциях QR1 участвуют NADH и NADPH, тогда как QR2 использует N-рибозилдегидроникотинамид (NRH) и N-метилдегидроникотинамид (NMH). Известно немного субстратов QR2.
К их числу относят менадион (витамин К3), допахиноны и коэнзим Q0 (убихинон) – единственный известный на сегодняшний день эндогенный субстрат фермента. J.Bourin и соавт. не исключают возможности взаимодействия OR2 с убихинонами с изопрениловыми боковыми цепями различной длины (Q1–Q10). Учитывая способность убихинонов встраиваться в биологические мембраны, в том числе мембраны митохондрий, где они включаются в дыхательную цепь переноса электронов, QR2 может модулировать гомеостаз и энергетический баланс клетки.
В этой связи интересно отметить общие клеточные структуры, участвующие в реализации эффектов афобазола как лиганда s1- и МТ3-рецепторов. Установлено также, что QR2 играет определенную роль в метаболической активации противоопухолевых препаратов из класса хинонов. Несмотря на невысокое содержание фермента в головном мозге, в последнее время особое внимание уделяется его регуляторным функциям в центральной нервной системе. Например, обсуждается влияние полиморфизма промоторной области гена QR2 в регуляции экспрессии и, как следствие, предрасположенности к болезни Паркинсона, а фермент рассматривается в качестве оксидазы токсичных катехоловых хинонов, продуктов окисления дофамина. Фармакологическое значение связывания афобазола с МТ3-типом рецептора должно явиться предметом дальнейших исследований.
MT1-рецептор на сегодняшний день изучен достаточно хорошо. Известно, что данный тип рецептора мелатонина связан с G-белками. Через МТ1-рецептор мелатонин участвует в регуляции циркадных ритмов. Установлено также, что мелатонин играет важную роль в формировании поведенческих реакций, а лиганды МТ1-рецептора обладают антидепрессивным и анксиолитическими свойствами. Не исключено, что анксиолитическое действие афобазола опосредуется и через данный тип рецептора. Мягкий антидепрессивный эффект афобазола может проявляться также посредством ингибирования активности МАО типа А – классической «мишени» для антидепрессантов.
Таким образом, рецепторограммы, полученные в результате исследования взаимодействия афобазола с нейрорецепторами, и результаты иммунофлуоресцентного исследования in vitro внутриклеточной локализации s1-рецептора в ответ на введение афобазола полностью соответствуют установленным фармакологическим эффектам афобазола, раскрывают первичные механизмы его действия как анксиолитика и нейропротектора и определяют дальнейшие перспективы фармакологического изучения и применения в фармакотерапии.

