Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Резюме
Специфический набор симптомов, сохраняющихся в течение длительного времени после перенесенного COVID-19, получил название «постковидный синдром». Важное место среди наиболее частых симптомов «постковидного синдрома» со стороны центральной нервной системы (ЦНС) занимают астенические проявления, а также депрессивные и тревожные нарушения, нарушения сна, когнитивные нарушения, летучие миалгии, головные боли напряжения (ГБН), функциональные (психосоматические) расстройства желудочно-кишечного тракта (ЖКТ), в особенности – «синдром раздраженного кишечника» (СРК), протекающий у этих пациентов чаще с диареей и/или с болями в животе, чем с запорами.
Эти симптомы весьма сходны с теми, которые чаще всего наблюдаются у пациентов с синдромом хронической усталости (СХУ) или с фибромиалгией (ФМА). Стоит отметить, что СХУ и ФМА тоже часто впервые манифестируют после перенесенных вирусных инфекций. Особенно часто – после инфекций высоконейротропными вирусами, такими как вирусы герпес-группы или вирус гриппа. Это сближает данные патологические состояния по их этиологии и патогенезу с «постковидным синдромом».
Согласно одной из гипотез, в патогенезе как «постковидного синдрома», так и СХУ, и ФМА – важную роль могут играть наблюдаемые при всех этих заболеваниях нарушения в работе лимфатико-глимфатической системы мозга и мозговых оболочек, а также характерные для всех этих заболеваний нарушения фазовой структуры и архитектоники сна, с уменьшением количества и продолжительности самой глубокой, 4-й фазы сна (так называемой фазы дельта-сна) и одновременным уменьшением суммарной спектральной мощности дельта-ритмов на электроэнцефалограмме (ЭЭГ) во время сна. Между тем показано, что лимфатико-глимфатическая система мозга и мозговых оболочек наиболее сильно активизируется именно во время фазы дельта-сна, и что степень ее активации достаточно хорошо коррелирует с суммарной мощностью дельта-волн на ЭЭГ сна.
В то же время уже достаточно давно было показано, что тразодон обладает специфическим нормализующим воздействием на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности самой глубокой, 4-й фазы сна и увеличением суммарной спектральной мощности дельта-волн на ЭЭГ сна. Это действие тразодона, в свою очередь, закономерно приводит к активизации работы лимфатико-глимфатической системы мозга и мозговых оболочек при лечении тразодоном. Одновременно в ряде клинических исследований было также уже довольно давно показано, что тразодон эффективен и безопасен в отношении устранения многих симптомов СХУ и ФМА.
Все это, вместе взятое, дает теоретические основания для попыток эмпирического применения тразодона, по аналогии с его уже доказанной эффективностью в лечении СХУ и ФМА, также в лечении проявлений «постковидного синдрома» со стороны ЦНС и ЖКТ.
Как показано в приведенных нами двух клинических примерах из нашей собственной практики, тразодон действительно может быть эффективным и безопасным средством для лечения проявлений «постковидного синдрома» со стороны ЦНС и ЖКТ. Мы также показываем, что тразодон нередко оказывается, со многих точек зрения, наилучшим именно для этой цели выбором среди всех имеющихся сегодня на рынке антидепрессантов (АД).
Ключевые слова: тразодон, вирус SARS-CoV-2, COVID-19, постковидный синдром, синдром хронической усталости, фибромиалгия, миалгический энцефаломиелит, синдром раздраженного кишечника, депрессивные расстройства, тревожные расстройства, фазовая структура сна, дельта-сон, лимфатико-глимфатическая система, аквапорин-4, астроглия, 5-HT1A-серотониновые рецепторы, 5-HT1D-серотониновые рецепторы, 5-HT2A-серотониновые рецепторы, 5-HT7-серотониновые рецепторы, a1-адренергические рецепторы.
Для цитирования: Беккер Р.А., Быков Ю.В. Об эффективности и безопасности применения тразодона в лечении нейропсихиатрических последствий постковидного синдрома (Обзор литературы и представление двух клинических случаев). Психиатрия и психофармакотерапия. 2021; 23 (6): 28–42.
On the efficacy and safety of using trazodone in the treatment of neuropsychiatric sequelae of long-COVID syndrome (A Literature Review with Presentation of Two Clinical Cases)
R.A.Bekker1, Yu.V.Bykov2
Abstract
A specific set of symptoms, which may persist for a long time after recovering from COVID-19 disease, got labeled as a «post-COVID syndrome». An important place in the overall clinical picture of «post-COVID syndrome» affecting the patient’s central nervous system (CNS) – plays the symptom of severe asthenia, often accompanied by depressive and anxiety symptoms, troubles with sleep, various cognitive impairments, myalgic pains, headaches, functional psychosomatic disorders of the gastrointestinal tract (GIT), and in particular – so-called «irritable bowel syndrome» (IBS), which in those patients is more often of diarrheal and/or abdominal pain type, than of constipational type.
The symptoms of post-COVID syndrome are very similar to those seen in patients who suffer from chronic fatigue syndrome (CFS), and in patients suffering from fibromyalgia (FMA). It is worth noting that both CFS and FMA, too, often have their first-time manifest after various viral infections, especially after infections which were caused by strongly neurotropic viruses, such as herpes-group viruses or influenza virus. This observation also brings these pathological conditions closer to the «post-COVID syndrome» in their possible aetiology and pathogenesis.
According to one plausible hypothesis, in the pathogenesis of both «post-COVID syndrome» and CFS and FMA, an important role can be played by the abnormal or deficient functioning of the lymphatic-glymphatic system of the brain and its meninges, as well as by the characteristic disturbances in the sleep architecture, which are often observed in all these diseases, namely – a marked reduction in the number and duration of deep sleep phases, together with a marked decrease in the total spectral power of delta waves in the electroencephalogram (EEG) registered during sleep. Meanwhile, it is also well known that the lymphatic-glymphatic system of the brain and its meninges is most active during the deepest, 4th, phase of nocturnal sleep, and that the level of activity of this important brain detoxification system correlates well with total delta wave EEG spectral power during nighttime sleep.
At the same time, it has long been known that trazodone has a specific normalizing effect on the sleep architecture, with an increase in the number and duration of the deepest (4th) sleep phase, coupled with an increase in the total spectral power of delta waves on the sleep EEG. This specific action of trazodone on sleep architecture naturally leads to the activation of the lymphatic-glymphatic system of the brain and its meninges under trazodone therapy. At the same time, a number of clinical studies have long ago shown that trazodone is effective and safe in terms of eliminating many of the symptoms of CFS and FMA.
All this, taken together, provides solid theoretical basis for the attempt to empirically try using trazodone in the treatment of «post-COVID syndrome», whose symptoms and plausible pathogenetic mechanisms are so strikingly similar to the symptoms and plausible pathogenetic mechanisms of CFS and FMA.
As we did show in the presentation of two real clinical cases from our own practice, trazodone can indeed be an effective and safe remedy for the treatment of several CNS and GIT manifestations of «post-COVID syndrome». We also show that trazodone can often be the best choice for this purpose, among all antidepressants (AD) currently available on the market.
Keywords: trazodone, SARS-CoV-2 virus, COVID-19, post-COVID syndrome, chronic fatigue syndrome, fibromyalgia, myalgic encephalomyelitis, irritable bowel syndrome, depressive disorders, anxiety disorders, sleep architecture, delta wave sleep, lymphatic-glymphatic system, aquaporin-4, astroglia, 5-HT1A-serotonergic receptors, 5-HT1D-serotonergic receptors, 5-HT2A-serotonergic receptors, 5-HT7-serotonergic receptors, a1-adrenergic receptors
For citation: Bekker R.A., Bykov Yu.V. On the efficacy and safety of using trazodone in the treatment of neuropsychiatric sequelae of long-COVID syndrome (A Literature Review with Presentation of Two Clinical Cases). Psychiatry and Psychopharmacotherapy. 2021; 23 (6): 28–42.
Введение(Обоснование актуальности проблемы)
Количество заболевших и переболевших COVID-19, инфекционной болезнью, вызываемой заражением новым коронавирусом SARS-CoV-2, во всем мире исчисляется на сегодня уже цифрой более чем в 265 миллионов человек, а количество умерших от этой болезни или ее осложнений – уже превысило 5,24 миллиона человек, согласно статистике Our World in Data [OWinD, 2021].
По разным данным, от 50 до 80% переболевших COVID-19, после выздоровления от острой фазы этой болезни еще на протяжении длительного времени – многих недель, многих месяцев или даже 1–2–3 лет (более длительных наблюдений пока не существует, так как сама болезнь сравнительно новая) продолжают испытывать различные нарушения в работе тех или иных органов и систем организма: прежде всего – центральной нервной системы (ЦНС), но также и желудочно-кишечного тракта (ЖКТ), и сердечно-сосудистой системы (ССС), и легких и верхних дыхательных путей; также могут наблюдаться симптомы со стороны печени, почек и мочевыводящих путей и др. [Yong SJ, 2021; Kamal M et al., 2021].
Эта крайне разнородная и плохо очерченная совокупность симптомов получила в научной литературе собирательное название «постковидный синдром», или «пролонгированный COVID-19» [Yong SJ, 2021; Kamal M et al., 2021].
Ясно, что при таком огромном количестве страдающих «постковидным синдромом» – организация доступной, быстрой и эффективной помощи подобным пациентам сегодня является одной из актуальнейших задач для систем общественного здравоохранения во всех странах мира, затронутых пандемией COVID-19 [Yong SJ, 2021; Kamal M et al., 2021].
А поскольку в общей клинической картине «постковидного синдрома» очень большое, нередко даже главенствующее место занимают именно психические и неврологические симптомы со стороны ЦНС (что, в целом, неудивительно с учетом очень высокой нейротропности, нейроинвазивности и нейротоксичности вируса SARS-CoV-2, гораздо более высокой, чем у его ближайших родственников – вирусов SARS-CoV и MERS), то на переднем крае борьбы с «постковидным синдромом» закономерно оказываются психиатры, психотерапевты и неврологи [Yong SJ, 2021; Kamal M et al., 2021].
Рассмотрению современных возможностей лечения нейропсихиатрических проявлений «постковидного синдрома», и уместности и целесообразности применения в этом контексте тразодона – как раз и посвящена данная статья.
Клиническая симптоматика «постковидного синдрома»
Наиболее часто встречающимися симптомами у пациентов с «постковидным синдромом», по данным разных исследований, являются длительная астенизация, физическая и умственная слабость, повышенная утомляемость при сравнительно небольших физических и/или умственных нагрузках, пониженная устойчивость к психоэмоциональным стрессам, эмоциональная лабильность, а также длительно сохраняющаяся одышка (диспноэ) [Yong SJ, 2021; Kamal M et al., 2021].
Другие часто встречающиеся и длительно персистирующие после перенесенной острой фазы COVID-19 симптомы могут включать в себя когнитивные нарушения (КН), нарушения памяти и концентрации внимания, разнообразные психические нарушения (чаще всего – проявления депрессии и/или тревожности, раздражительности, дисфории, недовольства собой и/или окружающими и жизнью в целом), нарушения сна и циркадных ритмов, «летучие» боли в грудной клетке, в животе, в мышцах (миалгии) и суставах (артралгии), тахикардию, экстрасистолы, нарушения восприятия запахов и вкусов, хронический кашель, хронические головные боли напряжения (ХГБН) или мигрени, разнообразные жалобы со стороны ЖКТ или ССС, мочеполовой системы (например, проявления синдрома раздраженного кишечника – СРК, чаще с диареей и/или болями, чем с запорами, или же проявления нейрогенной дисфункции мочевого пузыря – НДМП) [Yong SJ, 2021; Kamal M et al., 2021].
Многие из симптомов, чаще всего наблюдаемых при «постковидном синдроме», при всем своеобразии и большом полиморфизме и гетерогенности клинической картины этого синдрома, достаточно сильно напоминают симптомы, часто наблюдаемые при таких давно и хорошо известных заболеваниях, как синдром хронической усталости (СХУ), он же – хронический миалгический энцефаломиелит, или фибромиалгия (ФМА), или синдром постуральной ортостатической тахикардии (СПОТ), или синдром активации тучных клеток (САТК) [Yong SJ, 2021;
Kamal M et al., 2021].
В рамках «постковидного синдрома» могут также наблюдаться различные неврологические нарушения, в диапазоне от минимальных (например, учащение приступов ХГБН или мигрени по сравнению с тем, что было до перенесенного COVID-19) до очень грубых (параличи, парезы, полирадикулоневриты, ишемические или геморрагические инсульты, сенсоневральная глухота, слепота, ухудшение течения или манифестация de novo рассеянного склероза (РС), ухудшение течения или необычно ранняя манифестация различных деменций, например болезни Паркинсона (БП), деменции с тельцами Леви (ДТЛ) или болезни Альцгеймера (БА), дисциркуляторной энцефалопатии (ДЭП), особенно у предрасположенных лиц, синдром Гийена-Барре и т. д.) [Yong SJ, 2021; Kamal M et al., 2021].
Известные факторы риска, предрасполагающие к развитию «постковидного синдрома»
Среди известных факторов риска, повышающих вероятность развития «постковидного синдрома», называют принадлежность к женскому полу, наличие одновременно более чем 5 ранних симптомов COVID-19 почти с самого начала болезни, тяжелое течение болезни (например, потребовавшее госпитализации, кислородной поддержки или интубации трахеи), раннее развитие диспноэ в ходе болезни, использование высоких доз глюкокортикоидов для лечения острой фазы болезни (этот показатель, по всей вероятности, является еще одним субститутным маркером тяжелого течения болезни), высокие уровни определенных биомаркеров в крови, таких как С-реактивный белок, D-димер, количество лимфоцитов в крови, а также наличие у пациента предсуществующих психических расстройств [Yong SJ, 2021; Kamal M et al., 2021].
Из этого списка факторов риска можно сделать вывод о том, что в патогенетических механизмах развития «постковидного синдрома», вероятно, могут играть роль как интенсивность воспаления и повреждения тканей, гиперпродукция воспалительных цитокинов, степень гипоксии в острой фазе болезни, так и нервно-психические факторы (пережитый психоэмоциональный стресс, страх за свою жизнь и здоровье и т. д.; ведь пациенты с предсуществующими психическими расстройствами более чувствительны к такому, менее устойчивы к стрессу), и гормональные влияния (преобладание женского пола) [Yong SJ, 2021; Kamal M et al., 2021].
Гипотезы о вероятных патогенетических механизмах развития «постковидного синдрома»
Как точные патогенетические механизмы, обуславливающие развитие всего описанного нами выше множества симптомов «постковидного синдрома», так и причины столь большого их разнообразия (полиморфизма), их гетерогенности (неоднородности их распределения в популяции), а также столь большой их вариабельности как по степени тяжести, так и по длительности их персистирования у разных пациентов – пока окончательно не выяснены [Yong SJ, 2021; Kamal M et al., 2021].
Тем не менее на сегодняшний день уже существует несколько гипотез о возможных механизмах, принимающих участие в общем патогенезе «постковидного синдрома». В частности, некоторые авторы считают, что по крайней мере часть симптомов «постковидного синдрома» может быть связана с долгосрочными последствиями изначального повреждения самим вирусом SARS-CoV-2 или же ответной воспалительной атакой со стороны иммунокомпетентных клеток организма хозяина таких тканей, как легкие, ЦНС, сердечная мышца, сосуды, почки или печень, или с долгосрочными последствиями перенесенной в острой фазе COVID-19 гипоксии тканей, полиорганной недостаточности с интоксикацией, или с тромбоэмболическими либо, напротив, геморрагическими осложнениями и их последствиями, или с отсроченными последствиями побочных эффектов применявшихся для лечения COVID-19 определенных лекарств и т. д. [Yong SJ, 2021; Kamal M et al., 2021].
Другие же авторы считают, что симптомы, развивающиеся в рамках «постковидного синдрома», могут быть лучше всего объяснены в рамках гипотезы о длительной персистенции патологического воспаления после выздоровления от острой фазы COVID-19 – например, вследствие необычно длительной персистенции частиц самого вируса as is, или, как минимум, неких его уже не способных к размножению и заражению клеток «обломков» (кусочков вирусных белков и РНК) в тканях, или же вследствие вызванной вирусом длительной дисфункции или дерегуляции иммунной системы (ее персистирующей воспалительной гиперактивации), или же вследствие того, что изначальное инфицирование вирусом SARS-CoV-2 запустило некий самоподдерживающийся в дальнейшем аутоиммунный воспалительный процесс (например, такой, как РС), став, таким образом, триггером для его запуска и манифестации [Yong SJ, 2021; Kamal M et al., 2021].
Некоторые другие специалисты считают, что причиной как минимум некоторых симптомов «постковидного синдрома» может быть длительная «постковидная» нейроэндокринная (моно- или полигландулярная) и/или нейровегетативная дисфункция. Действительно, вирус SARS-CoV-2 способен инфицировать и повреждать ткани буквально всех эндокринных желез организма человека – надпочечников, щитовидной железы, половых желез у обоих полов (яичек или яичников), поджелудочной железы, гипофиза, шишковидной железы (эпифиза), гипоталамуса, а также нервные клетки как высших центров вегетативной регуляции в ЦНС, так и периферической вегетативной нервной системы [Pal R, Banerjee M, 2020; Speer G, Somogyi P, 2021; Akbas EM, Akbas N, 2021; Selvaraj K et al., 2021].
Поэтому, безусловно, перенесенный COVID-19 может вызывать длительные «постковидные» моно- или полиэндокринные, а также нейровегетативные дисфункции, давно известные симптомы каждой из которых частично могут объяснять некоторые симптомы «постковидного синдрома» [Pal R, Banerjee M, 2020; Speer G, Somogyi P, 2021; Akbas EM, Akbas N, 2021; Selvaraj K et al., 2021].
Безусловно, играют очень важную роль в общих механизмах патогенеза «постковидного синдрома» также разнообразные психические и психологические факторы – перенесенный стресс, страх смерти, страх повторного заражения, страх перед возможными отдаленными последствиями перенесенного заболевания для здоровья, последствия длительной депривации сна на фоне кашля, боли, одышки, общего плохого самочувствия, последствия вынужденной длительной социальной изоляции, потери работы, снижения уровня доходов и т. п. [Yong SJ, 2021;
Kamal M et al., 2021].
Гипотеза о роли дисфункции глимфатико-лимфатической системы мозга и мозговых оболочек в механизмах патогенеза «постковидного синдрома»
В последнее время Питером Востином была сформулирована очень интересная, новая и свежая гипотеза о том, что в общих механизмах патогенеза «постковидного синдрома» может играть роль выраженное нарушение функционирования глимфатико-лимфатической системы мозга и мозговых оболочек при этом синдроме, и связанное с этим нарушение детоксикации мозга и ликвора от вредных продуктов жизнедеятельности нервных и глиальных клеток [Wostyn P, 2021].
П. Востин проводит попутно недвусмысленную параллель как по клинической картине, так и по этиопатогенезу, между «постковидным синдромом» и СХУ/ФМА (кстати, классический СХУ и ФМА тоже часто манифестируют после перенесенных острых вирусных инфекций, особенно – инфекций высоконейротропными вирусами, например, после перенесенного острого опоясывающего лишая, инфекционного мононуклеоза или гриппа, и тоже, как и «постковидный синдром», часто сопровождаются выраженными иммунологическими и эндокринными сдвигами – поэтому, собственно, СХУ и ФМА и отнесли формально к ведению ревматологов, а не, скажем, психиатров или неврологов) [Wostyn P, 2021; Wostyn P, De Deyn PP, 2018].
Ранее, в 2018-м году, то есть еще до пандемии COVID-19, коллектив под руководством этого же автора выдвинул гипотезу о том, что, возможно, патогенез ФМА и СХУ тоже связан с выраженным нарушением функции глимфатико-лимфатической системы мозга и мозговых оболочек, и что ФМА и СХУ, по существу, возможно, представляют собой некую «перегрузку глимфатико-лимфатической системы неудаленными токсичными продуктами жизнедеятельности ЦНС» [Wostyn P et al., 2018; Wostyn P, De Deyn PP, 2018].
Эти авторы на самом деле, основываясь на данной гипотезе, затем предложили в цитируемых статьях достаточно радикальный метод лечения тяжелых форм СХУ и ФМА – в виде оперативного шунтирования части ликвора из позвоночного столба в брюшную полость для облегчения глимфатико-лимфатического дренажа и детоксикации ЦНС и снижения повышенного внутричерепного давления (ВЧД). По их утверждениям, данная процедура действительно приносит части пациентов с тяжелыми формами СХУ и/или ФМА облегчение симптомов [Wostyn P et al., 2018; Wostyn P, De Deyn PP, 2018].
Для нас, однако, важно здесь отметить, что глимфатико-лимфатическая система мозга и мозговых оболочек в наибольшей степени активизируется во время фазы самого глубокого медленноволнового сна (4-й фазы сна), и что степень ее активации тесно коррелирует с суммарной спектральной мощностью дельта-волн на электроэнцефалограмме (ЭЭГ) сна [Jessen NA et al., 2015; Hablitz LM et al., 2019].
Также важно отметить здесь, что и «постковидный синдром», и «классический» СХУ, и ФМА практически всегда закономерно сопровождаются выраженными нарушениями фазовой структуры и архитектоники сна, с уменьшением количества и продолжительности или даже почти полным лишением самых глубоких фаз сна (3-й и 4-й) и уменьшением суммарной спектральной мощности дельта-волн на ЭЭГ сна, а также нарушениями циркадных ритмов [Morillas-Arques P, 2010; Yong SJ, 2021].
Возможно, как раз именно эти нарушения и являются причиной отмеченных П. Востином нарушений в работе лимфатико-глимфатической системы как при СХУ и ФМА, так и при «постковидном синдроме» [Wostyn P et al., 2018; Wostyn P, De Deyn PP, 2018].
Ниже мы обсудим еще одну интересную гипотезу патогенеза «постковидного синдрома» – а именно гипотезу о возможном непосредственном повреждающем воздействии вируса SARS-CoV-2 на один из ключевых компонентов глимфатико-лимфатической системы – на аквапорин-4, или о запуске вирусом аутоиммунной реакции на этот поврежденный белок. А затем мы поговорим о том, какое к этому всему может иметь отношение тразодон, и как он здесь может помочь.
Возможная роль аквапоринов 1-го и 4-го типов в патогенезе и в лечении нейропсихиатрических последствий «постковидного синдрома»Аквапорины 1-го и 4-го типов могут служить потенциальными клеточными мишенями для атаки вируса SARS-CoV-2
Как известно, наиболее часто используемыми «входными воротами» для инфицирования вирусом SARS-CoV-2 клеток организма человека и животных является мембранный белок ангиотензин-превращающего фермента типа 2 (ACE2). Он широко представлен на поверхности мембран клеток самых разных органов и тканей, в том числе клеток тканей легких, сердца, сосудов, почек, печени, разных отделов ЖКТ и, разумеется, в глиальных и нервных клетках ЦНС [Natoli S et al., 2020; Pruimboom L, 2021].
Однако взаимодействием с мембранным белком ACE2 возможности для проникновения вируса SARS-CoV-2 внутрь клеток нашего организма и для последующего развития заболевания COVID-19 отнюдь не ограничиваются [Millet JK et al., 2021].
Показано, что альтернативными, хотя и «менее удобными», входными воротами инфицирования, вместо белка ACE2, для этого вируса могут послужить, например, такие рецепторные белки, как обильно представленный на поверхности клеток обонятельного эпителия и нейронов обонятельной луковицы белок нейропилин-1 (NRP-1), или антиген CD147, присутствующий на поверхности иммунокомпетентных и многих других клеток нашего организма, или дипептидил-пептидаза типа 4 (DPP-4), а также аланил-аминопептидаза (ANPEP), глутамил-аминопептидаза (ENPEP), ангиотензиновый рецептор типа 2 (AGTR2), или, например, сигма-рецепторы нейронов и глиальных клеток, или толл-подобный рецептор типа 4 (TLR4), который тоже обильно представлен на поверхности нейронов и глиальных клеток [Yesilkaya UH et al., 2020; Masre SF et al., 2021; Moutal A et al., 2021; Conte С, 2021; Pruimboom L, 2021].
В силу столь большого разнообразия способов взаимодействия вируса SARS-CoV-2 с различными поверхностными белками клеток – совершенно не вызывает удивления тот факт, что у вируса SARS-CoV-2 недавно была обнаружена способность связываться и активно взаимодействовать еще с одним поверхностным белком клеток –
а именно с белком аквапорин-4 (AQP-4) – мембранным транспортером воды, широко представленным в глимфатико-лимфатической системе мозга и мозговых оболочек. Вирус SARS-CoV-2 может использовать этот белок в качестве еще одного возможного варианта «альтернативных входных ворот» для инфицирования клеток ЦНС [Corrêa DG et al., 2021; Valencia-Sanchez C, Flanagan EP, 2021].
 Особенно неприятно здесь то, что результатом взаимодействия частиц вируса SARS-CoV-2 с белком AQP-4 часто становится повреждение молекул этого белка. Оно, в свою очередь, способно запустить аутоиммунную воспалительную реакцию клеток астроглии против молекул поврежденного вирусом белка AQP-4, как якобы «чужеродного». Это приводит к появлению в дальнейшем в крови и в ликворе аутоантител против белка AQP-4, и к развитию в дальнейшем уже не вирусного, а аутоиммунного по своему патогенетическому механизму хронического менингоэнцефаломиелорадикулоневрита [Corrêa DG et al., 2021; Valencia-Sanchez C, Flanagan EP, 2021].
Особенно неприятно здесь то, что результатом взаимодействия частиц вируса SARS-CoV-2 с белком AQP-4 часто становится повреждение молекул этого белка. Оно, в свою очередь, способно запустить аутоиммунную воспалительную реакцию клеток астроглии против молекул поврежденного вирусом белка AQP-4, как якобы «чужеродного». Это приводит к появлению в дальнейшем в крови и в ликворе аутоантител против белка AQP-4, и к развитию в дальнейшем уже не вирусного, а аутоиммунного по своему патогенетическому механизму хронического менингоэнцефаломиелорадикулоневрита [Corrêa DG et al., 2021; Valencia-Sanchez C, Flanagan EP, 2021].
Описав некоторое количество случаев развития подобного осложнения после перенесенного заболевания COVID-19, имевшего типичные для «традиционных» аутоиммунных менингоэнцефаломиелорадикулоневритов тяжелые неврологические проявления (параличи, слепота, глухота и др.), авторы цитируемой нами статьи предположили, что и в патогенезе более легких случаев нейропсихиатрических проявлений «постковидного синдрома», таких как длительная постковидная астения, постковидная депрессия, постковидная тревожность или бессонница, – тоже может играть некую роль аутоиммунная агрессия клеток астроглии и периферических лимфоцитов против ткани мозга, которая изначально запустилась именно в ответ на повреждение вирусом белка AQP-4 [Corrêa DG et al., 2021].
Иначе говоря, эти авторы выдвинули предположение о том, что более легкие нейропсихиатрические симптомы «постковидного синдрома» – тоже могут быть проявлениями своеобразного «низкоинтенсивного аутоиммунного воспаления ЦНС» (менее интенсивного, чем это обычно подразумевается, когда говорят об аутоиммунном менингоэнцефалите), или, другими словами, проявлениями «вялотекущего аутоиммунного менингоэнцефалита» [Corrêa DG et al., 2021].
 Это объяснение природы нейропсихиатрических симптомов «легкого постковидного синдрома», как вялотекущего, низкоинтенсивного аутоиммунного менингоэнцефалита, не имеющего традиционно подразумеваемых для менингоэнцефалита грубых неврологических проявлений, и связанного с аутоиммунной агрессией астроглии именно против белка AQP-4 – только на первый взгляд может показаться чрезмерно экстравагантным [Corrêa DG et al., 2021].
Это объяснение природы нейропсихиатрических симптомов «легкого постковидного синдрома», как вялотекущего, низкоинтенсивного аутоиммунного менингоэнцефалита, не имеющего традиционно подразумеваемых для менингоэнцефалита грубых неврологических проявлений, и связанного с аутоиммунной агрессией астроглии именно против белка AQP-4 – только на первый взгляд может показаться чрезмерно экстравагантным [Corrêa DG et al., 2021].
На самом же деле эта идея частично перекликается, например, с тоже казавшейся в свое время слишком экстравагантной, но сегодня уже вполне серьезно обсуждаемой в научном сообществе, наряду с прочими гипотезами об этиопатогенезе депрессий, идеей, выдвинутой турецким исследователем Турханом Канли еще в 2014 г. и затем развитой им в 2019 г., – а именно идеей о том, что клиническая депрессия может представлять собой некое своеобразное низкоинтенсивное герпетическое, цитомегаловирусное или эндоретровирусное воспаление ЦНС («вялотекущий герпетический, цитомегаловирусный или эндоретровирусный менингоэнцефалит») [Canli T, 2014; 2019].
Основанием для этого Т. Канли выдвинул мысль о том, что часто наблюдаемая при больших депрессивных эпизодах (БДЭ) реактивация вирусов герпес-группы (вируса простого герпеса, носителями которого являются до 90-95% популяции, вируса Эпштейна-Барр или цитомегаловируса), а также реактивация так называемых «эндогенных ретровирусов» или ретротранспозонов, тоже часто наблюдаемая при БДЭ, – может представлять собой не сопутствующее вторичное явление, не следствие ослабления иммунитета на фоне депрессии, а, наоборот, важный патогенетический фактор в развитии самой же депрессии [Canli T, 2014; 2019].
В качестве возможного альтернативного объяснения для длительной персистенции нейропсихиатрических симптомов «постковидного синдрома» авторы цитируемой нами статьи предлагают идею о том, что повреждение вирусом SARS-CoV-2 белка AQP-4, даже если оно и не приведет к развитию хронического вялотекущего аутоиммунного воспаления ЦНС в конкретном случае (у конкретного пациента) – оно, тем не менее, может привести к длительной «постковидной» дисфункции этого белка [Corrêa DG et al., 2021].
А длительная «постковидная» дисфункция белка AQP-4, в свою очередь, может привести к длительным «постковидным» нарушениям детоксикационной функции глимфатико-лимфатической системы мозга и мозговых оболочек, к «постковидным» нарушениям водного обмена и осморегуляции в ЦНС. По мысли авторов цитируемой нами статьи, именно это может играть роль одного из важных факторов в развитии таких часто наблюдаемых симптомов «легкого постковидного синдрома», как постковидная астения, постковидная депрессия, постковидные когнитивные нарушения, постковидная бессонница, постковидная тревожность [Corrêa DG et al., 2021].
Стоит отметить также, что уже достаточно давно было известно, что в патогенезе РС, особенно в патогенезе одного из вариантов его течения – так называемого аутоиммунного оптиконевромиелита, – важную роль играет наличие аутоантител в крови и в ликворе именно к белку аквапорин-4. В соответствии с этим, в литературе описано некоторое количество случаев как первичной манифестации аутоиммунного оптиконевромиелита (или, реже, других форм РС) после перенесенного COVID-19, так и ухудшение течения уже изначально имевшегося на момент заболевания COVID-19 аутоиммунного оптиконевромиелита (или, реже, другой формы РС) после выздоровления от коронавирусной болезни [Batum M et al., 2020; Ghosh R et al., 2020; Tomczak A, Han MH, 2020; Shaw VC et al., 2020; Louapre С et al., 2021].
Все эти факты, вместе взятые, тоже говорят об определенной тропности вируса SARS-CoV-2 к белку аквапорин-4, о склонности этого вируса повреждать данный белок, нарушать его функцию, а затем запускать аутоиммунную агрессию клеток астроглии против поврежденных молекул именно этого белка [Batum M et al., 2020; Ghosh R et al., 2020; Tomczak A, Han MH, 2020; Shaw VC et al., 2020; Louapre С et al., 2021].
В контексте изучения острых и хронических последствий заболевания COVID-19 для различных органов и систем организма внимание исследователей привлекают нарушения функции не только аквапорина-4, но и других представителей семейства аквапоринов [Allnoch L et al., 2021].
Так, в частности, было показано, что воспаление мелких сосудов и капилляров ЦНС (церебральная микроангиопатия и капилляропатия), развивающееся при поражении ЦНС вирусом SARS-CoV-2 у экспериментальных животных (сирийских хомячков), приводит сначала к выраженной дисфункции (из-за блокады вирусными белками) белка аквапорин-1 (AOP-1) в эндотелии сосудов, а затем к снижению или даже полной временной утрате его экспрессии на поверхности клеток эндотелия сосудов, к повышенной утечке жидкости из внутрисосудистого русла в ткань мозга и к развитию отека мозга. Авторы данной статьи не без оснований предположили, что в развитии отека мозга на фоне заболевания COVID-19 у человека может играть роль тот же патогенетический механизм (дисфункция аквапорина-1), что и у сирийских хомячков
[Allnoch L et al., 2021].
Аквапорины 1 и 4-го типов могут быть перспективными терапевтическими мишенями для лечения как легочных, так и нейропсихиатрических последствий «постковидного синдрома»
Авторы другой интересной статьи выдвинули гипотезу о том, что выраженная дисфункция нескольких важных белков семейства аквапоринов, очень широко представленных в тканях верхних дыхательных путей и легких, – а именно белков AQP1, AQP3, AQP4 и AQP5 (аквапоринов 1, 3, 4 и 5-го типов; напомним, что аквапорины
1 и 4-го типов широко представлены также в глимфатико-лимфатической системе ЦНС) на фоне инфицирования дыхательных путей вирусом SARS-CoV-2 – может играть важную патогенетическую роль в развитии ассоциированной с COVID-19 бронхопневмонии, в формировании бронхиального и альвеолярного выпота и, в пределе, отека легких (то есть в накоплении в бронхах и в легочных альвеолах избыточной жидкости), а также в развитии легочной капилляропатии и микроангиопатии, оксидативного и нитрозативного стресса, повреждающего ткани верхних дыхательных путей и ткань легких, и даже в развитии системного цитокинового шторма на фоне COVID-19 [Joseph-Antony LM et al., 2021].
Авторы этой статьи также предположили, что в будущем те лекарства, которые смогут тем или иным образом активизировать функцию белков семейства аквапоринов в легочной ткани и в ткани бронхиального дерева, и/или смогут достаточно эффективно устранять вызванную вирусом SARS-CoV-2 дисфункцию этих белков в легких и в бронхах, – могут оказаться весьма перспективными средствами для лечения бронхо-легочных проявлений при COVID-19 и бронхо-легочных осложнений после перенесенного COVID-19 [Joseph-Antony LM et al., 2021].
Рассуждая по аналогии с авторами процитированной нами выше статьи, но не в контексте бронхо-легочных последствий COVID-19, а в контексте последствий этой болезни для ЦНС – мы точно так же можем предположить, что те лекарственные средства, которые могут активизировать функции аквапоринов 1 и 4-го типов в ЦНС и/или могут устранять их дисфункцию, вызванную инфицированием ЦНС вирусом SARS-CoV-2 – в том числе и косвенным образом, например, через увеличение количества и продолжительности фаз глубокого сна и параллельное увеличение суммарной мощности дельта-ритмов на ЭЭГ сна (с этими параметрами, как мы знаем, достоверно коррелирует повышение экспрессии белка AQP-4 на поверхности мембран астроцитов, а белка AOP-1 – в эндотелии мелких сосудов ЦНС, а также активация этих белков, открытие в них пор для молекул воды), – могут оказаться весьма эффективными средствами для лечения нейропсихиатрических последствий COVID-19 («постковидного синдрома»).
Обновленные данные о фармакологическом профиле тразодона, в контексте его потенциальных преимуществ при лечении нейропсихиатрических проявлений «постковидного синдрома»
В начале этого раздела мы хотели бы напомнить читателю, что атипичный антидепрессант (ААД) тразодон уже однажды, в 2018-м году, становился героем нашего подробного обзора [Беккер РА, Быков ЮВ, 2018].
Однако с тех пор как в мировой, так и в российской научной литературе появилось немало новых данных о тразодоне, которые не могли войти в тот наш обзор, поскольку они были опубликованы позднее даты его выхода в свет. В частности, в 2021-м году в 3-м номере журнала «Психиатрия и психофармакотерапия им. П.Б. Ганнушкина» был опубликован весьма подробный обзор проф. Н.Н. Петровой, канд. мед. наук Ф.Ш. Шагиахметова и Р.Р. Борукаева, посвященный различным граням клинической эффективности тразодона, прежде всего при его использовании по «неклассическим» показаниям, официально не предусмотренным инструкцией по его применению – например, в качестве корректора экстрапирамидного синдрома (ЭПС) и акатизии на фоне лечения антипсихотиками (АП), или в качестве корректора сексуальных дисфункций при лечении антидепрессантами (АД) из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) или из группы селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН), а также в качестве средства уменьшения негативной и когнитивной симптоматики шизофрении или средства, потенциально способного затормозить прогрессирование некоторых форм деменции, таких как БА и сосудистая деменция на фоне ДЭП [Петрова Н.Н. и соавт., 2021].
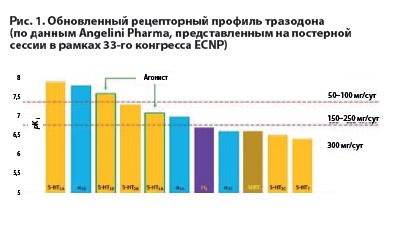
А немногим ранее, в 2020 г., компания Angelini Pharma (первооткрыватель и производитель тразодона) представила на постерной сессии 33-го конгресса Европейского колледжа нейропсихиатрии (ECNP), проходившего в онлайн-формате в период с 12 по 15 сентября 2020 г., доклад, в котором, наряду с интересной информацией о клиническом применении тразодона в различных контекстах, приводились также обновленные и уточненные данные о рецепторном профиле тразодона [Odagaki Y et al., 2005; ECNP Poster Session, 2020].
 Соответствующее изображение со слайда, которое наглядно, в графическом виде, иллюстрирует эти обновленные и уточненные данные о рецепторном профиле тразодона, воспроизведено нами выше на рис. 1 [ECNP Poster Session, 2020].
Соответствующее изображение со слайда, которое наглядно, в графическом виде, иллюстрирует эти обновленные и уточненные данные о рецепторном профиле тразодона, воспроизведено нами выше на рис. 1 [ECNP Poster Session, 2020].
Поскольку же данная наша статья посвящена рассмотрению потенциальных преимуществ выбора тразодона именно для лечения нейропсихиатрических проявлений «постковидного синдрома», то мы хотим, в рамках данной статьи, сосредоточиться на рассмотрении только и исключительно тех фармакологических свойств тразодона, которые могут оказаться полезными именно в данном контексте. Итак, первой особенностью фармакологического профиля тразодона, на которой мы бы хотели заострить внимание читателя, и которая, на наш взгляд, может оказаться релевантной и весьма полезной в лечении нейропсихиатрических симптомов «постковидного синдрома», – является весьма выраженное специфическое нормализующее действие тразодона на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности фаз глубокого медленноволнового сна (3-й и особенно 4-й – самой глубокой, так называемой «фазы дельта-сна»), с увеличением суммарной спектральной мощности дельта-ритма на ЭЭГ сна, с облегчением не только засыпания, но и поддержания непрерывности сна, устранением ночных и чрезмерно ранних утренних пробуждений, с устранением дневной сонливости, вялости и разбитости за счет повышения эффективности ночного сна [Wichniak A et al., 2017].
Специфическое нормализующее влияние тразодона на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности фаз глубокого медленноволнового сна (3-й и особенно 4-й) и представленности дельта-ритмов на ЭЭГ сна, связано с высокоаффинным антагонизмом (точнее, инверсным агонизмом) тразодона к 5-HT2A-подтипу серотониновых рецепторов и одновременным высокоаффинным антагонизмом к α1B подтипу адренергических рецепторов. При этом сильный антагонизм тразодона к гистаминовым H1-рецепторам облегчает засыпание и поддержание непрерывности ночного сна [Wichniak A et al., 2017].
Сильный парциальный агонизм тразодона к 5-HT1A и 5-HT1D-подтипам серотониновых рецепторов при этом способствует устранению характерной для депрессивных расстройств избыточной представленности REM-фаз в течение ночного сна, задержке латентного периода наступления первой REM-фазы, но без свойственного многим другим АД чрезмерного подавляющего влияния на REM-сон. При дозах тразодона 300 мг/сут и выше начинает также играть роль антагонизм тразодона к 5-HT2C-подтипу серотониновых рецепторов (способствует увеличению количества и продолжительности глубоких фаз сна и активации дельта-ритмов на ЭЭГ сна) и к 5-HT7-подтипу их (способствует нормализации циркадных ритмов и фазовой структуры сна) [Wichniak A et al., 2017].
С учетом уже обсуждавшихся нами выше гипотез о роли нарушений в работе глимфатико-лимфатической системы мозга и мозговых оболочек и нарушений работы аквапоринов 1 и 4-го типов в общем механизме патогенеза «постковидного синдрома» и СХУ, и о том, что лекарства, тем или иным образом активизирующие работу глимфатико-лимфатической системы, процессы детоксикации мозга и ликвора и работу аквапоринов – например, за счет увеличения количества и продолжительности фаз глубокого медленноволнового сна и повышения представленности дельта-ритмов на ЭЭГ сна – могут оказаться эффективными терапевтическими агентами для лечения этих состояний [Wostyn P, 2021], – тразодон, на наш взгляд, заслуживает особенного внимания в контексте его перспективности для лечения «постковидного синдрома».
Это свойство тразодона в данном контексте тем более важно, что нарушения засыпания и поддержания сна, нарушения фазовой структуры сна с лишением или сокращением количества и продолжительности фаз глубокого сна, а также нарушения циркадных ритмов, действительно, очень часты в клинической картине нейропсихиатрических проявлений «постковидного синдрома», наряду с тревогой и депрессией [Yong SJ, 2021; Kamal M et al., 2021; Deng J et al., 2021].
 Ранее уже было показано, что нарушения засыпания и поддержания сна, нарушения его фазовой структуры, а также нарушения циркадных ритмов или, например, вынужденная депривация сна, стрессы, нарушающие сон, – усугубляют течение острой фазы заболевания COVID-19, повышают риск тяжелого течения этой болезни и развития серьезных ее осложнений, риск летального исхода, а также риск развития длительного и тяжелого «постковидного синдрома». В частности, было показано, что этим рискам больше подвержены работники ночных смен и посменные работники (со скользящим графиком), в том числе работники сферы здравоохранения [da Silva FR et al., 2020; Rowlands AV et al., 2021; de Almondes KM et al., 2021].
Ранее уже было показано, что нарушения засыпания и поддержания сна, нарушения его фазовой структуры, а также нарушения циркадных ритмов или, например, вынужденная депривация сна, стрессы, нарушающие сон, – усугубляют течение острой фазы заболевания COVID-19, повышают риск тяжелого течения этой болезни и развития серьезных ее осложнений, риск летального исхода, а также риск развития длительного и тяжелого «постковидного синдрома». В частности, было показано, что этим рискам больше подвержены работники ночных смен и посменные работники (со скользящим графиком), в том числе работники сферы здравоохранения [da Silva FR et al., 2020; Rowlands AV et al., 2021; de Almondes KM et al., 2021].
И наоборот, было показано, что нормализация сна и его фазовой структуры, нормализация циркадных ритмов с помощью различных методов, таких как налаживание гигиены сна, режима сна и отдыха, когнитивно-поведенческая терапия инсомнии (CBT-i), музыкотерапия и другие, в том числе применение лекарственных препаратов, налаживающих сон, – способны оказать выраженное положительное влияние как на течение и исход острой фазы заболевания COVID-19, так и на течение «постковидного синдрома», и на длительность реабилитации после выздоровления от острой фазы болезни [da Silva FR et al., 2020; Rowlands AV et al., 2021; de Almondes KM et al., 2021].
Важно также отметить, что тразодон уже ранее показал свою эффективность при лечении клинически и этиопатогенетически весьма сходного с «постковидным синдромом» состояния – ФМА [Morillas-Arques P et al., 2010].
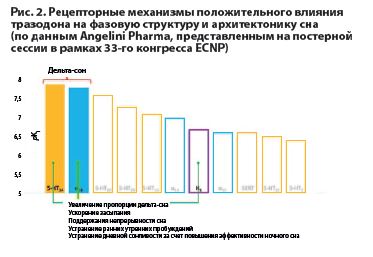
Рецепторные механизмы специфического положительного влияния тразодона на фазовую структуру и архитектонику сна изображены на рис. 2. Второй аспект клинической фармакологии тразодона, который представляется нам весьма важным подчеркнуть при обсуждении потенциальных преимуществ применения именно этого препарата для лечения нейропсихиатрических последствий «постковидного синдрома», – это выраженная способность тразодона, наряду с его основным действием – антидепрессивным и анксиолитическим, – также улучшать когнитивное функционирование и память у пациентов с самыми разными психическими и неврологическими заболеваниями. Этот эффект тразодона наблюдается не только у пациентов с депрессивными и тревожными расстройствами, но и у пациентов с различными формами деменций (БА, ДЭП и др.), и у пациентов с шизофренией [Петрова НН с соавт, 2021].
Этот аспект фармакологического действия тразодона представляется нам очень важным в контексте обсуждения его применимости для лечения «постковидного синдрома» по той причине, что пациенты с «постковидным синдромом» очень часто предъявляют жалобы на выраженное ухудшение когнитивных функций, концентрации внимания и памяти, не пропорциональное степени тяжести симптомов депрессии и тревоги у них [Yong SJ, 2021; Kamal M et al., 2021].
Способность тразодона улучшать когнитивные функции у пациентов с различными психическими и неврологическими расстройствами зиждется отчасти на уже обсуждавшемся нами выше свойстве этого препарата специфически улучшать фазовую структуру и архитектонику ночного сна, увеличивать количество и продолжительность глубоких фаз сна (3-й и особенно 4-й) и представленность дельта-ритмов на ЭЭГ сна, активизировать работу глимфатико-лимфатической системы мозга и мозговых оболочек, белков-аквапоринов 1 и 4-го типов, повышать эффективность детоксикации мозга и ликвора [Н.Н. Петрова и соавт., 2021].
Между тем хорошо известно, сколь важную роль играют нормальное количество именно глубокого, медленноволнового, восстановительного дельта-сна, а также нормальная работа глимфатико-лимфатической системы и аквапоринов 1 и 4-го типов – в поддержании и сохранении нормального когнитивного функционирования и в работе процессов консолидации памяти [Н.Н. Петрова и соавт., 2021].
Другая же часть прокогнитивного действия тразодона связана не с его выраженным специфическим положительным влиянием на фазовую структуру сна и на активность глимфатико-лимфатической системы, а непосредственно с его рецепторными свойствами, а именно – с его сильным парциальным агонизмом к 5-HT1A-подтипу серотониновых рецепторов и с его сильным антагонизмом к их 5-HT2A-подтипу, а также (при дозах 300 мг/сут и выше) – с его антагонизмом к 5-HT2C- и 5-HT7-подтипам серотониновых рецепторов, и к пресинаптическим «тормозным» α2C-адренергическим рецепторам. Показано, что соответствующее воздействие на каждый из этих подтипов рецепторов способно оказать положительное воздействие на когнитивную функцию [Ogren SO et al., 2008; Meltzer HY, Sumiyoshi T, 2008; Landolt HP, Wehrle R, 2009; Jensen NH et al., 2010; Del’Guidice T et al., 2014; Berridge CW, Spencer RC, 2016].
В сумме все эти рецепторные эффекты тразодона, плюс отсутствие у него, в отличие от многих других АД, неблагоприятного для когнитивной функции М-холиноблокирующего действия, – приводят к увеличению под его влиянием выделения норадреналина, дофамина и ацетилхолина в префронтальной коре (ПФК), и к улучшению когнитивного функционирования при его воздействии [Stahl SM, 2013; Беккер РА, Быков ЮВ, 2018].
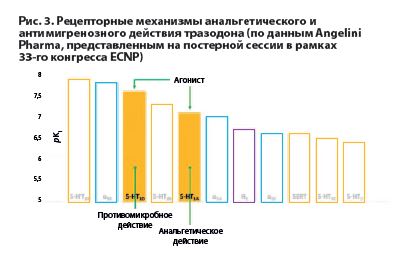
Третий же аспект фармакологического действия тразодона, на котором мы бы хотели акцентировать внимание в контексте обсуждения перспективности выбора именно этого препарата для лечения нейропсихиатрических последствий «постковидного синдрома», – это наличие у тразодона выраженных антимигренозных и анальгетических свойств, а также его эффективность при СРК [ECNP Poster Session, 2020; Петрова НН с соавт, 2021].
Наличие у тразодона таких свойств весьма важно в том плане, что очень многие пациенты с «постковидным синдромом», вне зависимости от степени тяжести их депрессии и тревоги, также предъявляют жалобы на ту или иную сопутствующую алгическую симптоматику – например, на хронические головные боли напряжения (ХГБН), на частые приступы мигрени, на «летучие» боли в мышцах и суставах (миалгии и артралгии), подобные тем, которые наблюдаются у пациентов с СХУ или ФМА, а также на проявления СРК с болями и/или диареей [Yong SJ, 2021; Kamal M et al., 2021].
 Эффективность тразодона как анальгетика связывают прежде всего с его сильным парциальным агонизмом по отношению к 5-HT1A-подтипу серотониновых рецепторов, а его эффективность в предотвращении или снижении частоты и тяжести приступов мигрени – прежде всего с его сильным парциальным агонизмом по отношению к 5-HT1D-подтипу их. При дозах тразодона 300 мг/сут и выше начинает играть роль также его антагонизм по отношению к 5-HT7-подтипу серотониновых рецепторов, тоже играющих важную роль в модуляции болевой чувствительности. Эффективность же тразодона при лечении СРК связывают с модуляцией им активности серотонинергических рецепторов подтипов 5-HT1A и 5-HT2A/C в ЖКТ [Bixquert-Jiménez M, Bixquert-Pla L, 2005; ECNP Poster Session, 2020; Петрова НН и соавт., 2021].
Эффективность тразодона как анальгетика связывают прежде всего с его сильным парциальным агонизмом по отношению к 5-HT1A-подтипу серотониновых рецепторов, а его эффективность в предотвращении или снижении частоты и тяжести приступов мигрени – прежде всего с его сильным парциальным агонизмом по отношению к 5-HT1D-подтипу их. При дозах тразодона 300 мг/сут и выше начинает играть роль также его антагонизм по отношению к 5-HT7-подтипу серотониновых рецепторов, тоже играющих важную роль в модуляции болевой чувствительности. Эффективность же тразодона при лечении СРК связывают с модуляцией им активности серотонинергических рецепторов подтипов 5-HT1A и 5-HT2A/C в ЖКТ [Bixquert-Jiménez M, Bixquert-Pla L, 2005; ECNP Poster Session, 2020; Петрова НН и соавт., 2021].
Основные рецепторные механизмы анальгетического и антимигренозного действия тразодона схематически представлены ниже на рис. 3. Определенную роль в общем механизме анальгетического действия тразодона, вероятно, играет также его способность, подобно СИОЗСиН (например, венлафаксину) и трициклическим антидепрессантам (ТЦА), таким как амитриптилин, косвенно активизировать работу эндогенной опиоидной системы. Анальгетическое действие тразодона частично снимается налоксоном. В то же время активация эндогенной опиоидной системы и развитие анальгезии не наблюдаются при применении СИОЗС [Schreiber S et al., 2000; Schreiber S, Pick GG, 2020].
В контексте обсуждения перспективности того или иного АД для лечения нейропсихиатрических проявлений «постковидного синдрома» в последнее время много говорится о желательности наличия у обсуждаемых препаратов агонистической активности по отношению к сигма-1 (s1) и/или сигма-2 (s2) рецепторам нервных клеток
[П.В. Морозов с соавт., 2021].
Здесь интересно отметить, что, несмотря на то, что у тразодона, согласно имеющимся данным, аффинность к s1- и s2-рецепторам довольно низкая (pKi=5,9 и 6,0 соответственно), то есть находится примерно в том же диапазоне, что и его аффинность к 5-HT7-подтипу серотониновых рецепторов, – но его сигма-рецепторная активность, по-видимому, все же может являться клинически значимой, по крайней мере при его высоких дозах (300 мг/сут и выше) [Garrone B et al., 2000].
Показано, что агонизм тразодона к s1- и s2-рецепторам нейронов, по крайней мере in vitro, принимает участие в реализации таких эффектов тразодона при его клинически релевантных концентрациях, как ингибирование чрезмерного высвобождения глутамата и предотвращение развития глутамат-опосредованной эксайтотоксичности. Эти эффекты тразодона частично снимаются такими экспериментальными s1- и s2-антагонистами, как 3-PPP или BD-1047 [Garrone B et al., 2000].
Логично предположить, что этот, пусть и не очень высокоаффинный, s1-рецепторный агонизм тразодона может иметь определенное значение также и в контексте обсуждения перспектив его применения для лечения нейропсихиатрических проявлений «постковидного синдрома». Действительно, с s1-рецепторным агонизмом различных препаратов отчасти связывают их противовоспалительный и иммуномодулирующий эффекты, угнетение под их влиянием секреции воспалительных цитокинов, в частности, такого важного из них, как интерлейкин-6 (IL-6), снижение под их влиянием уровней оксидативного и нитрозативного стресса в клетке, уменьшение под их влиянием митохондриальной дисфункции и дисфункции эндоплазматического ретикулума, повышение устойчивости клеток к неблагоприятным воздействиям, предотвращение их апоптоза, а также лизосомотропные эффекты (торможение избыточной аутофагии и повышение ее эффективности и др.), угнетение репликации вируса SARS-CoV-2 [Jain A et al., 2021].
Еще в 2015 г., задолго до нынешней пандемии COVID-19, было показано, что тразодон, действительно, обладает мощными противовоспалительными и иммуномодулирующими свойствами, угнетает секрецию таких провоспалительных цитокинов, как интерферон-гамма (ИФН-γ), фактор некроза опухолей-альфа (ФНО-α), ИЛ-6, снижает активность провоспалительного и проапоптотического каскада NF-kappaB/p38/c-Jun N-terminal kinase (JNK), повышает секрецию мозгового нейротрофического фактора (BDNF), стимулирует нейрогенез и оказывает нейропротективное действие. Общий механизм противовоспалительного и нейропротективного действия тразодона воспроизведен ниже на рисунке № 5 [Daniele S et al., 2015 (a); (b)].
С учетом гипотезы о том, что хроническое нейровоспаление, повышенная воспалительная активность нейроглии, гиперсекреция ею воспалительных цитокинов, а также прямое повреждающее (нейротоксическое, нейропатогенное или запускающее те или иные нейродегенеративные процессы в ЦНС) воздействие инвазии вируса SARS-CoV-2 в мозг – могут играть важную роль в общем механизме патогенеза нейропсихиатрических симптомов «постковидного синдрома» [Yong SJ, 2021], – вполне очевидно, сколь полезными могут оказаться в данном контексте упоминавшиеся нами выше противовоспалительные, иммуномодулирующие и нейропротективные свойства тразодона [Daniele S et al., 2015 (a); (b)].
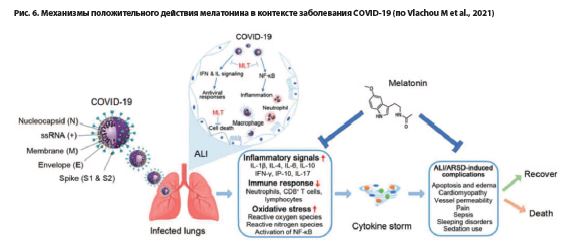
Также сравнительно недавно было показано, что низкий уровень эндогенного мелатонина в крови, например у пациентов пожилого и старческого возраста, у пациентов с некоторыми серьезными психическими и соматическими расстройствами, в частности с расстройствами аутистического спектра (РАС), с сахарным диабетом (СД), с ожирением и/или метаболическим синдромом (МС), – коррелирует с повышенным риском тяжелого течения заболевания COVID-19 и развития серьезных осложнений и даже летального исхода, а также с длительным «постковидным синдромом» и с замедленным восстановлением после перенесенного заболевания [Simko F, Reiter RJ, 2020; Barone MU et al., 2021 (a); (b)].
С другой же стороны, было показано, что адъювантное назначение экзогенного мелатонина, как вещества, обладающего мощным противовоспалительным, антиоксидантным, антицитокиновым, анти-свободнорадикальным, иммуномодулирующим и прямым противовирусным действием, – может облегчать течение COVID-19 и «постковидного синдрома», и что оно снижает риск тяжелых осложнений и летальных исходов при этой болезни и ускоряет восстановление в фазе выздоровления от нее, как и при ряде других тяжелых вирусных инфекций [Anderson G, Reiter RJ, 2020; Vlachou M et al., 2021].
Кроме того, сегодня также известно и о том, что мелатонин обладает мощным цитопротективным и, в частности, нейропротективным действием. Мелатонин также непосредственно (через взаимодействие с MT1- и MT2-рецепторами астроцитов и клеток эндотелия мозговых сосудов) активизирует работу глимфатико-лимфатической системы мозга и мозговых оболочек, и повышает эффективность детоксикации мозговой ткани и ликвора, и делает это независимо от своего влияния на сон и циркадные ритмы [Cardinali DP, 2019; 2021; Li Y et al., 2020].
Между тем, с учетом уже обсуждавшейся нами ранее гипотезы о роли нарушений в работе глимфатико-лимфатической системы мозга и мозговых оболочек в механизмах патогенеза «постковидного синдрома» и СХУ, способность мелатонина непосредственно активизировать работу этой системы – может иметь важное терапевтическое значение при лечении этих состояний [Wostyn P, 2021].
В этом контексте важно отметить, что целый ряд различных лекарств, как среди психотропных препаратов и, что самое неприятное, в том числе среди лекарств, применяемых именно для лечения депрессий, тревожных расстройств и нарушений сна (а это, например, флуоксетин, барбитураты, многие бензодиазепиновые транквилизаторы (БДТ), почти все Z-лекарства, кроме короткодействующего залеплона, многие из АП), так и среди не-психотропных лекарств (это, например, β-блокаторы, такие как пропранолол и атенолол, блокаторы медленных кальциевых каналов (БМКК), такие как верапамил, дилтиазем, амлодипин, или нестероидные противовоспалительные препараты (НПВС), такие как ибупрофен), а также злоупотребление алкоголем, никотином, кофеином – могут существенно снижать ночную секрецию мелатонина [Meyer AC et al., 1986; Childs PA et al., 1995; Murphy PJ et al., 1996; Stoschitzky K et al., 1999].
В контексте заболевания COVID-19 и «постковидного синдрома» свойство всех вышеупомянутых лекарств в различной степени подавлять секрецию эндогенного мелатонина, безусловно, является нежелательным и вредным.
В то же время тразодон, в отличие от всех вышеупомянутых лекарств, – достоверно повышает содержание мелатонина в крови. Предполагается, что в основе этого про-мелатонинергического эффекта тразодона может лежать стимуляция секреции мелатонина, которая происходит за счет стимуляции 5-HT2C-подтипа серотониновых рецепторов шишковидной железы на фоне высвобождения серотонина под влиянием одного из активных метаболитов тразодона – мета-хлорфенилпиперазина (mCPP), и одновременное торможение окислительного катаболизма мелатонина в печени, за счет конкуренции за один и тот же цитохром системы P450 печени (CYP450 1A2) между мелатонином и тразодоном [Morera AL et al., 2009].
С учетом всего сказанного нами выше о положительном влиянии мелатонина на течение заболевания COVID-19, на риск развития его тяжелых осложнений и длительного «постковидного синдрома», а также на течение процессов реабилитации, восстановления от «постковидного синдрома» – свойство тразодона повышать уровень эндогенного мелатонина в крови тоже может иметь существенное значение в обсуждаемом контексте.
На сегодняшний день тразодон официально рекомендован Московским городским научным обществом терапевтов для лечения «постковидной бессонницы», «постковидной депрессии и/или тревожности» и «постковидной астении». Завершая описание тех фармакологических свойств тразодона, которые, на наш взгляд, могут иметь отношение к его эффективности и его перспективам в лечении разнообразных нейропсихиатрических последствий «постковидного синдрома», а в целом ряде случаев даже могут сделать именно его препаратом наилучшего выбора для этих целей, – перейдем к представлению двух клинических случаев из нашей собственной практики, в которых тразодон оказался эффективен и безопасен при лечении данной патологии.
Представление клинических случаев
Клинический случай №1. Постковидный синдром с тяжелой депрессией и тревогой, дисфорическими проявлениями и грубыми нарушениями фазовой структуры сна, подтвержденными объективной полисомнографией.
Мужчина А. К., 1988 года рождения (33 года на момент обращения за консультацией), женат, имеет двоих малолетних детей. По образованию экономист. Переболел COVID-19 в марте 2021 г. Несмотря на молодой возраст и отсутствие коморбидных соматических заболеваний, течение болезни быстро приняло тяжелый характер, в силу чего пациенту потребовалась госпитализация в реанимационное отделение. В течение более чем двух недель данный пациент находился на ИВЛ, получал большие дозы глюкокортикоидов.
Данный пациент ранее психическими расстройствами не страдал, жалоб по этому поводу не предъявлял, к психиатрам не обращался, активно занимался спортом (пауэрлифтингом) на любительском уровне, был успешным и достаточно высокооплачиваемым руководителем среднего звена в крупной торговой сети. Психические расстройства у ближайших родственников пациент также отрицает. После выздоровления от COVID-19 данный пациент был вынужден оставить работу и занятия спортом. В течение многих месяцев после выздоровления он предъявлял неврологам и психиатрам жалобы на выраженную физическую и психическую астенизацию (физическую слабость, быструю утомляемость при физических и умственных нагрузках, постоянное чувство усталости), подавленное настроение, ухудшение памяти и концентрации внимания, неясное «грызущее» чувство тревоги, частые приступы гнева и раздражения, которые он срывал на членах семьи (жене и детях). Получал от врачей назначения мильгаммы, сульбутиамина (без какого-либо видимого эффекта), эсциталопрама, сертралина (отказывался от их приема после нескольких дней проб каждого из них, из-за их негативного влияния на его способность к эякуляции и достижению оргазма, а также из-за усиления тревожности и нарушений сна). Одной из очень субъективно важных для этого пациента жалоб было специфическое нарушение сна, которое проявлялось неоднократными пробуждениями среди ночи, поверхностным, не приносящим отдыха и успокоения, сном, частыми кошмарными сновидениями, а также ощущением наутро «будто и не спал вовсе». О депрессивных, тревожных и дисфорических проявлениях рассказал уже после жалоб на проблемы со сном, очевидно придавая им меньшую субъективную значимость.
Показатели шкалы депрессии Бека на момент обращения за консультацией – 21 балл (тяжелая депрессия), показатели шкалы тревоги Шихана – 86 баллов (крайне выраженная тревожность). Предполагая, что причиной всех его проблем, и в частности его проблем со сном, является некое гипотетическое «органическое поражение мозга вирусом после перенесенного COVID-19», добился проведения ему ряда обследований, в частности магнито-резонансной томографии (МРТ) головного мозга, а также полисомнографии.
Пациент был настолько озабочен резко неудовлетворительным качеством своего сна после перенесенного COVID-19, что даже проводил в разговоре сравнение своего состояния с «фатальной семейной бессонницей» и с летальными последствиями принудительного лишения сна у животных, о чем прочитал в Википедии, что значительно усилило имевшиеся у него тревожность и фиксацию на субъективном качестве сна. На МРТ у данного пациента не было обнаружено никаких признаков органической патологии ЦНС. В то же время при проведении ему полисомнографического исследования было обнаружено, что у этого пациента практически полностью отсутствует 4-я фаза сна (фаза глубокого сна), что латентность REM-фазы сна у него значительно укорочена по сравнению с нормой, и что суммарная мощность дельта-ритмов (total EEG delta power) во всех фазах сна также значительно ниже нормы.
С учетом имеющихся в литературе данных о специфическом нормализующем воздействии тразодона на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности фаз глубокого сна (3-й и особенно 4-й) и совокупной мощности дельта-ритмов, с сопутствующей этому активацией лимфатико-глимфатической системы мозга и мозговых оболочек, а также с учетом гипотезы о том, что нарушения в работе лимфатико-глимфатической системы мозга и мозговых оболочек могут играть важную роль в патогенезе постковидного синдрома, – данному пациенту было предложено попробовать лечение тразодоном в антидепрессивных дозах (с постепенным доведением дозы до 300 мг/сут в 2 приема).
Дополнительным аргументом в пользу выбора нами именно тразодона для лечения этого пациента послужило выраженное антиагрессивное и анти-дисфорическое действие тразодона, реализующееся через такие свойственные ему рецепторные механизмы, как агонизм к 5-HT1D–
и 5-HT1A-подтипам серотониновых рецепторов и антагонизм к 5-HT2A-подтипу серотониновых рецепторов. С учетом наличия у данного пациента приступов раздражительности, гневливости и дисфории в отношении членов семьи, это было сочтено нами важным дополнительным фактором в выборе именно тразодона, как следующего АД, после двух неудачных проб им СИОЗС (эсциталопрама и сертралина). Кроме того, при выборе именно тразодона для лечения этого пациента мы ориентировались также на то, что он, в отличие от СИОЗС, не только не вызывает сексуальных дисфункций, на которые жаловался пациент при первых же пробах СИОЗС, а также не вызывает обострения тревоги и бессонницы в начале терапии – но, напротив, улучшает либидо и сексуальную функцию пациентов, быстро нормализует сон и оказывает выраженное анксиолитическое действие с первых же дней терапии.
Лечение А. К. было начато нами с дозы 50 мг тразодона на ночь. В дальнейшем ночная доза тразодона увеличивалась на 50 мг каждые 3 дня до достижения 150 мг на ночь. Через 3 дня после достижения этой дозы нами был добавлен утренний прием тразодона в дозе 50 мг. Затем, также с интервалами в 3 дня, утренняя доза тразодона тоже постепенно увеличивалась до достижения 150 мг (итого 300 мг/сут). Переносимость препарата у данного пациента оказалась очень хорошей.
Уже в первые дни терапии, то есть уже на дозе 50 мг тразодона на ночь, отметил значительное улучшение сна, снижение утренней и дневной тревожности. На дозе 150 мг тразодона на ночь у пациента прекратились ночные пробуждения. Спустя 3 нед пребывания на 300 мг/сут тразодона он отметил, по его словам, «возвращение сил», исчезновение мучительного чувства постоянной, хронической усталости, вялости и разбитости. На этом фоне пациент спонтанно, без какого-либо побуждения со стороны консультирующего специалиста, возобновил занятия любимым видом спорта (пауэрлифтингом). Настроение пациента к этому времени стало из выраженно депрессивного – субдепрессивным. Исчезли приступы гнева и раздражения в отношении членов семьи, нормализовались отношения с женой и старшим ребенком, значительно ухудшившиеся за время пребывания пациента в депрессии.
После восьми недель пребывания на 300 мг/сут тразодона показатели шкалы депрессии Бека и шкалы тревоги Шихана у данного пациента полностью нормализовались, а все жалобы, которые он ранее предъявлял, исчезли, или, как выразился сам пациент, «утратили актуальность». Пациент возобновил поиск работы. В настоящее время он снова работает менеджером среднего звена, но уже в другой торговой сети.
Клинический случай № 2. Постковидный синдром с легкой депрессией, протекавшей с выраженной астенией, нарушениями сна, тревожностью, синдромом ДП/ДР, «туманом в голове» и постковидным СРК. Мужчина М. С., 1998 года рождения (23 года на момент обращения за консультацией), холост. По образованию химик-технолог. Коморбидные соматические заболевания: СД 1-го типа (инсулинозависимый) с 14-летнего возраста. Психические заболевания у себя или у близких родственников данный пациент отрицает.
По собственному признанию пациента, он «с детства обладал тревожно-мнительным, слегка ипохондрическим характером». Однако эта характерологическая особенность пациента никогда ранее, до перенесенного им в апреле 2021 года COVID-19, не вызывала у него каких-либо нарушений адаптации, никаких проблем в реальной жизни, учебе или работе. Поэтому данная личностная особенность пациента никогда ранее не служила для него причиной обратиться за психиатрической или психотерапевтической помощью.
Вместе с тем, в силу именно этой личностной особенности, данный пациент очень ригидно и ответственно относится к контролю своей диеты, режима инсулинотерапии и уровня гликемии с помощью портативного глюкометра. В силу этой же личностной особенности данный пациент очень негативно относится к любым потенциально возможным побочным эффектам от психотропных препаратов на аппетит, массу тела и уровень глюкозы в крови в любую сторону. В апреле 2021 г. данный пациент амбулаторно переболел легкой формой COVID-19. После выздоровления от COVID-19 он в течение многих месяцев предъявлял психиатрам и неврологам жалобы на слегка сниженное настроение, физическую слабость, вялость, апатию, быструю утомляемость, частые головные боли, преходящие «летучие» боли в мышцах и суставах, трудности с засыпанием, повышенную тревожность, проблемы с памятью и концентрацией внимания, «туман в голове», легкое ощущение «нереальности, искусственности мира» и легкое ощущение «собственной измененности» (типичные проявления легкой формы синдрома деперсонализации-дереализации – ДП/ДР), пробуждения ранним утром (обычно в 5–6 ч утра) в горячем поту, с сильнейшей тревогой, тахикардией («сильно бьющимся сердцем», по описанию пациента), а также на иногда возникавшие после пробуждения «сонные параличи» (невозможность пошевелиться в течение нескольких минут после пробуждения).
Одновременно с этим пациент стал предъявлять гастроэнтерологам жалобы на частые и болезненные приступы диареи, возникавшие без видимой причины. Детальное гастроэнтерологическое и колопроктологическое обследование, включавшее в себя анализ кала на кальпротектин, перианальный мазок на яйца глистов, бакпосев кала, ректосигмоидоскопию, колоноскопию, ирригоскопию толстой кишки (бариевую клизму), – не смогло выявить какой-либо органической патологии ЖКТ. Вследствие этого гастроэнтерологом был поставлен диагноз СРК, и рекомендовано обращение к психиатру и/или психотерапевту. Следует отметить, что, в отличие от предыдущего описанного нами пациента, данный пациент после развития вышеописанных симптомов продолжал работать по специальности, несмотря на свое не очень хорошее общее психическое и физическое состояние (как он сам выразился – «превозмогать состояние»). Одной из причин для такого «превозмогания» пациент называл «чувство долга», а именно – ощущаемую им моральную обязанность финансово помогать родителям и младшей сестре. До обращения за консультацией к одному из соавторов настоящей статьи данный пациент получал от невролога назначения гопантената кальция, пирацетама, мексидола, сульбутиамина, фенибута (без какого-либо заметного эффекта), а от психиатра – назначение сертралина с гидроксизином (от приема которых пациент отказался спустя всего 4 дня, почувствовав на фоне начала приема сертралина тошноту и резкое снижение аппетита, и испытав на этом фоне, вскоре после очередного введения инсулина, приступ легкой гипогликемии с головокружением и слабостью), затем – назначение миртазапина 30 мг на ночь с сульпиридом 50 мг 3 раза в день (от приема которых пациент также отказался спустя всего несколько дней, обратив внимание на значительное повышение аппетита на фоне такой терапии и испугавшись, что это может ухудшить гликемический контроль, или вызвать крайне нежелательную для него прибавку веса). Показатель шкалы депрессии Бека у этого пациента на момент обращения за консультацией составлял 13 баллов (субдепрессия или легкая депрессия), показатель шкалы Шихана – 28 баллов (легкая или умеренная тревожность). Показатель шкалы дереализации Нуллера на момент обращения за консультацией – 9 баллов.
С учетом характера жалоб данного пациента, в которых значительное место, наряду с астенией, повышенной утомляемостью и слабостью, занимали повышенная тревожность, нарушения сна и сонные параличи вскоре после пробуждения, а также нарушения памяти и концентрации внимания, «летучие боли во всем теле», головные боли и проявления СРК, и с учетом данных о наличии у тразодона, наряду с анксиолитической и антидепрессивной, также выраженной анальгетической и прокогнитивной активности, данных об эффективности тразодона при СРК, ГБН и мигренях, и о специфической способности тразодона нормализовывать фазовую структуру сна и устранять разнообразные парасомнические нарушения (в том числе «сонные параличи»), – мы сочли, что в данном случае назначение именно тразодона в качестве АД будет особенно уместным выбором.
Еще одной важной мотивацией для выбора нами именно тразодона в качестве АД у этого пациента была нейтральность тразодона в отношении регуляции аппетита и массы тела, уровня гликемии. Это представлялось нам немаловажным фактором в выборе подходящего АД, с учетом очень ригидного негативного отношения данного пациента к любым побочным эффектам психотропных препаратов на аппетит, массу тела и уровень гликемии в любую сторону. Поскольку депрессия у данного пациента, в отличие от предыдущего описанного нами случая, не была тяжелой ни по оценочным шкалам, ни по общему клиническому впечатлению от видеобеседы в Skype, ни по субъективной оценке самого пациента («слегка сниженное настроение», по его собственным словам), и производила впечатление во многом вторичной по отношению к симптомам астенизации, тревожности и нарушениям сна, – то мы предположили, что данному пациенту может хватить и дозы 150 мг/сут тразодона (вся доза на ночь) – дозы не столько антидепрессивной, сколько нормализующей сон и способствующей устранению тревожности. Лечение пациента М. С., как и предыдущего пациента, было начато нами с дозы тразодона 50 мг на ночь. Затем с интервалами в 3 дня доза тразодона была доведена нами до 100 мг на ночь, а затем до 150 мг на ночь. С учетом наличия в клинической картине болезни данного пациента также синдрома ДП/ДР, и наличия в литературе данных о специфической эффективности ламотриджина именно в связке с серотонинергическими АД (но не в монотерапии!) в устранении этого синдрома – мы сочли целесообразным включить в терапию этого пациента также ламотриджин, начиная с 25 мг на ночь, с постепенным доведением дозы до 100 мг на ночь, с интервалами повышения 25 мг каждые 7 дней.
С первых же дней терапии тразодоном и ламотриджином, уже на дозах 50 мг/сут первого и 25 мг/сут второго, пациент отметил облегчение засыпания, уменьшение тревожности. После 4 нед пребывания на 150 мг/сут тразодона и 100 мг/сут ламотриджина пациент отметил исчезновение «летучих» болей в теле, головных болей, улучшение настроения и общего самочувствия, улучшение концентрации внимания, возвращение «чувства отдыха и выспанности» после ночного сна, значительное уменьшение частоты и болезненности приступов диареи, «прояснение в голове», уменьшение дереализации, а также то, что ему «стало значительно легче справляться с работой», что он «меньше совершает ошибок на работе и реже получает замечания от начальства». К сроку 8 нед пребывания на 150 мг/сут тразодона и
100 мг/сут ламотриджина данный пациент вышел в полную ремиссию, как по линии симптомов депрессии, тревожности, нарушений сна и когнитивного функционирования, синдрома ДП/ДР, так и по линии СРК и ГБН.
Заключение
Как видно из приведенных нами данных литературы, а также из рассмотрения представленных нами двух клинических случаев из нашей собственной практики – так называемый «постковидный синдром» и его крайне многообразные, как «сугубо психические», так и неврологические и психосоматические проявления (включая, например, нередко встречающийся так называемый«постковидный СРК») – ныне являются весьма актуальной проблемой как для современной психиатрии и неврологии, так и для различных областей соматической медицины – например, гастроэнтерологии, пульмонологии, урологии, кардиологии.
Соматическим врачам многих специальностей – например, уже упомянутым нами выше гастроэнтерологам, пульмонологам, кардиологам, урологам – сегодня часто приходится иметь дело с многочисленными психосоматическими проявлениями «постковидного синдрома» и дифференцировать их от соответствующих органических соматических заболеваний.
Весьма важное место в общей клинической картине «постковидного синдрома», наряду с часто наблюдаемыми при этом синдроме проявлениями депрессии, тревожности, нарушениями сна, его фазовой структуры и архитектоники, когнитивными нарушениями, – занимают симптомы так называемой «постковидной астении», а также необъяснимые «летучие» боли в теле (в мышцах, костях, суставах и др.), частые головные боли, функциональные нарушения ЖКТ (особенно часто – СРК, причем он чаще протекает у этих пациентов с диареей и/или болями в животе, чем с запорами). На этом основании многие авторы проводят параллель между сравнительно недавно описанным «постковидным синдромом» – и давно известными и хорошо описанными в литературе синдромом хронической усталости (СХУ) и фибромиалгией (ФМА). Некоторые авторы говорят даже о том, что, возможно, «постковидный синдром» – по крайней мере в плане своих типичных психоневрологических и психосоматических проявлений – является просто еще одним вариантом давно известных заболеваний СХУ и/или ФМА, для которого триггером послужило перенесенное заболевание COVID-19. Это аналогично тому, как для развития СХУ и ФМА триггерами часто являются перенесенный инфекционный мононуклеоз (инфекция вирусом Эпштейна-Барр или цитомегаловирусом), перенесенный герпес (опоясывающий лишай) или, например, перенесенный грипп, или другая острая вирусная инфекция.
Между тем в современной научной литературе имеется немало данных о роли нарушений функции белка аквапорин-4 (AQP-4), нарушений функции клеток астроглии (их воспалительной активации, испытываемого ими при этом повышенного уровня оксидативного и нитрозативного стресса, их свободнорадикального повреждения и митохондриальной дисфункции) и, в целом, нарушений в работе лимфатико-глимфатической системы мозга и мозговых оболочек – в патогенезе как известного с недавних пор «постковидного синдрома», так и давно известных заболеваний СХУ и ФМА. С учетом данных о том, что лимфатико-глимфатическая система мозга и мозговых оболочек в наибольшей степени активизируется именно во время 4-й фазы наиболее глубокого сна (так называемой фазы дельта-сна), и что нарушения фазовой структуры сна (уменьшение количества и продолжительности глубоких фаз сна и суммарной мощности дельта-ритмов на ЭЭГ сна) – приводят к вторичным нарушениям функции лимфатико-глимфатической системы мозга и мозговых оболочек, к вторичной воспалительной активации клеток астроглии, а также данных о специфической способности тразодона нормализовывать фазовую структуру сна (увеличивать количество и продолжительность 4-й фазы сна и суммарную мощность дельта-ритмов на ЭЭГ сна), активизировать работу лимфатико-глимфатической системы мозга и мозговых оболочек, оказывать противовоспалительное действие в ЦНС (уменьшать воспалительную активацию клеток астроглии), активизировать работу белка AQP-4, которая закономерно нарушается при инфекции вирусом SARS-CoV-,2 – тразодон, на наш взгляд, является одним из наиболее желательных препаратов выбора среди АД для лечения психоневрологических и психосоматических проявлений «постковидного синдрома».
На сегодняшний день тразодон официально рекомендован Московским городским научным обществом терапевтов для лечения постковидной бессонницы, а также постковидных депрессивных и тревожных нарушений. Стоит также отметить, что высокая эффективность и безопасность применения тразодона для лечения двух патологических состояний, весьма сходных с «постковидным синдромом» как по клинической симптоматике, так и по предполагаемым механизмам этиопатогенеза – а именно для лечения СХУ и ФМА, – была уже ранее доказана в ряде клинических исследований. Это позволяет, по аналогии, предполагать, что тразодон может оказаться весьма эффективным и безопасным средством также и для лечения разнообразных психоневрологических и психосоматических проявлений «постковидного синдрома».
Приведенные нами в настоящей статье два клинических примера успешного применения тразодона для лечения «постковидного синдрома» из нашей собственной практики – на наш взгляд, очень ярко иллюстрируют вышеуказанный тезис.
Сведения об авторАХ:
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве. 8410501, Израиль, Беэр-Шева;
Быков Юрий Витальевич – ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России. 355017, Россия, Ставрополь, ул. Мира, д. 310. E-mail: yubykov@gmail.com
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2021
Об эффективности и безопасности применения тразодона в лечении нейропсихиатрических последствий постковидного синдрома (Обзор литературы и представление двух клинических случаев) №06 2021
Резюме
Специфический набор симптомов, сохраняющихся в течение длительного времени после перенесенного COVID-19, получил название «постковидный синдром». Важное место среди наиболее частых симптомов «постковидного синдрома» со стороны центральной нервной системы (ЦНС) занимают астенические проявления, а также депрессивные и тревожные нарушения, нарушения сна, когнитивные нарушения, летучие миалгии, головные боли напряжения (ГБН), функциональные (психосоматические) расстройства желудочно-кишечного тракта (ЖКТ), в особенности – «синдром раздраженного кишечника» (СРК), протекающий у этих пациентов чаще с диареей и/или с болями в животе, чем с запорами.
Эти симптомы весьма сходны с теми, которые чаще всего наблюдаются у пациентов с синдромом хронической усталости (СХУ) или с фибромиалгией (ФМА). Стоит отметить, что СХУ и ФМА тоже часто впервые манифестируют после перенесенных вирусных инфекций. Особенно часто – после инфекций высоконейротропными вирусами, такими как вирусы герпес-группы или вирус гриппа. Это сближает данные патологические состояния по их этиологии и патогенезу с «постковидным синдромом».
Согласно одной из гипотез, в патогенезе как «постковидного синдрома», так и СХУ, и ФМА – важную роль могут играть наблюдаемые при всех этих заболеваниях нарушения в работе лимфатико-глимфатической системы мозга и мозговых оболочек, а также характерные для всех этих заболеваний нарушения фазовой структуры и архитектоники сна, с уменьшением количества и продолжительности самой глубокой, 4-й фазы сна (так называемой фазы дельта-сна) и одновременным уменьшением суммарной спектральной мощности дельта-ритмов на электроэнцефалограмме (ЭЭГ) во время сна. Между тем показано, что лимфатико-глимфатическая система мозга и мозговых оболочек наиболее сильно активизируется именно во время фазы дельта-сна, и что степень ее активации достаточно хорошо коррелирует с суммарной мощностью дельта-волн на ЭЭГ сна.
В то же время уже достаточно давно было показано, что тразодон обладает специфическим нормализующим воздействием на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности самой глубокой, 4-й фазы сна и увеличением суммарной спектральной мощности дельта-волн на ЭЭГ сна. Это действие тразодона, в свою очередь, закономерно приводит к активизации работы лимфатико-глимфатической системы мозга и мозговых оболочек при лечении тразодоном. Одновременно в ряде клинических исследований было также уже довольно давно показано, что тразодон эффективен и безопасен в отношении устранения многих симптомов СХУ и ФМА.
Все это, вместе взятое, дает теоретические основания для попыток эмпирического применения тразодона, по аналогии с его уже доказанной эффективностью в лечении СХУ и ФМА, также в лечении проявлений «постковидного синдрома» со стороны ЦНС и ЖКТ.
Как показано в приведенных нами двух клинических примерах из нашей собственной практики, тразодон действительно может быть эффективным и безопасным средством для лечения проявлений «постковидного синдрома» со стороны ЦНС и ЖКТ. Мы также показываем, что тразодон нередко оказывается, со многих точек зрения, наилучшим именно для этой цели выбором среди всех имеющихся сегодня на рынке антидепрессантов (АД).
Ключевые слова: тразодон, вирус SARS-CoV-2, COVID-19, постковидный синдром, синдром хронической усталости, фибромиалгия, миалгический энцефаломиелит, синдром раздраженного кишечника, депрессивные расстройства, тревожные расстройства, фазовая структура сна, дельта-сон, лимфатико-глимфатическая система, аквапорин-4, астроглия, 5-HT1A-серотониновые рецепторы, 5-HT1D-серотониновые рецепторы, 5-HT2A-серотониновые рецепторы, 5-HT7-серотониновые рецепторы, a1-адренергические рецепторы.
Для цитирования: Беккер Р.А., Быков Ю.В. Об эффективности и безопасности применения тразодона в лечении нейропсихиатрических последствий постковидного синдрома (Обзор литературы и представление двух клинических случаев). Психиатрия и психофармакотерапия. 2021; 23 (6): 28–42.
On the efficacy and safety of using trazodone in the treatment of neuropsychiatric sequelae of long-COVID syndrome (A Literature Review with Presentation of Two Clinical Cases)
R.A.Bekker1, Yu.V.Bykov2
Abstract
A specific set of symptoms, which may persist for a long time after recovering from COVID-19 disease, got labeled as a «post-COVID syndrome». An important place in the overall clinical picture of «post-COVID syndrome» affecting the patient’s central nervous system (CNS) – plays the symptom of severe asthenia, often accompanied by depressive and anxiety symptoms, troubles with sleep, various cognitive impairments, myalgic pains, headaches, functional psychosomatic disorders of the gastrointestinal tract (GIT), and in particular – so-called «irritable bowel syndrome» (IBS), which in those patients is more often of diarrheal and/or abdominal pain type, than of constipational type.
The symptoms of post-COVID syndrome are very similar to those seen in patients who suffer from chronic fatigue syndrome (CFS), and in patients suffering from fibromyalgia (FMA). It is worth noting that both CFS and FMA, too, often have their first-time manifest after various viral infections, especially after infections which were caused by strongly neurotropic viruses, such as herpes-group viruses or influenza virus. This observation also brings these pathological conditions closer to the «post-COVID syndrome» in their possible aetiology and pathogenesis.
According to one plausible hypothesis, in the pathogenesis of both «post-COVID syndrome» and CFS and FMA, an important role can be played by the abnormal or deficient functioning of the lymphatic-glymphatic system of the brain and its meninges, as well as by the characteristic disturbances in the sleep architecture, which are often observed in all these diseases, namely – a marked reduction in the number and duration of deep sleep phases, together with a marked decrease in the total spectral power of delta waves in the electroencephalogram (EEG) registered during sleep. Meanwhile, it is also well known that the lymphatic-glymphatic system of the brain and its meninges is most active during the deepest, 4th, phase of nocturnal sleep, and that the level of activity of this important brain detoxification system correlates well with total delta wave EEG spectral power during nighttime sleep.
At the same time, it has long been known that trazodone has a specific normalizing effect on the sleep architecture, with an increase in the number and duration of the deepest (4th) sleep phase, coupled with an increase in the total spectral power of delta waves on the sleep EEG. This specific action of trazodone on sleep architecture naturally leads to the activation of the lymphatic-glymphatic system of the brain and its meninges under trazodone therapy. At the same time, a number of clinical studies have long ago shown that trazodone is effective and safe in terms of eliminating many of the symptoms of CFS and FMA.
All this, taken together, provides solid theoretical basis for the attempt to empirically try using trazodone in the treatment of «post-COVID syndrome», whose symptoms and plausible pathogenetic mechanisms are so strikingly similar to the symptoms and plausible pathogenetic mechanisms of CFS and FMA.
As we did show in the presentation of two real clinical cases from our own practice, trazodone can indeed be an effective and safe remedy for the treatment of several CNS and GIT manifestations of «post-COVID syndrome». We also show that trazodone can often be the best choice for this purpose, among all antidepressants (AD) currently available on the market.
Keywords: trazodone, SARS-CoV-2 virus, COVID-19, post-COVID syndrome, chronic fatigue syndrome, fibromyalgia, myalgic encephalomyelitis, irritable bowel syndrome, depressive disorders, anxiety disorders, sleep architecture, delta wave sleep, lymphatic-glymphatic system, aquaporin-4, astroglia, 5-HT1A-serotonergic receptors, 5-HT1D-serotonergic receptors, 5-HT2A-serotonergic receptors, 5-HT7-serotonergic receptors, a1-adrenergic receptors
For citation: Bekker R.A., Bykov Yu.V. On the efficacy and safety of using trazodone in the treatment of neuropsychiatric sequelae of long-COVID syndrome (A Literature Review with Presentation of Two Clinical Cases). Psychiatry and Psychopharmacotherapy. 2021; 23 (6): 28–42.
Введение(Обоснование актуальности проблемы)
Количество заболевших и переболевших COVID-19, инфекционной болезнью, вызываемой заражением новым коронавирусом SARS-CoV-2, во всем мире исчисляется на сегодня уже цифрой более чем в 265 миллионов человек, а количество умерших от этой болезни или ее осложнений – уже превысило 5,24 миллиона человек, согласно статистике Our World in Data [OWinD, 2021].
По разным данным, от 50 до 80% переболевших COVID-19, после выздоровления от острой фазы этой болезни еще на протяжении длительного времени – многих недель, многих месяцев или даже 1–2–3 лет (более длительных наблюдений пока не существует, так как сама болезнь сравнительно новая) продолжают испытывать различные нарушения в работе тех или иных органов и систем организма: прежде всего – центральной нервной системы (ЦНС), но также и желудочно-кишечного тракта (ЖКТ), и сердечно-сосудистой системы (ССС), и легких и верхних дыхательных путей; также могут наблюдаться симптомы со стороны печени, почек и мочевыводящих путей и др. [Yong SJ, 2021; Kamal M et al., 2021].
Эта крайне разнородная и плохо очерченная совокупность симптомов получила в научной литературе собирательное название «постковидный синдром», или «пролонгированный COVID-19» [Yong SJ, 2021; Kamal M et al., 2021].
Ясно, что при таком огромном количестве страдающих «постковидным синдромом» – организация доступной, быстрой и эффективной помощи подобным пациентам сегодня является одной из актуальнейших задач для систем общественного здравоохранения во всех странах мира, затронутых пандемией COVID-19 [Yong SJ, 2021; Kamal M et al., 2021].
А поскольку в общей клинической картине «постковидного синдрома» очень большое, нередко даже главенствующее место занимают именно психические и неврологические симптомы со стороны ЦНС (что, в целом, неудивительно с учетом очень высокой нейротропности, нейроинвазивности и нейротоксичности вируса SARS-CoV-2, гораздо более высокой, чем у его ближайших родственников – вирусов SARS-CoV и MERS), то на переднем крае борьбы с «постковидным синдромом» закономерно оказываются психиатры, психотерапевты и неврологи [Yong SJ, 2021; Kamal M et al., 2021].
Рассмотрению современных возможностей лечения нейропсихиатрических проявлений «постковидного синдрома», и уместности и целесообразности применения в этом контексте тразодона – как раз и посвящена данная статья.
Клиническая симптоматика «постковидного синдрома»
Наиболее часто встречающимися симптомами у пациентов с «постковидным синдромом», по данным разных исследований, являются длительная астенизация, физическая и умственная слабость, повышенная утомляемость при сравнительно небольших физических и/или умственных нагрузках, пониженная устойчивость к психоэмоциональным стрессам, эмоциональная лабильность, а также длительно сохраняющаяся одышка (диспноэ) [Yong SJ, 2021; Kamal M et al., 2021].
Другие часто встречающиеся и длительно персистирующие после перенесенной острой фазы COVID-19 симптомы могут включать в себя когнитивные нарушения (КН), нарушения памяти и концентрации внимания, разнообразные психические нарушения (чаще всего – проявления депрессии и/или тревожности, раздражительности, дисфории, недовольства собой и/или окружающими и жизнью в целом), нарушения сна и циркадных ритмов, «летучие» боли в грудной клетке, в животе, в мышцах (миалгии) и суставах (артралгии), тахикардию, экстрасистолы, нарушения восприятия запахов и вкусов, хронический кашель, хронические головные боли напряжения (ХГБН) или мигрени, разнообразные жалобы со стороны ЖКТ или ССС, мочеполовой системы (например, проявления синдрома раздраженного кишечника – СРК, чаще с диареей и/или болями, чем с запорами, или же проявления нейрогенной дисфункции мочевого пузыря – НДМП) [Yong SJ, 2021; Kamal M et al., 2021].
Многие из симптомов, чаще всего наблюдаемых при «постковидном синдроме», при всем своеобразии и большом полиморфизме и гетерогенности клинической картины этого синдрома, достаточно сильно напоминают симптомы, часто наблюдаемые при таких давно и хорошо известных заболеваниях, как синдром хронической усталости (СХУ), он же – хронический миалгический энцефаломиелит, или фибромиалгия (ФМА), или синдром постуральной ортостатической тахикардии (СПОТ), или синдром активации тучных клеток (САТК) [Yong SJ, 2021;
Kamal M et al., 2021].
В рамках «постковидного синдрома» могут также наблюдаться различные неврологические нарушения, в диапазоне от минимальных (например, учащение приступов ХГБН или мигрени по сравнению с тем, что было до перенесенного COVID-19) до очень грубых (параличи, парезы, полирадикулоневриты, ишемические или геморрагические инсульты, сенсоневральная глухота, слепота, ухудшение течения или манифестация de novo рассеянного склероза (РС), ухудшение течения или необычно ранняя манифестация различных деменций, например болезни Паркинсона (БП), деменции с тельцами Леви (ДТЛ) или болезни Альцгеймера (БА), дисциркуляторной энцефалопатии (ДЭП), особенно у предрасположенных лиц, синдром Гийена-Барре и т. д.) [Yong SJ, 2021; Kamal M et al., 2021].
Известные факторы риска, предрасполагающие к развитию «постковидного синдрома»
Среди известных факторов риска, повышающих вероятность развития «постковидного синдрома», называют принадлежность к женскому полу, наличие одновременно более чем 5 ранних симптомов COVID-19 почти с самого начала болезни, тяжелое течение болезни (например, потребовавшее госпитализации, кислородной поддержки или интубации трахеи), раннее развитие диспноэ в ходе болезни, использование высоких доз глюкокортикоидов для лечения острой фазы болезни (этот показатель, по всей вероятности, является еще одним субститутным маркером тяжелого течения болезни), высокие уровни определенных биомаркеров в крови, таких как С-реактивный белок, D-димер, количество лимфоцитов в крови, а также наличие у пациента предсуществующих психических расстройств [Yong SJ, 2021; Kamal M et al., 2021].
Из этого списка факторов риска можно сделать вывод о том, что в патогенетических механизмах развития «постковидного синдрома», вероятно, могут играть роль как интенсивность воспаления и повреждения тканей, гиперпродукция воспалительных цитокинов, степень гипоксии в острой фазе болезни, так и нервно-психические факторы (пережитый психоэмоциональный стресс, страх за свою жизнь и здоровье и т. д.; ведь пациенты с предсуществующими психическими расстройствами более чувствительны к такому, менее устойчивы к стрессу), и гормональные влияния (преобладание женского пола) [Yong SJ, 2021; Kamal M et al., 2021].
Гипотезы о вероятных патогенетических механизмах развития «постковидного синдрома»
Как точные патогенетические механизмы, обуславливающие развитие всего описанного нами выше множества симптомов «постковидного синдрома», так и причины столь большого их разнообразия (полиморфизма), их гетерогенности (неоднородности их распределения в популяции), а также столь большой их вариабельности как по степени тяжести, так и по длительности их персистирования у разных пациентов – пока окончательно не выяснены [Yong SJ, 2021; Kamal M et al., 2021].
Тем не менее на сегодняшний день уже существует несколько гипотез о возможных механизмах, принимающих участие в общем патогенезе «постковидного синдрома». В частности, некоторые авторы считают, что по крайней мере часть симптомов «постковидного синдрома» может быть связана с долгосрочными последствиями изначального повреждения самим вирусом SARS-CoV-2 или же ответной воспалительной атакой со стороны иммунокомпетентных клеток организма хозяина таких тканей, как легкие, ЦНС, сердечная мышца, сосуды, почки или печень, или с долгосрочными последствиями перенесенной в острой фазе COVID-19 гипоксии тканей, полиорганной недостаточности с интоксикацией, или с тромбоэмболическими либо, напротив, геморрагическими осложнениями и их последствиями, или с отсроченными последствиями побочных эффектов применявшихся для лечения COVID-19 определенных лекарств и т. д. [Yong SJ, 2021; Kamal M et al., 2021].
Другие же авторы считают, что симптомы, развивающиеся в рамках «постковидного синдрома», могут быть лучше всего объяснены в рамках гипотезы о длительной персистенции патологического воспаления после выздоровления от острой фазы COVID-19 – например, вследствие необычно длительной персистенции частиц самого вируса as is, или, как минимум, неких его уже не способных к размножению и заражению клеток «обломков» (кусочков вирусных белков и РНК) в тканях, или же вследствие вызванной вирусом длительной дисфункции или дерегуляции иммунной системы (ее персистирующей воспалительной гиперактивации), или же вследствие того, что изначальное инфицирование вирусом SARS-CoV-2 запустило некий самоподдерживающийся в дальнейшем аутоиммунный воспалительный процесс (например, такой, как РС), став, таким образом, триггером для его запуска и манифестации [Yong SJ, 2021; Kamal M et al., 2021].
Некоторые другие специалисты считают, что причиной как минимум некоторых симптомов «постковидного синдрома» может быть длительная «постковидная» нейроэндокринная (моно- или полигландулярная) и/или нейровегетативная дисфункция. Действительно, вирус SARS-CoV-2 способен инфицировать и повреждать ткани буквально всех эндокринных желез организма человека – надпочечников, щитовидной железы, половых желез у обоих полов (яичек или яичников), поджелудочной железы, гипофиза, шишковидной железы (эпифиза), гипоталамуса, а также нервные клетки как высших центров вегетативной регуляции в ЦНС, так и периферической вегетативной нервной системы [Pal R, Banerjee M, 2020; Speer G, Somogyi P, 2021; Akbas EM, Akbas N, 2021; Selvaraj K et al., 2021].
Поэтому, безусловно, перенесенный COVID-19 может вызывать длительные «постковидные» моно- или полиэндокринные, а также нейровегетативные дисфункции, давно известные симптомы каждой из которых частично могут объяснять некоторые симптомы «постковидного синдрома» [Pal R, Banerjee M, 2020; Speer G, Somogyi P, 2021; Akbas EM, Akbas N, 2021; Selvaraj K et al., 2021].
Безусловно, играют очень важную роль в общих механизмах патогенеза «постковидного синдрома» также разнообразные психические и психологические факторы – перенесенный стресс, страх смерти, страх повторного заражения, страх перед возможными отдаленными последствиями перенесенного заболевания для здоровья, последствия длительной депривации сна на фоне кашля, боли, одышки, общего плохого самочувствия, последствия вынужденной длительной социальной изоляции, потери работы, снижения уровня доходов и т. п. [Yong SJ, 2021;
Kamal M et al., 2021].
Гипотеза о роли дисфункции глимфатико-лимфатической системы мозга и мозговых оболочек в механизмах патогенеза «постковидного синдрома»
В последнее время Питером Востином была сформулирована очень интересная, новая и свежая гипотеза о том, что в общих механизмах патогенеза «постковидного синдрома» может играть роль выраженное нарушение функционирования глимфатико-лимфатической системы мозга и мозговых оболочек при этом синдроме, и связанное с этим нарушение детоксикации мозга и ликвора от вредных продуктов жизнедеятельности нервных и глиальных клеток [Wostyn P, 2021].
П. Востин проводит попутно недвусмысленную параллель как по клинической картине, так и по этиопатогенезу, между «постковидным синдромом» и СХУ/ФМА (кстати, классический СХУ и ФМА тоже часто манифестируют после перенесенных острых вирусных инфекций, особенно – инфекций высоконейротропными вирусами, например, после перенесенного острого опоясывающего лишая, инфекционного мононуклеоза или гриппа, и тоже, как и «постковидный синдром», часто сопровождаются выраженными иммунологическими и эндокринными сдвигами – поэтому, собственно, СХУ и ФМА и отнесли формально к ведению ревматологов, а не, скажем, психиатров или неврологов) [Wostyn P, 2021; Wostyn P, De Deyn PP, 2018].
Ранее, в 2018-м году, то есть еще до пандемии COVID-19, коллектив под руководством этого же автора выдвинул гипотезу о том, что, возможно, патогенез ФМА и СХУ тоже связан с выраженным нарушением функции глимфатико-лимфатической системы мозга и мозговых оболочек, и что ФМА и СХУ, по существу, возможно, представляют собой некую «перегрузку глимфатико-лимфатической системы неудаленными токсичными продуктами жизнедеятельности ЦНС» [Wostyn P et al., 2018; Wostyn P, De Deyn PP, 2018].
Эти авторы на самом деле, основываясь на данной гипотезе, затем предложили в цитируемых статьях достаточно радикальный метод лечения тяжелых форм СХУ и ФМА – в виде оперативного шунтирования части ликвора из позвоночного столба в брюшную полость для облегчения глимфатико-лимфатического дренажа и детоксикации ЦНС и снижения повышенного внутричерепного давления (ВЧД). По их утверждениям, данная процедура действительно приносит части пациентов с тяжелыми формами СХУ и/или ФМА облегчение симптомов [Wostyn P et al., 2018; Wostyn P, De Deyn PP, 2018].
Для нас, однако, важно здесь отметить, что глимфатико-лимфатическая система мозга и мозговых оболочек в наибольшей степени активизируется во время фазы самого глубокого медленноволнового сна (4-й фазы сна), и что степень ее активации тесно коррелирует с суммарной спектральной мощностью дельта-волн на электроэнцефалограмме (ЭЭГ) сна [Jessen NA et al., 2015; Hablitz LM et al., 2019].
Также важно отметить здесь, что и «постковидный синдром», и «классический» СХУ, и ФМА практически всегда закономерно сопровождаются выраженными нарушениями фазовой структуры и архитектоники сна, с уменьшением количества и продолжительности или даже почти полным лишением самых глубоких фаз сна (3-й и 4-й) и уменьшением суммарной спектральной мощности дельта-волн на ЭЭГ сна, а также нарушениями циркадных ритмов [Morillas-Arques P, 2010; Yong SJ, 2021].
Возможно, как раз именно эти нарушения и являются причиной отмеченных П. Востином нарушений в работе лимфатико-глимфатической системы как при СХУ и ФМА, так и при «постковидном синдроме» [Wostyn P et al., 2018; Wostyn P, De Deyn PP, 2018].
Ниже мы обсудим еще одну интересную гипотезу патогенеза «постковидного синдрома» – а именно гипотезу о возможном непосредственном повреждающем воздействии вируса SARS-CoV-2 на один из ключевых компонентов глимфатико-лимфатической системы – на аквапорин-4, или о запуске вирусом аутоиммунной реакции на этот поврежденный белок. А затем мы поговорим о том, какое к этому всему может иметь отношение тразодон, и как он здесь может помочь.
Возможная роль аквапоринов 1-го и 4-го типов в патогенезе и в лечении нейропсихиатрических последствий «постковидного синдрома»Аквапорины 1-го и 4-го типов могут служить потенциальными клеточными мишенями для атаки вируса SARS-CoV-2
Как известно, наиболее часто используемыми «входными воротами» для инфицирования вирусом SARS-CoV-2 клеток организма человека и животных является мембранный белок ангиотензин-превращающего фермента типа 2 (ACE2). Он широко представлен на поверхности мембран клеток самых разных органов и тканей, в том числе клеток тканей легких, сердца, сосудов, почек, печени, разных отделов ЖКТ и, разумеется, в глиальных и нервных клетках ЦНС [Natoli S et al., 2020; Pruimboom L, 2021].
Однако взаимодействием с мембранным белком ACE2 возможности для проникновения вируса SARS-CoV-2 внутрь клеток нашего организма и для последующего развития заболевания COVID-19 отнюдь не ограничиваются [Millet JK et al., 2021].
Показано, что альтернативными, хотя и «менее удобными», входными воротами инфицирования, вместо белка ACE2, для этого вируса могут послужить, например, такие рецепторные белки, как обильно представленный на поверхности клеток обонятельного эпителия и нейронов обонятельной луковицы белок нейропилин-1 (NRP-1), или антиген CD147, присутствующий на поверхности иммунокомпетентных и многих других клеток нашего организма, или дипептидил-пептидаза типа 4 (DPP-4), а также аланил-аминопептидаза (ANPEP), глутамил-аминопептидаза (ENPEP), ангиотензиновый рецептор типа 2 (AGTR2), или, например, сигма-рецепторы нейронов и глиальных клеток, или толл-подобный рецептор типа 4 (TLR4), который тоже обильно представлен на поверхности нейронов и глиальных клеток [Yesilkaya UH et al., 2020; Masre SF et al., 2021; Moutal A et al., 2021; Conte С, 2021; Pruimboom L, 2021].
В силу столь большого разнообразия способов взаимодействия вируса SARS-CoV-2 с различными поверхностными белками клеток – совершенно не вызывает удивления тот факт, что у вируса SARS-CoV-2 недавно была обнаружена способность связываться и активно взаимодействовать еще с одним поверхностным белком клеток –
а именно с белком аквапорин-4 (AQP-4) – мембранным транспортером воды, широко представленным в глимфатико-лимфатической системе мозга и мозговых оболочек. Вирус SARS-CoV-2 может использовать этот белок в качестве еще одного возможного варианта «альтернативных входных ворот» для инфицирования клеток ЦНС [Corrêa DG et al., 2021; Valencia-Sanchez C, Flanagan EP, 2021].
Описав некоторое количество случаев развития подобного осложнения после перенесенного заболевания COVID-19, имевшего типичные для «традиционных» аутоиммунных менингоэнцефаломиелорадикулоневритов тяжелые неврологические проявления (параличи, слепота, глухота и др.), авторы цитируемой нами статьи предположили, что и в патогенезе более легких случаев нейропсихиатрических проявлений «постковидного синдрома», таких как длительная постковидная астения, постковидная депрессия, постковидная тревожность или бессонница, – тоже может играть некую роль аутоиммунная агрессия клеток астроглии и периферических лимфоцитов против ткани мозга, которая изначально запустилась именно в ответ на повреждение вирусом белка AQP-4 [Corrêa DG et al., 2021].
Иначе говоря, эти авторы выдвинули предположение о том, что более легкие нейропсихиатрические симптомы «постковидного синдрома» – тоже могут быть проявлениями своеобразного «низкоинтенсивного аутоиммунного воспаления ЦНС» (менее интенсивного, чем это обычно подразумевается, когда говорят об аутоиммунном менингоэнцефалите), или, другими словами, проявлениями «вялотекущего аутоиммунного менингоэнцефалита» [Corrêa DG et al., 2021].
На самом же деле эта идея частично перекликается, например, с тоже казавшейся в свое время слишком экстравагантной, но сегодня уже вполне серьезно обсуждаемой в научном сообществе, наряду с прочими гипотезами об этиопатогенезе депрессий, идеей, выдвинутой турецким исследователем Турханом Канли еще в 2014 г. и затем развитой им в 2019 г., – а именно идеей о том, что клиническая депрессия может представлять собой некое своеобразное низкоинтенсивное герпетическое, цитомегаловирусное или эндоретровирусное воспаление ЦНС («вялотекущий герпетический, цитомегаловирусный или эндоретровирусный менингоэнцефалит») [Canli T, 2014; 2019].
Основанием для этого Т. Канли выдвинул мысль о том, что часто наблюдаемая при больших депрессивных эпизодах (БДЭ) реактивация вирусов герпес-группы (вируса простого герпеса, носителями которого являются до 90-95% популяции, вируса Эпштейна-Барр или цитомегаловируса), а также реактивация так называемых «эндогенных ретровирусов» или ретротранспозонов, тоже часто наблюдаемая при БДЭ, – может представлять собой не сопутствующее вторичное явление, не следствие ослабления иммунитета на фоне депрессии, а, наоборот, важный патогенетический фактор в развитии самой же депрессии [Canli T, 2014; 2019].
В качестве возможного альтернативного объяснения для длительной персистенции нейропсихиатрических симптомов «постковидного синдрома» авторы цитируемой нами статьи предлагают идею о том, что повреждение вирусом SARS-CoV-2 белка AQP-4, даже если оно и не приведет к развитию хронического вялотекущего аутоиммунного воспаления ЦНС в конкретном случае (у конкретного пациента) – оно, тем не менее, может привести к длительной «постковидной» дисфункции этого белка [Corrêa DG et al., 2021].
А длительная «постковидная» дисфункция белка AQP-4, в свою очередь, может привести к длительным «постковидным» нарушениям детоксикационной функции глимфатико-лимфатической системы мозга и мозговых оболочек, к «постковидным» нарушениям водного обмена и осморегуляции в ЦНС. По мысли авторов цитируемой нами статьи, именно это может играть роль одного из важных факторов в развитии таких часто наблюдаемых симптомов «легкого постковидного синдрома», как постковидная астения, постковидная депрессия, постковидные когнитивные нарушения, постковидная бессонница, постковидная тревожность [Corrêa DG et al., 2021].
Стоит отметить также, что уже достаточно давно было известно, что в патогенезе РС, особенно в патогенезе одного из вариантов его течения – так называемого аутоиммунного оптиконевромиелита, – важную роль играет наличие аутоантител в крови и в ликворе именно к белку аквапорин-4. В соответствии с этим, в литературе описано некоторое количество случаев как первичной манифестации аутоиммунного оптиконевромиелита (или, реже, других форм РС) после перенесенного COVID-19, так и ухудшение течения уже изначально имевшегося на момент заболевания COVID-19 аутоиммунного оптиконевромиелита (или, реже, другой формы РС) после выздоровления от коронавирусной болезни [Batum M et al., 2020; Ghosh R et al., 2020; Tomczak A, Han MH, 2020; Shaw VC et al., 2020; Louapre С et al., 2021].
Все эти факты, вместе взятые, тоже говорят об определенной тропности вируса SARS-CoV-2 к белку аквапорин-4, о склонности этого вируса повреждать данный белок, нарушать его функцию, а затем запускать аутоиммунную агрессию клеток астроглии против поврежденных молекул именно этого белка [Batum M et al., 2020; Ghosh R et al., 2020; Tomczak A, Han MH, 2020; Shaw VC et al., 2020; Louapre С et al., 2021].
В контексте изучения острых и хронических последствий заболевания COVID-19 для различных органов и систем организма внимание исследователей привлекают нарушения функции не только аквапорина-4, но и других представителей семейства аквапоринов [Allnoch L et al., 2021].
Так, в частности, было показано, что воспаление мелких сосудов и капилляров ЦНС (церебральная микроангиопатия и капилляропатия), развивающееся при поражении ЦНС вирусом SARS-CoV-2 у экспериментальных животных (сирийских хомячков), приводит сначала к выраженной дисфункции (из-за блокады вирусными белками) белка аквапорин-1 (AOP-1) в эндотелии сосудов, а затем к снижению или даже полной временной утрате его экспрессии на поверхности клеток эндотелия сосудов, к повышенной утечке жидкости из внутрисосудистого русла в ткань мозга и к развитию отека мозга. Авторы данной статьи не без оснований предположили, что в развитии отека мозга на фоне заболевания COVID-19 у человека может играть роль тот же патогенетический механизм (дисфункция аквапорина-1), что и у сирийских хомячков
[Allnoch L et al., 2021].
Аквапорины 1 и 4-го типов могут быть перспективными терапевтическими мишенями для лечения как легочных, так и нейропсихиатрических последствий «постковидного синдрома»
Авторы другой интересной статьи выдвинули гипотезу о том, что выраженная дисфункция нескольких важных белков семейства аквапоринов, очень широко представленных в тканях верхних дыхательных путей и легких, – а именно белков AQP1, AQP3, AQP4 и AQP5 (аквапоринов 1, 3, 4 и 5-го типов; напомним, что аквапорины
1 и 4-го типов широко представлены также в глимфатико-лимфатической системе ЦНС) на фоне инфицирования дыхательных путей вирусом SARS-CoV-2 – может играть важную патогенетическую роль в развитии ассоциированной с COVID-19 бронхопневмонии, в формировании бронхиального и альвеолярного выпота и, в пределе, отека легких (то есть в накоплении в бронхах и в легочных альвеолах избыточной жидкости), а также в развитии легочной капилляропатии и микроангиопатии, оксидативного и нитрозативного стресса, повреждающего ткани верхних дыхательных путей и ткань легких, и даже в развитии системного цитокинового шторма на фоне COVID-19 [Joseph-Antony LM et al., 2021].
Авторы этой статьи также предположили, что в будущем те лекарства, которые смогут тем или иным образом активизировать функцию белков семейства аквапоринов в легочной ткани и в ткани бронхиального дерева, и/или смогут достаточно эффективно устранять вызванную вирусом SARS-CoV-2 дисфункцию этих белков в легких и в бронхах, – могут оказаться весьма перспективными средствами для лечения бронхо-легочных проявлений при COVID-19 и бронхо-легочных осложнений после перенесенного COVID-19 [Joseph-Antony LM et al., 2021].
Рассуждая по аналогии с авторами процитированной нами выше статьи, но не в контексте бронхо-легочных последствий COVID-19, а в контексте последствий этой болезни для ЦНС – мы точно так же можем предположить, что те лекарственные средства, которые могут активизировать функции аквапоринов 1 и 4-го типов в ЦНС и/или могут устранять их дисфункцию, вызванную инфицированием ЦНС вирусом SARS-CoV-2 – в том числе и косвенным образом, например, через увеличение количества и продолжительности фаз глубокого сна и параллельное увеличение суммарной мощности дельта-ритмов на ЭЭГ сна (с этими параметрами, как мы знаем, достоверно коррелирует повышение экспрессии белка AQP-4 на поверхности мембран астроцитов, а белка AOP-1 – в эндотелии мелких сосудов ЦНС, а также активация этих белков, открытие в них пор для молекул воды), – могут оказаться весьма эффективными средствами для лечения нейропсихиатрических последствий COVID-19 («постковидного синдрома»).
Обновленные данные о фармакологическом профиле тразодона, в контексте его потенциальных преимуществ при лечении нейропсихиатрических проявлений «постковидного синдрома»
В начале этого раздела мы хотели бы напомнить читателю, что атипичный антидепрессант (ААД) тразодон уже однажды, в 2018-м году, становился героем нашего подробного обзора [Беккер РА, Быков ЮВ, 2018].
Однако с тех пор как в мировой, так и в российской научной литературе появилось немало новых данных о тразодоне, которые не могли войти в тот наш обзор, поскольку они были опубликованы позднее даты его выхода в свет. В частности, в 2021-м году в 3-м номере журнала «Психиатрия и психофармакотерапия им. П.Б. Ганнушкина» был опубликован весьма подробный обзор проф. Н.Н. Петровой, канд. мед. наук Ф.Ш. Шагиахметова и Р.Р. Борукаева, посвященный различным граням клинической эффективности тразодона, прежде всего при его использовании по «неклассическим» показаниям, официально не предусмотренным инструкцией по его применению – например, в качестве корректора экстрапирамидного синдрома (ЭПС) и акатизии на фоне лечения антипсихотиками (АП), или в качестве корректора сексуальных дисфункций при лечении антидепрессантами (АД) из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) или из группы селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН), а также в качестве средства уменьшения негативной и когнитивной симптоматики шизофрении или средства, потенциально способного затормозить прогрессирование некоторых форм деменции, таких как БА и сосудистая деменция на фоне ДЭП [Петрова Н.Н. и соавт., 2021].
А немногим ранее, в 2020 г., компания Angelini Pharma (первооткрыватель и производитель тразодона) представила на постерной сессии 33-го конгресса Европейского колледжа нейропсихиатрии (ECNP), проходившего в онлайн-формате в период с 12 по 15 сентября 2020 г., доклад, в котором, наряду с интересной информацией о клиническом применении тразодона в различных контекстах, приводились также обновленные и уточненные данные о рецепторном профиле тразодона [Odagaki Y et al., 2005; ECNP Poster Session, 2020].
Поскольку же данная наша статья посвящена рассмотрению потенциальных преимуществ выбора тразодона именно для лечения нейропсихиатрических проявлений «постковидного синдрома», то мы хотим, в рамках данной статьи, сосредоточиться на рассмотрении только и исключительно тех фармакологических свойств тразодона, которые могут оказаться полезными именно в данном контексте. Итак, первой особенностью фармакологического профиля тразодона, на которой мы бы хотели заострить внимание читателя, и которая, на наш взгляд, может оказаться релевантной и весьма полезной в лечении нейропсихиатрических симптомов «постковидного синдрома», – является весьма выраженное специфическое нормализующее действие тразодона на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности фаз глубокого медленноволнового сна (3-й и особенно 4-й – самой глубокой, так называемой «фазы дельта-сна»), с увеличением суммарной спектральной мощности дельта-ритма на ЭЭГ сна, с облегчением не только засыпания, но и поддержания непрерывности сна, устранением ночных и чрезмерно ранних утренних пробуждений, с устранением дневной сонливости, вялости и разбитости за счет повышения эффективности ночного сна [Wichniak A et al., 2017].
Специфическое нормализующее влияние тразодона на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности фаз глубокого медленноволнового сна (3-й и особенно 4-й) и представленности дельта-ритмов на ЭЭГ сна, связано с высокоаффинным антагонизмом (точнее, инверсным агонизмом) тразодона к 5-HT2A-подтипу серотониновых рецепторов и одновременным высокоаффинным антагонизмом к α1B подтипу адренергических рецепторов. При этом сильный антагонизм тразодона к гистаминовым H1-рецепторам облегчает засыпание и поддержание непрерывности ночного сна [Wichniak A et al., 2017].
Сильный парциальный агонизм тразодона к 5-HT1A и 5-HT1D-подтипам серотониновых рецепторов при этом способствует устранению характерной для депрессивных расстройств избыточной представленности REM-фаз в течение ночного сна, задержке латентного периода наступления первой REM-фазы, но без свойственного многим другим АД чрезмерного подавляющего влияния на REM-сон. При дозах тразодона 300 мг/сут и выше начинает также играть роль антагонизм тразодона к 5-HT2C-подтипу серотониновых рецепторов (способствует увеличению количества и продолжительности глубоких фаз сна и активации дельта-ритмов на ЭЭГ сна) и к 5-HT7-подтипу их (способствует нормализации циркадных ритмов и фазовой структуры сна) [Wichniak A et al., 2017].
С учетом уже обсуждавшихся нами выше гипотез о роли нарушений в работе глимфатико-лимфатической системы мозга и мозговых оболочек и нарушений работы аквапоринов 1 и 4-го типов в общем механизме патогенеза «постковидного синдрома» и СХУ, и о том, что лекарства, тем или иным образом активизирующие работу глимфатико-лимфатической системы, процессы детоксикации мозга и ликвора и работу аквапоринов – например, за счет увеличения количества и продолжительности фаз глубокого медленноволнового сна и повышения представленности дельта-ритмов на ЭЭГ сна – могут оказаться эффективными терапевтическими агентами для лечения этих состояний [Wostyn P, 2021], – тразодон, на наш взгляд, заслуживает особенного внимания в контексте его перспективности для лечения «постковидного синдрома».
Это свойство тразодона в данном контексте тем более важно, что нарушения засыпания и поддержания сна, нарушения фазовой структуры сна с лишением или сокращением количества и продолжительности фаз глубокого сна, а также нарушения циркадных ритмов, действительно, очень часты в клинической картине нейропсихиатрических проявлений «постковидного синдрома», наряду с тревогой и депрессией [Yong SJ, 2021; Kamal M et al., 2021; Deng J et al., 2021].
И наоборот, было показано, что нормализация сна и его фазовой структуры, нормализация циркадных ритмов с помощью различных методов, таких как налаживание гигиены сна, режима сна и отдыха, когнитивно-поведенческая терапия инсомнии (CBT-i), музыкотерапия и другие, в том числе применение лекарственных препаратов, налаживающих сон, – способны оказать выраженное положительное влияние как на течение и исход острой фазы заболевания COVID-19, так и на течение «постковидного синдрома», и на длительность реабилитации после выздоровления от острой фазы болезни [da Silva FR et al., 2020; Rowlands AV et al., 2021; de Almondes KM et al., 2021].
Важно также отметить, что тразодон уже ранее показал свою эффективность при лечении клинически и этиопатогенетически весьма сходного с «постковидным синдромом» состояния – ФМА [Morillas-Arques P et al., 2010].
Рецепторные механизмы специфического положительного влияния тразодона на фазовую структуру и архитектонику сна изображены на рис. 2. Второй аспект клинической фармакологии тразодона, который представляется нам весьма важным подчеркнуть при обсуждении потенциальных преимуществ применения именно этого препарата для лечения нейропсихиатрических последствий «постковидного синдрома», – это выраженная способность тразодона, наряду с его основным действием – антидепрессивным и анксиолитическим, – также улучшать когнитивное функционирование и память у пациентов с самыми разными психическими и неврологическими заболеваниями. Этот эффект тразодона наблюдается не только у пациентов с депрессивными и тревожными расстройствами, но и у пациентов с различными формами деменций (БА, ДЭП и др.), и у пациентов с шизофренией [Петрова НН с соавт, 2021].
Этот аспект фармакологического действия тразодона представляется нам очень важным в контексте обсуждения его применимости для лечения «постковидного синдрома» по той причине, что пациенты с «постковидным синдромом» очень часто предъявляют жалобы на выраженное ухудшение когнитивных функций, концентрации внимания и памяти, не пропорциональное степени тяжести симптомов депрессии и тревоги у них [Yong SJ, 2021; Kamal M et al., 2021].
Способность тразодона улучшать когнитивные функции у пациентов с различными психическими и неврологическими расстройствами зиждется отчасти на уже обсуждавшемся нами выше свойстве этого препарата специфически улучшать фазовую структуру и архитектонику ночного сна, увеличивать количество и продолжительность глубоких фаз сна (3-й и особенно 4-й) и представленность дельта-ритмов на ЭЭГ сна, активизировать работу глимфатико-лимфатической системы мозга и мозговых оболочек, белков-аквапоринов 1 и 4-го типов, повышать эффективность детоксикации мозга и ликвора [Н.Н. Петрова и соавт., 2021].
Между тем хорошо известно, сколь важную роль играют нормальное количество именно глубокого, медленноволнового, восстановительного дельта-сна, а также нормальная работа глимфатико-лимфатической системы и аквапоринов 1 и 4-го типов – в поддержании и сохранении нормального когнитивного функционирования и в работе процессов консолидации памяти [Н.Н. Петрова и соавт., 2021].
Другая же часть прокогнитивного действия тразодона связана не с его выраженным специфическим положительным влиянием на фазовую структуру сна и на активность глимфатико-лимфатической системы, а непосредственно с его рецепторными свойствами, а именно – с его сильным парциальным агонизмом к 5-HT1A-подтипу серотониновых рецепторов и с его сильным антагонизмом к их 5-HT2A-подтипу, а также (при дозах 300 мг/сут и выше) – с его антагонизмом к 5-HT2C- и 5-HT7-подтипам серотониновых рецепторов, и к пресинаптическим «тормозным» α2C-адренергическим рецепторам. Показано, что соответствующее воздействие на каждый из этих подтипов рецепторов способно оказать положительное воздействие на когнитивную функцию [Ogren SO et al., 2008; Meltzer HY, Sumiyoshi T, 2008; Landolt HP, Wehrle R, 2009; Jensen NH et al., 2010; Del’Guidice T et al., 2014; Berridge CW, Spencer RC, 2016].
В сумме все эти рецепторные эффекты тразодона, плюс отсутствие у него, в отличие от многих других АД, неблагоприятного для когнитивной функции М-холиноблокирующего действия, – приводят к увеличению под его влиянием выделения норадреналина, дофамина и ацетилхолина в префронтальной коре (ПФК), и к улучшению когнитивного функционирования при его воздействии [Stahl SM, 2013; Беккер РА, Быков ЮВ, 2018].
Третий же аспект фармакологического действия тразодона, на котором мы бы хотели акцентировать внимание в контексте обсуждения перспективности выбора именно этого препарата для лечения нейропсихиатрических последствий «постковидного синдрома», – это наличие у тразодона выраженных антимигренозных и анальгетических свойств, а также его эффективность при СРК [ECNP Poster Session, 2020; Петрова НН с соавт, 2021].
Наличие у тразодона таких свойств весьма важно в том плане, что очень многие пациенты с «постковидным синдромом», вне зависимости от степени тяжести их депрессии и тревоги, также предъявляют жалобы на ту или иную сопутствующую алгическую симптоматику – например, на хронические головные боли напряжения (ХГБН), на частые приступы мигрени, на «летучие» боли в мышцах и суставах (миалгии и артралгии), подобные тем, которые наблюдаются у пациентов с СХУ или ФМА, а также на проявления СРК с болями и/или диареей [Yong SJ, 2021; Kamal M et al., 2021].
Основные рецепторные механизмы анальгетического и антимигренозного действия тразодона схематически представлены ниже на рис. 3. Определенную роль в общем механизме анальгетического действия тразодона, вероятно, играет также его способность, подобно СИОЗСиН (например, венлафаксину) и трициклическим антидепрессантам (ТЦА), таким как амитриптилин, косвенно активизировать работу эндогенной опиоидной системы. Анальгетическое действие тразодона частично снимается налоксоном. В то же время активация эндогенной опиоидной системы и развитие анальгезии не наблюдаются при применении СИОЗС [Schreiber S et al., 2000; Schreiber S, Pick GG, 2020].
В контексте обсуждения перспективности того или иного АД для лечения нейропсихиатрических проявлений «постковидного синдрома» в последнее время много говорится о желательности наличия у обсуждаемых препаратов агонистической активности по отношению к сигма-1 (s1) и/или сигма-2 (s2) рецепторам нервных клеток
[П.В. Морозов с соавт., 2021].
Здесь интересно отметить, что, несмотря на то, что у тразодона, согласно имеющимся данным, аффинность к s1- и s2-рецепторам довольно низкая (pKi=5,9 и 6,0 соответственно), то есть находится примерно в том же диапазоне, что и его аффинность к 5-HT7-подтипу серотониновых рецепторов, – но его сигма-рецепторная активность, по-видимому, все же может являться клинически значимой, по крайней мере при его высоких дозах (300 мг/сут и выше) [Garrone B et al., 2000].
Показано, что агонизм тразодона к s1- и s2-рецепторам нейронов, по крайней мере in vitro, принимает участие в реализации таких эффектов тразодона при его клинически релевантных концентрациях, как ингибирование чрезмерного высвобождения глутамата и предотвращение развития глутамат-опосредованной эксайтотоксичности. Эти эффекты тразодона частично снимаются такими экспериментальными s1- и s2-антагонистами, как 3-PPP или BD-1047 [Garrone B et al., 2000].
Логично предположить, что этот, пусть и не очень высокоаффинный, s1-рецепторный агонизм тразодона может иметь определенное значение также и в контексте обсуждения перспектив его применения для лечения нейропсихиатрических проявлений «постковидного синдрома». Действительно, с s1-рецепторным агонизмом различных препаратов отчасти связывают их противовоспалительный и иммуномодулирующий эффекты, угнетение под их влиянием секреции воспалительных цитокинов, в частности, такого важного из них, как интерлейкин-6 (IL-6), снижение под их влиянием уровней оксидативного и нитрозативного стресса в клетке, уменьшение под их влиянием митохондриальной дисфункции и дисфункции эндоплазматического ретикулума, повышение устойчивости клеток к неблагоприятным воздействиям, предотвращение их апоптоза, а также лизосомотропные эффекты (торможение избыточной аутофагии и повышение ее эффективности и др.), угнетение репликации вируса SARS-CoV-2 [Jain A et al., 2021].
Еще в 2015 г., задолго до нынешней пандемии COVID-19, было показано, что тразодон, действительно, обладает мощными противовоспалительными и иммуномодулирующими свойствами, угнетает секрецию таких провоспалительных цитокинов, как интерферон-гамма (ИФН-γ), фактор некроза опухолей-альфа (ФНО-α), ИЛ-6, снижает активность провоспалительного и проапоптотического каскада NF-kappaB/p38/c-Jun N-terminal kinase (JNK), повышает секрецию мозгового нейротрофического фактора (BDNF), стимулирует нейрогенез и оказывает нейропротективное действие. Общий механизм противовоспалительного и нейропротективного действия тразодона воспроизведен ниже на рисунке № 5 [Daniele S et al., 2015 (a); (b)].
С учетом гипотезы о том, что хроническое нейровоспаление, повышенная воспалительная активность нейроглии, гиперсекреция ею воспалительных цитокинов, а также прямое повреждающее (нейротоксическое, нейропатогенное или запускающее те или иные нейродегенеративные процессы в ЦНС) воздействие инвазии вируса SARS-CoV-2 в мозг – могут играть важную роль в общем механизме патогенеза нейропсихиатрических симптомов «постковидного синдрома» [Yong SJ, 2021], – вполне очевидно, сколь полезными могут оказаться в данном контексте упоминавшиеся нами выше противовоспалительные, иммуномодулирующие и нейропротективные свойства тразодона [Daniele S et al., 2015 (a); (b)].
Также сравнительно недавно было показано, что низкий уровень эндогенного мелатонина в крови, например у пациентов пожилого и старческого возраста, у пациентов с некоторыми серьезными психическими и соматическими расстройствами, в частности с расстройствами аутистического спектра (РАС), с сахарным диабетом (СД), с ожирением и/или метаболическим синдромом (МС), – коррелирует с повышенным риском тяжелого течения заболевания COVID-19 и развития серьезных осложнений и даже летального исхода, а также с длительным «постковидным синдромом» и с замедленным восстановлением после перенесенного заболевания [Simko F, Reiter RJ, 2020; Barone MU et al., 2021 (a); (b)].
С другой же стороны, было показано, что адъювантное назначение экзогенного мелатонина, как вещества, обладающего мощным противовоспалительным, антиоксидантным, антицитокиновым, анти-свободнорадикальным, иммуномодулирующим и прямым противовирусным действием, – может облегчать течение COVID-19 и «постковидного синдрома», и что оно снижает риск тяжелых осложнений и летальных исходов при этой болезни и ускоряет восстановление в фазе выздоровления от нее, как и при ряде других тяжелых вирусных инфекций [Anderson G, Reiter RJ, 2020; Vlachou M et al., 2021].
Кроме того, сегодня также известно и о том, что мелатонин обладает мощным цитопротективным и, в частности, нейропротективным действием. Мелатонин также непосредственно (через взаимодействие с MT1- и MT2-рецепторами астроцитов и клеток эндотелия мозговых сосудов) активизирует работу глимфатико-лимфатической системы мозга и мозговых оболочек, и повышает эффективность детоксикации мозговой ткани и ликвора, и делает это независимо от своего влияния на сон и циркадные ритмы [Cardinali DP, 2019; 2021; Li Y et al., 2020].
Между тем, с учетом уже обсуждавшейся нами ранее гипотезы о роли нарушений в работе глимфатико-лимфатической системы мозга и мозговых оболочек в механизмах патогенеза «постковидного синдрома» и СХУ, способность мелатонина непосредственно активизировать работу этой системы – может иметь важное терапевтическое значение при лечении этих состояний [Wostyn P, 2021].
В этом контексте важно отметить, что целый ряд различных лекарств, как среди психотропных препаратов и, что самое неприятное, в том числе среди лекарств, применяемых именно для лечения депрессий, тревожных расстройств и нарушений сна (а это, например, флуоксетин, барбитураты, многие бензодиазепиновые транквилизаторы (БДТ), почти все Z-лекарства, кроме короткодействующего залеплона, многие из АП), так и среди не-психотропных лекарств (это, например, β-блокаторы, такие как пропранолол и атенолол, блокаторы медленных кальциевых каналов (БМКК), такие как верапамил, дилтиазем, амлодипин, или нестероидные противовоспалительные препараты (НПВС), такие как ибупрофен), а также злоупотребление алкоголем, никотином, кофеином – могут существенно снижать ночную секрецию мелатонина [Meyer AC et al., 1986; Childs PA et al., 1995; Murphy PJ et al., 1996; Stoschitzky K et al., 1999].
В контексте заболевания COVID-19 и «постковидного синдрома» свойство всех вышеупомянутых лекарств в различной степени подавлять секрецию эндогенного мелатонина, безусловно, является нежелательным и вредным.
В то же время тразодон, в отличие от всех вышеупомянутых лекарств, – достоверно повышает содержание мелатонина в крови. Предполагается, что в основе этого про-мелатонинергического эффекта тразодона может лежать стимуляция секреции мелатонина, которая происходит за счет стимуляции 5-HT2C-подтипа серотониновых рецепторов шишковидной железы на фоне высвобождения серотонина под влиянием одного из активных метаболитов тразодона – мета-хлорфенилпиперазина (mCPP), и одновременное торможение окислительного катаболизма мелатонина в печени, за счет конкуренции за один и тот же цитохром системы P450 печени (CYP450 1A2) между мелатонином и тразодоном [Morera AL et al., 2009].
С учетом всего сказанного нами выше о положительном влиянии мелатонина на течение заболевания COVID-19, на риск развития его тяжелых осложнений и длительного «постковидного синдрома», а также на течение процессов реабилитации, восстановления от «постковидного синдрома» – свойство тразодона повышать уровень эндогенного мелатонина в крови тоже может иметь существенное значение в обсуждаемом контексте.
На сегодняшний день тразодон официально рекомендован Московским городским научным обществом терапевтов для лечения «постковидной бессонницы», «постковидной депрессии и/или тревожности» и «постковидной астении». Завершая описание тех фармакологических свойств тразодона, которые, на наш взгляд, могут иметь отношение к его эффективности и его перспективам в лечении разнообразных нейропсихиатрических последствий «постковидного синдрома», а в целом ряде случаев даже могут сделать именно его препаратом наилучшего выбора для этих целей, – перейдем к представлению двух клинических случаев из нашей собственной практики, в которых тразодон оказался эффективен и безопасен при лечении данной патологии.
Представление клинических случаев
Клинический случай №1. Постковидный синдром с тяжелой депрессией и тревогой, дисфорическими проявлениями и грубыми нарушениями фазовой структуры сна, подтвержденными объективной полисомнографией.
Мужчина А. К., 1988 года рождения (33 года на момент обращения за консультацией), женат, имеет двоих малолетних детей. По образованию экономист. Переболел COVID-19 в марте 2021 г. Несмотря на молодой возраст и отсутствие коморбидных соматических заболеваний, течение болезни быстро приняло тяжелый характер, в силу чего пациенту потребовалась госпитализация в реанимационное отделение. В течение более чем двух недель данный пациент находился на ИВЛ, получал большие дозы глюкокортикоидов.
Данный пациент ранее психическими расстройствами не страдал, жалоб по этому поводу не предъявлял, к психиатрам не обращался, активно занимался спортом (пауэрлифтингом) на любительском уровне, был успешным и достаточно высокооплачиваемым руководителем среднего звена в крупной торговой сети. Психические расстройства у ближайших родственников пациент также отрицает. После выздоровления от COVID-19 данный пациент был вынужден оставить работу и занятия спортом. В течение многих месяцев после выздоровления он предъявлял неврологам и психиатрам жалобы на выраженную физическую и психическую астенизацию (физическую слабость, быструю утомляемость при физических и умственных нагрузках, постоянное чувство усталости), подавленное настроение, ухудшение памяти и концентрации внимания, неясное «грызущее» чувство тревоги, частые приступы гнева и раздражения, которые он срывал на членах семьи (жене и детях). Получал от врачей назначения мильгаммы, сульбутиамина (без какого-либо видимого эффекта), эсциталопрама, сертралина (отказывался от их приема после нескольких дней проб каждого из них, из-за их негативного влияния на его способность к эякуляции и достижению оргазма, а также из-за усиления тревожности и нарушений сна). Одной из очень субъективно важных для этого пациента жалоб было специфическое нарушение сна, которое проявлялось неоднократными пробуждениями среди ночи, поверхностным, не приносящим отдыха и успокоения, сном, частыми кошмарными сновидениями, а также ощущением наутро «будто и не спал вовсе». О депрессивных, тревожных и дисфорических проявлениях рассказал уже после жалоб на проблемы со сном, очевидно придавая им меньшую субъективную значимость.
Показатели шкалы депрессии Бека на момент обращения за консультацией – 21 балл (тяжелая депрессия), показатели шкалы тревоги Шихана – 86 баллов (крайне выраженная тревожность). Предполагая, что причиной всех его проблем, и в частности его проблем со сном, является некое гипотетическое «органическое поражение мозга вирусом после перенесенного COVID-19», добился проведения ему ряда обследований, в частности магнито-резонансной томографии (МРТ) головного мозга, а также полисомнографии.
Пациент был настолько озабочен резко неудовлетворительным качеством своего сна после перенесенного COVID-19, что даже проводил в разговоре сравнение своего состояния с «фатальной семейной бессонницей» и с летальными последствиями принудительного лишения сна у животных, о чем прочитал в Википедии, что значительно усилило имевшиеся у него тревожность и фиксацию на субъективном качестве сна. На МРТ у данного пациента не было обнаружено никаких признаков органической патологии ЦНС. В то же время при проведении ему полисомнографического исследования было обнаружено, что у этого пациента практически полностью отсутствует 4-я фаза сна (фаза глубокого сна), что латентность REM-фазы сна у него значительно укорочена по сравнению с нормой, и что суммарная мощность дельта-ритмов (total EEG delta power) во всех фазах сна также значительно ниже нормы.
С учетом имеющихся в литературе данных о специфическом нормализующем воздействии тразодона на фазовую структуру и архитектонику сна, с увеличением количества и продолжительности фаз глубокого сна (3-й и особенно 4-й) и совокупной мощности дельта-ритмов, с сопутствующей этому активацией лимфатико-глимфатической системы мозга и мозговых оболочек, а также с учетом гипотезы о том, что нарушения в работе лимфатико-глимфатической системы мозга и мозговых оболочек могут играть важную роль в патогенезе постковидного синдрома, – данному пациенту было предложено попробовать лечение тразодоном в антидепрессивных дозах (с постепенным доведением дозы до 300 мг/сут в 2 приема).
Дополнительным аргументом в пользу выбора нами именно тразодона для лечения этого пациента послужило выраженное антиагрессивное и анти-дисфорическое действие тразодона, реализующееся через такие свойственные ему рецепторные механизмы, как агонизм к 5-HT1D–
и 5-HT1A-подтипам серотониновых рецепторов и антагонизм к 5-HT2A-подтипу серотониновых рецепторов. С учетом наличия у данного пациента приступов раздражительности, гневливости и дисфории в отношении членов семьи, это было сочтено нами важным дополнительным фактором в выборе именно тразодона, как следующего АД, после двух неудачных проб им СИОЗС (эсциталопрама и сертралина). Кроме того, при выборе именно тразодона для лечения этого пациента мы ориентировались также на то, что он, в отличие от СИОЗС, не только не вызывает сексуальных дисфункций, на которые жаловался пациент при первых же пробах СИОЗС, а также не вызывает обострения тревоги и бессонницы в начале терапии – но, напротив, улучшает либидо и сексуальную функцию пациентов, быстро нормализует сон и оказывает выраженное анксиолитическое действие с первых же дней терапии.
Лечение А. К. было начато нами с дозы 50 мг тразодона на ночь. В дальнейшем ночная доза тразодона увеличивалась на 50 мг каждые 3 дня до достижения 150 мг на ночь. Через 3 дня после достижения этой дозы нами был добавлен утренний прием тразодона в дозе 50 мг. Затем, также с интервалами в 3 дня, утренняя доза тразодона тоже постепенно увеличивалась до достижения 150 мг (итого 300 мг/сут). Переносимость препарата у данного пациента оказалась очень хорошей.
Уже в первые дни терапии, то есть уже на дозе 50 мг тразодона на ночь, отметил значительное улучшение сна, снижение утренней и дневной тревожности. На дозе 150 мг тразодона на ночь у пациента прекратились ночные пробуждения. Спустя 3 нед пребывания на 300 мг/сут тразодона он отметил, по его словам, «возвращение сил», исчезновение мучительного чувства постоянной, хронической усталости, вялости и разбитости. На этом фоне пациент спонтанно, без какого-либо побуждения со стороны консультирующего специалиста, возобновил занятия любимым видом спорта (пауэрлифтингом). Настроение пациента к этому времени стало из выраженно депрессивного – субдепрессивным. Исчезли приступы гнева и раздражения в отношении членов семьи, нормализовались отношения с женой и старшим ребенком, значительно ухудшившиеся за время пребывания пациента в депрессии.
После восьми недель пребывания на 300 мг/сут тразодона показатели шкалы депрессии Бека и шкалы тревоги Шихана у данного пациента полностью нормализовались, а все жалобы, которые он ранее предъявлял, исчезли, или, как выразился сам пациент, «утратили актуальность». Пациент возобновил поиск работы. В настоящее время он снова работает менеджером среднего звена, но уже в другой торговой сети.
Клинический случай № 2. Постковидный синдром с легкой депрессией, протекавшей с выраженной астенией, нарушениями сна, тревожностью, синдромом ДП/ДР, «туманом в голове» и постковидным СРК. Мужчина М. С., 1998 года рождения (23 года на момент обращения за консультацией), холост. По образованию химик-технолог. Коморбидные соматические заболевания: СД 1-го типа (инсулинозависимый) с 14-летнего возраста. Психические заболевания у себя или у близких родственников данный пациент отрицает.
По собственному признанию пациента, он «с детства обладал тревожно-мнительным, слегка ипохондрическим характером». Однако эта характерологическая особенность пациента никогда ранее, до перенесенного им в апреле 2021 года COVID-19, не вызывала у него каких-либо нарушений адаптации, никаких проблем в реальной жизни, учебе или работе. Поэтому данная личностная особенность пациента никогда ранее не служила для него причиной обратиться за психиатрической или психотерапевтической помощью.
Вместе с тем, в силу именно этой личностной особенности, данный пациент очень ригидно и ответственно относится к контролю своей диеты, режима инсулинотерапии и уровня гликемии с помощью портативного глюкометра. В силу этой же личностной особенности данный пациент очень негативно относится к любым потенциально возможным побочным эффектам от психотропных препаратов на аппетит, массу тела и уровень глюкозы в крови в любую сторону. В апреле 2021 г. данный пациент амбулаторно переболел легкой формой COVID-19. После выздоровления от COVID-19 он в течение многих месяцев предъявлял психиатрам и неврологам жалобы на слегка сниженное настроение, физическую слабость, вялость, апатию, быструю утомляемость, частые головные боли, преходящие «летучие» боли в мышцах и суставах, трудности с засыпанием, повышенную тревожность, проблемы с памятью и концентрацией внимания, «туман в голове», легкое ощущение «нереальности, искусственности мира» и легкое ощущение «собственной измененности» (типичные проявления легкой формы синдрома деперсонализации-дереализации – ДП/ДР), пробуждения ранним утром (обычно в 5–6 ч утра) в горячем поту, с сильнейшей тревогой, тахикардией («сильно бьющимся сердцем», по описанию пациента), а также на иногда возникавшие после пробуждения «сонные параличи» (невозможность пошевелиться в течение нескольких минут после пробуждения).
Одновременно с этим пациент стал предъявлять гастроэнтерологам жалобы на частые и болезненные приступы диареи, возникавшие без видимой причины. Детальное гастроэнтерологическое и колопроктологическое обследование, включавшее в себя анализ кала на кальпротектин, перианальный мазок на яйца глистов, бакпосев кала, ректосигмоидоскопию, колоноскопию, ирригоскопию толстой кишки (бариевую клизму), – не смогло выявить какой-либо органической патологии ЖКТ. Вследствие этого гастроэнтерологом был поставлен диагноз СРК, и рекомендовано обращение к психиатру и/или психотерапевту. Следует отметить, что, в отличие от предыдущего описанного нами пациента, данный пациент после развития вышеописанных симптомов продолжал работать по специальности, несмотря на свое не очень хорошее общее психическое и физическое состояние (как он сам выразился – «превозмогать состояние»). Одной из причин для такого «превозмогания» пациент называл «чувство долга», а именно – ощущаемую им моральную обязанность финансово помогать родителям и младшей сестре. До обращения за консультацией к одному из соавторов настоящей статьи данный пациент получал от невролога назначения гопантената кальция, пирацетама, мексидола, сульбутиамина, фенибута (без какого-либо заметного эффекта), а от психиатра – назначение сертралина с гидроксизином (от приема которых пациент отказался спустя всего 4 дня, почувствовав на фоне начала приема сертралина тошноту и резкое снижение аппетита, и испытав на этом фоне, вскоре после очередного введения инсулина, приступ легкой гипогликемии с головокружением и слабостью), затем – назначение миртазапина 30 мг на ночь с сульпиридом 50 мг 3 раза в день (от приема которых пациент также отказался спустя всего несколько дней, обратив внимание на значительное повышение аппетита на фоне такой терапии и испугавшись, что это может ухудшить гликемический контроль, или вызвать крайне нежелательную для него прибавку веса). Показатель шкалы депрессии Бека у этого пациента на момент обращения за консультацией составлял 13 баллов (субдепрессия или легкая депрессия), показатель шкалы Шихана – 28 баллов (легкая или умеренная тревожность). Показатель шкалы дереализации Нуллера на момент обращения за консультацией – 9 баллов.
С учетом характера жалоб данного пациента, в которых значительное место, наряду с астенией, повышенной утомляемостью и слабостью, занимали повышенная тревожность, нарушения сна и сонные параличи вскоре после пробуждения, а также нарушения памяти и концентрации внимания, «летучие боли во всем теле», головные боли и проявления СРК, и с учетом данных о наличии у тразодона, наряду с анксиолитической и антидепрессивной, также выраженной анальгетической и прокогнитивной активности, данных об эффективности тразодона при СРК, ГБН и мигренях, и о специфической способности тразодона нормализовывать фазовую структуру сна и устранять разнообразные парасомнические нарушения (в том числе «сонные параличи»), – мы сочли, что в данном случае назначение именно тразодона в качестве АД будет особенно уместным выбором.
Еще одной важной мотивацией для выбора нами именно тразодона в качестве АД у этого пациента была нейтральность тразодона в отношении регуляции аппетита и массы тела, уровня гликемии. Это представлялось нам немаловажным фактором в выборе подходящего АД, с учетом очень ригидного негативного отношения данного пациента к любым побочным эффектам психотропных препаратов на аппетит, массу тела и уровень гликемии в любую сторону. Поскольку депрессия у данного пациента, в отличие от предыдущего описанного нами случая, не была тяжелой ни по оценочным шкалам, ни по общему клиническому впечатлению от видеобеседы в Skype, ни по субъективной оценке самого пациента («слегка сниженное настроение», по его собственным словам), и производила впечатление во многом вторичной по отношению к симптомам астенизации, тревожности и нарушениям сна, – то мы предположили, что данному пациенту может хватить и дозы 150 мг/сут тразодона (вся доза на ночь) – дозы не столько антидепрессивной, сколько нормализующей сон и способствующей устранению тревожности. Лечение пациента М. С., как и предыдущего пациента, было начато нами с дозы тразодона 50 мг на ночь. Затем с интервалами в 3 дня доза тразодона была доведена нами до 100 мг на ночь, а затем до 150 мг на ночь. С учетом наличия в клинической картине болезни данного пациента также синдрома ДП/ДР, и наличия в литературе данных о специфической эффективности ламотриджина именно в связке с серотонинергическими АД (но не в монотерапии!) в устранении этого синдрома – мы сочли целесообразным включить в терапию этого пациента также ламотриджин, начиная с 25 мг на ночь, с постепенным доведением дозы до 100 мг на ночь, с интервалами повышения 25 мг каждые 7 дней.
С первых же дней терапии тразодоном и ламотриджином, уже на дозах 50 мг/сут первого и 25 мг/сут второго, пациент отметил облегчение засыпания, уменьшение тревожности. После 4 нед пребывания на 150 мг/сут тразодона и 100 мг/сут ламотриджина пациент отметил исчезновение «летучих» болей в теле, головных болей, улучшение настроения и общего самочувствия, улучшение концентрации внимания, возвращение «чувства отдыха и выспанности» после ночного сна, значительное уменьшение частоты и болезненности приступов диареи, «прояснение в голове», уменьшение дереализации, а также то, что ему «стало значительно легче справляться с работой», что он «меньше совершает ошибок на работе и реже получает замечания от начальства». К сроку 8 нед пребывания на 150 мг/сут тразодона и
100 мг/сут ламотриджина данный пациент вышел в полную ремиссию, как по линии симптомов депрессии, тревожности, нарушений сна и когнитивного функционирования, синдрома ДП/ДР, так и по линии СРК и ГБН.
Заключение
Как видно из приведенных нами данных литературы, а также из рассмотрения представленных нами двух клинических случаев из нашей собственной практики – так называемый «постковидный синдром» и его крайне многообразные, как «сугубо психические», так и неврологические и психосоматические проявления (включая, например, нередко встречающийся так называемый«постковидный СРК») – ныне являются весьма актуальной проблемой как для современной психиатрии и неврологии, так и для различных областей соматической медицины – например, гастроэнтерологии, пульмонологии, урологии, кардиологии.
Соматическим врачам многих специальностей – например, уже упомянутым нами выше гастроэнтерологам, пульмонологам, кардиологам, урологам – сегодня часто приходится иметь дело с многочисленными психосоматическими проявлениями «постковидного синдрома» и дифференцировать их от соответствующих органических соматических заболеваний.
Весьма важное место в общей клинической картине «постковидного синдрома», наряду с часто наблюдаемыми при этом синдроме проявлениями депрессии, тревожности, нарушениями сна, его фазовой структуры и архитектоники, когнитивными нарушениями, – занимают симптомы так называемой «постковидной астении», а также необъяснимые «летучие» боли в теле (в мышцах, костях, суставах и др.), частые головные боли, функциональные нарушения ЖКТ (особенно часто – СРК, причем он чаще протекает у этих пациентов с диареей и/или болями в животе, чем с запорами). На этом основании многие авторы проводят параллель между сравнительно недавно описанным «постковидным синдромом» – и давно известными и хорошо описанными в литературе синдромом хронической усталости (СХУ) и фибромиалгией (ФМА). Некоторые авторы говорят даже о том, что, возможно, «постковидный синдром» – по крайней мере в плане своих типичных психоневрологических и психосоматических проявлений – является просто еще одним вариантом давно известных заболеваний СХУ и/или ФМА, для которого триггером послужило перенесенное заболевание COVID-19. Это аналогично тому, как для развития СХУ и ФМА триггерами часто являются перенесенный инфекционный мононуклеоз (инфекция вирусом Эпштейна-Барр или цитомегаловирусом), перенесенный герпес (опоясывающий лишай) или, например, перенесенный грипп, или другая острая вирусная инфекция.
Между тем в современной научной литературе имеется немало данных о роли нарушений функции белка аквапорин-4 (AQP-4), нарушений функции клеток астроглии (их воспалительной активации, испытываемого ими при этом повышенного уровня оксидативного и нитрозативного стресса, их свободнорадикального повреждения и митохондриальной дисфункции) и, в целом, нарушений в работе лимфатико-глимфатической системы мозга и мозговых оболочек – в патогенезе как известного с недавних пор «постковидного синдрома», так и давно известных заболеваний СХУ и ФМА. С учетом данных о том, что лимфатико-глимфатическая система мозга и мозговых оболочек в наибольшей степени активизируется именно во время 4-й фазы наиболее глубокого сна (так называемой фазы дельта-сна), и что нарушения фазовой структуры сна (уменьшение количества и продолжительности глубоких фаз сна и суммарной мощности дельта-ритмов на ЭЭГ сна) – приводят к вторичным нарушениям функции лимфатико-глимфатической системы мозга и мозговых оболочек, к вторичной воспалительной активации клеток астроглии, а также данных о специфической способности тразодона нормализовывать фазовую структуру сна (увеличивать количество и продолжительность 4-й фазы сна и суммарную мощность дельта-ритмов на ЭЭГ сна), активизировать работу лимфатико-глимфатической системы мозга и мозговых оболочек, оказывать противовоспалительное действие в ЦНС (уменьшать воспалительную активацию клеток астроглии), активизировать работу белка AQP-4, которая закономерно нарушается при инфекции вирусом SARS-CoV-,2 – тразодон, на наш взгляд, является одним из наиболее желательных препаратов выбора среди АД для лечения психоневрологических и психосоматических проявлений «постковидного синдрома».
На сегодняшний день тразодон официально рекомендован Московским городским научным обществом терапевтов для лечения постковидной бессонницы, а также постковидных депрессивных и тревожных нарушений. Стоит также отметить, что высокая эффективность и безопасность применения тразодона для лечения двух патологических состояний, весьма сходных с «постковидным синдромом» как по клинической симптоматике, так и по предполагаемым механизмам этиопатогенеза – а именно для лечения СХУ и ФМА, – была уже ранее доказана в ряде клинических исследований. Это позволяет, по аналогии, предполагать, что тразодон может оказаться весьма эффективным и безопасным средством также и для лечения разнообразных психоневрологических и психосоматических проявлений «постковидного синдрома».
Приведенные нами в настоящей статье два клинических примера успешного применения тразодона для лечения «постковидного синдрома» из нашей собственной практики – на наш взгляд, очень ярко иллюстрируют вышеуказанный тезис.
Сведения об авторАХ:
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве. 8410501, Израиль, Беэр-Шева;
Быков Юрий Витальевич – ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России. 355017, Россия, Ставрополь, ул. Мира, д. 310. E-mail: yubykov@gmail.com
28 октября 2021
Количество просмотров: 1368

