Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2013
Биполярное аффективное расстройство типа II: особенности клиники и возможности комплексной терапии, включающей Вальдоксан №03 2013
Номера страниц в выпуске:24-32
Резюме. С целью изучения клинических особенностей депрессии у больных биполярным аффективным расстройством (БАР) типа II с оценкой эффективности комплексной терапии, включающей Вальдоксан, обследованы 30 пациентов до и после лечения (7-недельное наблюдение). Установлена атипичность депрессии, отмечена хорошая переносимость терапии Вальдоксаном, показана возможность купирования тревожного спектра депрессивных расстройств в рамках БАР типа II уже в первые 2 нед лечения, что способствует включению пациентов в групповую психотерапию, повышая комплаенс. Необходимо обратить внимание и на нормотимическое действие Вальдоксана, что может быть связано с его ресинхронизирующим эффектом.
Ключевые слова: депрессия при биполярном аффективном расстройстве типа II, Вальдоксан.
Bipolar affective disorder type II: clinical features and the possibility of the treatment, including agomelatine
E.Yu.Antokhin1, E.A.Harina1,2
1Orenburg State Medical Academy; 2Orenburg Regional Clinical Psychiatric Hospital №1
Summary. In order to study the clinical features of depression in patients with bipolar disorder (BD) type II with the performance evaluation of complex therapy including agomelatine, 30 patients were examined before and after treatment (7-week follow-up). Set atypical depression, therapy was well tolerated agomelatine, the possibility of range anxiety relief of depressive disorders in the BD type II in the first two weeks of treatment, which promotes the inclusion of patients in group therapy, increasing compliance. Must pay attention to the normothymic effect of agomelatine that may be related to his resynchronization effect.
Key words: depression at bipolar disorder type II, agomelatine.
Введение
Биполярное аффективное расстройство (БАР) типа II было признано в качестве самостоятельной диагностической категории в Американской классификации психических расстройств 4-го пересмотра (DSM-IV) [21, 30]. В существующей Международной классификации болезней 10-го пересмотра (МКБ-10) данная категория упоминается в кластере F31.8 «другие биполярные аффективные расстройства», но без диагностических указаний [14]. Согласно DSM-IV для диагностики БАР типа II необходимо наличие в настоящем состоянии и/или в анамнезе одного или нескольких тяжелых депрессивных эпизодов и по крайней мере одного эпизода гипомании длительностью не менее 4 дней [30, 61].
Термин БАР типа II впервые был использован около 35 лет назад, чтобы дифференцировать пациентов с рекуррентными депрессивными эпизодами и гипоманией от пациентов с классической картиной БАР в понимании термина «маниакально-депрессивный психоз»: наличие тяжелых (психотических) депрессивных и маниакальных фаз, которое было обозначено как БАР типа I [6, 11, 46, 95]. Проведенные исследования показали не только клинические, но и патогенетические различия 2 вариантов БАР, включая как биологические факторы (наследственность [45, 94], биохимические [62] и нейрофизиологические различия [28, 64]), так и психологические (пато-, нейро-, социопсихологические [70, 86, 88, 93, 94]).
В силу преобладания в клиническом течении депрессивных эпизодов при практически полном отсутствии обращения пациентов за помощью в периоды гипомании БАР типа II чаще всего диагностируется в рамках рекуррентной депрессии [37, 38, 43, 69, 81]. Так, ряд зарубежных исследований показал, что между первичным обращением к психиатру и правильной постановкой диагноза проходит в среднем 12 лет, в то время как для БАР типа I этот срок составляет 7 лет, а для униполярной депрессии – 3,3 года [50, 51]. Сложность постановки диагноза также связана с некоторой долей субъективности в оценке симптомов гипомании, которые не всегда могут приводить к заметному ухудшению социального функционирования, а иногда, хотя и на короткий период времени, и улучшать его [35–37, 42, 52]. Например, удачные авантюры, рискованные финансовые операции с поверхностной оценкой последствий неудач и известной долей везения и т.п., что может быть особенно характерно для периодов социальных кризисов [11, 12, 77].
Существует немало доказательств сопоставимости нарушений социальной адаптации и риска суицида у больных БАР типов I и II, а ряд исследований обозначает больший риск суицидальных действий у больных БАР типа II [58, 59, 82, 83, 89, 91]. Кроме того, в силу недостаточной диагностики БАР типа II, а также использования в терапии больных в момент тяжелого депрессивного эпизода трициклических антидепрессантов (ТЦА) показана большая склонность БАР типа II к быстроциклическому течению [40, 84, 85], развитию резистентности к терапии [67, 80, 90], большей частоте коморбидности – как психопатологической, так и соматической [26, 71, 89]. Предположения же о том, что БАР типа II является «мягкой» разновидностью БАР типа I, не подтвердились [58–60, 87, 89, 92].
Недостаточная диагностика БАР типа II обусловливает и трудности его терапии [1, 6, 56, 65]. Причем в фармакотерапии, особенно депрессивного эпизода в рамках БАР, существуют нередко противоречивые подходы [6, 11, 24]. Одни исследования показывают полезность монотерапии антидепрессантами периода депрессии при БАР [25, 32, 79], другие рекомендуют с учетом риска развития инверсии аффекта «прикрытие» антидепрессивной терапии нормотимиками [40, 67, 69, 72] или атипичными нейролептиками [12, 39]. Большинство исследований показывает нецелесообразность использования в лечении депрессии в рамках БАР ТЦА [27, 41], отдавая предпочтение высокоселективным антидепрессантам [25, 29, 57]. Эффективность последнего подхода (нормотимик и антидепрессант из группы селективных ингибиторов обратного захвата серотонина – СИОЗС) при БАР типа I получает все больше доказательств. В то же время существует ряд доказательных исследований монотерапии пациентов с БАР типа II антидепрессантами флуоксетином [31, 32], венлафаксином [33, 34] и циталопрамом [79]. При этом показано, что применение высокоселективных антидепрессантов не повышает риск развития инверсии аффекта [10, 29, 57]. Тем не менее исследований лечения пациентов с депрессией в рамках БАР типа II, в частности антидепрессантами нового поколения, в России явно недостаточно. В особенности это касается относительно нового антидепрессанта с уникальным механизмом действия – Вальдоксана.
Вальдоксан (агомелатин) – агонист MT1- и МТ2-рецепторов мелатонина и антагонист 5НТ2С-серотониновых рецепторов. В механизме действия он объединяет нейроэндокринные и моноаминергические механизмы. За счет антагонизма к 5НТ2С-рецепторам он повышает уровень в префронтальной коре норадреналина и дофамина (лечение депрессии с синдромом дефицита норадреналина и дофамина), а стимуляция мелатонинергической передачи способствует усилению антидепрессивного эффекта, анксиолитическому действию, а также восстанавливает координированную работу нарушенных циркадных ритмов и сон. Вальдоксан не повышает внеклеточные уровни серотонина, в связи с чем не вызывает побочных эффектов, свойственных СИОЗС (тошнота, диарея, половые дисфункции, диссомния). Кроме того, Вальдоксан не обладает аффинитетом к гистаминергическим Н1-, a1-адренергическим и мускариновым рецепторам, поэтому не вызывает побочных эффектов, характерных для ТЦА [8, 9, 19, 24, 44, 54, 75]. Длительный прием ряда антидепрессантов уменьшает уязвимость мозга к стрессу, повышает нейропластичность гиппокампально-амигдалярных мозговых структур, усиливая выработку нейротрофических мозговых факторов (BDNF, CREB). На настоящий момент подобные механизмы действия описаны для ТЦА, ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН), тианептина и Вальдоксана [15, 20, 73].
В плацебо-контролируемых исследованиях с подбором терапевтических дозировок было показано, что рекомендуемая дозировка Вальдоксана при терапии депрессии составляет 25 мг/сут, с повышением при необходимости до 50 мг/сут [19, 63, 68, 78]. Несмотря на сравнительно недавнее появление, Вальдоксан уже подвергся довольно активному клиническому исследованию. Так, его эффективность показана при лечении большого депрессивного расстройства [19, 24, 54, 63, 66, 68, 75, 78] и для предотвращения рецидивов при нем [53, 76], в том числе в сравнительных исследованиях c венлафаксином [66] и пароксетином [68], умеренных и тяжелых непсихотических депрессий в амбулаторной и стационарной практике [4, 8, 9, 18, 44], при БАР [10, 13, 18, 19, 23, 68], но без дифференцировки групп пациентов на разновидности БАР, проведен фармакоэкономический анализ в сравнении с препаратами СИОЗС, ИОЗСН, НаССа [7].
Хронобиологическая гипотеза развития БАР является одной из наиболее базисно объясняющих механизмы патогенеза БАР [16, 17]. Для БАР характерны сезонное течение с наибольшим количеством обострений в весенне-осенний период, нарушения суточных ритмов, секреции мелатонина и, соответственно, цикла «сон–бодрствование» [6, 11, 73]. В ряде исследований показано, что у больных с БАР имеются нарушения и социальных ритмов [5, 22, 49, 55, 74], на основе которых разработана социально-ритмическая психотерапия [47, 48]. В связи с этим исследования эффективности терапии в реальной практике Вальдоксаном больных с БАР типа II с его ресинхронизирующим эффектом представляют несомненный интерес.
Цель исследования – изучить клинические особенности депрессии у больных БАР типа II с оценкой эффективности комплексной терапии, включающей Вальдоксан.
Материалы и методы
В исследовании приняли участие 30 пациентов в возра-сте от 21 до 45 лет (средний возраст 31,7±6,2 года), в том числе 21 женщина и 9 мужчин. Включены пациенты с диагнозом БАР типа II (F31.8 МКБ-10 – «другие БАР»), дополненные критериями DSM-IV:
1) наличие в анамнезе и/или в настоящем статусе тяжелого депрессивного эпизода, отвечающего критериям МКБ-10: депрессивный эпизод должен длиться по крайней мере 2 нед, присутствует снижение интересов или снижение удовольствия от деятельности, обычно приятной для больного, отсутствуют реакции на события или деятельность, которые в норме ее вызывают, пробуждение утром за 2 ч или более до обычного времени, депрессия тяжелее по утрам, объективные свидетельства заметной психомоторной заторможенности или ажитации, заметное снижение аппетита, снижение массы тела (5% или более от массы тела в прошлом месяце), заметное снижение либидо;
2) наличие в анамнезе и/или в настоящем статусе гипоманиакального эпизода, отвечающего критериям МКБ-10: повышенное или раздражительное настроение, которое является явно анормальным для данного индивидуума и сохраняется по меньшей мере 4 дня подряд; должны быть представлены минимум 3 симптома из числа следующих, что сказывается на личностном функционировании в повседневной жизни: повышенная активность или физическое беспокойство, повышенная говорливость, затруднения в сосредоточении внимания или отвлекаемость, сниженная потребность во сне, повышение сексуальной энергии, небольшие кутежи или другие типы безрассудного или безответственного поведения, повышенная общительность или фамильярность.
Исключались пациенты в периоде беременности и лактации, с коморбидностью с шизофренией и расстройствами шизофренического спектра, алкоголизмом, наркоманией, деменцией, тяжелыми соматическими заболеваниями в фазе декомпенсации (почечная, печеночная, сердечная недостаточность, неконтролируемая гипергликемия), принимающие флувоксамин, ципрофлоксацин (сильные ингибиторы CYP1A2) в течение 2 нед, предшествующих включению в исследование. Состояние пациентов оценивалось клинико-психопатологическим методом с применением синдромального опросника SCL-90R [62] на 3, 7, 14, 21, 28, 35, 42, 49-й дни терапии. Все включенные пациенты закончили исследование к 49-му дню; 80% пациентов имели опыт приема ТЦА, 70% – ранее получали лечение селективными антидепрессантами (СИОЗС, СИОЗСН). Только 2 (6,7%) из обследуемых, которых вели как пациентов с личностными расстройствами, получали ранее нормотимик (карбамазепин). Из анамнестических сведений исследуемого контингента больных известно о преимущественно полиморфной картине всех предыдущих депрессивных эпизодов с затяжным и резистентным к терапии характером расстройств, постепенным укорочением «светлых промежутков» (интермиссий).
Следует отметить значительный удельный вес наследственной отягощенности в исследуемой группе (в 45% случаев – маниакально-депрессивное заболевание с депрессивным типом течения, в 24% – алкоголизм с суицидальными попытками, в 3% случаев – параноидная форма шизофрении). Заболевание впервые возникло в возрасте от 18 до 27 лет, в среднем в 23 года. У 64% пациентов имелись указания на алкоголизацию в анамнезе и эпизодическое употребление психоактивных веществ без сформированного синдрома зависимости. Более 50% пациентов прибегали к несистемному, но частому приему транквилизаторов, преимущественно бензодиазепинов, без назначения врача нередко при легкой тревоге. Очевидно, что указанные явления возникли как результат недостаточной психотерапии пациентов во время предыдущих госпитализаций, низкой комплаентности в отношении антидепрессантов, связанной в том числе с побочными действиями (особенно ТЦА). Эти пациенты также были оценены как угрожаемые по формированию резистентности к последующей терапии.
Статистическая оценка сдвига показателей проводилась с помощью непараметрического W-критерия согласованных пар для зависимых выборок Вилкоксона на основе программной системы Statistica for Windows (версия 7.0).
В качестве значимых принимались результаты со степенью достоверности не ниже 95% (p<0,05).
Результаты и обсуждение
Отличительной особенностью всех случаев на момент исследования являлась атипичная картина депрессии с отсутствием идеомоторной заторможенности, но с выраженной тревогой, обсессивно-фобическими симптомами (рис. 1), повышенной двигательной активностью, но преимущественно малопродуктивной. У части пациентов (17 человек – 67,7%) имели место явления инверсии аффекта в течение дня до нескольких часов, когда пациенты отмечали внезапное ощущение «прилива сил», «дополнительной энергии» со стремлением к общению, с веселостью, «душевным подъемом». По выражению одной из пациенток, «наступало просветление», «возникала уверенность, что я со всем справлюсь, что моя болезнь несерьезная, хотелось попросить о выписке, выйти на работу», вместе с тем ближе к вечеру больными отмечалось нарастание тревоги, беспокойства, неусидчивости либо резкой слабости, подавленности настроения с чувством опустошения, безрадостности, безнадежности. В 50% таких случаев наблюдалось резкое повышение аппетита с выраженным чувством голода. У 8 (26,7%) пациентов с самого начала на первый план выступало сочетание тревожных и дисфорических проявлений с конфликтными ситуациями с другими пациентами и персоналом, несоблюдением режима приема препаратов. С данным контингентом пациентов (нонкомплаентные) проводилась более тщательная индивидуальная психотерапевтическая работа в рамках комплаенс-терапии. Атипизм депрессивных эпизодов проявлялся как в анамнезе, так и во время текущего депрессивного эпизода, в повышении аппетита, прибавке массы тела, нарушении пищевого поведения в виде чрезмерного употребления сладостей, десертов, особенно шоколада, причем наблюдалось это преимущественно в вечернее время суток на фоне гипотимии.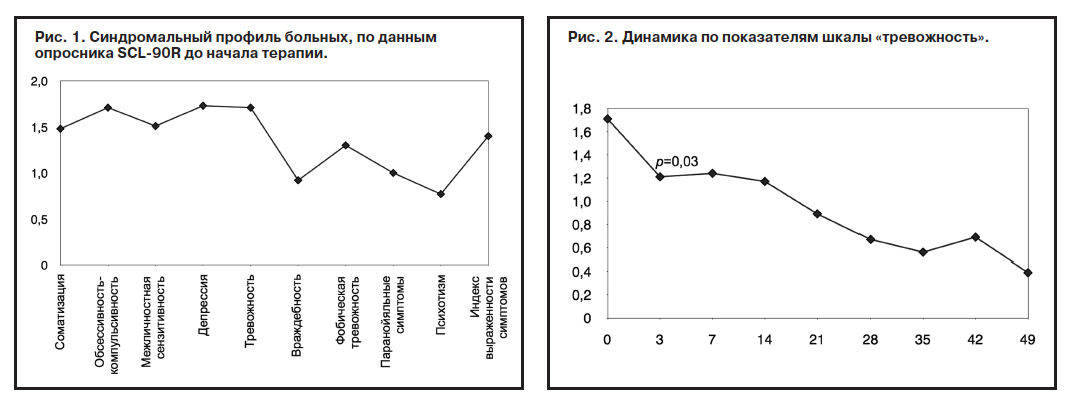
У большинства пациентов (26 человек – 86,8%) имела место сонливость в течение всего дня с трудностями пробуждения, тягостным ощущением усталости и разбитости, отсутствием субъективной удовлетворенности сном.
У остальных наблюдалась бессонница с ранними пробуждениями, чутким, поверхностным сном.
Применяемая нами комбинация комплаенс-терапии и фармакотерапии показала свою эффективность уже с первых дней ведения пациентов, особенно в отношении проявлений тревоги, что было подтверждено достоверным снижением показателей соответствующей шкалы опросника SCL-90R к 3-му дню лечения (рис. 2): «тревога» (c 1,71 до 1,21; р=0,03), а также, хотя и недостоверным, снижением показателей других шкал.
Клинически это проявлялось в заметном снижении тревоги в течение дня и в процессе межличностного общения, некоторой стабилизации соматовегетативных и суточных колебаний. Нормализация сна отмечалась всеми пациентами, у некоторых из них сохранялись единичные ночные пробуждения с последующим засыпанием, также субъективно пациенты указывали на повышение удовлетворенности качеством ночного сна.
К 7-му дню терапии у пациентов сохранялась тревожно-депрессивная симптоматика, но менее выраженная, чем в самом начале терапии. Установление доверительного контакта с лечащим врачом, адаптация к режиму отделения, улучшение комплаенса способствовало уменьшению разных опасений, тревожности, что отражают показатели шкал опросника SCL-90R: достоверное снижение по шкале «фобическая тревога» (с 1,3 до 0,71; р=0,04; рис. 3) и относительное снижение по шкале «враждебность» (рис. 4).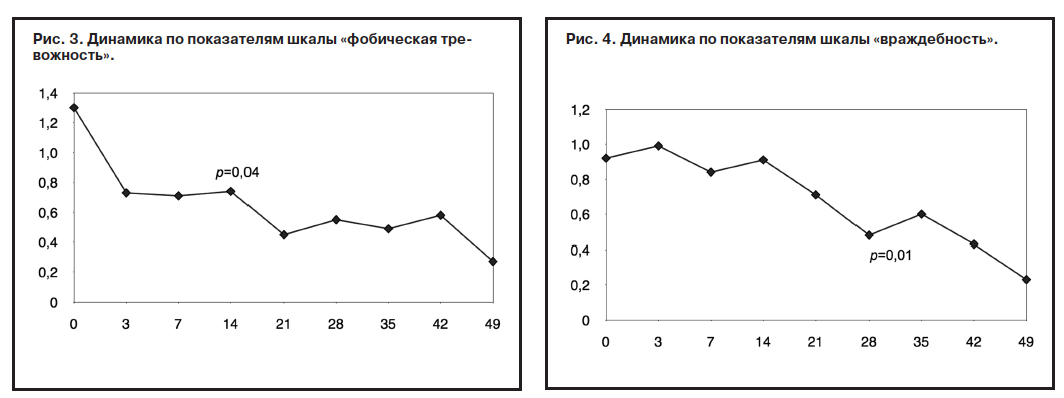
С 7-го дня терапии все пациенты были включены в тренинговую психотерапевтическую группу. Столь раннему началу активной психотерапевтической работы способствовали помимо заметного клинического улучшения статуса пациентов минимальные (у части пациентов отсутствовали) побочные действия получаемой фармакотерапии. На 1-м этапе групповых тренингов (информационно-обучающем) больные направлялись в открытую группу, где широко использовалась информационно-образовательная работа с интерактивным разбором причин ухудшения состояния. На части занятий в доступной форме разбирались анатомо-физиологические и биохимические механизмы развития депрессий, гипоманиакальных состояний, важность своевременного выявления последних для назначения адекватной терапии, предотвращающей формирование затяжного течения, быстроциклических форм, роль современных препаратов с разбором причин их побочных действий, последствия бессистемного приема транквилизаторов. На 2-м этапе больные включались в закрытую группу специализированных тренингов, в частности, в тренинг анализа ситуации (ТАС) и копингориентированный тренинг (КОТ). Более подробная информация по общим принципам групповой психотерапии больных с депрессией в Оренбургская областная клиническая психиатрическая больница №1 отражена в части предыдущих наших публикаций [2–4]. В структуру ТАС и КОТ именно для больных с БАР типа II, при которых нередко нарушены циркадианные и социальные ритмы, были интегрированы занятия, направленные на выработку поведенческих стратегий, регулирующих социальные ритмы, с преодолением ситуаций возникновения межличностных проблем, вызывающих аффективную дестабилизацию (аналог межличностной и социально-ритмической терапии [47, 48]).
Статистически значимых различий показателей по шкалам опросника SCL-90R между 7 и 14-м днем терапии не отмечено. Тем не менее наблюдалось небольшое повышение показателей шкал «обсессивность-компульсивность», «межличностная сензитивность», «депрессивность» и «враждебность», что можно объяснить началом более интенсивной работы в тренинговой группе с интерактивным разбором причин ухудшения состояния и, следовательно, актуализацией психотравмирующих ситуаций и, безусловно, групповой динамикой.
К концу 3-й недели терапии (21-й день) имели место статистически достоверные сдвиги по следующим шкалам опросника SCL-90R (рис. 5–7): «соматизация» (с 1,48 до начала лечения до 0,91; р=0,00), «индекс выраженности симптомов» (с 1,40 до 0,88; р=0,01) и «обсессивность-компульсивность» (с 1,71 до 1,18; р=0,00).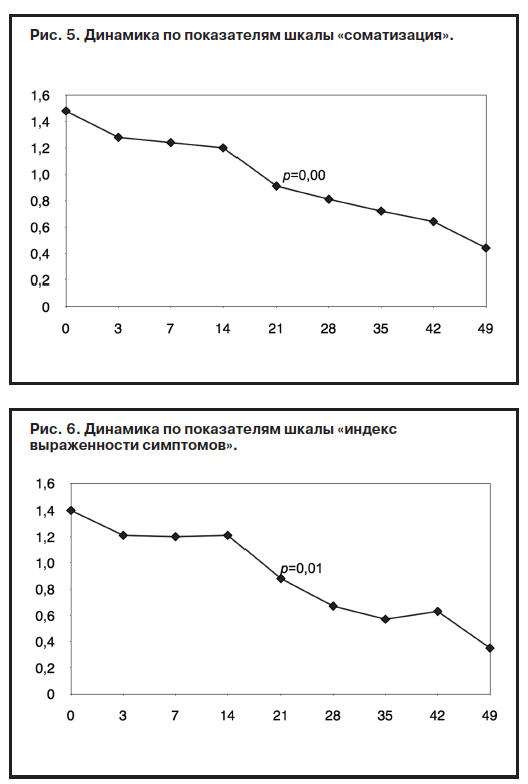
Ригидность структуры аффекта в начале лечения с нередким недоверием к терапии, ее эффективности объяснялась отчасти дисфорическим содержанием статуса, который выходил на первый план по мере снижения тревоги и нашел отражение в показателях опросника SCL-90R. Согласно полученным данным показатель «паранойяльные симптомы» (отражение ригидности, консерватизма при непсихотических проявлениях) оказался наименее динамичным в процессе терапии, и относительное снижение показателей по этой шкале произошло только к 21-му дню лечения.
При анализе показателей опросника по лечению с 14-го по 35-й день наблюдения были получены следующие данные (рис. 8).
Имело место снижение интенсивности всех показателей симптоматической конфигурации, но статистически достоверно отмечено снижение по шкалам «соматизация», «индекс выраженности симптомов» и «обсессивность-компульсивность» к 21-му дню лечения, а по шкалам «депрессия», «враждебность» и «межличностная тревожность» (рис. 3, 4, 9) – к 28-му дню терапии: «депрессия» (с 1,73 до 0,87; р=0,01), «враждебность» (с 0,92 до 0,48; р=0,01), «межличностная сензитивность» (с 1,51 до 0,79; р=0,01) (рис. 10). Можно отметить относительную ригидность показателей «фобической тревоги» (рис. 3) и «враждебности» (рис. 4) в период с 14-го по 35-й день лечения. По-видимому, при терапии Вальдоксаном анксиолитическое действие препарата связано с эффектами нейропластичности [23, 35, 36, 38], в частности, повышением клеточной пролиферации и нейрогенеза в зубчатой извилине головного мозга – участка, который участвует в обработке эмоций [45], что требует более продолжительной антидепрессивной терапии, особенно при депрессии с признаками резистентности.
К 49-му дню терапии снижение по всем шкалам опросника SCL-90R наблюдалось более чем на 70%, что объективно отмечалось в статусе. Прежде всего практически нормализовалось настроение, восстановился цикл «сон–бодрствование», улучшилась социальная активность (лечебные отпуска и перевод на дневной стационар уже с 3-й недели терапии). В результате повысился уровень приверженности пациентов продолжению терапии Вальдоксаном на амбулаторном этапе. Следует отметить и нормотимический эффект препарата у пациентов с нестабильностью суточной динамики аффекта, что, по-видимому, связано с ресинхронизирующим влиянием Вальдоксана.
Далее приводится история болезни пациента с БАР
типа II на терапии Вальдоксаном.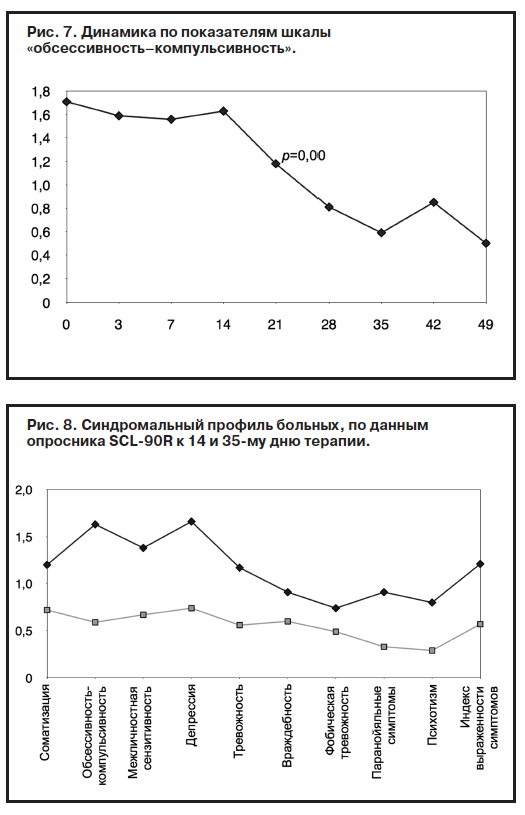
Клинический случай
Пациент С. 30 лет поступает впервые. Явных указаний на отягощенную наследственность нет, но дед по материнской линии отличался высокой активностью в молодом и зрелом возрасте, затем к 40 годам стал злоупотреблять алкоголем, умер в 52 года от инфаркта. Обследуемый родился первым и единственным ребенком при нормальной беременности и родах у матери-одиночки. Развитие в раннем периоде без особенностей. Жил и воспитывался до юношеских лет у бабушки по материнской линии, которая отличалась мягким нравом, была ласковой, заботливой. Мать периодически жила с ними или отдельно с отчимом, по характеру спокойная, но достаточно строгая, «могла задавить авторитетом». Посещал детский сад. В школу пошел с 7 лет, учился удовлетворительно, проявлял интерес к точным наукам, со сверстниками и преподавателями имел ровные отношения. Охотно участвовал в проведении школьных вечеров, предпочитал находиться в центре внимания, занимался в танцевальном, театральном кружках, пользовался успехом у ровесниц. Через год после окончания 11-го класса поступил на экономический факультет Современной гуманитарной академии, который окончил в 2007 г., параллельно успешно работал в шинном центре менеджером до июля 2010 г. С 2003 г. встречался с девушкой, жили в гражданском браке. В армии не служил из-за плоскостопия. По характеру описывает себя общительным, ранимым, мнительным, принимающим все близко к сердцу, эмоциональным.
С января 2009 г. после смерти воспитавшей его бабушки отмечал некоторую подавленность настроения, которое нормализовалось к февралю. В октябре 2009 г. внезапно без видимых внешних причин стал чрезмерно брезгливым, часто мыл руки, неоднократно перепроверял, выключен ли газ, закрыта ли дверь, безопасно ли лежат шнуры на полу, через некоторое время частота этих действий возросла и стала мешать выполнению обязанностей на работе (многократно перепроверял счета, цифры), «голова была забита только этим», стал рассеянным, подавленным, невнимательным, забывчивым, несобранным, было сниженным настроение. По совету коллег обращался к знахарке, принимал по ее назначению амитриптилин в малых дозах: состояние улучшилось, практически полностью исчезли навязчивости, нормализовалось настроение, стал «прежним».
В апреле 2010 г., через месяц после окончания приема амитриптилина, отмечал значительный подъем настроения, активности, «сделался как энерджайзер», стал меньше спать, для отдыха хватало 2–3 ч в сутки, был повышенным аппетит, стал более неутомим, выносливее обычного. На этом фоне принял решение о покупке дорогостоящей недостроенной дачи на деньги, полученные по наследству от бабушки. Затем дополнительно взял кредит на строительство, бросил работу, подрабатывал на такси в ночное время, некоторое время работал на фирме у друга. Со стороны друзей неоднократно слышал в свой адрес похвалу, понял, что началась «новая светлая полоса в жизни». К концу августа состояние стало изменяться – осознал необдуманность ряда решений, снизилось настроение, переживал, что не сможет выплатить кредит, стал плаксивым, апатичным, ничем не хотел заниматься, лежал целыми днями дома. Затем нарушился сон, пропал аппетит, стали появляться мысли о нежелании жить, тяготился одиночеством, так как в это время еще больше одолевали мысли сожаления, самообвинения, самобичевания, стал меньше следить за внешним видом. Потерял в массе тела около 10 кг. Возникла упорная бессонница. Обратился к психотерапевту, начал прием паксила до 60 мг/сут, через 3 нед лечения отметил некоторое облегчение состояния. Прекратил прием препарата самостоятельно, так как считал, что «будет зависимость», появился плохо контролируемый аппетит и «возникали проблемы при интимных контактах». Вновь возникло ощущение «прилива энергии», строил планы на будущее по открытию собственного бизнеса по продаже шин, пытался переоформить кредит. Затем на фоне нескольких отказов банков по предоставлению кредита вновь ухудшилось настроение, возникла бессонница. Тем не менее отмечал несколько эпизодов в течение дня, во время которых на 1–2 ч чувствовал прилив сил, «желание жить», которые затем сменялись безразличием к себе, своей жизни. Обратился к психотерапевту и был направлен в отделение неврозов ГБУЗ ОрОКПБ №1.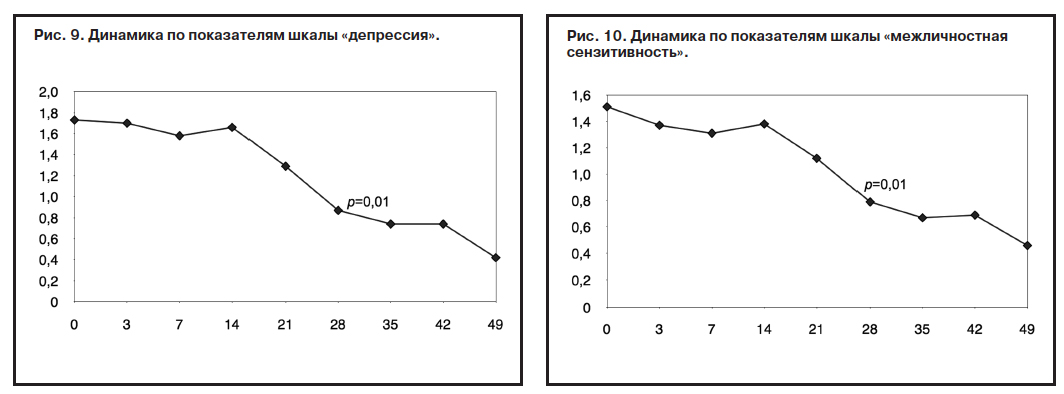
Психический статус. В ясном сознании. Верно ориентирован во времени, в месте и собственной личности. Контакту доступен. Вступает в беседу с заметным волнением. На вопросы часто отвечает быстрыми фразами, суетлив, неусидчив. Выражение лица несколько озабоченное. Несмотря на предъявление жалоб на выраженную подавленность, тяжесть в груди, мысли о нежелании жить, периодически улыбается, при этом отмечает, что за последние дни стал чувствовать себя лучше. Сам это связывает с беседой с психотерапевтом до поступления («он сказал, что здесь мне помогут, у меня появилась надежда»). На вопросы отвечает по существу, но часто путается в последовательности событий. Мимика выразительная. Внимание с трудностями концентрации, память без грубых нарушений. Мышление последовательное, без патологической психопродукции. Эмоциональные реакции выразительные. Суицидальные мысли отрицает. Охотно соглашается на лечение.
Назначено лечение Вальдоксаном 25 мг/сут. С 1-го дня терапии отмечал улучшение сна, снижение тревоги. К 3-му дню обратился с просьбой о переводе на дневной стационар, которая была удовлетворена. Посещал регулярно групповые занятия, был на них достаточно активным. Отметил преимущества Вальдоксана перед предыдущими препаратами: отсутствие седации при полноценном сне, возможность управлять автомобилем, отсутствие повышения аппетита (стал тщательно следить за внешним видом).
Катамнез в течение 8 мес: вернулся на прежнее место работы, снимает квартиру, познакомился с девушкой, поддерживает с ней отношения. Договорился с банком по реструктуризации задолженности. При этом продолжает прием Вальдоксана, отмечает его стабилизирующее влияние на настроение («стало меньше раскачки»), посещает сеансы индивидуальной когнитивной психотерапии с освоением методик планирования деятельности.
Обсуждение. Особенностью данного клинического случая является в первую очередь атипизм депрессивных расстройств в виде наличия в дебюте заболевания обсессивно-компульсивной симптоматики, которая достаточно быстро купировалась малыми дозами амитриптилина. По нашим данным [39], появление навязчивых мыслей в дебюте БАР типа II может указывать на гипоманиакальный эквивалент идеаторной сферы без активизации на этот период позитивного аффекта. А быстрый ответ на терапию, обычно устойчивой к ТЦА обсессивной симптоматики, обусловлен ведущей аффективной симптоматикой. В дальнейшем обсессивных проявлений не наблюдалось, в структуре депрессии преобладал тревожный аффект, который приобрел выраженный тоскливо-адинамический характер. Также отмечен четкий гипоманиакальный эпизод с легкостью принятия решений, смены планов, гиперактивностью. Данный случай показателен и тем, что ближайшее окружение не отметило патологичности гипоманиакального аффекта, а все обращения за помощью были связаны с депрессией. Еще одним признаком биполярности аффекта при депрессии является быстрый ответ на терапию паксилом при достаточно тяжелой депрессии с нарушениями витальности. Отсутствие побочных действий у Вальдоксана с хорошим ответом на терапию способствовало формированию комплаенса на его долгосрочный прием с улучшением состояния и стабилизацией социального статуса.
Диагноз: БАР типа II, текущий эпизод умеренной депрессии.
Таким образом, комплексная терапия больных БАР типа II, включающая Вальдоксан, показала свою эффективность. Отмечена хорошая переносимость терапии Вальдоксаном, показана возможность купирования тревожного спектра депрессивных расстройств в рамках БАР типа II уже в первые 2 нед лечения, что способствует включению пациентов в групповую психотерапию, повышая комплаенс. Необходимо обратить внимание и на нормотимическое действие Вальдоксана, что может быть связано с его ресинхронизирующим эффектом. Для достижения более качественной интермиссии при БАР типа II необходима длительная поддерживающая терапия Вальдоксаном, что, вероятно, также обусловлено эффектами нейропластичности.
Сведения об авторах
Антохин Евгений Юрьевич – канд. мед. наук, доц. каф. психиатрии, медицинской психологии ГБОУ ВПО ОрГМА Минздрава РФ. E-mail: antioh73@yandex.ru
Харина Екатерина Александровна – заочный аспирант каф. психиатрии, медицинской психологии ГБОУ ВПО ОрГМА Минздрава РФ, врач-психотерапевт ГБУЗ ОрОКПБ №1
Ключевые слова: депрессия при биполярном аффективном расстройстве типа II, Вальдоксан.
Bipolar affective disorder type II: clinical features and the possibility of the treatment, including agomelatine
E.Yu.Antokhin1, E.A.Harina1,2
1Orenburg State Medical Academy; 2Orenburg Regional Clinical Psychiatric Hospital №1
Summary. In order to study the clinical features of depression in patients with bipolar disorder (BD) type II with the performance evaluation of complex therapy including agomelatine, 30 patients were examined before and after treatment (7-week follow-up). Set atypical depression, therapy was well tolerated agomelatine, the possibility of range anxiety relief of depressive disorders in the BD type II in the first two weeks of treatment, which promotes the inclusion of patients in group therapy, increasing compliance. Must pay attention to the normothymic effect of agomelatine that may be related to his resynchronization effect.
Key words: depression at bipolar disorder type II, agomelatine.
Введение
Биполярное аффективное расстройство (БАР) типа II было признано в качестве самостоятельной диагностической категории в Американской классификации психических расстройств 4-го пересмотра (DSM-IV) [21, 30]. В существующей Международной классификации болезней 10-го пересмотра (МКБ-10) данная категория упоминается в кластере F31.8 «другие биполярные аффективные расстройства», но без диагностических указаний [14]. Согласно DSM-IV для диагностики БАР типа II необходимо наличие в настоящем состоянии и/или в анамнезе одного или нескольких тяжелых депрессивных эпизодов и по крайней мере одного эпизода гипомании длительностью не менее 4 дней [30, 61].
Термин БАР типа II впервые был использован около 35 лет назад, чтобы дифференцировать пациентов с рекуррентными депрессивными эпизодами и гипоманией от пациентов с классической картиной БАР в понимании термина «маниакально-депрессивный психоз»: наличие тяжелых (психотических) депрессивных и маниакальных фаз, которое было обозначено как БАР типа I [6, 11, 46, 95]. Проведенные исследования показали не только клинические, но и патогенетические различия 2 вариантов БАР, включая как биологические факторы (наследственность [45, 94], биохимические [62] и нейрофизиологические различия [28, 64]), так и психологические (пато-, нейро-, социопсихологические [70, 86, 88, 93, 94]).
В силу преобладания в клиническом течении депрессивных эпизодов при практически полном отсутствии обращения пациентов за помощью в периоды гипомании БАР типа II чаще всего диагностируется в рамках рекуррентной депрессии [37, 38, 43, 69, 81]. Так, ряд зарубежных исследований показал, что между первичным обращением к психиатру и правильной постановкой диагноза проходит в среднем 12 лет, в то время как для БАР типа I этот срок составляет 7 лет, а для униполярной депрессии – 3,3 года [50, 51]. Сложность постановки диагноза также связана с некоторой долей субъективности в оценке симптомов гипомании, которые не всегда могут приводить к заметному ухудшению социального функционирования, а иногда, хотя и на короткий период времени, и улучшать его [35–37, 42, 52]. Например, удачные авантюры, рискованные финансовые операции с поверхностной оценкой последствий неудач и известной долей везения и т.п., что может быть особенно характерно для периодов социальных кризисов [11, 12, 77].
Существует немало доказательств сопоставимости нарушений социальной адаптации и риска суицида у больных БАР типов I и II, а ряд исследований обозначает больший риск суицидальных действий у больных БАР типа II [58, 59, 82, 83, 89, 91]. Кроме того, в силу недостаточной диагностики БАР типа II, а также использования в терапии больных в момент тяжелого депрессивного эпизода трициклических антидепрессантов (ТЦА) показана большая склонность БАР типа II к быстроциклическому течению [40, 84, 85], развитию резистентности к терапии [67, 80, 90], большей частоте коморбидности – как психопатологической, так и соматической [26, 71, 89]. Предположения же о том, что БАР типа II является «мягкой» разновидностью БАР типа I, не подтвердились [58–60, 87, 89, 92].
Недостаточная диагностика БАР типа II обусловливает и трудности его терапии [1, 6, 56, 65]. Причем в фармакотерапии, особенно депрессивного эпизода в рамках БАР, существуют нередко противоречивые подходы [6, 11, 24]. Одни исследования показывают полезность монотерапии антидепрессантами периода депрессии при БАР [25, 32, 79], другие рекомендуют с учетом риска развития инверсии аффекта «прикрытие» антидепрессивной терапии нормотимиками [40, 67, 69, 72] или атипичными нейролептиками [12, 39]. Большинство исследований показывает нецелесообразность использования в лечении депрессии в рамках БАР ТЦА [27, 41], отдавая предпочтение высокоселективным антидепрессантам [25, 29, 57]. Эффективность последнего подхода (нормотимик и антидепрессант из группы селективных ингибиторов обратного захвата серотонина – СИОЗС) при БАР типа I получает все больше доказательств. В то же время существует ряд доказательных исследований монотерапии пациентов с БАР типа II антидепрессантами флуоксетином [31, 32], венлафаксином [33, 34] и циталопрамом [79]. При этом показано, что применение высокоселективных антидепрессантов не повышает риск развития инверсии аффекта [10, 29, 57]. Тем не менее исследований лечения пациентов с депрессией в рамках БАР типа II, в частности антидепрессантами нового поколения, в России явно недостаточно. В особенности это касается относительно нового антидепрессанта с уникальным механизмом действия – Вальдоксана.
Вальдоксан (агомелатин) – агонист MT1- и МТ2-рецепторов мелатонина и антагонист 5НТ2С-серотониновых рецепторов. В механизме действия он объединяет нейроэндокринные и моноаминергические механизмы. За счет антагонизма к 5НТ2С-рецепторам он повышает уровень в префронтальной коре норадреналина и дофамина (лечение депрессии с синдромом дефицита норадреналина и дофамина), а стимуляция мелатонинергической передачи способствует усилению антидепрессивного эффекта, анксиолитическому действию, а также восстанавливает координированную работу нарушенных циркадных ритмов и сон. Вальдоксан не повышает внеклеточные уровни серотонина, в связи с чем не вызывает побочных эффектов, свойственных СИОЗС (тошнота, диарея, половые дисфункции, диссомния). Кроме того, Вальдоксан не обладает аффинитетом к гистаминергическим Н1-, a1-адренергическим и мускариновым рецепторам, поэтому не вызывает побочных эффектов, характерных для ТЦА [8, 9, 19, 24, 44, 54, 75]. Длительный прием ряда антидепрессантов уменьшает уязвимость мозга к стрессу, повышает нейропластичность гиппокампально-амигдалярных мозговых структур, усиливая выработку нейротрофических мозговых факторов (BDNF, CREB). На настоящий момент подобные механизмы действия описаны для ТЦА, ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН), тианептина и Вальдоксана [15, 20, 73].
В плацебо-контролируемых исследованиях с подбором терапевтических дозировок было показано, что рекомендуемая дозировка Вальдоксана при терапии депрессии составляет 25 мг/сут, с повышением при необходимости до 50 мг/сут [19, 63, 68, 78]. Несмотря на сравнительно недавнее появление, Вальдоксан уже подвергся довольно активному клиническому исследованию. Так, его эффективность показана при лечении большого депрессивного расстройства [19, 24, 54, 63, 66, 68, 75, 78] и для предотвращения рецидивов при нем [53, 76], в том числе в сравнительных исследованиях c венлафаксином [66] и пароксетином [68], умеренных и тяжелых непсихотических депрессий в амбулаторной и стационарной практике [4, 8, 9, 18, 44], при БАР [10, 13, 18, 19, 23, 68], но без дифференцировки групп пациентов на разновидности БАР, проведен фармакоэкономический анализ в сравнении с препаратами СИОЗС, ИОЗСН, НаССа [7].
Хронобиологическая гипотеза развития БАР является одной из наиболее базисно объясняющих механизмы патогенеза БАР [16, 17]. Для БАР характерны сезонное течение с наибольшим количеством обострений в весенне-осенний период, нарушения суточных ритмов, секреции мелатонина и, соответственно, цикла «сон–бодрствование» [6, 11, 73]. В ряде исследований показано, что у больных с БАР имеются нарушения и социальных ритмов [5, 22, 49, 55, 74], на основе которых разработана социально-ритмическая психотерапия [47, 48]. В связи с этим исследования эффективности терапии в реальной практике Вальдоксаном больных с БАР типа II с его ресинхронизирующим эффектом представляют несомненный интерес.
Цель исследования – изучить клинические особенности депрессии у больных БАР типа II с оценкой эффективности комплексной терапии, включающей Вальдоксан.
Материалы и методы
В исследовании приняли участие 30 пациентов в возра-сте от 21 до 45 лет (средний возраст 31,7±6,2 года), в том числе 21 женщина и 9 мужчин. Включены пациенты с диагнозом БАР типа II (F31.8 МКБ-10 – «другие БАР»), дополненные критериями DSM-IV:
1) наличие в анамнезе и/или в настоящем статусе тяжелого депрессивного эпизода, отвечающего критериям МКБ-10: депрессивный эпизод должен длиться по крайней мере 2 нед, присутствует снижение интересов или снижение удовольствия от деятельности, обычно приятной для больного, отсутствуют реакции на события или деятельность, которые в норме ее вызывают, пробуждение утром за 2 ч или более до обычного времени, депрессия тяжелее по утрам, объективные свидетельства заметной психомоторной заторможенности или ажитации, заметное снижение аппетита, снижение массы тела (5% или более от массы тела в прошлом месяце), заметное снижение либидо;
2) наличие в анамнезе и/или в настоящем статусе гипоманиакального эпизода, отвечающего критериям МКБ-10: повышенное или раздражительное настроение, которое является явно анормальным для данного индивидуума и сохраняется по меньшей мере 4 дня подряд; должны быть представлены минимум 3 симптома из числа следующих, что сказывается на личностном функционировании в повседневной жизни: повышенная активность или физическое беспокойство, повышенная говорливость, затруднения в сосредоточении внимания или отвлекаемость, сниженная потребность во сне, повышение сексуальной энергии, небольшие кутежи или другие типы безрассудного или безответственного поведения, повышенная общительность или фамильярность.
Исключались пациенты в периоде беременности и лактации, с коморбидностью с шизофренией и расстройствами шизофренического спектра, алкоголизмом, наркоманией, деменцией, тяжелыми соматическими заболеваниями в фазе декомпенсации (почечная, печеночная, сердечная недостаточность, неконтролируемая гипергликемия), принимающие флувоксамин, ципрофлоксацин (сильные ингибиторы CYP1A2) в течение 2 нед, предшествующих включению в исследование. Состояние пациентов оценивалось клинико-психопатологическим методом с применением синдромального опросника SCL-90R [62] на 3, 7, 14, 21, 28, 35, 42, 49-й дни терапии. Все включенные пациенты закончили исследование к 49-му дню; 80% пациентов имели опыт приема ТЦА, 70% – ранее получали лечение селективными антидепрессантами (СИОЗС, СИОЗСН). Только 2 (6,7%) из обследуемых, которых вели как пациентов с личностными расстройствами, получали ранее нормотимик (карбамазепин). Из анамнестических сведений исследуемого контингента больных известно о преимущественно полиморфной картине всех предыдущих депрессивных эпизодов с затяжным и резистентным к терапии характером расстройств, постепенным укорочением «светлых промежутков» (интермиссий).
Следует отметить значительный удельный вес наследственной отягощенности в исследуемой группе (в 45% случаев – маниакально-депрессивное заболевание с депрессивным типом течения, в 24% – алкоголизм с суицидальными попытками, в 3% случаев – параноидная форма шизофрении). Заболевание впервые возникло в возрасте от 18 до 27 лет, в среднем в 23 года. У 64% пациентов имелись указания на алкоголизацию в анамнезе и эпизодическое употребление психоактивных веществ без сформированного синдрома зависимости. Более 50% пациентов прибегали к несистемному, но частому приему транквилизаторов, преимущественно бензодиазепинов, без назначения врача нередко при легкой тревоге. Очевидно, что указанные явления возникли как результат недостаточной психотерапии пациентов во время предыдущих госпитализаций, низкой комплаентности в отношении антидепрессантов, связанной в том числе с побочными действиями (особенно ТЦА). Эти пациенты также были оценены как угрожаемые по формированию резистентности к последующей терапии.
Статистическая оценка сдвига показателей проводилась с помощью непараметрического W-критерия согласованных пар для зависимых выборок Вилкоксона на основе программной системы Statistica for Windows (версия 7.0).
В качестве значимых принимались результаты со степенью достоверности не ниже 95% (p<0,05).
Результаты и обсуждение
Отличительной особенностью всех случаев на момент исследования являлась атипичная картина депрессии с отсутствием идеомоторной заторможенности, но с выраженной тревогой, обсессивно-фобическими симптомами (рис. 1), повышенной двигательной активностью, но преимущественно малопродуктивной. У части пациентов (17 человек – 67,7%) имели место явления инверсии аффекта в течение дня до нескольких часов, когда пациенты отмечали внезапное ощущение «прилива сил», «дополнительной энергии» со стремлением к общению, с веселостью, «душевным подъемом». По выражению одной из пациенток, «наступало просветление», «возникала уверенность, что я со всем справлюсь, что моя болезнь несерьезная, хотелось попросить о выписке, выйти на работу», вместе с тем ближе к вечеру больными отмечалось нарастание тревоги, беспокойства, неусидчивости либо резкой слабости, подавленности настроения с чувством опустошения, безрадостности, безнадежности. В 50% таких случаев наблюдалось резкое повышение аппетита с выраженным чувством голода. У 8 (26,7%) пациентов с самого начала на первый план выступало сочетание тревожных и дисфорических проявлений с конфликтными ситуациями с другими пациентами и персоналом, несоблюдением режима приема препаратов. С данным контингентом пациентов (нонкомплаентные) проводилась более тщательная индивидуальная психотерапевтическая работа в рамках комплаенс-терапии. Атипизм депрессивных эпизодов проявлялся как в анамнезе, так и во время текущего депрессивного эпизода, в повышении аппетита, прибавке массы тела, нарушении пищевого поведения в виде чрезмерного употребления сладостей, десертов, особенно шоколада, причем наблюдалось это преимущественно в вечернее время суток на фоне гипотимии.

У большинства пациентов (26 человек – 86,8%) имела место сонливость в течение всего дня с трудностями пробуждения, тягостным ощущением усталости и разбитости, отсутствием субъективной удовлетворенности сном.
У остальных наблюдалась бессонница с ранними пробуждениями, чутким, поверхностным сном.
Применяемая нами комбинация комплаенс-терапии и фармакотерапии показала свою эффективность уже с первых дней ведения пациентов, особенно в отношении проявлений тревоги, что было подтверждено достоверным снижением показателей соответствующей шкалы опросника SCL-90R к 3-му дню лечения (рис. 2): «тревога» (c 1,71 до 1,21; р=0,03), а также, хотя и недостоверным, снижением показателей других шкал.
Клинически это проявлялось в заметном снижении тревоги в течение дня и в процессе межличностного общения, некоторой стабилизации соматовегетативных и суточных колебаний. Нормализация сна отмечалась всеми пациентами, у некоторых из них сохранялись единичные ночные пробуждения с последующим засыпанием, также субъективно пациенты указывали на повышение удовлетворенности качеством ночного сна.
К 7-му дню терапии у пациентов сохранялась тревожно-депрессивная симптоматика, но менее выраженная, чем в самом начале терапии. Установление доверительного контакта с лечащим врачом, адаптация к режиму отделения, улучшение комплаенса способствовало уменьшению разных опасений, тревожности, что отражают показатели шкал опросника SCL-90R: достоверное снижение по шкале «фобическая тревога» (с 1,3 до 0,71; р=0,04; рис. 3) и относительное снижение по шкале «враждебность» (рис. 4).

С 7-го дня терапии все пациенты были включены в тренинговую психотерапевтическую группу. Столь раннему началу активной психотерапевтической работы способствовали помимо заметного клинического улучшения статуса пациентов минимальные (у части пациентов отсутствовали) побочные действия получаемой фармакотерапии. На 1-м этапе групповых тренингов (информационно-обучающем) больные направлялись в открытую группу, где широко использовалась информационно-образовательная работа с интерактивным разбором причин ухудшения состояния. На части занятий в доступной форме разбирались анатомо-физиологические и биохимические механизмы развития депрессий, гипоманиакальных состояний, важность своевременного выявления последних для назначения адекватной терапии, предотвращающей формирование затяжного течения, быстроциклических форм, роль современных препаратов с разбором причин их побочных действий, последствия бессистемного приема транквилизаторов. На 2-м этапе больные включались в закрытую группу специализированных тренингов, в частности, в тренинг анализа ситуации (ТАС) и копингориентированный тренинг (КОТ). Более подробная информация по общим принципам групповой психотерапии больных с депрессией в Оренбургская областная клиническая психиатрическая больница №1 отражена в части предыдущих наших публикаций [2–4]. В структуру ТАС и КОТ именно для больных с БАР типа II, при которых нередко нарушены циркадианные и социальные ритмы, были интегрированы занятия, направленные на выработку поведенческих стратегий, регулирующих социальные ритмы, с преодолением ситуаций возникновения межличностных проблем, вызывающих аффективную дестабилизацию (аналог межличностной и социально-ритмической терапии [47, 48]).
Статистически значимых различий показателей по шкалам опросника SCL-90R между 7 и 14-м днем терапии не отмечено. Тем не менее наблюдалось небольшое повышение показателей шкал «обсессивность-компульсивность», «межличностная сензитивность», «депрессивность» и «враждебность», что можно объяснить началом более интенсивной работы в тренинговой группе с интерактивным разбором причин ухудшения состояния и, следовательно, актуализацией психотравмирующих ситуаций и, безусловно, групповой динамикой.
К концу 3-й недели терапии (21-й день) имели место статистически достоверные сдвиги по следующим шкалам опросника SCL-90R (рис. 5–7): «соматизация» (с 1,48 до начала лечения до 0,91; р=0,00), «индекс выраженности симптомов» (с 1,40 до 0,88; р=0,01) и «обсессивность-компульсивность» (с 1,71 до 1,18; р=0,00).

Ригидность структуры аффекта в начале лечения с нередким недоверием к терапии, ее эффективности объяснялась отчасти дисфорическим содержанием статуса, который выходил на первый план по мере снижения тревоги и нашел отражение в показателях опросника SCL-90R. Согласно полученным данным показатель «паранойяльные симптомы» (отражение ригидности, консерватизма при непсихотических проявлениях) оказался наименее динамичным в процессе терапии, и относительное снижение показателей по этой шкале произошло только к 21-му дню лечения.
При анализе показателей опросника по лечению с 14-го по 35-й день наблюдения были получены следующие данные (рис. 8).
Имело место снижение интенсивности всех показателей симптоматической конфигурации, но статистически достоверно отмечено снижение по шкалам «соматизация», «индекс выраженности симптомов» и «обсессивность-компульсивность» к 21-му дню лечения, а по шкалам «депрессия», «враждебность» и «межличностная тревожность» (рис. 3, 4, 9) – к 28-му дню терапии: «депрессия» (с 1,73 до 0,87; р=0,01), «враждебность» (с 0,92 до 0,48; р=0,01), «межличностная сензитивность» (с 1,51 до 0,79; р=0,01) (рис. 10). Можно отметить относительную ригидность показателей «фобической тревоги» (рис. 3) и «враждебности» (рис. 4) в период с 14-го по 35-й день лечения. По-видимому, при терапии Вальдоксаном анксиолитическое действие препарата связано с эффектами нейропластичности [23, 35, 36, 38], в частности, повышением клеточной пролиферации и нейрогенеза в зубчатой извилине головного мозга – участка, который участвует в обработке эмоций [45], что требует более продолжительной антидепрессивной терапии, особенно при депрессии с признаками резистентности.
К 49-му дню терапии снижение по всем шкалам опросника SCL-90R наблюдалось более чем на 70%, что объективно отмечалось в статусе. Прежде всего практически нормализовалось настроение, восстановился цикл «сон–бодрствование», улучшилась социальная активность (лечебные отпуска и перевод на дневной стационар уже с 3-й недели терапии). В результате повысился уровень приверженности пациентов продолжению терапии Вальдоксаном на амбулаторном этапе. Следует отметить и нормотимический эффект препарата у пациентов с нестабильностью суточной динамики аффекта, что, по-видимому, связано с ресинхронизирующим влиянием Вальдоксана.
Далее приводится история болезни пациента с БАР
типа II на терапии Вальдоксаном.

Клинический случай
Пациент С. 30 лет поступает впервые. Явных указаний на отягощенную наследственность нет, но дед по материнской линии отличался высокой активностью в молодом и зрелом возрасте, затем к 40 годам стал злоупотреблять алкоголем, умер в 52 года от инфаркта. Обследуемый родился первым и единственным ребенком при нормальной беременности и родах у матери-одиночки. Развитие в раннем периоде без особенностей. Жил и воспитывался до юношеских лет у бабушки по материнской линии, которая отличалась мягким нравом, была ласковой, заботливой. Мать периодически жила с ними или отдельно с отчимом, по характеру спокойная, но достаточно строгая, «могла задавить авторитетом». Посещал детский сад. В школу пошел с 7 лет, учился удовлетворительно, проявлял интерес к точным наукам, со сверстниками и преподавателями имел ровные отношения. Охотно участвовал в проведении школьных вечеров, предпочитал находиться в центре внимания, занимался в танцевальном, театральном кружках, пользовался успехом у ровесниц. Через год после окончания 11-го класса поступил на экономический факультет Современной гуманитарной академии, который окончил в 2007 г., параллельно успешно работал в шинном центре менеджером до июля 2010 г. С 2003 г. встречался с девушкой, жили в гражданском браке. В армии не служил из-за плоскостопия. По характеру описывает себя общительным, ранимым, мнительным, принимающим все близко к сердцу, эмоциональным.
С января 2009 г. после смерти воспитавшей его бабушки отмечал некоторую подавленность настроения, которое нормализовалось к февралю. В октябре 2009 г. внезапно без видимых внешних причин стал чрезмерно брезгливым, часто мыл руки, неоднократно перепроверял, выключен ли газ, закрыта ли дверь, безопасно ли лежат шнуры на полу, через некоторое время частота этих действий возросла и стала мешать выполнению обязанностей на работе (многократно перепроверял счета, цифры), «голова была забита только этим», стал рассеянным, подавленным, невнимательным, забывчивым, несобранным, было сниженным настроение. По совету коллег обращался к знахарке, принимал по ее назначению амитриптилин в малых дозах: состояние улучшилось, практически полностью исчезли навязчивости, нормализовалось настроение, стал «прежним».
В апреле 2010 г., через месяц после окончания приема амитриптилина, отмечал значительный подъем настроения, активности, «сделался как энерджайзер», стал меньше спать, для отдыха хватало 2–3 ч в сутки, был повышенным аппетит, стал более неутомим, выносливее обычного. На этом фоне принял решение о покупке дорогостоящей недостроенной дачи на деньги, полученные по наследству от бабушки. Затем дополнительно взял кредит на строительство, бросил работу, подрабатывал на такси в ночное время, некоторое время работал на фирме у друга. Со стороны друзей неоднократно слышал в свой адрес похвалу, понял, что началась «новая светлая полоса в жизни». К концу августа состояние стало изменяться – осознал необдуманность ряда решений, снизилось настроение, переживал, что не сможет выплатить кредит, стал плаксивым, апатичным, ничем не хотел заниматься, лежал целыми днями дома. Затем нарушился сон, пропал аппетит, стали появляться мысли о нежелании жить, тяготился одиночеством, так как в это время еще больше одолевали мысли сожаления, самообвинения, самобичевания, стал меньше следить за внешним видом. Потерял в массе тела около 10 кг. Возникла упорная бессонница. Обратился к психотерапевту, начал прием паксила до 60 мг/сут, через 3 нед лечения отметил некоторое облегчение состояния. Прекратил прием препарата самостоятельно, так как считал, что «будет зависимость», появился плохо контролируемый аппетит и «возникали проблемы при интимных контактах». Вновь возникло ощущение «прилива энергии», строил планы на будущее по открытию собственного бизнеса по продаже шин, пытался переоформить кредит. Затем на фоне нескольких отказов банков по предоставлению кредита вновь ухудшилось настроение, возникла бессонница. Тем не менее отмечал несколько эпизодов в течение дня, во время которых на 1–2 ч чувствовал прилив сил, «желание жить», которые затем сменялись безразличием к себе, своей жизни. Обратился к психотерапевту и был направлен в отделение неврозов ГБУЗ ОрОКПБ №1.

Психический статус. В ясном сознании. Верно ориентирован во времени, в месте и собственной личности. Контакту доступен. Вступает в беседу с заметным волнением. На вопросы часто отвечает быстрыми фразами, суетлив, неусидчив. Выражение лица несколько озабоченное. Несмотря на предъявление жалоб на выраженную подавленность, тяжесть в груди, мысли о нежелании жить, периодически улыбается, при этом отмечает, что за последние дни стал чувствовать себя лучше. Сам это связывает с беседой с психотерапевтом до поступления («он сказал, что здесь мне помогут, у меня появилась надежда»). На вопросы отвечает по существу, но часто путается в последовательности событий. Мимика выразительная. Внимание с трудностями концентрации, память без грубых нарушений. Мышление последовательное, без патологической психопродукции. Эмоциональные реакции выразительные. Суицидальные мысли отрицает. Охотно соглашается на лечение.
Назначено лечение Вальдоксаном 25 мг/сут. С 1-го дня терапии отмечал улучшение сна, снижение тревоги. К 3-му дню обратился с просьбой о переводе на дневной стационар, которая была удовлетворена. Посещал регулярно групповые занятия, был на них достаточно активным. Отметил преимущества Вальдоксана перед предыдущими препаратами: отсутствие седации при полноценном сне, возможность управлять автомобилем, отсутствие повышения аппетита (стал тщательно следить за внешним видом).
Катамнез в течение 8 мес: вернулся на прежнее место работы, снимает квартиру, познакомился с девушкой, поддерживает с ней отношения. Договорился с банком по реструктуризации задолженности. При этом продолжает прием Вальдоксана, отмечает его стабилизирующее влияние на настроение («стало меньше раскачки»), посещает сеансы индивидуальной когнитивной психотерапии с освоением методик планирования деятельности.
Обсуждение. Особенностью данного клинического случая является в первую очередь атипизм депрессивных расстройств в виде наличия в дебюте заболевания обсессивно-компульсивной симптоматики, которая достаточно быстро купировалась малыми дозами амитриптилина. По нашим данным [39], появление навязчивых мыслей в дебюте БАР типа II может указывать на гипоманиакальный эквивалент идеаторной сферы без активизации на этот период позитивного аффекта. А быстрый ответ на терапию, обычно устойчивой к ТЦА обсессивной симптоматики, обусловлен ведущей аффективной симптоматикой. В дальнейшем обсессивных проявлений не наблюдалось, в структуре депрессии преобладал тревожный аффект, который приобрел выраженный тоскливо-адинамический характер. Также отмечен четкий гипоманиакальный эпизод с легкостью принятия решений, смены планов, гиперактивностью. Данный случай показателен и тем, что ближайшее окружение не отметило патологичности гипоманиакального аффекта, а все обращения за помощью были связаны с депрессией. Еще одним признаком биполярности аффекта при депрессии является быстрый ответ на терапию паксилом при достаточно тяжелой депрессии с нарушениями витальности. Отсутствие побочных действий у Вальдоксана с хорошим ответом на терапию способствовало формированию комплаенса на его долгосрочный прием с улучшением состояния и стабилизацией социального статуса.
Диагноз: БАР типа II, текущий эпизод умеренной депрессии.
Таким образом, комплексная терапия больных БАР типа II, включающая Вальдоксан, показала свою эффективность. Отмечена хорошая переносимость терапии Вальдоксаном, показана возможность купирования тревожного спектра депрессивных расстройств в рамках БАР типа II уже в первые 2 нед лечения, что способствует включению пациентов в групповую психотерапию, повышая комплаенс. Необходимо обратить внимание и на нормотимическое действие Вальдоксана, что может быть связано с его ресинхронизирующим эффектом. Для достижения более качественной интермиссии при БАР типа II необходима длительная поддерживающая терапия Вальдоксаном, что, вероятно, также обусловлено эффектами нейропластичности.
Сведения об авторах
Антохин Евгений Юрьевич – канд. мед. наук, доц. каф. психиатрии, медицинской психологии ГБОУ ВПО ОрГМА Минздрава РФ. E-mail: antioh73@yandex.ru
Харина Екатерина Александровна – заочный аспирант каф. психиатрии, медицинской психологии ГБОУ ВПО ОрГМА Минздрава РФ, врач-психотерапевт ГБУЗ ОрОКПБ №1
Список исп. литературыСкрыть список1. Акжигитов Р.Г., Яковлев А.Ю. К вопросу о диагностике расстройств биполярного спектра. Обозрение психиатрии и мед. психологии. 2011; 1: 41–5.
2. Антохин Е.Ю., Авеличев В.К., Байдавлетова Э.Т. Протекторные психологические механизмы при дистимии и их динамика в процессе комплексной терапии в стационаре. Соц. и клин. психиатрия. 2009; 2: 57–63.
3. Антохин Е.Ю. Гендерные аспекты психогенных депрессий: особенности клиники, подходы к терапии. Соц. и клин. психиатрия. 2010; 2: 52–66.
4. Антохин Е.Ю. Терапия тяжелой рекуррентной депрессии. Психиатр. и психофармакотер. 2010; 6: 18–23.
5. Бескова Д.А. Влияние социальных факторов на циркадианные ритмы (от нормального функционирования до психических расстройств). Обозрение психиатрии и мед. психологии. 2010; 1: 52–60.
6. Биполярное аффективное расстройство. Диагностика и лечение. Под ред. С.Н.Мосолова. М.: МУДпресс-информ, 2008.
7. Гурович И.Я., Любов Е.Б., Чапурин С.А., Чурилин Ю.Ю. Лечение Вальдоксаном, венлафаксином, дулоксетином, эсциталопрамом, миртазапином, пароксетином, сертралином, флуоксетином депрессивных расстройств: фармакоэкономический анализ. Психиатр. и психофармакотер. 2010; 1: 25–31.
8. Злоказова М.В. Опыт применения Вальдоксана при лечении умеренных и тяжелых депрессивных расстройств непсихотического уровня у амбулаторных пациентов. Психиатр. и психофармакотер. 2009; 4: 39–41.
9. Иванов С.В. Вальдоксан (агомелатин) при терапии умеренныХ и тяжелых депРессий непсихОтического уровНя в амбулатОрной и гоСпитальной практике (результаты российского многоцентрового исследования ХРОНОС). Психиатр. и психофармакотер. 2009; 6: 14–7.
10. Иванов С.В. Вальдоксан в терапии биполярной депрессии: результаты российского многоцентрового натуралистического исследования ХРОНОС. Обозрение психиатрии и мед. психологии. 2011; 2: 26–30.
11. Краснов В.Н. Расстройства аффективного спектра. М.: Практическая медицина, 2011.
12. Крюкова Е.М., Антохин Е.Ю., Будза В.Г. Особенности психопатологии и терапии депрессии при биполярном аффективном расстройстве II типа. Материалы XV Съезда психиатров России. М., 2010; с. 107.
13. Марачев М.П. Эффективность агомелатина при терапии атипичной депрессии. Психиатр. и психофармакотер. 2012; 3: 25–30.
14. Международная классификация болезней (10-й пересмотр): классификация психических и поведенческих расстройств. Клинические описания и указания по диагностике. Под ред. Ю.Л.Нуллера, С.Ю.Циркина. ВОЗ, Россия. СПб.: Оверлайд, 1994.
15. Марценковский И.А. Терапия депрессий через призму современных нейробиологических исследований. НейроNews психоневрология и нейропсихиатрия. 2008; 4: 9. http://neuro.health-ua.com/article/124.html
16. Мосолов С.Н. Клиника и терапия затяжных (стационарных и лабильно-континуальных) форм фазно протекающих психозов (клинико-экспериментальное исследование). Автореф. дис. … д-ра мед. наук. М., 1992; 2: 307–22.
17. Мосолов С.Н. Сравнительные полисомнографические характеристики больных биполярными фазно протекающими психозами с частыми («быстрые циклы») и редкими обострениями. Соц. и клин. психиатрия. 1992; 3: 20–9.
18. Мосолов С.Н. Эффективность и переносимость агомелатина при депрессивных состояниях в рамках рекуррентной депрессии и биполярного расстройства (доклад). Париж, 2011; 9: 7–8.
19. Олье Ж.-П., Каспер З. Эффективность Вальдоксана (агомелатина), агониста МТ1/МТ2-рецепторов и антагониста 5НТ2С-рецепторов при большом депрессивном расстройстве. Рос. психиатр. журн. 2009; 2: 85–95.
20. Погосова Г.В., Колтунова И.Е., Гудкова О.А. Стресс, депрессия и их влияние на нейропластичность: возможно ли обратное развитие? Обозрение психиатрии и мед. психологии. 2008; 3: 49–52.
21. Психиатрия. Национальное руководство. Краткое издание. Под. ред. Ю.А.Александровского, Т.Б.Дмитриевой, В.Н.Краснова, Н.Г.Незнанова и др. М.: ГЭОТАР-Медиа, 2012.
22. Смулевич А.Б., Иванов С.В. Депрессия и биологические ритмы: анкетное исследование ЦИРКАДИАН-I. Психиатр. и психофармакотер. 2008; 6: 4–8.
23. Счастный Е.Д., Зражевская И.А. Применение инновационного антидепрессанта Вальдоксана (агомелатин) при лечении пациента с быстроциклическим течением биполярного аффективного расстройства (клинический случай). Психиатр. и психофармакотер. 2009; 5: 22–5.
24. Терапия антидепрессантами и другие методы лечения депрессивных расстройств. Доклад рабочей группы CINP на основе обзора доказательных данных. Под ред. В.Н.Краснова. М., 2008.
25. Agosti V, Stewart JW. Efficacy and safety of antidepressant monotherapy in the treatment of bipolar-II depression. Int Clin Psycho-pharm 2007; 22: 309–11.
26. Akiskal HS, Maser JD, Zeller PJ et al. Switching from «unipolar» to bipolar II: An 11-year prospective study of clinical and temperamental predictors in 559 patients. Arch Gen Psychiat 1995; 52: 114–23.
27. Altshuler LL, Post RM, Leverich GS et al. Antidepressant-induced mania and cycle acceleration: a controversy revisited. Am J Psychiat 1995; 152: 1130–8.
28. Altshuler LL, Curran JG, Hauser P et al. T2-hyperintensities in bipolar disorder: magnetic resonance imaging comparison and literature meta-analysis. Am J Psychiat 1995; 152: 1139–44.
29. Altshuler LL, Suppes T, Black DO et al. Lower switch rate in depressed patients with bipolar II than bipolar I disorder treated adjunctively with second-generation antidepressants. Am J Psychiat 2006; 163: 313–5.
30. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4th ed. Text Revision (DSM-IVTR). Washington, DC: American Psychiatric Press, 2000.
31. Amsterdam JD, Garcia-Espaсa F, Fawcett J et al. Efficacy and safety of fluoxetine in treating bipolar II major depressive episode. J Clin Psychopharmacol 1998; 18: 435–40.
32. Amsterdam JD, Brunswick DJ. Antidepressant monotherapy for bipolar type II major depression. Bipolar Dis 2003; 5: 388–95.
33. Amsterdam JD. Efficacy and safety of venlafaxine in the treatment of bipolar II major depressive episode. J Clin Psychopharmacol 1998; 18: 414–7.
34. Amsterdam JD, Garcia-Espana F. Venlafaxine monotherapy in women with bipolar II and unipolar major depression. J Affect Dis 2000; 59: 225–9.
35. Angst J. The emerging epidemiology of hypomania and bipolar II disorder. J Affect Dis 1998; 50: 143–51.
36. Angst J, Gamma A, Benazzi F et al. Toward a re-definition of subthreshold bipolarity. Epidemiology and proposed criteria for bipolar II, minor bipolar disorders and hypomania. J Affect Dis 2003; 73: 133–46.
37. Angst J, Adolfsson R, Benazzi F et al. The HCL-32. Towards a self-assessment tool for hypomanic symptoms in outpatients. J Affect Dis 2005; 88: 217–33.
38. Angst J, Azorin JM, Bowden ChL et al. Prevalence and characteristics of udiagnosed bipolar disorders in patients with a major depressive episode. The BRIDGE Study. Arch Gen Psychiat 2011; 68 (8): 791–99.
39. Antokhin EYu, Bardyurkina VA, Budza VG et al. Bipolar depression of the II type: psychopathology, therapy. Europ Psychiat 2010; 1: 211.
40. Baldessarini RJ, Tondo L, Floris G, Hennen J. Effects of rapid cycling on response to lithium maintenance treatment in 360 bipolar I and II disorder patients. J Affect Dis 2000; 61: 13–22.
41. Benazzi F. Antidepressant-associated hypomania in outpatient depression: a 203-case study in private practice. J Affect Dis 1997; 46: 73–7.
42. Benazzi F, Akiskal HS. Refining the evaluation of bipolar II: beyond the strict SCID-CV guidelines for hypomania. J Affect Dis 2003; 73: 33–8.
43.Benazzi F. Bipolar II disorder: epidemiology, diagnosis and management. CNS Drugs 2007; 21: 727–40.
44. Bourin M, Prica C. Агонист мелатониновых рецепторов Вальдоксан (агомелатин): новый препарат для терапии монополярной депрессии (реферат). Обозрение психиатрии и мед. психологии. 2009; 4: 74–82.
45. Cassano GB, Dell’Osso L, Frank E et al. The bipolar spectrum: a clinical reality in search of diagnostic criteria and an assessment methodology. J Affect Dis 1999; 54: 319–28.
46. Dunner DL, Gershon ES, Goodwin FK. Heritable factors in the severity of affective illness. Biol Psychiat 1976; 11: 31–42.
47. Frank E, Swartz HA, Kupfer DJ et al. Interpersonal and social rhythms therapy: managing the chaos of bipolar disorder. Biol Psychiat 2000; 48: 593–604.
48. Frank E, Kupfer DJ, Thase ME et al. Two-year outcomes for interpersonal and social rhythm in individuals with bipolar I disorder. Arch Gen Psychiat 2005; 62: 996–1004.
49. Germain A. Психоповеденческий подход к нарушениям циркадианных ритмов у пациентов с депрессией. Обозрение психиатрии и мед. психологии. 2008; 2: 37–41.
50. Ghaemi SN, Sachs GS, Chiou AM et al. Is bipolar disorder still under diagnosed? Are depressants over utilized? J Affect Dis 1999; 52: 135–44.
51. Ghaemi SN, Ko JY, Goodwin FK. «Cade's disease» and beyond: misdiagnosis, antidepressant use and proposed definition for bipolar spectrum disorder. Can J Psychiat 2002; 47: 125–34.
52. Goodwin GM. Hypomania: what's in a name? Br J Psychiat 2002; 181: 94–5.
53. Goodwin GM, Emsley R, Rembry S, Rouillon F. Вальдоксан (агомелатин) предотвращает рецидивы у пациентов с большим депрессивным расстройством без признаков синдрома отмены: 24-недельное рандомизированное двойное слепое плацебо-контролируемое исследование. Психиатр. и психофармакотер. 2010; 2: 46–51.
54. Hamon M. Рецепторные профили антидепрессантов. Обозрение психиатрии и мед. психологии. 2009; 2: 67–72.
55. Hirschfeld RM, Montgomery SA, Keller MB et al. Social functioning in depression: a review. J Clin Psychiat 2000; 61: 268–75.
56. Hirschfeld RM, Williams JB, Spitzer RL et al. Development and validation of a screening instrument for bipolar spectrum disorder: the mood disorder questionnaire. Am J Psychiat 2000; 157: 1872–5.
57. Joffe RT, MacQueen GM, Marriott M et al. Induction of mania and cycle acceleration in bipolar disorder: effect of different classes of antidepressant. Acta Psychiat Scand 2002; 105: 427–30.
58. Judd LL, Akiskal HS. The prevalence and disability of bipolar spectrum disorders in the US population: re-analysis of the ECA database taking into account subthreshold cases. J Affect Dis 2003; 73: 121–31.
59. Judd LL, Akiskal HS, Schettler PJ et al. Psychosocial disability in the course of bipolar I and II disorders: a prospective, comparative, longitudinal study. Arch Gen Psychiat 2005; 62: 1322–30.
60. Judd LL, Akiskal HS, Schettler PJ et al. A prospective investigation of the natural history of the long-term weekly symptomatic status of bipolar II disorder. Arch Gen Psychiat 2003; 60: 261–9.
61. Kaplan HI, Sadock BJ. Клиническая психиатрия. Пер. c англ. Под ред. Т.Б.Дмитриева. М.: ГЭОТАР-Медицина, 1998.
62. Kato T, Kunugi H, Nanko S, Kato N. Association of bipolar disorder with the 5178 polymorphism in mitochondrial DNA. Am J Med Gen 2000; 96: 182–6.
63. Kennedy SH, Emsley R. Placebo-controlled trial of Valdoxan in the treatment of major depressive disorder. Eur Neuropsychopharmacol 2006; 16: 93–100.
64. Konradi C, Zimmerman EI, Yang CK et al. Hippocampal interneurons in bipolar disorder. Arch Gen Psychiat 2011; 68 (4): 340–50.
65. Kupka RW, Altshuler LL, Nolen WA et al. Three times more days depressed than manic or hypomanic in both bipolar I and bipolar II disorder. Bipolar Dis 2007; 9: 531–5.
66. Lemoine P, Guilleminault C, Alvarez E. Улучшение субъективных показателей сна при большом депрессивном расстройстве на фоне терапии новейшим антидепрессантом Вальдоксаном: рандомизированное двойное слепое сравнение с венлафаксином (реферат). Обозрение психиатрии и мед. психологии. 2009; 3: 54–63.
67. Li CT, Bai YM, Huang YL et al. Association between antidepressant resistance in unipolar depression and subsequent bipolar disorder: cohort study. BJP 2012; 200: 45–51.
68. Lao H, Hale A, D’haenen H. Determination of the dose of agomelatine, a melatoninergic agonist and selective 5HT-antagonist, in the treatment of mayor depressive disorder: a placebo-controlled dose range study. Int Clin Psychopharmacol 2002; 17: 239–47.
69. MacQueen GM, Young LT. Bipolar II disorder: symptoms, course, and response to treatment. Psychiat Serv 2001; 52: 358–61.
70. Malkoff-Schwarts S, Frank E, Anderson B et al. Stressfull life events and social rhythm disruption in the onset of manic and depressive bipolar episodes: a preliminary investigation. Arch Gen Psychiat 1998; 55: 702–7.
71. Merikangas KR, Akiskal HS, Angst J et al. Lifetime and 12-month prevalence of bipolar spectrum disorder in the National Comorbidity Survey replication. Arch Gen Psychiat 2007; 64: 543–52.
72. Merikangas KR, Jin R, He JP et al. Prevalence and correlates of bipolar spectrum disorder in the world mental health survey initiative. Arch Gen Psychiat 2011; 68 (3): 241–51.
73. Millan MJ. Препараты с двойным и тройным механизмом действия для лечения ядерных и коморбидных проявлений большой депрессии: новые концепции, новые препараты (расширенный реферат). Психиатр. и психофармакотер. 2009; 3: 4–20.
74. Monteleone P, Maj M. Circadian rhythm disturbances in depression: implications for treatment and quality of remission. Medicographia 2009; 31 (2): 132–9.
75. Montgomery SA, Olie JP, Kennedy SH. Antidepressants efficacy of agomelatine in major depressive disorder: meta-analysis of three pivotal studies. Eur Neuropsychopharmacol 2006; 16 (4): 321.
76. Munoz C. Better quality remission in depression: Valdoxan, the first melatonergic antidepressant. Medicographia 2009; 31 (2): 175–81.
77. Murphy J, Shevlin M, Houston J, Adamson G. A population based analysis of subclinical psychosis and help-seeking behavior. Schizophr Bull 2012; 38 (2): 360–7.
78. Olie JP, Emsley R. Confirmed clinical efficacy of agomelatine (25–50 mg) in major depression: two randomized double-blind, placebo-controlled studies. Eur Neuropsychopharmacol 2005; 15 (3): 416.
79. Parker G, Tully L, Olley A, Hadzi-Pavlovic D. SSRIs as mood stabilizers for bipolar II disorder? A proof of concept study. J Affect Dis 2006; 92: 205–14.
80. Perlis RH, Uher R, Ostacher M et al. Association between bipolar spectrum features and treatment outcomes in outpatients with major depressive disorder. Arch Gen Psychiat 2011; 68 (4): 351–60.
81. Piver A, Yatham LN, Lam RW. Bipolar spectrum disorders. New perspectives. Can Fam Physician 2002; 48: 896–904.
82. Rihmer Z, Pestality P. Bipolar II disorder and suicidal behavior. Psychiat Clin North Am 1999; 22: 667–73.
83. Rihmer Z, Kiss K. Bipolar disorders and suicidal behavior. Bipolar Dis 2002; 4 (1): 21–5.
84. Sellgren C, Landqon M, Lichtenstein P et al. Validity of bipolar disorder hospital discharge diagnoses: file review and multiple register linkage in Sweden. Acta Psychiat Scandinav 2011; 124 (6): 447–53.
85. Simpson SG, McMahon FJ, McInnis MG et al. Diagnostic reliability of bipolar II disorder. Arch Gen Psychiat 2002; 59: 736–40.
86. Solq B, Bonnin CM, Torrent C et al. Neurocognitive impairment and psychosocial functioning in bipolar II disorder. Acta Psychiat Scandinav 2012; 125 (4): 309–17.
87. Suppes T, Marangell LB, Bernstein IH et al. A single blind comparison of lithium and lamotrigine for the treatment of bipolar II depression. J Affect Dis 2008; 111: 334–43.
88. Thaker GK. Neurophysiological end phenotypes across bipolar and schizophrenia psychosis. Schizophr Bull 2008; 34: 760–73.
89. Tondo L, Baldessarini RJ, Hennen J, Floris G. Lithium maintenance treatment of depression and mania in bipolar I and bipolar II disorders. Am J Psychiat 1998; 155: 638–45.
90. Undurraga J, Baldessarini RJ, Valentн M et al. Bipolar depression: clinical correlates of receiving antidepressants. J Affect Dis 2012; 139 (1): 89–93.
91. Vieta E, Benabarre A, Colom F et al. Suicidal behavior in bipolar I and bipolar II disorder. J Nerv Ment Dis 1997; 185: 407–9.
92. Vieta E, Suppes T. Bipolar II disorder: arguments for and against a distinct diagnostic entity. Bipolar Dis 2008; 10: 163–78.
93. Xu G, Lin K, Rao D et al. Neuropsychological performance in bipolar I, bipolar II and unipolar depression patients: a longitudinal, naturalistic study. J Affect Dis 2012; 136 (3): 328–39.
94. Wong MC. Management of bipolar II disorder. Indian J Psychol Med 2011; 33 (1): 18–28.
95. Zivanovic O, Nedic A. Kraepelin's concept of manic-depressive insanity: one hundred years later. J Affect Disord 2012; 137:15–24.
16 сентября 2013
Количество просмотров: 4345


