Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2010
Эффективность лечебного процесса у больных шизофренией, принимающих атипичные нейролептики: значение клинических особенностей заболевания, безопасности и переносимости терапии, терапевтического сотрудничества и микросоциальных факторов. Часть 2 №02 2010
Номера страниц в выпуске:34-40
При исследовании безопасности и переносимости антипсихотической терапии мы подробно не останавливались на определении частоты и анализе динамики нежелательных явлений (НЯ), развивающихся при ее проведении, поскольку эти данные подробно представлены в литературе. Отметим лишь, что их частота соответствовала результатам, полученным ранее. Основное внимание было сосредоточено на изучении влияния НЯ, развивающихся во время лечебного процесса, на его эффективность.
Результаты исследования (продолжение) Факторы, влияющие на эффективность применения атипичных нейролептиков
При исследовании безопасности и переносимости антипсихотической терапии мы подробно не останавливались на определении частоты и анализе динамики нежелательных явлений (НЯ), развивающихся при ее проведении, поскольку эти данные подробно представлены в литературе. Отметим лишь, что их частота соответствовала результатам, полученным ранее. Ни у одного больного при оценке по шкале UKU не наблюдали побочных эффектов «тяжелой степени» (3 балла) длительностью более 10 дней. Это было связано со своевременной коррекцией терапии (изменение дозы нейролептика, назначение корректоров).
Основное внимание было сосредоточено на изучении влияния НЯ, развивающихся во время лечебного процесса, на его эффективность. НЯ могли значительно снижать ее из-за необходимости пересмотра схемы лечения врачом или из-за отказа от него больных. Во-первых, некоторые НЯ представляли определенного рода угрозу для соматического состояния больных. В этих случаях пересматривать схему лечения приходилось по жизненным показаниям. Во-вторых, при развитии побочных эффектов больные могли испытывать той или иной степени дискомфорт, ухудшающий их общее состояние. Эти НЯ не представляли опасности для здоровья. Однако их появление иногда требовало пересмотра схемы лечения врачом по этическим соображениям или для поддержания терапевтического сотрудничества. В этих случаях эффективность лечебного процесса также снижалась из-за резкого ухудшения качества терапевтического сотрудничества (нарушение режима терапии больными, снижение доверия к врачу). В-третьих, побочные эффекты могли вызывать негативное отношение к лечению родственников больных, их вмешательству в процесс терапии, что становилось причиной отказа от нее.
Отмеченные в проведенном исследовании опасные для здоровья (жизни) осложнения развивались только на этапе купирующей терапии. Они были расценены как последствия типичных побочных эффектов нейролептиков, которые сами по себе угрозы не представляли. В обследованной выборке к ним относились пневмонии и коллапсы. Других осложнений, в том числе возникающих вследствие повышенной индивидуальной чувствительности (злокачественный нейролептический синдром, поражение крови, печени, сердца и др.), отмечено не было, возможно, из-за относительно небольшой численности обследованных больных.
Развитие пневмоний отмечено у 3,8% больных, принимавших клозапин. Им были назначены высокие дозы (более 400 мг/сут). Эти пациенты входили в группу больных шизофренией, протекающей в форме приступов, а их состояние характеризовалось развернутыми психозами с выраженным возбуждением и отказом от принятия медицинской помощи. Пневмонии развивались по аспирационно-гипостатическому механизму из-за аспирации слюны при выраженной гиперсаливации (2–3 балла по шкале UKU) и ограничения подвижности больных вследствие длительного медикаментозного сна. При приеме рисперидона, оланзапина, кветиапина или типичных нейролептиков развития пневмоний не отмечено. Статистически значимых различий между группами не выявлено, что могло быть связано с редкостью данного осложнения при относительной малочисленности изученной выборки.
Ортостатические коллапсы наблюдали у 6,7, 0,96, 2,1, 2,1 и 3,2% больных, принимавших клозапин, рисперидон, оланзапин, кветиапин и типичные нейролептики (зуклопентиксол) соответственно. Статистически значимых различий между группами не выявлено. Ортостатические обмороки наблюдали как при острых психозах, так и при обострениях вялотекущей или параноидной шизофрении, но во всех случаях при небольшой длительности заболевания и истории его лечения!
При развитии пневмоний и коллапсов терапию не отменяли, «смену» нейролептика не проводили. Осуществлялось лишь временное (от нескольких дней до 2 нед) снижение его суточной дозы по жизненным показаниям, что было достаточно для ослабления гиперсаливации, седативного и гипотензивного действия. В дальнейшем дозы вновь повышали, но более медленно. Повторных осложнений не отмечено. Важно, что их развитие во многом было связано с недостаточным вниманием к состоянию больных медицинских работников, поскольку предвидеть их риск можно было заранее по жалобам пациентов или объективному наблюдению. Все случаи перечисленных осложнений завершились благоприятно, поскольку большинство пациентов были молоды и соматически здоровы. Можно предположить, что при сопутствующей соматической патологии или у пожилых больных описанные нежелательные явления протекали бы не столь безболезненно, на что ранее указывали ряд авторов [1–3]. По некоторым данным, примерно у половины пожилых больных, получающих клозапин в дозе 300 мг/сут, лечение приходится отменять [4]. Однако необходимо учитывать, что в пожилом возрасте потребность использования высоких доз нейролептиков и их быстрого повышения, при котором развитие осложнений наиболее вероятно, возникает редко. Это связано с тем, что у пожилых больных «активность» шизофрении обычно «затухает», сформировывается дефект, развивающиеся психозы отличаются «стертостью», бедностью аффективного компонента. Одновременно многие больные адаптируются к соматотропному действию нейролептиков при его длительном приеме.
Другим фактором, ограничивающим эффективность купирующей терапии, было появление у больных субъективного дискомфорта, вызванного плохой переносимостью нейролептиков. Он определялся типичными побочными эффектами. При лечении клозапином к ним относились повышенное слюноотделение, запоры, головокружение и сонливость; при приеме рисперидона – непроизвольные движения, заложенность носа и головокружение (обычно у пожилых больных или молодых женщин при вялом течении шизофрении); при лечении оланзапином – сонливость, головокружение, сухость во рту и запоры; при терапия кветиапином – сонливость и головокружения; при приеме традиционных нейролептиков – неконтролируемые движения, запоры, иногда головокружения. Негативное восприятие побочных эффектов свойственно всем больным, но его последствия были различны. При небольшой выраженности продуктивных расстройств (обычно у больных с сохранной критикой или хотя бы сознанием болезни) проведение рациональной психотерапии методами убеждения и косвенного внушения обычно позволяло в полном объеме сохранить терапевтическое сотрудничество. В случаях выраженной продуктивной симптоматики и отсутствия критики оно обычно нарушалось. Больные пытались активно противодействовать медицинской помощи, хотя в условиях стационара это было не столь значимо.
Особого внимания заслуживают случаи выраженного субъективного дискомфорта из-за индивидуальной непереносимости одного из нейролептиков. При этом варианте назначение даже небольших доз приводило к развитию выраженных побочных эффектов, причиняющих больным сильный дискомфорт. Таких больных было 1,2%. У 2 пациентов (рисперидон) наблюдали тяжелые формы острой дистонии (3 балла по шкале UKU). Ее развитие потребовало снижения дозы нейролептика по этическим соображениям, поскольку высокие дозы корректоров были малоэффективны. Психическое состояние этих больных характеризовалось «стертыми» обострениями, развившимися на фоне длительного течения шубообразной шизофрении с признаками перехода в непрерывный тип. У 2 больных (оланзапин) развилась выраженная акатизия (3 балла по шкале UKU). Эти случаи относились к вялотекущей шизофрении. У 1 больного параноидной шизофренией (кветиапин) наблюдали появление 2 твердых болезненных образований в области соска. В этом случае терапия была отменена, но не только из-за этого НЯ, а из-за низкой эффективности. Случаи коллапсов, которые можно расценивать как повышенную индивидуальную чувствительность больных к гипотензивному эффекту, были рассмотрены ранее.
К более тяжелому варианту индивидуальной непереносимости относили случаи развития выраженных побочных эффектов при применении различных нейролептиков, т.е. психофармакотерапии в целом. У этих больных ее проведение было значительно затруднено, поскольку они испытывают сильнейший дискомфорт при приеме любых антипсихотических средств. В настоящем исследовании таких наблюдений не было. Однако индивидуальная непереносимость психофармакотерапии была установлена, по данным анамнеза, на этапе включения в исследование у 5 (1,2%) пациентов. В прошлом применение у них различных нейролептиков, даже в небольших дозах, вызывало развитие выраженных побочных эффектов, плохо поддающихся коррекции. Это приводило к формированию негативного отношения больных к приему лекарств и его прекращению в амбулаторных условиях. В рамках настоящего исследования всем больным был назначен кветиапин (исходя из данных литературы о благоприятном профиле его побочных эффектов). Терапия переносилась хорошо. При вялотекущей шизофрении она была успешной. У больного с параноидной формой эффективность лечения была невысокой, но оно было продолжено исходя из соображения: невысокая эффективность лечения более полезна, чем его полная неэффективность при отказе больного от приема лекарств (соотношение «польза/риск»).
В отдельную группу целесообразно выделить больных, у которых индивидуальная «непереносимость» проявлялась ухудшением психического состояния из-за необычной трактовки побочных эффектов. В данном случае необходимо отметить некоторую условность термина «непереносимость», поскольку она возникала вследствие индивидуальной «психопатологической переработки» субъективного дискомфорта. Таких больных было 2,3%. У 2 пациентов, страдающих параноидной шизофренией с ее длительным течением ближе к безремиссионному (клозапин), было восприятие терапии как «отравление организма». Эти высказывания в прямом смысле не свидетельствовали о бреде отравления, а скорее о бредоподобных фантазиях. Таким способом они выражали свое отношение к терапии как к «тяжелой», дискомфортной. Еще 4 больных (2 – клозапин, 2 – оланзапин) встраивали «нейролептический дискомфорт» в бредовую систему (сенсорный психический автоматизм, бред воздействия). У 4 больных (1 – рисперидон, 1 – оланзапин и 2 – галоперидол) с бредовой ипохондрией неприятные телесные ощущения, вызванные нейролептиками, встраивались в систему бреда. Во всех случаях усиление тяжести побочных эффектов приводило к ухудшению психического состояния больных, несмотря на проведение эффективной терапии.
Большинство случаев НЯ, вызывающих дискомфорт (за исключением гиперсаливации и гипотензии), не представляло опасности. Возможно, это объяснялось преобладанием в обследованной группе молодых соматически здоровых пациентов, тщательным контролем над их состоянием и рациональным подбором доз нейролептиков. Однако выраженный дискомфорт иногда требовал пересмотра схемы купирующей терапии по этическим соображениям с потерей ее эффективности. Кроме того, он мог влиять на отношение к ней больных. Это проявлялось снижением их доверия к врачу, появлением или усилением негативного отношения к лекарствам, попытками нарушения режима приема терапии. Последний фактор, впрочем, при стационарном лечении не играл важной роли, но имел большое значение, если терапию проводили амбулаторно. У некоторых больных дискомфорт, вызванный купирующей терапией, отражался на терапевтическом сотрудничестве в период последующего поддерживающего лечения. К этой категории относились больные с невысоким качеством сформированных ремиссий, особенно при их параноидном варианте в рамках различных форм заболевания, при преобладании в структуре состояния невротической ипохондрии или психопатоподобной симптоматики. У пациентов с высоким качеством ремиссий субъективный дискомфорт обычно в меньшей степени отражался на терапевтическом сотрудничестве при дальнейшем поддерживающем лечении. В этом отношении наиболее показательны случаи острых (вернее «острейших») психозов, при которых дискомфорт от приема нейролептиков в начале купирующей терапии резко усиливал негативизм, протест против лечения, нарушал доверие больных к врачу вплоть до полного отказа от общения. Однако по мере ослабления психопатологической симптоматики, появления сознания болезни, а затем и критики наблюдали формирование полноценного терапевтического сотрудничества с высоким уровнем доверия и правильным соблюдением схемы приема лекарств.
В проведенном исследовании изменение схемы купирующей терапии при стойком субъективном дискомфорте ограничивалось снижением доз нейролептиков в течение первых 2–4 нед лечения. В дальнейшем тяжесть большинства субъективно неприятных явлений ослабевала самопроизвольно. «Смены» нейролептиков не проводили. Число наблюдений снижения их доз было невелико и составило 6 (5,7%), 3 (2,9%), 5 (5,2%), 0 (0%) и 3 (9,7%) больных, принимавших клозапин, рисперидон, оланзапин, кветиапин и типичные средства (за исключением случаев снижения доз при пневмонии и коллапсах). Несмотря на то что при лечении клозапином и типичными нейролептиками число таких больных было несколько большим, чем при приеме других средств, эта разница достигала статистической значимости только по сравнению с группой больных, принимавших кветиапин (р=0,03 и р=0,01).
Общее число больных, у которых на этапе купирующей терапии по перечисленным причинам (осложнения, субъективный дискомфорт) было проведено снижение дозы нейролептика, было большим при лечении клозапином (19,8%) и типичными средствами (16,1%), меньшим – при приеме кветиапина (4,2%), рисперидона и оланзапина – 6,7 и 12,4%. Статистический анализ показал, что значение побочных эффектов в ограничении возможности проведения эффективного лечения убывает в следующем порядке: типичные нейролептики и клозапин – оланзапин – рисперидон и кветиапин.
При длительной поддерживающей терапии значение субъективного дискомфорта для успешности лечебного процесса значительно возрастало, поскольку контроль над приемом лекарств становился менее строгим. Содержание жалоб больных определялось спектрами основных побочных эффектов нейролептиков. Хотя при длительном лечении их тяжесть значительно уменьшалась из-за адаптации к ним или снижения дозы нейролептика, часть больных жаловались на неприятные ощущения активнее, чем прежде. Это вызвано более «острым» восприятием ими тягостных явлений в условиях обычной жизни и ослаблением психотерапевтической поддержки медицинскими работниками из-за более редкого общения. У части больных при длительном лечении развивались «новые» НЯ, не наблюдавшиеся в период купирующей терапии или рассматривающиеся при ее проведении как лечебный эффект. Это было связано либо с изменением психического состояния (например, лекарственная седация), либо с медленным, постепенным нарастанием побочных эффектов (например, увеличение массы тела), либо с возможностью их выявления только в условиях обычной жизни (например, нарушение сексуальной функции).
В ряде случаев дискомфорт от приема нейролептиков был связан с психологическим фактором в виде внешней или самостигматизации. Больные испытывали не физический, а психологический дискомфорт от изменений во внешнем виде, например от угревой сыпи, непроизвольных движений или пастозности лица. Стигматизация в связи с побочными эффектами была характерна для пациентов с высоким качеством ремиссий при незначительной выраженности продуктивных и негативных расстройств. Больные с выраженными изменениями личности обычно безразлично воспринимали перемену внешности.
При поддерживающей терапии побочные эффекты чаще развивались при приеме клозапина и оланзапина, реже – при лечении рисперидоном и кветиапином. Субъективный дискомфорт сильно влиял на терапевтическое сотрудничество, однако оно было связано и с другими факторами, например с эффективностью лечения или отношением к нему родных. Поэтому нарушение режима приема лекарств обычно наблюдали при сочетании у одного больного нескольких «неблагоприятных» факторов. Например, высокая эффективность клозапина часто «нивелировала» субъективный дискомфорт от терапии. Напротив, дискомфорт при приеме оланзапина у многих больных «дополнялся» его низкой эффективностью, что приводило к более частому нарушению терапевтического сотрудничества. Показателен пример седативного действия, одинаково часто развивавшегося при длительном лечении клозапином и оланзапином. Больные, принимавшие клозапин, реже нарушали режим терапии, чем пациенты, лечившиеся оланзапином. В целом же на субъективный дискомфорт жаловались 56 (70%), 24 (34,8%), 41 (61,2%) и 13 (61,9%) больных, принимавших клозапин, рисперидон, оланзапин и кветиапин. При лечении рисперидоном их число было меньше, чем при приеме клозапина (c2=18,48, р=0,0000) и оланзапина (c2=9,5, р=0,002). Прямой корреляции между переносимостью терапии и качеством соблюдения режима поддерживающей терапии не выявлено. Непереносимость терапии часто нивелировалась другими факторами.
Проведение эффективной психофармакотерапии в ряде случаев ограничивалось тем, что побочные эффекты, развивающиеся у больных, вызывали или усиливали негативное отношение к лечению их родственников. При купирующей терапии таких наблюдений было 4,4%. К побочным эффектам, чаще всего вызывающим протест родственников против лечения, относились непроизвольные движения, сильная сонливость и заторможенность, слюнотечение. Однако поскольку негативное отношение к лечению возникало у родственников определенного психологического типа, такую их реакцию могли вызвать даже незначительные жалобы. Обычно при изначальной претенциозности членов семьи беседа, а также обсуждение значения и последствий НЯ успокаивали их. Иногда, несмотря на эти меры, родные активно вмешивались в процесс терапии или отказывались от ее проведения. В этих случаях приходилось активно пользоваться методами психообразования и рациональной психотерапии родных, в том числе с привлечением других врачей, что позволяло продолжить купирующую терапию во всех случаях. Однако в период дальнейшей поддерживающей терапии, когда контроль врача над ее проведением значительно ослабевал, негативное отношение к ней родных приводило к быстрому ее прекращению.
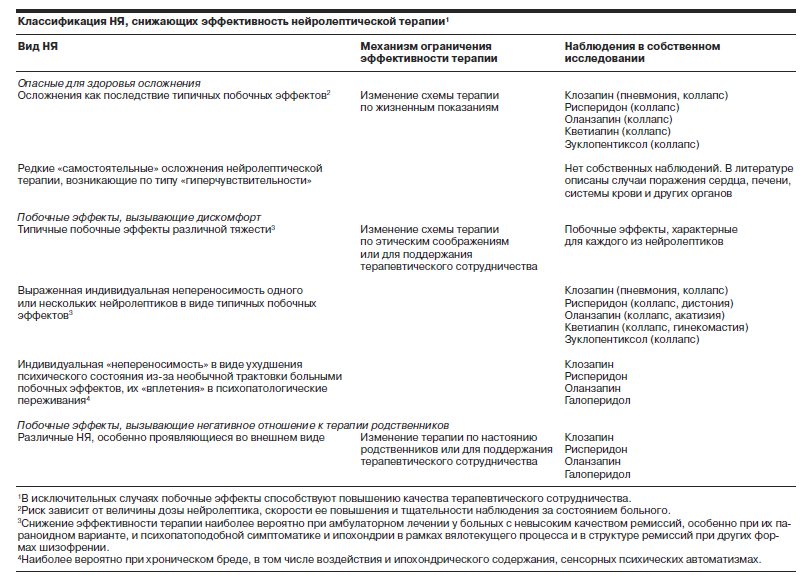
Обобщение полученных данных позволяет предложить классификацию НЯ (побочных эффектов и осложнений), снижающих эффективность лечебного процесса у больных шизофренией (см. таблицу).
Одним из важнейших факторов, снижающих эффективность лечебного процесса у больных всеми формами шизофрении, было отсутствие терапевтического сотрудничества (комплаенс). Результаты этой части исследования были опубликованы нами ранее (Психиатрия и психофармакотерапия. 2008; 10 (3): 16–22).
Обсуждение
Данные проведенного исследования показывают, что безопасность нейролептической терапии довольно высока, это согласуется с мнением ряда авторов [5]. Хотя она сопровождается развитием осложнений (в проведенном исследовании – коллапсы, пневмонии), для молодых соматически здоровых пациентов это не представляет угрозы при своевременном принятии соответствующих мер. Важную роль в их развитии играет недостаточное внимание медицинских работников к состоянию больных. Статистически значимых различий по частоте развития осложнений при приеме клозапина, рисперидона, оланзапина, кветиапина и типичных нейролептиков в проведенном исследовании не выявлено, что, однако, можно связать с редкостью их возникновения. Ранее указывалось, что применение клозапина сопряжено с риском развития агранулоцитоза [5–7]. Однако проведенный нами анализ данных литературы и недавно опубликованные результаты собственного исследования [8] позволяют считать терапию более безопасной, чем это предполагалось ранее.
Проведенное исследование показало, что лечение клозапином переносится несколько хуже, чем другими атипичными нейролептиками. Это проявляется большей частотой (и большей тяжестью, по данным литературы) побочных эффектов, не опасных для жизни, но вызывающих дискомфорт. В связи с худшей переносимостью клозапина лишь немногие психиатры предпочитают его другим средствам, о чем свидетельствует недавно проведенный опрос [9]. Худшая общая переносимость клозапина рассматривается в качестве одной из причин его отнесения к препаратам резерва [5–7, 10]. Наша позиция не соответствует этой точке зрения. Мы полагаем, что во многих случаях клозапин следует рассматривать в качестве нейролептика выбора. Это обосновывается следующими фактами:
Большое значение имеют полученные в нашем исследовании данные о различии качества терапевтического сотрудничества при применении атипичных нейролептиков и как следствие различной частоте обострений шизофрении. Хотя терапевтическое сотрудничество формируется под влиянием многих факторов, одну из ведущих ролей играет качество ремиссии. Применение при купирующей и поддерживающей терапии нейролептиков высокой мощности (клозапин) приводит к формированию ремиссий наиболее высокого качества, чаще достигается критичное отношение больных к своему состоянию или сознание его болезненности. Как следствие они лучше осознают необходимость лечения и реже нарушают режим его приема. Длительная терапия клозапином в этом случае более эффективна. Применение при обострениях шизофрении (особенно непрерывной параноидной и приступообразной) нейролептиков с низким антипсихотическим потенциалом (рисперидон, оланзапин) приводит к формированию ремиссий худшего качества. Больные быстро прекращают лечение. Риск рецидивирования у них очень высок. Интересно сопоставление этих данных с результатами исследований особенностей динамики эндогенного процесса в первые годы применения низкопотентного нейролептика хлорпромазина, когда его отмену производили сразу после отзвучания острых проявлений психоза, а поддерживающую терапию не проводили. При таком лечении отмечено увеличение частоты повторных обострений по сравнению с больными, лечившимися непсихофармакологическими методами [3, 15, 17], при которых психоз обрывается самостоятельно по «внутренним» механизмам его течения (терапия сном) либо из-за высокоэффективного шокового воздействия (инсулиновые шоки, электросудорожная терапия). Подобным образом применение атипичных нейролептиков невысокой мощности (рисперидон, оланзапин) при обострениях наиболее активно текущих форм шизофрении приводит лишь к «раскачиванию» состояния больного из психоза в неглубокую ремиссию и обратно. Выписка из стационара после стихания наиболее острых проявлений психоза, но при отсутствии качественной ремиссии (недолечивание) приводит к раннему отказу больных от лечения и быстрому рецидивированию, поскольку активность болезненного процесса в этот период еще высока, а сдерживающие ее факторы отсутствуют. Течение эндогенного процесса при таком лечении даже может быть более неблагоприятным, чем при нелеченой болезни.
Результаты проведенного исследования свидетельствуют об отсутствии различия качества терапевтического сотрудничества при лечении традиционными и атипичными нейролептиками, что связано с их сопоставимой переносимостью. Больные, принимающие атипичные нейролептики, значительно реже страдают от заторможенности, непроизвольных движений и других побочных эффектов, характерных для традиционных средств. Однако у них часто развиваются метаболические, эндокринные и некоторые другие нарушения, доставляющие физическое или психологическое страдание, приводящие к изменениям внешности. Эти данные не соответствуют широко распространенному мнению о более высоком качестве терапевтического сотрудничества при лечении атипичными нейролептиками.
Особого обсуждения заслуживает вопрос значения микросоциальных факторов (роль семьи) в формировании терапевтического поведения больных шизофренией. Ранее ему был посвящен целый ряд исследований, однако единой точки зрения не сформировано. Наши данные свидетельствуют, что семейный фактор играет одну из решающих ролей в формировании различных моделей терапевтического поведения больных шизофренией. Установлено значение семейного положения, отношения родственников к проводимой терапии, их заинтересованности в ее успехе, активности их участия в лечебном процессе. Семья или близкое окружение может способствовать оптимизации терапевтического сотрудничества или приводить к его разрушению. Новизну имеют данные о феномене «выгорания» родственников при длительном лечении больных, снижении их заинтересованности в его успехе.
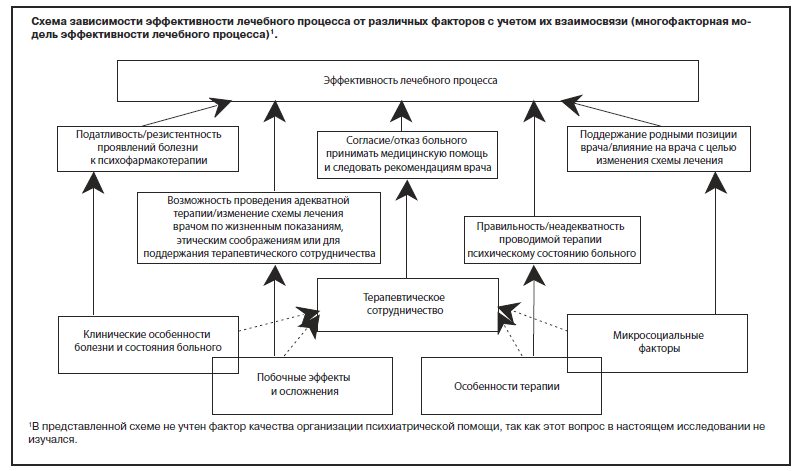
В заключение необходимо подчеркнуть, что выявленные различия эффективности атипичных нейролептиков определялись многими факторами: клиническими особенностями заболевания и психического состояния больных, безопасностью и переносимостью лечения, качеством терапевтического сотрудничества, заинтересованностью в успехе лечения и активностью участия в нем родственников больных. Эффективность купирующей терапии, проводимой обычно в стационаре, зависела главным образом от клинических особенностей патологического процесса. На эффективность лечения на этом этапе также влияла его безопасность и переносимость. Значение других факторов было незначительным, поскольку больные не могли самостоятельно контролировать режим приема лекарств, а родственники имели лишь ограниченную возможность вмешиваться в процесс лечения. При проведении длительной амбулаторной терапии роль этих факторов значительно возрастала. В связи с этим правомерно разграничение понятий «эффективность нейролептика», которая определяется его мощностью и спектром антипсихотического действия, и «эффективность терапии (лечебного процесса)», которая зависит от целого комплекса факторов. Обобщение полученных данных позволяет предложить схему зависимости эффективности лечебного процесса от различных факторов с учетом их взаимосвязи (многофакторная модель эффективности лечебного процесса) (см. рисунок).
Выводы
1. Эффективность терапии шизофрении зависит от многих факторов. Правомерно разграничение понятий «эффективность нейролептика» (определяется соотношением его мощности, спектра антипсихотического действия и клинических особенностей заболевания) и «эффективность лечебного процесса» (зависит от клинических особенностей заболевания, переносимости и безопасности терапии, качества терапевтического сотрудничества, заинтересованности и участия в лечении близкого окружения больного).
2. Эффективность атипичных нейролептиков значительно отличается при различных формах и вариантах течения шизофрении, разных симптомокомплексах, на различных этапах эндогенного процесса (обострение–ремиссия, манифестация–активное течение–дефект).
3. При обострениях параноидной шизофрении и шизофрении, протекающей приступообразно, эффективность нейролептиков (степень ослабления продуктивных расстройств, число больных со значительным улучшением состояния, скорость наступления терапевтического эффекта) убывает в ряду: клозапин Ѓ (высокопотентные типичные) Ѓ рисперидон и оланзапин Ѓ кветиапин (практически неэффективен); при вялотекущей шизофрении – в ряду: клозапин Ѓ кветиапин Ѓ оланзапин Ѓ рисперидон.
4. Спектр действия клозапина наиболее широк (симптомокомплексы различной структуры на различных этапах течения болезни – от ее манифестации до дефекта). Рисперидон и оланзапин наиболее эффективны при паранойяльном синдроме в рамках манифестации непрерывной шизофрении; при неразвернутых острых психозах (бредовое настроение и восприятие) и подострых приступах без выраженных нарушений стройности мышления на этапе «выгорания» шизофрении. К предикторам высокой эффективности кветиапина и оланзапина при вялотекущей шизофрении относятся навязчивости, деперсонализация и небредовая ипохондрия в сочетании с тревогой или субдепрессией. Оланзапин эффективен при двигательных навязчивостях, приближающихся к кататоническим стереотипиям. Специфичность действия рисперидона при вялотекущей шизофрении наиболее узка и ограничивается неврозоподобной симптоматикой при небольшой длительности болезни.
5. После отзвучания обострений различных форм шизофрении длительная терапия приводит к дальнейшему улучшению состояния больных. Оно проявляется ослаблением «остаточной» продуктивной, вторичной негативной и «эндореактивной» симптоматики. Окончательное формирование структуры ремиссии (структуры дефекта), максимальное восстановление социальной адаптации происходит спустя полгода – год.
6. При шизофрении, протекающей приступообразно, эффективность терапии убывает в ряду: клозапин Ѓ оланзапин Ѓ рисперидон. При вялотекущей шизофрении длительное применение атипичных нейролептиков приводит к сопоставимому ослаблению остаточных продуктивных расстройств; при лечении негативной симптоматики эффективность терапии убывает в ряду: клозапин Ѓ оланзапин и кветиапин Ѓ рисперидон. При манифестации различных форм шизофрении длительная терапия клозапином приводит к значительному ослаблению психопатологических расстройств вплоть до доболезненного уровня, а при непрерывной параноидной шизофрении способствует переходу ее течения из непрерывного в условно приступообразное.
7. Длительная терапия атипичными нейролептиками вносит значительные особенности в структуру лекарственных ремиссий. Применение клозапина в наибольшей степени способствует «отщеплению» продуктивной симптоматики (апатический тип ремиссий). Наиболее благоприятный вариант ремиссий при терапии рисперидоном характеризуется сочетанием симптомов простого дефицита и повышенной истощаемости с аффективными и ипохондрическими включениями (астенический вариант).
8. Эффективность амбулаторной терапии зависит от качества терапевтического сотрудничества. У большинства больных оно остается несформированным или нарушается в процессе лечения («ранний» и «поздний» нонкомплаенс). На его формирование влияют многие факторы (тяжесть психического состояния, особенности терапии, ее безопасность и переносимость, участие семьи в лечебном процессе). Их значение различается на ранних и отдаленных этапах ремиссии. Влияние одних факторов может нивелироваться за счет других.
9. Особенности психического состояния и нейролептической терапии вносят значительные коррективы в качество терапевтического сотрудничества, что проявляется различной частотой повторных обострений шизофрении. При непрерывной параноидной шизофрении и шизофрении, протекающей приступообразно, их частота возрастает при применении нейролептиков в ряду: клозапин Ѓ высокопотентные типичные Ѓ оланзапин Ѓ рисперидон; при вялотекущей шизофрении – в ряду: рисперидон, оланзапин и кветиапин Ѓ клозапин.
10. Эффективность лечения зависит от его переносимости и безопасности. Она снижается из-за необходимости пересмотра схемы лечения врачом (по жизненным показаниям, этическим соображениям или для поддержания терапевтического сотрудничества) или нарушения режима терапии больным без согласия врача (из-за субъективной тягостности состояния). При купирующей и поддерживающей терапии значение побочных эффектов для ограничения ее эффективности убывает в ряду: высокопотентные типичные нейролептики и клозапин Ѓ оланзапин Ѓ рисперидон Ѓ кветиапин.
11. Купирующая терапия атипичными нейролептиками относительно безопасна. Редкие осложнения (пневмонии, коллапсы) не представляют угрозы для молодых соматически здоровых пациентов при условии своевременного принятия соответствующих мер. Терапия клозапином более безопасна, чем это предполагалось ранее.
12. Значение побочных эффектов для формирования терапевтического сотрудничества определяется тяжестью психического состояния больного. Субъективный дискомфорт наиболее остро воспринимают больные с невысоким качеством ремиссий (психотическая, психопатоподобная, ипохондрическая симптоматика с отсутствием критики или сознания болезни). При ремиссиях высокого качества плохая переносимость терапии влияет на терапевтическое сотрудничество в меньшей степени.
13. Эффективность лечения и качество терапевтического сотрудничества зависят от особенностей семейного положения больного, отношения родственников к проводимой терапии, их заинтересованности в ее успехе, активности их участия в лечебном процессе. Семья или близкое окружение может способствовать формированию терапевтического сотрудничества или приводить к его разрушению.
14. Полученные данные свидетельствуют о правомерности формулирования принципа дифференцированного применения атипичных нейролептиков при лечении шизофрении.
При исследовании безопасности и переносимости антипсихотической терапии мы подробно не останавливались на определении частоты и анализе динамики нежелательных явлений (НЯ), развивающихся при ее проведении, поскольку эти данные подробно представлены в литературе. Отметим лишь, что их частота соответствовала результатам, полученным ранее. Ни у одного больного при оценке по шкале UKU не наблюдали побочных эффектов «тяжелой степени» (3 балла) длительностью более 10 дней. Это было связано со своевременной коррекцией терапии (изменение дозы нейролептика, назначение корректоров).
Основное внимание было сосредоточено на изучении влияния НЯ, развивающихся во время лечебного процесса, на его эффективность. НЯ могли значительно снижать ее из-за необходимости пересмотра схемы лечения врачом или из-за отказа от него больных. Во-первых, некоторые НЯ представляли определенного рода угрозу для соматического состояния больных. В этих случаях пересматривать схему лечения приходилось по жизненным показаниям. Во-вторых, при развитии побочных эффектов больные могли испытывать той или иной степени дискомфорт, ухудшающий их общее состояние. Эти НЯ не представляли опасности для здоровья. Однако их появление иногда требовало пересмотра схемы лечения врачом по этическим соображениям или для поддержания терапевтического сотрудничества. В этих случаях эффективность лечебного процесса также снижалась из-за резкого ухудшения качества терапевтического сотрудничества (нарушение режима терапии больными, снижение доверия к врачу). В-третьих, побочные эффекты могли вызывать негативное отношение к лечению родственников больных, их вмешательству в процесс терапии, что становилось причиной отказа от нее.
Отмеченные в проведенном исследовании опасные для здоровья (жизни) осложнения развивались только на этапе купирующей терапии. Они были расценены как последствия типичных побочных эффектов нейролептиков, которые сами по себе угрозы не представляли. В обследованной выборке к ним относились пневмонии и коллапсы. Других осложнений, в том числе возникающих вследствие повышенной индивидуальной чувствительности (злокачественный нейролептический синдром, поражение крови, печени, сердца и др.), отмечено не было, возможно, из-за относительно небольшой численности обследованных больных.
Развитие пневмоний отмечено у 3,8% больных, принимавших клозапин. Им были назначены высокие дозы (более 400 мг/сут). Эти пациенты входили в группу больных шизофренией, протекающей в форме приступов, а их состояние характеризовалось развернутыми психозами с выраженным возбуждением и отказом от принятия медицинской помощи. Пневмонии развивались по аспирационно-гипостатическому механизму из-за аспирации слюны при выраженной гиперсаливации (2–3 балла по шкале UKU) и ограничения подвижности больных вследствие длительного медикаментозного сна. При приеме рисперидона, оланзапина, кветиапина или типичных нейролептиков развития пневмоний не отмечено. Статистически значимых различий между группами не выявлено, что могло быть связано с редкостью данного осложнения при относительной малочисленности изученной выборки.
Ортостатические коллапсы наблюдали у 6,7, 0,96, 2,1, 2,1 и 3,2% больных, принимавших клозапин, рисперидон, оланзапин, кветиапин и типичные нейролептики (зуклопентиксол) соответственно. Статистически значимых различий между группами не выявлено. Ортостатические обмороки наблюдали как при острых психозах, так и при обострениях вялотекущей или параноидной шизофрении, но во всех случаях при небольшой длительности заболевания и истории его лечения!
При развитии пневмоний и коллапсов терапию не отменяли, «смену» нейролептика не проводили. Осуществлялось лишь временное (от нескольких дней до 2 нед) снижение его суточной дозы по жизненным показаниям, что было достаточно для ослабления гиперсаливации, седативного и гипотензивного действия. В дальнейшем дозы вновь повышали, но более медленно. Повторных осложнений не отмечено. Важно, что их развитие во многом было связано с недостаточным вниманием к состоянию больных медицинских работников, поскольку предвидеть их риск можно было заранее по жалобам пациентов или объективному наблюдению. Все случаи перечисленных осложнений завершились благоприятно, поскольку большинство пациентов были молоды и соматически здоровы. Можно предположить, что при сопутствующей соматической патологии или у пожилых больных описанные нежелательные явления протекали бы не столь безболезненно, на что ранее указывали ряд авторов [1–3]. По некоторым данным, примерно у половины пожилых больных, получающих клозапин в дозе 300 мг/сут, лечение приходится отменять [4]. Однако необходимо учитывать, что в пожилом возрасте потребность использования высоких доз нейролептиков и их быстрого повышения, при котором развитие осложнений наиболее вероятно, возникает редко. Это связано с тем, что у пожилых больных «активность» шизофрении обычно «затухает», сформировывается дефект, развивающиеся психозы отличаются «стертостью», бедностью аффективного компонента. Одновременно многие больные адаптируются к соматотропному действию нейролептиков при его длительном приеме.
Другим фактором, ограничивающим эффективность купирующей терапии, было появление у больных субъективного дискомфорта, вызванного плохой переносимостью нейролептиков. Он определялся типичными побочными эффектами. При лечении клозапином к ним относились повышенное слюноотделение, запоры, головокружение и сонливость; при приеме рисперидона – непроизвольные движения, заложенность носа и головокружение (обычно у пожилых больных или молодых женщин при вялом течении шизофрении); при лечении оланзапином – сонливость, головокружение, сухость во рту и запоры; при терапия кветиапином – сонливость и головокружения; при приеме традиционных нейролептиков – неконтролируемые движения, запоры, иногда головокружения. Негативное восприятие побочных эффектов свойственно всем больным, но его последствия были различны. При небольшой выраженности продуктивных расстройств (обычно у больных с сохранной критикой или хотя бы сознанием болезни) проведение рациональной психотерапии методами убеждения и косвенного внушения обычно позволяло в полном объеме сохранить терапевтическое сотрудничество. В случаях выраженной продуктивной симптоматики и отсутствия критики оно обычно нарушалось. Больные пытались активно противодействовать медицинской помощи, хотя в условиях стационара это было не столь значимо.
Особого внимания заслуживают случаи выраженного субъективного дискомфорта из-за индивидуальной непереносимости одного из нейролептиков. При этом варианте назначение даже небольших доз приводило к развитию выраженных побочных эффектов, причиняющих больным сильный дискомфорт. Таких больных было 1,2%. У 2 пациентов (рисперидон) наблюдали тяжелые формы острой дистонии (3 балла по шкале UKU). Ее развитие потребовало снижения дозы нейролептика по этическим соображениям, поскольку высокие дозы корректоров были малоэффективны. Психическое состояние этих больных характеризовалось «стертыми» обострениями, развившимися на фоне длительного течения шубообразной шизофрении с признаками перехода в непрерывный тип. У 2 больных (оланзапин) развилась выраженная акатизия (3 балла по шкале UKU). Эти случаи относились к вялотекущей шизофрении. У 1 больного параноидной шизофренией (кветиапин) наблюдали появление 2 твердых болезненных образований в области соска. В этом случае терапия была отменена, но не только из-за этого НЯ, а из-за низкой эффективности. Случаи коллапсов, которые можно расценивать как повышенную индивидуальную чувствительность больных к гипотензивному эффекту, были рассмотрены ранее.
К более тяжелому варианту индивидуальной непереносимости относили случаи развития выраженных побочных эффектов при применении различных нейролептиков, т.е. психофармакотерапии в целом. У этих больных ее проведение было значительно затруднено, поскольку они испытывают сильнейший дискомфорт при приеме любых антипсихотических средств. В настоящем исследовании таких наблюдений не было. Однако индивидуальная непереносимость психофармакотерапии была установлена, по данным анамнеза, на этапе включения в исследование у 5 (1,2%) пациентов. В прошлом применение у них различных нейролептиков, даже в небольших дозах, вызывало развитие выраженных побочных эффектов, плохо поддающихся коррекции. Это приводило к формированию негативного отношения больных к приему лекарств и его прекращению в амбулаторных условиях. В рамках настоящего исследования всем больным был назначен кветиапин (исходя из данных литературы о благоприятном профиле его побочных эффектов). Терапия переносилась хорошо. При вялотекущей шизофрении она была успешной. У больного с параноидной формой эффективность лечения была невысокой, но оно было продолжено исходя из соображения: невысокая эффективность лечения более полезна, чем его полная неэффективность при отказе больного от приема лекарств (соотношение «польза/риск»).
В отдельную группу целесообразно выделить больных, у которых индивидуальная «непереносимость» проявлялась ухудшением психического состояния из-за необычной трактовки побочных эффектов. В данном случае необходимо отметить некоторую условность термина «непереносимость», поскольку она возникала вследствие индивидуальной «психопатологической переработки» субъективного дискомфорта. Таких больных было 2,3%. У 2 пациентов, страдающих параноидной шизофренией с ее длительным течением ближе к безремиссионному (клозапин), было восприятие терапии как «отравление организма». Эти высказывания в прямом смысле не свидетельствовали о бреде отравления, а скорее о бредоподобных фантазиях. Таким способом они выражали свое отношение к терапии как к «тяжелой», дискомфортной. Еще 4 больных (2 – клозапин, 2 – оланзапин) встраивали «нейролептический дискомфорт» в бредовую систему (сенсорный психический автоматизм, бред воздействия). У 4 больных (1 – рисперидон, 1 – оланзапин и 2 – галоперидол) с бредовой ипохондрией неприятные телесные ощущения, вызванные нейролептиками, встраивались в систему бреда. Во всех случаях усиление тяжести побочных эффектов приводило к ухудшению психического состояния больных, несмотря на проведение эффективной терапии.
Большинство случаев НЯ, вызывающих дискомфорт (за исключением гиперсаливации и гипотензии), не представляло опасности. Возможно, это объяснялось преобладанием в обследованной группе молодых соматически здоровых пациентов, тщательным контролем над их состоянием и рациональным подбором доз нейролептиков. Однако выраженный дискомфорт иногда требовал пересмотра схемы купирующей терапии по этическим соображениям с потерей ее эффективности. Кроме того, он мог влиять на отношение к ней больных. Это проявлялось снижением их доверия к врачу, появлением или усилением негативного отношения к лекарствам, попытками нарушения режима приема терапии. Последний фактор, впрочем, при стационарном лечении не играл важной роли, но имел большое значение, если терапию проводили амбулаторно. У некоторых больных дискомфорт, вызванный купирующей терапией, отражался на терапевтическом сотрудничестве в период последующего поддерживающего лечения. К этой категории относились больные с невысоким качеством сформированных ремиссий, особенно при их параноидном варианте в рамках различных форм заболевания, при преобладании в структуре состояния невротической ипохондрии или психопатоподобной симптоматики. У пациентов с высоким качеством ремиссий субъективный дискомфорт обычно в меньшей степени отражался на терапевтическом сотрудничестве при дальнейшем поддерживающем лечении. В этом отношении наиболее показательны случаи острых (вернее «острейших») психозов, при которых дискомфорт от приема нейролептиков в начале купирующей терапии резко усиливал негативизм, протест против лечения, нарушал доверие больных к врачу вплоть до полного отказа от общения. Однако по мере ослабления психопатологической симптоматики, появления сознания болезни, а затем и критики наблюдали формирование полноценного терапевтического сотрудничества с высоким уровнем доверия и правильным соблюдением схемы приема лекарств.
В проведенном исследовании изменение схемы купирующей терапии при стойком субъективном дискомфорте ограничивалось снижением доз нейролептиков в течение первых 2–4 нед лечения. В дальнейшем тяжесть большинства субъективно неприятных явлений ослабевала самопроизвольно. «Смены» нейролептиков не проводили. Число наблюдений снижения их доз было невелико и составило 6 (5,7%), 3 (2,9%), 5 (5,2%), 0 (0%) и 3 (9,7%) больных, принимавших клозапин, рисперидон, оланзапин, кветиапин и типичные средства (за исключением случаев снижения доз при пневмонии и коллапсах). Несмотря на то что при лечении клозапином и типичными нейролептиками число таких больных было несколько большим, чем при приеме других средств, эта разница достигала статистической значимости только по сравнению с группой больных, принимавших кветиапин (р=0,03 и р=0,01).
Общее число больных, у которых на этапе купирующей терапии по перечисленным причинам (осложнения, субъективный дискомфорт) было проведено снижение дозы нейролептика, было большим при лечении клозапином (19,8%) и типичными средствами (16,1%), меньшим – при приеме кветиапина (4,2%), рисперидона и оланзапина – 6,7 и 12,4%. Статистический анализ показал, что значение побочных эффектов в ограничении возможности проведения эффективного лечения убывает в следующем порядке: типичные нейролептики и клозапин – оланзапин – рисперидон и кветиапин.
При длительной поддерживающей терапии значение субъективного дискомфорта для успешности лечебного процесса значительно возрастало, поскольку контроль над приемом лекарств становился менее строгим. Содержание жалоб больных определялось спектрами основных побочных эффектов нейролептиков. Хотя при длительном лечении их тяжесть значительно уменьшалась из-за адаптации к ним или снижения дозы нейролептика, часть больных жаловались на неприятные ощущения активнее, чем прежде. Это вызвано более «острым» восприятием ими тягостных явлений в условиях обычной жизни и ослаблением психотерапевтической поддержки медицинскими работниками из-за более редкого общения. У части больных при длительном лечении развивались «новые» НЯ, не наблюдавшиеся в период купирующей терапии или рассматривающиеся при ее проведении как лечебный эффект. Это было связано либо с изменением психического состояния (например, лекарственная седация), либо с медленным, постепенным нарастанием побочных эффектов (например, увеличение массы тела), либо с возможностью их выявления только в условиях обычной жизни (например, нарушение сексуальной функции).
В ряде случаев дискомфорт от приема нейролептиков был связан с психологическим фактором в виде внешней или самостигматизации. Больные испытывали не физический, а психологический дискомфорт от изменений во внешнем виде, например от угревой сыпи, непроизвольных движений или пастозности лица. Стигматизация в связи с побочными эффектами была характерна для пациентов с высоким качеством ремиссий при незначительной выраженности продуктивных и негативных расстройств. Больные с выраженными изменениями личности обычно безразлично воспринимали перемену внешности.
При поддерживающей терапии побочные эффекты чаще развивались при приеме клозапина и оланзапина, реже – при лечении рисперидоном и кветиапином. Субъективный дискомфорт сильно влиял на терапевтическое сотрудничество, однако оно было связано и с другими факторами, например с эффективностью лечения или отношением к нему родных. Поэтому нарушение режима приема лекарств обычно наблюдали при сочетании у одного больного нескольких «неблагоприятных» факторов. Например, высокая эффективность клозапина часто «нивелировала» субъективный дискомфорт от терапии. Напротив, дискомфорт при приеме оланзапина у многих больных «дополнялся» его низкой эффективностью, что приводило к более частому нарушению терапевтического сотрудничества. Показателен пример седативного действия, одинаково часто развивавшегося при длительном лечении клозапином и оланзапином. Больные, принимавшие клозапин, реже нарушали режим терапии, чем пациенты, лечившиеся оланзапином. В целом же на субъективный дискомфорт жаловались 56 (70%), 24 (34,8%), 41 (61,2%) и 13 (61,9%) больных, принимавших клозапин, рисперидон, оланзапин и кветиапин. При лечении рисперидоном их число было меньше, чем при приеме клозапина (c2=18,48, р=0,0000) и оланзапина (c2=9,5, р=0,002). Прямой корреляции между переносимостью терапии и качеством соблюдения режима поддерживающей терапии не выявлено. Непереносимость терапии часто нивелировалась другими факторами.
Проведение эффективной психофармакотерапии в ряде случаев ограничивалось тем, что побочные эффекты, развивающиеся у больных, вызывали или усиливали негативное отношение к лечению их родственников. При купирующей терапии таких наблюдений было 4,4%. К побочным эффектам, чаще всего вызывающим протест родственников против лечения, относились непроизвольные движения, сильная сонливость и заторможенность, слюнотечение. Однако поскольку негативное отношение к лечению возникало у родственников определенного психологического типа, такую их реакцию могли вызвать даже незначительные жалобы. Обычно при изначальной претенциозности членов семьи беседа, а также обсуждение значения и последствий НЯ успокаивали их. Иногда, несмотря на эти меры, родные активно вмешивались в процесс терапии или отказывались от ее проведения. В этих случаях приходилось активно пользоваться методами психообразования и рациональной психотерапии родных, в том числе с привлечением других врачей, что позволяло продолжить купирующую терапию во всех случаях. Однако в период дальнейшей поддерживающей терапии, когда контроль врача над ее проведением значительно ослабевал, негативное отношение к ней родных приводило к быстрому ее прекращению.
Обобщение полученных данных позволяет предложить классификацию НЯ (побочных эффектов и осложнений), снижающих эффективность лечебного процесса у больных шизофренией (см. таблицу).
Одним из важнейших факторов, снижающих эффективность лечебного процесса у больных всеми формами шизофрении, было отсутствие терапевтического сотрудничества (комплаенс). Результаты этой части исследования были опубликованы нами ранее (Психиатрия и психофармакотерапия. 2008; 10 (3): 16–22).
Обсуждение
Данные проведенного исследования показывают, что безопасность нейролептической терапии довольно высока, это согласуется с мнением ряда авторов [5]. Хотя она сопровождается развитием осложнений (в проведенном исследовании – коллапсы, пневмонии), для молодых соматически здоровых пациентов это не представляет угрозы при своевременном принятии соответствующих мер. Важную роль в их развитии играет недостаточное внимание медицинских работников к состоянию больных. Статистически значимых различий по частоте развития осложнений при приеме клозапина, рисперидона, оланзапина, кветиапина и типичных нейролептиков в проведенном исследовании не выявлено, что, однако, можно связать с редкостью их возникновения. Ранее указывалось, что применение клозапина сопряжено с риском развития агранулоцитоза [5–7]. Однако проведенный нами анализ данных литературы и недавно опубликованные результаты собственного исследования [8] позволяют считать терапию более безопасной, чем это предполагалось ранее.
Проведенное исследование показало, что лечение клозапином переносится несколько хуже, чем другими атипичными нейролептиками. Это проявляется большей частотой (и большей тяжестью, по данным литературы) побочных эффектов, не опасных для жизни, но вызывающих дискомфорт. В связи с худшей переносимостью клозапина лишь немногие психиатры предпочитают его другим средствам, о чем свидетельствует недавно проведенный опрос [9]. Худшая общая переносимость клозапина рассматривается в качестве одной из причин его отнесения к препаратам резерва [5–7, 10]. Наша позиция не соответствует этой точке зрения. Мы полагаем, что во многих случаях клозапин следует рассматривать в качестве нейролептика выбора. Это обосновывается следующими фактами:
1. По эффективности клозапин превосходит все другие нейролептики (наибольшее ослабление психопатологических расстройств, благоприятный лекарственный патоморфоз стереотипа течения болезни, формирование ремиссий наилучшего качества с максимально возможным восстановлением социальной адаптации и др.). Высокая эффективность лечения повышает успешность лечебного процесса (улучшение качества терапевтического сотрудничества), что значительно улучшает отдаленный прогноз.
2. Лечение клозапином значительно снижает риск смерти у больных шизофренией, в первую очередь за счет уменьшения вероятности суицида, которая может достигать 30%.
3. Терапия клозапином должна рассматриваться как более безопасная, чем это предполагалось ранее:
• высокая вероятность переоценки установленного риска агранулоцитоза (погрешности ранее полученных данных из-за влияния сопутствующих факторов и ретроспективной оценки причин агранулоцитоза);
• общая сопоставимость частоты опасных осложнений при терапии клозапином и традиционными нейролептиками (риск злокачественного нейролептического синдрома и агранулоцитоза, развивающихся при применении многих типичных нейролептиков, никогда не рассматривался в качестве причины ограничения их широкого применения);
• отсутствие данных сравнения значения побочных эффектов и осложнений при терапии клозапином и другими атипичными нейролептиками (одним из неблагоприятных последствий применения атипичных нейролептиков нового поколения считается повышение риска развития хронических соматических заболеваний и смертности, связанной с ними).
Большое значение имеют полученные в нашем исследовании данные о различии качества терапевтического сотрудничества при применении атипичных нейролептиков и как следствие различной частоте обострений шизофрении. Хотя терапевтическое сотрудничество формируется под влиянием многих факторов, одну из ведущих ролей играет качество ремиссии. Применение при купирующей и поддерживающей терапии нейролептиков высокой мощности (клозапин) приводит к формированию ремиссий наиболее высокого качества, чаще достигается критичное отношение больных к своему состоянию или сознание его болезненности. Как следствие они лучше осознают необходимость лечения и реже нарушают режим его приема. Длительная терапия клозапином в этом случае более эффективна. Применение при обострениях шизофрении (особенно непрерывной параноидной и приступообразной) нейролептиков с низким антипсихотическим потенциалом (рисперидон, оланзапин) приводит к формированию ремиссий худшего качества. Больные быстро прекращают лечение. Риск рецидивирования у них очень высок. Интересно сопоставление этих данных с результатами исследований особенностей динамики эндогенного процесса в первые годы применения низкопотентного нейролептика хлорпромазина, когда его отмену производили сразу после отзвучания острых проявлений психоза, а поддерживающую терапию не проводили. При таком лечении отмечено увеличение частоты повторных обострений по сравнению с больными, лечившимися непсихофармакологическими методами [3, 15, 17], при которых психоз обрывается самостоятельно по «внутренним» механизмам его течения (терапия сном) либо из-за высокоэффективного шокового воздействия (инсулиновые шоки, электросудорожная терапия). Подобным образом применение атипичных нейролептиков невысокой мощности (рисперидон, оланзапин) при обострениях наиболее активно текущих форм шизофрении приводит лишь к «раскачиванию» состояния больного из психоза в неглубокую ремиссию и обратно. Выписка из стационара после стихания наиболее острых проявлений психоза, но при отсутствии качественной ремиссии (недолечивание) приводит к раннему отказу больных от лечения и быстрому рецидивированию, поскольку активность болезненного процесса в этот период еще высока, а сдерживающие ее факторы отсутствуют. Течение эндогенного процесса при таком лечении даже может быть более неблагоприятным, чем при нелеченой болезни.
Результаты проведенного исследования свидетельствуют об отсутствии различия качества терапевтического сотрудничества при лечении традиционными и атипичными нейролептиками, что связано с их сопоставимой переносимостью. Больные, принимающие атипичные нейролептики, значительно реже страдают от заторможенности, непроизвольных движений и других побочных эффектов, характерных для традиционных средств. Однако у них часто развиваются метаболические, эндокринные и некоторые другие нарушения, доставляющие физическое или психологическое страдание, приводящие к изменениям внешности. Эти данные не соответствуют широко распространенному мнению о более высоком качестве терапевтического сотрудничества при лечении атипичными нейролептиками.
Особого обсуждения заслуживает вопрос значения микросоциальных факторов (роль семьи) в формировании терапевтического поведения больных шизофренией. Ранее ему был посвящен целый ряд исследований, однако единой точки зрения не сформировано. Наши данные свидетельствуют, что семейный фактор играет одну из решающих ролей в формировании различных моделей терапевтического поведения больных шизофренией. Установлено значение семейного положения, отношения родственников к проводимой терапии, их заинтересованности в ее успехе, активности их участия в лечебном процессе. Семья или близкое окружение может способствовать оптимизации терапевтического сотрудничества или приводить к его разрушению. Новизну имеют данные о феномене «выгорания» родственников при длительном лечении больных, снижении их заинтересованности в его успехе.
В заключение необходимо подчеркнуть, что выявленные различия эффективности атипичных нейролептиков определялись многими факторами: клиническими особенностями заболевания и психического состояния больных, безопасностью и переносимостью лечения, качеством терапевтического сотрудничества, заинтересованностью в успехе лечения и активностью участия в нем родственников больных. Эффективность купирующей терапии, проводимой обычно в стационаре, зависела главным образом от клинических особенностей патологического процесса. На эффективность лечения на этом этапе также влияла его безопасность и переносимость. Значение других факторов было незначительным, поскольку больные не могли самостоятельно контролировать режим приема лекарств, а родственники имели лишь ограниченную возможность вмешиваться в процесс лечения. При проведении длительной амбулаторной терапии роль этих факторов значительно возрастала. В связи с этим правомерно разграничение понятий «эффективность нейролептика», которая определяется его мощностью и спектром антипсихотического действия, и «эффективность терапии (лечебного процесса)», которая зависит от целого комплекса факторов. Обобщение полученных данных позволяет предложить схему зависимости эффективности лечебного процесса от различных факторов с учетом их взаимосвязи (многофакторная модель эффективности лечебного процесса) (см. рисунок).

Выводы
1. Эффективность терапии шизофрении зависит от многих факторов. Правомерно разграничение понятий «эффективность нейролептика» (определяется соотношением его мощности, спектра антипсихотического действия и клинических особенностей заболевания) и «эффективность лечебного процесса» (зависит от клинических особенностей заболевания, переносимости и безопасности терапии, качества терапевтического сотрудничества, заинтересованности и участия в лечении близкого окружения больного).
2. Эффективность атипичных нейролептиков значительно отличается при различных формах и вариантах течения шизофрении, разных симптомокомплексах, на различных этапах эндогенного процесса (обострение–ремиссия, манифестация–активное течение–дефект).
3. При обострениях параноидной шизофрении и шизофрении, протекающей приступообразно, эффективность нейролептиков (степень ослабления продуктивных расстройств, число больных со значительным улучшением состояния, скорость наступления терапевтического эффекта) убывает в ряду: клозапин Ѓ (высокопотентные типичные) Ѓ рисперидон и оланзапин Ѓ кветиапин (практически неэффективен); при вялотекущей шизофрении – в ряду: клозапин Ѓ кветиапин Ѓ оланзапин Ѓ рисперидон.
4. Спектр действия клозапина наиболее широк (симптомокомплексы различной структуры на различных этапах течения болезни – от ее манифестации до дефекта). Рисперидон и оланзапин наиболее эффективны при паранойяльном синдроме в рамках манифестации непрерывной шизофрении; при неразвернутых острых психозах (бредовое настроение и восприятие) и подострых приступах без выраженных нарушений стройности мышления на этапе «выгорания» шизофрении. К предикторам высокой эффективности кветиапина и оланзапина при вялотекущей шизофрении относятся навязчивости, деперсонализация и небредовая ипохондрия в сочетании с тревогой или субдепрессией. Оланзапин эффективен при двигательных навязчивостях, приближающихся к кататоническим стереотипиям. Специфичность действия рисперидона при вялотекущей шизофрении наиболее узка и ограничивается неврозоподобной симптоматикой при небольшой длительности болезни.
5. После отзвучания обострений различных форм шизофрении длительная терапия приводит к дальнейшему улучшению состояния больных. Оно проявляется ослаблением «остаточной» продуктивной, вторичной негативной и «эндореактивной» симптоматики. Окончательное формирование структуры ремиссии (структуры дефекта), максимальное восстановление социальной адаптации происходит спустя полгода – год.
6. При шизофрении, протекающей приступообразно, эффективность терапии убывает в ряду: клозапин Ѓ оланзапин Ѓ рисперидон. При вялотекущей шизофрении длительное применение атипичных нейролептиков приводит к сопоставимому ослаблению остаточных продуктивных расстройств; при лечении негативной симптоматики эффективность терапии убывает в ряду: клозапин Ѓ оланзапин и кветиапин Ѓ рисперидон. При манифестации различных форм шизофрении длительная терапия клозапином приводит к значительному ослаблению психопатологических расстройств вплоть до доболезненного уровня, а при непрерывной параноидной шизофрении способствует переходу ее течения из непрерывного в условно приступообразное.
7. Длительная терапия атипичными нейролептиками вносит значительные особенности в структуру лекарственных ремиссий. Применение клозапина в наибольшей степени способствует «отщеплению» продуктивной симптоматики (апатический тип ремиссий). Наиболее благоприятный вариант ремиссий при терапии рисперидоном характеризуется сочетанием симптомов простого дефицита и повышенной истощаемости с аффективными и ипохондрическими включениями (астенический вариант).
8. Эффективность амбулаторной терапии зависит от качества терапевтического сотрудничества. У большинства больных оно остается несформированным или нарушается в процессе лечения («ранний» и «поздний» нонкомплаенс). На его формирование влияют многие факторы (тяжесть психического состояния, особенности терапии, ее безопасность и переносимость, участие семьи в лечебном процессе). Их значение различается на ранних и отдаленных этапах ремиссии. Влияние одних факторов может нивелироваться за счет других.
9. Особенности психического состояния и нейролептической терапии вносят значительные коррективы в качество терапевтического сотрудничества, что проявляется различной частотой повторных обострений шизофрении. При непрерывной параноидной шизофрении и шизофрении, протекающей приступообразно, их частота возрастает при применении нейролептиков в ряду: клозапин Ѓ высокопотентные типичные Ѓ оланзапин Ѓ рисперидон; при вялотекущей шизофрении – в ряду: рисперидон, оланзапин и кветиапин Ѓ клозапин.
10. Эффективность лечения зависит от его переносимости и безопасности. Она снижается из-за необходимости пересмотра схемы лечения врачом (по жизненным показаниям, этическим соображениям или для поддержания терапевтического сотрудничества) или нарушения режима терапии больным без согласия врача (из-за субъективной тягостности состояния). При купирующей и поддерживающей терапии значение побочных эффектов для ограничения ее эффективности убывает в ряду: высокопотентные типичные нейролептики и клозапин Ѓ оланзапин Ѓ рисперидон Ѓ кветиапин.
11. Купирующая терапия атипичными нейролептиками относительно безопасна. Редкие осложнения (пневмонии, коллапсы) не представляют угрозы для молодых соматически здоровых пациентов при условии своевременного принятия соответствующих мер. Терапия клозапином более безопасна, чем это предполагалось ранее.
12. Значение побочных эффектов для формирования терапевтического сотрудничества определяется тяжестью психического состояния больного. Субъективный дискомфорт наиболее остро воспринимают больные с невысоким качеством ремиссий (психотическая, психопатоподобная, ипохондрическая симптоматика с отсутствием критики или сознания болезни). При ремиссиях высокого качества плохая переносимость терапии влияет на терапевтическое сотрудничество в меньшей степени.
13. Эффективность лечения и качество терапевтического сотрудничества зависят от особенностей семейного положения больного, отношения родственников к проводимой терапии, их заинтересованности в ее успехе, активности их участия в лечебном процессе. Семья или близкое окружение может способствовать формированию терапевтического сотрудничества или приводить к его разрушению.
14. Полученные данные свидетельствуют о правомерности формулирования принципа дифференцированного применения атипичных нейролептиков при лечении шизофрении.
Список исп. литературыСкрыть список1. Авруцкий Г.Я., Гурович И.Я., Громова В.В. Фармакотерапия психических заболеваний. М.: Медицина, 1974.
2. Морозова В.Д. Особенности клиники шизофрении, сочетающейся с церебральной сосудистой патологией. М., 1987.
3. Штернберг Э.Я. Особенности побочного действия психотропных средств в позднем возрасте. В кн.: Материалы II Всероссийского съезда невропатологов и психиатров. М., 1967; с. 552–3.
4. Chengappa K, Baker R, Kreinbrook S et al. Clozapine use in female geriatric patients with psychoses. Geriatric Psychiat Neurol 1995; 8 (1): 12–5.
5. Baldessarini RJ, Tarazi FI. Медикаментозное лечение психозов и маний. В кн.: Клиническая фармакология по Гудману и Гилману. М.: Практика, 2006; с. 382–411.
6. Arana GW, Rosenbaum JF. Фармакотерапия психических расстройств. М.: Бином, 2004.
7. Falkai P, Wobrock T, Lieberman J et al. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for Biological Treatment of Schizophrenia, Part 1: Acute treatment of schizophrenia (1). World J Biolog Psychiat 2005; 6 (3): 132–91.
8. Данилов Д.С. Повторная оценка безопасности применения клозапина при лечении шизофрении. Рос. психиат. журн. 2010; 1: 94–100.
9. Мосолов С.Н. Спорные и малоизученные вопросы практического использования антипсихотической фармакотерапии у больных шизофренией (анализ интерактивного опроса врачей). Тер. психич. расстройств. 2006; 1: 41–8.
10. American Psychiatric Association. Practice guideline for the treatment of patients with schizophrenia (2nd ed). Am J Psychiat 2004; 161 (2): 1–114.
11. Bebbington PE. The content and context of compliance. Internati Clin Psychopharmacol 1995; 9 (5): 41–50.
12. Sair A, Bhui K, Hag S et al. Improving treatment adherence among patients with chronic psychoses. Psychiat Bull 1998; 22: 77–81.
13. Александровский А.Б. Рецидивы шизофрении и пути их профилактики. М.: Медицина, 1964.
14. Алимов Х.А. Условия развития рецидивов шизофрении и некоторые пути их профилактики. Дис. ... канд. мед. наук. М., 1961.
15. Зеневич Г.В. Ремиссии при шизофрении. М.: Медицина, 1964.
16. Писарницкая А.М. Катамнез больных шизофренией, леченных методами активной терапии. Журн. невропатол. и психиат. им. С.С.Корсакова. 1952; 52 (2): 84–5.
17. Каневская Ф.О., Тарасов Г.К., Цуцульковская М.Я. Поддерживающая терапия нейролептическими препаратами в условиях психоневрологического диспансера. Журн. невропатол. и психиат. им. С.С.Корсакова. 1960; 60 (2): 242–7.
10 марта 2010
Количество просмотров: 2254


