Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2010
Оценка терапевтической эквивалентности двух препаратов кветиапина (Кетилепт и Сероквель) у больных с расстройствами шизофренического спектра №03 2010
Номера страниц в выпуске:13-16
Объем реализации воспроизведенных (генерических) лекарственных средств на фармацевтическом рынке Российской Федерации, как и во многих других странах мира, количественно превосходит долю оригинальных препаратов. Существующая тенденция справедлива и в отношении психотропных препаратов, среди которых за последние годы уже появилось и продолжает появляться все большее число генериков.
Объем реализации воспроизведенных (генерических) лекарственных средств на фармацевтическом рынке Российской Федерации, как и во многих других странах мира, количественно превосходит долю оригинальных препаратов. Существующая тенденция справедлива и в отношении психотропных препаратов, среди которых за последние годы уже появилось и продолжает появляться все большее число генериков. Наряду с очевидными преимуществами (более низкая стоимость и более широкая доступность лечения современными лекарственными средствами) применение генериков вызывает как у врачей, так и у пациентов целый ряд вопросов и опасений, связанных прежде всего с надлежащим уровнем эффективности и переносимости терапии, который должен быть не хуже, чем у оригинальных препаратов (А.С.Аведисова, Р.В.Ахапкин, 2008).
Проблема терапевтической эквивалентности все более часто поднимается в медицинской литературе, демонстрируя нелегкость и неоднозначность своего решения (B.Kirshner, 1991; R.Simon, 2004). Само понятие терапевтической эквивалентности воспроизведенного и оригинального лекарственного средства уже относительно давно определено регулирующими органами Европейского союза и США. В частности, в Европе подразумевают, что «лекарственный препарат терапевтически эквивалентен другому препарату, если он содержит ту же активную субстанцию или лекарственное вещество и, по результатам клинических исследований, обладает такой же эффективностью и безопасностью, как и препарат сравнения, эффективность и безопасность которого установлены» (CPMP, 1998). В США лекарственные средства считаются терапевтически эквивалентными, «только если они фармацевтически эквивалентны, и у них ожидаются одинаковые клинические эффекты и профиль безопасность при назначении пациентам по показаниям» (FDA, 2008). В обоих определениях однозначно говорится об эффективности и переносимости сравниваемой фармакотерапии, которые, как известно, устанавливаются путем проведения клинических исследований. Однако когда речь заходит о критериях терапевтической эквивалентности, сравнительная эффективность и переносимость в них не находят отражения. В частности, критерии терапевтической эквивалентности FDA включают: 1) разрешение препаратов к применению, 2) фармацевтическую эквивалентность, 3) биоэквивалентность, 4) соответствующую маркировку, 5) производство в соответствии со стандартами GMP (Good Manufacturing Practice). Таким образом, возникает определенная дилемма: с одной стороны, «идентичность эффективности и безопасности» подразумевает проведение специальных сравнительных клинических исследований, с другой – существующие правила не требуют проведения клинических исследований для установления терапевтической эквивалентности при регистрации воспроизведенного лекарственного средства. Что касается России, то в проекте Федерального закона «Об обращении лекарственных средств», многие положения которого начинают действовать уже с 2010 г., понятие «терапевтическая эквивалентность» отсутствует и речь идет только о биоэквивалентности.
Всеобщее признание биоэквивалентности в качестве стандарта оценки идентичности и взаимозаменяемости препаратов опирается на убежденность в том, что если препараты фармацевтически эквивалентны и обладают сходной биодоступностью, то они должны оказывать одинаковые клинические эффекты и иметь одинаковый профиль безопасности при введении пациентам в соответствии с указаниями в инструкции, т.е. являться терапевтически эквивалентными. Кроме того, принципы и методы определения биоэквивалентности давно и хорошо изучены и детально разработаны, их проведение не требует больших временных, материальных и энергозатрат, они могут быть легко воспроизведены в любой соответствующей лаборатории, при этом отклонения воспроизведенных результатов могут быть незначительными. Однако в большом количестве работ показано, что терапевтическая эквивалентность необязательно следует из биоэквивалентности (F.Heller, A.Dupont, 2009). Современный подход к определению биоэквивалентности, основанный на методике так называемой усредненной биоэквивалентности, допускает 20–25% различие фармакокинетических показателей генерического и оригинального препаратов. В этой связи существует опасение, что основанная на этой методике оценка эквивалентности может не подтвердиться в условиях клиники, особенно в случаях применения препаратов с узким терапевтическим интервалом или у пациентов с большой вариабельностью симптомов и их выраженности. Последнее особенно характерно для больных, страдающих психическими расстройствами, при которых помимо полиморфизма клинических проявлений отмечается также значительная вариабельность как терапевтических ответов, так и профилей переносимости.
Таким образом, установление биоэквивалентности не должно полностью подменять изучение терапевтической эквивалентности. Однако следует отметить, что проведение исследований терапевтической эквивалентности является не такой простой задачей, как может показаться на первый взгляд. Исходя из задач, ставящихся в исследованиях терапевтической эквивалентности (определение идентичности между сравниваемыми препаратами по их эффективности и переносимости), первой проблемой, возникающей перед исследователем, является выбор критериев оценки эффективности и переносимости. В настоящее время в исследованиях психофармакотерапии применяются самые разнообразные показатели, характеризующие терапевтический эффект, среди которых нет общепринятых стандартов, например число больных с улучшением, или респондеров, или степень редукции баллов психометрических шкал. Кроме того, эти показатели даже при исследованиях одного препарата у схожих групп больных дают очень вариабельные значения, что затрудняет определение терапевтического интервала для эталонного (оригинального) лекарственного средства и делает проблематичным сравнение с ним воспроизведенных препаратов.
Большинство исследований терапевтической эквивалентности вслед за сравнительными исследованиями эффективности терапии основывается на подтверждении статистической «нулевой» гипотезы, предполагающей, что между сравниваемыми препаратами нет различий, а следовательно, они эквиваленты (R.Simon, 2004). Проблемой при этом является то, что невозможность отклонить «нулевую» гипотезу часто рассматривается как ее подтверждение, в то время как она может быть обусловлена целым рядом других факторов, например недостаточным размером выборки или большой вариабельностью сравниваемых показателей. Кроме того, метод, сосредоточенный на ценности определения величины p как критерия статистической значимости, полностью игнорирует величину любого найденного различия между самими показателями. В этой связи целесообразным было бы, помимо нахождения p, также строить 95% доверительные интервалы различий между средними значениями сравниваемых показателей, позволяющими предположить наличие клинически важных различий в случае недостаточной мощности выборки.
Несмотря на обозначенный круг проблем, актуальных для исследований терапевтической эквивалентности, подобные испытания постепенно приходят в психофармакотерапию в связи с распространением генерических лекарственных средств. Наибольшее количество сравнений с оригиналом было проведено в отношении генериков клозапина. Не более десятка проведенных исследований, различавшихся по дизайну, числу больных и срокам терапии, дают противоречивые результаты, демонстрируя либо отсутствие различий между препаратами, по одним данным, либо выявляя различия между ними (не в пользу генерических препаратов) – по другим (C.Paton, 2006). Последнее исследование, основной особенностью которого было длительное 6-месячное сравнение эффективности и переносимости терапии клозапином, не выявило значимых различий между генерическим и оригинальным препаратами (O.Oluboka и соавт., 2010). Известны также два отечественных исследования еще одного атипичного нейролептика – рисперидона, в которых была показана терапевтическая эквивалентность его аналогов оригинальному препарату (Р.В.Ахапкин, 2008; А.И.Колчев, 2008).
Целью настоящего исследования стало определение взаимозаменяемости оригинального препарата кветиапина Сероквеля и генерического препарата Кетилепта на основании исследования их терапевтической эквивалентности. По данным компании-производителя, биоэквивалентность Кетилепта очень близка к оригинальному препарату.
Для определения терапевтической эквивалентности антипсихотиков был выбран открытый перекрестный дизайн исследования, предполагавший рандомизированную терапию Кетилептом или Сероквелем двух групп больных шизофренией в течение 1 мес, за который должна быть проведена титрация доз кветиапина и достигнуто стабильное состояние пациентов, после чего в обеих группах происходила замена исходного препарата на другой в той же дозе с последующим наблюдением за эффективностью и переносимостью лечения еще в течение 1 мес. Для оценки эффективности нейролептической терапии, помимо клинико-психопатологического метода, использовали шкалу общего клинического впечатления (CGI) и шкалу позитивных и негативных симптомов (PANSS). Переносимость терапии оценивали путем регистрации нежелательных явлений. Оценку состояния пациентов проводили на четырех этапах исследования: исходную при включении в испытание, в конце 1-го месяца терапии перед заменой препарата, через 1 нед после замены препарата и в конце 2-го месяца терапии.
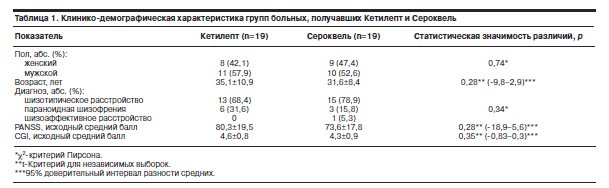
Исследование выполняли на базе ПКБ №12 г. Москвы. Все пациенты проходили амбулаторное лечение, их состояние на момент включения определялось отсутствием острой психотической симптоматики, а в психическом статусе в основном преобладали негативные симптомы. Проводимая антипсихотическая терапия являлась преимущественно поддерживающей. В общей сложности лечение было начато у 41 пациента. Двое больных, начавших принимать Кетилепт, и один – Сероквель, пропустили период замены препарата и были исключены из дальнейшего исследования. Таким образом, в исследование вошли 38 больных, по 19 человек в каждой группе, из которых все завершили программу в срок. Сформированные терапевтические группы были сопоставимы по возрасту, полу, формам и вариантам течения шизофрении, выраженности фоновых показателей, о чем свидетельствует отсутствие статистически значимых различий по демографическим и клиническим показателям между сравниваемыми группами пациентов (табл. 1).
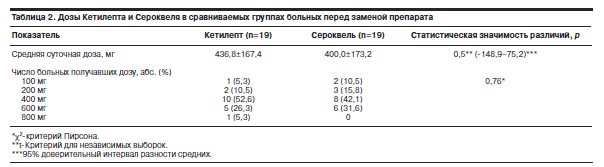
На первом этапе исследования в обеих группах больных проводили титрацию доз кветиапина до терапевтически эффективного уровня, обеспечивающего стабильное состояние пациентов. Титрацию начинали с дозы 50–100 мг/сут, которую повышали при необходимости вплоть до 800 мг/сут. Средняя суточная доза Кетилепта (436,8±167,4 мг/сут) оказалась немного выше средней суточной дозы Сероквеля (400,0±173,2 мг/сут). Кроме того, среди больных, принимавших первоначально Кетилепт, был 1 пациент, получавший 800 мг препарата в сутки, в то время как ни один больной из тех, кто начал принимать Сероквель, не дошел до такого уровня дозировки. Большинство пациентов в обеих группах принимали кветиапин в дозе 400 мг/сут. Второй по распространенности оказалась доза 600 мг/сут. Выявленные незначительные различия между группами не имели статистической значимости (табл. 2).
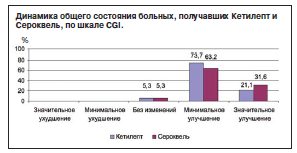
При этом общее состояние осталось без изменений лишь у 1 (5,3%) пациента в каждой из групп. Минимальное улучшение было выявлено у 73,7% больных, получавших Кетилепт, и у 63,2% пациентов, принимавших Сероквель, а значительное улучшение – у 21,1% больных в 1-й группе и у 31,6% – во 2-й (см. рисунок).
Значимость различий между группами не была установлена ни по одному из описанных показателей.
На первом этапе исследования нежелательные явления возникли у 9 (47,4%) пациентов, принимавших Кетилепт, и у 10 (52,6%) больных, получавших Сероквель.
Как видно из табл. 4, оба препарата характеризовались одинаковым профилем переносимости.
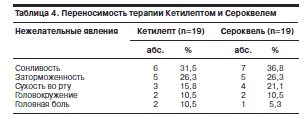
Наиболее частыми побочными эффектами являлись сонливость и заторможенность, которые возникали у 31,5% больных при приеме Кетилепта и у 36,8% пациентов, принимавших Сероквель. Сухость во рту, головокружение и головная боль возникали реже, имея примерно одинаковую распространенность в группах.
Выраженность всех нежелательных явлений, возникавших при терапии изучаемыми препаратами, не превышала умеренной степени, и они субъективно легко переносились больными. Все нежелательные явления возникали в период с 1-й по 2-ю неделю терапии и впоследствии подвергались частичной или полной редукции, не требовавшей корректировки доз исследуемых препаратов или других мер.
На втором этапе исследования со второй половины 28-го дня производили перекрестную замену Кетилепта на Сероквель в 1-й группе пациентов и Сероквеля на Кетилепт во 2-й. Состояние пациентов оценивали через неделю (35-й день) и через месяц (56-й день) после замены препаратов.
Вновь назначенные препараты давали в той же самой дозе, которая была подобрана за первые 4 нед исследования. С 28-го по 56-й день наблюдения ни у одного пациента в какой-либо группе больных не пришлось изменять дозировку кветиапина, т.е. соотношение пациентов, принимавших разные дозы препарата, а также величина средней дозы в каждой группе остались такими же, как и в конце первого этапа исследования (см. табл. 2).
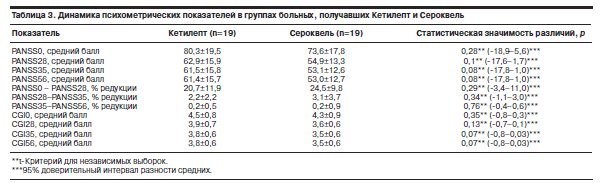
В обеих группах пациентов в среднем продолжилась редукция симптоматики, хотя ее темпы заметно снизились вследствие достижения большинством больных стабильного состояния. Так, среди пациентов 1-й группы через 1 нед после замены Кетилепта на Сероквель средний балл шкалы PANSS снизился на 1,4 пункта, а средний процент его редукции составил 2,2%, тяжесть общего состояния по шкале CGI также в среднем уменьшилась на 0,1 балла. За последующие 3 нед средний балл шкалы PANSS в этой группе снизился в среднем еще на 0,1 пункта, а средний процент его редукции стал 0,2%, тяжесть общего состояние по CGI не изменилась. Аналогичная ситуация происходила и после замены Сероквеля на Кетилепт (см. табл. 3). Во 2-й группе через 1 нед после смены препарата средний балл шкалы PANSS уменьшился на 1,8 пункта, а его средняя редукция соответствовала 3,1%, тяжесть общего состояния по шкале CGI в среднем сократилась на 0,1 балла. В последние 3 нед исследования изменения среднего балла шкалы PANSS, среднего процента его редукции, а также тяжести общего состояние по шкале CGI во 2-й группе были в точности такими же, как и в 1-й. Выявляемые различия между группами в абсолютных и относительных величинах оцениваемых показателей были статистически незначимыми.
Несмотря на то что после перекрестной замены препаратов в обеих группах имелись единичные пациенты, у которых на 35-й или 56-й дни исследования отмечено повышение общего балла шкалы PANSS на 1–2 пункта по сравнению с 28-м днем, это не было расценено как ухудшение общего состояния как субъективно самими пациентами, так и по оценкам динамики состояния шкалы CGI. Поэтому соотношения больных по степени улучшения состояния в обеих группах по сравнению с исходным уровнем на 35-й и 56-й дни терапии остались такими же, как и на момент замены препаратов (см. рисунок).
После замены препаратов ни в одной из групп у больных не возникло новых нежелательных явлений. Все пациенты закончили исследование в срок. В отличие от некоторых работ, демонстрировавших увеличение «психологических» нежелательных явлений в связи с заменой оригинальных препаратов на генерические, в настоящем исследовании ни один пациент не подтвердил, что каким-либо образом почувствовал смену одного препарата на другой, притом что исследование являлось открытым и больные знали о замене одного препарата кветиапина на другой.
Таким образом, в результате проведенного исследования было показано, что при терапии оригинальным препаратом кветианина Сероквелем и генерическим препаратом Кетилептом двух групп пациентов, сопоставимых по своим демографическим и клиническим характеристикам, не выявляется каких-либо статистически значимых различий между группами больных по показателям как эффективности, так и переносимости терапии. При сравнении абсолютных величин показателей тяжести общего состояния по шкале CGI и среднего балла PANSS, которые исходно были несколько выше в 1-й группе и сохраняли более выраженный характер на протяжении всего исследования, с учетом широты доверительных интервалов разницы средних величин этих показателей и уменьшения значения p со временем, могло возникнуть предположение о возможности существования значимых различий между группами, которые не проявились либо в силу малого размера выборки, либо из-за недостаточной продолжительности наблюдения. Введение в анализ относительного показателя – среднего процента редукции общего балла шкалы PANSS, позволившего в определенной степени нивелировать имевшуюся неравномерность между группами, показало, что значимость различий между группами не только не возрастала в процессе терапии, но и, наоборот, уменьшалась, так как темпы редукции среднего балла шкалы PANSS сравнялись в обеих группах к концу исследования.
Замена одного препарата на другой не повлияла ни на один из анализируемых показателей, включая соотношение числа больных с улучшением, дозы назначаемого препарата, количество и выраженность нежелательных явлений, и для пациентов по их субъективным оценкам прошла «незамеченной».
Учитывая полученные данные, можно сделать вывод о терапевтической эквивалентности и взаимозаменяемости генерического препарата Кетилепт и оригинального Сероквеля.
Проблема терапевтической эквивалентности все более часто поднимается в медицинской литературе, демонстрируя нелегкость и неоднозначность своего решения (B.Kirshner, 1991; R.Simon, 2004). Само понятие терапевтической эквивалентности воспроизведенного и оригинального лекарственного средства уже относительно давно определено регулирующими органами Европейского союза и США. В частности, в Европе подразумевают, что «лекарственный препарат терапевтически эквивалентен другому препарату, если он содержит ту же активную субстанцию или лекарственное вещество и, по результатам клинических исследований, обладает такой же эффективностью и безопасностью, как и препарат сравнения, эффективность и безопасность которого установлены» (CPMP, 1998). В США лекарственные средства считаются терапевтически эквивалентными, «только если они фармацевтически эквивалентны, и у них ожидаются одинаковые клинические эффекты и профиль безопасность при назначении пациентам по показаниям» (FDA, 2008). В обоих определениях однозначно говорится об эффективности и переносимости сравниваемой фармакотерапии, которые, как известно, устанавливаются путем проведения клинических исследований. Однако когда речь заходит о критериях терапевтической эквивалентности, сравнительная эффективность и переносимость в них не находят отражения. В частности, критерии терапевтической эквивалентности FDA включают: 1) разрешение препаратов к применению, 2) фармацевтическую эквивалентность, 3) биоэквивалентность, 4) соответствующую маркировку, 5) производство в соответствии со стандартами GMP (Good Manufacturing Practice). Таким образом, возникает определенная дилемма: с одной стороны, «идентичность эффективности и безопасности» подразумевает проведение специальных сравнительных клинических исследований, с другой – существующие правила не требуют проведения клинических исследований для установления терапевтической эквивалентности при регистрации воспроизведенного лекарственного средства. Что касается России, то в проекте Федерального закона «Об обращении лекарственных средств», многие положения которого начинают действовать уже с 2010 г., понятие «терапевтическая эквивалентность» отсутствует и речь идет только о биоэквивалентности.
Всеобщее признание биоэквивалентности в качестве стандарта оценки идентичности и взаимозаменяемости препаратов опирается на убежденность в том, что если препараты фармацевтически эквивалентны и обладают сходной биодоступностью, то они должны оказывать одинаковые клинические эффекты и иметь одинаковый профиль безопасности при введении пациентам в соответствии с указаниями в инструкции, т.е. являться терапевтически эквивалентными. Кроме того, принципы и методы определения биоэквивалентности давно и хорошо изучены и детально разработаны, их проведение не требует больших временных, материальных и энергозатрат, они могут быть легко воспроизведены в любой соответствующей лаборатории, при этом отклонения воспроизведенных результатов могут быть незначительными. Однако в большом количестве работ показано, что терапевтическая эквивалентность необязательно следует из биоэквивалентности (F.Heller, A.Dupont, 2009). Современный подход к определению биоэквивалентности, основанный на методике так называемой усредненной биоэквивалентности, допускает 20–25% различие фармакокинетических показателей генерического и оригинального препаратов. В этой связи существует опасение, что основанная на этой методике оценка эквивалентности может не подтвердиться в условиях клиники, особенно в случаях применения препаратов с узким терапевтическим интервалом или у пациентов с большой вариабельностью симптомов и их выраженности. Последнее особенно характерно для больных, страдающих психическими расстройствами, при которых помимо полиморфизма клинических проявлений отмечается также значительная вариабельность как терапевтических ответов, так и профилей переносимости.
Таким образом, установление биоэквивалентности не должно полностью подменять изучение терапевтической эквивалентности. Однако следует отметить, что проведение исследований терапевтической эквивалентности является не такой простой задачей, как может показаться на первый взгляд. Исходя из задач, ставящихся в исследованиях терапевтической эквивалентности (определение идентичности между сравниваемыми препаратами по их эффективности и переносимости), первой проблемой, возникающей перед исследователем, является выбор критериев оценки эффективности и переносимости. В настоящее время в исследованиях психофармакотерапии применяются самые разнообразные показатели, характеризующие терапевтический эффект, среди которых нет общепринятых стандартов, например число больных с улучшением, или респондеров, или степень редукции баллов психометрических шкал. Кроме того, эти показатели даже при исследованиях одного препарата у схожих групп больных дают очень вариабельные значения, что затрудняет определение терапевтического интервала для эталонного (оригинального) лекарственного средства и делает проблематичным сравнение с ним воспроизведенных препаратов.
Большинство исследований терапевтической эквивалентности вслед за сравнительными исследованиями эффективности терапии основывается на подтверждении статистической «нулевой» гипотезы, предполагающей, что между сравниваемыми препаратами нет различий, а следовательно, они эквиваленты (R.Simon, 2004). Проблемой при этом является то, что невозможность отклонить «нулевую» гипотезу часто рассматривается как ее подтверждение, в то время как она может быть обусловлена целым рядом других факторов, например недостаточным размером выборки или большой вариабельностью сравниваемых показателей. Кроме того, метод, сосредоточенный на ценности определения величины p как критерия статистической значимости, полностью игнорирует величину любого найденного различия между самими показателями. В этой связи целесообразным было бы, помимо нахождения p, также строить 95% доверительные интервалы различий между средними значениями сравниваемых показателей, позволяющими предположить наличие клинически важных различий в случае недостаточной мощности выборки.
Несмотря на обозначенный круг проблем, актуальных для исследований терапевтической эквивалентности, подобные испытания постепенно приходят в психофармакотерапию в связи с распространением генерических лекарственных средств. Наибольшее количество сравнений с оригиналом было проведено в отношении генериков клозапина. Не более десятка проведенных исследований, различавшихся по дизайну, числу больных и срокам терапии, дают противоречивые результаты, демонстрируя либо отсутствие различий между препаратами, по одним данным, либо выявляя различия между ними (не в пользу генерических препаратов) – по другим (C.Paton, 2006). Последнее исследование, основной особенностью которого было длительное 6-месячное сравнение эффективности и переносимости терапии клозапином, не выявило значимых различий между генерическим и оригинальным препаратами (O.Oluboka и соавт., 2010). Известны также два отечественных исследования еще одного атипичного нейролептика – рисперидона, в которых была показана терапевтическая эквивалентность его аналогов оригинальному препарату (Р.В.Ахапкин, 2008; А.И.Колчев, 2008).
Целью настоящего исследования стало определение взаимозаменяемости оригинального препарата кветиапина Сероквеля и генерического препарата Кетилепта на основании исследования их терапевтической эквивалентности. По данным компании-производителя, биоэквивалентность Кетилепта очень близка к оригинальному препарату.
Для определения терапевтической эквивалентности антипсихотиков был выбран открытый перекрестный дизайн исследования, предполагавший рандомизированную терапию Кетилептом или Сероквелем двух групп больных шизофренией в течение 1 мес, за который должна быть проведена титрация доз кветиапина и достигнуто стабильное состояние пациентов, после чего в обеих группах происходила замена исходного препарата на другой в той же дозе с последующим наблюдением за эффективностью и переносимостью лечения еще в течение 1 мес. Для оценки эффективности нейролептической терапии, помимо клинико-психопатологического метода, использовали шкалу общего клинического впечатления (CGI) и шкалу позитивных и негативных симптомов (PANSS). Переносимость терапии оценивали путем регистрации нежелательных явлений. Оценку состояния пациентов проводили на четырех этапах исследования: исходную при включении в испытание, в конце 1-го месяца терапии перед заменой препарата, через 1 нед после замены препарата и в конце 2-го месяца терапии.
Исследование выполняли на базе ПКБ №12 г. Москвы. Все пациенты проходили амбулаторное лечение, их состояние на момент включения определялось отсутствием острой психотической симптоматики, а в психическом статусе в основном преобладали негативные симптомы. Проводимая антипсихотическая терапия являлась преимущественно поддерживающей. В общей сложности лечение было начато у 41 пациента. Двое больных, начавших принимать Кетилепт, и один – Сероквель, пропустили период замены препарата и были исключены из дальнейшего исследования. Таким образом, в исследование вошли 38 больных, по 19 человек в каждой группе, из которых все завершили программу в срок. Сформированные терапевтические группы были сопоставимы по возрасту, полу, формам и вариантам течения шизофрении, выраженности фоновых показателей, о чем свидетельствует отсутствие статистически значимых различий по демографическим и клиническим показателям между сравниваемыми группами пациентов (табл. 1).

На первом этапе исследования в обеих группах больных проводили титрацию доз кветиапина до терапевтически эффективного уровня, обеспечивающего стабильное состояние пациентов. Титрацию начинали с дозы 50–100 мг/сут, которую повышали при необходимости вплоть до 800 мг/сут. Средняя суточная доза Кетилепта (436,8±167,4 мг/сут) оказалась немного выше средней суточной дозы Сероквеля (400,0±173,2 мг/сут). Кроме того, среди больных, принимавших первоначально Кетилепт, был 1 пациент, получавший 800 мг препарата в сутки, в то время как ни один больной из тех, кто начал принимать Сероквель, не дошел до такого уровня дозировки. Большинство пациентов в обеих группах принимали кветиапин в дозе 400 мг/сут. Второй по распространенности оказалась доза 600 мг/сут. Выявленные незначительные различия между группами не имели статистической значимости (табл. 2).



При этом общее состояние осталось без изменений лишь у 1 (5,3%) пациента в каждой из групп. Минимальное улучшение было выявлено у 73,7% больных, получавших Кетилепт, и у 63,2% пациентов, принимавших Сероквель, а значительное улучшение – у 21,1% больных в 1-й группе и у 31,6% – во 2-й (см. рисунок).
Значимость различий между группами не была установлена ни по одному из описанных показателей.
На первом этапе исследования нежелательные явления возникли у 9 (47,4%) пациентов, принимавших Кетилепт, и у 10 (52,6%) больных, получавших Сероквель.
Как видно из табл. 4, оба препарата характеризовались одинаковым профилем переносимости.

Наиболее частыми побочными эффектами являлись сонливость и заторможенность, которые возникали у 31,5% больных при приеме Кетилепта и у 36,8% пациентов, принимавших Сероквель. Сухость во рту, головокружение и головная боль возникали реже, имея примерно одинаковую распространенность в группах.
Выраженность всех нежелательных явлений, возникавших при терапии изучаемыми препаратами, не превышала умеренной степени, и они субъективно легко переносились больными. Все нежелательные явления возникали в период с 1-й по 2-ю неделю терапии и впоследствии подвергались частичной или полной редукции, не требовавшей корректировки доз исследуемых препаратов или других мер.
На втором этапе исследования со второй половины 28-го дня производили перекрестную замену Кетилепта на Сероквель в 1-й группе пациентов и Сероквеля на Кетилепт во 2-й. Состояние пациентов оценивали через неделю (35-й день) и через месяц (56-й день) после замены препаратов.
Вновь назначенные препараты давали в той же самой дозе, которая была подобрана за первые 4 нед исследования. С 28-го по 56-й день наблюдения ни у одного пациента в какой-либо группе больных не пришлось изменять дозировку кветиапина, т.е. соотношение пациентов, принимавших разные дозы препарата, а также величина средней дозы в каждой группе остались такими же, как и в конце первого этапа исследования (см. табл. 2).
В обеих группах пациентов в среднем продолжилась редукция симптоматики, хотя ее темпы заметно снизились вследствие достижения большинством больных стабильного состояния. Так, среди пациентов 1-й группы через 1 нед после замены Кетилепта на Сероквель средний балл шкалы PANSS снизился на 1,4 пункта, а средний процент его редукции составил 2,2%, тяжесть общего состояния по шкале CGI также в среднем уменьшилась на 0,1 балла. За последующие 3 нед средний балл шкалы PANSS в этой группе снизился в среднем еще на 0,1 пункта, а средний процент его редукции стал 0,2%, тяжесть общего состояние по CGI не изменилась. Аналогичная ситуация происходила и после замены Сероквеля на Кетилепт (см. табл. 3). Во 2-й группе через 1 нед после смены препарата средний балл шкалы PANSS уменьшился на 1,8 пункта, а его средняя редукция соответствовала 3,1%, тяжесть общего состояния по шкале CGI в среднем сократилась на 0,1 балла. В последние 3 нед исследования изменения среднего балла шкалы PANSS, среднего процента его редукции, а также тяжести общего состояние по шкале CGI во 2-й группе были в точности такими же, как и в 1-й. Выявляемые различия между группами в абсолютных и относительных величинах оцениваемых показателей были статистически незначимыми.
Несмотря на то что после перекрестной замены препаратов в обеих группах имелись единичные пациенты, у которых на 35-й или 56-й дни исследования отмечено повышение общего балла шкалы PANSS на 1–2 пункта по сравнению с 28-м днем, это не было расценено как ухудшение общего состояния как субъективно самими пациентами, так и по оценкам динамики состояния шкалы CGI. Поэтому соотношения больных по степени улучшения состояния в обеих группах по сравнению с исходным уровнем на 35-й и 56-й дни терапии остались такими же, как и на момент замены препаратов (см. рисунок).
После замены препаратов ни в одной из групп у больных не возникло новых нежелательных явлений. Все пациенты закончили исследование в срок. В отличие от некоторых работ, демонстрировавших увеличение «психологических» нежелательных явлений в связи с заменой оригинальных препаратов на генерические, в настоящем исследовании ни один пациент не подтвердил, что каким-либо образом почувствовал смену одного препарата на другой, притом что исследование являлось открытым и больные знали о замене одного препарата кветиапина на другой.
Таким образом, в результате проведенного исследования было показано, что при терапии оригинальным препаратом кветианина Сероквелем и генерическим препаратом Кетилептом двух групп пациентов, сопоставимых по своим демографическим и клиническим характеристикам, не выявляется каких-либо статистически значимых различий между группами больных по показателям как эффективности, так и переносимости терапии. При сравнении абсолютных величин показателей тяжести общего состояния по шкале CGI и среднего балла PANSS, которые исходно были несколько выше в 1-й группе и сохраняли более выраженный характер на протяжении всего исследования, с учетом широты доверительных интервалов разницы средних величин этих показателей и уменьшения значения p со временем, могло возникнуть предположение о возможности существования значимых различий между группами, которые не проявились либо в силу малого размера выборки, либо из-за недостаточной продолжительности наблюдения. Введение в анализ относительного показателя – среднего процента редукции общего балла шкалы PANSS, позволившего в определенной степени нивелировать имевшуюся неравномерность между группами, показало, что значимость различий между группами не только не возрастала в процессе терапии, но и, наоборот, уменьшалась, так как темпы редукции среднего балла шкалы PANSS сравнялись в обеих группах к концу исследования.
Замена одного препарата на другой не повлияла ни на один из анализируемых показателей, включая соотношение числа больных с улучшением, дозы назначаемого препарата, количество и выраженность нежелательных явлений, и для пациентов по их субъективным оценкам прошла «незамеченной».
Учитывая полученные данные, можно сделать вывод о терапевтической эквивалентности и взаимозаменяемости генерического препарата Кетилепт и оригинального Сероквеля.
Список исп. литературыСкрыть список1. Аведисова А.С. Ахапкин Р.В. Генерики: мифы и факты. Учебное пособие. М., 2008.
2. Ахапкин Р.В. Исследование терапевтической эквивалентности двух препаратов рисперидона – рилептида и рисполепта у больных шизофренией. Журн. неврол. и психиат. им. С.С.Корсакова. М., 2008; 8: 29–33.
3. Колчев А.И. Программа ТЭССА (Терапевтическая Эквивалентность Сперидана и Рисполепта). Рус. мед. журн. М., 2008; 16 (26): 1786–9.
4. Approved drug product with therapeutic equivalence evaluations. 28th Edition. FDA, 2008.
5. Heller FR, Dupont AG. Generics: need for clinical concern? Acta Clin Belg 2009; 64 (5): 415–22.
6. Kirshner B. Methodological standards for assessing therapeutic equivalence. J Clin Epidemiol 1991; 44 (8): 839–49.
7. Oluboka O, Stewart S, Landry S, Adams S. Does therapeutic equivalence follow bioequivalence? A randomized trial to assess clinical effects after switching from clozaril to generic clozapine (gen-clozapine). J Clin Pharmacol 2010; 50 (5): 531–5.
8. Paton C. Generic clozapine: outcomes after switching formulations. Brit J Psychiat 2006; 189: 184–5.
9. Simon RM. Design and Analysis of Therapeutic Equivalence Trials. Advances in clinical trial biostatistics. Ed. by Geller N. L. 2004.
10. The rules governing medicinal products in the European Union. Investigation of Bioavailability and Bioequivalence, v. 3C, 1998.


