Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2010
Ладастен в терапии органической астении и расстройств адаптации №03 2010
Номера страниц в выпуске:23-27
Набор психотропных средств в терапии астении с учетом психогенных, конституциональных, соматогенных, эндогенно-процессуальных факторов оставался до недавнего времени относительно неизменным. В качестве препаратов выбора используются ноотропы, адаптогены, транквилизаторы, психостимуляторы, антидепрессанты с преимущественно активирующим компонентом действия. Однако назначение этих средств требует ограничения. В первую очередь это касается нежелательных явлений. В ГУ НИИ фармакологии им. В.В.Закусова РАМН было найдено соединение адамантилбромфениламин. Разработка препарата на основе фармакогенетической методологии позволила установить наличие у него активирующих и анксиолитических свойств. Новое соединение было названо «Ладастен». Получило дальнейшее развитие научное положение о различных механизмах действия Ладастена в условиях экспериментально-стрессового воздействия.
В зарубежных и отечественных исследованиях в терминологический строй применительно к астеническим состояниям включены: соматогенная астения; невропатическая конституция (конституциональные астеники); астенические депрессии; «псевдоневротическая» («процессуальная псевдоастения», «шизоастения») астения в клинике шизофрении [1]. Набор психотропных средств в терапии астении с учетом психогенных, конституциональных, соматогенных, эндогенно-процессуальных факторов оставался до недавнего времени относительно неизменным. В качестве препаратов выбора используются ноотропы, адаптогены, транквилизаторы, психостимуляторы, антидепрессанты с преимущественно активирующим компонентом действия. Однако назначение этих средств требует ограничения. В первую очередь это касается нежелательных явлений (НЯ) в виде гипоседации или гиперстимулирующего действия, миорелаксации и аддиктивного потенциала транквилизаторов и психостимуляторов, а также возникновения синдрома отмены. Подтверждены, к примеру, результаты ранее проведенных исследований об ограниченных возможностях применения сиднокарба только при гипостенических вариантах астении; негативном влиянии препарата на тревогу, расстройства сна и другие гиперергические проявления в структуре астении [2]. В ГУ НИИ фармакологии им. В.В.Закусова РАМН было найдено соединение адамантилбромфениламин. Разработка препарата на основе фармакогенетической методологии позволила установить наличие у него активирующих и анксиолитических свойств. Новое соединение было названо «Ладастен». Получило дальнейшее развитие научное положение о различных механизмах действия Ладастена в условиях экспериментально-стрессового воздействия: усиление моноаминергических процессов у животных с активным фенотипом ответа на стресс (активация поведения) и предотвращение нарушения ГАМК-трансмиссии при выраженной реакции страха у животных с пассивно-оборонительной стратегией поведения в условиях эмоционально-стрессовой реакции [3].
Изучен психотропный эффект Ладастена у пациентов с диагностической рубрикой МКБ-10 (1994 г.) «Неврастения» (F48.0) без сопутствующей соматической и неврологической патологии [4]. Наиболее выраженным с первых дней приема Ладастена был активирующий эффект в виде повышения уровня бодрствования и редукции астении, несколько позднее выявлялся статистически значимый показатель анксиолитического эффекта. Ко 2-й неделе краткосрочной терапии отмечено позитивное влияние препарата на нарушение ночного сна и сниженное настроение. Верифицирована с помощью типа организации электроэнцефалографии (в частности, альфа-ритма) индивидуально-типологическая реакция на Ладастен у больных с неврастенией [5]. Подтверждена эффективность Ладастена в терапии неврастении в ходе рандомизированного слепого плацебо-контролируемого исследования [6]. Получены доказательства эффективности Ладастена в терапии соматогенной астении при инфекционных, гастроэнтерологических, кардиологических и ревматоидных заболеваниях и неврастении [7].
Материалы и методы
Целью настоящего исследования явилось изучение клинической эффективности и безопасности Ладастена у больных с органическим эмоционально-лабильным (астеническим) расстройством (в последующем изложении органическая астения – ОА; F06.6) и расстройством адаптации (РА) – F43.2 по МКБ-10 [8]. Общее число включенных в исследование больных составило 29 человек. Среди пациентов с ОА (n=13) женщин было 7 (53,8%), мужчин – 6 (46,2%), средний возраст 47,1±3,7 года, продолжительность актуального астенического состояния 4,9±1,4 мес. В соответствии с причиной ОА пациенты распределились следующим образом: сосудистая патология в виде артериальной гипертензии, артериальной гипотензии, атеросклероза церебральных сосудов, врожденного порока сердца – 30,8%, отдаленные последствия закрытой черепно-мозговой травмы легкой и средней степени тяжести – 23,1%, сочетанная посттравматическая и сосудистая патология – 38,5%, посттравматическая и послеоперационная (оперативное вмешательство по поводу рака желудка) – 7,7%.
В группе пациентов с РА (n=16) женщин было 12 (75%), мужчин – 4 (25%), средний возраст на момент обследования составил 42,3±3,2 года; продолжительность болезненного состояния 4,8±1,05 мес.
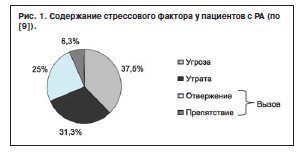
Среди пациентов с РА в ближайшем анамнезе выявлена объективная психотравмирующая ситуация с ее личностным значением в виде «Утраты», «Угрозы», «Вызова» [9] (рис. 1). В содержание стрессового фактора «Угроза» (37,5%) включены угроза здоровью значимых лиц, вербальная агрессия и угроза физической расправы (к примеру, со стороны соседей по общежитию), угроза материальному положению семьи в связи с алкоголизацией одного из членов семьи, угроза увольнения в связи с «набором новой команды» после смены руководителя организации. Стрессовая ситуация в виде «Утраты» (31,3%) подразумевала утрату актуального объекта привязанности и любви (в том числе разрыв отношений с молодым человеком по причине его наркотизации), разлуку с взрослой дочерью в связи с ее переездом в другой город, смерть мужа после длительной болезни с утратой опоры в жизни и материального достатка в семье, утрату места работы в связи с сокращением штата. Личное значение стрессового фактора «Вызов» (25%) содержало отвержение жены мужем в связи с его алкоголизацией, оскорблениями в адрес жены; взрослой дочери – матерью («постоянные ссоры с матерью, домашняя обстановка выбивает из колеи»), отца ребенка бывшей женой («после расторжения брака запрещает видеться с сыном»), отвержение сотрудника непосредственным руководителем («обман с распределением жилья»); отвержение отца сыном-наркоманом в силу девиантного поведения. Содержание стрессового фактора в виде «Препятствия» могло подразумевать повышение в должности по работе с невозможностью справиться с оперативным составлением деловой документации. Как правило, у каждого пациента имел место один стрессовый фактор.
Длительность терапии Ладастеном составила 28 дней. Оценку состояния проводили на 0, 3, 7, 14, 21 и 28-й дни от начала терапии. В первые 2 нед терапии Ладастен назначали в дозе 50–100 мг/сут в 1 или 2 приема в утренние и дневные часы, на 3-й неделе допускали по необходимости увеличение дозы до 150 мг/сут в 2 приема. Терапевтическая доза у 61,5% больных составила 150 мг/сут, у 30,8% – 100 мг/сут, у 7,7% – 50 мг/сут. Исследование проведено на базе ИОКПБ №1 в отделении пограничных состояний №13 и дневном стационаре.
Анализ эффективности терапии проведен с использованием общепринятых 2 субшкал шкалы общего клинического впечатления (CGI-S и CGI-I), шкал оценки астении (MFI – The Multidimensional Fatigue Inventory), визуальной аналоговой шкалы астении (VAS-A). Достоверность рассчитывали с использованием пакета Statistica 6.0 [Difference tests: r,%, means (Difference between two proportions)]; при анализе динамики редукции баллов по шкалам использовали парный двухвыборочный t-тест для средних. Сравнительный анализ базисных (общих) критериев астенических состояний [7] в клинике ОА и РА проведен по методу определения их частоты в общей совокупности признаков [10].
Результаты
Среди пациентов с ОА и РА закончили исследование 26 (89,7%) человек, выбыли из исследования 3 (10,3%) человека: по одному больному в связи с неэффективностью терапии, острой респираторной вирусной инфекцией, плановой госпитализацией в кардиологическое отделение.
На фоне лечения Ладастеном наблюдались следующие симптомы: тошнота (у 2-х больных), сонливость (у 2-х больных), головная боль (у 1-го больного), которые были кратковременные и не требовали отмены препарата.
Сравнительный анализ астенических состояний выявил достоверно большую представленность нарушений физической и умственной активности в группе больных с ОА (р<0,05) по сравнению с группой больных с РА (см. таблицу).
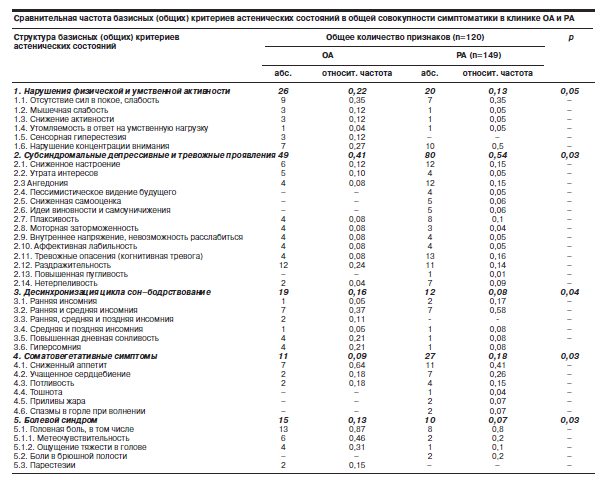
В структуре нарушений физической и умственной активности в обеих группах пациентов первое ранговое место по частоте занимает симптом отсутствия сил в покое с ощущением постоянной слабости (соответственно 34,6%/26 и 35,6%/20); значительно реже в группе пациентов с ОА отмечали мышечную слабость и снижение активности в производственной и бытовой сферах (соответственно по 11,5%/26), в единичных наблюдениях эти симптомы выявлены в группе пациентов с РА. У пациентов с РА отсутствовал симптом сенсорной гиперестезии, напротив, в группе пациентов с ОА он был представлен в 49 (11,5%) наблюдениях. Нарушение концентрации внимания выявлено у половины пациентов с РА (50%/20), в то время как с ОА – лишь у 1/4 пациентов (26,9%/26).
В группе пациентов с РА отмечена достоверно большая частота субсиндромальных депрессивных и тревожных расстройств (р<0,03) по сравнению с группой больных с ОА. Структура блока субсиндромальных депрессивных и тревожных расстройств значительно «рассыпана» по своим проявлениям и включала 14 наименований. Существенно отметить, что в клинике ОА отсутствуют симптомы пессимистического видения будущего, сниженной самооценки, идей виновности и уничижения, повышенной пугливости. Близким по частоте в обеих группах пациентов с РА и ОА оказалось наличие симптома сниженного настроения (соответственно 15%/80 и 12,2%/49). У больных с ОА заметно преобладала частота раздражительности (24,5%/49 против 13,8%/80). Напротив, у пациентов с РА в 2 раза чаще выявлены навязчивые тревожные опасения, отражающие психотравмирующую ситуацию, когнитивная тревога (16,3%/80 против 8,2%/49), так же как и симптом нетерпеливости (8,8%/80 против 4,1%/49).
В структуре болевого синдрома близкой по частоте в двух группах пациентов с ОА и РА оказалась головная боль (соответственно 86,7%/15 и 80%/10), однако с большей частотой ее усиления при изменении метеоусловий отмечены у пациентов с ОА по сравнению с РА (46,2%/13 против 25%/8).
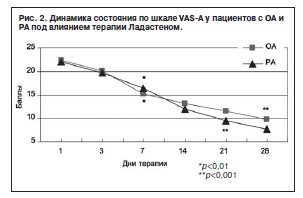
Выявлено статистически значимое снижение баллов по шкале VAS-А в результате терапии Ладастеном у пациентов с ОА и РА к концу 1-й недели (соответственно 32,8% при р<0,01 и 25,8% при р<0,01) с возрастанием достоверных различий на 3-й неделе терапии у пациентов с РА (65,6% при р<0,001) и на 4-й неделе у пациентов с ОА (56,5% при р<0,001).
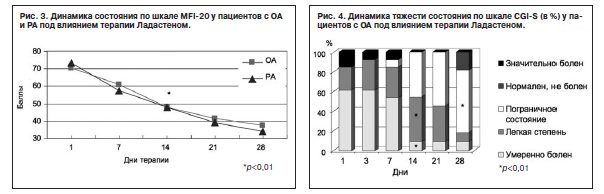
Данные представлены на рис. 2. В соответствии со шкалой MFI-20 отмечено статистически значимое уменьшение баллов у пациентов с ОА и РА к 14-му дню терапии (соответственно 32,2% при р<0,01 и 34,6% при р<0,01) с той же достоверностью различий к концу терапии (соответственно редукция баллов на 46,8% при р<0,01 и 46,3% при р<0,01). Данные представлены на рис. 3.
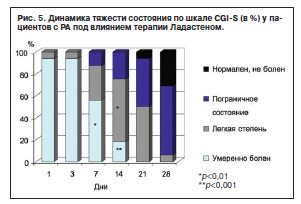
По шкале CGI-S на 14-й день терапии отмечено статистически достоверное уменьшение числа пациентов с ОА с умеренной степенью тяжести состояния (р<0,01) и статистически значимое увеличение числа пациентов с легкой степенью тяжести состояния (р<0,01). На заключительном визите (28-й день терапии) отмечено статистически большее число пациентов с ОА с «пограничным» состоянием (63,6%, р<0,01); «нормальным» – 18,2%, с умеренной и легкой степенью тяжести – по 9,1% (рис. 4). В группе пациентов с РА наблюдали достоверное снижение числа больных с умеренной степенью тяжести состояния (р<0,01) на 7-й день терапии, возрастание достоверных различий к 14-му дню терапии (р<0,001). На заключительном визите состояние пациентов с РА оценено как «пограничное» в 62,5% случаев, «нормальное» состояние – в 31,3%, легкая степень тяжести – в 6,2% (рис. 5).
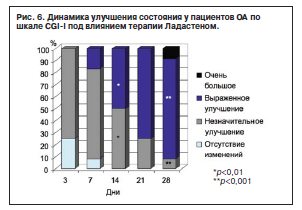
Эффективность терапии Ладастеном у пациентов с ОА по критериям шкалы CGI-I «выраженное» и «незначительное» улучшение достигает достоверных различий к 14-му дню терапии (р<0,01); к концу терапии статистически значимо увеличивается число пациентов с «выраженным» улучшением (81,2%; р<0,001) и уменьшается число пациентов с «незначительным» улучшением (9,1%; р<0,001). Данные представлены на рис. 6.
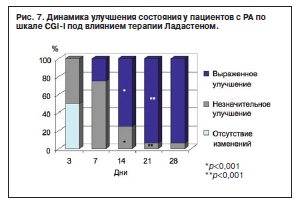
У пациентов с РА эффективность терапии Ладастеном по критериям «выраженное» и «незначительное» улучшение достигает достоверной разницы к 14-му дню терапии (75 и 25% соответственно; р<0,01 и р<0,01); к 21-му дню терапии статистически значимо увеличивается число пациентов с «выраженным» улучшением (93,8%; р<0,001) и уменьшается с «незначительным» улучшением (6,2%; p<0,001), данные представлены на рис. 7.
Заключение
Проведенное сравнительное исследование базисных критериев астенических состояний в клинической картине ОА и РА выявило статистически достоверно большую частоту нарушений физической и умственной активности, признаков десинхронизации цикла сон–бодрствование, наличие болевого синдрома в клинике ОА (р<0,03 до р<0,05). Напротив, в клинической структуре РА по сравнению с ОА отмечена достоверно большая частота субсиндромальных депрессивных и тревожных расстройств, а также соматовегетативных нарушений (р<0,03).
В результате кратковременной (28 дней) терапии Ладастеном число респондеров (редукция суммарного балла по шкалам от долечебного уровня на 50% и более) у пациентов с ОА и РА по шкале VAS-А составило 54,5 и 93,3% соответственно, по шкале MFI-20 – 36,6 и 46,7%; патреспондеры (уменьшение баллов от 30 до 50%) по шкале VAS-А у пациентов с ОА и РА 45,5 и 6,7% соответственно, по шкале MFI-20 – 63,7 и 53,3%. По шкале CGI-I к концу курса терапии Ладастеном у пациентов с РА «выраженное» улучшение отмечено у 93,8%; среди пациентов с ОА – 81,2%.
Ладастен является эффективным препаратом в терапии ОА (сосудистого, посттравматического, сочетанного генеза) и РА. Значительная представленность соматовегетативных расстройств у больных с РА и их положительная динамика могут свидетельствовать в пользу наличия у Ладастена определенного вегетостабилизирующего эффекта. Коррекция астенических расстройств положительно сказывается на обратной динамике ситуационно обусловленных субсиндромальных депрессивных и тревожных расстройств в клинике РА. Меньшее число респондеров в группе ОА, очевидно, обусловлено стабильностью основного заболевания (сосудистого, посттравматического, сочетанного генеза), но с положительной динамикой астенического и болевого компонентов в его структуре. Положительный эффект выявлен на 1–2-й неделе терапии в обеих группах больных. Отмеченные НЯ в ходе лечения были кратковременные и не требовали дополнительных назначений для коррекции.
Изучен психотропный эффект Ладастена у пациентов с диагностической рубрикой МКБ-10 (1994 г.) «Неврастения» (F48.0) без сопутствующей соматической и неврологической патологии [4]. Наиболее выраженным с первых дней приема Ладастена был активирующий эффект в виде повышения уровня бодрствования и редукции астении, несколько позднее выявлялся статистически значимый показатель анксиолитического эффекта. Ко 2-й неделе краткосрочной терапии отмечено позитивное влияние препарата на нарушение ночного сна и сниженное настроение. Верифицирована с помощью типа организации электроэнцефалографии (в частности, альфа-ритма) индивидуально-типологическая реакция на Ладастен у больных с неврастенией [5]. Подтверждена эффективность Ладастена в терапии неврастении в ходе рандомизированного слепого плацебо-контролируемого исследования [6]. Получены доказательства эффективности Ладастена в терапии соматогенной астении при инфекционных, гастроэнтерологических, кардиологических и ревматоидных заболеваниях и неврастении [7].
Материалы и методы
Целью настоящего исследования явилось изучение клинической эффективности и безопасности Ладастена у больных с органическим эмоционально-лабильным (астеническим) расстройством (в последующем изложении органическая астения – ОА; F06.6) и расстройством адаптации (РА) – F43.2 по МКБ-10 [8]. Общее число включенных в исследование больных составило 29 человек. Среди пациентов с ОА (n=13) женщин было 7 (53,8%), мужчин – 6 (46,2%), средний возраст 47,1±3,7 года, продолжительность актуального астенического состояния 4,9±1,4 мес. В соответствии с причиной ОА пациенты распределились следующим образом: сосудистая патология в виде артериальной гипертензии, артериальной гипотензии, атеросклероза церебральных сосудов, врожденного порока сердца – 30,8%, отдаленные последствия закрытой черепно-мозговой травмы легкой и средней степени тяжести – 23,1%, сочетанная посттравматическая и сосудистая патология – 38,5%, посттравматическая и послеоперационная (оперативное вмешательство по поводу рака желудка) – 7,7%.
В группе пациентов с РА (n=16) женщин было 12 (75%), мужчин – 4 (25%), средний возраст на момент обследования составил 42,3±3,2 года; продолжительность болезненного состояния 4,8±1,05 мес.

Среди пациентов с РА в ближайшем анамнезе выявлена объективная психотравмирующая ситуация с ее личностным значением в виде «Утраты», «Угрозы», «Вызова» [9] (рис. 1). В содержание стрессового фактора «Угроза» (37,5%) включены угроза здоровью значимых лиц, вербальная агрессия и угроза физической расправы (к примеру, со стороны соседей по общежитию), угроза материальному положению семьи в связи с алкоголизацией одного из членов семьи, угроза увольнения в связи с «набором новой команды» после смены руководителя организации. Стрессовая ситуация в виде «Утраты» (31,3%) подразумевала утрату актуального объекта привязанности и любви (в том числе разрыв отношений с молодым человеком по причине его наркотизации), разлуку с взрослой дочерью в связи с ее переездом в другой город, смерть мужа после длительной болезни с утратой опоры в жизни и материального достатка в семье, утрату места работы в связи с сокращением штата. Личное значение стрессового фактора «Вызов» (25%) содержало отвержение жены мужем в связи с его алкоголизацией, оскорблениями в адрес жены; взрослой дочери – матерью («постоянные ссоры с матерью, домашняя обстановка выбивает из колеи»), отца ребенка бывшей женой («после расторжения брака запрещает видеться с сыном»), отвержение сотрудника непосредственным руководителем («обман с распределением жилья»); отвержение отца сыном-наркоманом в силу девиантного поведения. Содержание стрессового фактора в виде «Препятствия» могло подразумевать повышение в должности по работе с невозможностью справиться с оперативным составлением деловой документации. Как правило, у каждого пациента имел место один стрессовый фактор.
Длительность терапии Ладастеном составила 28 дней. Оценку состояния проводили на 0, 3, 7, 14, 21 и 28-й дни от начала терапии. В первые 2 нед терапии Ладастен назначали в дозе 50–100 мг/сут в 1 или 2 приема в утренние и дневные часы, на 3-й неделе допускали по необходимости увеличение дозы до 150 мг/сут в 2 приема. Терапевтическая доза у 61,5% больных составила 150 мг/сут, у 30,8% – 100 мг/сут, у 7,7% – 50 мг/сут. Исследование проведено на базе ИОКПБ №1 в отделении пограничных состояний №13 и дневном стационаре.
Анализ эффективности терапии проведен с использованием общепринятых 2 субшкал шкалы общего клинического впечатления (CGI-S и CGI-I), шкал оценки астении (MFI – The Multidimensional Fatigue Inventory), визуальной аналоговой шкалы астении (VAS-A). Достоверность рассчитывали с использованием пакета Statistica 6.0 [Difference tests: r,%, means (Difference between two proportions)]; при анализе динамики редукции баллов по шкалам использовали парный двухвыборочный t-тест для средних. Сравнительный анализ базисных (общих) критериев астенических состояний [7] в клинике ОА и РА проведен по методу определения их частоты в общей совокупности признаков [10].
Результаты
Среди пациентов с ОА и РА закончили исследование 26 (89,7%) человек, выбыли из исследования 3 (10,3%) человека: по одному больному в связи с неэффективностью терапии, острой респираторной вирусной инфекцией, плановой госпитализацией в кардиологическое отделение.
На фоне лечения Ладастеном наблюдались следующие симптомы: тошнота (у 2-х больных), сонливость (у 2-х больных), головная боль (у 1-го больного), которые были кратковременные и не требовали отмены препарата.
Сравнительный анализ астенических состояний выявил достоверно большую представленность нарушений физической и умственной активности в группе больных с ОА (р<0,05) по сравнению с группой больных с РА (см. таблицу).

В структуре нарушений физической и умственной активности в обеих группах пациентов первое ранговое место по частоте занимает симптом отсутствия сил в покое с ощущением постоянной слабости (соответственно 34,6%/26 и 35,6%/20); значительно реже в группе пациентов с ОА отмечали мышечную слабость и снижение активности в производственной и бытовой сферах (соответственно по 11,5%/26), в единичных наблюдениях эти симптомы выявлены в группе пациентов с РА. У пациентов с РА отсутствовал симптом сенсорной гиперестезии, напротив, в группе пациентов с ОА он был представлен в 49 (11,5%) наблюдениях. Нарушение концентрации внимания выявлено у половины пациентов с РА (50%/20), в то время как с ОА – лишь у 1/4 пациентов (26,9%/26).
В группе пациентов с РА отмечена достоверно большая частота субсиндромальных депрессивных и тревожных расстройств (р<0,03) по сравнению с группой больных с ОА. Структура блока субсиндромальных депрессивных и тревожных расстройств значительно «рассыпана» по своим проявлениям и включала 14 наименований. Существенно отметить, что в клинике ОА отсутствуют симптомы пессимистического видения будущего, сниженной самооценки, идей виновности и уничижения, повышенной пугливости. Близким по частоте в обеих группах пациентов с РА и ОА оказалось наличие симптома сниженного настроения (соответственно 15%/80 и 12,2%/49). У больных с ОА заметно преобладала частота раздражительности (24,5%/49 против 13,8%/80). Напротив, у пациентов с РА в 2 раза чаще выявлены навязчивые тревожные опасения, отражающие психотравмирующую ситуацию, когнитивная тревога (16,3%/80 против 8,2%/49), так же как и симптом нетерпеливости (8,8%/80 против 4,1%/49).

В структуре болевого синдрома близкой по частоте в двух группах пациентов с ОА и РА оказалась головная боль (соответственно 86,7%/15 и 80%/10), однако с большей частотой ее усиления при изменении метеоусловий отмечены у пациентов с ОА по сравнению с РА (46,2%/13 против 25%/8).
Выявлено статистически значимое снижение баллов по шкале VAS-А в результате терапии Ладастеном у пациентов с ОА и РА к концу 1-й недели (соответственно 32,8% при р<0,01 и 25,8% при р<0,01) с возрастанием достоверных различий на 3-й неделе терапии у пациентов с РА (65,6% при р<0,001) и на 4-й неделе у пациентов с ОА (56,5% при р<0,001).
Данные представлены на рис. 2. В соответствии со шкалой MFI-20 отмечено статистически значимое уменьшение баллов у пациентов с ОА и РА к 14-му дню терапии (соответственно 32,2% при р<0,01 и 34,6% при р<0,01) с той же достоверностью различий к концу терапии (соответственно редукция баллов на 46,8% при р<0,01 и 46,3% при р<0,01). Данные представлены на рис. 3.

По шкале CGI-S на 14-й день терапии отмечено статистически достоверное уменьшение числа пациентов с ОА с умеренной степенью тяжести состояния (р<0,01) и статистически значимое увеличение числа пациентов с легкой степенью тяжести состояния (р<0,01). На заключительном визите (28-й день терапии) отмечено статистически большее число пациентов с ОА с «пограничным» состоянием (63,6%, р<0,01); «нормальным» – 18,2%, с умеренной и легкой степенью тяжести – по 9,1% (рис. 4). В группе пациентов с РА наблюдали достоверное снижение числа больных с умеренной степенью тяжести состояния (р<0,01) на 7-й день терапии, возрастание достоверных различий к 14-му дню терапии (р<0,001). На заключительном визите состояние пациентов с РА оценено как «пограничное» в 62,5% случаев, «нормальное» состояние – в 31,3%, легкая степень тяжести – в 6,2% (рис. 5).
Эффективность терапии Ладастеном у пациентов с ОА по критериям шкалы CGI-I «выраженное» и «незначительное» улучшение достигает достоверных различий к 14-му дню терапии (р<0,01); к концу терапии статистически значимо увеличивается число пациентов с «выраженным» улучшением (81,2%; р<0,001) и уменьшается число пациентов с «незначительным» улучшением (9,1%; р<0,001). Данные представлены на рис. 6.



У пациентов с РА эффективность терапии Ладастеном по критериям «выраженное» и «незначительное» улучшение достигает достоверной разницы к 14-му дню терапии (75 и 25% соответственно; р<0,01 и р<0,01); к 21-му дню терапии статистически значимо увеличивается число пациентов с «выраженным» улучшением (93,8%; р<0,001) и уменьшается с «незначительным» улучшением (6,2%; p<0,001), данные представлены на рис. 7.
Заключение
Проведенное сравнительное исследование базисных критериев астенических состояний в клинической картине ОА и РА выявило статистически достоверно большую частоту нарушений физической и умственной активности, признаков десинхронизации цикла сон–бодрствование, наличие болевого синдрома в клинике ОА (р<0,03 до р<0,05). Напротив, в клинической структуре РА по сравнению с ОА отмечена достоверно большая частота субсиндромальных депрессивных и тревожных расстройств, а также соматовегетативных нарушений (р<0,03).
В результате кратковременной (28 дней) терапии Ладастеном число респондеров (редукция суммарного балла по шкалам от долечебного уровня на 50% и более) у пациентов с ОА и РА по шкале VAS-А составило 54,5 и 93,3% соответственно, по шкале MFI-20 – 36,6 и 46,7%; патреспондеры (уменьшение баллов от 30 до 50%) по шкале VAS-А у пациентов с ОА и РА 45,5 и 6,7% соответственно, по шкале MFI-20 – 63,7 и 53,3%. По шкале CGI-I к концу курса терапии Ладастеном у пациентов с РА «выраженное» улучшение отмечено у 93,8%; среди пациентов с ОА – 81,2%.
Ладастен является эффективным препаратом в терапии ОА (сосудистого, посттравматического, сочетанного генеза) и РА. Значительная представленность соматовегетативных расстройств у больных с РА и их положительная динамика могут свидетельствовать в пользу наличия у Ладастена определенного вегетостабилизирующего эффекта. Коррекция астенических расстройств положительно сказывается на обратной динамике ситуационно обусловленных субсиндромальных депрессивных и тревожных расстройств в клинике РА. Меньшее число респондеров в группе ОА, очевидно, обусловлено стабильностью основного заболевания (сосудистого, посттравматического, сочетанного генеза), но с положительной динамикой астенического и болевого компонентов в его структуре. Положительный эффект выявлен на 1–2-й неделе терапии в обеих группах больных. Отмеченные НЯ в ходе лечения были кратковременные и не требовали дополнительных назначений для коррекции.
Список исп. литературыСкрыть список1. Головизнина О.Л. Клинико-психологическая дифференциация больных с психогенными (непсихотическими) депрессиями. Рос. психиат. журн. 2004; 4: 4–8.
2. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Новый подход к терапии неврастении и соматогенной астении (результаты многоцентрового исследования эффективности и безопасности Ладастена). Журн. психиат. и психофармакотер. 2009; 1: 18–26.
3. Смулевич А.Б., Дубницкая Э.Б. Астения и коморбидные психические расстройства. Психиат. и психофармакотер. 2009; 4: 4–7.
4. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica. М.: МедиаСфера, 2002.
5. Воронин М.В. Изучение механизмов психотропного действия Ладастена в зависимости от фенотипа реакции на эмоциональный стресс. Автореф. дис. … канд. мед. наук. М., 2004.
6. Незнамов Г.Г., Сюняков С.А., Телешова Е.С. и др. Новый препарат со стимулирующими и анксиолитическими свойствами Ладастен при лечении неврастении (результаты сравнительного исследования с плацебо). Журн. неврол. и психиат. им. С.С.Корсакова. 2009; 5: 20–6.
7. Международная классификация болезней (10-й пересмотр). Классификация психических и поведенческих расстройств. СПб., 1994.
8. Сюняков С.А., Гришин С.А., Телешова Е.С., Незнамов Г.Г., Середенин С.Б. Результаты пилотного клинического исследования Ладастена. Эксперимент. и клин. фармакол. 2006; 4: 10–5.
9. Сафарова Т.П. Клинико-фармакологическое обоснование дифференцированной психофармакотерапии больных с астеническими расстройствами. Автореф. дисс. … канд. мед. наук. М., 1997.
10. Гришин С.А. Клинико-фармакологическая характеристика Ладастена в качестве антиастенического средства. Автореф. дис. … канд. мед. наук. М., 2008.
25 июня 2010
Количество просмотров: 2706


