Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2010
Кветиапин при терапии биполярного аффективного расстройства №05 2010
Номера страниц в выпуске:14-19
Проблема терапии биполярных аффективных расстройств (БАР) является одной из ведущих в современной психиатрии. Высокий риск суицидальных попыток, выраженность витальной симптоматики, большая частота случаев резистентности к фармакотерапии обусловливают необходимость совершенствования диагностики и оптимизации медикаментозного лечения таких больных.
Биполярное аффективное расстройство
Проблема терапии биполярных аффективных расстройств (БАР) является одной из ведущих в современной психиатрии. Высокий риск суицидальных попыток, выраженность витальной симптоматики, большая частота случаев резистентности к фармакотерапии обусловливают необходимость совершенствования диагностики и оптимизации медикаментозного лечения таких больных.
БАР – вариант течения аффективного психоза (аффективных расстройств по критериям МКБ-10). По клиническим проявлениям БАР подразделяется на I (чередование депрессивных и маниакальных эпизодов) и II (депрессии и гипомании) типы [18, 42, 50]. В DSM-IV к БАР отнесена циклотимия, а также выделен подтип с быстрым чередованием эпизодов.
Показатели распространенности БАР в популяции различаются по странам и регионам, колеблются в очень широких пределах – от 0,07 до 8,3% для БАР I типа и от 5,3 до 11,0% для БАР II типа и с годами постоянно увеличиваются1. Доля больных с БАР составляет 5% от всех психически больных, госпитализируемых в стационар [42]. Гендерное соотношение по критерию заболеваемости БАР составляет 1,2 на 100 мужчин и 1,8 на 100 женщин [50].
Значимость своевременной диагностики терапии БАР определяется рядом клинико-динамических характеристик заболевания. У 50–90% пациентов в любой фазе цикла наблюдаются психотические симптомы [2, 27, 49]. При нелеченом БАР до 25–50% пациентов совершают как минимум одну суицидальную попытку [17, 43]. Кроме того, в периоды интермиссии у многих больных БАР отмечается аффективная лабильность и колебания настроения, которые у 20–30% пациентов приводят к выраженной дезадаптации и инвалидизации [12, 18, 50].
Основные стратегии терапии БАР направлены на лечение текущего острого эпизода и обеспечение максимально возможной длительной ремиссии (прерывание цикличности процесса).
В качестве основных средств для лечения БАР сегодня рассматриваются нормотимики (препараты лития, антиконвульсанты) и антипсихотики [18, 42], а в роли дополнительных используются бензодиазепины (при маниакальной фазе) и антидепрессанты (при депрессивной фазе) [2, 18]. При этом эффективность профилактической монотерапии нормотимиками не превышает, по данным различных авторов, 70% [10, 12].
Эффективность антипсихотиков I поколения (галоперидол, хлорпромазин и др.) в лечении острого маниакального эпизода, особенно с преобладанием психомоторного и идеаторного возбуждения, экспансивного бреда и т.д., установлена давно. В то же время выраженные экстрапирамидные осложнения и риск инверсии аффекта (развитие депрессивной фазы) существенно ограничивают возможность применения этих средств [2, 10].
Атипичные антипсихотики также демонстрируют высокую эффективность при лечении БАР. По всей видимости, их действие основано на способности связываться с различными подтипами серотониновых рецепторов (5-НТ1A, 5-НТ2A, 5-НТ2C и др.), а также блокировать D4-рецепторы дофамина, принадлежащие к D2-семейству и избирательно концентрирующиеся в лимбической системе, играющей важную роль в регуляции аффективной сферы [2, 4, 16, 78].
Из атипичных антипсихотиков, применяющихся в лечении БАР, оланзапин и рисперидон обладают целым рядом серьезных побочных эффектов. Применение оланзапина связано со значимым риском повышения массы тела и развития метаболического синдрома, включающего развитие гиперлипидемии, гипергликемии и возрастание риска развития сахарного диабета типа 2. Кроме того, оланзапин способен вызывать антихолинергические эффекты и акатизию [2, 8, 74]. Рисперидон обладает способностью вызывать гиперпролактинемию, что обусловливает серьезные гормональные, метаболические и иммунные нарушения, а также характеризуется относительно большим риском появления экстрапирамидных нарушений по сравнению с другими атипичными антипсихотиками [8, 74]. Арипипразол оказывает гепатотоксическое влияние, вызывает выраженные диспепсические нарушения и акатизию; на фоне приема зипрасидона могут наблюдаться экстрапирамидные нарушения и существенно удлиняться интервал QT [2, 74].
Согласно данным литературы, сравнительно высокую эффективность и безопасность в лечении как маниакальных, так и депрессивных фаз БАР демонстрирует атипичный антипсихотик кветиапин.
Фармакокинетика и фармакодинамика кветиапина
Кветиапин является производным дибензотиазепина [21, 29, 37, 40, 41, 56, 64, 70]. Фармакодинамика препарата характеризуется связыванием с несколькими нейромедиаторными системами. При этом тимотропное действие кветиапина реализуется влиянием на постсинаптическую мембрану рецепторов, расположенных в ядре шва, гиппокампе, базальных ганглиях и гипоталамусе – образованиях, которые принято считать базисом серотонинергической системы [4, 23, 38, 64]. Наибольшее сродство кветиапина отмечается к 5-НТ1А- и 5-НТ2-серотонинергическим, D2- и D1-дофаминовым, a1- и a2-адренергическим рецепторам [67, 70, 71]. У препарата не выявлено сродства к холинергическим мускариновым и бензодиазепиновым рецепторам, что обусловливает малую выраженность экстрапирамидных холинолитических побочных эффектов [7, 15, 22, 38] и поздней дискинезии [40, 41, 64].
Основные характеристики линейной фармакокинетики кветиапина представлены в табл. 1.
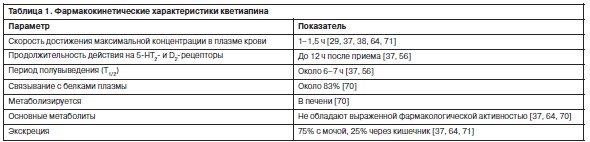
Следует заметить, что прием пищи существенно не влияет на биодоступность препарата. У пожилых больных средний клиренс кветиапина на 30–50% ниже, чем наблюдаемый у пациентов в возрасте от 18 до 65 лет [37, 84]. Средний клиренс лекарственного вещества меньше на 25% у пациентов с тяжелыми нарушениями функции почек и у пациентов с циррозом печени [37].
Спектр клинического действия кветиапина
Клинические исследования по применению кветиапина отражены в большом числе публикаций [3, 11, 19, 26, 30, 35, 36, 69].
Наиболее характерным для кветиапина традиционно считается выраженный седативный эффект, что определяет его преимущественное применение при острых психотических состояниях, протекающих с возбуждением и тревогой. Среди других атипичных антипсихотиков он уступает лишь эффекту клозапина и обусловлен высоким тропизмом к a1- и a2-адренорецепторам и блокадой H1-гистаминовых рецепторов [6, 7, 10, 11, 15, 20].
Экспериментально установлено, что кветиапин на этапе как активной (кратковременной), так и поддерживающей (длительной) терапии шизофрении, психотических расстройств позднего возраста (в том числе при болезнях Паркинсона и Альцгеймера) достоверно эффективнее в сравнении с плацебо, а также не уступает по эффективности конвенционным нейролептикам (галоперидол, хлорпромазин) [6, 7, 12, 13, 20, 21, 32, 46, 52, 53, 55, 63, 80]
Ряд авторов сообщают об успешном использовании кветиапина для коррекции негативных симптомов при шизофрении и снижения выраженности когнитивного дефицита [52, 53], преодоления резистентности в отношении предыдущих курсов терапии традиционными и атипичными антипсихотиками [12, 22, 34, 35, 68, 77], а также при неврозоподобных расстройствах в рамках малопрогредиентной шизофрении (сенестоипохондрия [1], тревожно-фобическое расстройство и обсессивно-компульсивное расстройство [5]).
Безусловный интерес вызывает публикация данных об эффективности кветиапина при терапии шизофрении, протекающей с аффективными колебаниями [20, 77], постпсихотических депрессий [15, 69] и шизоаффективного психоза [4, 5, 31].
В настоящее время активно изучается терапевтическое действие кветиапина как на маниакальную, так и на депрессивную симптоматику БАР.
Кветиапин – один из немногих антипсихотиков, имеющих широкую доказательную базу при лечении острого маниакального (маниакально-бредового) эпизода [14, 54, 77]. Препарат утвержден EMEA и FDA в качестве одного из препаратов выбора в терапии нейролептиками биполярной мании [18].
Особо следует отметить регистрируемую в исследованиях эффективность кветиапина (как в виде монотерапии, так и в сочетании с нормотимиками) в лечении БАР с быстрой сменой циклов [39, 47, 83].
Диапазон эффективных терапевтических доз кветиапина представлен в табл. 2.
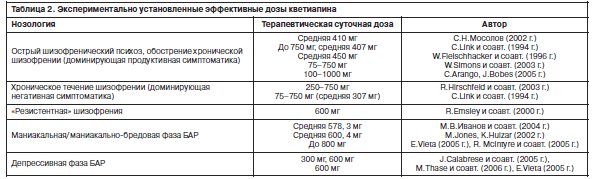
Кветиапин применяется при лечении биполярной мании как в виде монотерапии, так и в сочетании с препаратами лития или антиконвульсантами [65, 66, 82].
В режиме купирующей монотерапии эффективность кветиапина является сопоставимой с действием лития, вальпроата и галоперидола, а в некоторых случаях даже превосходит их, в том числе по показателям безопасности и переносимости [2, 15, 47, 48, 57, 82].
В публикации М.В.Иванова и соавт. (2004 г.) по результатам 12-недельного открытого нерандомизированного клинического исследования указано, что к окончанию курса лечения снижение баллов по шкале мании Янга (YMRS) у пациентов с БАР I типа достигает 72%. При этом явное уменьшение (около 50% от исходного уровня) маниакальных проявлений отмечено уже в течение первого месяца приема препарата.
В других исследованиях также обнаружено, что среднее время достижения эутимической ремиссии при приеме кветиапина составляет около 28 дней, что существенно быстрее, чем при терапии нормотимиками [2, 11, 12].
Антиманиакальный эффект кветиапина также подтверждается в ряде плацебо-контролируемых исследований. В работе B.Paulsson и K.Huizar (2003 г.) число респондеров в основной группе и группе контроля (плацебо) отличается на 16%. По шкале CGI-BP уменьшение суммарных оценок к окончанию терапии в группах происходит соответственно в 1,6 и 1,2 раза.
В анализе результатов 12-недельного исследования эффективности монотерапии кветиапином при актуальной мании у 403 пациентов с БАР I типа E.Vieta и соавт. (2005 г.) приводят данные о статистически достоверном превосходстве препарата по сравнению с плацебо (р=0,021). При этом половина больных соответствуют критериям респондеров (снижение баллов на 50% и более по шкале YMRS) уже к 28-му дню терапии.
В заключение M.Jones и K.Huizar (2002 г.) по двойному слепому рандомизированному плацебо-контролируемому исследованию активности кветиапина, галоперидола, лития и плацебо при маниях в структуре БАР I типа у больных, получавших кветиапин, отмечена редукция суммарной оценки по шкале YMRS на 19 баллов, тогда как в случаях плацебо-контроля – только на 5 баллов. Доля респондеров в группе пациентов, получавших кветиапин, увеличивается с 21-го к 81-му дню исследования на 20%, а в группе контроля (плацебо) – на 5%. Кветиапин, галоперидол и литий по сумме выявленных отклонений по шкалам CGI, CGI-BP, MADRS, PANSS, GAS, SAS и BARS демонстрируют сходную степень эффективности и статистически достоверное различие с контрольной группой.
В двойном слепом рандомизированном 12-недельном исследовании R.McIntyre и соавт. (2005 г.) 302 пациента с БАР принимали кветиапин, галоперидол или плацебо. По наблюдениям авторов, показатели шкалы YMRS достоверно уменьшаются с 21-го дня терапии кветиапином (-12,29 против -8,32 для плацебо; p<0,01). Различие в пользу кветиапина увеличивается к 84-му дню (-17,52 против -9,48 для плацебо; p<0,001). Галоперидол также демонстрирует преимущество перед плацебо на 21 и 84-й дни терапии, однако заметно уступает кветиапину по показателям безопасности и переносимости.
M.Brecher и K.Huizar (2003 г.) в сходном по дизайну исследовании также регистрируют равное число респондентов при приеме кветиапина и галоперидола [25].
B.Paulsson и K.Huizar (2003 г.) описывают результаты 12-недельного многоцентрового рандомизированного двойного слепого исследования, в котором согласно итоговым показателям шкалы YMRS кветиапин не уступает литию по степени выраженности антиманиакального эффекта [59].
В ряде работ рассматривается возможность сочетанного применения кветиапина и нормотимиков для усиления антиманиакального/антипсихотического действия [2, 65, 66, 82]. При этом в условиях комбинированной терапии добавление кветиапина к лечению нормотимиками повышает эффективность терапии примерно на 20% [65, 66]. Особо указывается, что назначение кветиапина в этих случаях зачастую позволяет избежать добавления в схему бензодиазепинов для купирования психомоторного возбуждения [12, 57, 66, 82].
Важно отметить, что на данный момент кветиапин – единственный антипсихотик, утвержденный FDA для монотерапии острого депрессивного эпизода сроком до 8 нед [2, 18]. Можно предположить, что антидепрессивный эффект кветиапина обусловлен влиянием на 5-НТ1А- и 5-НТ2-серотонинергические и дофаминовые рецепторы [51, 87].
В проводимых в последние годы исследованиях кветиапин демонстрирует эффективность в лечении биполярной депрессии при оценке клинического ответа по редукции на 50% баллов и более по шкале оценки депрессии Монтгомери–Асберга (MADRS) и шкале оценки депрессии Гамильтона (HDRS) [33, 39, 61, 68, 69, 79, 86].
В 8-недельном двойном слепом рандомизированном исследовании M.Thase и соавт. (2006 г.) снижение выраженности депрессии в рамках БАР I и II типов (509 больных) по сравнению с исходным уровнем значимо больше у пациентов, принимавших кветиапин, в сравнении с плацебо как на первой, так и на последней неделе терапии (р<0,001 в обоих случаях). Снижение баллов по шкале MADRS при приеме кветиапина к 8-й неделе составляет 61 и 54% при приеме доз 300 и 600 мг/сут соответственно. Уменьшение баллов по шкале HDRS также достоверно больше в группе пациентов, принимавших кветиапин, чем в группе плацебо (р<0,001), уже с первой недели лечения и на протяжении всего периода терапии.
В другом аналогичном исследовании, включавшем 542 амбулаторных пациента с большим депрессивным эпизодом в рамках БАР I и II типов, а также больных с «быстрым ритмом» [27], кветиапин демонстрирует по сравнению с плацебо статистически значимое уменьшение депрессии по шкалам MADRS, HDRS также с первой недели терапии. На завершающем визите респондерами по установленным в исследовании критериям (снижение баллов по шкале MADRS на 50% и более) признаны 57,6 и 58,2% (при приеме 300 и 600 мг/сут соответственно) больных, принимавших кветиапин, против 36,1% пациентов из группы плацебо. Соотношение пациентов, достигших ремиссии (12 баллов и менее по шкале MADRS), составляет 52,9% при приеме кветиапина и 28,4% на фоне приема плацебо.
В многоцентровом исследовании BOLDER II отмечен благоприятный эффект кветиапина в отношении параллельной редукции симптомов депрессии, тревоги и ослабления когнитивного дефицита [5, 7, 9].
Переносимость и нежелательные явления кветиапина
По мнению некоторых исследователей, у больных БАР риск развития экстрапирамидных симптомов (ЭПС) и поздней дискинезии выше, чем у больных шизофренией, и они более склонны к отказу от терапии вследствие развития побочных эффектов, снижающих качество жизни [85, 86]. По данным F.Seemuller и соавт. (2005 г.), ЭПС и поздняя дискинезия, вызванная приемом традиционных антипсихотиков, в группе больных БАР встречаются в 37,9% наблюдений, тогда как в группе больных шизофренией – в 23,3% наблюдений.
Кветиапин обладает хорошей переносимостью, уменьшающей риск отказа пациента от приема препарата, что в свою очередь способствует соблюдению режима терапии, эффективному лечению больных и повышает качество жизни пациентов [20, 60, 73]. Как сообщают J.Hellewell и соавт. (1999 г.), 97% пациентов, которых перевели на кветиапин с других антипсихотических препаратов, предпочитают своему предшествующему лечению терапию кветиапином [45]. Проведенный W.Simons и соавт. (2001, 2003 гг.) ретроспективный анализ информации, взятой из американской базы данных по исследованию комплаентности антипсихотикам, доказывает, что доля пациентов, остающихся на монотерапии кветиапином, значительно выше, чем доля пациентов, получающих галоперидол или другие атипичные антипсихотики [72].
В сравнительных исследованиях указывается на сопоставимость частоты возникновения нежелательных явлений при приеме кветиапина и плацебо [21, 52, 54, 75, 81, 83].
Другие авторы подчеркивают лучшую переносимость кветиапина в сравнении с типичными антипсихотиками. Так, С.Link и соавт. (1994 г.) находят, что кветиапин в сравнении с хлорпромазином реже вызывает сомноленцию (14% против 19%), инсомнию (10% против 16%) и не снижает уровень артериального давления (18% наблюдений при приеме хлорпромазина). По данным L.Arvanitis и соавт. (1997 г.), частота ЭПС при применении кветиапина составляет 4–8%, а на фоне приема галоперидола – 37%. R.McIntyre и соавт. (2005 г.) сообщают, что ЭПС наблюдаются у 12,7% больных, получающих кветиапин, против 59,6% больных, принимающих галоперидол (р<0,0001). В исследованиях, выполненных С.Link и соавт. (1994 г.), S.Stahl (1999 г.), С.Arango, J.Bobes (2005 г.), ЭПС, включая острые дистонические реакции и паркинсонизм, не регистрируется вовсе.
При сравнении переносимости кветиапина и нормотимиков G.Sacts и соавт. (2000 г.) устанавили, что частота отмены терапии вследствие развития у больных побочных эффектов при использовании комбинации лития и вальпроатов достигает 5,9% случаев. Присоединение к этой схеме кветиапина с одновременным снижением доз нормотимиков уменьшает данный показатель до 2,3%.
Наиболее частые нежелательные явления, отмечающиеся при применении кветиапина, представлены в табл. 3.
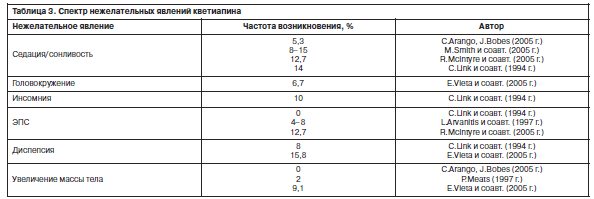
Установлено, что такие нежелательные явления, возникающие при приеме кветиапина, как седация, сонливость, ортостатическая гипотензия, головокружение, диспепсия, носят транзиторный и/или дозозависимый характер и нивелируются через 2–3 нед от начала терапии [20] или при уменьшении дозы препарата [2].
В отличие от многих атипичных антипсихотиков кветиапин практически не влияет на уровень пролактина в крови [13, 15, 20, 21, 53, 77], не оказывает токсического действия на картину крови, значимого влияния на сердечную деятельность и показатели электрокардиограммы [15, 56].
Особо необходимо подчеркнуть, что в отличие от терапии галоперидолом и ряда атипичных антипсихотиков случаев инверсии аффекта и развития депрессивного эпизода при применении кветиапина не наблюдается [2, 11, 54].
В литературе описаны случаи передозировки кветиапина в виде однократного приема 3–10 г препарата [44, 58, 62, 76]. При этом в течении 24 ч регистрируются увеличение частоты сердечных сокращений до 128 уд/мин и гипотензия.
Выводы
Таким образом, приведенные данные свидетельствуют о том, что кветиапин обладает следующими основными преимуществами:
В настоящее время в России кветиапин представлен несколькими брэндами. Недавно был зарегистрирован и появился в свободной продаже кветиапин производства израильской компании «Тева» – Лаквель. В связи с более экономичной стоимостью сравнительно с оригинальным продуктом и гарантированно высоким качеством препаратов компании «Тева», Лаквель имеет все шансы быстро войти в широкую практику врачей-психиатров.
Проблема терапии биполярных аффективных расстройств (БАР) является одной из ведущих в современной психиатрии. Высокий риск суицидальных попыток, выраженность витальной симптоматики, большая частота случаев резистентности к фармакотерапии обусловливают необходимость совершенствования диагностики и оптимизации медикаментозного лечения таких больных.
БАР – вариант течения аффективного психоза (аффективных расстройств по критериям МКБ-10). По клиническим проявлениям БАР подразделяется на I (чередование депрессивных и маниакальных эпизодов) и II (депрессии и гипомании) типы [18, 42, 50]. В DSM-IV к БАР отнесена циклотимия, а также выделен подтип с быстрым чередованием эпизодов.
Показатели распространенности БАР в популяции различаются по странам и регионам, колеблются в очень широких пределах – от 0,07 до 8,3% для БАР I типа и от 5,3 до 11,0% для БАР II типа и с годами постоянно увеличиваются1. Доля больных с БАР составляет 5% от всех психически больных, госпитализируемых в стационар [42]. Гендерное соотношение по критерию заболеваемости БАР составляет 1,2 на 100 мужчин и 1,8 на 100 женщин [50].
Значимость своевременной диагностики терапии БАР определяется рядом клинико-динамических характеристик заболевания. У 50–90% пациентов в любой фазе цикла наблюдаются психотические симптомы [2, 27, 49]. При нелеченом БАР до 25–50% пациентов совершают как минимум одну суицидальную попытку [17, 43]. Кроме того, в периоды интермиссии у многих больных БАР отмечается аффективная лабильность и колебания настроения, которые у 20–30% пациентов приводят к выраженной дезадаптации и инвалидизации [12, 18, 50].
Основные стратегии терапии БАР направлены на лечение текущего острого эпизода и обеспечение максимально возможной длительной ремиссии (прерывание цикличности процесса).
В качестве основных средств для лечения БАР сегодня рассматриваются нормотимики (препараты лития, антиконвульсанты) и антипсихотики [18, 42], а в роли дополнительных используются бензодиазепины (при маниакальной фазе) и антидепрессанты (при депрессивной фазе) [2, 18]. При этом эффективность профилактической монотерапии нормотимиками не превышает, по данным различных авторов, 70% [10, 12].
Эффективность антипсихотиков I поколения (галоперидол, хлорпромазин и др.) в лечении острого маниакального эпизода, особенно с преобладанием психомоторного и идеаторного возбуждения, экспансивного бреда и т.д., установлена давно. В то же время выраженные экстрапирамидные осложнения и риск инверсии аффекта (развитие депрессивной фазы) существенно ограничивают возможность применения этих средств [2, 10].
Атипичные антипсихотики также демонстрируют высокую эффективность при лечении БАР. По всей видимости, их действие основано на способности связываться с различными подтипами серотониновых рецепторов (5-НТ1A, 5-НТ2A, 5-НТ2C и др.), а также блокировать D4-рецепторы дофамина, принадлежащие к D2-семейству и избирательно концентрирующиеся в лимбической системе, играющей важную роль в регуляции аффективной сферы [2, 4, 16, 78].
Из атипичных антипсихотиков, применяющихся в лечении БАР, оланзапин и рисперидон обладают целым рядом серьезных побочных эффектов. Применение оланзапина связано со значимым риском повышения массы тела и развития метаболического синдрома, включающего развитие гиперлипидемии, гипергликемии и возрастание риска развития сахарного диабета типа 2. Кроме того, оланзапин способен вызывать антихолинергические эффекты и акатизию [2, 8, 74]. Рисперидон обладает способностью вызывать гиперпролактинемию, что обусловливает серьезные гормональные, метаболические и иммунные нарушения, а также характеризуется относительно большим риском появления экстрапирамидных нарушений по сравнению с другими атипичными антипсихотиками [8, 74]. Арипипразол оказывает гепатотоксическое влияние, вызывает выраженные диспепсические нарушения и акатизию; на фоне приема зипрасидона могут наблюдаться экстрапирамидные нарушения и существенно удлиняться интервал QT [2, 74].
Согласно данным литературы, сравнительно высокую эффективность и безопасность в лечении как маниакальных, так и депрессивных фаз БАР демонстрирует атипичный антипсихотик кветиапин.
Фармакокинетика и фармакодинамика кветиапина
Кветиапин является производным дибензотиазепина [21, 29, 37, 40, 41, 56, 64, 70]. Фармакодинамика препарата характеризуется связыванием с несколькими нейромедиаторными системами. При этом тимотропное действие кветиапина реализуется влиянием на постсинаптическую мембрану рецепторов, расположенных в ядре шва, гиппокампе, базальных ганглиях и гипоталамусе – образованиях, которые принято считать базисом серотонинергической системы [4, 23, 38, 64]. Наибольшее сродство кветиапина отмечается к 5-НТ1А- и 5-НТ2-серотонинергическим, D2- и D1-дофаминовым, a1- и a2-адренергическим рецепторам [67, 70, 71]. У препарата не выявлено сродства к холинергическим мускариновым и бензодиазепиновым рецепторам, что обусловливает малую выраженность экстрапирамидных холинолитических побочных эффектов [7, 15, 22, 38] и поздней дискинезии [40, 41, 64].
Основные характеристики линейной фармакокинетики кветиапина представлены в табл. 1.

Следует заметить, что прием пищи существенно не влияет на биодоступность препарата. У пожилых больных средний клиренс кветиапина на 30–50% ниже, чем наблюдаемый у пациентов в возрасте от 18 до 65 лет [37, 84]. Средний клиренс лекарственного вещества меньше на 25% у пациентов с тяжелыми нарушениями функции почек и у пациентов с циррозом печени [37].
Спектр клинического действия кветиапина
Клинические исследования по применению кветиапина отражены в большом числе публикаций [3, 11, 19, 26, 30, 35, 36, 69].
Наиболее характерным для кветиапина традиционно считается выраженный седативный эффект, что определяет его преимущественное применение при острых психотических состояниях, протекающих с возбуждением и тревогой. Среди других атипичных антипсихотиков он уступает лишь эффекту клозапина и обусловлен высоким тропизмом к a1- и a2-адренорецепторам и блокадой H1-гистаминовых рецепторов [6, 7, 10, 11, 15, 20].
Экспериментально установлено, что кветиапин на этапе как активной (кратковременной), так и поддерживающей (длительной) терапии шизофрении, психотических расстройств позднего возраста (в том числе при болезнях Паркинсона и Альцгеймера) достоверно эффективнее в сравнении с плацебо, а также не уступает по эффективности конвенционным нейролептикам (галоперидол, хлорпромазин) [6, 7, 12, 13, 20, 21, 32, 46, 52, 53, 55, 63, 80]
Ряд авторов сообщают об успешном использовании кветиапина для коррекции негативных симптомов при шизофрении и снижения выраженности когнитивного дефицита [52, 53], преодоления резистентности в отношении предыдущих курсов терапии традиционными и атипичными антипсихотиками [12, 22, 34, 35, 68, 77], а также при неврозоподобных расстройствах в рамках малопрогредиентной шизофрении (сенестоипохондрия [1], тревожно-фобическое расстройство и обсессивно-компульсивное расстройство [5]).
Безусловный интерес вызывает публикация данных об эффективности кветиапина при терапии шизофрении, протекающей с аффективными колебаниями [20, 77], постпсихотических депрессий [15, 69] и шизоаффективного психоза [4, 5, 31].
В настоящее время активно изучается терапевтическое действие кветиапина как на маниакальную, так и на депрессивную симптоматику БАР.
Кветиапин – один из немногих антипсихотиков, имеющих широкую доказательную базу при лечении острого маниакального (маниакально-бредового) эпизода [14, 54, 77]. Препарат утвержден EMEA и FDA в качестве одного из препаратов выбора в терапии нейролептиками биполярной мании [18].
Особо следует отметить регистрируемую в исследованиях эффективность кветиапина (как в виде монотерапии, так и в сочетании с нормотимиками) в лечении БАР с быстрой сменой циклов [39, 47, 83].
Диапазон эффективных терапевтических доз кветиапина представлен в табл. 2.

Кветиапин применяется при лечении биполярной мании как в виде монотерапии, так и в сочетании с препаратами лития или антиконвульсантами [65, 66, 82].
В режиме купирующей монотерапии эффективность кветиапина является сопоставимой с действием лития, вальпроата и галоперидола, а в некоторых случаях даже превосходит их, в том числе по показателям безопасности и переносимости [2, 15, 47, 48, 57, 82].
В публикации М.В.Иванова и соавт. (2004 г.) по результатам 12-недельного открытого нерандомизированного клинического исследования указано, что к окончанию курса лечения снижение баллов по шкале мании Янга (YMRS) у пациентов с БАР I типа достигает 72%. При этом явное уменьшение (около 50% от исходного уровня) маниакальных проявлений отмечено уже в течение первого месяца приема препарата.
В других исследованиях также обнаружено, что среднее время достижения эутимической ремиссии при приеме кветиапина составляет около 28 дней, что существенно быстрее, чем при терапии нормотимиками [2, 11, 12].
Антиманиакальный эффект кветиапина также подтверждается в ряде плацебо-контролируемых исследований. В работе B.Paulsson и K.Huizar (2003 г.) число респондеров в основной группе и группе контроля (плацебо) отличается на 16%. По шкале CGI-BP уменьшение суммарных оценок к окончанию терапии в группах происходит соответственно в 1,6 и 1,2 раза.
В анализе результатов 12-недельного исследования эффективности монотерапии кветиапином при актуальной мании у 403 пациентов с БАР I типа E.Vieta и соавт. (2005 г.) приводят данные о статистически достоверном превосходстве препарата по сравнению с плацебо (р=0,021). При этом половина больных соответствуют критериям респондеров (снижение баллов на 50% и более по шкале YMRS) уже к 28-му дню терапии.
В заключение M.Jones и K.Huizar (2002 г.) по двойному слепому рандомизированному плацебо-контролируемому исследованию активности кветиапина, галоперидола, лития и плацебо при маниях в структуре БАР I типа у больных, получавших кветиапин, отмечена редукция суммарной оценки по шкале YMRS на 19 баллов, тогда как в случаях плацебо-контроля – только на 5 баллов. Доля респондеров в группе пациентов, получавших кветиапин, увеличивается с 21-го к 81-му дню исследования на 20%, а в группе контроля (плацебо) – на 5%. Кветиапин, галоперидол и литий по сумме выявленных отклонений по шкалам CGI, CGI-BP, MADRS, PANSS, GAS, SAS и BARS демонстрируют сходную степень эффективности и статистически достоверное различие с контрольной группой.
В двойном слепом рандомизированном 12-недельном исследовании R.McIntyre и соавт. (2005 г.) 302 пациента с БАР принимали кветиапин, галоперидол или плацебо. По наблюдениям авторов, показатели шкалы YMRS достоверно уменьшаются с 21-го дня терапии кветиапином (-12,29 против -8,32 для плацебо; p<0,01). Различие в пользу кветиапина увеличивается к 84-му дню (-17,52 против -9,48 для плацебо; p<0,001). Галоперидол также демонстрирует преимущество перед плацебо на 21 и 84-й дни терапии, однако заметно уступает кветиапину по показателям безопасности и переносимости.
M.Brecher и K.Huizar (2003 г.) в сходном по дизайну исследовании также регистрируют равное число респондентов при приеме кветиапина и галоперидола [25].
B.Paulsson и K.Huizar (2003 г.) описывают результаты 12-недельного многоцентрового рандомизированного двойного слепого исследования, в котором согласно итоговым показателям шкалы YMRS кветиапин не уступает литию по степени выраженности антиманиакального эффекта [59].
В ряде работ рассматривается возможность сочетанного применения кветиапина и нормотимиков для усиления антиманиакального/антипсихотического действия [2, 65, 66, 82]. При этом в условиях комбинированной терапии добавление кветиапина к лечению нормотимиками повышает эффективность терапии примерно на 20% [65, 66]. Особо указывается, что назначение кветиапина в этих случаях зачастую позволяет избежать добавления в схему бензодиазепинов для купирования психомоторного возбуждения [12, 57, 66, 82].
Важно отметить, что на данный момент кветиапин – единственный антипсихотик, утвержденный FDA для монотерапии острого депрессивного эпизода сроком до 8 нед [2, 18]. Можно предположить, что антидепрессивный эффект кветиапина обусловлен влиянием на 5-НТ1А- и 5-НТ2-серотонинергические и дофаминовые рецепторы [51, 87].
В проводимых в последние годы исследованиях кветиапин демонстрирует эффективность в лечении биполярной депрессии при оценке клинического ответа по редукции на 50% баллов и более по шкале оценки депрессии Монтгомери–Асберга (MADRS) и шкале оценки депрессии Гамильтона (HDRS) [33, 39, 61, 68, 69, 79, 86].
В 8-недельном двойном слепом рандомизированном исследовании M.Thase и соавт. (2006 г.) снижение выраженности депрессии в рамках БАР I и II типов (509 больных) по сравнению с исходным уровнем значимо больше у пациентов, принимавших кветиапин, в сравнении с плацебо как на первой, так и на последней неделе терапии (р<0,001 в обоих случаях). Снижение баллов по шкале MADRS при приеме кветиапина к 8-й неделе составляет 61 и 54% при приеме доз 300 и 600 мг/сут соответственно. Уменьшение баллов по шкале HDRS также достоверно больше в группе пациентов, принимавших кветиапин, чем в группе плацебо (р<0,001), уже с первой недели лечения и на протяжении всего периода терапии.
В другом аналогичном исследовании, включавшем 542 амбулаторных пациента с большим депрессивным эпизодом в рамках БАР I и II типов, а также больных с «быстрым ритмом» [27], кветиапин демонстрирует по сравнению с плацебо статистически значимое уменьшение депрессии по шкалам MADRS, HDRS также с первой недели терапии. На завершающем визите респондерами по установленным в исследовании критериям (снижение баллов по шкале MADRS на 50% и более) признаны 57,6 и 58,2% (при приеме 300 и 600 мг/сут соответственно) больных, принимавших кветиапин, против 36,1% пациентов из группы плацебо. Соотношение пациентов, достигших ремиссии (12 баллов и менее по шкале MADRS), составляет 52,9% при приеме кветиапина и 28,4% на фоне приема плацебо.
В многоцентровом исследовании BOLDER II отмечен благоприятный эффект кветиапина в отношении параллельной редукции симптомов депрессии, тревоги и ослабления когнитивного дефицита [5, 7, 9].
Переносимость и нежелательные явления кветиапина
По мнению некоторых исследователей, у больных БАР риск развития экстрапирамидных симптомов (ЭПС) и поздней дискинезии выше, чем у больных шизофренией, и они более склонны к отказу от терапии вследствие развития побочных эффектов, снижающих качество жизни [85, 86]. По данным F.Seemuller и соавт. (2005 г.), ЭПС и поздняя дискинезия, вызванная приемом традиционных антипсихотиков, в группе больных БАР встречаются в 37,9% наблюдений, тогда как в группе больных шизофренией – в 23,3% наблюдений.
Кветиапин обладает хорошей переносимостью, уменьшающей риск отказа пациента от приема препарата, что в свою очередь способствует соблюдению режима терапии, эффективному лечению больных и повышает качество жизни пациентов [20, 60, 73]. Как сообщают J.Hellewell и соавт. (1999 г.), 97% пациентов, которых перевели на кветиапин с других антипсихотических препаратов, предпочитают своему предшествующему лечению терапию кветиапином [45]. Проведенный W.Simons и соавт. (2001, 2003 гг.) ретроспективный анализ информации, взятой из американской базы данных по исследованию комплаентности антипсихотикам, доказывает, что доля пациентов, остающихся на монотерапии кветиапином, значительно выше, чем доля пациентов, получающих галоперидол или другие атипичные антипсихотики [72].
В сравнительных исследованиях указывается на сопоставимость частоты возникновения нежелательных явлений при приеме кветиапина и плацебо [21, 52, 54, 75, 81, 83].
Другие авторы подчеркивают лучшую переносимость кветиапина в сравнении с типичными антипсихотиками. Так, С.Link и соавт. (1994 г.) находят, что кветиапин в сравнении с хлорпромазином реже вызывает сомноленцию (14% против 19%), инсомнию (10% против 16%) и не снижает уровень артериального давления (18% наблюдений при приеме хлорпромазина). По данным L.Arvanitis и соавт. (1997 г.), частота ЭПС при применении кветиапина составляет 4–8%, а на фоне приема галоперидола – 37%. R.McIntyre и соавт. (2005 г.) сообщают, что ЭПС наблюдаются у 12,7% больных, получающих кветиапин, против 59,6% больных, принимающих галоперидол (р<0,0001). В исследованиях, выполненных С.Link и соавт. (1994 г.), S.Stahl (1999 г.), С.Arango, J.Bobes (2005 г.), ЭПС, включая острые дистонические реакции и паркинсонизм, не регистрируется вовсе.
При сравнении переносимости кветиапина и нормотимиков G.Sacts и соавт. (2000 г.) устанавили, что частота отмены терапии вследствие развития у больных побочных эффектов при использовании комбинации лития и вальпроатов достигает 5,9% случаев. Присоединение к этой схеме кветиапина с одновременным снижением доз нормотимиков уменьшает данный показатель до 2,3%.
Наиболее частые нежелательные явления, отмечающиеся при применении кветиапина, представлены в табл. 3.

Установлено, что такие нежелательные явления, возникающие при приеме кветиапина, как седация, сонливость, ортостатическая гипотензия, головокружение, диспепсия, носят транзиторный и/или дозозависимый характер и нивелируются через 2–3 нед от начала терапии [20] или при уменьшении дозы препарата [2].
В отличие от многих атипичных антипсихотиков кветиапин практически не влияет на уровень пролактина в крови [13, 15, 20, 21, 53, 77], не оказывает токсического действия на картину крови, значимого влияния на сердечную деятельность и показатели электрокардиограммы [15, 56].
Особо необходимо подчеркнуть, что в отличие от терапии галоперидолом и ряда атипичных антипсихотиков случаев инверсии аффекта и развития депрессивного эпизода при применении кветиапина не наблюдается [2, 11, 54].
В литературе описаны случаи передозировки кветиапина в виде однократного приема 3–10 г препарата [44, 58, 62, 76]. При этом в течении 24 ч регистрируются увеличение частоты сердечных сокращений до 128 уд/мин и гипотензия.
Выводы
Таким образом, приведенные данные свидетельствуют о том, что кветиапин обладает следующими основными преимуществами:
• эффективен при терапии шизофрении, протекающей с аффективными колебаниями, постпсихотических депрессий и шизоаффективного психоза;Учитывая широкий спектр клинико-фармакологических эффектов, кветиапин может применяться при любых вариантах клинического течения БАР.
• эффективен и утвержден для лечения как маниакальной (моно- или комбинированная терапия), так и депрессивной фазы (монотерапия) БАР;
• эффективен при лечении БАР с быстрой сменой фаз;
• характеризуется широким клинико-фармакологическим спектром (наличие антиманиакального/антипсихотического, антиагрессивного, антидепрессивного, анксиолитического и седативного эффектов) и быстрым наступлением клинического эффекта (редукции маниакальной симптоматики уже на 1-й неделе);
• не уступает по своей эффективности такому классическому антипсихотику, как галоперидол, но выгодно отличается от него отсутствием побочных экстрапирамидных эффектов и отсутствуем длительного повышения уровня пролактина;
• хорошо сочетается с препаратами лития, вальпроатами;
• позволяет отказаться от сопутствующего применения бензодиазепинов;
• имеет хороший профиль безопасности.
В настоящее время в России кветиапин представлен несколькими брэндами. Недавно был зарегистрирован и появился в свободной продаже кветиапин производства израильской компании «Тева» – Лаквель. В связи с более экономичной стоимостью сравнительно с оригинальным продуктом и гарантированно высоким качеством препаратов компании «Тева», Лаквель имеет все шансы быстро войти в широкую практику врачей-психиатров.
Список исп. литературыСкрыть список1. Бурлаков В.А. К проблеме лечения шизофрении, протекающей с сенестоипохондрическими нарушениями (опыт применения Сероквеля). Психиат. и психофармакотер. 2003; 2: 106–9.
2. Бурчинский С.Г. Нейролептики в фармакотерапии биполярных аффективных расстройств: возможности выбора. Нейро News: психоневрология и нейропсихиатрия. 2009; 6: http: //neuro.health-ua.com/article/203.html
3. Гурович И.Я., Шмуклер А.Б., Магомедова М.В. и др. Помощь больным шизофренией с первыми психотическими эпизодами: применение кветиапина. Соц. и клин. психиат. 2004; 3: 69–72.
4. Иванов М.В., Мазо Г.Э., Чомский А.Н. и др. Сероквель: перспективы и опыт терапии маний при биполярных аффективных расстройствах. Обоз. психиат. и мед. психол. им. В.М.Бехтерева. 2004; 4: 15–7.
5. Ильина Н.А. Терапия шизофрении и шизоаффективных расстройств: опыт применения кветиапина (сероквеля). Психиат. и психофармакотер. 2004; 6: 276–82.
6. Калинин В.В. Применение препарата Сероквель (кветиапин) для лечения больных шизофренией. Психиат. и психофармакотер. 2005; 2: 34–8.
7. Калинин В.В. Сероквель – атипичный нейролептик: особенности психотропного эффекта и показания. Психиат. и психофармакотер. 2001; 5.
8. Любов Е.Б., Чапурин С.А., Чурилин Ю.Ю. Фармакоэкономическая модель антирецидивного лечения Сероквелем, Рисполептом и Зипрексой пациентов в первом эпизоде шизофрении. Психиат. и психофармакотер. 2005; 4: 193–8.
9. Мазо Г.Э. Влияние терапии Сероквелем на депрессивную симптоматику в структуре шизофрении. Психиат. и психофармакотер. 2003; 6: 259–62.
10. Малин Д.И. Место нейролептической терапии в лечении биполярного аффективного расстройства. 2004; 5: 236–8.
11. Малин Д.И. Эффективность кветиапина (сероквеля) в лечении острых психозов при адекватном дозировании. Психиат. и психофармакотер. 2005; 3: 149–51.
12. Мосолов С.Н. Полвека нейролептической терапии: основные итоги и новые рубежи. Новые достижения в терапии психических заболеваний. М., 2002.
13. Мосолов С.Н., Александровский Ю.А., Вовин Р.Я. и др. Новый атипичный антипсихотик Сероквель. Результаты российских клинических испытаний. Психиат. и психофармакотер. 1999; 2: 16–24.
14. Смулевич А.Б., Зеленина Е.В. Терапия маниакальных и маниакально-бредовых состояний (клинические эффекты Сероквеля). Психиат. и психофармакотер. 2005; 1: 20–4.
15. Ястребов Д.В. Клиническое применение препарата сероквель. Фарматека. Неврология, Психиатрия. 2005; 17 (112): 112.
16. Ahlfors UG, Baastrup PC, Dencker SJ et al. Flupenthixol decanoate in recurrent manic-depressive illness. A comparison with lithium. Acta Psychiat Scand 1981; 64 (3): 226–37.
17. Altshuler LL, Gitlin MJ, Mintz J et al. Subsyndromal depression is associated with functional impairment in patients with bipolar disorder. J Clin Psychiat 2002; 63: 807–81.
18. American Psychiatric Association: Practice Guideline for the Treatment of Patients With Bipolar Disorder (Revision). Am J Psychiat 2002; 159.
19. Apter JT, Cantillon M. Efficacy, safety, and tolerability of \'Seroquel\' (quetiapine fumarate) in elderly patients with psychotic disorders. Abstracts of the 36th Annual Meeting of the American College of Neuropsychopharmacology. 1997; p. 295.
20. Arango C, Bobes J. Managing acute exacerbation of schizophrenia: focus on quetiapine. Curr Med Res Opin 2004; 5: 19–26.
21. Arvanitis LA, Miller BG. the Seroquel Trial 13 study group. Multiple fixed doses of \'Seroquel\' (quetiapine) in patients with acute exacerbation of schizophrenia: a comparison with haloperidol and placebo. Biol Psychiat 1997; 42: 233–46.
22. Avnon M, Goldin V, Neissburg J. Two long-term neuroleptic resistant patients treated by "Seroquel" (JCJ 204636) an atypical neuroleptic. Eur Neuropsychopharmacol 1996; 6: 54–124.
23. Audinot V, Canton H, Newman-Tancredi A et al. In vitro and ex vitro patterns of occupation of 5-HT2A and a1-adrenergic as compared to dopamine D2-receptors by novel antypsychotics. Eur Neuropsychopharmacol 1995; 3: 330.
24. Bartko G, Varadi H, Simon L et al. Patient satisfaction after switching from conventional to new atypical antipsychotics in schizophrenia. Int J Psychiat Clin Pract 2002; 6: 9–14.
25. Brecher MM, Huizar K. Quetiapine monotherapy for acute mania with bipolar disorder. Presented at the 27th Nordic Psychiatric Congress, August 13–16, 2003, Reykjavik, Iceland.
26. Bobes J, Garcia-Portilla MP, Saiz PA et al. High degree of tolerability for monotherapy with high doses of quetiapine: a case report. J Clin Psychiat 2002; 63: 1048–9.
27. Calabrese JR, Bowden CL, Sachs GS et al. A double-blind placebocontrolled study of lamotrigine monotherapy in outpatients with bipolar I depression. J Clin Psychiat 1999; 60: 79–88.
28. Calabrese JR, Keck PE, Macfadden W et al. A Randomized, Double-Blind, Placebo-Controlled Trial of Quetiapine in the Treatment of Bipolar I or II Depression. Am J Psychiat 2005; 162: 1351–60.
29. Casey D. Seroquel (quetiapine): preclinical and clinical findings of a new atypical antipsychotic. Exp Opin Invest Drugs 1996; 8: 939–57.
30. Chengappa KNR, Goldstein JM, Greenwood M et al. A post hoc analysis of the impact on hostility and agitation of quetiapine and haloperidol among patients with schizophrenia. Clin Ther 2003; 25: 530–41.
31. Chengappa KNR, Parepally H, Brar JS et al. A random- assignment, double-blind, clinical trial of once- vs twice-daily administration of quetiapine fumarate in patients with schizophrenia or schizoaffective disorder: a pilot study. Can J Psychiat 2003; 48: 187–94.
32. Copolov DL, Link CGG, Kowalcyk B. A multicentre, double- blind, randomized comparison of quetiapine (ICI 204, 636, "Seroquel") and haloperidol in schizophrenia. Psychol Med 2000; 30: 95–105.
33. DelBello MP, Schwiers ML, Rosenberg HL, Strakowski SM. A double-blind, randomized, placebo-controlled study of quetiapine as adjunctive treatment for adolescent mania. J Am Acad Child Adolesc Psychiat 2002; 41: 1216–23.
34. De Nayer A, Windhager E, Irmansyah F, et al. Efficacy and tolerability of quetiapine in patients with schizophrenia switched from other antipsychotics. Int J Psychiat Clin Pract 2003; 7: 59–66.
35. Emsley RA, Raniwalla J, Bailey PJ et al. A comparison of the effects of quetiapine ("Seroquel") and haloperidol in schizophrenic patients with a history of and a demonstrated, partial response to conventional antipsychotic treatment. Int Clin Psychopharmacol 2000; 15: 121–31.
36. Fleischhacker W, Linkz C, Hurst B. JCJ-204636 (Seroquel) – a putative new atypical antipsychotic: results from phase III trials. Schizophr Res 1996; 2/3: l32.
37. Fulton B, Goa K. JCJ-204.636. An initial appraisal of its pharmacological properties and clinical potential in the treatment of schizophrenia. CNS Drugs 1995; 1: 68–78.
38. Gefvert O, Lindstrom L, Langstrom B et al. Time course for dopamine and serotonin receptor occupancy in the brain of schizophrenic patients following dosing with 150 mg. «Seroquel» TTD. Eur Neuropsychopharmacol 1996; 6: 74.
39. Ghaemi SN, Goldberg JF, Henry CA et al. Quetiapine for rapid-cycling bipolar disorder: a long-term follow-up study (abstract). Bipolar Disord 2003; 5 (suppl 1): 50.
40. Goldstein J. Preclinical profile of Seroquel (quetiapine): an atypical antipsychotic with clozapine-like pharmacology. Schizophrenia: Breaking down the barriers. Ed. Holliday S., Ancil R. and Mac Ewan G. 1996; 177–208.
41. Goldstein J, Arvanitis L. JCJ-204, 636 (Seroquel): a dibenzothiazepine atypical antipsychotic. Review of preclinical pharmacology and highlights of phase II clinical trials. CNS Drugs Reviews 1: 50–73.
42. Goodwin GM. (Consensus Group of the British Association for Psychopharmacology): Evidence-based guidelines for treating bipolar disorder: recommendations from the British Association for Psychopharmacology. J Psychopharmacol 2003; 17: 149–73.
43. Goodwin F, Jamison K. Manic-Depressive Illness. New York, Oxford University Press 1990.
44. Harmon T, Krenzelok E. Rapid loss of consciousness from acute quetiapine overdosage. J Toxicol - Clin Toxicol 1997; 35 (5): 546.
45. Hellewell JSE, Kalali AH, Langham SJ et al. Patient satisfaction and acceptability of long-term treatment with quetiapine. Int J Psychiatry Clin Pract 1999; 3: 105–13.
46. Hirschfeld RM. The efficacy of atypical antipsychotics in bipolar disorders. J Clin Psychiat 2003; 64 (Suppl 8): 15–21.
47. Janicak PG, Davis JM, Ayd F et al. The Pharmacology of Bipolar Disorders. In: Janicak PG et al. Principles and practice of psychopharmacotherapy. Update 3. Baltimore: Williams & Wilkins., 1995.
48. Jones M, Huizar K. Practice guideline for the treatment of patients with bipolar disorders (revision). Am J Psychiat 2002; 159: 1–50.
49. Judd LL, Akiskal HS, Schettler PJ et al. A prospective investigation of the natural history of the long-term weekly symptomatic status of bipolar II disorder. Arch Gen Psychiat 2003; 60: 261–9.
50. Kaplan Н, Sadock B. Comprehensive Textbook of Psychiatry, 4th edn.1996.
51. Lapin IP, Oxenkrug GF. Intensification of the central serotoniner process as a possible determinant of the thymoleptic effect. Lancet 1969; 1: 132–6.
52. Link C, Arvanitis L, Miller B et al. A multicentre, placebo-controlled, double-blind evaluation of Seroquel in hospitalised patients with acute exacerbation of chronic and subchronic schizophrenia. Eur Neuropsychopharm 1994; 4 (3 Spec. Jss): 385–6.
53. Link С, Smith A, Miller В et al. A multicentre, double-blind, controlled comparison of Seroquel and chlorpromazine in the treatment of hospitalised patients with acute exacerbation of subchronic and chronic schizophrenia. Eur Neuropsychopharm 1994; 4 (3 Spec. Jss): 385.
54. McIntyre RS, Brecher M, Paulsson B et al. Quetiapine or haloperidol as monotherapy for bipolar mania—a 12-week, double-blind, randomised, parallel-group, placebo-controlled trial. Eur Neuropsychopharmacol 2005; 15: 573–85.
55. McManus DQ, Rak IW. Safety and Tolerability of «Seroquel» (QUETIAPINE) in Elderly Subjects with Psychosis. Neurology 1997; 48: А100.
56. Meats P. Quetiapine (Seroquel): an effective and well-tolerated atypical antipsychotic. Int J Psychiat Clin Pract 1997; 4: 231–9.
57. Mullen JA, Devine NA, Sweitzer DE. Quetiapine versus placebo as adjnct to Lithium or Divaloproex for the treatment of bipolar disorder. Presented at the Psychiatric Congress: Quetiapine and Bipolar Affective Disorders, October 14–17, 2003, Kanne, France.
58. Nudelman E, Vinuela LM, Cohen CI. Safety in Overdose of Quetiapine: A Case Report. J Clin Psychiat 1998; 59 (8): 433.
59. Paulsson B, Huizar K. Quetiapine monotherapy for treatment of bipolar disorder. Presented at the Psychiatric Congress: Quetiapine and Bipolar Affective Disorders, October 14–17, 2003, Kanne, France.
60. Perkins DO. Predictors of noncompliance in patients with schizophrenia. J Clin Psychiat 2002; 63: 1121–8.
61. Post RM, Leverich GS, Altshuler LL et al. An overview of recent findings of the Stanley Foundation Bipolar Network (part I). Bipolar Disord 2003; 5: 310–9.
62. Pollack PT, Zbuk K. Quetiapine fumarate overdose: clinical and pharmacokinetic lessons from extreme conditions. Clin Pharmacol Ther 2000; 68 (1): 92–7.
63. Purdon SE, Malla A, Labelle A, Lit W. Neuropsychological change in patients with schizophrenia after treatment with quetiapine or haloperidol. J Psychiat Neurosci 2001; 26: 137–49.
64. Robinson С, Robinson К, Castaner J. Quetiapine Fumarate. Drugs of the Future 1996; 5: 483–9.
65. Sachs G, Chengappa KN, Suppes T et al. Quetiapine with lithium or divalproex for the treatment of bipolar mania: a randomized, double-blind, placebo-controlled study. Bipolar Disord 2004; 6: 213–23.
66. Sacts GS, Printz DJ, Kahn DA et al. The Expert Consensus Guide Line Series: Medication Treatment of Bipolar Disorders. Posgaded Med 2000; 1: 104.
67. Sailer C, Salama A. Seroquel: biochemical profile of a potential atypical antipsychotic. Psychopharmacology 1993; 3: 285–92.
68. Sajatovic M, Brescan DW, Periz DE et al. Quetiapine alone and added to a mood stabilizer for serious mood disorders J Clin Psychiat 2001; 62: 728–32.
69. Sajatovic M, Mullen JA, Sweitzer DE. Efficacy of quetiapine and risperidone against depressive symptoms in outpatients with psychosis. J Clin Psychiat 2002; 63: 1156–63.
70. Seroquel: a putative atypical antipsychotic drug with serotonin- and dopamine-receptor antagonist properties. J Clin Psychiat 1995; 9: 438–45.
71. Shimada E, Murasaki M, Miura S et al. A phase I study in healthy volunteers of JCJ 204636, a novel neuroleptic agent. Can J Physiol Phannacol 1994; 72 (suppl.1): 445.
72. Simons WR, Bassi R, White R. Antipsychotic compliance evaluation: a population-based managed care study of persistence with initially prescribed antipsychotic medication. International Society for Pharmacoeconomics and Outcomes Research 4th Annual European Congress, Cannes, France, 11–13 November 2001.
73. Simons WR. Persistency and Compliance Evaluation (PACE): a US population-based analysis of persistency with initially prescribed antipsychotics. College of Psychiatric and Neurologic Pharmacists 6th Annual Meeting, Charleston, South Carolina, USA, 1–4 May 2003.
74. Seemuller F, Forsthoff A, Dittmann S et al. The safety and tolerability of atypical antipsychotics in bipolar disorder. Expert Opin Drug Saf 2005; 4 (5): 849–68.
75. Smith MA, McCoy R, Hamer J, Brecher M. Optimal titration for quetiapine: pilot trial. College of Psychiatric and Neurologic Pharmacists 5th Annual Meeting, Seattle, Washington, USA, 18–21 April 2002.
76. Smith MA, McCoy R, Hamer J et al. Rapid dose escalation with Quetiapine. J Clin Psychopharmacol 2005; 25: 331–35.
77. Stahl S. Psychopharmacology of antipsychotics. Martin Dunitz Ltd, London: 1999.
78. Sverdlov NR. Dopamine and depression: circuitas logic? J Biol Psychiay 1993; 33: 751–8.
79. Suppes T, McElroy SL, Keck PE et al. Use of quetiapine in bipolar disorder: a case series with prospective evaluation. Int Clin Psychopharmacol 2004; 19: 173–4.
80. Targum SD, Criden MR. Efficacy of «Seroquel» (Quetiapine) in Parkinson\'s Patients With Psychosis. Movement Disord 1997; 12 (5): 842–3.
81. Thase ME, Macfadden W, Weisler RH et al. Efficacy of Quetiapine Monotherapy in Bipolar I and II Depression. A Double-blind, Placebo-controlled Study (The BOLDER II Study). J Clin Psychopharmacol 2006; 26: 600–9.
82. Vieta E, Mullen J, Brecher M et al. Quetiapine monotherapy for mania associated with bipolar disorder: combined analysis of two international, double-blind, randomised, placebo-controlled studies. Curr Med Res Opin 2005; 21: 923–34.
83. Vieta E, Parramon G, Padrell E et al. Quetiapine in the treatment of rapid cycling bipolar disorder. Bipolar Disord 2002; 4: 335–40.
84. Wong Y, Ewing B, Jaskiw G et al. Multiple-doses of «Seroquel» (quetiapine) in elderly psychotic patients. 149th Annual meeting of АРА. N.Y. (May 4–9), 1996.
85. Yeang PP, Goldstein JM, Hellewell JSE. Extrapyramidal Symptoms in General and Elderly Psychotic Patients Population. Presented at the Psychiatric Congress: Quetiapine and Bipolar Affective Disorders. Kanne, France. October, 14–17 2003.
86. Zarate CA, Rothschild A, Fletcher KE et al. Clinical predictors of acute response with quetiapine in psychotic mood disorders. J Clin Psychiat 2000; 61: 185–9.
87. Zornberg GL, Pope HG. Treatment of depression in bipolar disorder: new directions for research. J Clin Psychopharmacol 1993; 13: 397–408.


