Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2004
Терапия пиразидолом (пирлиндол) больных с депрессиями и хроническим болевым синдромом №05 2004
В общемедицинской популяции среди пациентов, имеющих тяжелое физическое заболевание, распространенность психических расстройств составляет 23–39% в зависимости от пола и возраста. Значительную часть таких больных составляют лица с хроническими болями в пояснично-крестцовой области. Показано, что эта группа пациентов имеет неблагоприятный прогноз для выздоровления и представляет важнейшую медико-социальную проблему, так как на лечение болей в спине приходится до 80% затрат здравоохранения.
В общемедицинской популяции среди пациентов, имеющих тяжелое физическое заболевание, распространенность психических расстройств составляет 23–39% в зависимости от пола и возраста [1]. Значительную часть таких больных составляют лица с хроническими болями в пояснично-крестцовой области. Показано, что эта группа пациентов имеет неблагоприятный прогноз для выздоровления и представляет важнейшую медико-социальную проблему, так как на лечение болей в спине приходится до 80% затрат здравоохранения [2, 3].
Во многих эпидемиологических исследованиях [4, 5] показана тесная связь хронической боли и аффективных расстройств, в первую очередь – депрессивного спектра [6]. У больных с депрессивными расстройствами боль отмечалась в 57–100% случаев [7, 8]. Среди них наиболее достоверные показатели коморбидности боли и депрессии составляют 50–65% [9, 10].
Пожизненный риск возникновения депрессии у больных с хроническими болями составляет 23% для мужчин и 42% для женщин [7, 11], и именно депрессия является ведущим фактором снижения трудоспособности у таких больных [5, 12, 13]. Сочетание депрессии и хронической боли приводит к развитию так называемого аномального болевого поведения, а также отражается в ограничении выбора стратегий преодоления боли больными: они теряют веру в возможность излечения и полностью отказываются от “борьбы”. У таких пациентов нарушается социальная и профессиональная адаптация, снижается качество жизни [14]. Кроме того, депрессия понижает порог болевой чувствительности, что приводит к усилению боли и повышению доз анальгетиков [15].
В силу клинического сходства депрессивных и хронических болевых расстройств ряд исследователей [11, 16] обобщают патогенетические механизмы этих расстройств и считают, что хронический болевой синдром (ХБС) является “замаскированной депрессией”, а идиопатический болевой синдром должен рассматриваться в числе особого варианта депрессии.
Выделены общие биологические патогенетические механизмы возникновения хронической боли и депрессии. В результате предложено [28] рассматривать нарушение индоламиновой нейротрансмиссии характерным признаком обоих расстройств, который могут вызвать нарушения в обмене энкефалина [17].
У пациентов с хроническими болями отмечают сходные с обнаруживаемыми при депрессии полисомнографическую структуру сна и результаты дексаметозонового теста [8, 11]. Помимо этого, в обеих категориях больных (соматические больные и больные депрессией) было выявлено понижение содержания 5-оксиндолилуксусной кислоты (5-ОИУК) – основного метаболита серотонина и повышенное содержание субстанции Р в цереброспинальной жидкости при высокой концентрации эндорфинов [4]. Также было установлено, что у депрессивных больных с выраженной болевой симптоматикой наблюдается более низкая активность тромбоцитарной моноаминоксидазы (МАО), которая, как известно, положительно коррелирует с концентрацией в ликворе 5-ОИУК [8]. Поэтому предложено считать снижение активности тромбоцитарной МАО биологическим маркером “болевых” депрессий.
Депрессия у больных с хронической болью, как правило, протекает атипично, под “маской” алгических феноменов [11, 18]), из-за чего симптомы депрессии обычно остаются нераспознанными. Наиболее часто встречающимся вариантом течения депрессивных расстройств у больных с ХБС являются нозогенные депрессии, формирующиеся под воздействием стресса, как реакции на соматическое заболевание. В этом случае ключевую роль в их этиологии играют такие факторы, как внезапное возникновение болевого синдрома, прогрессирование болезни, телесный дискомфорт, появление внешнего дефекта, связанного с основным соматоневрологическим заболеванием, ограничение бытовой и профессиональной деятельности пациента. Различают кратковременные и затяжные нозогенные депрессии [11]. Кратковременные депрессии, часто формирующиеся под воздействием “стресса госпитализации”, не превышают по продолжительности 1–2 мес и характеризуются относительно легкими проявлениями гипотимии. При этом по мере уменьшения болевого синдрома и восстановления трудоспособности происходит редукция аффективных расстройств. Затяжные нозогенные депрессии продолжаются более 6–12 мес и оцениваются в рамках посттравматического стрессового расстройства. Их клиническая картина чаще соответствует ипохондрической депрессии с неотвязными мыслями о наихудшем исходе заболевания, тревожными ожиданиями повторных приступов боли. Депрессия всегда осложняет состояние таких больных. Она понижает болевой порог и толерантность к боли и в конечном итоге мешает успешному купированию болевого синдрома. Однако несмотря на то что хронические алгии часто сопровождаются депрессивными расстройствами, их выявлению и терапии уделяется недостаточное внимание. Комплексный подход к боли и депрессивным расстройствам требует понимания каждой проблемы в отдельности и четкой оценки их взаимосвязи. Раннее распознавание депрессивных симптомов предотвращает взаимную индукцию этих состояний и является основной задачей оказания квалифицированной медицинской помощи [19].
Выявление депрессии у больных с ХБС является непростой задачей для интерниста. Иногда больные считают депрессивные симптомы естественным следствием боли или умышленно скрывают их, так как боль с их точки зрения является социально более приемлемым заболеванием. Пациенты с хронической болью часто страдают от бессонницы, также относя ее к последствиям боли. Риск суицида, всегда существующий у депрессивных пациентов, увеличивается при выраженных болевых расстройствах. Поэтому врач должен вовремя выявить и начать лечить депрессию, в противном случае лечение боли может оказаться неэффективным.
Таким образом, значительные успехи за последнее десятилетие в области изучения патогенеза боли и депрессии открыли широкие возможности не только для активного вмешательства в купирование боли, но и создали существенные предпосылки для применения антидепрессантов.
Расширение сферы применения антидепрессантов различных фармакологических групп связано с их способностью снижать или редуцировать сопутствующую болям аффективную патологию; потенцировать эндогенные опиаты, играющие важную роль в патогенезе болевого синдрома; собственного анальгетического воздействия, достигаемого за счет повышения уровня серотонина.
При этом указанные особенности действия антидепрессантов отмечены не у всех препаратов. Несмотря на описанную при ХБС эффективность многих серотонинергических и норадренергических антидепрессантов, амитриптилин остается единственным препаратом, анальгетический эффект которого доказан в экспериментальных и клинических исследованиях [20].
На необходимость дальнейшей оптимизации терапии депрессий у больных с ХБС, использования как высокоэффективных, так и хорошо переносимых препаратов указывает и чрезвычайная чувствительность таких пациентов к нежелательным явлениям психофармакотерапии. Это диктует необходимость дальнейшего изучения эффективности антидепрессантов с благоприятным профилем переносимости (в частности, препаратов “сбалансированного” действия) у больных с ХБС.
Известно, что функционирование моноаминергических систем, в том числе медиаторов боли, во многом определяется состоянием МАО – ключевого фермента обмена серотонина, норадреналина и дофамина. Однако существует лишь несколько работ, в которых авторы приводят данные об эффективности антидепрессантов из группы ингибиторов МАО (ИМАО) при ХБС [21, 22]. В контролируемых исследованиях фенелзин был признан более эффективным по сравнению с имипрамином и плацебо в лечении болевых/депрессивных синдромов [23]. Этот препарат оказался эффективным в лечении лицевой боли и других ХБС, но вызывал большое число побочных эффектов [24].
Отечественный препарат “Пиразидол” (селективный ИМАО типа А обратимого действия) отличается от традиционных ИМАО меньшей токсичностью и риском нежелательных взаимодействий с соматотропными лекарственными средствами, в том числе используемыми в неврологической практике. Показана эффективность селективных ИМАО при депрессиях с преобладанием апатии, заторможенности и анергии (явлений негативной аффективности), а также при тревожно-соматизированных и тревожных депрессиях. При этом указывается, что их положительный терапевтический эффект наблюдался на более ранних по сравнению с ТЦА этапах терапии.
Психиатрическое обследование включало клинико-психопатологическую характеристику состояния, а также оценку по шкале Гамильтон-депрессия (HDRS–17). Всем больным проводили неврологическое, нейроортопедическое обследования, в том числе рентгенографию, магнитно-резонансную томографию и др. Болевой синдром оценивали при помощи числовой ранговой (ЧРШ) и визуально-ранговой (ВРШ) шкал, в которых с помощью словесных и цифровых характеристик пациенты могли наиболее адекватно охарактеризовать боль и оценить степень ее выраженности. Для оценки многомерного болевого опыта применяли болевой опросник Мак Гилла. Частоту побочных эффектов оценивали с помощью шкалы UKU. Для статистической обработки данных применяли компьютерную программу.
Обследованы 30 больных, хроническая боль которых была обусловлена “хронической вертеброгенной люмбоишиалгией”, “компрессионной радикулопатией пояснично-крестцовых корешков”, у которых наряду с ХБС выявлялись депрессивные расстройства. Соотношение мужчин и женщин составило 1:2,75 (8 мужчин и 22 женщины). Средний возраст больных 48,2±12,4 года.
Клинико-психопатологический анализ выявил у обследованных больных депрессивные расстройства легкой (65%) и средней (35%) степени тяжести. При оценке депрессивного состояния пациентов в соответствии со шкалой Гамильтона средний балл выраженности депрессивных расстройств составил 18,3 (min 7,2; max 23,4). Депрессия носила в 75% случаев астеноипохондрический и в 35% дистимический характер. Структуру депрессивного синдрома составили тревожная (63,3% – 19 человек) и адинамическая (36,6% – 11 человек) депрессии.
Депрессивное настроение больных с ХБС проявлялось утратой ранее присущих интересов, снижением способности получать удовольствие, общей подавленностью. Наряду с депрессивными симптомами у больных наблюдался целый ряд коморбидных (тревожных, ипохондрических, инсомнических, вегетативных) расстройств, что утяжеляло их состояние и социальную адаптацию. При оценке выраженности тревожного радикала у 63,3% больных выявилась психическая тревога – озабоченность, предчувствия наихудшего, ожидание усиления боли, раздражительность. Вместе с этим у больных регистрировались и явления соматической тревоги, проявляющиеся болями в мышцах (36,6%), шумом и звоном в ушах (15%), чувством слабости (45%), приливами жара и ознобом (43,3%), сердцебиением (17%), болями в груди, ощущениями перебоев в сердце (16,6%), гастроинтестинальными симптомами – кишечными коликами, запором, чувством переполнения желудка (43,3%), а также нейровегетативные симптомы – головокружения, головные боли напряжения (46,6%). У 86,6% наблюдали инсомнию (трудности засыпания, отсутствие ощущения отдыха и чувство разбитости при пробуждении). У 40% больных выявлено снижение интеллектуальной продуктивности (трудности концентрации внимания, ослабление памяти).
Болевые ощущения носили изнуряющий характер, зачастую полностью определяя мимику, осанку и поведение больных. Среднюю выраженность алгий в исследуемой группе оценивали как сильную (5,8±2,5 по ВРШ). Пациенты описывали боль, как схватывающую, впивающуюся, щемящую, тянущую, ноющую, немую, сводящую и т.д., тем самым постоянно подчеркивая при ее характеристике выраженность эмоционального компонента.
Все больные получали пиразидол в таблетированной форме по 0,05 г перорально 2 раза в день в суточной дозе 200–300 мг. Продолжительность курса терапии составляла 6 нед. Наряду с пиразидолом больным назначали традиционную терапию анальгетиками, нестероидными противовоспалительными препаратами (НПВП), миорелаксантами, а также мануальную терапию и массаж.
Обследования проводили до начала терапии (фон), на 7, 14, 28 и 42-й дни лечения.
Общую эффективность терапии пиразидолом оценивали при анализе данных шкалы HDRS в динамике (табл. 1).
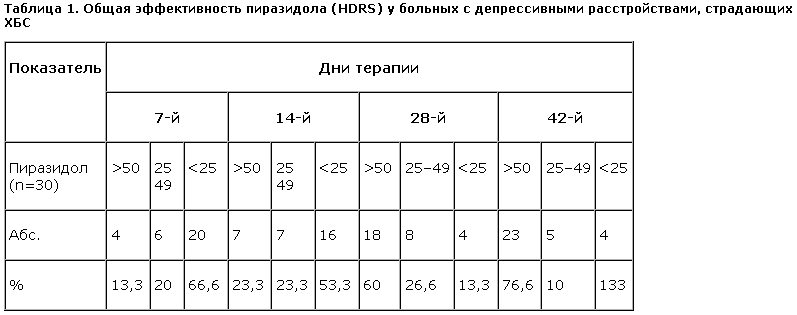
Согласно полученным результатам, начиная уже с 7-го дня лечения, отмечено постепенное нарастание терапевтического эффекта. Так, уже к концу 1-й недели лечения наблюдался неполный антидепрессивный эффект у 6 (20%) больных. При этом на первой неделе у 13,3% и на 2-й неделе лечения у 23,3% больных наблюдали полный терапевтический эффект. Дальнейшая динамика редукции депрессии постепенно нарастала к концу лечения как для полного, так и для неполного терапевтического эффекта. На 6-й неделе терапии у 76,7% больных, принимавших пиразидол, наблюдали полный терапевтический эффект и у 10% – парциальный. В 13,3% случаев лечение оказалось неэффективным.
Тимоаналептический эффект пиразидола наступал на 2–3-й неделе терапии и постепенно нарастал к концу курса лечения. Клинически он выражался в улучшении настроения, уменьшении чувства тоски, подавленности, безнадежности, улучшении сна. Во время проведения терапии больные отмечали снижение эмоционального реагирования, стабилизацию вегетативных проявлений.
Динамика показателей шкалы Гамильтона соответствовала описанным клиническим наблюдениям. Ко 2-й неделе терапии суммарный балл шкалы сократился на 10,4%, к 28-му дню – на 53,5%. При этом различия значений этого показателя до начала терапии и на 28-й день лечения становились статистически значимыми (р<0,01). На 6-й неделе терапии среднее значение суммарного балла по шкале Гамильтона составило 4,5, что соответствовало редукции депрессивной симптоматики на 75,4% в сравнении с изначальным уровнем.
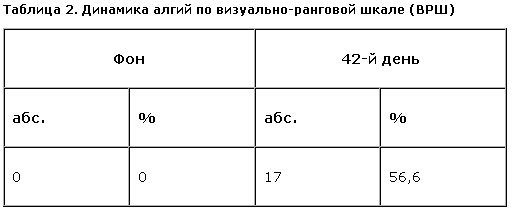
Эффективность редукции боли в процессе терапии пиразидолом оценивалась при достижении субъективной оценки “умеренная” и “слабая боль” (ВРШ). Несмотря на частые обострения болевого синдрома в связи со статической или динамической нагрузкой, провоцирование массажем и мануальной терапией, оценка уровня боли в динамике (до и после терапии пиразидолом) выявила разницу, превышающую степень случайной вероятности (р=0,004). Так, на 6-й неделе терапии пиразидолом 56% больных отметили снижение интенсивности болевого синдрома (табл. 2).
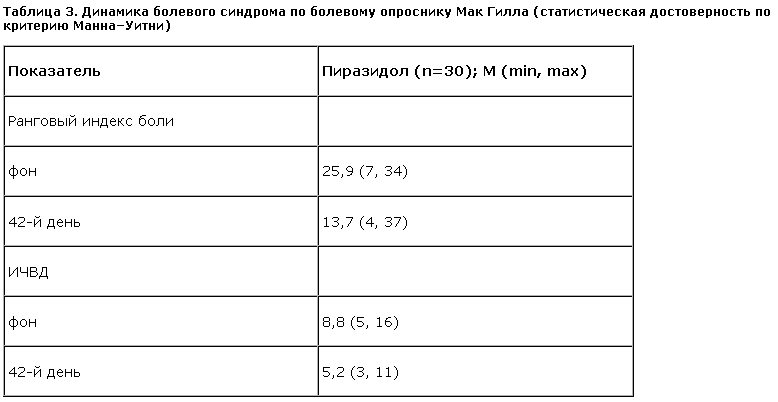
Вместе с редукцией выраженности ХБС в процессе лечения пиразидолом менялся характер (“окраска”) алгических ощущений с “мучительного” на “терпимый”. Так, например, из первоначально “дергающей” боль становилась “пульсирующей”, из “раздирающей” – “распирающей” и т. д. Если в начале терапии согласно оценке аффективного класса опросника Мак Гилла боль “приводила в ярость”, то к концу терапии она вызывала у пациента только “чувство досады” – снижение индекса числа выделенных дескриптеров [ИЧВД с 8,8 (min 5, max 16) до 5,2 (min 3, max 11)], что отражено в табл. 3.
Применение пиразидола сопровождалось хорошей переносимостью, с редкостью возникновения нежелательных явлений (р<0,005). Актуализацию тревоги наблюдали лишь в 13,3% случаев в группе больных с “тревожной депрессией” (табл. 4).
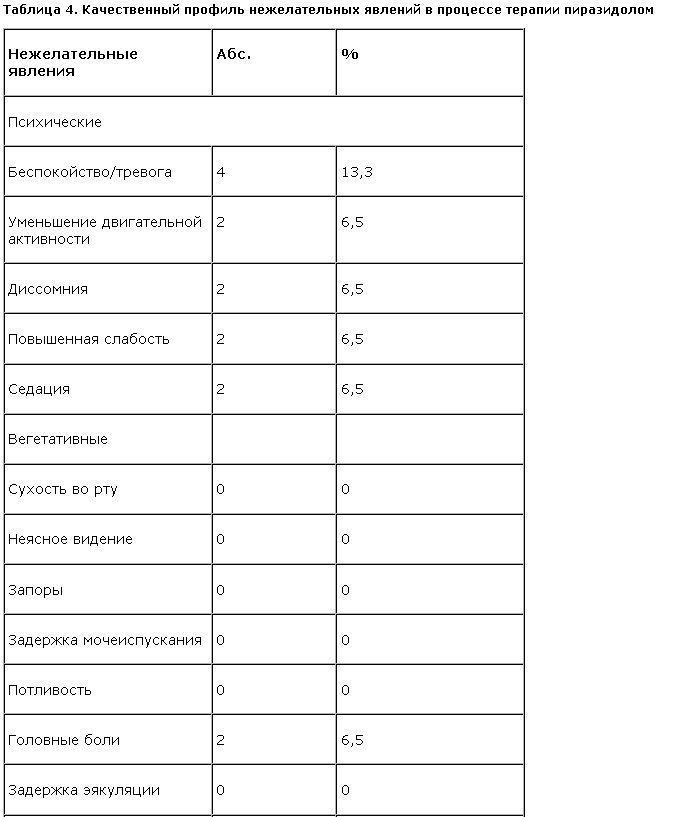
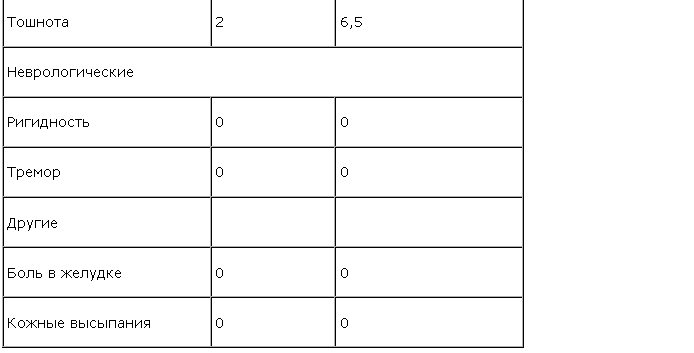
В таких случаях она легко поддавалась коррекции транквилизатором. Кроме того, у 6,5% больных в начале терапии выявлялись жалобы на уменьшение двигательной активности, седацию, повышение слабости, а также на головные боли и тошноту. Все эти нежелательные явления не носили дезадаптирующий характер, не приводили к отказу от терапии и воспринимались больными как обыденное явление при приеме лекарств.
Таким образом, результаты настоящего исследования показали, что препарат “Пиразидол” является антидепрессантом с достаточно выраженным тимоаналептическим действием. Он был эффективен в 76,6% случаев при лечении депрессий у больных ХБС и в 56,6% облегчал болевой синдром у этих больных.
Результаты настоящего исследования показали, что пиразидол оказался эффективным как при заторможенных (анестетических, апатических), так и при ажитированных (тревожных) вариантах депрессий, что подтверждает отмеченный многими авторами сбалансированный профиль его действия. Преимущество пиразидола в сравнении с необратимыми ингибиторами МАО заключается в его хорошей переносимости. Кроме того, пиразидол при сочетании с препаратами, используемыми в неврологической практике (миорелаксанты, антиконвульсанты, НПВП и др.), не выявил никаких клинически значимых побочных симптомов, обусловленных лекарственными взаимодействиями. Таким образом, включение пиразидола в комплексную терапию больных с ХБС и депрессивными расстройствами является научно обоснованным терапевтическим выбором.
Во многих эпидемиологических исследованиях [4, 5] показана тесная связь хронической боли и аффективных расстройств, в первую очередь – депрессивного спектра [6]. У больных с депрессивными расстройствами боль отмечалась в 57–100% случаев [7, 8]. Среди них наиболее достоверные показатели коморбидности боли и депрессии составляют 50–65% [9, 10].
Пожизненный риск возникновения депрессии у больных с хроническими болями составляет 23% для мужчин и 42% для женщин [7, 11], и именно депрессия является ведущим фактором снижения трудоспособности у таких больных [5, 12, 13]. Сочетание депрессии и хронической боли приводит к развитию так называемого аномального болевого поведения, а также отражается в ограничении выбора стратегий преодоления боли больными: они теряют веру в возможность излечения и полностью отказываются от “борьбы”. У таких пациентов нарушается социальная и профессиональная адаптация, снижается качество жизни [14]. Кроме того, депрессия понижает порог болевой чувствительности, что приводит к усилению боли и повышению доз анальгетиков [15].
В силу клинического сходства депрессивных и хронических болевых расстройств ряд исследователей [11, 16] обобщают патогенетические механизмы этих расстройств и считают, что хронический болевой синдром (ХБС) является “замаскированной депрессией”, а идиопатический болевой синдром должен рассматриваться в числе особого варианта депрессии.
Выделены общие биологические патогенетические механизмы возникновения хронической боли и депрессии. В результате предложено [28] рассматривать нарушение индоламиновой нейротрансмиссии характерным признаком обоих расстройств, который могут вызвать нарушения в обмене энкефалина [17].
У пациентов с хроническими болями отмечают сходные с обнаруживаемыми при депрессии полисомнографическую структуру сна и результаты дексаметозонового теста [8, 11]. Помимо этого, в обеих категориях больных (соматические больные и больные депрессией) было выявлено понижение содержания 5-оксиндолилуксусной кислоты (5-ОИУК) – основного метаболита серотонина и повышенное содержание субстанции Р в цереброспинальной жидкости при высокой концентрации эндорфинов [4]. Также было установлено, что у депрессивных больных с выраженной болевой симптоматикой наблюдается более низкая активность тромбоцитарной моноаминоксидазы (МАО), которая, как известно, положительно коррелирует с концентрацией в ликворе 5-ОИУК [8]. Поэтому предложено считать снижение активности тромбоцитарной МАО биологическим маркером “болевых” депрессий.
Депрессия у больных с хронической болью, как правило, протекает атипично, под “маской” алгических феноменов [11, 18]), из-за чего симптомы депрессии обычно остаются нераспознанными. Наиболее часто встречающимся вариантом течения депрессивных расстройств у больных с ХБС являются нозогенные депрессии, формирующиеся под воздействием стресса, как реакции на соматическое заболевание. В этом случае ключевую роль в их этиологии играют такие факторы, как внезапное возникновение болевого синдрома, прогрессирование болезни, телесный дискомфорт, появление внешнего дефекта, связанного с основным соматоневрологическим заболеванием, ограничение бытовой и профессиональной деятельности пациента. Различают кратковременные и затяжные нозогенные депрессии [11]. Кратковременные депрессии, часто формирующиеся под воздействием “стресса госпитализации”, не превышают по продолжительности 1–2 мес и характеризуются относительно легкими проявлениями гипотимии. При этом по мере уменьшения болевого синдрома и восстановления трудоспособности происходит редукция аффективных расстройств. Затяжные нозогенные депрессии продолжаются более 6–12 мес и оцениваются в рамках посттравматического стрессового расстройства. Их клиническая картина чаще соответствует ипохондрической депрессии с неотвязными мыслями о наихудшем исходе заболевания, тревожными ожиданиями повторных приступов боли. Депрессия всегда осложняет состояние таких больных. Она понижает болевой порог и толерантность к боли и в конечном итоге мешает успешному купированию болевого синдрома. Однако несмотря на то что хронические алгии часто сопровождаются депрессивными расстройствами, их выявлению и терапии уделяется недостаточное внимание. Комплексный подход к боли и депрессивным расстройствам требует понимания каждой проблемы в отдельности и четкой оценки их взаимосвязи. Раннее распознавание депрессивных симптомов предотвращает взаимную индукцию этих состояний и является основной задачей оказания квалифицированной медицинской помощи [19].
Выявление депрессии у больных с ХБС является непростой задачей для интерниста. Иногда больные считают депрессивные симптомы естественным следствием боли или умышленно скрывают их, так как боль с их точки зрения является социально более приемлемым заболеванием. Пациенты с хронической болью часто страдают от бессонницы, также относя ее к последствиям боли. Риск суицида, всегда существующий у депрессивных пациентов, увеличивается при выраженных болевых расстройствах. Поэтому врач должен вовремя выявить и начать лечить депрессию, в противном случае лечение боли может оказаться неэффективным.
Таким образом, значительные успехи за последнее десятилетие в области изучения патогенеза боли и депрессии открыли широкие возможности не только для активного вмешательства в купирование боли, но и создали существенные предпосылки для применения антидепрессантов.
Расширение сферы применения антидепрессантов различных фармакологических групп связано с их способностью снижать или редуцировать сопутствующую болям аффективную патологию; потенцировать эндогенные опиаты, играющие важную роль в патогенезе болевого синдрома; собственного анальгетического воздействия, достигаемого за счет повышения уровня серотонина.
При этом указанные особенности действия антидепрессантов отмечены не у всех препаратов. Несмотря на описанную при ХБС эффективность многих серотонинергических и норадренергических антидепрессантов, амитриптилин остается единственным препаратом, анальгетический эффект которого доказан в экспериментальных и клинических исследованиях [20].
На необходимость дальнейшей оптимизации терапии депрессий у больных с ХБС, использования как высокоэффективных, так и хорошо переносимых препаратов указывает и чрезвычайная чувствительность таких пациентов к нежелательным явлениям психофармакотерапии. Это диктует необходимость дальнейшего изучения эффективности антидепрессантов с благоприятным профилем переносимости (в частности, препаратов “сбалансированного” действия) у больных с ХБС.
Известно, что функционирование моноаминергических систем, в том числе медиаторов боли, во многом определяется состоянием МАО – ключевого фермента обмена серотонина, норадреналина и дофамина. Однако существует лишь несколько работ, в которых авторы приводят данные об эффективности антидепрессантов из группы ингибиторов МАО (ИМАО) при ХБС [21, 22]. В контролируемых исследованиях фенелзин был признан более эффективным по сравнению с имипрамином и плацебо в лечении болевых/депрессивных синдромов [23]. Этот препарат оказался эффективным в лечении лицевой боли и других ХБС, но вызывал большое число побочных эффектов [24].
Отечественный препарат “Пиразидол” (селективный ИМАО типа А обратимого действия) отличается от традиционных ИМАО меньшей токсичностью и риском нежелательных взаимодействий с соматотропными лекарственными средствами, в том числе используемыми в неврологической практике. Показана эффективность селективных ИМАО при депрессиях с преобладанием апатии, заторможенности и анергии (явлений негативной аффективности), а также при тревожно-соматизированных и тревожных депрессиях. При этом указывается, что их положительный терапевтический эффект наблюдался на более ранних по сравнению с ТЦА этапах терапии.
Психиатрическое обследование включало клинико-психопатологическую характеристику состояния, а также оценку по шкале Гамильтон-депрессия (HDRS–17). Всем больным проводили неврологическое, нейроортопедическое обследования, в том числе рентгенографию, магнитно-резонансную томографию и др. Болевой синдром оценивали при помощи числовой ранговой (ЧРШ) и визуально-ранговой (ВРШ) шкал, в которых с помощью словесных и цифровых характеристик пациенты могли наиболее адекватно охарактеризовать боль и оценить степень ее выраженности. Для оценки многомерного болевого опыта применяли болевой опросник Мак Гилла. Частоту побочных эффектов оценивали с помощью шкалы UKU. Для статистической обработки данных применяли компьютерную программу.
Обследованы 30 больных, хроническая боль которых была обусловлена “хронической вертеброгенной люмбоишиалгией”, “компрессионной радикулопатией пояснично-крестцовых корешков”, у которых наряду с ХБС выявлялись депрессивные расстройства. Соотношение мужчин и женщин составило 1:2,75 (8 мужчин и 22 женщины). Средний возраст больных 48,2±12,4 года.
Клинико-психопатологический анализ выявил у обследованных больных депрессивные расстройства легкой (65%) и средней (35%) степени тяжести. При оценке депрессивного состояния пациентов в соответствии со шкалой Гамильтона средний балл выраженности депрессивных расстройств составил 18,3 (min 7,2; max 23,4). Депрессия носила в 75% случаев астеноипохондрический и в 35% дистимический характер. Структуру депрессивного синдрома составили тревожная (63,3% – 19 человек) и адинамическая (36,6% – 11 человек) депрессии.
Депрессивное настроение больных с ХБС проявлялось утратой ранее присущих интересов, снижением способности получать удовольствие, общей подавленностью. Наряду с депрессивными симптомами у больных наблюдался целый ряд коморбидных (тревожных, ипохондрических, инсомнических, вегетативных) расстройств, что утяжеляло их состояние и социальную адаптацию. При оценке выраженности тревожного радикала у 63,3% больных выявилась психическая тревога – озабоченность, предчувствия наихудшего, ожидание усиления боли, раздражительность. Вместе с этим у больных регистрировались и явления соматической тревоги, проявляющиеся болями в мышцах (36,6%), шумом и звоном в ушах (15%), чувством слабости (45%), приливами жара и ознобом (43,3%), сердцебиением (17%), болями в груди, ощущениями перебоев в сердце (16,6%), гастроинтестинальными симптомами – кишечными коликами, запором, чувством переполнения желудка (43,3%), а также нейровегетативные симптомы – головокружения, головные боли напряжения (46,6%). У 86,6% наблюдали инсомнию (трудности засыпания, отсутствие ощущения отдыха и чувство разбитости при пробуждении). У 40% больных выявлено снижение интеллектуальной продуктивности (трудности концентрации внимания, ослабление памяти).
Болевые ощущения носили изнуряющий характер, зачастую полностью определяя мимику, осанку и поведение больных. Среднюю выраженность алгий в исследуемой группе оценивали как сильную (5,8±2,5 по ВРШ). Пациенты описывали боль, как схватывающую, впивающуюся, щемящую, тянущую, ноющую, немую, сводящую и т.д., тем самым постоянно подчеркивая при ее характеристике выраженность эмоционального компонента.
Все больные получали пиразидол в таблетированной форме по 0,05 г перорально 2 раза в день в суточной дозе 200–300 мг. Продолжительность курса терапии составляла 6 нед. Наряду с пиразидолом больным назначали традиционную терапию анальгетиками, нестероидными противовоспалительными препаратами (НПВП), миорелаксантами, а также мануальную терапию и массаж.
Обследования проводили до начала терапии (фон), на 7, 14, 28 и 42-й дни лечения.
Общую эффективность терапии пиразидолом оценивали при анализе данных шкалы HDRS в динамике (табл. 1).

Согласно полученным результатам, начиная уже с 7-го дня лечения, отмечено постепенное нарастание терапевтического эффекта. Так, уже к концу 1-й недели лечения наблюдался неполный антидепрессивный эффект у 6 (20%) больных. При этом на первой неделе у 13,3% и на 2-й неделе лечения у 23,3% больных наблюдали полный терапевтический эффект. Дальнейшая динамика редукции депрессии постепенно нарастала к концу лечения как для полного, так и для неполного терапевтического эффекта. На 6-й неделе терапии у 76,7% больных, принимавших пиразидол, наблюдали полный терапевтический эффект и у 10% – парциальный. В 13,3% случаев лечение оказалось неэффективным.
Тимоаналептический эффект пиразидола наступал на 2–3-й неделе терапии и постепенно нарастал к концу курса лечения. Клинически он выражался в улучшении настроения, уменьшении чувства тоски, подавленности, безнадежности, улучшении сна. Во время проведения терапии больные отмечали снижение эмоционального реагирования, стабилизацию вегетативных проявлений.
Динамика показателей шкалы Гамильтона соответствовала описанным клиническим наблюдениям. Ко 2-й неделе терапии суммарный балл шкалы сократился на 10,4%, к 28-му дню – на 53,5%. При этом различия значений этого показателя до начала терапии и на 28-й день лечения становились статистически значимыми (р<0,01). На 6-й неделе терапии среднее значение суммарного балла по шкале Гамильтона составило 4,5, что соответствовало редукции депрессивной симптоматики на 75,4% в сравнении с изначальным уровнем.
Эффективность редукции боли в процессе терапии пиразидолом оценивалась при достижении субъективной оценки “умеренная” и “слабая боль” (ВРШ). Несмотря на частые обострения болевого синдрома в связи со статической или динамической нагрузкой, провоцирование массажем и мануальной терапией, оценка уровня боли в динамике (до и после терапии пиразидолом) выявила разницу, превышающую степень случайной вероятности (р=0,004). Так, на 6-й неделе терапии пиразидолом 56% больных отметили снижение интенсивности болевого синдрома (табл. 2).

Вместе с редукцией выраженности ХБС в процессе лечения пиразидолом менялся характер (“окраска”) алгических ощущений с “мучительного” на “терпимый”. Так, например, из первоначально “дергающей” боль становилась “пульсирующей”, из “раздирающей” – “распирающей” и т. д. Если в начале терапии согласно оценке аффективного класса опросника Мак Гилла боль “приводила в ярость”, то к концу терапии она вызывала у пациента только “чувство досады” – снижение индекса числа выделенных дескриптеров [ИЧВД с 8,8 (min 5, max 16) до 5,2 (min 3, max 11)], что отражено в табл. 3.

Применение пиразидола сопровождалось хорошей переносимостью, с редкостью возникновения нежелательных явлений (р<0,005). Актуализацию тревоги наблюдали лишь в 13,3% случаев в группе больных с “тревожной депрессией” (табл. 4).


В таких случаях она легко поддавалась коррекции транквилизатором. Кроме того, у 6,5% больных в начале терапии выявлялись жалобы на уменьшение двигательной активности, седацию, повышение слабости, а также на головные боли и тошноту. Все эти нежелательные явления не носили дезадаптирующий характер, не приводили к отказу от терапии и воспринимались больными как обыденное явление при приеме лекарств.
Таким образом, результаты настоящего исследования показали, что препарат “Пиразидол” является антидепрессантом с достаточно выраженным тимоаналептическим действием. Он был эффективен в 76,6% случаев при лечении депрессий у больных ХБС и в 56,6% облегчал болевой синдром у этих больных.
Результаты настоящего исследования показали, что пиразидол оказался эффективным как при заторможенных (анестетических, апатических), так и при ажитированных (тревожных) вариантах депрессий, что подтверждает отмеченный многими авторами сбалансированный профиль его действия. Преимущество пиразидола в сравнении с необратимыми ингибиторами МАО заключается в его хорошей переносимости. Кроме того, пиразидол при сочетании с препаратами, используемыми в неврологической практике (миорелаксанты, антиконвульсанты, НПВП и др.), не выявил никаких клинически значимых побочных симптомов, обусловленных лекарственными взаимодействиями. Таким образом, включение пиразидола в комплексную терапию больных с ХБС и депрессивными расстройствами является научно обоснованным терапевтическим выбором.
Список исп. литературыСкрыть список1. Guthrie E. Emotional disorder in chronic illness: psychotherapeutic interventions. Br J Psychiatry 1996 Mar; 168 (3): 265–73.
2. Gatchel RJ, Gardea MA. Lower back pain: psychosocial issues. Their importance in predicting disability, response to treatment and search for compensation. Neurologic clinics 1999; 17: 149–66.
3. Waddell G, Pilowsky I, Bond M. Clinical assessment and interpretation of abnormal illness behaviour in low back pain. Pain 1989; 39: 41–53.
4. Atkinson JH, Slater MA, Patterson TL et al. Prevalence, onset and risk of psychiatric disorders in men with chronic low–back pain. Pain IS. Bonica J.J., Definitions and taxonomy of pain. The Management of pain. Eds J.J. Bonica et al. 2-nd Et. Philadelphia, 1990; 1: 18.
5. Haley WE, Turner JA, Romano JM. Depression in chronic pain patients: relation to pain, activity and sex differences. Pain 1985; 23: 337–43.
6. de Leon J, Saiz-Ruiz J, Chinchilla A, Morales P. Why do some psychiatric patients somatize? Acta Psychiatr Scand 1987 Aug; 76 (2): 203–9.
7. Ward NG, Bloom VL, Friedel RO. The effectiveness of tricyclic antidepressants in the treatment of co-existing pain and depression. Pain 1979; 7: 331–41.
8. Von Knorring L, Perris C, Eisemann M et al. Pain as a symptom in depressive disorder. I. Relationship to diagnostic subgroup and depressive symtomatology. Pain 1983; 15: 19–26.
9. Flor H, Turk DC, Sholtz OB. Impact of chronic pain on the spouse: marital, emotional, and physical consequences. J Psychosom Res 1987; 31: 63–71.
10. Kramlinger KG, Swanson DW, Maruta T. Are patients with chronic pain depressed? Am J Psychiatry 1983 Jun; 140 (6): 747–9.
11. Blumer D, Heiborn M. Chronic pain as a variant of depressive disease: the pain prone disorder. J Nerv Dis 1981; 170: 381–406.
12. Doan В, Wadden N. Relationship between depressive symptoms and descriptions of chronic pain. Pain 1989; 36: 75–84.
13. Dworkin RH, Gitlin MJ. Clinical aspects of depression in chronic pain patients. Clin JPain 1991 Jun; 7 (2): 79–94.
14. Осипова В.В. Психологические аспекты боли. В кн.: Болевые синдромы в неврологической практике. Под ред. А.М.Вейна и др. М.: МЕДпресс, 1999; с. 90–105.
15. Greenberg L, Edwards E, Henn FA. Related Articles, Links Dexamethasone suppression test in helpless rats. Biol Psychiatry 1989 Sep; 26 (5): 530–2.
16. Lopes Ibor JJ. Masked depression. Br J Psychiat 1972; 120: 245–58.
17. Lindsay PG, Wycoff M. The depression-pain syndrome and the response to antidepressants. Psychosomatics 1981; 22: 571–7.
18. Смулевич А.Б. Депрессии при соматических и психических заболеваниях. М., 2003; с. 93–4.
19. Gallagher RM, Verma S. Managing pain and comorbid depression: A public health challenge. Semin Clin Neuropsychiatry 1999 Jul; 4 (3): 203–20.
20. Sindrup SH. Antidepressants in pain treatment. Nord J Psychiatr 1993; 47 (Suppl. 30): 67–73.
21. Lascelles RG. Atypical facial pain and depression. Br J Psychiatry 1966 Jul; 112 (488): 651–9.
22. Merskey H, Hester RA. The treatment of chronic pain with psychotropic drugs. Postgrad Med J 1972 Oct; 48 (564): 594–8.
23. Davidson J, Raft D, Pelton S. An outpatient evaluation of phenelzine and imipramine. J Clin Psychiatry 1987 Apr; 48 (4): 143–6.
24. Krishnan K, France R, Houpt J. Chronic low back pain and depression. Psychosomatics 1985; 26: 299–302.

