Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2003
Ремерон (миртазапин) в лечении депрессий с нарушениями сна №01 2003
Введение
Отмечаемый в последние десятилетия значительный рост интереса к изучению широкого круга депрессивных расстройств можно связать с их большей выявляемостью и расширением возможностей дифференцированной терапии [1, 2].
Хорошо известно, что наряду с изменением ряда важнейших биологических показателей при депрессии большее значение приобретают расстройства сна. Это находит отражение в современных классификациях. В МКБ-10 из соматических симптомов нарушение сна выносится на первое место.
Согласно данным литературы, нарушения цикла сон-бодрствование при депрессии достигают 83–100%. Использование объективных полисомнографических исследований позволяет выявить нарушения сна у всех (100%) больных [3–5].
Выделяется три типа расстройств сна [6]:
А. Пресомнические, ведущим проявлением которых являются трудности засыпания.
Б. Интросомнические, включающие ночные пробуждения, трудности засыпания после них и ощущение недостаточной глубины сна.
В. Постсомнические расстройства характеризуются сокращением времени сна за счет раннего пробуждения, как правило, сочетающимся с плохим самочувствием в утренние часы.
Попытки оценить особенности нарушений сна при депрессиях в рамках разных нозологических форм привели к противоречивым результатам [7].
В то же время большинство исследователей отмечают трудности засыпания (пресомнические расстройства) при психогенных депрессиях, тогда как раннее утреннее пробуждение (постсомнические расстройства) признается более характерным для эндогенных.
Прерывистый сон и сокращение длительности сна (интросомнические расстройства) с одинаковой частотой выявляются как при психогенных, так и при эндогенных депрессиях.
Подобное мнение обусловлено, по-видимому, не только различиями методических подходов в оценке нарушений сна, но и тем, что нозологическая принадлежность не является валидным дифференцирующим признаком для анализа связи расстройств сна и депрессий. Такой точки зрения придерживаются исследователи, которые считают, что клинический, нозологический диагноз меньше значит для специфики расстройств сна, чем психопатологическая структура [5, 8].
На основании многолетних исследований отделения аффективной патологии Московского НИИ психиатрии мы исходим из представления о сложной структуре эмоциональной составляющей депрессии, включающей наряду с тоской элементы тревоги и апатии. Эти составляющие находятся в определенном соотношении. Преобладание по степени выраженности одного из них определяет структуру и характер депрессии в целом. В зависимости от ведущего (наиболее выраженного) аффекта выделяются тоскливые, тревожные, апатические варианты депрессии. В связи с этим представляется правомерным рассмотрение нарушений сна при депрессии, с учетом ведущего аффекта в структуре депрессивного синдрома и типа депрессивной триады [1, 9].
Современные возможности лечения депрессивных расстройств существенно расширяются благодаря успехам психофармакологии в разработке новых классов психотропных препаратов [10].
Один из антидепрессантов ремерон (миртазапин), впервые появившийся в Нидерландах в 1994 г., в настоящее время получил широкое распространение и признание.
Ремерон (миртазапин) – препарат, относящийся к классу НаССА (первый норадренергический и селективный серотонинергический антидепрессант). Принцип действия ремерона отличается от всех известных антидепрессантов. Ремерон повышает норадренергическую и серотонинергическую передачу путем блокады центральных a2-адренергических ауторецепторов и a2-серотонинергических гетерорецепторов, а также обладает избирательным антагонизмом к постсинаптическим 5-НТ2- и 5-НТ3-рецепторам. Повышение норадренергической и серотонинергической нейротрансмиссии, связанное с потенцированием 5-НТ1-рецепторов, лежит в основе антидепрессивной активности ремерона. Благодаря специфическому связыванию с рецепторами у ремерона фактически отсутствуют антихолинергические, антиадренергические и серотонинергические побочные эффекты. Дополнительные анксиолитические и гипнотические свойства препарата, объясняются блокадой 5-НТ2-, 5-НТ3- и косвенной стимуляцией 5-НТ1а-рецепторов.
К настоящему времени проведено значительное количество исследований, подтверждающих эффективность миртазапина при лечении депрессий.
Большинство исследователей указывают на положительную динамику с конца первой недели тревоги и со второй недели основных депрессивных симптомов, включая витальные, меланхолические компоненты, при разного уровня и сложности структуре депрессии [11–13]. Имеются данные о преимуществах ремерона при сравнении с флувоксамином, флуоксетином, циталопрамом, пароксетином [14–16]. Специально подчеркивается эффективность при незначительном побочном эффекте, позволяющая рекомендовать его применение в геронтологической, соматической, наркологической практике [14, 17–20]. Особо отмечается благотворное влияние на нарушения сна, включая значительное сокращение периода засыпания, увеличение длительности и качества сна [10, 21, 22]. Согласно опубликованным данным достоверная редукция нарушений сна на первой неделе достигает 61,8%, а на второй неделе – 76,5%. Это дает основание рекомендовать ремерон (миртазапин) в качестве средства преодоления депрессивной инсомнии [23].
Отсутствие побочных эффектов позволяет использовать ремерон в геронтологической практике для лечения больных при сочетании депрессии и соматических заболеваний, в частности с ишемической болезнью сердца [10, 20].
Изучение клинических аспектов применения ремерона при депрессиях с нарушениями сна проведено в стационарных условиях отделения аффективной патологии МНИИП Минздрава РФ. В рамках открытого неконтролируемого исследования ремерон получали пациенты с депрессией, соответствовавшей критериям МКБ-10 (табл. 1).
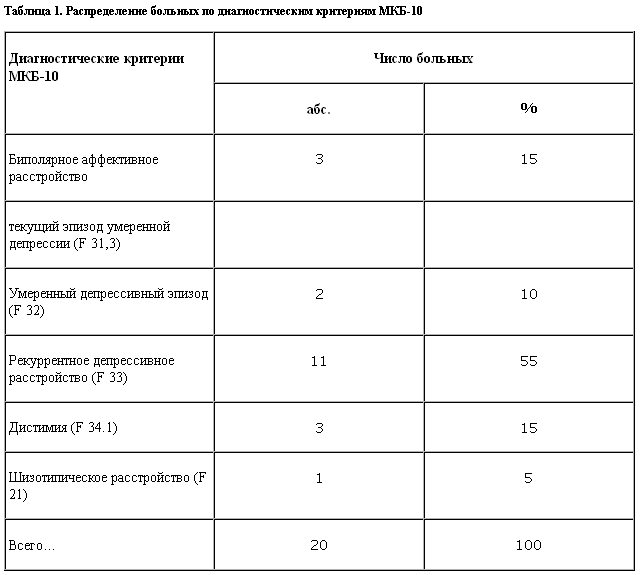
Как видно из приведенных данных, преобладали больные с рекуррентным депрессивным расстройством.
Не включали больных с расстройствами сна органической природы, алкоголизмом и наркоманиями, галлюцинаторно-бредовыми расстройствами, а также пациентов с тяжелой соматической патологией и депрессиями психотического уровня.
В исследование вошли 20 больных (12 мужчин, 8 женщин) в возрасте от 22 до 70 лет (средний возраст 44,95±15,8 года).
Ремерон назначали в дозе от 30 до 60 мг. В 1-й день пациенты получали 15 мг на ночь. В последующем дозу15 мг сохраняли у 1 больного, у 10 больных увеличили до 30 мг, у 6 – до 45 мг и у 3 – до 60 мг.
До проводимого исследования 3 пациента никогда не получали снотворных препаратов, 6 – эпизодически, 9 – регулярно, у 1 в предыдущие годы отмечена зависимость от бензодиазепинов.
Использовали: шкала Гамильтона депрессии (HAMD, 21 пункт), шкала Гамильтона тревоги (HARS, 14 пункт), а также госпитальная шкала оценки тревоги и депрессии и шкала побочных эффектов. Специально для исследования соотношения сна-бодрствования разработана оригинальная шкала, состоящая из 5 пунктов, оценивающая по 3-балльной системе: 1) сонливость, 2) пресомнические нарушения (затрудненное засыпание), 3) интросомнические (ночные пробуждения), 4) “А” постсомнические (раннее окончательное пробуждение), 4) “Б” постсомнические (позднее пробуждение), 5) уровень качества дневного бодрствования. Период наблюдения продолжался 28 дней. Показатели регистрировали по указанным шкалам до начала лечения, на 3, 7, 14, 21 и 28-й дни.
Независимо от диагностической оценки состояние больных рассматривали с учетом ведущего депрессивного аффекта и структуры депрессивной триады (табл. 2).
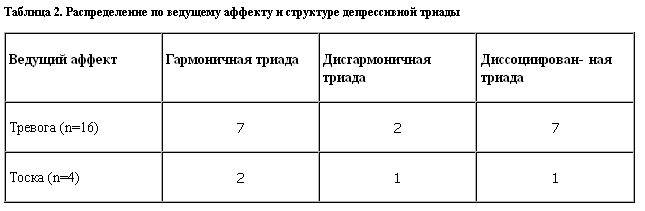
Нарушенное засыпание – частая жалоба депрессивных больных, при наличии тревоги – более длительное время. Для тревожных больных также характерно беспокойное поведение в постели с постоянным изменением позы. Чаще они лежат с открытыми глазами, испытывая непрерывный поток тревожных мыслей, обращенных в будущее. При тоскливых состояниях пациенты обычно спокойны, лежат с закрытыми глазами, испытывая тягостное состояние душевной "маяты" с пессимистическими мыслями, анализом прошлого, при имеющейся сонливости и желании спать.
Интросомнические нарушения при тревожных депрессиях характеризуются частыми пробуждениями в разные периоды ночи, им нередко предшествуют беспокойные сновидения. Больные просыпаются мгновенно по типу "включения", "вздрагивания", которые часто сопровождаются усилением тревоги. Засыпание после пробуждения относительно не затруднено. Пациенты с тоскливым аффектом просыпаются реже и чаще во второй половине ночи. Пробуждения носят более длительный характер и описываются как тягостное "пробирание" сквозь сон, "постепенный выход в бодрствование". Сновидения для этой группы менее характерны, но тягостны, мрачны и менее сюжетны. При пробуждении больные испытывают досаду. Засыпание вновь более проблематично.
Характерное для депрессивных больных раннее пробуждение утром без возможности уснуть снова более выражено при ведущем тоскливом аффекте. Проснувшись за 2–3 ч раньше обычного времени, они остаются в постели с безуспешными попытками уснуть вновь. Лежат неподвижно, с закрытыми глазами, что приводит к противоречивым показаниям медицинского персонала и больных о наличии у них "бессонницы". При тревоге, особенно с гармоничной структурой депрессивного синдрома, более характерно окончательное раннее пробуждение незадолго до обычного времени.
Анализ жалоб пациентов на более позднее пробуждение утром и длительное пребывание в постели выявил, что это свойственно тревожным пациентам с диссоциированной триадой и тоскливым пациентам с гармоничной триадой.
Имеются различия в состоянии дневного бодрствования в зависимости от ведущего аффекта. Пациенты с тоской чаще жалуются на чувство "разбитости", "тяжести", "отсутствие свежести" и "отдыха от сна". У тревожных больных превалирует "усталость-напряженность". Характер дневного бодрствования зависит от количества "потерянного времени" за ночь.
Отмечаемые в динамике смена ведущего аффекта и, соответственно, изменение структуры депрессивной триады меняет и характер нарушений сна, и качество дневного бодрствования.
Результаты исследования
Все 20 пациентов завершили исследование. Полученные данные обработаны с помощью статистических компьютерных пакетов программы Statistica-5.5.

Динамика депрессивных расстройств при терапии ремероном характеризовалась быстрым и стабильным нарастанием тимолептического эффекта. К концу наблюдения (28 дней) суммарный балл снизился на 80,3%. Редукции симптоматики менее 50% не отмечено ни в одном наблюдении. Исходя из показателей наиболее распространенной оценки эффективности по шкале Гамильтона (HAMD-21), состояние больных после 4 нед применения ремерона можно определить как ремиссию или отсутствие депрессии. До начала терапии средний балл по шкале Гамильтона депрессии составлял 26,1 (±4,91), на 3-й день терапии 19,2 (±5,6), на 7-й день 16,2 (±4,6), на 14-й день 11,92 (±5,2), на 21 и 28-й дни 8,05 (±4,5) и 5,2 (±3,1) балла соответственно (рис. 1). Статистически достоверное снижение тревоги выявлялось с 1-й недели, а нарушений сна – с 3-го дня терапии (р<0,05).
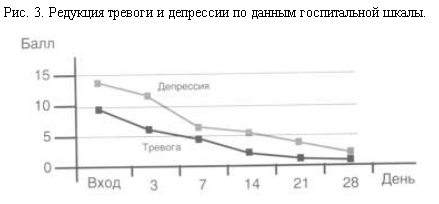
Данные субъективной оценки динамики по госпитальной шкале тревоги и депрессии приведены на рис. 3. До лечения баллы тревоги и депрессии соответствовали 9,45 (±3,6) и 13,55 (±3,6), на 3-й день – 6,3 (±2,8) и 11,45 (±3,4), на 7-й день – 4,75 (±2,3) и 9,6 (±3,6), на 14-й день – 2,6 (±2,4) и 5,75 (±4,2), на 21-й день – 1,65 (±1,56) и 3,95 (±3,3) и на 28-й день – 1,45 (±1,1) и 2,45 (±2,8).
Анализ данных позволяет отметить более быструю редукцию тревожных симптомов в сравнении с типичными депрессивными (тоскливыми) компонентами. Полученные данные в значительной степени совпадают с имеющимися в литературе [11, 14, 17, 21].
На рис. 4–6 показано процентное соотношение нарушений сна с другими показатели шкалы Гамильтона депрессии.
Как видно, отчетливая редукция нарушений сна выявляется на 1-й неделе и сохраняется в дальнейшем.
На рис. 7 приведены соотношения редукции гипотимии (тоски) (1), нарушений сна (4, 5, 6), психической (10) и соматической (11) тревоги по шкале депрессии Гамильтона. Статистический анализ показал, что редукция симптомов тревоги имеет большую выраженность в сравнении с гипотимией (тоской). Среди нарушений сна наиболее быстрая редукция характерна для затрудненного засыпания, затем – для беспокойного сна и в последнюю очередь – для ранних пробуждений.
Более наглядно динамику показателей состояния сна и бодрствования можно проследить по оригинальной шкале оценки нарушений сна и бодрствования на рис. 8–11, на которых показано в абсолютной величине состояние сна и бодрствования в динамике терапии.
По горизонтали отмечены пункты шкалы оценки нарушений сна и бодрствования, в каждом пункте 4 значения от 0 до 3, которые обозначены рядом стоящими столбиками, по вертикали число пациентов.







I – характеризует сонливость; II – характер засыпания; III – интросомнические расстройства; IVA – постсомнические расстройства (раннее пробуждение); IVB – постсомнические расстройства (позднее пробуждение); V – дневное бодрствование.
По динамике изменений видно, что число пациентов соответствующего признака, оцениваемого в пункте, перемещается справа налево, отражая уменьшение выраженности симптома. У 95% больных с первых дней после приема препарата появляется вечерняя сонливость, оцениваемая как "приятность" при подготовке ко сну. К 3-му дню затрудненное засыпание отмечали только 15% пациентов, 30% продолжали жаловаться на беспокойный сон с пробуждениями. Улучшились показатели утреннего сна и пробуждений, качество дневного бодрствования. К 7-му дню терапии при сохранении положительной тенденции улучшения сна в первой половине ночи, утреннее пробуждение и качество дневного функционирования изменяются мало.
К 14-му дню реже отмечаются утренние пробуждения, изменяется характер сновидений. При ведущем тоскливом аффекте сновидения становятся более "легкими", запоминающимися как приятные. При ведущем тревожном аффекте уменьшается количество "калейдоскопических" сновидений, содержание меняется с тревожного на нейтральное.
В ходе дальнейшего лечения улучшается самочувствие днем, снижается фиксация на расстройствах сна, облегчается засыпание, углубляется ночной сон, пробуждения нивелируются.
В течение 3 и 4-й недели улучшение сна продолжается. Необходимо, однако, отметить, что наиболее устойчивым к воздействию препарата оказываются постсомнические расстройства, особенно при ведущем тревожном аффекте.
Побочные эффекты возникали редко и были нестойкими. К ним отнесены: сухость во рту (3) и легкая сонливость (4). Указания о возможной сонливости при терапии ремероном 15 мг можно встретить и у других исследователей [19, 21]. Согласно нашим наблюдениям эффект 15 мг ремерона проявляется быстрее, чем 30 мг, и ощущается "как быстро накатывающаяся" сонливость. Специальный анализ показал, что выпускаемая в стандартной форме доза 30 мг имеет стабильную оболочку, в состав которой входит полисахарид гидроксипропил метил, полиэтилен гликоль 8000, двуокись титана (Е171), оксид желтого железа (Е172) и оксид красного железа (Е172). Возможно, что при приеме половины таблетки (15 мг), активное вещество препарата становится доступным в течение более короткого периода времени, а эффект более выраженным.
Эти наблюдения использованы нами для более быстрого купирования тревоги в утренние часы, при этом назначение ремерона утром не давало сонливости. В вечернее время назначение ремерона возможно дважды: 15 мг вечером (после ужина) и 15 мг непосредственно на ночь. Заключение
Проведенное исследование позволяет оценить ремерон как антидепрессант широкого спектра действия, включающего наряду с тимоаналептическим выраженный анксиолитический и гипнотический эффекты, особенно при нарушениях сна первой половины ночи.
Список исп. литературыСкрыть список1. Вертоградова О.П. В кн. Депрессия (психопатология, патогенез), под ред. проф. О.П.Вертоградовой. М., 1980; 9–15.
2. Краснов В.Н. Психиатр. и психофармакол., 2001; 5: 152–4.
3. Левин Я.И. Депрессия и сон. Психиатр. и психофармакол., 2000; 1: 20–3.
4. Синицкий В.Н. Депрессивные состояния. Киев, 1986; 271 с.
5. Твердохлеб В.П. Депрессии в амбулаторной и общесоматической практике. М., 1984; 128–33.
6. Вейн А.М. Нарушения сна и бодрствования. М.: Медицина, 1974; 384 с.
7. Зеленина Е.В. РМЖ. Современная Психиатрия., 1998; 2: 24–7.
8. Ward JA. Canad Psyhiat Ass J 1968; 13: 249–57.
9. Вертоградова О.П., Волошин В.М. Журн. неврол. и психиатр., 1983; 8: 1189–94.
10. Пантелеева Г.П. Психиатр. и психофармакол., 2001; 5: 158–62.
11. Мосолов С.Н., Костюкова Е.Г., Сердитов О.В. и др. Соц. и клин. психиатр., 2000; 1: 55–60.
12. David J, Nutt MD, Ph D. J Clin Psyhiat 1999; 60: 23–7.
13. Falkai P. J Clin Psyhiat 1999; 60: 36–40.
14. Морозова М.А., Бениашвили А.Г. Соц. и клин. психиатр., 2001; 1: 81–4.
15. Thompson C, Phil М. J Clin Psyhiat 1999; 60: 18–22.
16. Jack M. Gоrman. J Clin Psyhiat 1999; 60: 9–14.
17. Александровский Ю.А., Аведисова А.С., Спасова С.А., Файзуллоев А.З. Психиатр. и психофармакол., 2002; 4 (1): 25–31.
18. Иванец Н.И. и др. Вопр. наркол., 2001; 20–7.
19. Михайлова Н.М., Колыхалов И.В., Калын Я.Б., Жариков Г.А. Психиатр. и психофармакол., 2001; 2: 57–61.
20. Сыркин А.Л., Шеянов М.В., Печерская М.Б. и др. Психиатр. и психофармакол., 2002; 4 (2): 64–5.
21. Аведисова А.С. и др. Рос. психиатр. журн., 2000; 3: 48–51.
22. Thase M. J Clin Psyhiat 1999; 60: 32–5.
23. Колюцкая Е.В., Ястребов Д.В. РМЖ. Современная Психиатрия. 1999; 2–3: 50–2.


