Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2003
Нейрональная пластичность и терапия аффективных расстройств №05 2003
За последние полвека, прошедшие после открытия и внедрения в клиническую практику первых антидепрессантов, особенно в последние годы, теоретические представления о механизмах их терапевтического действия претерпели значительную эволюцию [1–3]. С одной стороны, необходимость пересмотра взглядов на этиологию и патогенез аффективных расстройств определялась тем, что длительное время господствовавшая моноаминовая гипотеза [4, 5] не вполне согласовывалась с рядом клинических, фармакокинетических и фармакодинамических аспектов антидепрессивной терапии. С другой – углубление знаний о природе эмоций и эмоциональных расстройств было тесно связано с бурным развитием нейрофизиологических, нейрохимических и молекулярно-генетических методов исследования структуры и функции головного мозга на экспериментальных моделях депрессии как in vivo (в поведении животных), так и in vitro (на клетках и культурах ткани). В самое последнее время эти методы были существенно дополнены достижениями нейровизуализационных технологий (рентгеновской компьютерной томографии – КТ, магнитно-резонансной томографии – МРТ, магнитно-резонансной спектроскопии, или функциональной МРТ – фМРТ, однофотонной эмиссионной томографии – ОФЭТ, или SPECT, позитронно-эмиссионной томографии – ПЭТ), позволяющих наглядно увидеть и количественно измерить многие параметры прижизненной структуры и метаболизма мозга человека.
Благодаря этим достижениям было показано, что при аффективных расстройствах, которые традиционно считались “функциональными”, отмечаются выраженные, причем не только ультраструктурные, но и макроморфологические изменения нервной ткани, т.е. наблюдается явление нейрональной пластичности [3, 6–8].
Термин “нейрональная пластичность”, относительно новый для психиатрии, уже давно использовался в неврологии и нейрохирургии для обозначения возможности восстановления (хотя бы частичного) тех или иных мозговых функций после повреждений ЦНС (в результате инсульта, черепно-мозговой травмы, хирургического вмешательства). В когнитивных нейронауках этим термином также обычно обозначали не столько морфологические, сколько функциональные перестройки нейрональной организации, развивающиеся, например, в процессе привыкания, при обучении, лежащие в основе памяти.
Наиболее изученными экспериментальными нейрофизиологическими моделями нейропластичности являются длительная посттетаническая потенциация нейронов гиппокампа, т.е. повышение их чувствительности после неоднократного раздражения афферентных волокон, и явление “раскачки” или “разжигания очага” (англ. kindling), лежащее в основе возникновения и генерализации эпилептических очагов [9].
Среди многообразия феноменов нейрональной пластичности в плане патофизиологических механизмов аффективных расстройств в настоящее время рассматривают нарушения структуры и функции дендритов (их укорочение, снижение числа шипиков и синаптических контактов), а также гибель нервных и глиальных клеток. Восстановление функций связано с реорганизацией и образованием новых синапсов, удлинением и разрастанием (sprouting) дендритов и аксонов и даже с нейрогенезом, т.е. с образованием новых нервных элементов из так называемых стволовых клеток [10, 11].
Эволюция представлений о патогенезе аффективных расстройств и механизмах действия антидепрессантов
Пресинаптические механизмы
Первые гипотезы относительно патогенеза депрессий подчеркивали значение нарушений синаптической передачи, опосредованной моноаминергическими нейротрансмиттерами, прежде всего серотонином и норадреналином (норэпинефрином), причем особое внимание уделялось пресинаптическим механизмам. Вначале предполагалось, что в основе депрессивных расстройств лежит общий дефицит синтеза (истощение) этих нейротрансмиттеров в некоторых (стволовых, лимбических) структурах головного мозга. Затем интерес исследователей переключился на механизмы регуляции содержания нейротрансмиттеров в синаптической щели (рис. 1).

Эти процессы включали: синтез нейротрансмиттеров из аминокислот-предшественников (прекурсором серотонина является триптофан, а норадреналина и дофамина – тирозин), их накопление в синаптических пузырьках (везикулах), выброс в синаптическую щель в связи с приходом нервного импульса, обратный захват пресинаптическим окончанием и разрушение ферментными системами (в частности, моноаминоксидазой типа А – МАО-А). Предполагалось, что антидепрессанты, подавляя (более или менее избирательно) обратный захват нейротрансмиттера или блокируя активность МАО-А, увеличивают интенсивность и длительность воздействия нейротрансмиттера на специфические рецепторы постсинаптической мембраны, тем самым повышая эффективность синаптической передачи.
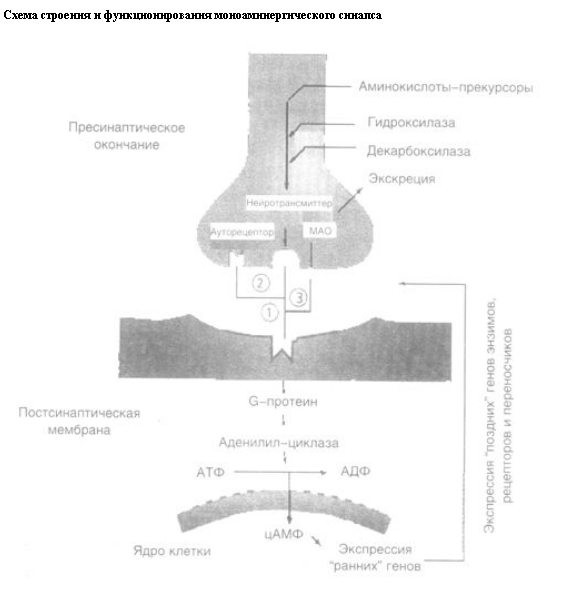
Представления, основанные на экспериментальной разработке и клиническом тестировании этой относительно простой модели, удовлетворительно объясняли терапевтический эффект первых антидепрессантов – ингибиторов МАО и трициклических соединений, а также послужили основой для разработки антидепрессантов последующих поколений – селективных ингибиторов обратного захвата серотонина и норадреналина(СИОЗС, СИОЗН, СИОЗСиН) и селективных обратимых ингибиторов МАО-А. Они также согласовывались с характером нарушений биоритмов у больных депрессией, в первую очередь с изменениями структуры ночного сна [12] в виде угнетения медленноволновой фазы при увеличении выраженности и уменьшении латентного периода наступления фазы сна с быстрыми движениями глаз (REM-сна), в норме связанных с активностью, соответственно, серотонинергических нейронов ядер шва (raphe) и норадренергических клеток голубого пятна (locus coeruleus) ствола мозга [13]. Моноаминовая гипотеза нашла и серьезное молекулярно-генетическое подтверждение – был обнаружен полиморфизм гена-промоутера белка-переносчика (транспортера) серотонина, причем у больных депрессией экспрессия этого гена оказалась сниженной.
Вместе с тем моноаминовая гипотеза не могла объяснить ряд клинических и фармакокинетических фактов. Известно, что концентрации антидепрессантов в крови достигают терапевтических значений уже в первые часы после начала приема. Сходную временную динамику (1,5–3 ч) имеют и изменения профиля фармако-ЭЭГ [19] после однократного приема средней дозы антидепрессанта. Повышение уровня моноаминергических нейротрансмиттеров также отмечается уже в первые 2 сут терапии. Однако тимолептическое действие антидепрессантов, как правило, проявляется с существенной (на 1,5–3 нед) задержкой относительно начала терапии. Тяжесть клинических проявлений депрессии коррелирует скорее не с фармакокинетическими показателями метаболизма серотонина и норадреналина, а с концентрацией кортизола в плазме крови и моче [20, 21]. Не укладывается в рамки этих представлений и антидепрессивный эффект тианептина (коаксила), который является не ингибитором, а, напротив, стимулятором [22] обратного захвата серотонина.
Постсинаптические (внутриклеточные) механизмы. Исследования, направленные на выяснение причин указанных противоречий, показали, что действие антидепрессантов не ограничивается их регуляторным влиянием на содержание моноаминергических нейротрансмиттеров в пресинаптических структурах, а также на число и чувствительность постсинаптических рецепторов, но распространяется и на внутриклеточные каскады процессов передачи сигнала. Эти каскады запускаются после связывания нейротрансмиттера со специфическими рецепторами постсинаптической мембраны и включают активацию вторичных мессенджеров: связанных с рецептором G-белков, аденилил-циклазы, циклоаденозин-монофосфата (цАМФ) и цАМФ-зависимой протеин-киназы С. Последняя проникает в ядро клетки и вызывает экспрессию промежуточных “ранних” генов, модулирующих экспрессию энзимов, рецепторных и других белков, вовлеченных в нейротрансмиссию как на постсинаптическом, так и на пресинаптическом уровнях. Одним из таких соединений является цАМФ-элементсвязывающий белок (CREB), который в свою очередь активирует ген, экспрессирующий мозговой нейротрофический фактор (BDNF), способствующий выживанию и восстановлению нейронов. Все эти процессы требуют мобилизации Са++ и ведут к повышению его концентрации внутри клетки.
В норме такая последовательность внутриклеточных событий приводит к генерации постсинаптическим нейроном нервного импульса, но при патологических условиях (при избытке основных возбуждающих нейротрансмиттеров – глутамата и NMDA, а также глюкокортикоидов, Са++ и генетически обусловленном нарушении активности Na/K-АТФазы) может вызвать лавинообразное увеличение внутриклеточной концентрации Са++, что ведет за собой повреждение и утрату отдельных отростков или гибель нервной клетки.
Нейрональная пластичность
Нейроморфологические данные, полученные на постмортальном материале мозга больных аффективными расстройствами (депрессией, биполярным расстройством, посттравматическим стрессовым расстройством) [23], убедительно свидетельствуют, что у них по сравнению с нормой уменьшены объем и толщина ростральной орбитофронтальной коры, префронтальной коры, коры переднего отдела поясной и парагиппокампальной извилин, а также объем базальных ганглиев и n.accumbens.
Кроме того, снижены размеры и плотность упаковки пирамидных, непирамидных и вставочных нейронов в ростральной орбитофронтальной, префронтальной и передней цингулярной коре, а также клеток зубчатой извилины и пирамидных нейронов поля СА3 гиппокампа. Уменьшены число, плотность и размеры глиальных клеток в каудальной орбитофронтальной, дорсолатеральной префронтальной и передней цингулярной коре, а также в миндалине.
Сходные морфологические изменения в лимбических структурах были получены и на экспериментальных моделях депрессии у животных. Под влиянием длительного стресса (в ситуациях вынужденного плавания или иммобилизации у грызунов – крыс, мышей, или социального стресса у низших приматов) или при хроническом повышении уровня кортикостероидов, что приводит к напоминающим депрессию нарушениям поведения, происходит уменьшение объема гиппокампа [24], снижение плотности дендритных шипиков и отмирание дистальных ветвей дендритов пирамидных нейронов поля СА3 [25], а также числа гранулярных клеток зубчатой извилины [24].

Благодаря развитию методов прижизненной структурной нейровизуализации головного мозга человека (КТ, МРТ) показано, что нейроморфологические находки не являются артефактами. Действительно, при аффективных расстройствах расширены боковые и 3-й желудочки мозга, уменьшен объем серого вещества в лобной, орбитофронтальной, медиальной префронтальной, височной и теменной зонах коры, вентральном стриатуме и гиппокампе [6, 26]. Наконец, по данным функциональной нейровизуализации (ПЭТ, фМРТ, SPECT), у больных депрессией снижены локальный мозговой кровоток и метаболизм глюкозы в лимбических структурах и префронтальной коре [23].
Таким образом, последствия хронического стресса и аффективные расстройства у человека, как и сходные с депрессией нарушения поведения у животных, ассоциируются с повреждением и гибелью мозговых клеток [6]. Эти данные согласуются с представлениями [27] о том, что тревожные расстройства, вызванные стрессогенными факторами, могут не только предшествовать, но и являться причиной по крайней мере некоторых форм депрессивных расстройств. Локализация морфологических нарушений прежде всего в лимбической системе, базальных ганглиях и ростральных отделах коры может объяснять как аффективные, так и моторные, и когнитивные расстройства при депрессии.
Основные причины повреждения и гибели клеток мозга. В качестве основной причины повреждения и гибели клеток мозга обычно называют избыток кортикостероидов (в частности, кортизола), характерный для состояний дистресса и депрессии. Кортикостероиды усиливают цитотоксическое действие возбуждающих аминокислот (глутамата, NMDA) и других агентов (Са++, b-амилоида, тау-протеинов). Роль гиперактивности гипоталамо-гипофизарно-адреналовой оси подтверждается тем, что адренэктомия предотвращает влияние стрессоров, а искусственное введение кортикостероидов (в отсутствие стресса) вызывает такие же изменения нервной ткани, как и стресс. Считается, что гиперактивность гипоталамо-гипофизарно-адреналовой системы при аффективных расстройствах связана с нарушением механизма обратной связи, по которому выделяющийся из надпочечников в кровяное русло кортизол тормозит продукцию гипоталамусом кортикотропин-рилизинг-фактора (КТРФ).
Одним из факторов, влияющих на цитотоксичность, является дефицит основного тормозного нейротрансмиттера ЦНС – гамма-аминомасляной кислоты (ГАМК) [8]. В этой связи можно отметить, что в гиппокампе – структуре, наиболее подверженной разрушительному действию стресса и депрессии, – по сравнению с другими отделами мозга относительно слабо развита система ГАМКергического возвратного торможения, но зато максимально представлена система возвратного возбуждения пирамидных нейронов [28]. Это предрасполагает к эпилептогенезу и повреждению нервных клеток гиппокампа цитотоксическими факторами.
Определенную роль играют и процессы перекисного окисления липидов [29] (при ишемии, гипогликемии, цереброваскулярной недостаточности), что особенно характерно для острых психотических состояний.
Отмеченные у больных депрессией морфологические изменения связаны с дефицитом нейропротективной системы, поскольку у значительной части пациентов значительно повышены концентрации КТРФ и кортикостероидов, а уровни экспрессии и активности CREB и BDNF без терапии снижены, но повышаются при хроническом приеме антидепрессантов.
Нейропротективные эффекты
Наиболее существенным открытием последних лет стало доказательство того, что эти деструктивные процессы, происходящие на клеточном уровне, являются частично обратимыми, причем нейропротективными свойствами обладают некоторые препараты, применяемые в качестве антидепрессантов или нормотимиков.
Так, на экспериментальных моделях стресса и депрессии на животных показано, что нейропротективный эффект оказывают: антидепрессант тианептин – стимулятор обратного захвата серотонина [8], мелатонин, являющийся мощным антиоксидантом, а также фенитоин [25] и ламотриджин – ингибиторы высвобождения глутамата. (Следует отметить, что не все тестированные антидепрессанты обнаруживают нейропротективную активность – для таких СИОЗС, как флуоксетин и флувоксамин, эффект не показан.) Предположительно, одним из механизмов действия тианептина (помимо активации системы CREB-BDNF) является ограничение модулирующего влияния серотонина на серотонинергические нейроны гипоталамуса, вырабатывающие КТРФ.
При профилактической терапии больных с биполярным расстройством восстановлению мозговых структур способствует литий – модулятор системы вторичных мессенджеров.
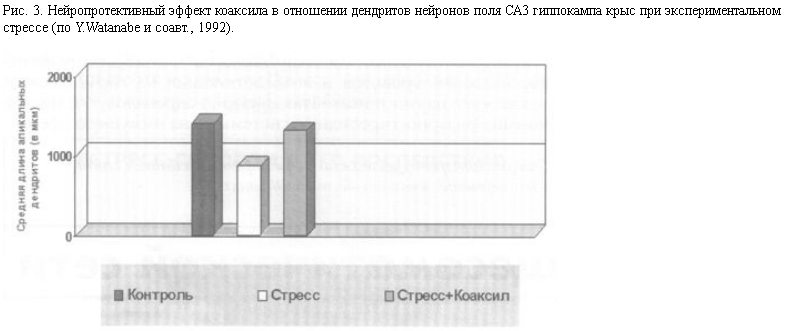
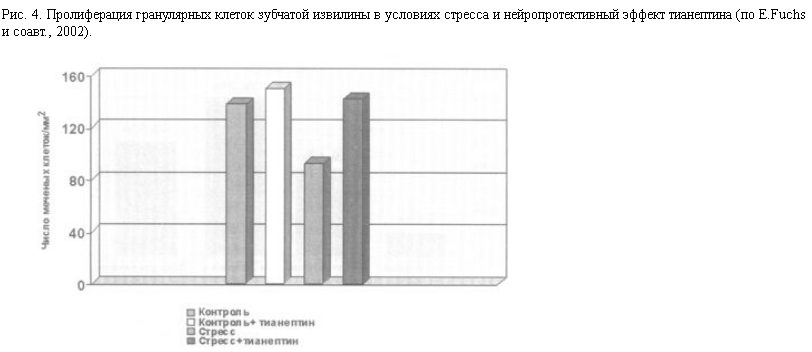
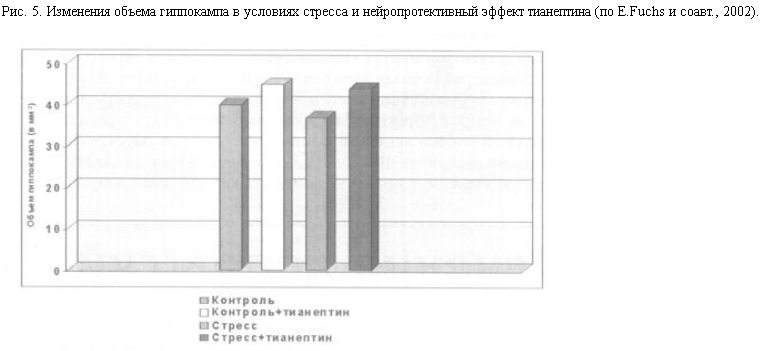
При пероральном (наиболее принятом в терапии депрессий) введении тианептина на фоне продолжающегося действия стрессорной ситуации в мозге животных происходит восстановление нарушенных нервных структур, что отражается в нормализации морфометрических показателей.
Нейропротективное влияние профилактической 4-недельной терапии нормотимиком (карбонатом лития) на сохранность серого вещества мозга больных с биполярным расстройством [30] иллюстрируется на рис. 6.
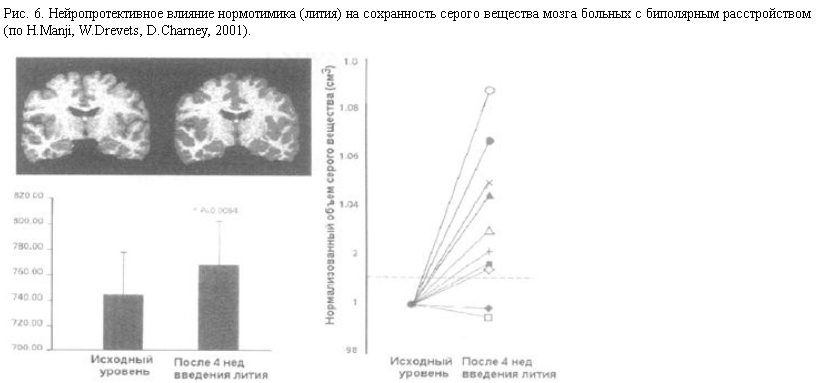
В левой части рисунка вверху приведены МРТ-томограммы мозга одного из больных, сделанные до и после 4-недельного курса терапии литием, а внизу – гистограммы, показывающие достоверное (р<0,01) увеличение абсолютного объема серого вещества (в среднем примерно на 3,5%) в группе обследованных больных (n=10). В правой части рисунка приведены индивидуальные данные для всех этих 10 пациентов, показывающие, что у 8 из 10 больных произошло достоверное увеличение относительных значений объема серого вещества (от 2 до 9%), наиболее выраженное в гиппокампе и стриатуме. В этом исследовании специальное внимание уделялось содержанию воды в мозговой ткани, так что прирост объема серого вещества связан не с набуханием мозга, а с восстановлением нервных структур. Таким образом, нейровизуализационные технологии показывают, что нейропластические процессы в связи с депрессией и антидепрессивной терапией действительно происходят в мозге взрослых пациентов с аффективными расстройствами, причем временные рамки этих процессов (3–4 нед) совпадают с динамикой терапевтического эффекта антидепрессантов.
Следует подчеркнуть, что представления о природе аффективных расстройств и действии антидепрессантов, основанные на открытии и изучении феномена нейропластичности, заставляют существенным образом пересмотреть остальные гипотезы о патофизиологических механизмах депрессий и их терапевтической динамике. Они подчеркивают значительную сложность взаимодействия серотонинергической системы с другими нейротрансмиттерными и нейрогуморальными системами мозга, а также указывают на ранее неизвестные (или не учитывавшиеся) “мишени” как моноаминергических нейротрансмиттеров, так и антидепрессантов. В связи с полиморфизмом депрессий можно полагать, что определенный вклад в их патогенез, по-видимому, вносят нарушения молекулярных механизмов, происходящие как на каждом из уровней синаптической трансмиссии: в пресинаптическом окончании, в синаптической щели, на постсинаптической мембране, в системе вторичных мессенджеров, при экспрессии “ранних” и “поздних” генов, так и участвующие в процессах нейропротекции и нейрогенеза.
Наличие явления нейропластичности, тесно связанного с нервными и гуморальными механизмами стресса, с цитотоксическим действием различных агентов, с цереброваскулярной недостаточностью, мозговой ишемией и гипогликемией, механизмами апоптоза и нейропротекции, необходимо учитывать при разработке стратегий комплексной терапии аффективных расстройств современными лекарственными средствами, включающими наряду с антидепрессантами препараты, оказывающие нейропротективное (антиоксиданты, нейротрофы) действие. Кроме того, в качестве направлений поиска новых перспективных антидепрессантов можно назвать использование существующих и разработку новых соединений, нормализующих обмен глутамата, Са++, мембранных протеинов, мозговой кровоток и воздействующих на гормональную (прежде всего на гипоталамо-гипофизарно-адреналовую и гипоталамо-гипофизарно-тиреоидную системы) и на иммунную сферы.


