Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2003
Эффективность терапии икселом расстройств адаптации у лиц с нарушенными социальными связями №06 2003
Введение
Расстройства адаптации (adjustment disorders) были введены в Международную классификацию психических расстройств в 1978 г. Тем не менее до настоящего времени данные нарушения продолжают считаться в числе наиболее спорных диагностических единиц (P.Casey и соавт., 2001). Сказанное затрагивает не только диагностические критерии, нуждающиеся, по мнению многих авторов, в дальнейшем уточнении, но и определение вариантов взаимоотношения указанной патологии с другими коморбидными психопатологическими феноменами (S.Snyder и соавт., 1990; J.Despland и соавт., 1995) и исходов (N.Andreasen, P.Hoenk, 1982). Исследования показали, что расстройства адаптации являются наиболее распространенными нарушениями среди внебольничных пациентов (от 5 до 20% всех амбулаторных пациентов с психическими расстройствами согласно J.Strain и соавт., 1998). Однако до настоящего времени вопросы их психофармакотерапии остаются недостаточно разработанными (Ю.А.Александровский, 2000; А.Ю.Шпикалов, 2002). R.TЪlle (1996 г.) рассматривает состояния психической дезадаптации в рамках реакций с преобладанием аффективных нарушений и подчеркивает необходимость назначения своевременного и адекватного лечения при состояниях данной группы в связи с тем, что пациенты с расстройствами адаптации традиционно считаются наиболее подверженными риску суицида среди всех больных невротическими расстройствами. Н.Д.Лакосина и М.М.Трунова (1994 г.) указывают на другой аспект проблемы терапии указанных нарушений, акцентируя внимание на тенденции реактивных состояний к затяжному течению с дальнейшей динамикой по типу невротического развития.
Традиционные подходы к фармакотерапии указанных состояний (P.Janicak и соавт., 2002) включают сочетанное назначение препаратов разных классов с учетом частого перекрывания нарушений тревожного и аффективного круга у данной группы пациентов. При этом использование традиционных антидепрессантов затруднено вследствие трудностей их применения для активной терапии во внебольничной практике (С.Н.Мосолов, 1995), а дополнительное назначение транквилизаторов углубляет проявления “поведенческой токсичности” антидепрессантов (А.Б.Смулевич и соавт., 1999).
В этом отношении представляет большой интерес возможность применения при указанных расстройствах нового антидепрессанта – милнаципрана (иксел/Ixel), являющегося представителем группы ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН). Препарат ингибирует обратный захват норадреналина и серотонина и при этом не обладает свойственным трициклическим антидепрессантам (ТЦА) холинолитическим действием (С.Н.Мосолов, 1995; А.Delini-Stula, 2002) и поведенческой токсичностью (П.В.Морозов, 2002). Исследования подтвердили сравнимую с ТЦА высокую эффективность милнаципрана при терапии широкого круга нарушений невротического и эндогенного уровней (А.С.Аведисова и соавт., 2000; S.Kasper и соавт., 1996). Рекомендуемая дозировка милнаципрана составляет 50–200 мг в сутки. Препарат характеризуется широтой действия, быстротой наступления терапевтического эффекта, хорошей переносимостью, возможностью использования у больных с различными соматическими нарушениями (S.Montgomery, 2001).
Цель исследования
Целью настоящего многоцентрового исследования явилась оценка эффективности и переносимости милнаципрана при лечении невротических нарушений, обусловленных расстройством адаптации.
Выборка сформирована из 90 госпитализированных и амбулаторных пациентов, проходивших лечение в 3 исследовательских центрах (табл. 1).

Обработку полученных данных проводили в отделе пограничной психиатрии (руководитель – проф. Ю.А.Александровский) Государственного научного центра социальной и судебной психиатрии им. В.П.Сербского.
Материал и методы исследования
В исследование включали пациентов в возрасте от 18 до 65 лет, состояние которых соответствовало критериям МКБ-10 для расстройств приспособительных реакций (F43.2).
Исключали пациентов с сопутствующими галлюцинаторно-бредовыми расстройствами, органическими заболеваниями ЦНС (включая эпилепсию и эписиндром), алкоголизмом или наркоманиями, любой клинически значимой соматической патологией.
В методы исследования помимо клинического входил набор шкал: шкала оценки степени депрессии Гамильтона (HDRS), шкала оценки тревоги Гамильтона (HARS), шкала Sheehan для субъективной оценки динамики состояния, шкала оценки жизненных событий Holmes и Rahe (1967 г.) и шкала оценки тяжести психосоциального стресса. У 12 пациентов проведено инструментальное обследование для определения влияния милнаципрана на психофизиологические и вегетативные показатели.
Началу активной терапии предшествовал период отмены сроком не менее 7 дней. Длительность лечения составляла 28 дней (4 нед активной терапии).
Милнаципран назначали в качестве средства монотерапии в дозировке от 50 до 200 мг в сутки в течение 4 нед. Оценку терапевтического эффекта и переносимости препарата проводили на всем протяжении лечения. Показатели оценочных шкал регистрировали в день начала лечения, на 7, 14 и 28-й день терапии.
Исследование предусматривало использование режима “гибкого” дозирования милнаципрана. Начальная суточная дозировка составляла 100 мг в сутки. На 2-й неделе при наличии удовлетворительного эффекта прежнюю дозу сохраняли, при недостаточности или отсутствии – увеличивали до 150–200 мг в сутки. При наличии нежелательных явлений допускали редукцию дозировки до 50 мг в сутки. В отдельных случаях с целью коррекции инсомнии допускали разовое назначение гипнотиков короткого времени действия в дозах, эквивалентных 10–20 мг диазепама.
Распределение больных по полу и диагностическим рубрикам МКБ-10 представлено в табл. 2.
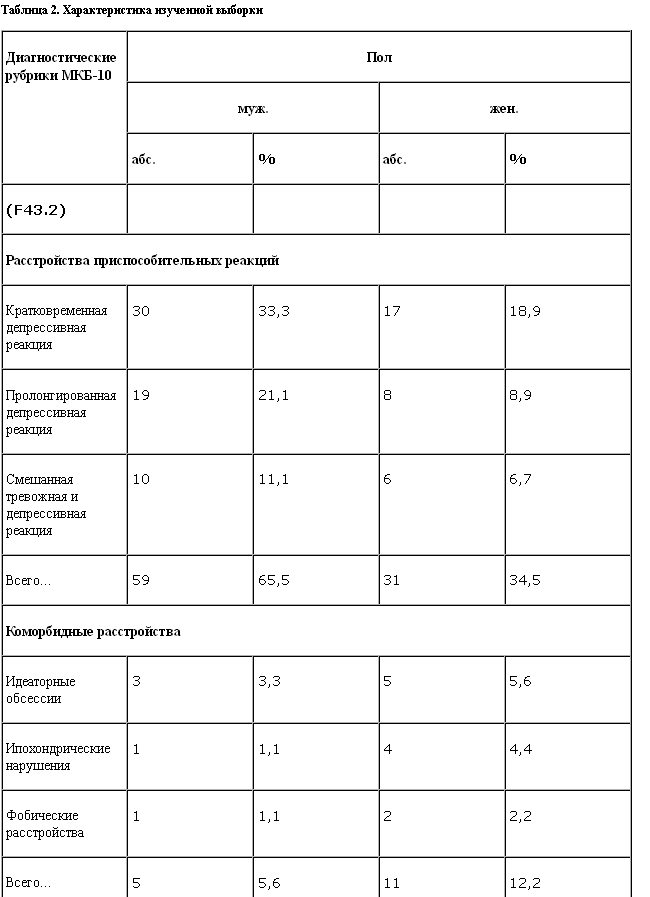
Материал исследования составили пациенты в возрасте от 19 до 63 лет (средний возраст 40,2 года). Средняя длительность заболевания составила 2 мес (от 2 нед до 8,5 мес).
Большинство пациентов (68 человек – 75,5%) не получали предшествовавшей терапии, 6 (6,7%) человек получали транквилизаторы, 16 (17,8%) – антидепрессанты в течение 0,5–2 мес без достижения выраженного эффекта.
Критерием эффективности для итоговой оценки результатов лечения служила 50% редукция суммарного балла шкалы HDRS.
Результаты исследования
Полный курс терапии завершили 88 (97,8%) пациентов. Один больной отказался от продолжения терапии в связи с отсутствием выраженного терапевтического эффекта, один пациент был исключен в связи с нежелательным явлением (нарушение мочеиспускания).
Значительный терапевтический эффект был достигнут у
69 (76,7%) пациентов. У 21 (23,3%) больного улучшение было незначительным или не было достигнуто.
Анализ динамики суммарных показателей шкал HDRS и HARS выявил их снижение на 88,9 и 59,6% (рис. 1).
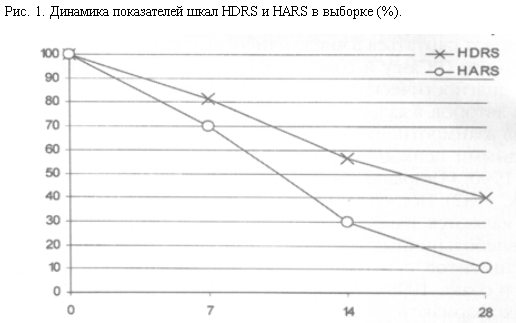
Представляет интерес тот факт, что редукция показателей шкалы HDRS была практически линейной на всем протяжении терапии. Динамика показателей шкалы HARS, напротив, характеризовалась быстрым снижением, с максимальной редукцией (57,21% снижение по сравнению с предыдущим значением) на отрезке 7–14 дней терапии.
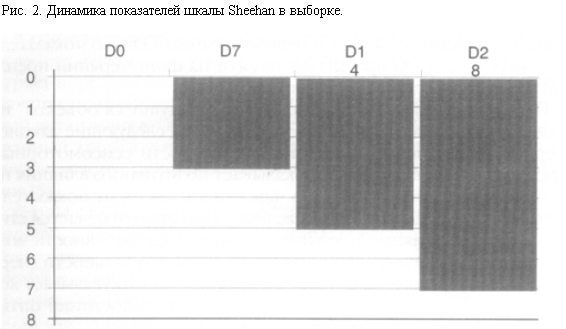
При терапии милнаципраном в изученной выборке зарегистрировано выраженное, субъективно отмечаемое улучшение состояния по шкале Sheehan (модальный показатель в 7 баллов – “значительное улучшение”), что свидетельствует о положительном субъективном восприятии действия препарата большинством пациентов (рис. 2).
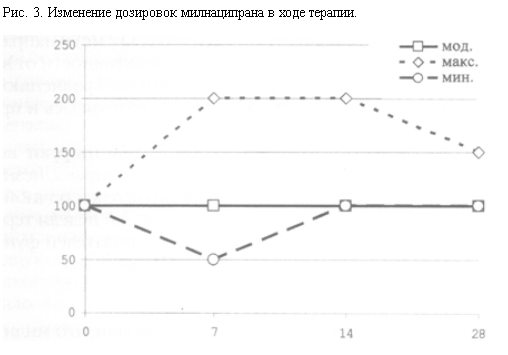
Сравнительный анализ групп респондеров и нонреспондеров показал, что максимальный ответ на терапию зарегистрирован у пациентов с преобладанием в клинической картине смешанных тревожных и депрессивных нарушений. Клиническая картина этих расстройств характеризовалась наличием снижения настроения до уровня субдепрессии с ощущением печали и уныния. Подавленность сопровождалась эмоциональной неустойчивостью, фиксацией на негативных сторонах жизни, переживанием собственных промахов и неудач в прошлом, сомнениями в собственной состоятельности. Наиболее характерными стрессовыми факторами, непосредственно предшествовавшими указанным нарушениям, являлись ситуации трудовых конфликтов, потеря работы (“конфликт-реакции” Brautigam, 1985 [цит. по R.TЪlle, 1996]). Связанные с этим переживания являлись основной фабулой тревожно-депрессивных проявлений, причем манифестация тревоги в большинстве случаев служила предиспонирующим фактором для появления фобических и ипохондрических нарушений (чаще в форме нозофобий по А.Б.Смулевичу, 2000). Назначение милнаципрана вызывало быструю редукцию тревожной симптоматики и приводило к плавному, но выраженному снижению интенсивности аффективных расстройств. Больные также отмечали появление выраженного стимулирующего эффекта препарата с исчезновением пассивности и проявлений “социальной абулии” (P.Janet, 1911).
В группе нонреспондеров, напротив, преобладали лица с пролонгированными, преимущественно депрессивными реакциями. Аффективные нарушения носили характер затяжной апатической субдепрессии с неотвязными депрессивными бессодержательными руминациями по типу “Gruebelsucht” (А.Б.Смулевич, 2000). Симптоматика тревожного регистра обнаруживалась в виде отдельных проявлений, являющихся вторичными по отношению к депрессивным переживаниям, и не имела самостоятельного клинического оформления. Указанные нарушения манифестировали на фоне психотравмирующей ситуации, характеризующейся длительной (более 3 мес) экспозицией (материальная и семейная неустроенность). Сниженная самооценка в основном проявлялась ощущением неспособности решить накопившиеся проблемы, собственного бессилия и несостоятельности. Данные переживания носили кататимный характер и имели тенденцию к затяжному течению с “амальгамированием” депрессивного денотативного комплекса с личностью больного, становясь своеобразным “стилем жизни” (А.Ю.Шпикалов, 2001). Подобные клинические особенности, по мнению большинства авторов (Н.Д.Лакосина, М.М.Трунова, 1993; А.Б.Смулевич, 2000; H.Binder, 1967; R.TЪlle, 1996), однозначно свидетельствуют в пользу тенденции к дальнейшей динамике состояния по типу невротического развития. Несмотря на определенные положительные сдвиги, к 24-му дню терапии состояние большинства пациентов не могло быть определено как “выраженное улучшение” в связи с персистированием аффективных расстройств. Субъективно отмечавшийся больными стимулирующий эффект препарата не вызывал обратного развития других составляющих депрессивного симптомокомплекса.
Нежелательные явления
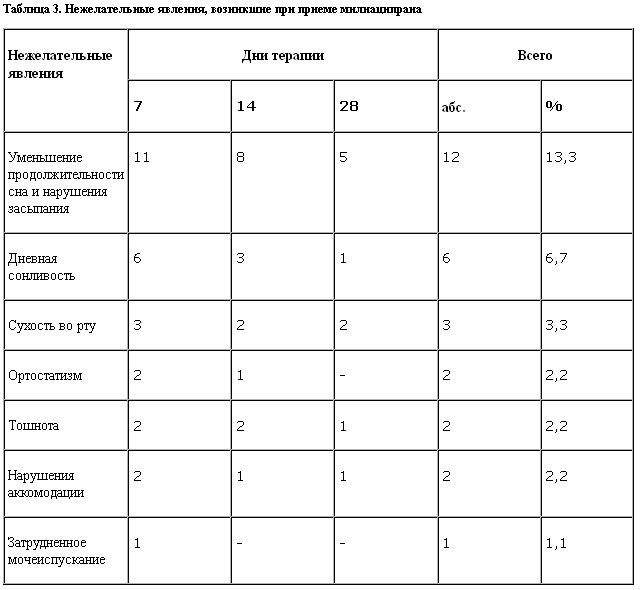
В ходе исследования регистрировались нежелательные реакции, причем можно утверждать, что частота их не превышала аналогичных показателей, приводимых другими авторами (S.Kasper, 1996), общее количество (n=28) незначительно, а большинство из них (нарушения сна, дневная сонливость в начале терапии, сухость во рту и тошнота) не являлись специфическими для милнаципрана (табл. 3).
Психофизиологические и нейровегетативные эффекты милнаципрана
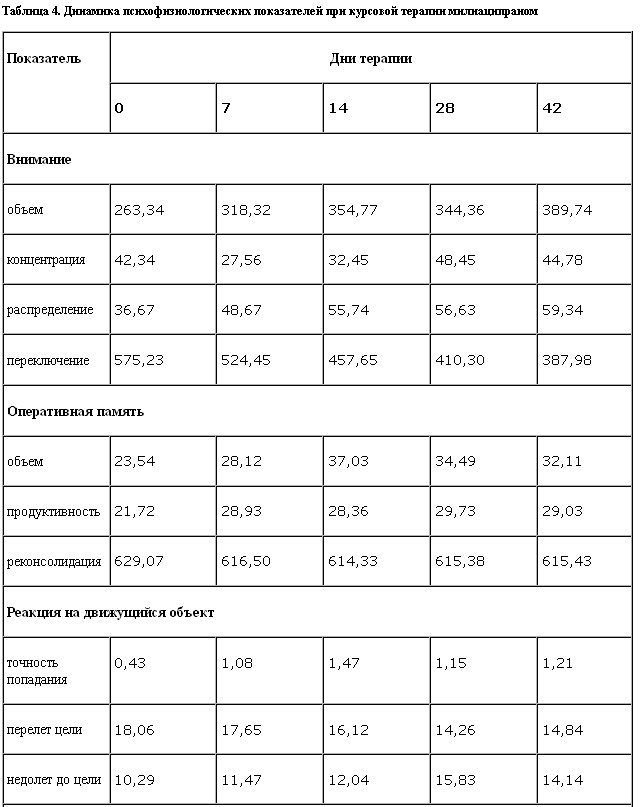
В рамках настоящего исследования была проведена дифференцированно-динамическая оценка влияния разовых однократных и курсовых доз милнаципрана на психофизиологические и нейровегетологические показатели у 12 пациентов. Регистрацию показателей проводили в 4 этапа (начальное обследование, исследование через 2 ч после приема разовой однократной дозы – 50 мг, на 7 и 21-й день курсовой терапии). Оценивали характеристики времени реакции, памяти и внимания, а также интегративные параметры вегетативной реактивности. Использовались автоматизированные системы диагностики “КПФК-99” и “ВНС-Спектр”. Результаты приведены в табл. 4.
Анализ результатов фонового обследования указывает на снижение показателей сенсомоторной активности (удлинение латентных периодов времени реакции), продуктивности памяти (большое число ошибочных ответов при выполнении тестовых заданий, оценивающих краткосрочную и оперативную память), нарушение переключения и распределения внимания (удлинение времени одного ответа и межинтервального ответа), что сопоставимо с данными других авторов об изменении психофизиологических показателей у больных с расстройствами тревожно-аффективного круга (J.Davidson, C.Turnbull, 1987).
Анализ полученных результатов динамической оценки влияния курсовой монотерапии милнаципраном указывает на позитивные сдвиги параметров объема, распределения и переключения внимания, которые носят однонаправленный характер. Следует отметить, что показатели концентрации внимания имеют тенденцию к интермиттированию. На фоне курсовой монотерапии отмечено улучшение показателей оперативной памяти при незначительном ухудшении продуктивности и относительно стабильном времени реконсолидации.
При выполнении “корректурной пробы” отмечено улучшение показателей объема внимания с 1-й недели терапии с оптимизацией к 3–4-й неделе. Показатели распределения характеризуются позитивной динамикой с 1-й недели. Показатели переключения внимания на фоне курсовой терапии улучшаются, начиная со 2-й недели терапии, о чем свидетельствует снижение времени одного ответа.
Отмечается увеличение доли правильно решенных арифметических действий, свидетельствующее об улучшении объема оперативной памяти, начиная со 2-й недели с оптимизацией к 3–4-й неделе терапии. На этом этапе исследования препарат оказывает нерезко выраженное негативное влияние на продуктивность оперативной памяти, что демонстрируется прогрессирующим увеличением количества ошибочно выполненных операций, с максимумом на 3-й неделе терапии. Однако показатель реконсолидации оперативной памяти на фоне терапии препаратом практически не изменяется.
При выполнении теста “Реакция на движущиеся объекты” на фоне курсовой монотерапии установлены следующие закономерности изменений баланса и подвижности сенсомоторных процессов: милнаципран не оказывает позитивного влияния на точность выполнения теста, о чем свидетельствуют показатели точности попадания в заданные цели. При этом отмечается стимулирующее влияние препарата с ростом интенсивности возбуждения в нейронах и снижением баланса и лабильности энергетических процессов в нервных клетках, на что указывает количество “недолетов” до цели. Этот показатель достигает оптимальных значений с 3-й недели терапии.
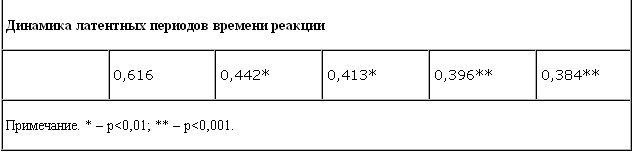
На фоне приема разовой дозы милнаципрана выявлено существенное изменение показателей латентных периодов времени реакции в сторону их сокращения (с 0,616 до 0,542 мс) и направленности вектора активности вегетативной реактивности от ваготонии в сторону симпатической активации по сравнению с начальным уровнем. Выявленная тенденция сохранялась и при курсовой терапии.
Результаты проведенного обследования демонстрируют выраженное вегетоактивирующее действие милнаципрана, незначительную инициальную супрессию функций краткосрочной и оперативной памяти, нормализующуюся после 2-й недели терапии, и сохранность психофизиологических показателей функции внимания на фоне приема разовых и курсовых доз.
Выводы
Результаты проведенного исследования показали, что милнаципран, назначаемый в дозировке 100 мг в сутки, обладает тимолептическим, анксиолитическим и мягким стимулирующим эффектами, представляя таким образом типичный антидепрессивный препарат сбалансированного действия, позволяющий достичь гармоничного купирования нарушений невротического круга в структуре расстройств адаптации.
Терапия милнаципраном в большинстве случаев позволяет достичь быстрого (в течение 14–28 дней активной терапии) обратного развития аффективных и тревожных расстройств. Хорошая переносимость препарата и отсутствие выраженных побочных явлений, включая проявления поведенческой токсичности, позволяют широко использовать его не только в условиях специализированного стационара, но и в амбулаторной практике (в том числе общемедицинской).


