Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№08 2003
Эссенциальные фосфолипиды в терапии неалкогольных стеатогепатитов №08 2003
Неалкогольную жировую печень в качестве самостоятельной нозологической единицы впервые описал J.Ludwig в 1980 г., обнаружив в печени не злоупотреблявших алкоголем пациентов изменения, сходные с таковыми при алкогольном гепатите. Жировая инфильтрация печеночных клеток лежит в основе самостоятельного заболевания или синдрома, называемого стеатоз печени (синонимы: жировой гепатоз, жировая дистрофия печени, жировая печень). Данный диагноз правомочен в том случае, если более 5–10% массы печени составляет жир, причем преимущественно в виде триглицеридов (ТГ) [2, 3]. При сочетании стеатоза с воспалительным процессом в печени говорят о наличии стеатогепатита (СГ). В первых сообщениях о СГ указывалось, что до 80–85% случаев составляют алкогольные, и лишь 15-20% – неалкогольные стеатогепатиты (НАСГ). В последние годы доля НАСГ увеличилась до 30–40%, что, вероятно, связано с улучшением качества обследования пациентов, широкого внедрения в клиническую практику ультразвукового метода исследования (УЗИ) органов брюшной полости и морфологического исследования биоптата печени.
НАСГ, представляющий собой всего лишь одну из стадий НАЖБП, в настоящее время является самостоятельной нозологической единицей.
Признанными факторами риска развития данной патологии являются ожирение, сахарный диабет типа 2, голодание, парентеральное питание, наличие илеоцекального анастомоза, избыточный бактериальный рост в кишечнике и др. [2, 3].
В связи с этим большинство исследователей сходятся во мнении, что НАСГ является печеночной составляющей метаболического синдрома (МС). В основе МС лежит инсулинорезистентность (ИР), которая провоцирует развитие ряда патологических состояний, таких как абдоминально-висцеральное ожирение, дислипидемия, артериальная гипертензия, сахарный диабет типа 2, атеросклероз, ишемическая болезнь сердца и др. Снижение чувствительности к инсулину наиболее ощутимо в жировой, печеночной, мышечных тканях, надпочечниках. ИР жировой ткани проявляется резистентностью к антилиполитическому действию инсулина, что приводит к накоплению свободных жирных кислот и глицерина, которые выделяются в портальный кровоток, поступают в печень и становятся источником формирования атерогенных липопротеинов очень низкой плотности (ЛПОНП). Кроме этого, ИР гепатоцитов снижает синтез гликогена и активирует гликогенолиз и глюконеогенез [4].
Выделяют первичный и вторичный НАСГ. Первичный подразумевает нарушения липидного и углеводного обмена в качестве основного этиологического фактора, в то время как развитие вторичного НАСГ связывают с приемом лекарственных препаратов, синдромом малабсорбции, болезнями накопления и др.
Патогенетические механизмы развития заболевания изучены еще недостаточно. Накопление жира в гепатоцитах и звездчатых клетках обусловлено увеличением поступления свободных жирных кислот (СЖК) в печень за счет высокого их содержания в пище, высвобождения их при липолизе жировой ткани, преобразования в жирные кислоты избыточного количества углеводов, поступающих в печень. В митохондриях снижается скорость b-окисления СЖК и одновременно увеличивается их синтез. Нарушается выведение ТГ из гепатоцитов, так как снижается синтез и/или секреция ЛПОНП [5]. Накопление жира в гепатоцитах в виде капель приводит к оттеснению и сдавлению органелл клетки, повреждениям, растяжению и разрывам мембран печеночных клеток.
Следующая стадия заболевания – формирование СГ. Этот процесс сопровождается воспалительно-некротическими изменениями в печени. В основе их развития лежат универсальные механизмы, не зависящие от этиологии стеатоза. В настоящее время ведущим фактором развития НАСГ, как составляющей МС, признается ИР, гиперинсулинемия, нарушения жирового и углеводного обменов. Известно, что при НАСГ происходит усиление перекисного окисления липидов (ПОЛ) вследствие индукции цитохрома Р-450 2Е1 в печени с увеличением потребления кислорода гепатоцитами и образованием активных форм кислорода в виде свободных радикалов. Активация ПОЛ и образование большого количества свободных радикалов приводит к набуханию митохондрий, ломкости лизосом, нарушению целостности клеточных мембран, нарушению работы мембранозависимых транспортных систем гепатоцита и, как следствие, накоплению токсических промежуточных продуктов, стимулирующих коллагенообразование. В результате несоответствия синтеза и секреции ТГ, стимулирующих воспалительные реакции, развивается фиброз. Таким образом, основным механизмом развития НАСГ признается накопление в печени СЖК в результате активации реакции ПОЛ [6].
Клиническая симптоматика НАСГ скудна и неспецифична. Заболевание может длительно протекать бессимптомно и патологические знаки со стороны печени (увеличение и уплотнение органа, изменения биохимических показателей) часто обнаруживаются случайно при обследовании по поводу другой патологии (сахарный диабет, артериальная гипертензия, эндокринные нарушения). Жалобы у большинства больных могут отсутствовать. Однако у части пациентов имеют место астенический (повышенная утомляемость, слабость), диспепсический (метеоризм, тошнота, нарушения стула, тяжесть в правом подреберье), болевой (тупые боли в правом подреберье) синдромы. По данным литературы, подобные симптомы имели место у 30% обследованных с данной патологией (O.James, 2000).
При физикальном обследовании у части пациентов пальпируется в различной степени увеличенная печень. Размеры и плотность печени отражают степень стеатоза и определяют характер прогрессирования. Размеры селезенки на стадии СГ обычно не изменены. При эхографическом обследовании выявляются жировая инфильтрация печени, в семиотику которой входят компактное расположение эхосигналов, повышение эхогенности ткани печени, обеднение сосудистого рисунка (белая печень).
Биохимическая картина заболевания характеризуется умеренно выраженным цитолитическим синдромом – повышением активности аланиновой (АЛТ) и аспарагиновой (АСТ) трансаминаз в достаточно широком диапазоне, у части пациентов отмечается повышение активности маркеров холестаза – щелочной фосфатазы (ЩФ), гаммаглутамилтранспептидазы (ГГТП), обычно не превышающих 2–3 норм. Более высокая активность этих ферментов, означающих наличие внутрипеченочного холестаза, при этой патологии встречается редко, и в таком случае необходимо исключать другой или смешанный генез поражения печени (алкогольный, лекарственный и др.). Уровень билирубина у больных НАСГ обычно в пределах нормальных значений, белково-синтетическая функция печени сохранена (содержание альбумина и протромбина, как правило, в пределах нормы и снижается только при развитии цирроза печени и печеночной недостаточности). В целом изменения биохимических параметров не коррелируют со степенью стеатоза и фиброза в печени, неспецифичны и отражают лишь факт повреждения печени.
В связи с неспецифичностью клинико-биохимической картины заболевания диагностика НАСГ должна базироваться на данных морфологического исследования гепатобиоптата.
В ткани печени этих больных выявляются:
• жировая дистрофия печени (крупнокапельная, мелкокапельная, смешанная);
• центролобулярная (реже – портальная и перипортальная) воспалительная инфильтрация нейтрофилами, лимфоцитами, гистиоцитами;
• фиброз (перигепатоцеллюлярный, перисинусоидальный и перивенулярный) различной степени выраженности [4].
Необходимо исключить и другие заболевания печени: вирусные инфекции, гепатоцеребральную дистрофию, идиопатический (наследственный) гемохроматоз, аутоиммунный гепатит, недостаточность a1-антитрипсина.
В целом НАСГ протекает доброкачественно и часто бессимптомно, однако, по данным динамического морфологического исследования ткани печени, примерно у половины пациентов со временем наблюдается усиление фиброза. Это свидетельствует о прогрессирующем течении заболевания, при этом данные о тяжести течения и скорости прогрессирования его в различных исследованиях значительно варьируют [7, 8]. По данным литературы, формирование цирроза печени наблюдается у 7–16% взрослых пациентов [2]. Обследование больших групп больных с криптогенным циррозом печени показало, что во многих случаях (до 60–80%) цирроз печени «неясной этиологии» развивается на фоне нераспознанного НАСГ. К неблагоприятным в плане прогрессирования НАСГ факторам относят: пожилой возраст, избыточную массу тела, сахарный диабет, соотношение активности АСТ/АЛТ>1.
В лечении НАСГ важное место отводится терапии МС и в первую очередь диете с постепенным снижением массы тела [9], а также адекватным физическим нагрузкам. Лекарственные препараты для лечения МС не должны приводить к усугублению дислипидемии. В связи с этим большие надежды возлагаются на применение бигуанида метформина и сенситайзеров инсулина II поколения (пиоглитазон). С большой осторожностью необходимо подходить к выбору гиполипидемического препарата при лечении МС, так как имеющиеся в арсенале врачей лекарственные средства (статины, фибраты) потенциально могут провоцировать развитие лекарственного гепатита у больного с НАСГ.
Грамотный подбор лекарственного препарата подразумевает воздействие его на звенья патогенеза заболевания. Целями лекарственной терапии при НАСГ являются снижение накопления СЖК в печени, восстановление повреждений в мембране гепатоцитов, защита органелл клетки, уменьшение «оксидантного» стресса, уменьшение фиброза. Это значит, что лекарственные препараты, применяющиеся для лечения НАСГ, должны отвечать определенным требованиям, а именно – обладать прямым цитопротективным действием, нормализовать структуру и функцию мембран печеночных клеток и внутриклеточных органелл, способствовать нормализации липидного обмена. Этим требованиям отвечают гепатопротекторы, содержащие в качестве основного действующего вещества эссенциальные фосфолипиды (ЭФ).
Фосфолипиды (ФЛ) необходимы для роста, развития и нормального функционирования всех соматических клеток, поэтому их называют «эссенциальными». Они являются главными компонентами клеточных мембран и мембран органелл клеток человека: мембраны клеток на 65% состоят из ФЛ, которые в свою очередь представлены несколькими функциональными классами этих веществ. Большинство ФЛ содержит в своей основе фосфорные эфиры глицерина: фосфатидилхолин (лецитин), фосфатидилсерин, фосфатидилэтаноламин (кефалин), фосфатидилинозит, кардиолипин, лизофосфатидилхолин (лизолецитин). Аминосодержащие ФЛ – фосфатидилэтаноламин и фосфатидилсерин также составляют значительную долю (32–43%) всех ФЛ мембран клеток.
В работах по изучению молекулярной топографии ФЛ в мембранах показано, что холинсодержащие ФЛ локализуются на наружной, «выпуклой» стороне мембраны, а аминосодержащие ФЛ – на внутренней части бислоя. Это расположение способствует образованию и поддержанию изгибов, формирует градиент гибкости мембраны. ФЛ составляют основной «каркас» биологических мембран, поэтому от того, какие ФЛ входят в мембраны и как они расположены друг относительно друга, зависят во многом свойства мембран. Степень подвижности жирно-кислотных цепей ФЛ определяет термин «жидкостность» ФЛ. Эти физические параметры играют весьма существенную роль, так как они составляют молекулярную основу функционирования мембран и липопротеинов, поэтому оказывают влияние на механизмы возникновения или развития ряда патологических состояний. Со снижением жидкостности (т.е. увеличение микровязкости) мембран возникают препятствия для протекания некоторых стадий ферментативных реакций – затрудняется диффузия субстратов и продуктов в более вязкой фазе, тормозится движение веществ как вдоль поверхности мембраны («латеральная» диффузия), так и между наружным и внутренним слоями мембраны (так называемая диффузия «флип-флоп»). Фосфолипидный состав мембраны определяет ее функциональную активность.
Хорошо известны основные механизмы действия ЭФ:
• мембранопротективный: нормализация текучести клеточных мембран и репарация гепатоцитов за счет восстановления фосфолипидного бислоя путем встраивания молекул ФЛ в поврежденные клеточные мембраны гепатоцитов; защита клеточных органелл (митохондрий, микросомальных ферментов) от повреждения приводит к усилению детоксицирующей функции гепатоцитов;
• антиоксидантный: уменьшение окислительного стресса за счет предотвращения окисления жира в печени;
• антифибротический: ЭФ препятствуют развитию фиброза, а также способствуют его регрессии путем подавления активности коллагеназы и трансформации звездчатых клеток в коллагенпродуцирующие;
• противовоспалительный: уменьшение синтеза провоспалительных цитокинов (TNFa, Il–1b). При наличии клинико-биохимических признаков повреждения гепатоцитов (увеличение и уплотнение печени, цитолитический синдром) больным с НАСГ назначают лекарственную терапию. Размеры и консистенция паренхимы печени коррелируют со степенью стеатоза, а цитолиз – с повышением активности трансаминаз (АЛТ, АСТ), что является отражением повреждений клетки и, прежде всего, мембран, нарушения их проницаемости и целостности, сопровождающихся выходом ферментов в кровяное русло. Степень повышения активности трансаминаз коррелирует со степенью повреждения мембран гепатоцитов. Поскольку главная функция ФЛ – формирование двойного липидного слоя в мембранах клеток, путем введения ФЛ извне можно воздействовать на нарушенную функцию мембраны при повреждении гепатоцита и способствовать ее восстановлению. Молекулы ФЛ встраиваются в места непосредственного повреждения мембраны гепатоцита, замещая имеющиеся дефекты и защищая органеллы клетки. Ненасыщенные жирные кислоты ФЛ повышают текучесть клеточных мембран, улучшают их эластичность и нормализуют проницаемость, уменьшают перекисное окисление липидов. ЭФ, являющиеся основными элементами в структуре оболочки и органелл гепатоцитов, оказывают регулирующее действие на проницаемость биомембран, нормализуют функционирование липидзависимых ферментных транспортных систем печеночных клеток, обеспечивают нормальные процессы окислительного фосфорилирования, регулируют метаболизм липидов и белков. Таким образом, воздействуя на основные звенья патогенеза НАСГ, ЭФ способствуют нормализации важнейших функций гепатоцита и печени в целом.
По данным исследователей, имеются доказательства высокой эффективности препарата при применении его в качестве гепатопротективного, гиполипидемического, гипохолестеринемического лекарственного средства [10, 11]. В работах отмечено, что препарат хорошо переносится, побочных эффектов при его применении не отмечено. Он может применяться и в сочетании с другими гепатопротекторными препаратами, что актуально у пациентов с МС и наличием сопутствующих заболеваний.
Показаниями к применению являются НАЖБП печени на всех стадиях, алкогольная болезнь печени, токсические и лекарственные поражения печени. Критерии назначения: наличие жировой инфильтрации печени и/или цитолитического синдрома. Препарат назначают в дозе 2 капсулы 2–3 раза в день в течение 3 мес, повторные курсы приема препарата при сохранении биохимической активности заболевания возможны через 2–3 мес.
В ЦНИИ гастроэнтерологии проведено изучение эффективности и безопасности применения препарата Эссливер Форте в терапии НАЖБП.
Материалы и методы
В исследование были включены 30 больных в возрасте 20–65 лет, находящихся на стационарном или амбулаторном лечении, которым на основании комплексного обследования установлен диагноз стеатоза печени или НАСГ. Не включали пациентов, принимающих гепатотоксичные препараты, имеющих маркеры вирусных гепатитов в сыворотке крови, больных циррозом печени.
При клиническом обследовании оценивали наличие у пациента астенического (общая слабость, утомляемость), диспепсического (тошнота, снижение аппетита, метеоризм, тяжесть в правом подреберье) и болевого (боли в правом подреберье) синдромов по 3-балльной шкале, где 0 баллов – отсутствие симптома, 1 балл – симптом слабо выражен, 2 балла – симптом умеренно выражен, 3 балла – выраженная интенсивность симптома.
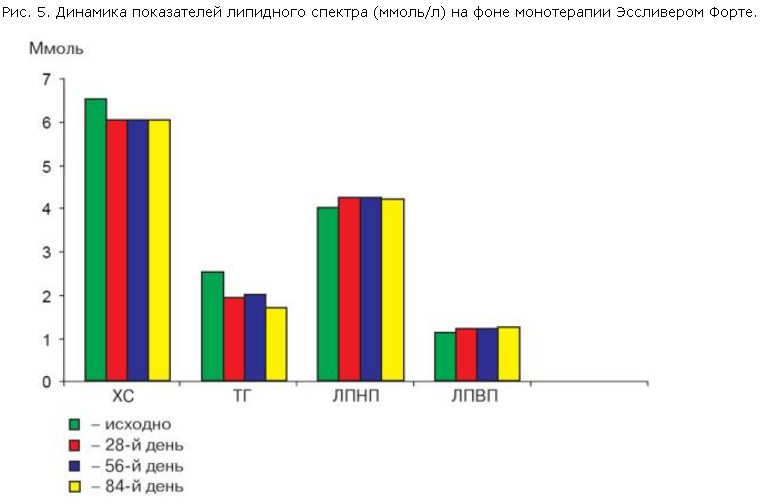
В процессе изучения осуществляли мониторинг следующих биохимических показателей: активности трансаминаз (АЛТ, АСТ), маркеров холестаза (ЩФ, ГГТП), билирубина, общего белка, альбумина, протромбина, показателей липидного спектра: ХС, ТГ, ЛПНП и ЛПВП. Биохимические исследования проводили с помощью коммерческих наборов реактивов фирмы "Randox" (Англия) и на биохимическом анализаторе Olympus 400 (Япония). Инструментальные методы исследования включали УЗИ органов брюшной полости.
Больным проводили монотерапию Эссливером Форте в дозе 2 капсулы 3 раза в сутки течение 3 мес. Мониторинг клинико-биохимических показателей проводился на 28, 56, 84-й дни терапии.
Результаты
В группу из 30 пациентов вошли 17 (56,7%) мужчин и 13 (43,3%) женщин, средний возраст составил 44,9±2 года. У всех больных имелась избыточная масса тела (92,5±8,4 кг). В результате комплексного обследования, включающего сбор анамнеза, анализ жалоб, данных физикального и лабораторно-инструментальных методов обследования, НАСГ диагностирован у 23 (76,7%) пациентов, неалкогольный стеатоз печени – у 7 (23,3%).
У всех пациентов при УЗИ выявлялись умеренная гепатомегалия, компактное расположение эхосигналов, обеднение сосудистого рисунка.
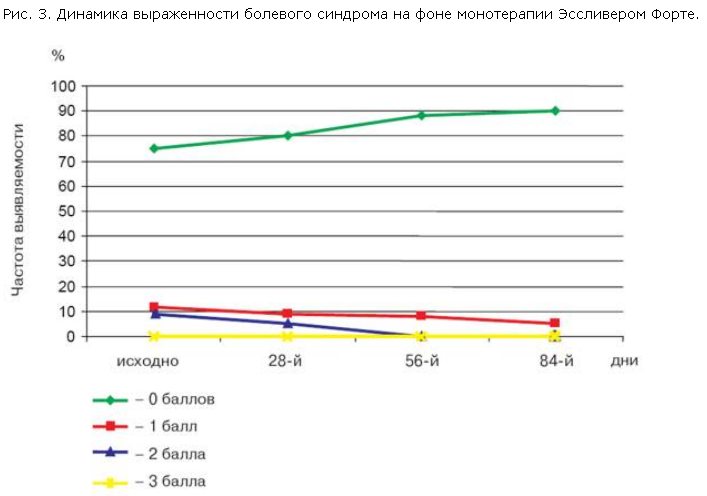
Наличие диспепсического синдрома было выявлено у 26 (86,6%) пациентов, несколько реже определяли астенический синдром – у 22 (73,3%) пациентов. Ноющего характера умеренной интенсивности боли в правом подреберье отмечали 7 (23,3%) больных.
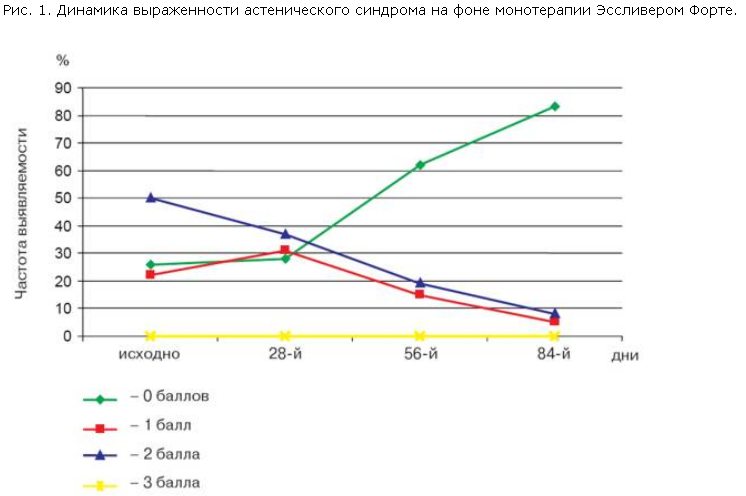
Кроме этого, нами отмечена положительная динамика в отношении диспепсического синдрома у пролеченных больных (рис. 2).
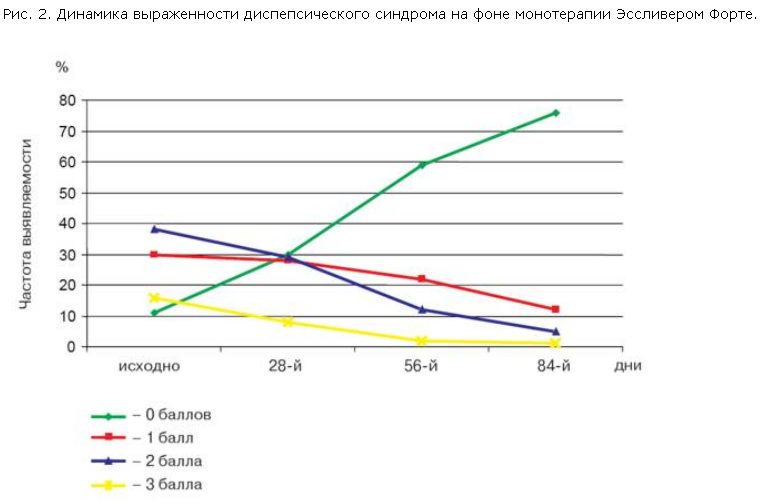
Исходно выраженную диспепсию отмечали 5 (16,7%) больных, умеренную – 12 (40%), слабую – 9 (30%). В процессе лечения выраженность симптомов постепенно снижалась, и к окончанию терапии лишь у 1 (3,3%) пациента сохранялась выраженная диспепсия (3 балла). Диспепсический синдром отсутствовал полностью к окончанию лечения у 23 (76,7%) пациентов.
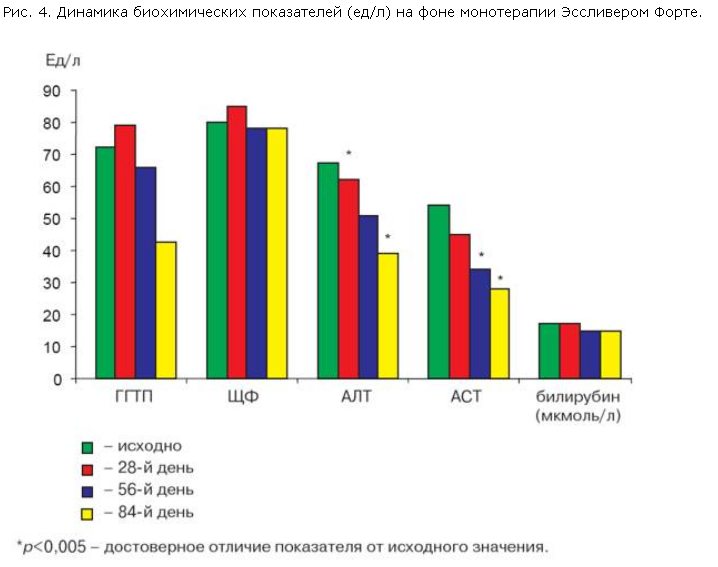
При биохимическом анализе отмечено, что показатели активности трансаминаз до лечения находились в пределах 1,5–2 норм (норма 5–32 ед/л), среднее значение АЛТ составило 66,9±8,6 ед/л. Уже к 28-му дню терапии активность АЛТ достоверно (p<0,005) снизилась по сравнению с исходным уровнем, данная положительная динамика сохранялась и к окончанию терапии, на 84-й день (рис. 4). Среднее значение АСТ до лечения составило 54,2±6,1 ед/л, к 56- и 84-му дням лечения активность этого фермента достоверно (p<0,005) снизилась по сравнению с исходными значениями. Таким образом, за 84 дня монотерапии Эссливером Форте произошла регрессия цитолитического синдрома, проявившаяся нормализацией активности трансаминаз. Активность ЩФ и ГГТП также значительно снизилась к окончанию лечения (p>0,005). Концентрация билирубина у всех больных оставалась в пределах нормы исходно и в течение всего периода наблюдения.
Оцениваемые с помощью УЗИ характеристики печени (размер, эхоструктура, эхогенность, видимость сосудистых структур) не изменялись в процессе терапии.
На протяжении проведения монотерапии Эссливером Форте не отмечено побочных действий препарата ни в одном случае. Отмечена высокая приверженность пациентов к терапии: больных, отказавшихся или прекративших лечение в связи с плохой переносимостью препарата, не было.
Заключение
На основании полученных данных можно сделать вывод о следующих эффектах Эссливер Форте терапии НАСГ:
• регрессирование астенического и диспепсического синдромов у подавляющего большинства пациентов;
• достоверное снижение выраженности цитолитического синдрома;
• наличие тенденции к снижению триглицеридемии;
• отсутствие побочных действий препарата на протяжении всего курса лечения, что говорит об эффективности и безопастности Эссливера Форте в лечении НАЖБП.
Препарат снижает клинико-биохимическую активность заболевания, улучшает качество жизни пациентов, характеризуется хорошей переносимостью, безопасностью в применении и может быть рекомендован для лечения НАЖБП. Эссливер Форте может применяться также в составе комплексного лечения НАСГ (в сочетании с другими гепатопротекторами, например с урсодеоксихолевой кислотой при наличии холестаза).
Таким образом, в арсенале гастроэнтерологов и гепатологов имеется комплексный препарат, позволяющий эффективно лечить метаболические заболевания печени, способствуя уменьшению воспалительного процесса, замедлению развития фиброза и формирования цирроза печени, улучшению прогноза заболевания.
Список исп. литературыСкрыть список1. Хазанов А.И. Клинические лекции по гастроэнтерологии и гепатологии. Т3. Болезни печени и билиарной системы. М.: Государственный институт усовершенствования врачей МО РФ, Главный военный клинический госпиталь им. Н.Н.Бурденко, 2002.
2. Радченко В.Г., Шабров А.В., Зиновьева В.Н. Основы клинической гепатологии. Заболевания печени и билиарной системы. СПб.: Диалект; М.: «БИНОМ», 2005.
3. Шерлок Ш., Дули Дж. Болезни печени и билиарной системы. Пер. с англ. М.: ГЭОТАР – Медицина, 1999.
4. Ивашкин В.Т., Шульпекова Ю.О. Неалкогольный стеатогепатит. Бол. орган. пищевар. 2002; 2: 41–5.
5. Alonso R, Uribe C, Astudillo J et al. Relation of weight loss to changes in some cardiovascular risk factors in overweight healthy men. Aterosclerosis 1997; 34: 318–9.
6. Haffner SM. Obesity and the metabolic syndrome: the San Antonio Heart Study. S.M.Haffner. Br J Nutr 2000; 83 (Suppl. 1): 67–70.
7. Bacon BR, Farahvash MJ, Janney CG et al. Nonalcocholic steatogepatitis: an expanded clinical entity. Gastroenterology 1994; 107: 1103.
8. Powell EE, Cooksley WGE, Hanson R et al. The natural history of nonalcocholic steatogepatitis: a follow-up study of forty-two patients for up to 21 years. Hepatology 1990; 11: 74.
9. Бурневич Э.З., Щаницына С.Е. Современные подходы к лечению неалкогольной жировой болезни печени. Гепатологический форум. М., 2006; 15–20.
10. Драпкина О.М. Неалкогольный стеатогепатит. Рациональная гепатопротекция. Мед. вестн. 2006; 42: 1–4.
11. Самсонов А.А. Эссенциальные фосфолипиды – «золотой стандарт» в терапии алкогольного и неалкогольного стеатогепатита. Мед. вестн. 2007; 10: 1–4.


