Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2009
Купирующая терапия шубообразной шизофрении: эффективность современных антипсихотических средств и дифференциация их назначения №01 2009
Номера страниц в выпуске:49-54
Современные стандарты лечения шизофрении основываются на позиции предпочтительности выбора терапии с оптимальным соотношением эффективности и переносимости. Высказывается мнение, что показатель польза/риск наиболее оптимален у атипичных нейролептиков нового поколения, поэтому многие авторы указывают на предпочтительность их использования при лечении шизофрении .
Введение
Современные стандарты лечения шизофрении основываются на позиции предпочтительности выбора терапии с оптимальным соотношением эффективности и переносимости. Высказывается мнение, что показатель польза/риск наиболее оптимален у атипичных нейролептиков нового поколения, поэтому многие авторы указывают на предпочтительность их использования при лечении шизофрении [5, 10, 13, 20, 21]. Считается, что применение атипичных нейролептиков наиболее рационально при манифестации заболевания из-за редкого развития неврологических расстройств и затормаживающего действия. Такие особенности повышают эффективность терапии благодаря более правильному соблюдению ее режима, способствуют улучшению качества жизни и уменьшают риск стигматизации. При прогрессировании болезни и снижении эффективности лечения предлагается использовать средства традиционного ряда [20–25]. Предполагается, что такая «смена» терапии может способствовать улучшению состояния, но только в случае более высокой индивидуальной чувствительности некоторых больных к препаратам этой группы. При неэффективности типичных нейролептиков рекомендуется использовать клозапин, который более эффективен, чем другие антипсихотические средства, при лечении длительно текущей шизофрении. Его широкое применение на ранних стадиях заболевания ограничивается риском развития агранулоцитоза [21, 24, 29]. У некоторых больных представленная «смена» терапии проводится в «сжатые» сроки. Это возможно при изначально низкой эффективности лечения, например при злокачественных формах болезни, или у ранее «не леченных» пациентов с длительным течением заболевания.
Несмотря на всю привлекательность идеи «высокая эффективность и хорошая переносимость», предложенный подход лечения шизофрении имеет ряд недостатков. Они связаны со спорностью некоторых теоретических данных, которые стали основой для его разработки, и с определенными трудностями его применения на практике. В последнее время все чаще высказывается мнение о «предварительности» результатов исследований, свидетельствующих о высокой эффективности атипичных нейролептиков нового поколения из-за погрешностей их методики, неверной интерпретации полученных данных или конфликта интересов [1, 8, 17, 19, 27, 28]. Накопленный опыт показывает, что такая терапия не так безопасна, как это предполагалось ранее, может представлять серьезную угрозу для здоровья пациентов и значительно ухудшать их качество жизни вследствие развития метаболических, эндокринных и сердечно-сосудистых нарушений [4, 15, 18, 26, 30, 31]. Наконец, в предложенной схеме отсутствуют рекомендации дифференцированного выбора атипичных нейролептиков нового поколения в зависимости от клинических особенностей психического состояния больного. Указывается, что индивидуальная эффективность этих средств может определяться только методом «проб и ошибок» [22, 29].
Отсутствие рекомендаций дифференцированного выбора атипичных нейролептиков нового поколения связано с традиционным для зарубежной психиатрии мнением о равной эффективности всех антипсихотических средств и их различии только в спектре побочных эффектов [12, 22, 23, 25, 29]. Однако отечественная и некоторые европейские психиатрические школы всегда придерживались позиции о различии профиля психотропной активности различных нейролептиков. На этом основании, например, были разработаны рекомендации дифференцированного применения традиционных антипсихотических средств. При выборе терапии предлагалось оценивать степень активности эндогенного процесса, его длительность, синдромальную форму заболевания и другие клинические характеристики. Важное внимание уделялось соотнесению структуры симптомокомплекса и особенностей «специфического» антипсихотического эффекта нейролептика. Дифференцированный подход к лечению нейролептиками нового поколения до сих пор не предложен, что связано с недостаточным вниманием к этой проблеме. Клинические исследования последнего времени обычно направлены на изучение лишь «общей» эффективности терапии при помощи количественной оценки динамики психопатологической симптоматики по стандартизированным шкалам. Тщательный анализ связи эффективности лечения и различных клинических особенностей заболевания, как правило, не проводится. Неизвестно, насколько эффективность лечения атипичными нейролептиками зависит от длительности заболевания, темпа его прогрессирования, особенностей психопатологической симптоматики. Таким образом, на практике выбор терапии приходится осуществлять эмпирически, что часто приводит к длительному «перебору» различных препаратов без достижения необходимого терапевтического эффекта.
Цель настоящего исследования заключалась в сравнительном изучении эффективности атипичных нейролептиков (клозапин, рисперидон, оланзапин и кветиапин) при лечении острых приступов и обострений шубообразной шизофрении. Это исследование является одним из этапов проводимой нами работы, направленной на детальное изучение эффективности различных атипичных нейролептиков при шизофрении и дифференцированного подхода их применения в зависимости от клинических особенностей состояния больного.
В задачи исследования входило:
Материалы и методы
Обследованы больные шубообразной шизофренией в период острого приступа или обострения заболевания (F20.01, F20.02, F23.1). Для нозологической квалификации состояния больных использовали отечественную классификацию шизофрении [11, 14] и критерии МКБ-10 [9, 16]. Во всех случаях наблюдали активное течение эндогенного процесса, больных с исходными состояниями в исследование не включали. В исследуемую группу отобраны пациенты c развернутыми приступами, начальными этапами развития острых психозов и стертыми обострениями болезни, развившимися на фоне длительно текущего эндогенного процесса. Состояние больных с развернутыми психозами определялось острым параноидом, острой парафренией, синдромами ложных узнаваний в сочетании с симптоматикой возбуждения или острой растерянности. В статусе больных с инициальными проявлениями приступов болезни преобладали тревожные, деперсонализационные и дереализационные расстройства, соответствующие начальным этапам бредообразования в виде бредового настроения и бредового восприятия; оформленные бредовые идеи, четкие галлюцинаторные переживания в этих случаях отсутствовали. При психозах, возникших на фоне длительного течения шизофрении, симптомы чувственного бреда, как правило, сочетались с хроническими нарушениями стройности мышления, свидетельствующими о длительном течении болезни.
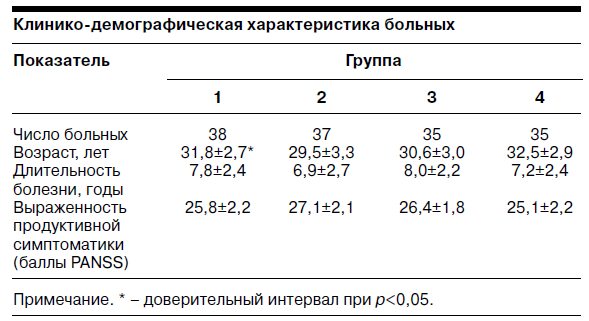
Первоначально обследованные больные были разделены на 4 группы, сопоставимые по численности, возрасту, длительности заболевания, тяжести психического состояния и соотношению различных симптомокомплексов (см. таблицу).
Сравнение эффективности терапии проводили при помощи:
Статистический анализ проводился при помощи расчета доверительного интервала при р=0,05 для сравнения средних величин. При сравнении качественных признаков проводилось вычисление величины «р» при помощи методов непараметрической статистики.
Результаты
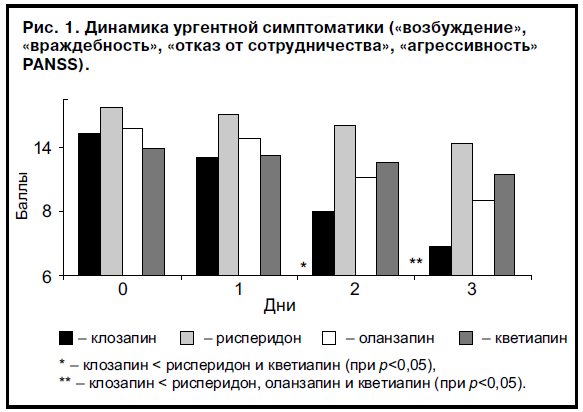
В начале наблюдения прежде всего нас интересовала выраженность седативного действия изучаемых нейролептиков. Известно, что достаточная «первичная» лекарственная седация при острых психозах во многом определяет дальнейший успех лечения, поскольку быстрое устранение возбуждения, агрессии и негативизма способствует улучшению терапевтического сотрудничества больного и врача. Проведено сравнение среднего суммарного балла по пунктам «возбуждение», «враждебность», «отказ от сотрудничества» и «агрессивность» PANSS (рис. 1). Оказалось, что при приеме клозапина лекарственная седация была более выражена, чем при терапии другими атипичными нейролептиками. Через 2 дня лечения средний балл по пунктам, отражающим симптомы психотического возбуждения, при приеме клозапина был значительно ниже, чем при терапии рисперидоном и кветиапином (10,0±1,1; 15,4±2,2 и 13,1±1,9 соответственно; р<0,05). Через 3 дня наблюдения прием клозапина был более эффективен (7,8±1,0), чем лечение не только рисперидоном (14,3±2,3) и кветиапином (12,3±2,3), но и оланзапином (10,7±1,5). Выраженность седативного действия рисперидона, оланзапина и кветиапина была примерно сопоставимой, хотя ургентная симптоматика при лечении оланзапином редуцировалась в несколько большей степени.
При клиническом наблюдении у больных, принимавших клозапин, отмечено быстрое ослабление психотического возбуждения. Достаточный седативный эффект развивался уже после первых приемов препарата. При наиболее острых приступах применение клозапина в течение нескольких суток обеспечивало заметное успокоение больных, выраженное ослабление возбуждения и негативизма, при необходимости достигался медикаментозный сон. Терапия оланзапином приводила к развитию слабого седативного эффекта. Его применение было эффективно у пациентов с психотической тревогой или слабым возбуждением без агрессии и негативизма. При ярких вариантах возбуждения прием оланзапина был неэффективен. Терапия рисперидоном и кветиапином почти не вызывала лекарственной седации. Дополнительное назначение транквилизаторов в этих случаях обеспечивало ослабление психотической тревоги на начальных стадиях психоза, но почти не влияло на тяжесть психомоторного возбуждения при развернутом чувственном бреде. В этом случае отмечено незначительное кратковременное успокоение больных с быстрым, порой моментальным нарастанием возбуждения до исходного уровня через нескольких часов после приема транквилизаторов.
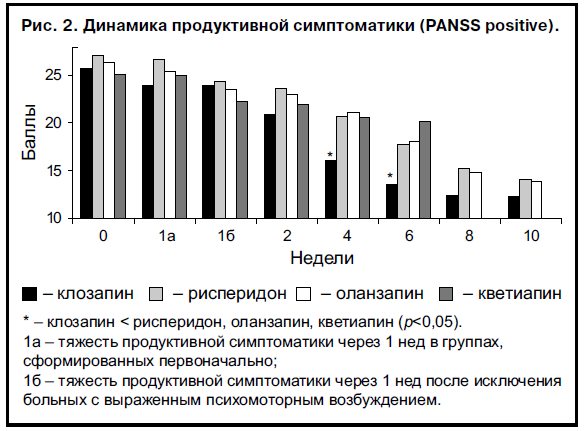
Динамическое сравнение выраженности продуктивной симптоматики в обследованных группах показало, что терапия клозапином приводила к большему ослаблению проявлений психоза, чем лечение другими атипичными нейролептиками (рис. 2). Через 4 нед лечения средний балл по подшкале продуктивных симптомов PANSS при приеме клозапина был значительно ниже, чем при лечении рисперидоном, оланзапином и кветиапином (16,0±1,7; 20,7±1,9; 21,1±2,1 и 20,5±2,0 соответственно; p<0,05). Через 6 нед терапии статистически значимые различия между группами сохранялись (13,6±1,3 и 17,8±2,1; 18,1±2,1 и 20,1±2,5 соответственно; p<0,05). Однако в дальнейшем через 8 и 10 нед тяжесть продуктивной симптоматики при приеме клозапина, рисперидона и оланзапина становилась примерно сопоставимой, хотя при лечении клозапином она была выражена в несколько меньшей степени. Статистически значимых различий между группами больных, принимавших рисперидон и оланзапин, не выявлено.
Представленные результаты сравнения тяжести продуктивных расстройств могли быть искажены из-за выбывания из исследования части больных с выраженным возбуждением, принимавших рисперидон, оланзапин и кветиапин. Поэтому для исключения фактора потери сопоставимости групп из статистического анализа было принудительно исключено 8 (21,1%) больных с наиболее острыми картинами психоза, лечившихся клозапином. Несмотря на это, повторный статистический анализ вновь показал, что прием клозапина приводил к большему ослаблению психотической симптоматики. Через 4 нед средний балл по подшкале продуктивных расстройств PANSS при приеме этого нейролептика был значительно ниже, чем при лечении рисперидоном, оланзапином и кветиапином (15,5±1,2; 20,7±1,9; 21,1±2,1 и 20,5±2,0 соответственно; p<0,05). Через 6 нед наблюдения отмеченные различия сохранялись (13,9±1,5; 17,8±2,1; 18,1±2,1 и 20,1±2,5 соответственно; p<0,05).
Во всех случаях прием клозапина приводил к быстрой редукции симптоматики, составляющей «синдромальное ядро» (чувственный бред, псевдогаллюцинации, иллюзорные узнавания, психотическая дереализация, нарушения стройности мышления). Причем в первую очередь отмечено ослабление обманов восприятия, а затем уменьшалась выраженность бреда и острых нарушений мышления. У некоторых больных с длительным течением шизофрении отмечено некоторое ослабление хронических нарушений стройности мышления, например резонерства. При приеме рисперидона и оланзапина состояние больных улучшалось гораздо медленнее. Клиническое наблюдение свидетельствовало о равной эффективности этих нейролептиков. Обращает внимание, что такая терапия была довольно эффективной в отношении обманов восприятия, однако бредовая симптоматика редуцировалась в гораздо меньшей степени. Состояние больных, принимавших клозапин, менялось незначительно. В большинстве случаев у этих больных терапия была пересмотрена, и через 6 нед наблюдения эта группа была исключена из дальнейшего сравнения (см. рис. 2).
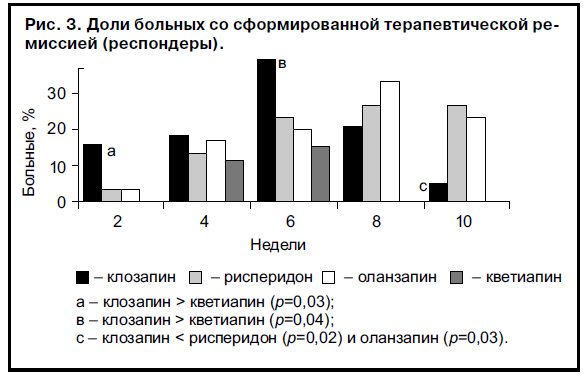
Динамическая оценка числа респондеров (больные со сформированной критикой) показала, что прием клозапина приводил к более раннему формированию терапевтических ремиссий, чем при лечении другими атипичными нейролептиками (рис. 3). Через 2 нед наблюдения число таких больных при приеме клозапина, рисперидона и оланзапина составило 6 (15,8%), 1 (3,3%) и 1 (3,3%) соответственно. При лечении кветиапином психоз не был купирован ни в одном случае. Через 4 нед после начала исследования терапия клозапином обеспечила формирование ремиссии еще у 7 (18,4%) больных, тогда как прием других нейролептиков в 4 (13,3%), 5 (16,7%) и 3 (11,5%) случаях в каждой группе соответственно. К концу 6-й недели купирующая терапия клозапином, рисперидоном, оланзапином и кветиапином была завершена у 15 (39,5%), 7 (23,3%), 6 (20,0%) и 4 (15,4%) больных соответственно. Через 2 мес состояния ремиссии достигли 8 (21%) больных, принимавших клозапин, 8 (26,7%) пациентов, лечившихся рисперидоном, и 10 (33,3%) больных, получавших оланзапин. В дальнейшем к респондерам были отнесены 2 (5,3%), 8 (26,7%) и 7 (23,3%) пациентов, лечившихся клозапином, рисперидоном и оланзапином. Таким образом, в течение первых 6 нед наблюдения доля респондеров при приеме клозапина была выше больше, чем в других группах пациентов, хотя эти различия достигали статистической значимости только по сравнению с больными, принимавшими кветиапин (через 2 нед p=0,03; через 6 нед p=0,04).
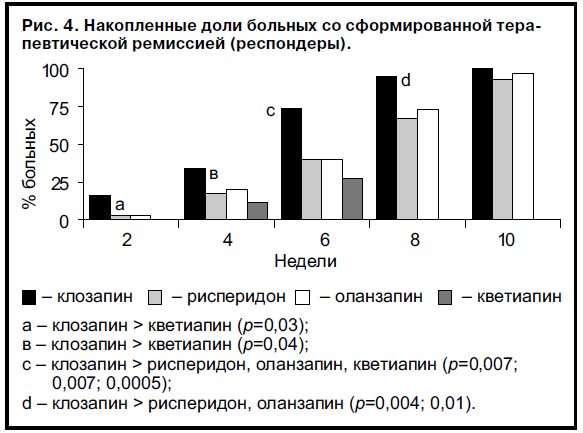
Более показательны результаты сравнения групп по общему числу больных со сформированной ремиссий (накопленная доля респондеров) (рис. 4). Через 6 нед приема клозапина таких пациентов было 28 (73,7%), что значительно превышало число респондеров при лечении рисперидоном (12 случаев – 40%, p=0,007), оланзапином (12 случаев – 40%, р=0,007) и кветиапином (7 случаев – 26,9%, р=0,0005). Через 8 нед наблюдения статистически значимые различия сохранялись: прием клозапина – 36 (94,7%) больных, рисперидона – 20 (66,6%, р=0,004) больных, оланзапина – 22 (73,3%, р=0,01) больных.
Динамический анализ клинических характеристик респондеров показал, что через 2 нед терапия клозапином приводила к формированию ремиссий у больных с инициальными проявлениями психотических состояний (бредовое настроение и восприятие – психотическая тревога, деперсонализация, дереализация). Через 4 нед наблюдения основную часть респондеров этой группы составили больные с развернутыми психозами, состояние которых определялось острой растерянностью без тяжелого возбуждения, и пациенты с подострыми приступами на фоне длительного течения эндогенного процесса без выраженных хронических нарушений стройности мышления. На этом этапе прием других атипичных нейролептиков был эффективен в основном при начальных проявлениях острых психозов. Через 6 нед терапия клозапином обеспечивала формирование ремиссии при наиболее острых состояниях (острый параноид и парафрения с выраженным возбуждением и негативизмом) и при подострых приступах у больных с длительным течением болезни и выраженными хроническими нарушениями стройности мышления. В остальных группах ремиссии в это время формировались при подострых состояниях на фоне длительно текущей шизофрении без выраженных нарушений мышления. Через 8–10 нед прием рисперидона и оланзапина обеспечивал формирование ремиссий в основном у больных с психозами, в клинической картине которых преобладал аффект растерянности.
Сравнительная оценка выраженности негативных расстройств у больных со сформированной лекарственной ремиссией (появление критики) показала, что купирующая терапия клозапином обеспечивала формирование ремиссий более несколько высокого качества, чем лечение другими атипичными нейролептиками. После завершения острой фазы психоза средний балл по подшкале негативных симптомов PANSS у больных этой группы был ниже, чем при приеме рисперидона и оланзапина, хотя эти различия не были статистически значимыми (21,7±1,7; 25,1±2,0 и 25,9±1,9 соответственно). Дальнейшее клиническое наблюдение отчетливо показывало, что при лечении клозапином больные быстрее адаптировались к условиям обычной жизни с лучшим восстановлением их социального статуса. При лечении рисперидоном и оланзапином период реадаптации был более длительным. Предположительно это было связано с большей эффективностью клозапина в отношении продуктивных расстройств, а не с его влиянием на дефицитарную симптоматику.
Обсуждение
Результаты проведенного исследования свидетельствуют о значительном различии эффективности клозапина, рисперидона, оланзапина и кветиапина при лечении острых приступов и обострений шубообразной шизофрении. Клиническое наблюдение и статистический анализ полученных данных показали, что у этой группы больных наиболее эффективно применение клозапина. Такая терапия позволяет добиться максимального ослабления психотической симптоматики и приводит к скорейшему обрыву психоза. Ее важное преимущество заключается в выраженном седативном действии, значение которого при лечении острых приступов шизофрении трудно переоценить. Терапия клозапином эффективна при различных синдромальных вариантах острых психозов и различной длительности заболевания. Применение этого нейролептика эффективно не только в отношении острых продуктивных расстройств, но и хронической психопатологической симптоматики при длительном течении болезни. Терапия острых приступов шизофрении рисперидоном и оланзапином менее эффективна. Для обрыва психоза при их применении требуется более длительное время, чем при лечении клозапином. Применение рисперидона и оланзапина наиболее полезно на этапе «развертывания» острого приступа и при подострых состояниях у длительно болеющих пациентов без выраженных нарушений стройности мышления. Терапия оланзапином эффективна также при наличии в структуре синдрома психотической тревоги. При развернутых психозах, сопровождающихся ярким возбуждением, агрессией и негативизмом, использование атипичных нейролептиков нового поколения не приводит к значительному улучшению состояния. Лечение острых приступов шизофрении кветиапином наименее эффективно. В большинстве случаев такая терапия не позволяет значительно ослабить проявления острого чувственного бреда, острых нарушений стройности мышления и других продуктивных расстройств. Ее применение полезно лишь у небольшой части больных на начальных этапах бредообразования.
Полученные данные позволяют предложить схему дифференцированной терапии острых приступов шизофрении с учетом особенностей психического состояния больного. На наш взгляд, у больных с развернутыми острыми психозами наиболее предпочтительно применение клозапина. Такая терапия по сравнению с другими атипичными нейролептиками позволяет в наиболее короткие сроки купировать приступ болезни и сформировать ремиссию максимально возможного качества. К ее безусловным преимуществам относится выраженное седативное действие и высокая эффективность в отношении различных продуктивных расстройств. Быстрое сокращение активной фазы заболевания в этом случае значительно улучшает отдаленный прогноз. Рисперидон и оланзапин могут рассматриваться в качестве препаратов выбора при лечении инициальных проявлений острых приступов шизофрении, например на этапах бредового настроения и бредового восприятия (деперсонализация, дереализация, отрывочные обманы восприятия). В этом случае мощность этих нейролептиков достаточна для предотвращения дальнейшего развертывания приступа и «обрыва» его начальной стадии. Использование оланзапина предпочтительно у больных с выраженной тревогой. В последнем случае может быть использована комбинация рисперидона или оланзапина с транквилизаторами. Рисперидон и оланзапин можно рассматривать в качестве препаратов выбора при лечении стертых приступов шизофрении при ее длительном течении на этапе «выгорания» эндогенного процесса и формирования апатического дефекта, особенно при амбулаторном лечении. В случае преобладания в структуре дефекта нарушений мышления применение рисперидона и оланзапина нецелесообразно. У таких больных более предпочтительно использование клозапина.
Поскольку в предложенной схеме купирующей терапии у части больных клозапин рассматривается в качестве средства выбора, необходимо остановиться на вопросе безопасности такого лечения. Ранее неоднократно подчеркивалось, что широкое применение этого нейролептика в клинической практике ограничивается риском развития агранулоцитоза. Однако результаты исследований последних лет свидетельствуют, что терапия клозапином является более безопасной, чем это предполагалось ранее. Рекомендация обязательного динамического исследования клинического анализа крови позволила снизить риск развития агранулоцитоза с 1–2% до 0,25–0,5% за счет отмены лечения на стадии выраженной лейкопении [20, 23]. Таким образом, эти данные свидетельствуют о сопоставимости риска развития агранулоцитоза при применении клозапина (0,25–0,5%) и некоторых типичных нейролептиков, например хлорпромазина, промазина или хлорпротиксена (0,3%). В нашем наблюдении 552 больных шизофренией, принимавших клозапин, не было зарегистрировано ни одного случая развития агранулоцитоза2. Необходимо также отметить возможность «завышенности» современных оценок распространенности агранулоцитоза у больных, принимающих клозапин. Поскольку агранулоцитоз относится к редким побочным эффектам, точно оценить риск этого осложнения можно только при проведении проспективных популяционных исследований. Эта проблема отчасти была решена при помощи создания специальных баз данных пациентов, принимающих клозапин. Однако методика таких популяционных наблюдений часто приводит к высокой вероятности погрешности полученных данных. Известно, что лейкопения и агранулоцитоз могут развиваться вследствие повышенной индивидуальной чувствительности больных к большой группе лекарственных средств (некоторые антибиотики, сульфаниламиды, нестероидные противовоспалительные препарата, карбамазепин, новокаинамид, диакарб и др.) [2, 3, 6, 7, 33]. Таким образом, существует вероятность того, что некоторые случаи агранулоцитоза, приписываемые клозапину, могут быть связаны с приемом других лекарств, часто используемых в клинической практике. Например, описан случай развития нейтропении при назначении эритромицина больному, длительно принимавшему клозапин. Повторный прием клозапина в этом случае не сопровождался какими-либо нарушениями картины белой крови [32].
Заключение
Следует подчеркнуть необходимость дальнейшего уточнения принципов дифференцированного назначения современных нейролептиков при лечении шизофрении. Как уже отмечено, современные стандарты лечения шизофрении основываются на позиции предпочтительности выбора терапии с оптимальным соотношением эффективности и переносимости. Поскольку высказывается мнение, что показатель польза/риск наиболее оптимален у атипичных нейролептиков нового поколения, многие авторы указывают на предпочтительность их использования, особенно на этапе манифестации эндогенного процесса. На наш взгляд, у некоторых групп больных, например при амбулаторном лечении, у пожилых пациентов и больных с сопутствующей соматической патологией, применение атипичных нейролептиков нового поколения действительно может быть более предпочтительным в связи с отсутствием затормаживающего действия, редким возникновением неврологических расстройств и остро развивающихся соматических побочных эффектов. Более правильное соблюдение медицинских рекомендаций некоторыми пациентами, принимающими такое лечения, является важным фактором, определяющим повышение успешности медицинского вмешательства. Однако у многих больных уже с самого начала терапии оправдано применение наиболее эффективных средств, например клозапина, даже в ущерб хорошей переносимости. Хорошо известно, что эндогенный процесс наиболее активно прогрессирует в первые годы после манифестации, в это время происходит наибольшее усиления тяжести продуктивных расстройств и формирование основных проявлений шизофренического дефекта. Поэтому назначение наиболее эффективных антипсихотических средств уже на «раннем этапе» заболевания (при условии тщательного динамического наблюдения для предотвращения осложнений и активном использовании различных методов формирования терапевтического сотрудничества) оправдано возможностью наибольшего сдерживания прогредиентности болезни и максимального улучшения состояния больного, что в конечном итоге значительно улучшает отдаленный прогноз.
Современные стандарты лечения шизофрении основываются на позиции предпочтительности выбора терапии с оптимальным соотношением эффективности и переносимости. Высказывается мнение, что показатель польза/риск наиболее оптимален у атипичных нейролептиков нового поколения, поэтому многие авторы указывают на предпочтительность их использования при лечении шизофрении [5, 10, 13, 20, 21]. Считается, что применение атипичных нейролептиков наиболее рационально при манифестации заболевания из-за редкого развития неврологических расстройств и затормаживающего действия. Такие особенности повышают эффективность терапии благодаря более правильному соблюдению ее режима, способствуют улучшению качества жизни и уменьшают риск стигматизации. При прогрессировании болезни и снижении эффективности лечения предлагается использовать средства традиционного ряда [20–25]. Предполагается, что такая «смена» терапии может способствовать улучшению состояния, но только в случае более высокой индивидуальной чувствительности некоторых больных к препаратам этой группы. При неэффективности типичных нейролептиков рекомендуется использовать клозапин, который более эффективен, чем другие антипсихотические средства, при лечении длительно текущей шизофрении. Его широкое применение на ранних стадиях заболевания ограничивается риском развития агранулоцитоза [21, 24, 29]. У некоторых больных представленная «смена» терапии проводится в «сжатые» сроки. Это возможно при изначально низкой эффективности лечения, например при злокачественных формах болезни, или у ранее «не леченных» пациентов с длительным течением заболевания.
Несмотря на всю привлекательность идеи «высокая эффективность и хорошая переносимость», предложенный подход лечения шизофрении имеет ряд недостатков. Они связаны со спорностью некоторых теоретических данных, которые стали основой для его разработки, и с определенными трудностями его применения на практике. В последнее время все чаще высказывается мнение о «предварительности» результатов исследований, свидетельствующих о высокой эффективности атипичных нейролептиков нового поколения из-за погрешностей их методики, неверной интерпретации полученных данных или конфликта интересов [1, 8, 17, 19, 27, 28]. Накопленный опыт показывает, что такая терапия не так безопасна, как это предполагалось ранее, может представлять серьезную угрозу для здоровья пациентов и значительно ухудшать их качество жизни вследствие развития метаболических, эндокринных и сердечно-сосудистых нарушений [4, 15, 18, 26, 30, 31]. Наконец, в предложенной схеме отсутствуют рекомендации дифференцированного выбора атипичных нейролептиков нового поколения в зависимости от клинических особенностей психического состояния больного. Указывается, что индивидуальная эффективность этих средств может определяться только методом «проб и ошибок» [22, 29].
Отсутствие рекомендаций дифференцированного выбора атипичных нейролептиков нового поколения связано с традиционным для зарубежной психиатрии мнением о равной эффективности всех антипсихотических средств и их различии только в спектре побочных эффектов [12, 22, 23, 25, 29]. Однако отечественная и некоторые европейские психиатрические школы всегда придерживались позиции о различии профиля психотропной активности различных нейролептиков. На этом основании, например, были разработаны рекомендации дифференцированного применения традиционных антипсихотических средств. При выборе терапии предлагалось оценивать степень активности эндогенного процесса, его длительность, синдромальную форму заболевания и другие клинические характеристики. Важное внимание уделялось соотнесению структуры симптомокомплекса и особенностей «специфического» антипсихотического эффекта нейролептика. Дифференцированный подход к лечению нейролептиками нового поколения до сих пор не предложен, что связано с недостаточным вниманием к этой проблеме. Клинические исследования последнего времени обычно направлены на изучение лишь «общей» эффективности терапии при помощи количественной оценки динамики психопатологической симптоматики по стандартизированным шкалам. Тщательный анализ связи эффективности лечения и различных клинических особенностей заболевания, как правило, не проводится. Неизвестно, насколько эффективность лечения атипичными нейролептиками зависит от длительности заболевания, темпа его прогрессирования, особенностей психопатологической симптоматики. Таким образом, на практике выбор терапии приходится осуществлять эмпирически, что часто приводит к длительному «перебору» различных препаратов без достижения необходимого терапевтического эффекта.
Цель настоящего исследования заключалась в сравнительном изучении эффективности атипичных нейролептиков (клозапин, рисперидон, оланзапин и кветиапин) при лечении острых приступов и обострений шубообразной шизофрении. Это исследование является одним из этапов проводимой нами работы, направленной на детальное изучение эффективности различных атипичных нейролептиков при шизофрении и дифференцированного подхода их применения в зависимости от клинических особенностей состояния больного.
В задачи исследования входило:
1) сравнение особенностей динамики продуктивной психопатологической симптоматики при применении различных атипичных нейролептиков на этапе купирующей терапии шубообразной шизофрении;
2) сравнение выраженности негативных расстройств при применении различных атипичных нейролептиков на этапе формирования терапевтической ремиссии;
3) выделение клинических предикторов эффективности различных атипичных нейролептиков при купирующей терапии шубообразной шизофрении;
4) предложение практических рекомендаций применения различных атипичных нейролептиков при проведении купирующей терапии шубообразной шизофрении.
Материалы и методы
Обследованы больные шубообразной шизофренией в период острого приступа или обострения заболевания (F20.01, F20.02, F23.1). Для нозологической квалификации состояния больных использовали отечественную классификацию шизофрении [11, 14] и критерии МКБ-10 [9, 16]. Во всех случаях наблюдали активное течение эндогенного процесса, больных с исходными состояниями в исследование не включали. В исследуемую группу отобраны пациенты c развернутыми приступами, начальными этапами развития острых психозов и стертыми обострениями болезни, развившимися на фоне длительно текущего эндогенного процесса. Состояние больных с развернутыми психозами определялось острым параноидом, острой парафренией, синдромами ложных узнаваний в сочетании с симптоматикой возбуждения или острой растерянности. В статусе больных с инициальными проявлениями приступов болезни преобладали тревожные, деперсонализационные и дереализационные расстройства, соответствующие начальным этапам бредообразования в виде бредового настроения и бредового восприятия; оформленные бредовые идеи, четкие галлюцинаторные переживания в этих случаях отсутствовали. При психозах, возникших на фоне длительного течения шизофрении, симптомы чувственного бреда, как правило, сочетались с хроническими нарушениями стройности мышления, свидетельствующими о длительном течении болезни.
Первоначально обследованные больные были разделены на 4 группы, сопоставимые по численности, возрасту, длительности заболевания, тяжести психического состояния и соотношению различных симптомокомплексов (см. таблицу).

Сравнение эффективности терапии проводили при помощи:
1) динамического сопоставления выраженности продуктивной симптоматики в период купирующей терапии по подшкале позитивных симптомов PANSS,Наблюдение продолжали 10 нед. Состояние больных оценивали исходно, в течение первых дней лечения – ежедневно (для оценки выраженности седативного эффекта), через 1 и 2 нед после начала терапии, а затем каждые 2 нед.
2) сопоставления тяжести негативных расстройств на момент формирования терапевтической ремиссии по подшкале негативных симптомов PANSS,
3) оценки соотношения респондеров (больных со сформированной лекарственной ремиссией) в исследуемых группах больных.
Статистический анализ проводился при помощи расчета доверительного интервала при р=0,05 для сравнения средних величин. При сравнении качественных признаков проводилось вычисление величины «р» при помощи методов непараметрической статистики.
Результаты

В начале наблюдения прежде всего нас интересовала выраженность седативного действия изучаемых нейролептиков. Известно, что достаточная «первичная» лекарственная седация при острых психозах во многом определяет дальнейший успех лечения, поскольку быстрое устранение возбуждения, агрессии и негативизма способствует улучшению терапевтического сотрудничества больного и врача. Проведено сравнение среднего суммарного балла по пунктам «возбуждение», «враждебность», «отказ от сотрудничества» и «агрессивность» PANSS (рис. 1). Оказалось, что при приеме клозапина лекарственная седация была более выражена, чем при терапии другими атипичными нейролептиками. Через 2 дня лечения средний балл по пунктам, отражающим симптомы психотического возбуждения, при приеме клозапина был значительно ниже, чем при терапии рисперидоном и кветиапином (10,0±1,1; 15,4±2,2 и 13,1±1,9 соответственно; р<0,05). Через 3 дня наблюдения прием клозапина был более эффективен (7,8±1,0), чем лечение не только рисперидоном (14,3±2,3) и кветиапином (12,3±2,3), но и оланзапином (10,7±1,5). Выраженность седативного действия рисперидона, оланзапина и кветиапина была примерно сопоставимой, хотя ургентная симптоматика при лечении оланзапином редуцировалась в несколько большей степени.
При клиническом наблюдении у больных, принимавших клозапин, отмечено быстрое ослабление психотического возбуждения. Достаточный седативный эффект развивался уже после первых приемов препарата. При наиболее острых приступах применение клозапина в течение нескольких суток обеспечивало заметное успокоение больных, выраженное ослабление возбуждения и негативизма, при необходимости достигался медикаментозный сон. Терапия оланзапином приводила к развитию слабого седативного эффекта. Его применение было эффективно у пациентов с психотической тревогой или слабым возбуждением без агрессии и негативизма. При ярких вариантах возбуждения прием оланзапина был неэффективен. Терапия рисперидоном и кветиапином почти не вызывала лекарственной седации. Дополнительное назначение транквилизаторов в этих случаях обеспечивало ослабление психотической тревоги на начальных стадиях психоза, но почти не влияло на тяжесть психомоторного возбуждения при развернутом чувственном бреде. В этом случае отмечено незначительное кратковременное успокоение больных с быстрым, порой моментальным нарастанием возбуждения до исходного уровня через нескольких часов после приема транквилизаторов.

Динамическое сравнение выраженности продуктивной симптоматики в обследованных группах показало, что терапия клозапином приводила к большему ослаблению проявлений психоза, чем лечение другими атипичными нейролептиками (рис. 2). Через 4 нед лечения средний балл по подшкале продуктивных симптомов PANSS при приеме клозапина был значительно ниже, чем при лечении рисперидоном, оланзапином и кветиапином (16,0±1,7; 20,7±1,9; 21,1±2,1 и 20,5±2,0 соответственно; p<0,05). Через 6 нед терапии статистически значимые различия между группами сохранялись (13,6±1,3 и 17,8±2,1; 18,1±2,1 и 20,1±2,5 соответственно; p<0,05). Однако в дальнейшем через 8 и 10 нед тяжесть продуктивной симптоматики при приеме клозапина, рисперидона и оланзапина становилась примерно сопоставимой, хотя при лечении клозапином она была выражена в несколько меньшей степени. Статистически значимых различий между группами больных, принимавших рисперидон и оланзапин, не выявлено.
Представленные результаты сравнения тяжести продуктивных расстройств могли быть искажены из-за выбывания из исследования части больных с выраженным возбуждением, принимавших рисперидон, оланзапин и кветиапин. Поэтому для исключения фактора потери сопоставимости групп из статистического анализа было принудительно исключено 8 (21,1%) больных с наиболее острыми картинами психоза, лечившихся клозапином. Несмотря на это, повторный статистический анализ вновь показал, что прием клозапина приводил к большему ослаблению психотической симптоматики. Через 4 нед средний балл по подшкале продуктивных расстройств PANSS при приеме этого нейролептика был значительно ниже, чем при лечении рисперидоном, оланзапином и кветиапином (15,5±1,2; 20,7±1,9; 21,1±2,1 и 20,5±2,0 соответственно; p<0,05). Через 6 нед наблюдения отмеченные различия сохранялись (13,9±1,5; 17,8±2,1; 18,1±2,1 и 20,1±2,5 соответственно; p<0,05).
Во всех случаях прием клозапина приводил к быстрой редукции симптоматики, составляющей «синдромальное ядро» (чувственный бред, псевдогаллюцинации, иллюзорные узнавания, психотическая дереализация, нарушения стройности мышления). Причем в первую очередь отмечено ослабление обманов восприятия, а затем уменьшалась выраженность бреда и острых нарушений мышления. У некоторых больных с длительным течением шизофрении отмечено некоторое ослабление хронических нарушений стройности мышления, например резонерства. При приеме рисперидона и оланзапина состояние больных улучшалось гораздо медленнее. Клиническое наблюдение свидетельствовало о равной эффективности этих нейролептиков. Обращает внимание, что такая терапия была довольно эффективной в отношении обманов восприятия, однако бредовая симптоматика редуцировалась в гораздо меньшей степени. Состояние больных, принимавших клозапин, менялось незначительно. В большинстве случаев у этих больных терапия была пересмотрена, и через 6 нед наблюдения эта группа была исключена из дальнейшего сравнения (см. рис. 2).

Динамическая оценка числа респондеров (больные со сформированной критикой) показала, что прием клозапина приводил к более раннему формированию терапевтических ремиссий, чем при лечении другими атипичными нейролептиками (рис. 3). Через 2 нед наблюдения число таких больных при приеме клозапина, рисперидона и оланзапина составило 6 (15,8%), 1 (3,3%) и 1 (3,3%) соответственно. При лечении кветиапином психоз не был купирован ни в одном случае. Через 4 нед после начала исследования терапия клозапином обеспечила формирование ремиссии еще у 7 (18,4%) больных, тогда как прием других нейролептиков в 4 (13,3%), 5 (16,7%) и 3 (11,5%) случаях в каждой группе соответственно. К концу 6-й недели купирующая терапия клозапином, рисперидоном, оланзапином и кветиапином была завершена у 15 (39,5%), 7 (23,3%), 6 (20,0%) и 4 (15,4%) больных соответственно. Через 2 мес состояния ремиссии достигли 8 (21%) больных, принимавших клозапин, 8 (26,7%) пациентов, лечившихся рисперидоном, и 10 (33,3%) больных, получавших оланзапин. В дальнейшем к респондерам были отнесены 2 (5,3%), 8 (26,7%) и 7 (23,3%) пациентов, лечившихся клозапином, рисперидоном и оланзапином. Таким образом, в течение первых 6 нед наблюдения доля респондеров при приеме клозапина была выше больше, чем в других группах пациентов, хотя эти различия достигали статистической значимости только по сравнению с больными, принимавшими кветиапин (через 2 нед p=0,03; через 6 нед p=0,04).

Более показательны результаты сравнения групп по общему числу больных со сформированной ремиссий (накопленная доля респондеров) (рис. 4). Через 6 нед приема клозапина таких пациентов было 28 (73,7%), что значительно превышало число респондеров при лечении рисперидоном (12 случаев – 40%, p=0,007), оланзапином (12 случаев – 40%, р=0,007) и кветиапином (7 случаев – 26,9%, р=0,0005). Через 8 нед наблюдения статистически значимые различия сохранялись: прием клозапина – 36 (94,7%) больных, рисперидона – 20 (66,6%, р=0,004) больных, оланзапина – 22 (73,3%, р=0,01) больных.
Динамический анализ клинических характеристик респондеров показал, что через 2 нед терапия клозапином приводила к формированию ремиссий у больных с инициальными проявлениями психотических состояний (бредовое настроение и восприятие – психотическая тревога, деперсонализация, дереализация). Через 4 нед наблюдения основную часть респондеров этой группы составили больные с развернутыми психозами, состояние которых определялось острой растерянностью без тяжелого возбуждения, и пациенты с подострыми приступами на фоне длительного течения эндогенного процесса без выраженных хронических нарушений стройности мышления. На этом этапе прием других атипичных нейролептиков был эффективен в основном при начальных проявлениях острых психозов. Через 6 нед терапия клозапином обеспечивала формирование ремиссии при наиболее острых состояниях (острый параноид и парафрения с выраженным возбуждением и негативизмом) и при подострых приступах у больных с длительным течением болезни и выраженными хроническими нарушениями стройности мышления. В остальных группах ремиссии в это время формировались при подострых состояниях на фоне длительно текущей шизофрении без выраженных нарушений мышления. Через 8–10 нед прием рисперидона и оланзапина обеспечивал формирование ремиссий в основном у больных с психозами, в клинической картине которых преобладал аффект растерянности.
Сравнительная оценка выраженности негативных расстройств у больных со сформированной лекарственной ремиссией (появление критики) показала, что купирующая терапия клозапином обеспечивала формирование ремиссий более несколько высокого качества, чем лечение другими атипичными нейролептиками. После завершения острой фазы психоза средний балл по подшкале негативных симптомов PANSS у больных этой группы был ниже, чем при приеме рисперидона и оланзапина, хотя эти различия не были статистически значимыми (21,7±1,7; 25,1±2,0 и 25,9±1,9 соответственно). Дальнейшее клиническое наблюдение отчетливо показывало, что при лечении клозапином больные быстрее адаптировались к условиям обычной жизни с лучшим восстановлением их социального статуса. При лечении рисперидоном и оланзапином период реадаптации был более длительным. Предположительно это было связано с большей эффективностью клозапина в отношении продуктивных расстройств, а не с его влиянием на дефицитарную симптоматику.
Обсуждение
Результаты проведенного исследования свидетельствуют о значительном различии эффективности клозапина, рисперидона, оланзапина и кветиапина при лечении острых приступов и обострений шубообразной шизофрении. Клиническое наблюдение и статистический анализ полученных данных показали, что у этой группы больных наиболее эффективно применение клозапина. Такая терапия позволяет добиться максимального ослабления психотической симптоматики и приводит к скорейшему обрыву психоза. Ее важное преимущество заключается в выраженном седативном действии, значение которого при лечении острых приступов шизофрении трудно переоценить. Терапия клозапином эффективна при различных синдромальных вариантах острых психозов и различной длительности заболевания. Применение этого нейролептика эффективно не только в отношении острых продуктивных расстройств, но и хронической психопатологической симптоматики при длительном течении болезни. Терапия острых приступов шизофрении рисперидоном и оланзапином менее эффективна. Для обрыва психоза при их применении требуется более длительное время, чем при лечении клозапином. Применение рисперидона и оланзапина наиболее полезно на этапе «развертывания» острого приступа и при подострых состояниях у длительно болеющих пациентов без выраженных нарушений стройности мышления. Терапия оланзапином эффективна также при наличии в структуре синдрома психотической тревоги. При развернутых психозах, сопровождающихся ярким возбуждением, агрессией и негативизмом, использование атипичных нейролептиков нового поколения не приводит к значительному улучшению состояния. Лечение острых приступов шизофрении кветиапином наименее эффективно. В большинстве случаев такая терапия не позволяет значительно ослабить проявления острого чувственного бреда, острых нарушений стройности мышления и других продуктивных расстройств. Ее применение полезно лишь у небольшой части больных на начальных этапах бредообразования.
Полученные данные позволяют предложить схему дифференцированной терапии острых приступов шизофрении с учетом особенностей психического состояния больного. На наш взгляд, у больных с развернутыми острыми психозами наиболее предпочтительно применение клозапина. Такая терапия по сравнению с другими атипичными нейролептиками позволяет в наиболее короткие сроки купировать приступ болезни и сформировать ремиссию максимально возможного качества. К ее безусловным преимуществам относится выраженное седативное действие и высокая эффективность в отношении различных продуктивных расстройств. Быстрое сокращение активной фазы заболевания в этом случае значительно улучшает отдаленный прогноз. Рисперидон и оланзапин могут рассматриваться в качестве препаратов выбора при лечении инициальных проявлений острых приступов шизофрении, например на этапах бредового настроения и бредового восприятия (деперсонализация, дереализация, отрывочные обманы восприятия). В этом случае мощность этих нейролептиков достаточна для предотвращения дальнейшего развертывания приступа и «обрыва» его начальной стадии. Использование оланзапина предпочтительно у больных с выраженной тревогой. В последнем случае может быть использована комбинация рисперидона или оланзапина с транквилизаторами. Рисперидон и оланзапин можно рассматривать в качестве препаратов выбора при лечении стертых приступов шизофрении при ее длительном течении на этапе «выгорания» эндогенного процесса и формирования апатического дефекта, особенно при амбулаторном лечении. В случае преобладания в структуре дефекта нарушений мышления применение рисперидона и оланзапина нецелесообразно. У таких больных более предпочтительно использование клозапина.
Поскольку в предложенной схеме купирующей терапии у части больных клозапин рассматривается в качестве средства выбора, необходимо остановиться на вопросе безопасности такого лечения. Ранее неоднократно подчеркивалось, что широкое применение этого нейролептика в клинической практике ограничивается риском развития агранулоцитоза. Однако результаты исследований последних лет свидетельствуют, что терапия клозапином является более безопасной, чем это предполагалось ранее. Рекомендация обязательного динамического исследования клинического анализа крови позволила снизить риск развития агранулоцитоза с 1–2% до 0,25–0,5% за счет отмены лечения на стадии выраженной лейкопении [20, 23]. Таким образом, эти данные свидетельствуют о сопоставимости риска развития агранулоцитоза при применении клозапина (0,25–0,5%) и некоторых типичных нейролептиков, например хлорпромазина, промазина или хлорпротиксена (0,3%). В нашем наблюдении 552 больных шизофренией, принимавших клозапин, не было зарегистрировано ни одного случая развития агранулоцитоза2. Необходимо также отметить возможность «завышенности» современных оценок распространенности агранулоцитоза у больных, принимающих клозапин. Поскольку агранулоцитоз относится к редким побочным эффектам, точно оценить риск этого осложнения можно только при проведении проспективных популяционных исследований. Эта проблема отчасти была решена при помощи создания специальных баз данных пациентов, принимающих клозапин. Однако методика таких популяционных наблюдений часто приводит к высокой вероятности погрешности полученных данных. Известно, что лейкопения и агранулоцитоз могут развиваться вследствие повышенной индивидуальной чувствительности больных к большой группе лекарственных средств (некоторые антибиотики, сульфаниламиды, нестероидные противовоспалительные препарата, карбамазепин, новокаинамид, диакарб и др.) [2, 3, 6, 7, 33]. Таким образом, существует вероятность того, что некоторые случаи агранулоцитоза, приписываемые клозапину, могут быть связаны с приемом других лекарств, часто используемых в клинической практике. Например, описан случай развития нейтропении при назначении эритромицина больному, длительно принимавшему клозапин. Повторный прием клозапина в этом случае не сопровождался какими-либо нарушениями картины белой крови [32].
Заключение
Следует подчеркнуть необходимость дальнейшего уточнения принципов дифференцированного назначения современных нейролептиков при лечении шизофрении. Как уже отмечено, современные стандарты лечения шизофрении основываются на позиции предпочтительности выбора терапии с оптимальным соотношением эффективности и переносимости. Поскольку высказывается мнение, что показатель польза/риск наиболее оптимален у атипичных нейролептиков нового поколения, многие авторы указывают на предпочтительность их использования, особенно на этапе манифестации эндогенного процесса. На наш взгляд, у некоторых групп больных, например при амбулаторном лечении, у пожилых пациентов и больных с сопутствующей соматической патологией, применение атипичных нейролептиков нового поколения действительно может быть более предпочтительным в связи с отсутствием затормаживающего действия, редким возникновением неврологических расстройств и остро развивающихся соматических побочных эффектов. Более правильное соблюдение медицинских рекомендаций некоторыми пациентами, принимающими такое лечения, является важным фактором, определяющим повышение успешности медицинского вмешательства. Однако у многих больных уже с самого начала терапии оправдано применение наиболее эффективных средств, например клозапина, даже в ущерб хорошей переносимости. Хорошо известно, что эндогенный процесс наиболее активно прогрессирует в первые годы после манифестации, в это время происходит наибольшее усиления тяжести продуктивных расстройств и формирование основных проявлений шизофренического дефекта. Поэтому назначение наиболее эффективных антипсихотических средств уже на «раннем этапе» заболевания (при условии тщательного динамического наблюдения для предотвращения осложнений и активном использовании различных методов формирования терапевтического сотрудничества) оправдано возможностью наибольшего сдерживания прогредиентности болезни и максимального улучшения состояния больного, что в конечном итоге значительно улучшает отдаленный прогноз.
27 января 2009
Количество просмотров: 2187

