Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2009
Проблема нарушения циркадных ритмов и их медикаментозная коррекция при болезни Альцгеймера №04 2009
Номера страниц в выпуске:13-16
Контакт и взаимодействие индивидуумов с окружающим миром осуществляются посредством когнитивных функций. Большинство когнитивных функций имеет условно-рефлекторный механизм и развивается после рождения под воздействием социума. В процессе взросления и обучения происходит дальнейшее совершенствование когнитивных функций, пока они не достигнут пика, индивидуального для каждого человека. В дальнейшем обычно в возрасте после 50 лет может отмечаться снижение памяти, внимания, скорости реакции и ряда других функций в рамках возрастной когнитивной дисфункции [2]. Однако возможно развитие тяжелой формы когнитивного дефицита, которая обозначается как деменция. В большинстве случаев когнитивные нарушения сопровождаются развитием нейропсихиатрических и поведенческих расстройств, которые в значительно большей мере нарушают повседневную активность и затрудняют ведение таких пациентов.
Контакт и взаимодействие индивидуумов с окружающим миром осуществляются посредством когнитивных функций. Большинство когнитивных функций имеет условно-рефлекторный механизм и развивается после рождения под воздействием социума. В процессе взросления и обучения происходит дальнейшее совершенствование когнитивных функций, пока они не достигнут пика, индивидуального для каждого человека. В дальнейшем обычно в возрасте после 50 лет может отмечаться снижение памяти, внимания, скорости реакции и ряда других функций в рамках возрастной когнитивной дисфункции [2].
Однако возможно развитие тяжелой формы когнитивного дефицита, которая обозначается как деменция. В большинстве случаев когнитивные нарушения сопровождаются развитием нейропсихиатрических и поведенческих расстройств, которые в значительно большей мере нарушают повседневную активность и затрудняют ведение таких пациентов.
Наиболее распространенной причиной развития деменции во всем мире в настоящее время является болезнь Альцгеймера (БА). Примерно в 60% случаев она является причиной развития тяжелых когнитивных нарушений. Распространенность БА в США достигает 8% среди лиц старше 65 лет. В дальнейшем прогнозируется увеличение числа больных (к 2050 г. почти в 5 раз) [22].
Вопрос о патогенетических процессах, в частности нарушении нейротрансмиттерной передачи, лежащих в основе когнитивного снижения, до конца не ясен. Наиболее общепринятой является концепция расстройства холинергической иннервации [7, 11, 12]. Показано, что степень нарушения холинергической системы коррелирует с тяжестью когнитивного дефицита [18].
Ацетилхолин является одним из наиболее исследованных нейротрансмиттеров. Ацетилхолин известен как нейротрансмиттер с 1914 г. Однако только через 15 лет были получены сведения, позволившие идентифицировать холинергические нейроны [55]. Ацетилхолин является преимущественно возбуждающим медиатором, хотя в ряде случаев он выступает как тормозной [3].
Ацетилхолин – один из наиболее изученных нейромедиаторов как регулятор двигательных процессов, однако его функции в деятельности головного мозга требуют дальнейших исследований [1].
Ацетилхолин представляет собой низкомолекулярный трансмиттер, который синтезируется при участии холинацетилтрансферазы. Нервная ткань не может синтезировать холин, и его источником является пища, а далее он доставляется через гематоэнцефалический барьер [52].
В головном мозге холинергические нейроны локализованы преимущественно в медиальном ядре перегородки, базальных гигантоклеточных ядрах (супраоптическое и паравентрикулярное), диагональной связке. Нейроны медиального ядра перегородки (Ch1) и диагональной связки (Ch2, Ch3) проецируются на медиальное ядро уздечки и интерпедункулярное ядро. Также они имеют связи с гиппокампом и обонятельными луковицами.
В области базальных ядер (Ch4), в частности ядра Мейнерта, холинергические нейроны составляют примерно 90%. Аксоны этих нейронов проецируются на кору больших полушарий, таламус, гиппокамп, амигдалу и ряд других областей. Они связаны афферентными волокнами с субкортикальной диэнцефальной областью и лимбико-паралимбической корой. Базальные ганглии играют роль своеобразной ретрансляционной станции между лимбической системой и новой корой [55]. Холинергические нейроны обнаружены также в полосатом теле, в прилежащем ядре [3].
Кроме того, две группы холинергических нейронов расположены в ядрах моста (педункуло-понтийное ядро Ch5 и латерально-дорсальное покрышечное ядро Ch6) и, осуществляя холинергическую иннервацию ствола и таламуса, они рассматриваются как часть восходящей ретикулярной системы [55].
Холинергические нейроны мозга наряду с их приоритетной ролью в осуществлении когнитивных функции, в первую очередь памяти и обучения, участвуют в регуляции движений. Альфа- и гамма-мотонейроны глазодвигательного, блокового, тройничного, отводящего, лицевого, языкоглоточного, блуждающего, добавочного, подъязычного, черепных и спинальных нервов являются холинергическими [55]. Также к холинергическим относятся преганглионарные и парасимпатическая часть постганглионарных нейронов вегетативной нервной системы.
В ретикулярной формации холинергические нейроны принимают участие в осуществлении контроля за ритмом сон–бодрствование [3]. Особое значение имеют нейроны педункуло-понтийного и латерально-дорсального покрышечного ядер среднего мозга, которые играют важную роль в обеспечении активации коры во время бодрствования и REM-фазы сна. Нейроны базальных ганглиев, в том числе и ядра Мейнерта, также принимают участие в этих процессах. Они проецируются преимущественно на церебральную кору, где способствуют повышению коркового ответа на входящие сенсорные стимулы [25].
Содержание нейротрансмиттеров не является стабильным показателем и имеет определенные суточные колебания. Важно то, что циркадные ритмы эндогенны и могут существовать независимо от окружающей среды [40]. Для осуществления им требуются пейсмекеры или «внутренние часы». Одними из таких часов являются супрахиазмальные ядра переднего гипоталамуса [21, 36]. Интересно, что время запуска этих ритмов может быть изменено (например, у лиц, работающих ночью) [4, 25].
Циркадный ритм включает состояние бодрствования и сон, который подразделяется на фазы медленного и парадоксального сна (REM-фаза). Фазы сна циклически меняются в течение ночи. У взрослого человека чередование фаз сна происходит примерно каждые 90–100 мин.
Существуют определенные циркадные ритмы выделения нейротрансмиттеров. Во время бодрствования доминирующими являются норадренергическая и серотонинергическая системы, однако гистаминергическая и холинергическая системы также активны. Ближе к ночи не только возрастает продукция ацетилхолина и гистамина, но и достигает максимума чувствительность М-холинорецепторов и Н2-рецепторов [28, 43].
Роль ацетилхолина подтверждена экспериментально. Микроинъекции агониста ацетилхолина в область ядер моста приводят к увеличению периода REM-сна. Введение же мускарина приводит к редукции медленноволнового сна [48].
Оказалось, что из всех известных активирующих мозговых систем, которые включаются при пробуждении и действуют во время бодрствования, в парадоксальном сне активны лишь одна-две. В REM-фазе сна функционируют лишь системы, локализованные в ретикулярной формации ствола и использующие в качестве медиатора ацетилхолин.
Существуют данные о том, что REM-сон облегчает процессы обучения и памяти [25]. Во время быстрого сна клетки мозга активны, однако отсутствует афферентная информация от органов чувств, так же как и нет эфферентной импульсации на двигательную систему. В связи с этим этот сон называют парадоксальным. В этой фазе сна происходит обработка информации, полученной ранее и хранящейся в памяти. Во время сна происходит консолидация следа в памяти, т.е. процесс долговременного запоминания информации (длится от 1 до 24 ч после предъявления стимула). Исследования здоровых волонтеров показали, что депривация сна оказывает негативное влияние на процессы консолидации памяти [35].
Долговременную память подразделяют на декларативную и процедурную. Декларативная память представляет собой память о фактах (память о том, «что»), процедурная память отвечает за приобретение и удержание разных навыков деятельности (память о том, «как»). Долговременная память обеспечивается структурами гиппокампового круга и их связями с мамиллярными телами и медиобазальными отделами лобных долей головного мозга. Декларативная память больше связана с гиппокампом и префронтальной корой, процедурная – со структурами стриатума. Разные виды памяти доминируют в разных фазах сна. В REM-фазу сна в большей мере осуществляется недекларативная память [19].
В процессе запоминания происходит активное взаимодействие неокортекса и гиппокампальных структур, которое по механизму обратной связи контролируется высвобождением ацетилхолина [39]. Это подтверждалось введением ингибитора холинэстеразы здоровым волонтерам во время фазы медленного сна, которое приводило к значительным нарушениям декларативной памяти в связи с повышением уровня ацетилхолина [20].
Старение прогрессивно сопровождается нарушением циркадных ритмов: например, у пожилых отмечается тенденция ложиться спать раньше и вставать раньше. Сон в течение ночи становится беспокойным [53]. Также с возрастом увеличивает количество других факторов, которые могут приводить к расстройствам сна (например, синдром беспокойных ног, апноэ во сне и др.).
При развитии деменции, например при БА, отмечается утрата холинергических нейронов, в первую очередь в области базальных ганглиев. У больных БА отмечается снижение уровня ацетилхолина в субарахноидальном пространстве и цереброспинальной жидкости, коррелирующее с тяжестью когнитивного дефицита, а также снижение количества и функциональной активности (на 50–90%) холинацетилтрансферазы, обеспечивающей синтез ацетилхолина [5].
Основным клиническим признаком БА является развитие грубого когнитивного дефицита. У ряда больных БА описывается усиление проявления симптомов во второй половине дня, вечером или ночью [26]. Существует предположение, что этот феномен связан с нарушением циркадных ритмов. У этих больных отмечается большее нарушение цикла сон–бодрствование, чем у здоровых индивидуумов аналогичного возраста. Отмечается задержки фаз циркадного цикла, сон в дневное время, беспокойство в ночное время. Могут быть изменения структуры ночного сна, становятся короче медленный сон, REM-фаза, чаще пробуждения, выше ночная локомоторная активность. Эти нарушения нарастают по мере прогрессирования заболевания [33, 34].
Нарушения циркадного ритма у больных БА часто лежат в основе развития поведенческих нарушений, приводят к увеличению психологического дистресса у ухаживающих лиц, могут явиться одной из причин для помещения пациента в специализированное учреждение [29, 38]. В связи с этим нарушения цикла сон–бодрствование у больных БА требуют прицельной коррекции.
Улучшение паттерна ночного сна возможно прежде всего путем увеличения физической активности и социальных отношений, уменьшения сна в дневное время. Большое значение имеет фототерапия с регуляцией уровня освещенности в разное время суток, который влияет на циркадные ритмы через воздействие на ретиногипоталамический тракт [25]. Эффективность фототерапии продемонстрирована во многих исследованиях [14, 17].
Еще одним направлением терапии нарушений циркадного ритма у больных БА является использование мелатонина. В двойном слепом исследовании мелатонин по сравнению с плацебо достоверно увеличивал продолжительность ночного сна и снижал ночную активность [6]. Однако результаты и эффективность фототерапии и возможности использования мелатонина еще требуют дальнейших исследований.
Абсолютно доказанной является эффективность использования ингибиторов ацетилхолинэстеразы, которые благодаря ингибированию гидролиза ацетилхолина в синаптической щели повышают его уровень и усиливают центральную холинергическую передачу [22, 51].
Назначение ингибиторов ацетилхолинэстеразы приводит к значительным когнитивным и поведенческим положительным эффектам. Поскольку нарушения холинергической нейротрансмиссии играют большую роль в формировании нарушений сна, препараты данной группы эффективны при необходимости восстановления цикла сон–бодрствование. Сохранность циркадных ритмов необходима для осуществления процессов консолидации памяти, и поэтому их нормализация будет иметь большое значение в восстановлении и сохранности когнитивных функций.
Активация холинергических нейронов связана с быстрым нарастанием концентрации ацетилхолина под воздействием препаратов. Однако в связи с тем что деменция является хроническим состоянием, быстрое увеличение дозы не рекомендуется.
Группа ингибиторов ацетилхолинестеразы включает 3 препарата: донепезил, ривастигмин и галантамин (реминил). Отличительной особенностью реминила является сочетание двух механизмов действия – ингибирование ацетилхолинэстеразы и аллостерическая модуляция никотиновых рецепторов. Благодаря аллостерической модуляции Н-холинорецепторов их активация достигается при более низких концентрациях ацетилхолина, что уменьшает риск потери чувствительности Н-холинорецепторов и формирования толерантности, а также уменьшает риск развития побочных явлений, благодаря чему достигается хорошая переносимость реминила [46, 54].
Никотиновые рецепторы играют важную роль в осуществлении когнитивной, поведенческой и двигательной функций и кровообращении в головном мозге [31, 32, 37]. Модуляция Н-холинорецепторов приводит к нормализации высвобождения разных нейромедиаторов (ацетилхолина, глутамата, допамина, норэпинефрина, серотонина и g-аминомасляной кислоты) и, соответственно, нормализации функций разных нейротрансмиттерных систем. Это оказывает выраженное положительное влияние не только на когнитивные функции, но и на психологические и поведенческие компоненты деменции [27].
Реминил обладает благоприятным профилем переносимости. Единственной группой побочных эффектов с незначительным превышением частоты их выраженности по сравнению с плацебо являются гастроинтестинальные побочные явления [15, 41, 50, 58]. Следует отметить, что они наблюдаются при приеме всех ингибиторов ацетилхолинэстеразы, что связано с ацетилхолиновой стимуляцией в головном мозге. Тошнота и рвота являются результатом активации допаминпродуцирующих холинергических нейронов гипоталамуса. Избежать их возникновения можно при постепенном увеличении дозы. Четырехнедельное наращивание дозы реминила [50] по сравнению с быстрым в течение 1 нед [41] позволило снизить частоту возникновения тошноты с 37 до 17%, рвоты – с 21 до 10% [24].
Одним из возможных побочных эффектов при назначении ингибиторов ацетилхолинэстеразы могут быть нарушения сна, возникающие вследствие слишком высокого ночного уровня ацетилхолина. Проведен ретроспективный анализ результатов 3 ранее проведенных рандомизированных двойных слепых контролируемых плацебо исследований [41, 50, 58] по эффективности реминила в отношении нарушений сна у больных БА. Всего анализ включал 1698 больных, из которых 705 человек получали реминил в дозе 24 мг/сут, 279 – 16 мг/сут, 714 пациентов составили группу плацебо [49]. Частота наблюдаемых нарушений сна была сопоставима во всех группах, и не было выявлено статистически значимых различий между реминилом и плацебо, за исключением кошмарных сновидений (однако с учетом низкой частоты их роль не определена). Эти результаты демонстрируют поддержание высокой гигиены сна во время терапии реминилом.
Традиционной формой реминила являлась таблетированная (назначается 2 раза в день). Однако совсем недавно была разработана новая капсульная форма пролонгированного действия. Капсулы пролонгированного действия состоят из жесткой капсулы, в которой содержатся гранулы белого цвета. Гранулы в свою очередь состоят из нескольких слоев. Наружный слой содержит реминил немедленного высвобождения (25%) и пленку, а сферы состоят из pH стабильного желатина, сахарозы и крахмала, что обеспечивает медленное/постепенное высвобождение реминила. Постепенное выделение препарата в течение продолжительного периода времени позволяет назначать препарат 1 раз в сутки. Капсулы реминила имеют сходный фармакокинетический профиль с таблетками, которые назначают 2 раза в день [44, 45]. Проведенные двойные слепые исследования показали, что эффективность таблетированной и пролонгированной форм реминила сопоставимы у больных с легкой и средней степенями тяжести БА. Побочные явления встречались с сопоставимой частотой при приеме плацебо, таблеток и капсул реминила [9]. При назначении капсул реминила также необходимо постепенное титрование дозы, которое позволяет снизить риск развития побочных эффектов [47].
Использование такой формы реминила имеет много преимуществ. Прежде всего отмечается повышение комплаентности больных. Поскольку основной проблемой при БА являются нарушения памяти, больные часто забывают принять препарат, могут злоупотреблять им, изменять схему лечения и дозировку. Назначение препаратов с однократным приемом позволяет избежать большинства этих проблем. Такая форма реминила является препаратом выбора для одиноких больных или при наличии минимального ухода [16].
Поскольку капсулы реминила созданы таким образом, что идет постепенное выделение препарата в течение продолжительного времени, пиковая концентрация в плазме ниже и достигается за более длительный период. Уровень ацетилхолина в плазме крови повышается постепенно по сравнению с таблетированной формой в соответствии с естественным изменением уровня ацетилхолина в плазме крови в течение дня в зависимости от ритма сна и бодрствования. Реминил в капсулах является биоэквивалентным таблетированной форме в аналогичной дозировке [59].
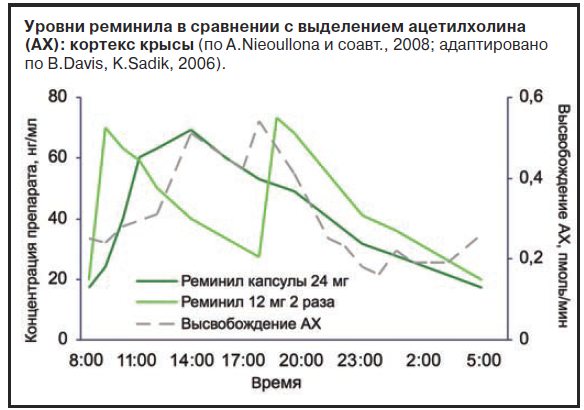
При использовании пролонгированных капсул реминила главным фармакокинетическим преимуществом является то, что концентрация в плазме крови снижается в вечернее время чуть более значительно по сравнению с таблетированной формой (см. рисунок) [10]. Таким образом, концентрация препарата в крови более точно соответствует суточному ритму выделения ацетилхолина (высокие концентрации во время бодрствования и низкие – в ночное время). При этом принимать препарат нужно утром. Это оказывает потенциальные положительные эффекты на сон, память и, возможно, ажитацию в вечернее время.
Проведено рандомизированное двойное слепое контролируемое плацебо исследование эффективности и безопасности реминила в виде капсул пролонгированного действия при лечении пациентов БА легкой и средней степени тяжести (GAL-INT-10) [9]. Исследование включало 971 больного, из которых 320 получали реминил в капсулах в дозе 16–24 мг, 327 – реминил в таблетках в дозе 16–24 мг/сут и 324 – плацебо. Препарат назначался на протяжении 26 нед после 4-недельного подбора дозы. Результаты продемонстрировали, что безопасность и эффективность капсул эквивалентна таковой препарату у таблетированной формы. На фоне приема капсул отмечалась достоверно более низкая частота развития побочных эффектов и их продолжительность была достоверно меньше [8]. Прием капсул реминила с пищей приводит к уменьшению частоты гастроинтестинальных проблем. Пища приводит к отсрочке достижения максимальной концентрации и не влияет на другие фармакокинетические параметры [44].
Таким образом, данные проведенных фармакологических, нейрофизиологических и клинических исследований подтверждают связь нарушений циркадных ритмов с центральной холинергической нейротрансмиссией, подчеркивают ее роль в осуществлении процессов сна и памяти. При нарушениях холинергической иннервации, которые являются значимыми при БА, целесообразно использовать ингибиторы ацетилхолинэстеразы, в частности реминил, что приводит к значительному регрессу когнитивных и поведенческих нарушений, нормализации цикла сон–бодрствование. Появление реминила пролонгированного действия упрощает схему приема препарата, в большей степени согласуется с физиологическими ритмами ацетилхолина, имеет более благоприятный профиль переносимости при эффективности, эквивалентной таблетированной форме, что позволяет рекомендовать его для широко использования у больных с деменцией.
Однако возможно развитие тяжелой формы когнитивного дефицита, которая обозначается как деменция. В большинстве случаев когнитивные нарушения сопровождаются развитием нейропсихиатрических и поведенческих расстройств, которые в значительно большей мере нарушают повседневную активность и затрудняют ведение таких пациентов.
Наиболее распространенной причиной развития деменции во всем мире в настоящее время является болезнь Альцгеймера (БА). Примерно в 60% случаев она является причиной развития тяжелых когнитивных нарушений. Распространенность БА в США достигает 8% среди лиц старше 65 лет. В дальнейшем прогнозируется увеличение числа больных (к 2050 г. почти в 5 раз) [22].
Вопрос о патогенетических процессах, в частности нарушении нейротрансмиттерной передачи, лежащих в основе когнитивного снижения, до конца не ясен. Наиболее общепринятой является концепция расстройства холинергической иннервации [7, 11, 12]. Показано, что степень нарушения холинергической системы коррелирует с тяжестью когнитивного дефицита [18].
Ацетилхолин является одним из наиболее исследованных нейротрансмиттеров. Ацетилхолин известен как нейротрансмиттер с 1914 г. Однако только через 15 лет были получены сведения, позволившие идентифицировать холинергические нейроны [55]. Ацетилхолин является преимущественно возбуждающим медиатором, хотя в ряде случаев он выступает как тормозной [3].
Ацетилхолин – один из наиболее изученных нейромедиаторов как регулятор двигательных процессов, однако его функции в деятельности головного мозга требуют дальнейших исследований [1].
Ацетилхолин представляет собой низкомолекулярный трансмиттер, который синтезируется при участии холинацетилтрансферазы. Нервная ткань не может синтезировать холин, и его источником является пища, а далее он доставляется через гематоэнцефалический барьер [52].
В головном мозге холинергические нейроны локализованы преимущественно в медиальном ядре перегородки, базальных гигантоклеточных ядрах (супраоптическое и паравентрикулярное), диагональной связке. Нейроны медиального ядра перегородки (Ch1) и диагональной связки (Ch2, Ch3) проецируются на медиальное ядро уздечки и интерпедункулярное ядро. Также они имеют связи с гиппокампом и обонятельными луковицами.
В области базальных ядер (Ch4), в частности ядра Мейнерта, холинергические нейроны составляют примерно 90%. Аксоны этих нейронов проецируются на кору больших полушарий, таламус, гиппокамп, амигдалу и ряд других областей. Они связаны афферентными волокнами с субкортикальной диэнцефальной областью и лимбико-паралимбической корой. Базальные ганглии играют роль своеобразной ретрансляционной станции между лимбической системой и новой корой [55]. Холинергические нейроны обнаружены также в полосатом теле, в прилежащем ядре [3].
Кроме того, две группы холинергических нейронов расположены в ядрах моста (педункуло-понтийное ядро Ch5 и латерально-дорсальное покрышечное ядро Ch6) и, осуществляя холинергическую иннервацию ствола и таламуса, они рассматриваются как часть восходящей ретикулярной системы [55].
Холинергические нейроны мозга наряду с их приоритетной ролью в осуществлении когнитивных функции, в первую очередь памяти и обучения, участвуют в регуляции движений. Альфа- и гамма-мотонейроны глазодвигательного, блокового, тройничного, отводящего, лицевого, языкоглоточного, блуждающего, добавочного, подъязычного, черепных и спинальных нервов являются холинергическими [55]. Также к холинергическим относятся преганглионарные и парасимпатическая часть постганглионарных нейронов вегетативной нервной системы.
В ретикулярной формации холинергические нейроны принимают участие в осуществлении контроля за ритмом сон–бодрствование [3]. Особое значение имеют нейроны педункуло-понтийного и латерально-дорсального покрышечного ядер среднего мозга, которые играют важную роль в обеспечении активации коры во время бодрствования и REM-фазы сна. Нейроны базальных ганглиев, в том числе и ядра Мейнерта, также принимают участие в этих процессах. Они проецируются преимущественно на церебральную кору, где способствуют повышению коркового ответа на входящие сенсорные стимулы [25].
Содержание нейротрансмиттеров не является стабильным показателем и имеет определенные суточные колебания. Важно то, что циркадные ритмы эндогенны и могут существовать независимо от окружающей среды [40]. Для осуществления им требуются пейсмекеры или «внутренние часы». Одними из таких часов являются супрахиазмальные ядра переднего гипоталамуса [21, 36]. Интересно, что время запуска этих ритмов может быть изменено (например, у лиц, работающих ночью) [4, 25].
Циркадный ритм включает состояние бодрствования и сон, который подразделяется на фазы медленного и парадоксального сна (REM-фаза). Фазы сна циклически меняются в течение ночи. У взрослого человека чередование фаз сна происходит примерно каждые 90–100 мин.
Существуют определенные циркадные ритмы выделения нейротрансмиттеров. Во время бодрствования доминирующими являются норадренергическая и серотонинергическая системы, однако гистаминергическая и холинергическая системы также активны. Ближе к ночи не только возрастает продукция ацетилхолина и гистамина, но и достигает максимума чувствительность М-холинорецепторов и Н2-рецепторов [28, 43].
Роль ацетилхолина подтверждена экспериментально. Микроинъекции агониста ацетилхолина в область ядер моста приводят к увеличению периода REM-сна. Введение же мускарина приводит к редукции медленноволнового сна [48].
Оказалось, что из всех известных активирующих мозговых систем, которые включаются при пробуждении и действуют во время бодрствования, в парадоксальном сне активны лишь одна-две. В REM-фазе сна функционируют лишь системы, локализованные в ретикулярной формации ствола и использующие в качестве медиатора ацетилхолин.
Существуют данные о том, что REM-сон облегчает процессы обучения и памяти [25]. Во время быстрого сна клетки мозга активны, однако отсутствует афферентная информация от органов чувств, так же как и нет эфферентной импульсации на двигательную систему. В связи с этим этот сон называют парадоксальным. В этой фазе сна происходит обработка информации, полученной ранее и хранящейся в памяти. Во время сна происходит консолидация следа в памяти, т.е. процесс долговременного запоминания информации (длится от 1 до 24 ч после предъявления стимула). Исследования здоровых волонтеров показали, что депривация сна оказывает негативное влияние на процессы консолидации памяти [35].
Долговременную память подразделяют на декларативную и процедурную. Декларативная память представляет собой память о фактах (память о том, «что»), процедурная память отвечает за приобретение и удержание разных навыков деятельности (память о том, «как»). Долговременная память обеспечивается структурами гиппокампового круга и их связями с мамиллярными телами и медиобазальными отделами лобных долей головного мозга. Декларативная память больше связана с гиппокампом и префронтальной корой, процедурная – со структурами стриатума. Разные виды памяти доминируют в разных фазах сна. В REM-фазу сна в большей мере осуществляется недекларативная память [19].
В процессе запоминания происходит активное взаимодействие неокортекса и гиппокампальных структур, которое по механизму обратной связи контролируется высвобождением ацетилхолина [39]. Это подтверждалось введением ингибитора холинэстеразы здоровым волонтерам во время фазы медленного сна, которое приводило к значительным нарушениям декларативной памяти в связи с повышением уровня ацетилхолина [20].
Старение прогрессивно сопровождается нарушением циркадных ритмов: например, у пожилых отмечается тенденция ложиться спать раньше и вставать раньше. Сон в течение ночи становится беспокойным [53]. Также с возрастом увеличивает количество других факторов, которые могут приводить к расстройствам сна (например, синдром беспокойных ног, апноэ во сне и др.).
При развитии деменции, например при БА, отмечается утрата холинергических нейронов, в первую очередь в области базальных ганглиев. У больных БА отмечается снижение уровня ацетилхолина в субарахноидальном пространстве и цереброспинальной жидкости, коррелирующее с тяжестью когнитивного дефицита, а также снижение количества и функциональной активности (на 50–90%) холинацетилтрансферазы, обеспечивающей синтез ацетилхолина [5].
Основным клиническим признаком БА является развитие грубого когнитивного дефицита. У ряда больных БА описывается усиление проявления симптомов во второй половине дня, вечером или ночью [26]. Существует предположение, что этот феномен связан с нарушением циркадных ритмов. У этих больных отмечается большее нарушение цикла сон–бодрствование, чем у здоровых индивидуумов аналогичного возраста. Отмечается задержки фаз циркадного цикла, сон в дневное время, беспокойство в ночное время. Могут быть изменения структуры ночного сна, становятся короче медленный сон, REM-фаза, чаще пробуждения, выше ночная локомоторная активность. Эти нарушения нарастают по мере прогрессирования заболевания [33, 34].
Нарушения циркадного ритма у больных БА часто лежат в основе развития поведенческих нарушений, приводят к увеличению психологического дистресса у ухаживающих лиц, могут явиться одной из причин для помещения пациента в специализированное учреждение [29, 38]. В связи с этим нарушения цикла сон–бодрствование у больных БА требуют прицельной коррекции.
Улучшение паттерна ночного сна возможно прежде всего путем увеличения физической активности и социальных отношений, уменьшения сна в дневное время. Большое значение имеет фототерапия с регуляцией уровня освещенности в разное время суток, который влияет на циркадные ритмы через воздействие на ретиногипоталамический тракт [25]. Эффективность фототерапии продемонстрирована во многих исследованиях [14, 17].
Еще одним направлением терапии нарушений циркадного ритма у больных БА является использование мелатонина. В двойном слепом исследовании мелатонин по сравнению с плацебо достоверно увеличивал продолжительность ночного сна и снижал ночную активность [6]. Однако результаты и эффективность фототерапии и возможности использования мелатонина еще требуют дальнейших исследований.
Абсолютно доказанной является эффективность использования ингибиторов ацетилхолинэстеразы, которые благодаря ингибированию гидролиза ацетилхолина в синаптической щели повышают его уровень и усиливают центральную холинергическую передачу [22, 51].
Назначение ингибиторов ацетилхолинэстеразы приводит к значительным когнитивным и поведенческим положительным эффектам. Поскольку нарушения холинергической нейротрансмиссии играют большую роль в формировании нарушений сна, препараты данной группы эффективны при необходимости восстановления цикла сон–бодрствование. Сохранность циркадных ритмов необходима для осуществления процессов консолидации памяти, и поэтому их нормализация будет иметь большое значение в восстановлении и сохранности когнитивных функций.
Активация холинергических нейронов связана с быстрым нарастанием концентрации ацетилхолина под воздействием препаратов. Однако в связи с тем что деменция является хроническим состоянием, быстрое увеличение дозы не рекомендуется.
Группа ингибиторов ацетилхолинестеразы включает 3 препарата: донепезил, ривастигмин и галантамин (реминил). Отличительной особенностью реминила является сочетание двух механизмов действия – ингибирование ацетилхолинэстеразы и аллостерическая модуляция никотиновых рецепторов. Благодаря аллостерической модуляции Н-холинорецепторов их активация достигается при более низких концентрациях ацетилхолина, что уменьшает риск потери чувствительности Н-холинорецепторов и формирования толерантности, а также уменьшает риск развития побочных явлений, благодаря чему достигается хорошая переносимость реминила [46, 54].
Никотиновые рецепторы играют важную роль в осуществлении когнитивной, поведенческой и двигательной функций и кровообращении в головном мозге [31, 32, 37]. Модуляция Н-холинорецепторов приводит к нормализации высвобождения разных нейромедиаторов (ацетилхолина, глутамата, допамина, норэпинефрина, серотонина и g-аминомасляной кислоты) и, соответственно, нормализации функций разных нейротрансмиттерных систем. Это оказывает выраженное положительное влияние не только на когнитивные функции, но и на психологические и поведенческие компоненты деменции [27].
Реминил обладает благоприятным профилем переносимости. Единственной группой побочных эффектов с незначительным превышением частоты их выраженности по сравнению с плацебо являются гастроинтестинальные побочные явления [15, 41, 50, 58]. Следует отметить, что они наблюдаются при приеме всех ингибиторов ацетилхолинэстеразы, что связано с ацетилхолиновой стимуляцией в головном мозге. Тошнота и рвота являются результатом активации допаминпродуцирующих холинергических нейронов гипоталамуса. Избежать их возникновения можно при постепенном увеличении дозы. Четырехнедельное наращивание дозы реминила [50] по сравнению с быстрым в течение 1 нед [41] позволило снизить частоту возникновения тошноты с 37 до 17%, рвоты – с 21 до 10% [24].
Одним из возможных побочных эффектов при назначении ингибиторов ацетилхолинэстеразы могут быть нарушения сна, возникающие вследствие слишком высокого ночного уровня ацетилхолина. Проведен ретроспективный анализ результатов 3 ранее проведенных рандомизированных двойных слепых контролируемых плацебо исследований [41, 50, 58] по эффективности реминила в отношении нарушений сна у больных БА. Всего анализ включал 1698 больных, из которых 705 человек получали реминил в дозе 24 мг/сут, 279 – 16 мг/сут, 714 пациентов составили группу плацебо [49]. Частота наблюдаемых нарушений сна была сопоставима во всех группах, и не было выявлено статистически значимых различий между реминилом и плацебо, за исключением кошмарных сновидений (однако с учетом низкой частоты их роль не определена). Эти результаты демонстрируют поддержание высокой гигиены сна во время терапии реминилом.
Традиционной формой реминила являлась таблетированная (назначается 2 раза в день). Однако совсем недавно была разработана новая капсульная форма пролонгированного действия. Капсулы пролонгированного действия состоят из жесткой капсулы, в которой содержатся гранулы белого цвета. Гранулы в свою очередь состоят из нескольких слоев. Наружный слой содержит реминил немедленного высвобождения (25%) и пленку, а сферы состоят из pH стабильного желатина, сахарозы и крахмала, что обеспечивает медленное/постепенное высвобождение реминила. Постепенное выделение препарата в течение продолжительного периода времени позволяет назначать препарат 1 раз в сутки. Капсулы реминила имеют сходный фармакокинетический профиль с таблетками, которые назначают 2 раза в день [44, 45]. Проведенные двойные слепые исследования показали, что эффективность таблетированной и пролонгированной форм реминила сопоставимы у больных с легкой и средней степенями тяжести БА. Побочные явления встречались с сопоставимой частотой при приеме плацебо, таблеток и капсул реминила [9]. При назначении капсул реминила также необходимо постепенное титрование дозы, которое позволяет снизить риск развития побочных эффектов [47].
Использование такой формы реминила имеет много преимуществ. Прежде всего отмечается повышение комплаентности больных. Поскольку основной проблемой при БА являются нарушения памяти, больные часто забывают принять препарат, могут злоупотреблять им, изменять схему лечения и дозировку. Назначение препаратов с однократным приемом позволяет избежать большинства этих проблем. Такая форма реминила является препаратом выбора для одиноких больных или при наличии минимального ухода [16].
Поскольку капсулы реминила созданы таким образом, что идет постепенное выделение препарата в течение продолжительного времени, пиковая концентрация в плазме ниже и достигается за более длительный период. Уровень ацетилхолина в плазме крови повышается постепенно по сравнению с таблетированной формой в соответствии с естественным изменением уровня ацетилхолина в плазме крови в течение дня в зависимости от ритма сна и бодрствования. Реминил в капсулах является биоэквивалентным таблетированной форме в аналогичной дозировке [59].

При использовании пролонгированных капсул реминила главным фармакокинетическим преимуществом является то, что концентрация в плазме крови снижается в вечернее время чуть более значительно по сравнению с таблетированной формой (см. рисунок) [10]. Таким образом, концентрация препарата в крови более точно соответствует суточному ритму выделения ацетилхолина (высокие концентрации во время бодрствования и низкие – в ночное время). При этом принимать препарат нужно утром. Это оказывает потенциальные положительные эффекты на сон, память и, возможно, ажитацию в вечернее время.
Проведено рандомизированное двойное слепое контролируемое плацебо исследование эффективности и безопасности реминила в виде капсул пролонгированного действия при лечении пациентов БА легкой и средней степени тяжести (GAL-INT-10) [9]. Исследование включало 971 больного, из которых 320 получали реминил в капсулах в дозе 16–24 мг, 327 – реминил в таблетках в дозе 16–24 мг/сут и 324 – плацебо. Препарат назначался на протяжении 26 нед после 4-недельного подбора дозы. Результаты продемонстрировали, что безопасность и эффективность капсул эквивалентна таковой препарату у таблетированной формы. На фоне приема капсул отмечалась достоверно более низкая частота развития побочных эффектов и их продолжительность была достоверно меньше [8]. Прием капсул реминила с пищей приводит к уменьшению частоты гастроинтестинальных проблем. Пища приводит к отсрочке достижения максимальной концентрации и не влияет на другие фармакокинетические параметры [44].
Таким образом, данные проведенных фармакологических, нейрофизиологических и клинических исследований подтверждают связь нарушений циркадных ритмов с центральной холинергической нейротрансмиссией, подчеркивают ее роль в осуществлении процессов сна и памяти. При нарушениях холинергической иннервации, которые являются значимыми при БА, целесообразно использовать ингибиторы ацетилхолинэстеразы, в частности реминил, что приводит к значительному регрессу когнитивных и поведенческих нарушений, нормализации цикла сон–бодрствование. Появление реминила пролонгированного действия упрощает схему приема препарата, в большей степени согласуется с физиологическими ритмами ацетилхолина, имеет более благоприятный профиль переносимости при эффективности, эквивалентной таблетированной форме, что позволяет рекомендовать его для широко использования у больных с деменцией.
27 августа 2009
Количество просмотров: 3165

