Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2009
Нейрофизиологическое и психофизиологическое изучение терапии Афобазолом больных с тревожными расстройствами №03 2009
Лечение тревожных расстройств в значительной части случаев требует продолжительного применения анксиолитиков. Наиболее распространенные анксиолитики бензодиазепиновой структуры имеют ограничения по длительности применения в связи с развитием нежелательных побочных явлений (седация, миорелаксация, негативное влияние на когнитивные процессы) и формированием лекарственной зависимости и синдрома отмены. Новый отечественный препарат Афобазол, разработанный в НИИ фармакологии РАМН на основе оригинальной фармакогенетической концепции анксиолитического эффекта [10, 11], относится к группе так называемых селективных анксиолитиков и характеризуется отсутствием побочных эффектов, свойственных бензодиазепиновым транквилизаторам. Афобазол является производным 2меркаптобензимидазола и не относится к классу агонистов бензодиазепиновых рецепторов. Его действие препятствует развитию связанных с тревогой мембранозависимых изменений в ГАМК-рецепторе, что повышает доступность соответствующего эндогенного лиганда. Действие препарата проявляется в виде сочетания анксиолитического и активирующего эффектов, не сопровождающихся гипноседативными эффектами. Седативное действие выявляется в дозах, в 40–50 раз превышающих ED50 для анксиолитического действия. При клиническом изучении Афобазола подтверждены экспериментальные данные об избирательности анксиолитического действия препарата в сочетании со стимулирующим компонентом при отсутствии седативного, миорелаксантного эффектов и негативного влияния на память и другие когнитивные функции [7, 12]. Сравнительные клинические исследования Афобазола показали его высокую эффективность при лечении тревожных расстройств, сопоставимую с таковой типичного бензодиазепинового анксиолитика диазепама, отсутствие значимых побочных эффектов, хорошую переносимость и отсутствие синдрома отмены при прекращении терапии [2, 3, 6, 8].
Установленные в эксперименте и при клиническом изучении свойства Афобазола свидетельствуют об адекватности его применения для длительного лечения больных с тревожными расстройствами. Несмотря на то что клинические показания к назначению анксиолитиков, в том числе и Афобазола, достаточно детально разработаны, проблема эффективности препарата и чувствительности/резистентности к терапии требует дальнейшего изучения и поиска соответствующих маркеров. Это обусловлено множественностью и комплексностью факторов, определяющих чувствительность больных к действию препаратов, среди которых высока вероятность влияния биологических, которые в рамках клинических исследований не могут учитываться в полной мере. Особенно большое значение эта проблема приобретает при необходимости длительной терапии для решения вопроса ее отмены или продолжения. Опыт нейрофизиологического и психофизиологического изучения разных психотропных препаратов (анксиолитики, антидепрессанты, ноотропы), накопленный в отделе пограничной психиатрии ГНЦ социальной и судебной психиатрии им. В.П.Сербского, свидетельствует о том, что соответствующие показатели, обнаруживая в ходе лечения выраженные изменения при высокой эффективности и их слабую реакцию или ее отсутствие при низкой, могут количественно отражать степень резистентности больных к терапии. На этой основе могут быть получены объективные неклинические показатели фармакореактивности больных, отражающие чувствительность к конкретным психотропным средствам и их прогностическую эффективность. Вероятно, что фармакореактивность, проявляющаяся в изменениях нейрофизиологических и психофизиологических показателей, является отражением фундаментального свойства мозга – его нейропластичности, которая интерпретируется как способность мозга к функциональной и структурной адаптации в условиях воздействия различных, в том числе фармакологических, факторов [1, 5, 13, 14]. Проведенное исследование Афобазола базировалось на выявленной ранее общей закономерности в динамике нейрофизиологических и психофизиологических показателей, предполагающей различие больных в плане фармакореактивности и связь показателей фармакореактивности с терапевтической чувствительностью/резистентностью к препарату.
Цель исследования – установить роль фактора терапевтической устойчивости в формировании динамики нейрофизиологических, психофизиологических и вегетологических показателей (биологических объективных показателей) в процессе длительного (42 дня) лечения Афобазолом больных с тревожными расстройствами.
Задачи исследования: а) анализ общего характера и направленности изменения показателей в процессе терапии Афобазолом; б) сравнительный анализ динамики показателей у больных с разной устойчивостью к терапии Афобазолом; в) выяснить роль выраженности изменения показателей как коррелята устойчивости к терапии.
Материалы и методы
Исследованы 13 больных с тревожными расстройствами в возрасте от 18 до 55 лет, наблюдавшихся клиницистами отдела пограничной психиатрии в процессе лечения Афобазолом и отобранных для терапии на основе клинических критериев. У больных отсутствовали выраженные изменения фоновой электроэнцефалограммы (ЭЭГ), включая очаговые, эпилептиформные и пароксизмальные, а также нарушения ритма сердца. Стандартизированная схема исследования больных включала следующие этапы: 1) фон до начала терапии после отмены психотропных препаратов на 7-е сутки; 2) через 1,5–2 ч после приема однократной дозы Афобазола 10 мг; 3) 7-е сутки терапии (30 мг/сут); 4) 21-е сутки терапии (30 мг/сут); 5) 42-е сутки терапии (30 или 60 мг/сут). Терапия Афобазолом проводилась с использованием суточной дозы препарата 30 мг внутрь, распределенной в течение дня на 3 приема по 10 мг. В случае малой эффективности лечения, определявшейся клиницистами после первых 3 нед, суточная доза повышалась до 60 мг (по 20 мг 3 раза). Факт повышения или сохранения исходной суточной дозы использовался в качестве критерия для разделения больных, соответственно, на устойчивых и чувствительных к действию Афобазола. Из 13 больных для анализа было оставлено 10 человек (2 мужчины и 8 женщин), прошедших все этапы обследования. Из них у 5 суточная доза не повышалась и у 5 повышалась, что явилось основанием для формирования 2 групп больных, соответственно, чувствительных и относительно устойчивых к терапии. В исследовании использовали метод количественной фармакоэлектроэнцефалографии (ФЭЭГ), комплекс психофизиологических тестов и вариационную пульсометрию на основе анализа R–R-кардиоинтервалов. В связи с высокой методической насыщенностью обследований при анализе влияния однократной дозы Афобазола использовалась только электроэнцефалографию как наиболее быстрый метод. На остальных этапах выполнялся весь комплекс методов. Регистрация ЭЭГ проводилась в состоянии бодрствующего покоя испытуемых монополярным способом от 16 электродов, расположенных по международной схеме 10–20 (О2-А2, Р4-А2, С4-А2, F4-А2, Fp2-A2, T6-A2, T4-A2, F8-A2, О1-А1, Р3-А1, С3-А1, F3-А1, Fp1-A1, T5-A1, T3-A1, F7A1). Запись осуществлялась при постоянной времени 0,3, фильтре высоких частот 70 Гц и режекторном фильтре 50 Гц, с частотой опроса сигнала 256. Продолжительность безартефактной записи, использующейся в дальнейшем анализе, составляла 120 с. Для всех отведений вычислялась с использованием быстрого Фурье-преобразования абсолютная мощность d-(1–3 Гц), θ-(4–7 Гц), a-(8–13 Гц), b1(14–20 Гц), b2-(21–30 Гц) и b3-(31–45 Гц) ритмов. Регистрацию и спектральный анализ ЭЭГ проводили на компьютерном электроэнцефалографе Neurotravel-24D (Ates Medica). ФЭЭГ-изучение действия Афобазола проводилось на основе оценки динамики ритмов ЭЭГ на этапах терапии в целом по группе и в подгруппах больных со стандартной и повышенной дозой препарата. Психофизиологическое исследование проводилось с использованием компьютеризированного психофизиологического комплекса КПФК-99 производства ЗАО ≪ВНИИМП-ВИТА≫. На базе комплекса оценивали показатели сенсомоторной активности – латентные периоды зрительномоторных реакций (мс); краткосрочной и оперативной памяти с определением ее продуктивности (количество правильных ответов) и временных параметров (среднего времени воспроизведения чисел и времени вычислений соответственно, в мс); внимания по тесту корректурной пробы с кольцами Ландольта с определением его объема (% правильных ответов, кроме выходящих по времени за 3) и концентрации (среднее время распознавания, мс). При вегетологическом исследовании использовался прибор ВНС-Спектр (Нейрософт), позволяющий анализировать вариабельность ритма сердца и ее динамику в процессе лечения. По данным 120–150 R–R-интервалов рассчитывались следующие показатели: средняя длительность интервалов (в мс), стандартное отклонение интервалов (в мс), коэффициент вариации, общая мощность R–R-спектра, отражающая суммарное регуляторное воздействие со стороны вегетативной системы на сердечныйритм, мощность низких частот спектра (0,04–0,15 Гц), связанных с активностью симпатического отдела вегетативной нервной системы, и мощность высоких частот спектра (0,15–0,40 Гц), отражающих активность парасимпатического отдела. Обработка данных всех методик осуществлялась по стандартной схеме с использованием программы дисперсионного анализа ANOVA для повторных событий при определении общегрупповых тенденций динамики показателей и ANOVA – при выяснении суммарных за период лечения изменений в подгруппах больных с разной чувствительностью к терапии.
Данные ЭЭГ
Дисперсионный анализ ЭЭГ в процессе лечения с использованием схемы ритм – полушарие – отведение выявил достоверную динамику ритмов ЭЭГ, характеризующую их изменения под влиянием Афобазола (рис. 1). Изменения d-ритма проявлялись постепенным, нарастающим к 42-м суткам, ослаблением его мощности, θ-ритма – близкой тенденцией с выходом максимум на 21-е сутки терапии, a-ритма – первоначальным его усилением при воздействии однократной тестовой дозы с последующей противоположной реакцией на 7–42-е сутки лечения, b1ритма – увеличением мощности на тестовой дозе и ее dснижением при курсовом лечении, b2 и b3 – сходной для ритмов выраженной реакцией повышения мощности на тестовой дозе с возвратом мощности ритмов при последующем лечении, практически до уровня фона. Анализ зависимости изменений от полушария мозга и отведения не выявил достоверного влияния этих факторов (табл. 1), что свидетельствует о генерализованномхарактере реакций ЭЭГ.
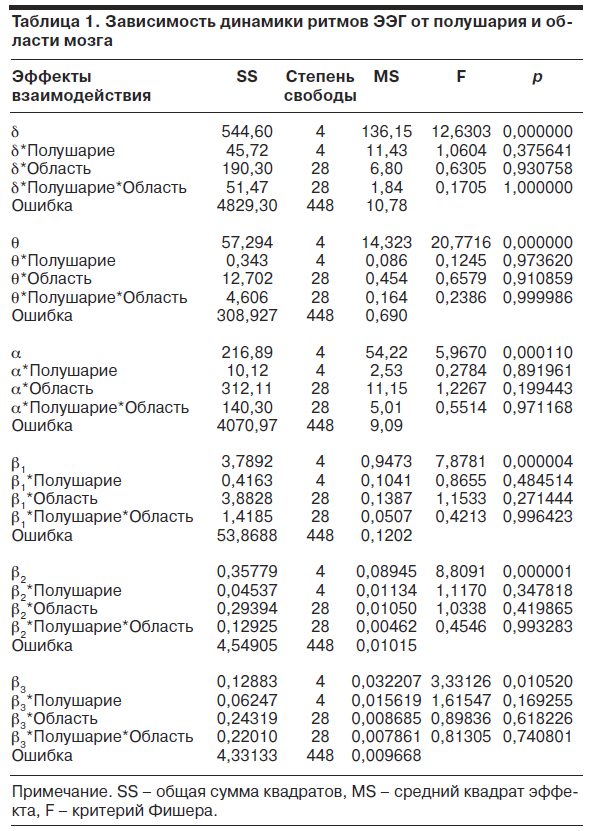
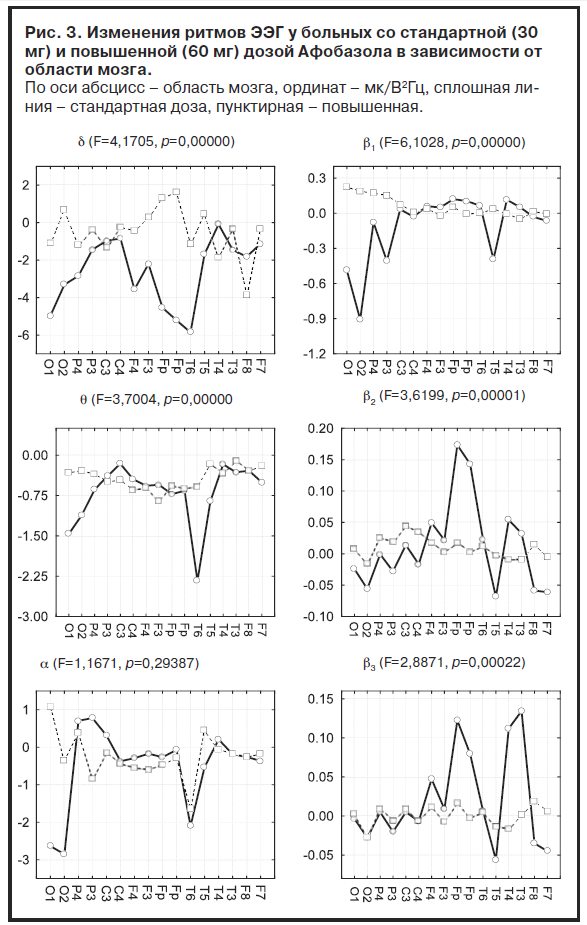
У больных с повышенной дозой препарата основной общей для всех ритмов тенденцией являлась приблизительно равномерная по отведениям относительно слабая реакция. В то же время у больных со стандартной дозой обнаруживались достоверно отличающие эту подгруппу отчетливые пространственные пики реакций: для d-ритма – снижение в затылочных, лобных полюсных и правой задневисочной областях (O2, O1, Fp2, Fp1, T6), для θ-ритма – снижение в затылочных и правой задневисочной областях (O2, O1, T6), для a-ритма – снижение в затылочных областях (O2, O1, взаимодействие недостоверно), для b1-ритма – также снижение в затылочных областях (O2, O1), для b2-ритма – повышение в лобных полюсных областях (Fp2, Fp1), для b3-ритма – повышение в лобных полюсных и средних височных отделах (Fp2, Fp1, T4, T3). Результаты анализа показали соответствие между клиническими оценками чувствительности/устойчивости к Афобазолу и показателями армакоэлектроэнцефалографической реактивности больных. Это соответствие проявлялось в том, что высокая чувствительность к терапии, несмотря на более низкую дозу препарата, сопровождалась выраженными реакциями ритмов ЭЭГ, в то время как низкая – их слабыми реакциями. При этом основное значение имеют не генерализованные (общемозговые) изменения ритмов, а их изменения в определенных корковых зонах – локальные реакции. В частности, типичное для действия бензодиазепиновых анксиолитиков усиление диапазона обнаруживается только в лобных полюсных отделах и характерно для чувствительных к Афобазолу больных.
Дисперсионный анализ (ANOVA для повторных событий) выявил ряд общегрупповых достоверных тенденций динамики психофизиологических показателей в процессе терапии Афобазолом (рис. 4). Основная тенденция проявлялась постепенным сокращением времени выполнения тестов на краткосрочную и оперативную память, а также внимание. Сокращался также латентный период сенсомоторных реакций, но данная тенденция носила обратимый характер, ослабевая к 42-м суткам лечения. Показатели продуктивности памяти и внимания изменялись в процессе терапии недостоверно. Полученные данные свидетельствуют об активирующем влиянии Афобазола на когнитивные процессы, что проявляется преимущественно в скорости их протекания, без закономерного изменения собственно функции запоминания и внимания. Суммарные эффекты Афобазола, вычисленные в подгруппах больных за весь период терапии, обнаружили более выраженные, однако недостоверные тенденции сокращения времени выполнения тестов на краткосрочную и оперативную память и уменьшения латентных периодов сенсомоторной реакции у больных со стандартной дозой препарата (табл. 2).
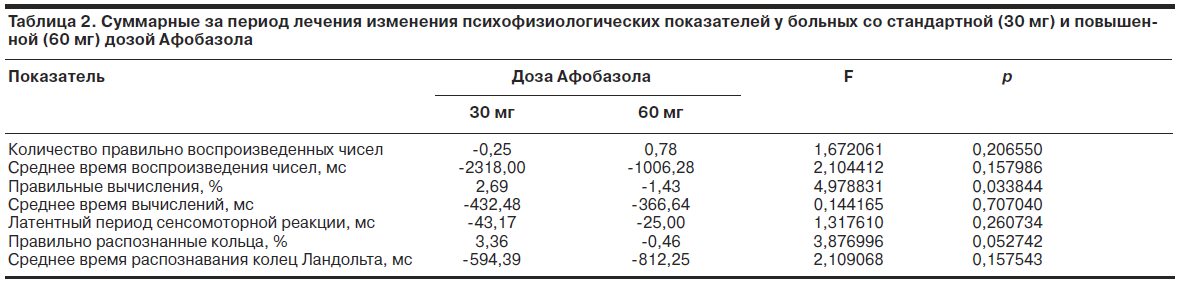
В то же время эту подгруппу больных характеризовали статистически достоверные отличия, проявляющиеся увеличением доли правильных вычислений и правильных распознаваний колец Ландольта, т.е. повышением продуктивности оперативной памяти и внимания. В целом психофизиологическое исследование выявило в качестве ведущей тенденции действия Афобазола активационный эффект, который у чувствительных к препарату больных преобладал и сопровождался повышением продуктивности оперативной памяти и внимания.
Результаты исследования вегетативного тонуса
Анализ динамики показателей ритма сердца по всей группе больных не выявил закономерного достоверного влияния Афобазола на вегетативный тонус (рис. 5).
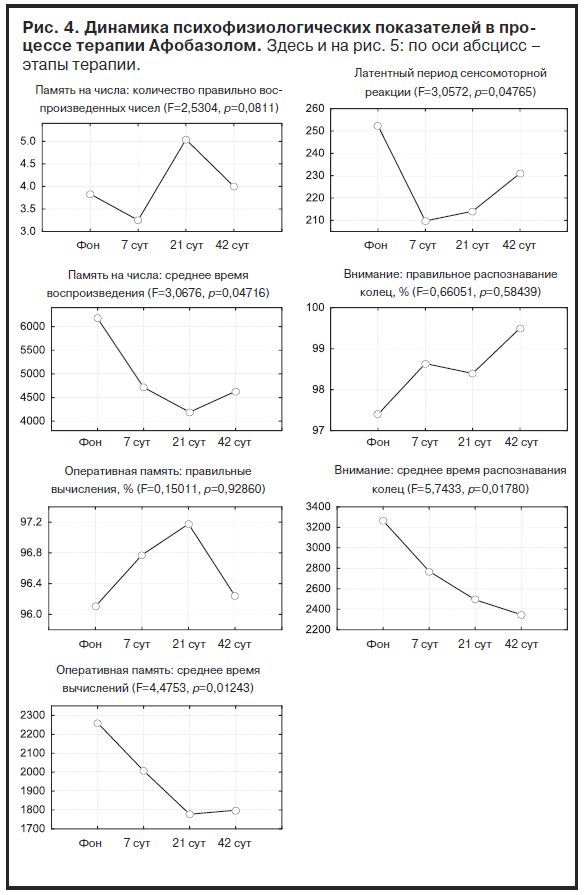
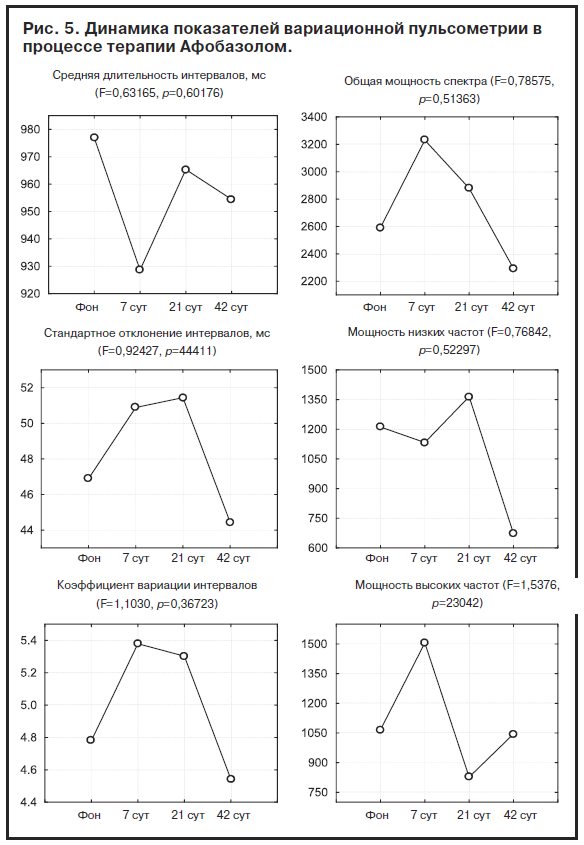
Однако оценка суммарных за период терапии изменений в подгруппах больных с разным уровнем доз препарата показала, что у больных с меньшей дозой Афобазола отмечается увеличение стандартного отклонения и коэффициента вариации интервалов, общей мощности спектра и мощности его низких частот, в то время как у больных с повышенной дозой изменения этих показателей имеют противоположную направленность (табл. 3).
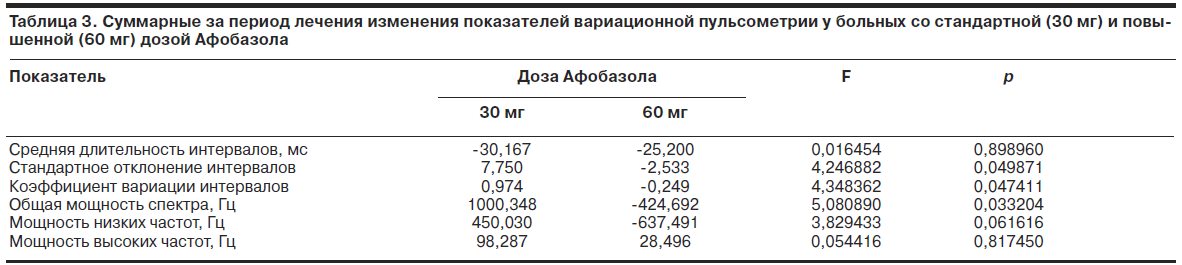
Межгрупповые различия достигали 5% уровня значимости, за исключением показателя мощности низких частот, где они были близки к этому уровню (p=0,062). Характер выявленных изменений свидетельствовал о том, что у чувствительных к Афобазолу пациентов в процессе терапии возрастает уровень регуляторных влияний на ритм сердца, что проявляется увеличением вариабельности кардиоинтервалов и общей мощности спектра с вероятной активацией симпатического отдела вегетативной нервной системы. У больных со сниженной чувствительностью к препарату регуляторные тенденции носят противоположную направленность.
Заключение
Анализ курсовой продолжительной терапии Афобазолом с использованием комплекса инструментальных методов диагностики позволил установить, что действие препарата проявляется типичным для других анксиолитиков усилением b-ритма в начале лечения. В процессе терапевтического улучшения состояния больных нарастают изменения активационного характера, проявляющиеся снижением мощности d- и θ-ритмов, повышением скорости сенсомоторных реакций и выполнения тестов на память и внимание. Вегетативный тонус при этом не обнаруживает значимых изменений. Динамика изученных показателей существенно отличалась у больных со стандартной суточной дозой Афобазола 30 мг (чувствительные к терапии пациенты) и повышенной из-за недостаточного клинического эффекта до60 мг (пациенты со сниженной чувствительностью). Таким образом, клиническая чувствительность/устойчивость больных к препарату находит отражение в объективных биологических показателях. Общим коррелятом при этом является большая выраженность транквилизирующего компонента и активационных изменений показателей в 1-й подгруппе больных, чем во 2-й. По информационной значимости изученные показатели ранжируются следующим образом: данные ЭЭГ, данные психофизиологического тестирования (когнитивные процессы), показатели вегетативного тонуса. В данных ЭЭГ основное значение имеют локальные перестройки спектра, психофизиологических – характеристики оперативной памяти и внимания. Полученные результаты свидетельствуют о возможности инструментальной оценки и прогноза эффективности терапии Афобазолом на основе анализа фармакочувствительности больных по данным нейрофизиологического и психофизиологического исследований.
Список исп. литературыСкрыть список1. Аведисова А.С. Нейропластичность и патогенез депрессии: новые данные. Психиат. и психофармакотер. 2004; 6 (6).
2. Аведисова А.С., Чахава В.О., Лесс Ю.Э., Малыгин Я.В. Новый анксиолитик «Афобазол» при терапии генерализованного тревожного расстройства (результаты сравнительного исследования с диазепамом). Психиат. и психофармакотер. 2006; 8 (3).
3. Аведисова А.С., Ахапкин Р.В. Эффективность и переносимость терапии афобазолом. Психиат. и психофармакотер. 2007; 9 (3).
4. Бочкарев В.К. Количественная электроэнцефалография в исследованиях действия психотропных средств. Фарматека. 2007; 7(142):28–32.
5. Изнак А.Ф. Нейрональная пластичность как один из аспектов патогенеза и терапии аффективных расстройств. Психиатрия и психофармакотерапия. 5(1).
6. Краснов В.Н., Вельтищев Д.Ю., Немцов А.В., Ивушкин А.А. Новые подходы к лечению стрессовых и тревожных расстройств: результаты многоцентрового исследования эффективности афобазола в психиатрической практике. Психиат. и психофармакотер. 2007;9 (4).
7. Незнамов Г.Г. Сюняков С.А., Чумаков Д.В. и др. Результаты клинического изучения селективного анксиолитика афобазол. Эксперимент и клин фармакол. 2001; 64 (2): 15–9.
8. Незнамов Г.Г., Сюняков С.А., Чумаков Д.В. и др. Новый анксиолитик афобазол: результаты сравнительного клинического исследования с диазепамом при генерализованном тревожном расстройстве. Психиат. и психофармакотер. 2006;8 (4).
9. Незнамов Г.Г., Сюняков С.А., Бочкарев В.К., Телешова Е.С. Клинические данные о терапевтическом действии и эффективности феназепама. Клинико-электроэнцефалографическая характеристика феназепама. В кн.: Феназепам. 25 лет в медицинской практике. М.: Наука, 2007; 254–73.
10. Серединин С.Б. Воронина Т.А., Незнамов Г.Г. и др. Фармакогенетическая концепция анксиоселективного эффекта. М.: Вестн. РАМН, 1998; 11: 3–9.
11. Середенин С.Б. Лекции по фармакогенетике. М.: Медицинское информационное агентство, 2004.
12. Чумаков Д.В. Клинико-фармакологическая характеристика нового анксиолитика афобазола. Дис. … канд. мед. наук. М., 2004.
13. Aberg ND, Bryve KG, Isgaard J. Aspects of growth hormone and insulin-like growth factor-I related to neuroprotection, regeneration and functional plasticity in the adult brain. Scientific World Journal 2006; 6: 53–80.
14. Duman RS. Neural plasticity: consequences of stress and actions of antidepressant treatment. Dialog Clin Neurosci. 2004; 6 (2): 157–69.
15. Itil TM. Quantitative pharmaco-electroencephalography. Use of computerized cerebral biopotentials in psychotropic drug research. Psychotropic Drugs and the Human EEG. Modern Problems of Pharmacopsychiatry. Ed. Itil
T.M. Basel: Karger, 1974; 43–75.
16. Saletu B. Pharmacodynamics and EEG. Advances in Pharmaco-EEG. Ed. Krijzer F., Herrmann W.M. IPEG, 1996; 187–204.

