Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2014
Оценка эффективности и переносимости купирующей терапии атипичных и типичных нейролептиков при шизофрении №02 2014
Номера страниц в выпуске:29-35
Наличие в отечественной клинической практике внушительного набора различных антипсихотиков, отличающихся по химическому строению и рецепторному профилю взаимодействий, определяет актуальность проблемы выбора оптимального средства для фармакотерапии больных с разными формами и стадиями шизофрении.
Резюме. Проведено натуралистическое сравнительное 8-недельное психофармакотерапевтическое исследование эффективности и переносимости купирующей антипсихотической монотерапии обострения шизофрении оланзапином (Парнасан 20 мг/сут) и галоперидолом (20 мг/сут). С учетом показателей эффективности и переносимости оланзапин (Парнасан) может рассматриваться в качестве препарата выбора для купирования острого психотического эпизода с преобладанием в клинической картине бредовых расстройств, подозрительности, симптомов тревоги и ажитации, а также при наличии первичных или вторичных негативных и депрессивных расстройств, в том числе у пациентов со склонностью к развитию экстрапирамидных расстройств. Применение оланзапина (Парнасана) способствует улучшению повседневного функционирования больных.
Ключевые слова: шизофрения, острый психоз, Парнасан, оланзапин.
Efficacy and tolerability of atypical and conventional antipsychotics in jugulate treatment of schizophrenia
V.E.Medvedev1, V.I.Frolova1, E.V.Gushanskaya1,2, A.U.Ter-Israelyan1,2
1Chair of Psychiatry, Psychotherapy and Psychosomatic pathology, People’s Friendship University of Russia; 2Psychiatric Hospital №13, Moscow
Summary. We’ve conducted naturalistic 8-week comparative study of efficacy and tolerability of jugulate antipsychotic monotherapy with olanzapine (Parnasan 20 mg per day) and haloperidole (20 mg per day) for schizophrenia exacerbation. Taking into account efficacy and tolerability olanzapine (Parnasan) can be considered as the drug of choice for acute exacerbation of schizophrenia with delusional symptoms, suspiciousness, anxiety and agitation and with primary and secondary negative and depressive symptoms in patients with extrapyramidal disorders. Olansapine (Parnasan) encourages better everyday functioning.
Key words: schizophrenia, acute psychosis, Parnasan, olansapine.
Наличие в отечественной клинической практике внушительного набора различных антипсихотиков, отличающихся по химическому строению и рецепторному профилю взаимодействий, определяет актуальность проблемы выбора оптимального средства для фармакотерапии больных с разными формами и стадиями шизофрении.
Данные рандомизированных исследований свидетельствуют о сопоставимости показателей эффективности антипсихотиков разных поколений. Однако накопленный опыт клинического применения нейролептиков противоречит представлению об их эквивалентности по всем основным параметрам, включая степень редукции симптомов острого психоза, в рамках любой дименсиональной категории шизофрении (позитивные, негативные, когнитивные, аффективные расстройства), а также спектру нежелательных эффектов. В связи с этим сохраняется необходимость восполнения и совершенствования научной информации в аспекте сравнительных характеристик различных антипсихотиков и подходов к дифференцировке показаний для назначения каждого из них. Для этих целей продолжают осуществляться натуралистические (в том числе масштабные: CATIE, SOHO [1, 2]) сравнительные исследования в условиях, приближенных к рутинной клинической практике.
В результате проведения большого количества исследований (II–III фазы) накоплены данные, которые свидетельствуют о значительной, по крайней мере не уступающей традиционным нейролептикам, эффективности оланзапина в отношении продуктивной (позитивной) симптоматики при лечении больных шизофренией [3–6]. Однако данные об эффективности генерического препарата Парнасан в сравнении с традиционными антипсихотиками в литературе не представлены.
Таким образом, актуальным становится проведение комплексного исследования, направленного на сравнительное изучение эффективности и толерантности купирующей терапии Парнасаном и нейролептиками I поколения острых психотических расстройств при шизофрении.
Цель натуралистического открытого сравнительного фармакотерапевтического исследования – сравнение эффективности и переносимости атипичной (оланзапин) и традиционной (галоперидол) антипсихотической терапии при купировании острого шизофренического психоза в стационарных условиях.
Препаратами сравнения были выбраны оланзапин (Парнасан) и классический нейролептик I поколения галоперидол, принципиально отличающиеся как по химической структуре, так и по спектру рецепторного взаимодействия. Галоперидол преимущественно блокирует D2-дофаминовые рецепторы [7] и s1-рецепторы [8]. Оланзапин также является антагонистом D2-дофаминовых рецепторов [9], а также 5-HT2A, 5-HT2C, 5-HT3, 5-HT6, 5-HT7-серотониновых и H1-гистаминовых рецепторов [10, 11].
Работа проведена в 2013–2014-е годы на базе отделений клинической базы кафедры психиатрии, психотерапии и психосоматической патологии ФПК МР РУДН (заведующая кафедрой – профессор Н.Л.Зуйкова), МБУЗ ГПБ №13 г. Москвы (главный врач – А.Ю.Исраелян).
Для уменьшения вероятности влияния соматической патологии в исследование включались больные, не обнаруживающие при физикальном и инструментальном обследованиях симптомов соматических заболеваний в стадии декомпенсации или в тяжелой степени. Возраст включения пациентов был также ограничен с целью уменьшения риска обострения или манифестации сопутствующих соматических, неврологических или эндокринологических заболеваний, климактерического синдрома.
Критерии исключения: регулярный прием любых психотропных препаратов (включая пролонгированные формы антипсихотиков, антидепрессантов) в течение 6 нед до госпитализации, индивидуальная непереносимость оланзапина или галоперидола в анамнезе; высокий суицидальный риск (по шкале суицидального риска), зависимость от психоактивных веществ, беременность, лактация; органическое поражение центральной нервной системы (эпилепсия, деменция, новообразования, рассеянный склероз и т.п.), пролактинзависимые новообразования (пролактинома гипофиза и рак молочной железы), феохромоцитома, сопутствующий прием агонистов дофамина.
Набор пациентов, удовлетворяющих критериям включения, осуществлялся попеременно в одну из 2 групп по 40 пациентов в каждой по мере поступления в стационар. В случае исключения пациента из исследования в связи с недостаточной эффективностью или плохой переносимостью терапии в исследование включался другой пациент – так, чтобы число завершивших исследование в обеих группах составило 40 пациентов.
Дозы препаратов. В основной группе больных купирование психоза проводилось оланзапином (Парнасан) в дозировке до 20 мг/сут внутрь; в группе сравнения – галоперидолом до 20 мг/сут внутрь. Титрация доз осуществлялась в обеих группах одинаково: 10 мг/сут препарата в 1-й день, 20 мг/сут – со 2-го дня терапии. Прием препарата осуществлялся 1–4 раза в сутки с учетом индивидуальной переносимости. Длительность терапии составляла 8 нед (56 дней).
Сопутствующая психотропная терапия исключалась. При возникновении легких экстрапирамидных расстройств (ЭПР) дополнительно в течение не более 7 дней допускалось назначение корректора (бипериден, циклодол). При сохранении ЭПР доза антипсихотика снижалась до индивидуально переносимой вплоть до отмены терапии и исключения пациента из исследования.
Оценка эффективности терапии проводилась на плановых визитах: неделя (Н) 0 (состояние до начала лечения), Н1, Н2, Н4, Н6, Н8.
Инструментами сравнения и основными критериями эффективности наряду с клинической оценкой являлись редукция симптоматики по шкалам PANSS и CGI. Для респондеров критериями эффективности купирующей терапии считалось снижение суммы баллов по подшкале позитивных расстройств PANSS на 50% и более. Для оценки влияния терапии на повседневное функционирование использовалась шкала функционирования GAF.
Безопасность и переносимостьтерапии оценивались на основании спонтанных жалоб больного, шкалы побочных эффектов (UKU) и данных клинических и параклинических соматических исследований, включающих регистрацию основных гемодинамических показателей, в том числе электрокардиография (ЭКГ), клинический и биохимический анализы крови, индекс массы тела.
Для изучения влияния терапии на вторичные негативные расстройства (нейролептическая депрессия, паркинсоническая заторможенность и др.) на каждом визите применялись шкалы HADS и Симпсона–Ангуса. Для сравнения влияния препаратов на когнитивные функции использовалась батарея специализированных тестов (тесты беглости речевых ответов, Струпа и на ассоциативные ряды).
Оценка результатов проводилась стандартными методами статистического анализа с использованием программы Statistica.
Общее число пациентов, включенных в основную группу, составило 50, в группу сравнения – 56. Из основной группы к моменту завершения исследования выбыли 10 (20%) пациентов, из группы сравнения – 16 (28,6%; р<0,001). Таким образом, как и предполагалось дизайном исследования, в окон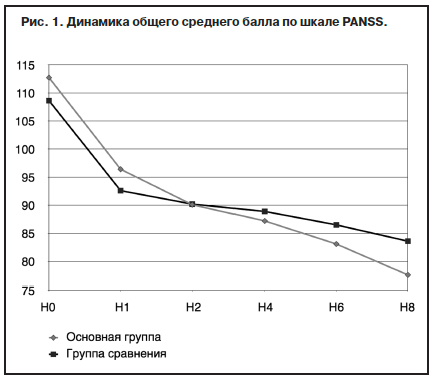 чательный анализ результатов были включены данные 40 больных из каждой группы. Отсутствие достоверных отличий по основным социодемографическим и клиническим показателям (табл. 1 и 2) позволяет рассчитывать на валидность полученных данных.
чательный анализ результатов были включены данные 40 больных из каждой группы. Отсутствие достоверных отличий по основным социодемографическим и клиническим показателям (табл. 1 и 2) позволяет рассчитывать на валидность полученных данных.
Эффективность терапии Среди пациентов, выбывших в основнй группе на 1–2-й неделе из-за неэффективности терапии, первый психотический эпизод регистрировался в 6 наблюдениях, повторный – в 4. Аналогичный показатель в группе сравнения составил 12 и 4 наблюдения соответственно. Согласно шкале CGI к окончанию терапии уменьшение тяжести состояния больного в основной группе достоверно превосходит таковой в группе сравнения (-14,9% vs -8,6%; р<0,05).
Число больных в «очень тяжелом» и «тяжелом» состоянии в основной группе к окончанию исследования снижается в обеих группах практически одинаково (-79,5% vs -83,5%). Число пациентов-респондеров по установленным в исследовании критериям в основной группе составило 30 (75%) наблюдений, в группе сравнения – 34 (85%). При этом оланзапин (Парнасан) оказался достоверно эффективнее у больных с первым психотическим эпизодом: 22 (75,9%) из 29 наблюдений (р<0,001), а галоперидол – с повторными обострениями: 23 (82,1%) из 28 наблюдений (р<0,001). В качестве одной из возможных причин неэффективности терапии у всех пациентов в группе оланзапина (Парнасан), не вошедших в число респондеров или выбывших до окончания исследования, следует выделить курение по 1–2 пачки сигарет в день. В литературе описан потенцирующий эффект табака на изоэнзим CYP1А2, ускоряющий метаболизм оланзапина и снижающий его концентрацию в плазме крови ниже ожидаемой [12, 13]. Динамика состояния больных по шкале PANSS представлена на рис. 1–4.
Как видно из рис. 1, снижение общего суммарного балла по шкале PANSS к окончанию 8-й недели лечения в основной группе (-31,1%) достоверно превосходит этот показатель в группе сравнения (-23%; р<0,001).
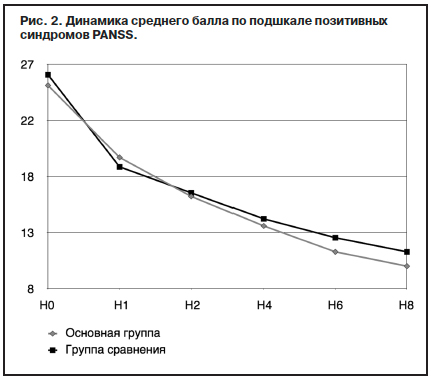
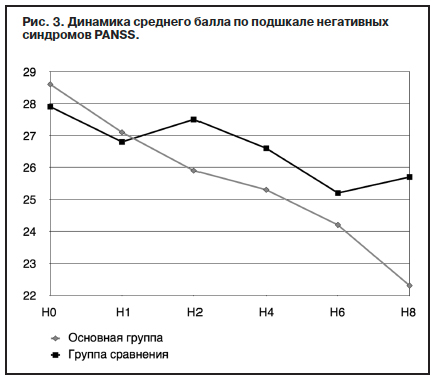
Из представленных на рис. 2 данных видно, что при купировании продуктивной симптоматики, начиная со 2-й недели терапии, применение оланзапина (Парнасана) на уровне тенденции превосходит терапию в группе сравнения. К окончанию исследования редукция баллов по подшкале продуктивной симптоматики PANSS в основной группе достигла 60,7%, в группе сравнения – 57,5%. Динамика негативных и когнитивных расстройств по шкале PANSS (рис. 3) отражает разнонаправленное действие антипсихотиков двух поколений.
При терапии оланзапином (Парнасаном) фиксируется непрерывное уменьшение выраженности негативных проявлений (на 22% за 8 нед), в то время как при применении галоперидола степень редукции расстройств составляет лишь 4,7% (р<0,001).
 При этом на фоне приема традиционного нейролептика на 2 и 8-й неделях лечения отмечается тенденция к увеличению выраженности негативной и когнитивной симптоматики. Последнее может быть обусловлено как непосредственным антагонизмом препарата к s1-рецепторам [14], снижением нейропластичности мозга и ухудшением когнитивных показателей [15], так и постепенным развитием нейролептической заторможенности и депрессии.
При этом на фоне приема традиционного нейролептика на 2 и 8-й неделях лечения отмечается тенденция к увеличению выраженности негативной и когнитивной симптоматики. Последнее может быть обусловлено как непосредственным антагонизмом препарата к s1-рецепторам [14], снижением нейропластичности мозга и ухудшением когнитивных показателей [15], так и постепенным развитием нейролептической заторможенности и депрессии.
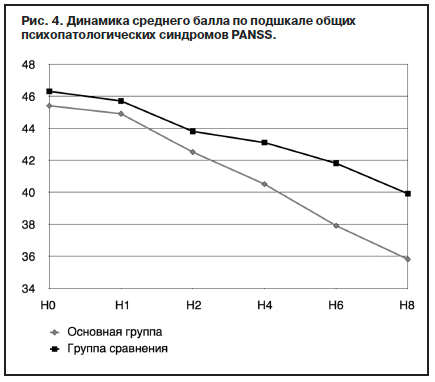
На это же указывают и результаты обследования пациентов по когнитивным тестам, шкалам HDRS, Симпсона–Ангуса и UKU. Влияние оланзапина (Парнасана) на общие (по PANSS) психопатологические симптомокомплексы статистически значимо превосходило галоперидол, начиная с 4-й недели терапии. К завершению исследования в основной группе средний балл редуцировался на 21%, в группе сравнения – на 13,8% (р<0,001).
Более детальная посимптомная (по PANSS) оценка спектра действия оланзапина и галоперидола представлена в табл. 3.
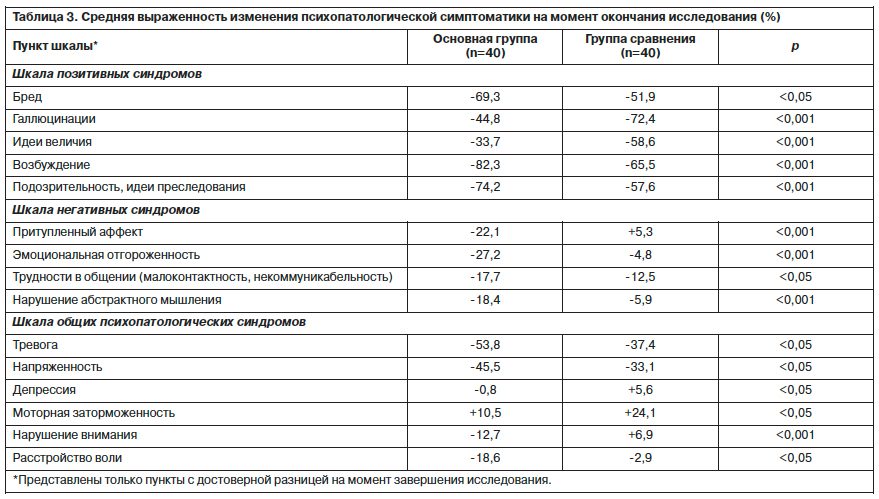
Между препаратами существовали различия в спектрах психотропной активности. Оланзапин (Парнасан) достоверно эффективнее купировал возбуждение, подозрительность, персекуторные бредовые идеи, тревогу и напряженность, уменьшал выраженность притупленного аффекта, эмоциональной отгороженности, некоммуникабельности, нарушений абстрактного мышления, внимания, воли, реже вызывал моторную заторможенность, симптомы депрессии. В то же время препарат в меньшей степени, чем галоперидол, нивелировал галлюцинаторную и парафренную симптоматику.
Переносимость терапии
ак уже было отмечено, по одному из наиболее важных для рутинной практики критерию – «отмена по любой причине» [16] терапия оланзапином (Парнасаном) достоверно превосходила лечение галоперидолом [17]. В частности, из-за нежелательных явлений (НЯ) досрочно выбыли 6 пациентов только из группы сравнения.
Во всех случаях причиной смены терапии явились выраженные и длительно не купировавшиеся ЭПР. Среди завершивших исследование пациентов потребность в назначении корректоров ЭПР возникала в 12 (30%) наблюдениях в основной группе и в 32 (80%) в группе сравнения (р<0,001).
Оценка безопасности терапии с применением психометрической шкалы Симпсона–Ангуса (рис. 5) также указывает на достоверное (p<0,05) превосходство оланзапина (Парнасана) над галоперидолом, начиная с 1-й недели терапии до окончания исследования.
Среди других наиболее частых НЯ нейролептической терапии в литературе указывается развитие депрессивной симптоматики [11, 18]. В настоящем исследовании были получены данные о разновекторном эффекте действия антипсихотиков двух поколений (табл. 4; рис. 6).
В основной группе тяжесть депрессивной симптоматики незначительно увеличивалась к концу 2-й недели терапии, затем прогрессивно снижалась (-10,3% от исходного уровня). В группе сравнения динамика депрессивной симптоматики носит ремиттирующий характер с тенденцией к увеличению (+80,3% от исходного уровня; р<0,001).
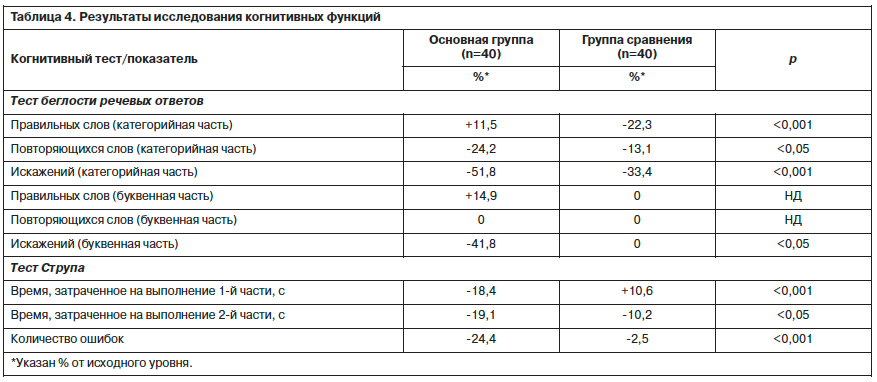
Аналогичным образом менялась выраженность когнитивных расстройств у пациентов обеих групп. По большинству показателей терапия оланзапином (Парнасаном) достоверно превосходила лечение галоперидолом. Кроме того, в группе сравнения по отдельным параметрам зарегистрирована отрицательная динамика когнитивного функционирования (см. табл. 4).

По показателю увеличения массы тела пациенты обеих групп существенно не отличались: за 8 нед терапии средняя прибавка составила 1,8 и 1,4 кг в основной группе и группе сравнения соответственно. Также не выявлено статистически значимых отличий между группами по основным гемодинамическим показателям, уровню липидов и глюкозы в крови. Лишь у 6 (15%) пациентов в основной группе отмечено незначительное, не выходящее за рамки установленных физиологических норм увеличение глюкозы в крови в сравнении с исходным.
По данным ЭКГ, в основной группе у 7 (17,5%), а в группе сравнения у 2 (5%; р<0,05) пациентов зарегистрированы эпизоды синусовой тахикардии.
Тенденция к увеличению артериального давления (АД) на 5 и более мм рт. ст. выявлена у 4 (10%) больных основной группы и у 3 (7,5%) – группы сравнения. При этом еще у 2 (5%) пациентов на фоне терапии традиционным нейролептиком отмечено снижение АД на 5 и более мм рт. ст.
Таким образом, спектр НЯ при краткосрочной купирующей терапии в 2 группах оказался во многом сходным (рис. 7). При этом выраженность большинства НЯ в основной группе на момент окончания исследования была достоверно меньшей.
Косвенным, но статистически достоверным показателем лучшей переносимости терапии атипичным антипсихотиком можно считать дробность приема препаратов, установленную в ходе лечения с учетом субъективной переносимости и стабильности эффекта 1-кратных дозировок. Так, на момент окончания периода наблюдения число пациентов, получавших оланзапин (Парнасан) 1–2 раза в день, составляло 35 (87,5%) наблюдений, 3–4 раза – 5 (12,5%). В то же время 2-кратный прием галоперидола оказался возможен лишь в 9 (22,5%) наблюдениях, 3–4-кратный – в 31 (77,5%) наблюдении.
Повседневное функционирование
Повседневное функционирование пациентов (шкала GAF; рис. 8) в основной группе улучшилось на 61,5% от исходного vs 43,7% в группе сравнения (р<0,001).
Оценка качества повседневного функционирования больного, обобщающая показатели эффективности и переносимости антипсихотической терапии, отражающая вероятность дальнейшего комплаенса и приверженности лечению, достоверно свидетельствует о превосходстве купирующей 8-недельной терапии атипичным антипсихотиком над монотерапией традиционным нейролептиком.
Заключение
Полученные данные в ходе натуралистического сравнительного 8-недельного психофармакотерапевтического исследования эффективности и переносимости купирующей антипсихотической монотерапии обострения шизофрении указывают на то, что оланзапин (Парнасан 20 мг/сут) может рассматриваться в качестве препарата выбора для купирования острого психотического эпизода (особенно развившегося впервые), впервые возникшего с преобладанием в клинической картине бредовых расстройств, подозрительности, симптомов тревоги и ажитации, а также при наличии первичных или вторичных негативных и депрессивных расстройств, в том числе у пациентов со склонностью к развитию ЭПР. Клинические эффекты и невысокая степень выраженности НЯ допускают при необходимости 1–2-кратное назначение препарата в течение суток.
Совокупность высокой эффективности и хорошей переносимости терапии оланзапином (Парнасаном) способствует улучшению повседневного функционирования больных и потенциально сопряжена с более высокими показателями комплаенса, приверженности терапии и качества жизни.
Сведения об авторах
Медведев Владимир Эрнстович – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН
Фролова Вероника Игоревна – канд. мед. наук., доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН
Гушанская Екатерина Владимировна – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН, зав. отд-нием ГПБ №13 г. Москвы
Тер-Исраелян Алексей Юрьевич – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН, гл. врач ГПБ №13 г. Москвы
Ключевые слова: шизофрения, острый психоз, Парнасан, оланзапин.
Efficacy and tolerability of atypical and conventional antipsychotics in jugulate treatment of schizophrenia
V.E.Medvedev1, V.I.Frolova1, E.V.Gushanskaya1,2, A.U.Ter-Israelyan1,2
1Chair of Psychiatry, Psychotherapy and Psychosomatic pathology, People’s Friendship University of Russia; 2Psychiatric Hospital №13, Moscow
Summary. We’ve conducted naturalistic 8-week comparative study of efficacy and tolerability of jugulate antipsychotic monotherapy with olanzapine (Parnasan 20 mg per day) and haloperidole (20 mg per day) for schizophrenia exacerbation. Taking into account efficacy and tolerability olanzapine (Parnasan) can be considered as the drug of choice for acute exacerbation of schizophrenia with delusional symptoms, suspiciousness, anxiety and agitation and with primary and secondary negative and depressive symptoms in patients with extrapyramidal disorders. Olansapine (Parnasan) encourages better everyday functioning.
Key words: schizophrenia, acute psychosis, Parnasan, olansapine.
Наличие в отечественной клинической практике внушительного набора различных антипсихотиков, отличающихся по химическому строению и рецепторному профилю взаимодействий, определяет актуальность проблемы выбора оптимального средства для фармакотерапии больных с разными формами и стадиями шизофрении.
Данные рандомизированных исследований свидетельствуют о сопоставимости показателей эффективности антипсихотиков разных поколений. Однако накопленный опыт клинического применения нейролептиков противоречит представлению об их эквивалентности по всем основным параметрам, включая степень редукции симптомов острого психоза, в рамках любой дименсиональной категории шизофрении (позитивные, негативные, когнитивные, аффективные расстройства), а также спектру нежелательных эффектов. В связи с этим сохраняется необходимость восполнения и совершенствования научной информации в аспекте сравнительных характеристик различных антипсихотиков и подходов к дифференцировке показаний для назначения каждого из них. Для этих целей продолжают осуществляться натуралистические (в том числе масштабные: CATIE, SOHO [1, 2]) сравнительные исследования в условиях, приближенных к рутинной клинической практике.
В результате проведения большого количества исследований (II–III фазы) накоплены данные, которые свидетельствуют о значительной, по крайней мере не уступающей традиционным нейролептикам, эффективности оланзапина в отношении продуктивной (позитивной) симптоматики при лечении больных шизофренией [3–6]. Однако данные об эффективности генерического препарата Парнасан в сравнении с традиционными антипсихотиками в литературе не представлены.
Таким образом, актуальным становится проведение комплексного исследования, направленного на сравнительное изучение эффективности и толерантности купирующей терапии Парнасаном и нейролептиками I поколения острых психотических расстройств при шизофрении.
Цель натуралистического открытого сравнительного фармакотерапевтического исследования – сравнение эффективности и переносимости атипичной (оланзапин) и традиционной (галоперидол) антипсихотической терапии при купировании острого шизофренического психоза в стационарных условиях.
Препаратами сравнения были выбраны оланзапин (Парнасан) и классический нейролептик I поколения галоперидол, принципиально отличающиеся как по химической структуре, так и по спектру рецепторного взаимодействия. Галоперидол преимущественно блокирует D2-дофаминовые рецепторы [7] и s1-рецепторы [8]. Оланзапин также является антагонистом D2-дофаминовых рецепторов [9], а также 5-HT2A, 5-HT2C, 5-HT3, 5-HT6, 5-HT7-серотониновых и H1-гистаминовых рецепторов [10, 11].
Работа проведена в 2013–2014-е годы на базе отделений клинической базы кафедры психиатрии, психотерапии и психосоматической патологии ФПК МР РУДН (заведующая кафедрой – профессор Н.Л.Зуйкова), МБУЗ ГПБ №13 г. Москвы (главный врач – А.Ю.Исраелян).
Дизайн исследования
В исследование включались пациенты обоих полов в возрасте от 18 до 45 лет, соответствующие диагностическим критериям Международной классификации болезней 10-го пересмотра для обострения шизофрении (F20), диагностированной (включая шизотипическое расстройство – F21) не менее 5 лет назад, и имеющие не менее 14 баллов по подшкале позитивных расстройств шкалы PANSS, но не более 6 баллов по шкале CGI. Для уменьшения вероятности влияния соматической патологии в исследование включались больные, не обнаруживающие при физикальном и инструментальном обследованиях симптомов соматических заболеваний в стадии декомпенсации или в тяжелой степени. Возраст включения пациентов был также ограничен с целью уменьшения риска обострения или манифестации сопутствующих соматических, неврологических или эндокринологических заболеваний, климактерического синдрома.Для уменьшения вероятности влияния соматической патологии в исследование включались больные, не обнаруживающие при физикальном и инструментальном обследованиях симптомов соматических заболеваний в стадии декомпенсации или в тяжелой степени. Возраст включения пациентов был также ограничен с целью уменьшения риска обострения или манифестации сопутствующих соматических, неврологических или эндокринологических заболеваний, климактерического синдрома.
Критерии исключения: регулярный прием любых психотропных препаратов (включая пролонгированные формы антипсихотиков, антидепрессантов) в течение 6 нед до госпитализации, индивидуальная непереносимость оланзапина или галоперидола в анамнезе; высокий суицидальный риск (по шкале суицидального риска), зависимость от психоактивных веществ, беременность, лактация; органическое поражение центральной нервной системы (эпилепсия, деменция, новообразования, рассеянный склероз и т.п.), пролактинзависимые новообразования (пролактинома гипофиза и рак молочной железы), феохромоцитома, сопутствующий прием агонистов дофамина.
Набор пациентов, удовлетворяющих критериям включения, осуществлялся попеременно в одну из 2 групп по 40 пациентов в каждой по мере поступления в стационар. В случае исключения пациента из исследования в связи с недостаточной эффективностью или плохой переносимостью терапии в исследование включался другой пациент – так, чтобы число завершивших исследование в обеих группах составило 40 пациентов.
Дозы препаратов. В основной группе больных купирование психоза проводилось оланзапином (Парнасан) в дозировке до 20 мг/сут внутрь; в группе сравнения – галоперидолом до 20 мг/сут внутрь. Титрация доз осуществлялась в обеих группах одинаково: 10 мг/сут препарата в 1-й день, 20 мг/сут – со 2-го дня терапии. Прием препарата осуществлялся 1–4 раза в сутки с учетом индивидуальной переносимости. Длительность терапии составляла 8 нед (56 дней).
Сопутствующая психотропная терапия исключалась. При возникновении легких экстрапирамидных расстройств (ЭПР) дополнительно в течение не более 7 дней допускалось назначение корректора (бипериден, циклодол). При сохранении ЭПР доза антипсихотика снижалась до индивидуально переносимой вплоть до отмены терапии и исключения пациента из исследования.
Оценка эффективности терапии проводилась на плановых визитах: неделя (Н) 0 (состояние до начала лечения), Н1, Н2, Н4, Н6, Н8.
Инструментами сравнения и основными критериями эффективности наряду с клинической оценкой являлись редукция симптоматики по шкалам PANSS и CGI. Для респондеров критериями эффективности купирующей терапии считалось снижение суммы баллов по подшкале позитивных расстройств PANSS на 50% и более. Для оценки влияния терапии на повседневное функционирование использовалась шкала функционирования GAF.
Безопасность и переносимостьтерапии оценивались на основании спонтанных жалоб больного, шкалы побочных эффектов (UKU) и данных клинических и параклинических соматических исследований, включающих регистрацию основных гемодинамических показателей, в том числе электрокардиография (ЭКГ), клинический и биохимический анализы крови, индекс массы тела.
Для изучения влияния терапии на вторичные негативные расстройства (нейролептическая депрессия, паркинсоническая заторможенность и др.) на каждом визите применялись шкалы HADS и Симпсона–Ангуса. Для сравнения влияния препаратов на когнитивные функции использовалась батарея специализированных тестов (тесты беглости речевых ответов, Струпа и на ассоциативные ряды).
Оценка результатов проводилась стандартными методами статистического анализа с использованием программы Statistica.
Общее число пациентов, включенных в основную группу, составило 50, в группу сравнения – 56. Из основной группы к моменту завершения исследования выбыли 10 (20%) пациентов, из группы сравнения – 16 (28,6%; р<0,001). Таким образом, как и предполагалось дизайном исследования, в окон
 чательный анализ результатов были включены данные 40 больных из каждой группы. Отсутствие достоверных отличий по основным социодемографическим и клиническим показателям (табл. 1 и 2) позволяет рассчитывать на валидность полученных данных.
чательный анализ результатов были включены данные 40 больных из каждой группы. Отсутствие достоверных отличий по основным социодемографическим и клиническим показателям (табл. 1 и 2) позволяет рассчитывать на валидность полученных данных.
Эффективность терапии Среди пациентов, выбывших в основнй группе на 1–2-й неделе из-за неэффективности терапии, первый психотический эпизод регистрировался в 6 наблюдениях, повторный – в 4. Аналогичный показатель в группе сравнения составил 12 и 4 наблюдения соответственно. Согласно шкале CGI к окончанию терапии уменьшение тяжести состояния больного в основной группе достоверно превосходит таковой в группе сравнения (-14,9% vs -8,6%; р<0,05).

Число больных в «очень тяжелом» и «тяжелом» состоянии в основной группе к окончанию исследования снижается в обеих группах практически одинаково (-79,5% vs -83,5%). Число пациентов-респондеров по установленным в исследовании критериям в основной группе составило 30 (75%) наблюдений, в группе сравнения – 34 (85%). При этом оланзапин (Парнасан) оказался достоверно эффективнее у больных с первым психотическим эпизодом: 22 (75,9%) из 29 наблюдений (р<0,001), а галоперидол – с повторными обострениями: 23 (82,1%) из 28 наблюдений (р<0,001). В качестве одной из возможных причин неэффективности терапии у всех пациентов в группе оланзапина (Парнасан), не вошедших в число респондеров или выбывших до окончания исследования, следует выделить курение по 1–2 пачки сигарет в день. В литературе описан потенцирующий эффект табака на изоэнзим CYP1А2, ускоряющий метаболизм оланзапина и снижающий его концентрацию в плазме крови ниже ожидаемой [12, 13]. Динамика состояния больных по шкале PANSS представлена на рис. 1–4.

Как видно из рис. 1, снижение общего суммарного балла по шкале PANSS к окончанию 8-й недели лечения в основной группе (-31,1%) достоверно превосходит этот показатель в группе сравнения (-23%; р<0,001).
Из представленных на рис. 2 данных видно, что при купировании продуктивной симптоматики, начиная со 2-й недели терапии, применение оланзапина (Парнасана) на уровне тенденции превосходит терапию в группе сравнения. К окончанию исследования редукция баллов по подшкале продуктивной симптоматики PANSS в основной группе достигла 60,7%, в группе сравнения – 57,5%. Динамика негативных и когнитивных расстройств по шкале PANSS (рис. 3) отражает разнонаправленное действие антипсихотиков двух поколений.
При терапии оланзапином (Парнасаном) фиксируется непрерывное уменьшение выраженности негативных проявлений (на 22% за 8 нед), в то время как при применении галоперидола степень редукции расстройств составляет лишь 4,7% (р<0,001).
 При этом на фоне приема традиционного нейролептика на 2 и 8-й неделях лечения отмечается тенденция к увеличению выраженности негативной и когнитивной симптоматики. Последнее может быть обусловлено как непосредственным антагонизмом препарата к s1-рецепторам [14], снижением нейропластичности мозга и ухудшением когнитивных показателей [15], так и постепенным развитием нейролептической заторможенности и депрессии.
При этом на фоне приема традиционного нейролептика на 2 и 8-й неделях лечения отмечается тенденция к увеличению выраженности негативной и когнитивной симптоматики. Последнее может быть обусловлено как непосредственным антагонизмом препарата к s1-рецепторам [14], снижением нейропластичности мозга и ухудшением когнитивных показателей [15], так и постепенным развитием нейролептической заторможенности и депрессии.
На это же указывают и результаты обследования пациентов по когнитивным тестам, шкалам HDRS, Симпсона–Ангуса и UKU. Влияние оланзапина (Парнасана) на общие (по PANSS) психопатологические симптомокомплексы статистически значимо превосходило галоперидол, начиная с 4-й недели терапии. К завершению исследования в основной группе средний балл редуцировался на 21%, в группе сравнения – на 13,8% (р<0,001).
Более детальная посимптомная (по PANSS) оценка спектра действия оланзапина и галоперидола представлена в табл. 3.

Между препаратами существовали различия в спектрах психотропной активности. Оланзапин (Парнасан) достоверно эффективнее купировал возбуждение, подозрительность, персекуторные бредовые идеи, тревогу и напряженность, уменьшал выраженность притупленного аффекта, эмоциональной отгороженности, некоммуникабельности, нарушений абстрактного мышления, внимания, воли, реже вызывал моторную заторможенность, симптомы депрессии. В то же время препарат в меньшей степени, чем галоперидол, нивелировал галлюцинаторную и парафренную симптоматику.
Переносимость терапии
ак уже было отмечено, по одному из наиболее важных для рутинной практики критерию – «отмена по любой причине» [16] терапия оланзапином (Парнасаном) достоверно превосходила лечение галоперидолом [17]. В частности, из-за нежелательных явлений (НЯ) досрочно выбыли 6 пациентов только из группы сравнения.
Во всех случаях причиной смены терапии явились выраженные и длительно не купировавшиеся ЭПР. Среди завершивших исследование пациентов потребность в назначении корректоров ЭПР возникала в 12 (30%) наблюдениях в основной группе и в 32 (80%) в группе сравнения (р<0,001).
Оценка безопасности терапии с применением психометрической шкалы Симпсона–Ангуса (рис. 5) также указывает на достоверное (p<0,05) превосходство оланзапина (Парнасана) над галоперидолом, начиная с 1-й недели терапии до окончания исследования.
Среди других наиболее частых НЯ нейролептической терапии в литературе указывается развитие депрессивной симптоматики [11, 18]. В настоящем исследовании были получены данные о разновекторном эффекте действия антипсихотиков двух поколений (табл. 4; рис. 6).
В основной группе тяжесть депрессивной симптоматики незначительно увеличивалась к концу 2-й недели терапии, затем прогрессивно снижалась (-10,3% от исходного уровня). В группе сравнения динамика депрессивной симптоматики носит ремиттирующий характер с тенденцией к увеличению (+80,3% от исходного уровня; р<0,001).

Аналогичным образом менялась выраженность когнитивных расстройств у пациентов обеих групп. По большинству показателей терапия оланзапином (Парнасаном) достоверно превосходила лечение галоперидолом. Кроме того, в группе сравнения по отдельным параметрам зарегистрирована отрицательная динамика когнитивного функционирования (см. табл. 4).

По показателю увеличения массы тела пациенты обеих групп существенно не отличались: за 8 нед терапии средняя прибавка составила 1,8 и 1,4 кг в основной группе и группе сравнения соответственно. Также не выявлено статистически значимых отличий между группами по основным гемодинамическим показателям, уровню липидов и глюкозы в крови. Лишь у 6 (15%) пациентов в основной группе отмечено незначительное, не выходящее за рамки установленных физиологических норм увеличение глюкозы в крови в сравнении с исходным.
По данным ЭКГ, в основной группе у 7 (17,5%), а в группе сравнения у 2 (5%; р<0,05) пациентов зарегистрированы эпизоды синусовой тахикардии.
Тенденция к увеличению артериального давления (АД) на 5 и более мм рт. ст. выявлена у 4 (10%) больных основной группы и у 3 (7,5%) – группы сравнения. При этом еще у 2 (5%) пациентов на фоне терапии традиционным нейролептиком отмечено снижение АД на 5 и более мм рт. ст.
Таким образом, спектр НЯ при краткосрочной купирующей терапии в 2 группах оказался во многом сходным (рис. 7). При этом выраженность большинства НЯ в основной группе на момент окончания исследования была достоверно меньшей.
Косвенным, но статистически достоверным показателем лучшей переносимости терапии атипичным антипсихотиком можно считать дробность приема препаратов, установленную в ходе лечения с учетом субъективной переносимости и стабильности эффекта 1-кратных дозировок. Так, на момент окончания периода наблюдения число пациентов, получавших оланзапин (Парнасан) 1–2 раза в день, составляло 35 (87,5%) наблюдений, 3–4 раза – 5 (12,5%). В то же время 2-кратный прием галоперидола оказался возможен лишь в 9 (22,5%) наблюдениях, 3–4-кратный – в 31 (77,5%) наблюдении.
Повседневное функционирование
Повседневное функционирование пациентов (шкала GAF; рис. 8) в основной группе улучшилось на 61,5% от исходного vs 43,7% в группе сравнения (р<0,001).
Оценка качества повседневного функционирования больного, обобщающая показатели эффективности и переносимости антипсихотической терапии, отражающая вероятность дальнейшего комплаенса и приверженности лечению, достоверно свидетельствует о превосходстве купирующей 8-недельной терапии атипичным антипсихотиком над монотерапией традиционным нейролептиком.
Заключение
Полученные данные в ходе натуралистического сравнительного 8-недельного психофармакотерапевтического исследования эффективности и переносимости купирующей антипсихотической монотерапии обострения шизофрении указывают на то, что оланзапин (Парнасан 20 мг/сут) может рассматриваться в качестве препарата выбора для купирования острого психотического эпизода (особенно развившегося впервые), впервые возникшего с преобладанием в клинической картине бредовых расстройств, подозрительности, симптомов тревоги и ажитации, а также при наличии первичных или вторичных негативных и депрессивных расстройств, в том числе у пациентов со склонностью к развитию ЭПР. Клинические эффекты и невысокая степень выраженности НЯ допускают при необходимости 1–2-кратное назначение препарата в течение суток.
Совокупность высокой эффективности и хорошей переносимости терапии оланзапином (Парнасаном) способствует улучшению повседневного функционирования больных и потенциально сопряжена с более высокими показателями комплаенса, приверженности терапии и качества жизни.
Сведения об авторах
Медведев Владимир Эрнстович – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН
Фролова Вероника Игоревна – канд. мед. наук., доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН
Гушанская Екатерина Владимировна – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН, зав. отд-нием ГПБ №13 г. Москвы
Тер-Исраелян Алексей Юрьевич – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР РУДН, гл. врач ГПБ №13 г. Москвы
Список исп. литературыСкрыть список1. Jindal RD, Keshavan MS. Classifying antipsychotic agents. Need for new terminology. CNS Drugs 2008; 12: 1047–59.
2. Иванов С.В. Клинические характеристики атипичных антипсихотиков: результаты сравнительных исследований при шизофрении. Психиатр. и психофармакотер. 2012; 2.
3. Davis JM et al. A meta-analysis of the efficacy of second-generation antipsychotics. Arch Gen Psichiat 2003; 60 (6): 553–64.
4. Leught S et al. Second-genetation vs. first-generation antipsychotic drugs for schizophrenia: a meta-analisis. Lancet 2009; 373: 31–41.
5. Дробижев М.Ю., Овчинников А.А. Антипсихотики: меняем старые поколения на новую классификацию? Соц. и клин. психиатрия. 2010; 2: 80–6.
6. Hayashi T, Stahl SM. S1-рецепторы и их роль в лечении аффективных расстройств. Психиатр. и психофармакотер. 2009; 1: 52–6.
7. Hindmarch I. Оценка негативного влияния психофармакологических лекарственных средств на когнитивные функции. Психиатр. и психофармакотер. 2008; 5: 32–8.
8. Lieberman JA et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005; 353: 1209–23.
9. Wu TN et al. Pharmacokinetics of Olanzapine in Chines male schizophrenic patients various smoking behaviors. Prog Neuropsychopharmacol Biol Psychiat 2008; 32: 1889–93.
10. Haro JM et al. SOHO Study Group. Three-year antipsychotic effectiveness in outpatient care of schizophrenia: observational vs. randomized studies results. Eur Neuropsychopharmacol 2007; 17 (4): 235–44.
11. Beasley CM Jr et al. All-cause treatment discontinuation in schizophrenia during treatment with olanzapine relative to other antipsychotics: an integrated analysis. J Clin Psychopharmacol 2007; 27 (3): 252–8.
12. Stahl S. Essenctial psychopharmacology. Cambridge 2013.
13. Медведев В.Э. Возможность и оправданность перевода на атипичные антипсихотики больных шизофренией. Психиатр. и психофармакотер. 2013; 5: 23–8.
14. Haslemo T et al. The effect of variable cigarette consumption on the interaction with clozapine and olanzapine. Eur J Clin Farmacol 2006; 62: 1049–53.
15. Данилов Д.С. Современные классификации антипсихотических средств и их значение для клинической практики (современное состояние вопроса и его перспективы).
16. Медведев В.Э. Оланзапин в психиатрической практике. Психиатр. и психофармакотер. 2011; 5: 10–5.
17. Kapur S et al. 5-HT2- and D2-receptor occupancy of olanzapine in schizophrenia: a PET investigation. Am J Psychiat 1998; 155: 921–8.
Обозрение психиатрии и мед. психологии. 2010; 3: 36–42.
18. Ястребов Д.В. Терапия современными антипсихотическими препаратами. Особенности применения оланзапина. Психи
10 июня 2014
Количество просмотров: 3273

