Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2014
Молекулярная генетика и фармакогенетика биполярного аффективного расстройства: обзор материалов 26-го Конгресса Европейской коллегии нейропсихофармакологии №03 2014
Номера страниц в выпуске:25-35
Данная публикация является одной из серии работ, посвященной материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии (5–9 октября 2013 г., Барселона, Испания). Приведен обзор генетических и фармакогенетических исследований биполярного аффективного расстройства. Обсуждается связь особенностей генотипа с суицидальным поведением при биполярном аффективном расстройстве и с эффективностью купирующей и поддерживающей терапии заболевания.
Данные обзоры подготовлены по материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии (октябрь 2013 года, Барселона) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании «Сервье» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»)
Резюме. Данная публикация является одной из серии работ, посвященной материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии (5–9 октября 2013 г., Барселона, Испания). Приведен обзор генетических и фармакогенетических исследований биполярного аффективного расстройства. Обсуждается связь особенностей генотипа с суицидальным поведением при биполярном аффективном расстройстве и с эффективностью купирующей и поддерживающей терапии заболевания.
Ключевые слова: Конгресс Европейской коллегии нейропсихофармакологии, биполярное аффективное расстройство, суицид, генетика, фармакогенетика, фармакокинетика, антидепрессанты, нормотимики, селективные ингибиторы обратного захвата серотонина, литий.
Molecular genetics and pharmacogenetics of bipolar disorder: the overview of proceedings of the 26th ECNP Congress
T.S.Syunyakov
FSBI Zakusov Institute of Pharmacology RAMS, Moscow
Summary. This publication is the part of the series of overviews on proceedings of the 26th Congress of European College of Neuropsychopharmacology (October 5–9 2013, Barcelona, Spain). The overview of genetic and pharmacogenetic studies on bipolar affective disorder is provided. Links between genotype and suicidal behavior and efficacy of acute and maintenance treatment of bipolar disorder are discussed.
Key words: 2013 ECNP Congress, bipolar affective disorder, suicide, genetics, pharmacogenetics, pharmacokinetics, antidepressants, mood stabilizers, selective serotonin reuptake inhibitors, lithium.
Генетические исследования в психиатрии имеют первоочередное значение. Являясь неотъемлемой частью трансляционного процесса, т.е. переноса результатов фундаментальных исследований в область практического применения, они позволяют изучить этиопатогенетические основы болезненных состояний, сформировать эндофенотипы – связку между фенотипическими проявлениями и лежащими у их истоков разнообразными механизмами – и направлены на понимание сути расстройства и выявление терапевтических мишеней, особенно при явлениях терапевтической рефрактерности.
Вопросы психогенетики были широко освещены на
26-м Конгрессе Европейской коллегии нейропсихофармакологии (European College of Nneuropsychopharmacology, ECNP) в Барселоне, проходившем 5–9 октября 2013 г. Здесь нашли отражение, в частности, проблемы фармако-, иммуногенетики, эпигенетики психических расстройств и прежде всего биполярного расстройства и нейродегенеративных заболеваний. Такое распределение тем удачно дополняет круг вопросов, рассматривавшихся весной 2013 г. на другом крупном мероприятии – Конгрессе Европейской психиатрической ассоциации, проводившемся во французской Ницце, где с данных позиций обозревались униполярные аффективные и тревожные расстройства. Данный обзор материалов конгресса сосредоточен на биполярном аффективном расстройстве (БАР), оставив в стороне его иммуногенетические аспекты, которые заслуживают отдельного рассмотрения. Причинами, по которым биполярное расстройство является предметом столь интенсивных исследований в области генетики и фармакогенетики, является не только то, что это тяжелое хроническое заболевание с серьезными последствиями, высоким риском суицидального поведения (23,4% в течение жизни), превосходящим таковой при тяжелых формах депрессивных нарушений (относительный риск 28 в сравнении с 21 [1]), с высокой распространенностью в общем населении, достигающей порядка 0,5–1,5% [2], при недостаточном выявлении и трудностях терапии, но и то, что исследования демонстрируют, что оно является одним из наиболее жестко генетически детерминированных психических заболеваний. Так, риск возникновения болезни среди родственников первой степени родства составляет около 10–15%, а генетическая конкордантность в близнецовых исследованиях достигает 70% [3]. Наследуются также отдельные аспекты состояния, и прежде всего это касается суицидального поведения, в формировании которого генетические факторы играют не меньшую роль, чем клинические или средовые (наследуемость суицидального поведения достигает 43% [4–6]).
Однако понимание генетических и молекулярно-биологических этиопатогенетических факторов до последнего времени едва ли выходило за рамки осознания их комплексности, многогранности и обусловленности множественными взаимодействиями как друг с другом, так и со средовыми и эпигенетическими влияниями, указывая на актуальность их изучения. В этой связи не удивительно, что на конгрессе генетической стороне биполярного расстройства была посвящена отдельная сессия, проводившаяся под председательством Иствана Биттера (Istvan Bitter) из Венгрии и Андреаса Райфа (Andreas Reif) из Германии. Здесь были представлены 4 доклада: Лейфа Бертилссона (Leif Bertillson, Каролинский институт, Швеция) – «Фармакогенетика антидепрессантов, антиконвульсантов и антипсихотиков»; Ксении Гонда (Xenia Gonda, Венгрия) – «Молекулярно-генетические аспекты действия серотонинергических препаратов при биполярном расстройстве»; Алессандро Серретти (Alessandro Serretti, Италия) – «Фармакогенетика эффективности и побочных эффектов терапии биполярного расстройства»; Антони Бенабарре (Antoni Benabarre, Испания) – «Генетика суицидального поведения при биполярном расстройстве: новые данные», – все они были посвящены вопросам фармакогенетики, науки, задачами которой на фундаментальном уровне является восполнение в рамках трансляционного процесса пробелов в знаниях об этиопатогенезе психических расстройств и определение новых мишеней действия и направлений в создании инновационных лекарственных средств, а на прикладном – персонифицированный прогноз терапевтического ответа. При этом в свете замечания профессора Бертилссона о том, что действие препарата выстраивается из континуума событий в ряду, начиная с его всасывания и метаболизма под действием ферментов, и до воздействия на рецепторы и прочие фармакологические мишени с присоединением каскадов дальнейших событий в виде воздействия на нейромедиаторные функции и системы вторичных внутриклеточных мессенджеров и эпигенетических модификаций, вырисовывается отчетливое разделение сообщений на «фармакогенетику фармакокинетики» и «фармакогенетику фармакодинамики».
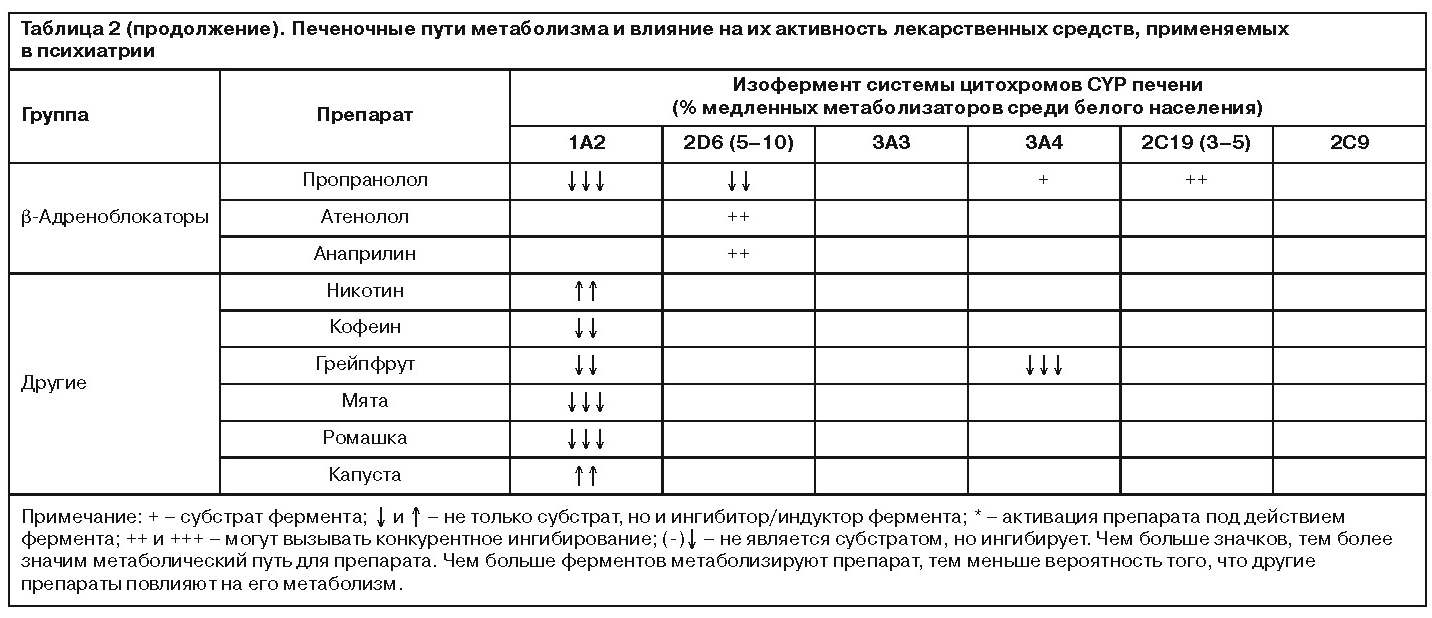
Фармакогенетическим аспектам фармакокинетики психотропных препаратов было посвящено сообщение профессора Каролинского института (Швеция) Л.Бертилссона. В самом начале своего выступления он обратился к данным 30-летней давности, согласно которым при изучении антигипертензивного средства дебрисохина и его гидроксиметаболита было получено распределение индивидов по соотношению их концентраций, представленное на рис. 1. Оказалось, что в популяции шведов данное соотношение колеблется в диапазоне от сотых долей до нескольких сотен, что свидетельствует о колоссальной изменчивости интенсивности метаболизма препарата, варьирующей в десятки тысяч раз между крайне низкими (справа на рис. 1) и ультравысокими значениями (слева).
Следует отметить, что дебрисохин является маркерным веществом, указывающим на активность фермента CYP2D6 системы цитохромов печени (имеющего большое значение для метаболизма психотропных препаратов, использующихся в том числе для терапии БАР). По данным докладчика, доля лиц с низкой интенсивностью метаболизма CYP2D6 (т.е. с гомозиготным состоянием по мутантному варианту гена CYP2D6) среди населения Швеции достаточно велика и составляет около 7%. И это означает, что у значительной части людей в случае проведения психо-тропной терапии циркулирующие уровни широкого круга антидепрессантов и антипсихотиков, метаболизирующихся данным ферментом, будут повышены. Следует также учитывать, что некоторые препараты являются ингибиторами (угнетают активность) либо индукторами (повышают активность) данного фермента. Таким образом, при одновременном применении двух препаратов, хотя бы один из которых является ингибитором фермента, показатели концентрации препаратов в крови этих больных окажутся еще больше. Вариабельность активности CYP2D6 детерминирована генетически и связана с несколькими функциональными полиморфизмами соответствующего гена, частота встречаемости которых среди представителей европеоидной, монголоидной и негроидной рас различается. И если среди шведов носителями немутантных типов гена являются 70% населения, то, например, в Зимбабве и Китае их доля снижается до 54 и 43%. Соответственно, в последних двух странах повышается доля лиц, наследовавших функционально ограниченные мутантные варианты гена (табл. 1).
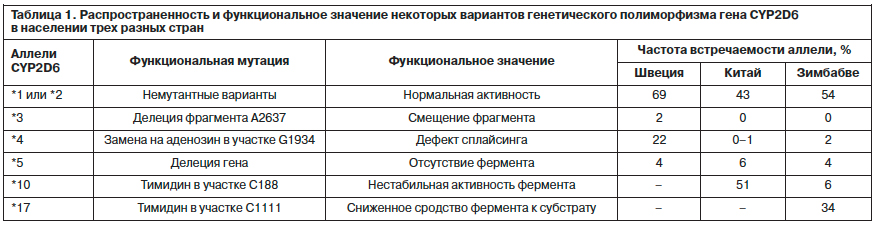
Особый интерес представляют ограниченные группы населения, соответствующие крайне левым областям гистограммы, представленной на рис. 1. В отличие от точечного однонуклеотидного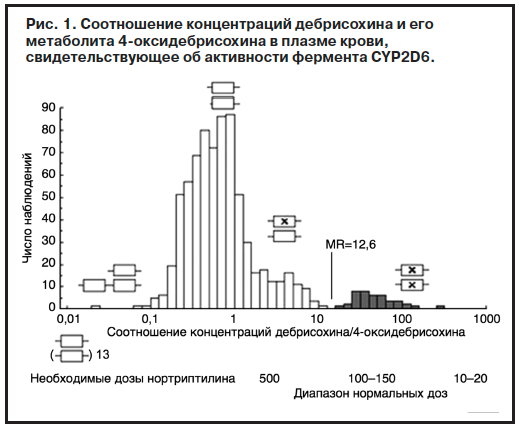 полиморфизма они отражают полиморфизм фермента другого типа – вариабельность числа копий гена (copy number variance), а у единственного пациента, отражающего крайне левый столбик диаграммы, было обнаружено 13 копий гена, обладающих неизмененной активностью. При этом число вариантов гена в геноме обратно пропорционально плазменным концентрациям субстрата фермента (рис. 2) [7]. Учет указанных вариантов представляется крайне важным с практической точки зрения – у медленных метаболизаторов эффективными окажутся крайне низкие дозы антидепрессанта нортриптилина (10–20 мг), а у быстрых – за пределами верхней границы рекомендованных доз (вплоть до 500–600 мг), при нормальном диапазоне суточных доз в 100–150 мг. По данным исследования C.Kawanishi и соавт. (2004 г.) [8], среди больных с рефрактерными депрессиями доля больных с быстрым метаболизмом в связи с дублированием гена CYP2D6 достигает 10% и точно такая же доля быстрых метаболизаторов среди больных с депрессией с завершенными суицидальными попытками [9]. Кроме того, активность данного метаболического пути коррелирует с выраженностью психастенических личностных черт, являющихся одним из факторов предрасположения к депрессиям [10].
полиморфизма они отражают полиморфизм фермента другого типа – вариабельность числа копий гена (copy number variance), а у единственного пациента, отражающего крайне левый столбик диаграммы, было обнаружено 13 копий гена, обладающих неизмененной активностью. При этом число вариантов гена в геноме обратно пропорционально плазменным концентрациям субстрата фермента (рис. 2) [7]. Учет указанных вариантов представляется крайне важным с практической точки зрения – у медленных метаболизаторов эффективными окажутся крайне низкие дозы антидепрессанта нортриптилина (10–20 мг), а у быстрых – за пределами верхней границы рекомендованных доз (вплоть до 500–600 мг), при нормальном диапазоне суточных доз в 100–150 мг. По данным исследования C.Kawanishi и соавт. (2004 г.) [8], среди больных с рефрактерными депрессиями доля больных с быстрым метаболизмом в связи с дублированием гена CYP2D6 достигает 10% и точно такая же доля быстрых метаболизаторов среди больных с депрессией с завершенными суицидальными попытками [9]. Кроме того, активность данного метаболического пути коррелирует с выраженностью психастенических личностных черт, являющихся одним из факторов предрасположения к депрессиям [10]. 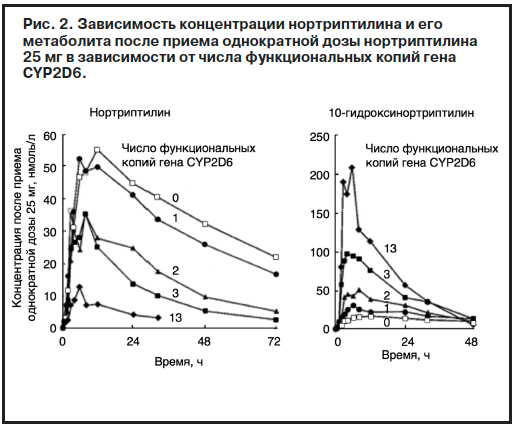
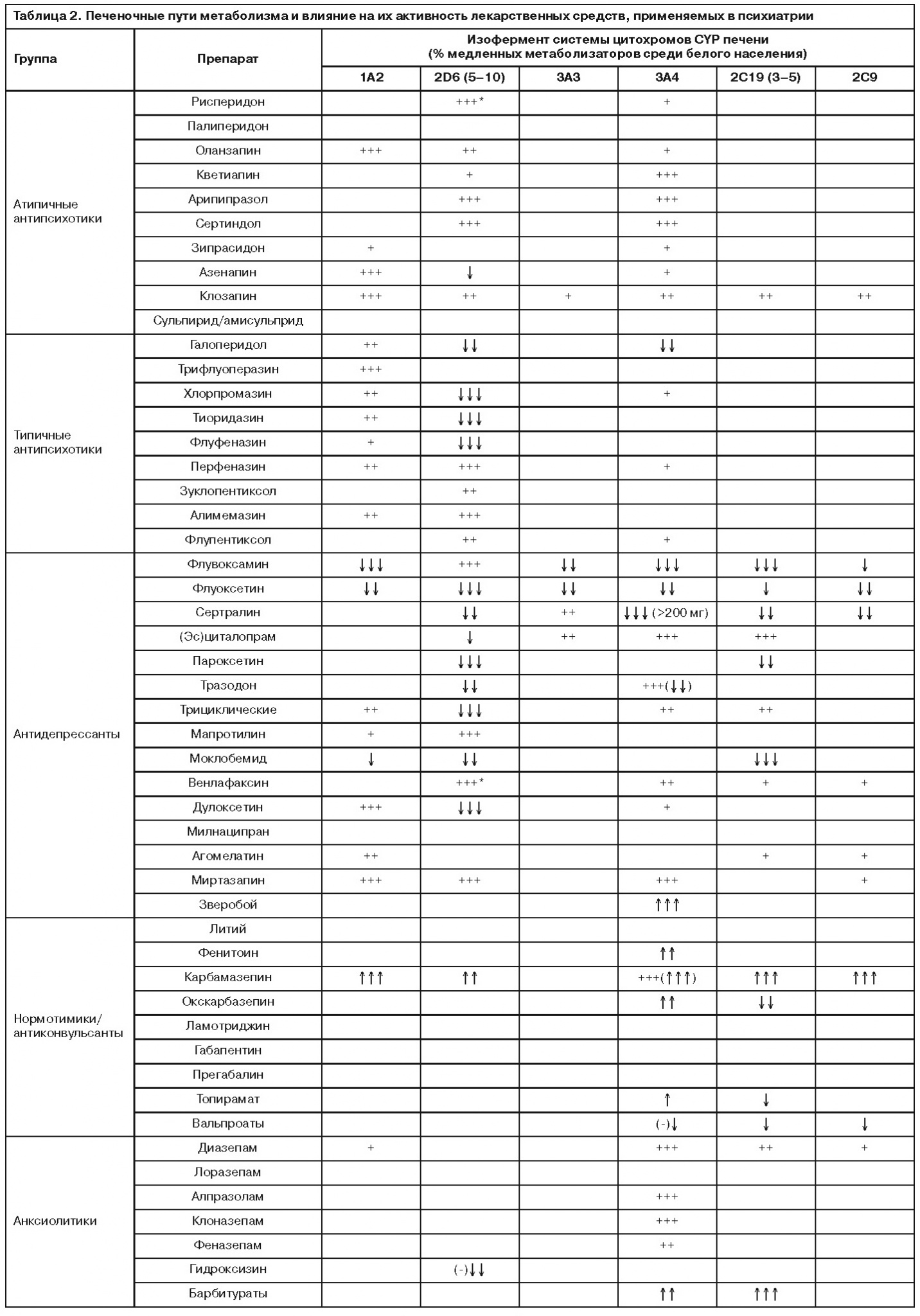
Однако CYP2D6 – лишь один из целого ряда ферментов системы цитохрома, обладающих генетически детерминированным полиморфизмом. В частности, 3% белого населения Европы являются носителями функционально более низкого по активности фермента CYP3C19, метаболизирующего циталопрам, диазепам, трициклические антидепрессанты, а его ингибитором является флувоксамин. Эталонным препаратом для оценки его активности является омепразол. Среди жителей Японии большинство – носители мутантной аллели со сниженной активностью, и это сказывается на особенностях действия кломипрамина. У японцев препарат, по сути, проявляет свойства селективного ингибитора обратного захвата серотонина (СИОЗС), тогда как в популяции европейцев наличие мощного норадренергического метаболита десметилкломипрамина трансформирует его в антидепрессант с двойным действием. Докладчик также коснулся особенностей, связанных с полиморфизмом CYP1A2, который опосредует метаболические превращения многих антипсихотиков. Нормальную активность фермента кодирует аллель *1А, тогда как у носителей мутантной версии *1С активность энзима снижена, а у носителей *1F – повышена. Его ингибитором является флувоксамин, который в комбинации с клозапином приводит к существенному увеличению плазменных концентраций последнего, повышая вероятность возникновения побочных эффектов. Оценивая активность данного энзима, следует учитывать, что табакокурение вызывает его индукцию, а кофеин – конкурентное ингибирование. Среди других обладающих генетическим полиморфизмом ферментов печени при применении психотропных препаратов может играть роль CYP3A4, участвующий в метаболизме бензодиазепинов и индуцируемый карбамазепином и вальпроатами, а также фермент глюкуронизации UGT1A4, отвечающий за биотрансформацию, в частности оланзапина и ламотриджина. Характеризуя генетический полиморфизм CYP3A4, необходимо добавить, что он практически не сказывается на активности фермента. При этом необходимо учитывать, что у женщин его активность выше, а грейпфрутовый сок является мощным ингибитором энзима.
Таким образом, «фармакогенетика фармакокинетики», являясь одной из наиболее изученных в данной области, способна предоставить информацию, которая уже на сегодняшний день может быть перенесена в практическую плоскость персонифицированной психофармакотерапии, поскольку позволяет соотносить индивидуальные особенности метаболизма пациентов с фармакокинетическими характеристиками препаратов и заблаговременно избегать терапевтических ошибок. В cвязи с этим в качестве дополнения к данному разделу сессии представляется важным привести информацию о путях метаболизма некоторых психотропных препаратов, обновленную данными, представленными на конгрессе (табл. 2).
Отчасти ответу на этот вопрос было посвящено сообщение «Молекулярно-генетические аспекты действия серотонинергических препаратов при биполярном расстройстве», представленное К.Гонда. В кратком вступлении автор рассмотрела данные о нарушениях серотонинергической функции при БАР. Так, в обзорной работе T.Mahmood и T.Silverstone (2001 г.) [11] указывается, что изменения ее активности характерны для всех аффективных расстройств, в том числе имеющих периодическую природу, однако при БАР они имеют некоторые особенности. Согласно экспериментальным исследованиям серотониновая система играет роль в формировании поискового поведения, локомоторной активности, поведения, направленного на поиск пищи, связанного с репродукцией, агрессией, и влияет на восприимчивость к болевым стимулам, т.е. выполняет интегративную функцию в отношении тех аспектов жизнедеятельности, разнонаправленные изменения которых отмечаются при депрессивных и маниакальных полюсах БАР. На нейрохимическом уровне изменения серотонинергической активности у больных с биполярными и униполярными депрессиями сходны и значительно отличаются от изменений при маниакальных состояниях. В головном мозге у больных с БАР, умерших во время депрессивной фазы, в лобных и теменных долях обнаруживалось снижение содержания серотонина и его метаболита 5-оксииндолацетата [12], а также активности обратного захвата серотонина [13], тогда как при маниях отмечается усиление обратного захвата серотонина [14]. При феномене быстрой цикличности отмечается несимметричное распределение связывания лиганда с моноаминовыми рецепторами в головном мозге [15]. Сопоставимые результаты были продемонстрированы в исследованиях содержания 5-оксииндолацетата в спинномозговой жидкости: при депрессиях наблюдается снижение его концентрации [16], а при маниях повышение [17]. Аналогичные по своей направленности изменения при биполярном расстройстве наблюдаются и в отношении обратного захвата серотонина тромбоцитами в периферической крови [18–20]. При этом способность имипрамина связываться с транспортером серотонина при биполярных депрессиях оказалась ниже, чем при униполярных [20]. В генетических исследованиях также прослеживается взаимосвязь разных компонентов серотонинергической системы с биполярной депрессией. Наиболее отчетлива ассоциация заболевания с коротким вариантом1 промотора полиморфного участка гена транспортера серотонина (5HTTLPR) и сVNTR-полиморфизмом2 участка, расположенного в интроне 2 гена транспортера серотонина [21]. В отношении генов серотонинергических рецепторов в генетических исследованиях были получены более противоречивые данные
(в особенности в отношении 1А- и 2А-рецепторов). Тем не менее при БАР обнаружена взаимосвязь с экспрессией гена 5-НТ3В-рецепторов [22], а у женщин с данным диагнозом отмечается незначительная оверэкспрессия гена
5-HT2C-рецепторов [23, 24]. Кроме того, выявляется зависимость между заболеванием и экспрессией других генов, участвующих в серотонинергической системе – полиморфный вариант TPH-A-гена триптофангидроксилазы, ключевого фермента биосинтеза серотонина, значительно повышает риск БАР [25].
Приведенные выше данные определяют глубокую вовлеченность генов разных компонентов серотонинергической системы в этиопатогенетические механизмы БАР, и в особенности это касается некоторых вариантов генов транспортера серотонина, 5-HT3B-рецепторов и ферментов биосинтеза серотонина. При этом данные представляют собой не только факторы уязвимости или отягощения БАР, но и задают вектор поиска генетических предпосылок эффективности психофармакотерапии заболевания у данного конкретного пациента, рассмотрению которых была посвящена оставшаяся часть сообщения.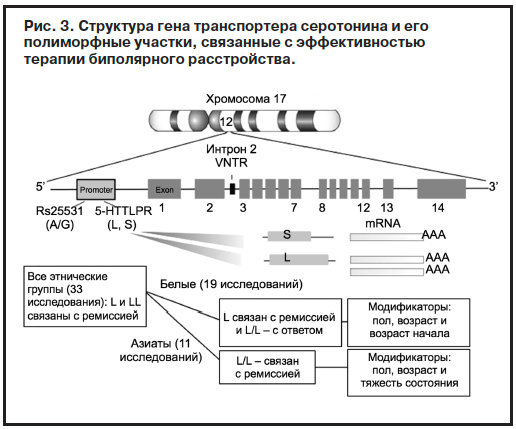
Следует отметить, что по оценке S.Porcelli и соавт. вклад генетических факторов в формирование антидепрессивного действия достигает 50% [26]. Исходя из исследований генетических ассоциаций, наиболее подходящим геном-кандидатом для данных изысканий является l/s-полиморфизм (т.е. длинный – long или короткий – short варианты) промотора гена транспортера серотонина 5HTTLPR (рис. 3).
По результатам многих работ он ассоциируется c разными аспектами результативности терапии биполярных депрессий. Так, у A.Serretti и M.Kato (2008 г.) [27] приводятся данные, что с l-вариантом гена связана вероятность улучшения ядерных симптомов депрессии, а по результатам метаанализа 33 исследований у представителей европеоидной расы обнаружена ассоциация между геном транспортера серотонина и вероятностью наступления терапевтического ответа и ремиссии: у носителей l-варианта гена наблюдались более благоприятные исходы лечения [26]. Следует отметить, что данная ассоциация имеет ряд особенностей. Во-первых, она касается прежде всего антидепрессантов, основным механизмом действия которых является ингибирование обратного захвата серотонина – для других антидепрессантов данная связь утрачивается [26]. Во-вторых, даже при носительстве длинного варианта гена наличие G-аллели в участке rs25531 промотора гена транспортера серотонина ассоциируется с отсутствием терапевтического ответа на терапию флуоксетином [28]. В-третьих, разные клинические факторы являются модулирующими в данной ассоциации. Так, пол, возраст и возраст манифестации болезни ассоциируются с прогнозом. Носители монозиготной аллели длинного варианта промотора демонстрируют повышающуюся эффективность в прямой зависимости от возраста больного и возраста начала болезни [26, 29]. Кроме того, среди носителей длинного варианта промотора у мужчин отмечается повышенная вероятность терапевтического ответа на СИОЗС, тогда как у женщин – ремиссии и большей стабильности достигаемого улучшения [26]. Длинный вариант гена в монозиготном состоянии помимо более высокой эффективности ассоциируется с меньшей вероятностью нежелательных эффектов терапии за исключением увеличения двигательной активности во время ночного сна [30].
Короткий вариант гена транспортера серотонина, находящийся в гомозиготном состоянии, напротив, ассоци-ируется не только с более низкой результативностью терапии, но и c 3,5-кратным увеличением риска возникновения бессонницы, 9,5-кратным увеличением риска ажитации при терапии флуоксетином [31], 5,5-кратным увеличением риска индуцирования мании [32], а также с повышением вероятности формирования быстрой цикличности и смены аффективной фазы.
Поскольку серотониновые рецепторы опосредуют прямые или косвенные эффекты СИОЗС, кодирующие их гены также стали предметом фармакогенетических исследований. Однако в полном соответствии с противоречивостью данных о вовлеченности серотонинергических рецепторов в этиопатогенез БАР результаты этих исследований оказались неоднозначными. Так, некоторые полиморфные варианты генов серотониновых рецепторов типов 1А (их аутоиндукция, как считается, опосредует антидепрессивное действие СИОЗС) и 1В ассоциируются с благоприятными исходами терапии [33], тогда как 1019С/G полиморфизм рецепторов типа 1A ассоциируется с благоприятным терапевтическим эффектом только у представителей азиатских рас [34]. Не выявлено однозначных ассоциаций с показателями эффективности флуоксетина при изучении однонуклеотидных полиморфизмов 102T/C и 1438A/G гена 2А-рецепторов [35, 36], хотя в исследовании STAR*D получены данные о том, что его вариабельность в участках rs7997012 и rs19228040 сказывается на эффективности циталопрама [37, 38].
Вместе с тем при анализе генов серотонинергических рецепторов гораздо более ясные взаимоотношения были получены в отношении их взаимосвязи с побочным действием антидепрессантов. Так, у гомозиготных носителей СС генотипа Т102С или GG варианта полиморфизма 1438G/A гена серотониновых рецепторов подтипа 2А отмечаются более тяжелые и непереносимые нежелательные реакции, в частности тошнота, желудочно-кишечные расстройства и сексуальная дисфункция, а к возникновению тошноты также предрасполагают некоторые полиморфизмы гена рецепторов подтипа 3В [39].
Помимо генов, кодирующих транспортер серотонина и серотониновые рецепторы, на фармакологический ответ на СИОЗС влияют также гены ферментов, участвующих как в формировании (триптофангидроксилаза 1-го и в особенности 2-го типа – TPH1 и TPH2 соответственно), так и в деградации моноаминов – катехол-О-метилтрансферазы и моноаминоксидазы (МАО). При этом если значение TPH1 в фармакогенетике лекарственного ответа варьирует для разных серотонинергических антидепрессантов (ниже для флуоксетина и венлафаксина [40] и выше для пароксетина и циталопрама [41, 42], то в отношении полиморфизмов TPH2 получены более определенные данные: полиморфизм rs2171363 в гетерозиготном состоянии ассоциируется с благоприятным прогнозом [43]. Также удельный вес в фармакогенетике терапевтического ответа на СИОЗС имеет ген, кодирующий белок, модулирующий активность фермента гуанозинтрифосфат-циклогидроксилазы I (GCHFR задействован в биосинтезе тетрагидробиоптерина, выступающего в качестве кофактора триптофан- и тирозингидроксилазы, ключевых ферментов образования серотонина и дофамина) [44], VNTR-полиморфизм гена МАО-А [45] и 158VAL/MET полиморфизм гена катехол-О-метилтрансферазы. Носители Met-варианта гена МАО-А слабее реагируют на терапию [46], кроме того, данный полиморфизм связан со скоростью реализации антидепрессивного действия пароксетина и флувоксамина [47], а rs13306278 полиморфизм в промоторе данного гена обнаруживает связь с формированием ремиссий при применении циталопрама и эсциталопрама [48].
Если сопоставить данные о роли генов транспортера серотонина и серотониновых рецепторов в формировании аффективных расстройств, терапевтического действия и побочных эффектов серотонинергических антидепрессантов, то прослеживается тенденция, что вероятность возникновения/тяжесть самого заболевания и медленно реализующийся терапевтический эффект антидепрессантов связываются в большей степени с генами транспортера серотонина, но не серотониновых рецепторов, тогда как в отношении побочных эффектов, возникающих в краткосрочном периоде, мы видим противоположную картину. Это, возможно, лишний раз подчеркивает тот факт, что нежелательные серотонинергические эффекты связаны как раз с генетическими особенностями постсинаптических рецепторов, в то время как в механизмах болезни и антидепрессивного действия серотониновой нейротрансмиссии отводится скорее регуляторная, опосредующая, а не каузальная роль. С регуляторной ролью серотонинергической системы также соотносятся данные об обнаруженных взаимосвязях некоторых нежелательных эффектов СИОЗС с генетическими вариантами компонентов других систем. Так, индуцированные СИОЗС экстрапирамидные расстройства ассоциируются с полиморфизмом гена дофаминовых D2-рецепторов [57], а суицидальные тенденции при терапии СИОЗС обнаруживают взаимосвязь с генетическими особенностями глутаматергической системы [58] и геном CREB1 [59].
Напоследок К.Гонда отметила, что несмотря на то что генетические факторы вносят 50% вклад в формирование эффективности антидепрессантов при терапии биполярных депрессий, назначения все еще производятся методом проб и ошибок, поскольку до сих пор не разработано рекомендаций по использованию фармакогенетических данных при терапии биполярных депрессий, а процесс трансляции имеющихся знаний осложнен тем, что во многих работах изучались смешанные популяции биполярных и униполярных больных и были получены неоднозначные результаты. Так или иначе, среди генов, кодирующих элементы серотонинергической системы, наибольшего внимания заслуживает ген транспортера серотонина, который должен быть включен в систему многоаллельного тестирования наряду с другими генами, вовлеченными в этиопатогенез биполярного расстройства, поскольку важно понимать, что даже в отношении серотонинергических антидепрессантов многие аспекты их терапевтического и побочного действия обусловлены другими системными механизмами.
В отличие от антидепрессантов, применяемых в основном для терапии депрессивных состояний при биполярном расстройстве, препараты 1-й линии терапии – нормотимики – обладают совершенно иными путями реализации их действия, фармакогенетическим аспектам которых были посвящены два оставшихся доклада.
Антонио Бенабарре из университетской клиники Барселоны изучал генетику суицидального поведения, которое при БАР не только чрезвычайно распространено, но и сопряжено с высокой смертностью, обусловленной как тяжестью состояния, так и выбором наиболее летальных способов. В своем докладе, отталкиваясь от того, что суицидальное поведение является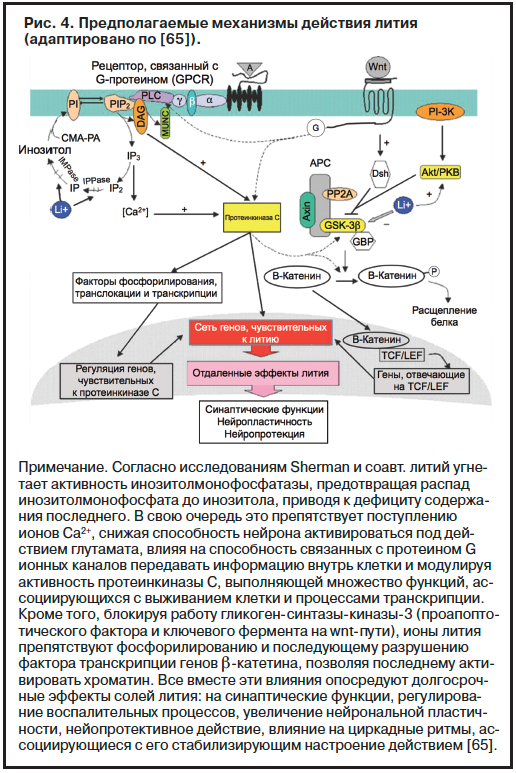 наследуемым феноменом, он рассмотрел его молекулярно-генетические основы, опираясь на предполагаемые механизмы действия солей лития, принимая во внимание, что у препарата выявлено специфическое антисуицидальное действие3.
наследуемым феноменом, он рассмотрел его молекулярно-генетические основы, опираясь на предполагаемые механизмы действия солей лития, принимая во внимание, что у препарата выявлено специфическое антисуицидальное действие3.
Механизмы действия лития (рис. 4) изучены мало, однако среди множества возможных мишеней в последнее время отчетливо вырисовывается взаимодействие ионов металла с двумя путями внутриклеточной передачи сигнала: фозфоинозитоловым и wnt/b-катениновым путями [66]. В основе гипотезы работы, выполненной под руководством А.Бенабарре, лежит предположение, что генетическая вариабельность ферментов на обоих путях действия лития связана с повышенной предрасположенностью к суицидальному поведению у больных БАР. С целью проверки данной гипотезы была изучена выборка из 199 больных БАР с суицидальным поведением. По результатам данной работы было показано, что генетическая вариабельность ферментов инозитолмонофосфатазы
2-го типа (АА-генотип фрагмента rs669838 гена IMPA2), инозитолполифосфатазы (GG-генотип участка rs4853694 гена INPP1) и гликоген-синтазы-киназы 3-го типа (носительство T-аллели в участке rs1732170 или
А-аллели в участке rs11921360 гена GSK-3b) связана с 2–3-кратным и даже более повышением риска суицидального поведения у больных биполярным расстройством [67]. Однако это не единственные генетические факторы риска суицидального поведения. Из опубликованных ранее по данной теме работ следует, что наиболее изученным фактором предрасположенности к суицидальному поведению при БАР является носительство короткой аллели гена транспортера серотонина, в отношении которого обнаружены ассоциации с наличием и количеством суицидальных попыток в анамнезе, их тяжестью и летальностью. Однако помимо гена транспортера серотонина суицидальные тенденции связываются со сниженной экспрессией и функциональным дефектом (Val66met полиморфизм) гена нейротрофного фактора головного мозга (BDNF), участвующего в развитии серотонинергических нейронов. Кроме того, 14-кратное повышение риска суицидов отмечается при гиперактивации системы «гипоталамус–гипофиз–надпочечники», а также с ее патологическим реагированием в ответ на стрессовые факторы [68–70]. И в полном соответствии с этим с суицидальными попытками при биполярном расстройстве ассоциируются нарушения генов, кодирующих рецепторы к кортикотропин-рилизинг-фактору (CRHR1 и CRHR2), генетическая вариабельность гена белка, связывающего CRH (CRHBP). При этом полиморфизм CRHR1 ассоциируется с суицидальным поведением при биполярных депрессиях даже при низких уровнях стрессового воздействия, а его взаимодействие с полиморфизмом CRHBP вносит существенный вклад в утяжеление суицидального поведения [71, 72]. Рядоположенными представляются также данные о том, что с возникновением суицидального поведения и числом депрессивных эпизодов у больных БАР ассоциируется полиморфизм уже упомянутого ранее гена FKBP5, а взаимодействие генетической вариабельности в генах CRHBP и FKBP5 связано с увеличением предиспозиции к суицидальному поведению у больных с травматическими событиями жизни в раннем возрасте [73, 74].
Таким образом, множество генетических факторов ассоциируется с высоким суицидальным риском. Эти биологические маркеры могут представлять дополнительный инструмент в руках психиатров при терапии больных биполярным расстройством. Кроме того, приведенные данные А.Бенабарре показывают, что у выявленного клинически специфического антисуицидального действия солей лития могут иметься свои собственные механизмы, а последующее их сопоставление с факторами риска самоубийства может позволить проводить более адресную и эффективную терапию.
Фармакогенетике терапевтического и побочного действия солей лития было посвящено сообщение Алессандро Серретти. Если раньше понимание патогенеза биполярных расстройств вращалось в основном вокруг моноаминовой гипотезы, то изучение молекулярных основ действия солей лития расширило наше понимание процессов, вовлеченных в генез биполярного расстройства.
В первом полногеномном исследовании была выявлена взаимосвязь действия лития с генами связывающего кальций белка, родственного кальмодулину, и металлопротеинов семейства «цинковых пальцев» [75]. И это соотносится с фактами о том, что кальций играет ключевую роль во внутриклеточных процессах, описанных выше, и что многие препараты, модулирующие кальциевые каналы, используются при терапии биполярного расстройства.
Из другого молекулярно-генетического исследования мы получили данные о зависимости ответа на литий от генов ионных каналов другого типа – натриевых (ген ACCN1) [76]. Не было выявлено неожиданных результатов и еще в одном исследовании [77], проведенном также с привлечением данных исследований клеточных генетических механизмов: с терапевтическим ответом на литий ассоциировалось несколько генов, отвечающих за внутриклеточную передачу сигнала, факторы транскрипции, клеточную адгезию, а также гены, контролирующие клеточный цикл, и гены ионотропных рецепторов к глутамату (табл. 3).
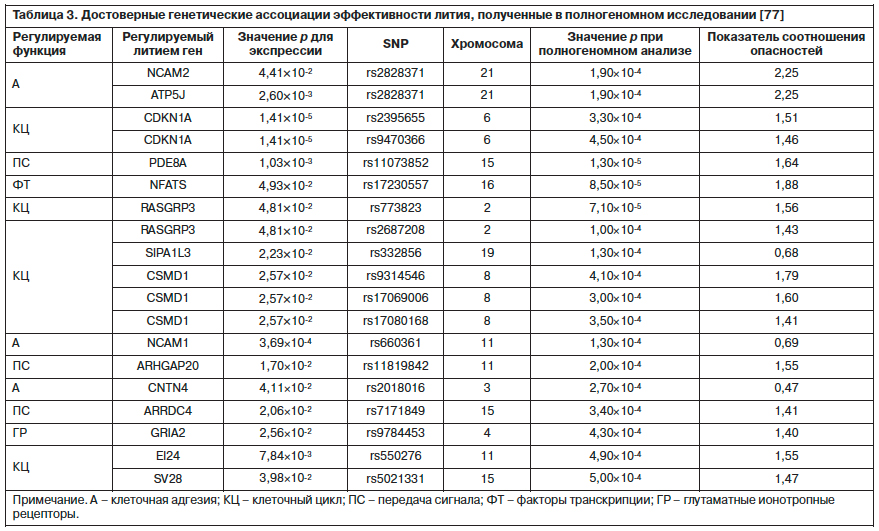
При этом некоторые из этих генов напрямую соотносятся с предполагаемыми механизмами действия лития, а некоторые – требуют комментария. Так, вещества, кодируемые генами клеточной адгезии, участвуют в процессах нейрональной пластичности, роста нервных волокон, в частности в гиппокампе, а эти процессы нарушены при депрессивных расстройствах. Вовлеченность в реализацию эффективности лития генов глутаматергических ионотропных рецепторов также неудивительна, поскольку связанные с ними механизмы ассоциируются с быстрым антидепрессивным ответом, наблюдающимся при введении кетамина. В крупномасштабном натуралистическом исследовании STEP-BP (Study of Therapeutic Effects of Intercessory Prayer) с числом наблюдений свыше 4 тыс. была обнаружена взаимосвязь терапевтического ответа на литий с участком на длинном плече хромосомы 4 (4q32), содержащем гены ионных каналов ACCN5 и глутаматных ионотропных рецепторов (GRIA2), экспрессию которых модулирует литий [78].
Под руководством А.Серретти был проведен альтернативный анализ (пока еще не опубликован) данных исследования STEP-BD, дополняющий предыдущий, в котором в отличие от предшествующей работы рассматривались ассоциации между генами и показателем частоты обострений, а не времени до первого обострения (рис. 5).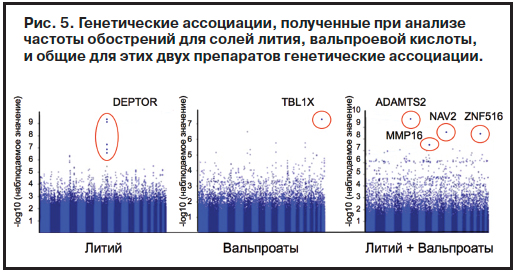 По результатам данной работы терапевтический ответ на литий как депрессивных, так и маниакальных состояний при БАР ассоциируется с геном DEPTOR. И это соотносится с данными предшествующих исследований, поскольку активность данного гена связана не только с уровнями стресса и кортизола [79], но и с активностью системы мишени рапамицина млекопитающих (система mTOR). А следует отметить, что данная система связана с глутаматергической и в течение нескольких часов активируется под воздействием малых доз неселективного блокатора глутаматных N-метил-D-аспартат-рецепторов кетамина, приводя к усилению сигнальной функции синаптических белков, формированию новых синаптических окончаний в префронтальной коре, повышая функциональность последних и опосредуя крайне быстро реализующуюся после однократного введения эффективность вещества в отношении депрессивных состояний (подобное действие не характерно для любых других антидепрессантов). Интересные данные были получены при проведении подобного анализа в отношении эффективности вальпроатов: больные, ответившие в плане частоты эпизодов обоих полюсов на терапию солями вальпроевой кислоты, отличались от остальных больных по гену TBL1X, который опосредует межбелковые взаимодействия, вовлечен во внутриклеточные процессы передачи сигнала, процессинг РНК, регулирование процессов координированного передвижения внутриклеточных везикул и сборки цитоскелета.
По результатам данной работы терапевтический ответ на литий как депрессивных, так и маниакальных состояний при БАР ассоциируется с геном DEPTOR. И это соотносится с данными предшествующих исследований, поскольку активность данного гена связана не только с уровнями стресса и кортизола [79], но и с активностью системы мишени рапамицина млекопитающих (система mTOR). А следует отметить, что данная система связана с глутаматергической и в течение нескольких часов активируется под воздействием малых доз неселективного блокатора глутаматных N-метил-D-аспартат-рецепторов кетамина, приводя к усилению сигнальной функции синаптических белков, формированию новых синаптических окончаний в префронтальной коре, повышая функциональность последних и опосредуя крайне быстро реализующуюся после однократного введения эффективность вещества в отношении депрессивных состояний (подобное действие не характерно для любых других антидепрессантов). Интересные данные были получены при проведении подобного анализа в отношении эффективности вальпроатов: больные, ответившие в плане частоты эпизодов обоих полюсов на терапию солями вальпроевой кислоты, отличались от остальных больных по гену TBL1X, который опосредует межбелковые взаимодействия, вовлечен во внутриклеточные процессы передачи сигнала, процессинг РНК, регулирование процессов координированного передвижения внутриклеточных везикул и сборки цитоскелета.
Принимая во внимание то, что несмотря на различия в механизмах действия солей лития и вальпроевой кислоты на каком-то уровне эти механизмы должны пересекаться, были определены общие гены, участвующие в реализации противорецидивной эффективности обоих лекарственных средств. Таковыми оказались гены, участвующие в формировании металлопротеинов (ADAMTS2, MMP16 и ZNF516) и регулирующие синаптическую пластичность и рост нервных окончаний (NAV2). Примечательно, что металлопротеины играют роль в воспалительных процессах, лежащих в основе депрессивных состояний, и с влиянием на них может быть связано нейропротективное действие лития [80–83]. В частности, связывающие нуклеиновые кислоты и регулирующие транскрипцию так называемые «цинковые пальцы» (ген ZNF516) играют важную роль в процессах пролиферации, дифференцировки и апоптоза клеток и являются генами риска БАР и шизофрении [84]. Если понимать, что все эти генетические механизмы не являются самодостаточными, то перед нами предстает комплексная картина генетической предрасположенности
к биполярному расстройству, раскрывающая дополнительные мишени для фармакологического воздействия
(см. рис. 5).
Другой стороной работы стало изучение взаимосвязи побочных эффектов терапии литием с генетическими основами. Результатами данного анализа стало выявление следующих взаимосвязей:
Таким образом, литий обладает крайне сложным механизмом действия, многие аспекты которого остаются неясными. Однако молекулярно-генетические исследования восполняют существующие пробелы. В приведенных исследованиях взаимосвязей терапевтического ответа на литий фактически реплицируются сопоставимые данные. Среди приблизительно 28 тыс. генов, содержащихся в геноме человека, с терапевтическим ответом на литий ассоциируются гены ионных каналов, ионотропных рецепторов к глутамату и металлопротеинов, которые регулируют множество аспектов стабилизации моноаминовой трансмиссии, процессов, вовлеченных в жизнеобеспечение и цикл клеток и связанных с повышением нейрональной пластичности и с нейропротекцией.
С этих позиций обнаруженные взаимосвязи представляются неслучайными и логичными, позволяют понять причины высокой индивидуальной вариабельности эффектов лития4 и несколько глубже представить всю комплексность механизмов болезни. В заключение А.Серретти отметил, что мы находимся лишь в начале данного пути и в будущем нам еще предстоит сопоставить колоссальные объемы информации.
Таким образом, хочется отметить, что генетическая регуляция фармакологического ответа при проведении терапии БАР осуществляется на всех уровнях и стадиях действия препаратов, включая регулирование циркулирующих концентраций, особенностей мишеней, с которыми взаимодействуют лекарственные вещества, и череду последующих событий, происходящих как в краткосрочной, так и долгосрочной перспективе. С одной стороны, это указывает на благоразумность учета эффективности разных препаратов у родственников пациентов с БАР при проведении терапии, с другой стороны, вся констелляция факторов рисует перед нами индивидуальный ландшафт наблюдаемых терапевтических и побочных эффектов при проведении купирующей и поддерживающей терапии. Показательными являются данные, представленные К.Гонда, свидетельствующие о разобщении и генетической вариабельности предполагаемых механизмов, лежащих в основе терапевтического и побочного действия серотонинергических антидепрессантов, между которыми не выстраивается прямой взаимосвязи: при нормальных терапевтических концентрациях одного и того же препарата у части больных может отмечаться быстрое терапевтическое действие без нежелательных эффектов, а в других случаях наблюдается противоположная картина. Наряду с этим, очерчивая факторы риска, сопряженные с болезнью и эффективностью либо неэффективностью терапии, фармакогенетические исследования задают новые направления научного поиска и, в частности, поднимают проблематику лечения больных, эндофенотипические особенности которых подразумевают неблагоприятный прогноз. Возможно, по аналогии с данными, озвученными в докладе А.Серретти, обнаружение общих патогенетических звеньев, на уровне которых пересекаются каскады действия разных лекарственных препаратов, позволит определить новые мишени для более успешной терапии резистентных случаев.
Более 10 лет назад завершился фундаментальный проект «Геном человека», и за это время произошло существенное расширение методологической базы и снижение стоимости исследований в области молекулярной генетики. Это естественным образом вылилось в проведение целого пласта исследований, направленных на поиск генов, участвующих в формировании предиспозиции к психическим заболеваниям, имеющим полигенный характер наследования. Накапливаются данные об их тонких генетических механизмах с учетом возможных взаимодействий генов друг с другом, а также со средовыми и эпигенетическими факторами. Прогресс в этой области позволяет дополнить представления о клинической картине БАР и о наблюдающемся при нем дисбалансе в моноаминергических системах, а в сочетании с результатами нейровизуализационных и нейрокогнитивных исследований дает возможность взглянуть на заболевание с высоты эндофенотипов, мало зависящих от постоянно изменяющихся классификаций, что, возможно, позволит увеличить уровни достоверности, доказательности и транслируемости исследовательских работ.
Сведения об авторe
Сюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва.
E-mail: Sjunja@bk.ru
Резюме. Данная публикация является одной из серии работ, посвященной материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии (5–9 октября 2013 г., Барселона, Испания). Приведен обзор генетических и фармакогенетических исследований биполярного аффективного расстройства. Обсуждается связь особенностей генотипа с суицидальным поведением при биполярном аффективном расстройстве и с эффективностью купирующей и поддерживающей терапии заболевания.
Ключевые слова: Конгресс Европейской коллегии нейропсихофармакологии, биполярное аффективное расстройство, суицид, генетика, фармакогенетика, фармакокинетика, антидепрессанты, нормотимики, селективные ингибиторы обратного захвата серотонина, литий.
Molecular genetics and pharmacogenetics of bipolar disorder: the overview of proceedings of the 26th ECNP Congress
T.S.Syunyakov
FSBI Zakusov Institute of Pharmacology RAMS, Moscow
Summary. This publication is the part of the series of overviews on proceedings of the 26th Congress of European College of Neuropsychopharmacology (October 5–9 2013, Barcelona, Spain). The overview of genetic and pharmacogenetic studies on bipolar affective disorder is provided. Links between genotype and suicidal behavior and efficacy of acute and maintenance treatment of bipolar disorder are discussed.
Key words: 2013 ECNP Congress, bipolar affective disorder, suicide, genetics, pharmacogenetics, pharmacokinetics, antidepressants, mood stabilizers, selective serotonin reuptake inhibitors, lithium.
Генетические исследования в психиатрии имеют первоочередное значение. Являясь неотъемлемой частью трансляционного процесса, т.е. переноса результатов фундаментальных исследований в область практического применения, они позволяют изучить этиопатогенетические основы болезненных состояний, сформировать эндофенотипы – связку между фенотипическими проявлениями и лежащими у их истоков разнообразными механизмами – и направлены на понимание сути расстройства и выявление терапевтических мишеней, особенно при явлениях терапевтической рефрактерности.
Вопросы психогенетики были широко освещены на
26-м Конгрессе Европейской коллегии нейропсихофармакологии (European College of Nneuropsychopharmacology, ECNP) в Барселоне, проходившем 5–9 октября 2013 г. Здесь нашли отражение, в частности, проблемы фармако-, иммуногенетики, эпигенетики психических расстройств и прежде всего биполярного расстройства и нейродегенеративных заболеваний. Такое распределение тем удачно дополняет круг вопросов, рассматривавшихся весной 2013 г. на другом крупном мероприятии – Конгрессе Европейской психиатрической ассоциации, проводившемся во французской Ницце, где с данных позиций обозревались униполярные аффективные и тревожные расстройства. Данный обзор материалов конгресса сосредоточен на биполярном аффективном расстройстве (БАР), оставив в стороне его иммуногенетические аспекты, которые заслуживают отдельного рассмотрения. Причинами, по которым биполярное расстройство является предметом столь интенсивных исследований в области генетики и фармакогенетики, является не только то, что это тяжелое хроническое заболевание с серьезными последствиями, высоким риском суицидального поведения (23,4% в течение жизни), превосходящим таковой при тяжелых формах депрессивных нарушений (относительный риск 28 в сравнении с 21 [1]), с высокой распространенностью в общем населении, достигающей порядка 0,5–1,5% [2], при недостаточном выявлении и трудностях терапии, но и то, что исследования демонстрируют, что оно является одним из наиболее жестко генетически детерминированных психических заболеваний. Так, риск возникновения болезни среди родственников первой степени родства составляет около 10–15%, а генетическая конкордантность в близнецовых исследованиях достигает 70% [3]. Наследуются также отдельные аспекты состояния, и прежде всего это касается суицидального поведения, в формировании которого генетические факторы играют не меньшую роль, чем клинические или средовые (наследуемость суицидального поведения достигает 43% [4–6]).
Однако понимание генетических и молекулярно-биологических этиопатогенетических факторов до последнего времени едва ли выходило за рамки осознания их комплексности, многогранности и обусловленности множественными взаимодействиями как друг с другом, так и со средовыми и эпигенетическими влияниями, указывая на актуальность их изучения. В этой связи не удивительно, что на конгрессе генетической стороне биполярного расстройства была посвящена отдельная сессия, проводившаяся под председательством Иствана Биттера (Istvan Bitter) из Венгрии и Андреаса Райфа (Andreas Reif) из Германии. Здесь были представлены 4 доклада: Лейфа Бертилссона (Leif Bertillson, Каролинский институт, Швеция) – «Фармакогенетика антидепрессантов, антиконвульсантов и антипсихотиков»; Ксении Гонда (Xenia Gonda, Венгрия) – «Молекулярно-генетические аспекты действия серотонинергических препаратов при биполярном расстройстве»; Алессандро Серретти (Alessandro Serretti, Италия) – «Фармакогенетика эффективности и побочных эффектов терапии биполярного расстройства»; Антони Бенабарре (Antoni Benabarre, Испания) – «Генетика суицидального поведения при биполярном расстройстве: новые данные», – все они были посвящены вопросам фармакогенетики, науки, задачами которой на фундаментальном уровне является восполнение в рамках трансляционного процесса пробелов в знаниях об этиопатогенезе психических расстройств и определение новых мишеней действия и направлений в создании инновационных лекарственных средств, а на прикладном – персонифицированный прогноз терапевтического ответа. При этом в свете замечания профессора Бертилссона о том, что действие препарата выстраивается из континуума событий в ряду, начиная с его всасывания и метаболизма под действием ферментов, и до воздействия на рецепторы и прочие фармакологические мишени с присоединением каскадов дальнейших событий в виде воздействия на нейромедиаторные функции и системы вторичных внутриклеточных мессенджеров и эпигенетических модификаций, вырисовывается отчетливое разделение сообщений на «фармакогенетику фармакокинетики» и «фармакогенетику фармакодинамики».
Фармакогенетическим аспектам фармакокинетики психотропных препаратов было посвящено сообщение профессора Каролинского института (Швеция) Л.Бертилссона. В самом начале своего выступления он обратился к данным 30-летней давности, согласно которым при изучении антигипертензивного средства дебрисохина и его гидроксиметаболита было получено распределение индивидов по соотношению их концентраций, представленное на рис. 1. Оказалось, что в популяции шведов данное соотношение колеблется в диапазоне от сотых долей до нескольких сотен, что свидетельствует о колоссальной изменчивости интенсивности метаболизма препарата, варьирующей в десятки тысяч раз между крайне низкими (справа на рис. 1) и ультравысокими значениями (слева).
Следует отметить, что дебрисохин является маркерным веществом, указывающим на активность фермента CYP2D6 системы цитохромов печени (имеющего большое значение для метаболизма психотропных препаратов, использующихся в том числе для терапии БАР). По данным докладчика, доля лиц с низкой интенсивностью метаболизма CYP2D6 (т.е. с гомозиготным состоянием по мутантному варианту гена CYP2D6) среди населения Швеции достаточно велика и составляет около 7%. И это означает, что у значительной части людей в случае проведения психо-тропной терапии циркулирующие уровни широкого круга антидепрессантов и антипсихотиков, метаболизирующихся данным ферментом, будут повышены. Следует также учитывать, что некоторые препараты являются ингибиторами (угнетают активность) либо индукторами (повышают активность) данного фермента. Таким образом, при одновременном применении двух препаратов, хотя бы один из которых является ингибитором фермента, показатели концентрации препаратов в крови этих больных окажутся еще больше. Вариабельность активности CYP2D6 детерминирована генетически и связана с несколькими функциональными полиморфизмами соответствующего гена, частота встречаемости которых среди представителей европеоидной, монголоидной и негроидной рас различается. И если среди шведов носителями немутантных типов гена являются 70% населения, то, например, в Зимбабве и Китае их доля снижается до 54 и 43%. Соответственно, в последних двух странах повышается доля лиц, наследовавших функционально ограниченные мутантные варианты гена (табл. 1).

Особый интерес представляют ограниченные группы населения, соответствующие крайне левым областям гистограммы, представленной на рис. 1. В отличие от точечного однонуклеотидного
 полиморфизма они отражают полиморфизм фермента другого типа – вариабельность числа копий гена (copy number variance), а у единственного пациента, отражающего крайне левый столбик диаграммы, было обнаружено 13 копий гена, обладающих неизмененной активностью. При этом число вариантов гена в геноме обратно пропорционально плазменным концентрациям субстрата фермента (рис. 2) [7]. Учет указанных вариантов представляется крайне важным с практической точки зрения – у медленных метаболизаторов эффективными окажутся крайне низкие дозы антидепрессанта нортриптилина (10–20 мг), а у быстрых – за пределами верхней границы рекомендованных доз (вплоть до 500–600 мг), при нормальном диапазоне суточных доз в 100–150 мг. По данным исследования C.Kawanishi и соавт. (2004 г.) [8], среди больных с рефрактерными депрессиями доля больных с быстрым метаболизмом в связи с дублированием гена CYP2D6 достигает 10% и точно такая же доля быстрых метаболизаторов среди больных с депрессией с завершенными суицидальными попытками [9]. Кроме того, активность данного метаболического пути коррелирует с выраженностью психастенических личностных черт, являющихся одним из факторов предрасположения к депрессиям [10].
полиморфизма они отражают полиморфизм фермента другого типа – вариабельность числа копий гена (copy number variance), а у единственного пациента, отражающего крайне левый столбик диаграммы, было обнаружено 13 копий гена, обладающих неизмененной активностью. При этом число вариантов гена в геноме обратно пропорционально плазменным концентрациям субстрата фермента (рис. 2) [7]. Учет указанных вариантов представляется крайне важным с практической точки зрения – у медленных метаболизаторов эффективными окажутся крайне низкие дозы антидепрессанта нортриптилина (10–20 мг), а у быстрых – за пределами верхней границы рекомендованных доз (вплоть до 500–600 мг), при нормальном диапазоне суточных доз в 100–150 мг. По данным исследования C.Kawanishi и соавт. (2004 г.) [8], среди больных с рефрактерными депрессиями доля больных с быстрым метаболизмом в связи с дублированием гена CYP2D6 достигает 10% и точно такая же доля быстрых метаболизаторов среди больных с депрессией с завершенными суицидальными попытками [9]. Кроме того, активность данного метаболического пути коррелирует с выраженностью психастенических личностных черт, являющихся одним из факторов предрасположения к депрессиям [10]. 
Однако CYP2D6 – лишь один из целого ряда ферментов системы цитохрома, обладающих генетически детерминированным полиморфизмом. В частности, 3% белого населения Европы являются носителями функционально более низкого по активности фермента CYP3C19, метаболизирующего циталопрам, диазепам, трициклические антидепрессанты, а его ингибитором является флувоксамин. Эталонным препаратом для оценки его активности является омепразол. Среди жителей Японии большинство – носители мутантной аллели со сниженной активностью, и это сказывается на особенностях действия кломипрамина. У японцев препарат, по сути, проявляет свойства селективного ингибитора обратного захвата серотонина (СИОЗС), тогда как в популяции европейцев наличие мощного норадренергического метаболита десметилкломипрамина трансформирует его в антидепрессант с двойным действием. Докладчик также коснулся особенностей, связанных с полиморфизмом CYP1A2, который опосредует метаболические превращения многих антипсихотиков. Нормальную активность фермента кодирует аллель *1А, тогда как у носителей мутантной версии *1С активность энзима снижена, а у носителей *1F – повышена. Его ингибитором является флувоксамин, который в комбинации с клозапином приводит к существенному увеличению плазменных концентраций последнего, повышая вероятность возникновения побочных эффектов. Оценивая активность данного энзима, следует учитывать, что табакокурение вызывает его индукцию, а кофеин – конкурентное ингибирование. Среди других обладающих генетическим полиморфизмом ферментов печени при применении психотропных препаратов может играть роль CYP3A4, участвующий в метаболизме бензодиазепинов и индуцируемый карбамазепином и вальпроатами, а также фермент глюкуронизации UGT1A4, отвечающий за биотрансформацию, в частности оланзапина и ламотриджина. Характеризуя генетический полиморфизм CYP3A4, необходимо добавить, что он практически не сказывается на активности фермента. При этом необходимо учитывать, что у женщин его активность выше, а грейпфрутовый сок является мощным ингибитором энзима.
Таким образом, «фармакогенетика фармакокинетики», являясь одной из наиболее изученных в данной области, способна предоставить информацию, которая уже на сегодняшний день может быть перенесена в практическую плоскость персонифицированной психофармакотерапии, поскольку позволяет соотносить индивидуальные особенности метаболизма пациентов с фармакокинетическими характеристиками препаратов и заблаговременно избегать терапевтических ошибок. В cвязи с этим в качестве дополнения к данному разделу сессии представляется важным привести информацию о путях метаболизма некоторых психотропных препаратов, обновленную данными, представленными на конгрессе (табл. 2).


Отчасти ответу на этот вопрос было посвящено сообщение «Молекулярно-генетические аспекты действия серотонинергических препаратов при биполярном расстройстве», представленное К.Гонда. В кратком вступлении автор рассмотрела данные о нарушениях серотонинергической функции при БАР. Так, в обзорной работе T.Mahmood и T.Silverstone (2001 г.) [11] указывается, что изменения ее активности характерны для всех аффективных расстройств, в том числе имеющих периодическую природу, однако при БАР они имеют некоторые особенности. Согласно экспериментальным исследованиям серотониновая система играет роль в формировании поискового поведения, локомоторной активности, поведения, направленного на поиск пищи, связанного с репродукцией, агрессией, и влияет на восприимчивость к болевым стимулам, т.е. выполняет интегративную функцию в отношении тех аспектов жизнедеятельности, разнонаправленные изменения которых отмечаются при депрессивных и маниакальных полюсах БАР. На нейрохимическом уровне изменения серотонинергической активности у больных с биполярными и униполярными депрессиями сходны и значительно отличаются от изменений при маниакальных состояниях. В головном мозге у больных с БАР, умерших во время депрессивной фазы, в лобных и теменных долях обнаруживалось снижение содержания серотонина и его метаболита 5-оксииндолацетата [12], а также активности обратного захвата серотонина [13], тогда как при маниях отмечается усиление обратного захвата серотонина [14]. При феномене быстрой цикличности отмечается несимметричное распределение связывания лиганда с моноаминовыми рецепторами в головном мозге [15]. Сопоставимые результаты были продемонстрированы в исследованиях содержания 5-оксииндолацетата в спинномозговой жидкости: при депрессиях наблюдается снижение его концентрации [16], а при маниях повышение [17]. Аналогичные по своей направленности изменения при биполярном расстройстве наблюдаются и в отношении обратного захвата серотонина тромбоцитами в периферической крови [18–20]. При этом способность имипрамина связываться с транспортером серотонина при биполярных депрессиях оказалась ниже, чем при униполярных [20]. В генетических исследованиях также прослеживается взаимосвязь разных компонентов серотонинергической системы с биполярной депрессией. Наиболее отчетлива ассоциация заболевания с коротким вариантом1 промотора полиморфного участка гена транспортера серотонина (5HTTLPR) и сVNTR-полиморфизмом2 участка, расположенного в интроне 2 гена транспортера серотонина [21]. В отношении генов серотонинергических рецепторов в генетических исследованиях были получены более противоречивые данные
(в особенности в отношении 1А- и 2А-рецепторов). Тем не менее при БАР обнаружена взаимосвязь с экспрессией гена 5-НТ3В-рецепторов [22], а у женщин с данным диагнозом отмечается незначительная оверэкспрессия гена
5-HT2C-рецепторов [23, 24]. Кроме того, выявляется зависимость между заболеванием и экспрессией других генов, участвующих в серотонинергической системе – полиморфный вариант TPH-A-гена триптофангидроксилазы, ключевого фермента биосинтеза серотонина, значительно повышает риск БАР [25].
Приведенные выше данные определяют глубокую вовлеченность генов разных компонентов серотонинергической системы в этиопатогенетические механизмы БАР, и в особенности это касается некоторых вариантов генов транспортера серотонина, 5-HT3B-рецепторов и ферментов биосинтеза серотонина. При этом данные представляют собой не только факторы уязвимости или отягощения БАР, но и задают вектор поиска генетических предпосылок эффективности психофармакотерапии заболевания у данного конкретного пациента, рассмотрению которых была посвящена оставшаяся часть сообщения.

Следует отметить, что по оценке S.Porcelli и соавт. вклад генетических факторов в формирование антидепрессивного действия достигает 50% [26]. Исходя из исследований генетических ассоциаций, наиболее подходящим геном-кандидатом для данных изысканий является l/s-полиморфизм (т.е. длинный – long или короткий – short варианты) промотора гена транспортера серотонина 5HTTLPR (рис. 3).
По результатам многих работ он ассоциируется c разными аспектами результативности терапии биполярных депрессий. Так, у A.Serretti и M.Kato (2008 г.) [27] приводятся данные, что с l-вариантом гена связана вероятность улучшения ядерных симптомов депрессии, а по результатам метаанализа 33 исследований у представителей европеоидной расы обнаружена ассоциация между геном транспортера серотонина и вероятностью наступления терапевтического ответа и ремиссии: у носителей l-варианта гена наблюдались более благоприятные исходы лечения [26]. Следует отметить, что данная ассоциация имеет ряд особенностей. Во-первых, она касается прежде всего антидепрессантов, основным механизмом действия которых является ингибирование обратного захвата серотонина – для других антидепрессантов данная связь утрачивается [26]. Во-вторых, даже при носительстве длинного варианта гена наличие G-аллели в участке rs25531 промотора гена транспортера серотонина ассоциируется с отсутствием терапевтического ответа на терапию флуоксетином [28]. В-третьих, разные клинические факторы являются модулирующими в данной ассоциации. Так, пол, возраст и возраст манифестации болезни ассоциируются с прогнозом. Носители монозиготной аллели длинного варианта промотора демонстрируют повышающуюся эффективность в прямой зависимости от возраста больного и возраста начала болезни [26, 29]. Кроме того, среди носителей длинного варианта промотора у мужчин отмечается повышенная вероятность терапевтического ответа на СИОЗС, тогда как у женщин – ремиссии и большей стабильности достигаемого улучшения [26]. Длинный вариант гена в монозиготном состоянии помимо более высокой эффективности ассоциируется с меньшей вероятностью нежелательных эффектов терапии за исключением увеличения двигательной активности во время ночного сна [30].
Короткий вариант гена транспортера серотонина, находящийся в гомозиготном состоянии, напротив, ассоци-ируется не только с более низкой результативностью терапии, но и c 3,5-кратным увеличением риска возникновения бессонницы, 9,5-кратным увеличением риска ажитации при терапии флуоксетином [31], 5,5-кратным увеличением риска индуцирования мании [32], а также с повышением вероятности формирования быстрой цикличности и смены аффективной фазы.
Поскольку серотониновые рецепторы опосредуют прямые или косвенные эффекты СИОЗС, кодирующие их гены также стали предметом фармакогенетических исследований. Однако в полном соответствии с противоречивостью данных о вовлеченности серотонинергических рецепторов в этиопатогенез БАР результаты этих исследований оказались неоднозначными. Так, некоторые полиморфные варианты генов серотониновых рецепторов типов 1А (их аутоиндукция, как считается, опосредует антидепрессивное действие СИОЗС) и 1В ассоциируются с благоприятными исходами терапии [33], тогда как 1019С/G полиморфизм рецепторов типа 1A ассоциируется с благоприятным терапевтическим эффектом только у представителей азиатских рас [34]. Не выявлено однозначных ассоциаций с показателями эффективности флуоксетина при изучении однонуклеотидных полиморфизмов 102T/C и 1438A/G гена 2А-рецепторов [35, 36], хотя в исследовании STAR*D получены данные о том, что его вариабельность в участках rs7997012 и rs19228040 сказывается на эффективности циталопрама [37, 38].
Вместе с тем при анализе генов серотонинергических рецепторов гораздо более ясные взаимоотношения были получены в отношении их взаимосвязи с побочным действием антидепрессантов. Так, у гомозиготных носителей СС генотипа Т102С или GG варианта полиморфизма 1438G/A гена серотониновых рецепторов подтипа 2А отмечаются более тяжелые и непереносимые нежелательные реакции, в частности тошнота, желудочно-кишечные расстройства и сексуальная дисфункция, а к возникновению тошноты также предрасполагают некоторые полиморфизмы гена рецепторов подтипа 3В [39].
Помимо генов, кодирующих транспортер серотонина и серотониновые рецепторы, на фармакологический ответ на СИОЗС влияют также гены ферментов, участвующих как в формировании (триптофангидроксилаза 1-го и в особенности 2-го типа – TPH1 и TPH2 соответственно), так и в деградации моноаминов – катехол-О-метилтрансферазы и моноаминоксидазы (МАО). При этом если значение TPH1 в фармакогенетике лекарственного ответа варьирует для разных серотонинергических антидепрессантов (ниже для флуоксетина и венлафаксина [40] и выше для пароксетина и циталопрама [41, 42], то в отношении полиморфизмов TPH2 получены более определенные данные: полиморфизм rs2171363 в гетерозиготном состоянии ассоциируется с благоприятным прогнозом [43]. Также удельный вес в фармакогенетике терапевтического ответа на СИОЗС имеет ген, кодирующий белок, модулирующий активность фермента гуанозинтрифосфат-циклогидроксилазы I (GCHFR задействован в биосинтезе тетрагидробиоптерина, выступающего в качестве кофактора триптофан- и тирозингидроксилазы, ключевых ферментов образования серотонина и дофамина) [44], VNTR-полиморфизм гена МАО-А [45] и 158VAL/MET полиморфизм гена катехол-О-метилтрансферазы. Носители Met-варианта гена МАО-А слабее реагируют на терапию [46], кроме того, данный полиморфизм связан со скоростью реализации антидепрессивного действия пароксетина и флувоксамина [47], а rs13306278 полиморфизм в промоторе данного гена обнаруживает связь с формированием ремиссий при применении циталопрама и эсциталопрама [48].
Если сопоставить данные о роли генов транспортера серотонина и серотониновых рецепторов в формировании аффективных расстройств, терапевтического действия и побочных эффектов серотонинергических антидепрессантов, то прослеживается тенденция, что вероятность возникновения/тяжесть самого заболевания и медленно реализующийся терапевтический эффект антидепрессантов связываются в большей степени с генами транспортера серотонина, но не серотониновых рецепторов, тогда как в отношении побочных эффектов, возникающих в краткосрочном периоде, мы видим противоположную картину. Это, возможно, лишний раз подчеркивает тот факт, что нежелательные серотонинергические эффекты связаны как раз с генетическими особенностями постсинаптических рецепторов, в то время как в механизмах болезни и антидепрессивного действия серотониновой нейротрансмиссии отводится скорее регуляторная, опосредующая, а не каузальная роль. С регуляторной ролью серотонинергической системы также соотносятся данные об обнаруженных взаимосвязях некоторых нежелательных эффектов СИОЗС с генетическими вариантами компонентов других систем. Так, индуцированные СИОЗС экстрапирамидные расстройства ассоциируются с полиморфизмом гена дофаминовых D2-рецепторов [57], а суицидальные тенденции при терапии СИОЗС обнаруживают взаимосвязь с генетическими особенностями глутаматергической системы [58] и геном CREB1 [59].
Напоследок К.Гонда отметила, что несмотря на то что генетические факторы вносят 50% вклад в формирование эффективности антидепрессантов при терапии биполярных депрессий, назначения все еще производятся методом проб и ошибок, поскольку до сих пор не разработано рекомендаций по использованию фармакогенетических данных при терапии биполярных депрессий, а процесс трансляции имеющихся знаний осложнен тем, что во многих работах изучались смешанные популяции биполярных и униполярных больных и были получены неоднозначные результаты. Так или иначе, среди генов, кодирующих элементы серотонинергической системы, наибольшего внимания заслуживает ген транспортера серотонина, который должен быть включен в систему многоаллельного тестирования наряду с другими генами, вовлеченными в этиопатогенез биполярного расстройства, поскольку важно понимать, что даже в отношении серотонинергических антидепрессантов многие аспекты их терапевтического и побочного действия обусловлены другими системными механизмами.
В отличие от антидепрессантов, применяемых в основном для терапии депрессивных состояний при биполярном расстройстве, препараты 1-й линии терапии – нормотимики – обладают совершенно иными путями реализации их действия, фармакогенетическим аспектам которых были посвящены два оставшихся доклада.
Антонио Бенабарре из университетской клиники Барселоны изучал генетику суицидального поведения, которое при БАР не только чрезвычайно распространено, но и сопряжено с высокой смертностью, обусловленной как тяжестью состояния, так и выбором наиболее летальных способов. В своем докладе, отталкиваясь от того, что суицидальное поведение является
 наследуемым феноменом, он рассмотрел его молекулярно-генетические основы, опираясь на предполагаемые механизмы действия солей лития, принимая во внимание, что у препарата выявлено специфическое антисуицидальное действие3.
наследуемым феноменом, он рассмотрел его молекулярно-генетические основы, опираясь на предполагаемые механизмы действия солей лития, принимая во внимание, что у препарата выявлено специфическое антисуицидальное действие3.
Механизмы действия лития (рис. 4) изучены мало, однако среди множества возможных мишеней в последнее время отчетливо вырисовывается взаимодействие ионов металла с двумя путями внутриклеточной передачи сигнала: фозфоинозитоловым и wnt/b-катениновым путями [66]. В основе гипотезы работы, выполненной под руководством А.Бенабарре, лежит предположение, что генетическая вариабельность ферментов на обоих путях действия лития связана с повышенной предрасположенностью к суицидальному поведению у больных БАР. С целью проверки данной гипотезы была изучена выборка из 199 больных БАР с суицидальным поведением. По результатам данной работы было показано, что генетическая вариабельность ферментов инозитолмонофосфатазы
2-го типа (АА-генотип фрагмента rs669838 гена IMPA2), инозитолполифосфатазы (GG-генотип участка rs4853694 гена INPP1) и гликоген-синтазы-киназы 3-го типа (носительство T-аллели в участке rs1732170 или
А-аллели в участке rs11921360 гена GSK-3b) связана с 2–3-кратным и даже более повышением риска суицидального поведения у больных биполярным расстройством [67]. Однако это не единственные генетические факторы риска суицидального поведения. Из опубликованных ранее по данной теме работ следует, что наиболее изученным фактором предрасположенности к суицидальному поведению при БАР является носительство короткой аллели гена транспортера серотонина, в отношении которого обнаружены ассоциации с наличием и количеством суицидальных попыток в анамнезе, их тяжестью и летальностью. Однако помимо гена транспортера серотонина суицидальные тенденции связываются со сниженной экспрессией и функциональным дефектом (Val66met полиморфизм) гена нейротрофного фактора головного мозга (BDNF), участвующего в развитии серотонинергических нейронов. Кроме того, 14-кратное повышение риска суицидов отмечается при гиперактивации системы «гипоталамус–гипофиз–надпочечники», а также с ее патологическим реагированием в ответ на стрессовые факторы [68–70]. И в полном соответствии с этим с суицидальными попытками при биполярном расстройстве ассоциируются нарушения генов, кодирующих рецепторы к кортикотропин-рилизинг-фактору (CRHR1 и CRHR2), генетическая вариабельность гена белка, связывающего CRH (CRHBP). При этом полиморфизм CRHR1 ассоциируется с суицидальным поведением при биполярных депрессиях даже при низких уровнях стрессового воздействия, а его взаимодействие с полиморфизмом CRHBP вносит существенный вклад в утяжеление суицидального поведения [71, 72]. Рядоположенными представляются также данные о том, что с возникновением суицидального поведения и числом депрессивных эпизодов у больных БАР ассоциируется полиморфизм уже упомянутого ранее гена FKBP5, а взаимодействие генетической вариабельности в генах CRHBP и FKBP5 связано с увеличением предиспозиции к суицидальному поведению у больных с травматическими событиями жизни в раннем возрасте [73, 74].
Таким образом, множество генетических факторов ассоциируется с высоким суицидальным риском. Эти биологические маркеры могут представлять дополнительный инструмент в руках психиатров при терапии больных биполярным расстройством. Кроме того, приведенные данные А.Бенабарре показывают, что у выявленного клинически специфического антисуицидального действия солей лития могут иметься свои собственные механизмы, а последующее их сопоставление с факторами риска самоубийства может позволить проводить более адресную и эффективную терапию.
Фармакогенетике терапевтического и побочного действия солей лития было посвящено сообщение Алессандро Серретти. Если раньше понимание патогенеза биполярных расстройств вращалось в основном вокруг моноаминовой гипотезы, то изучение молекулярных основ действия солей лития расширило наше понимание процессов, вовлеченных в генез биполярного расстройства.
В первом полногеномном исследовании была выявлена взаимосвязь действия лития с генами связывающего кальций белка, родственного кальмодулину, и металлопротеинов семейства «цинковых пальцев» [75]. И это соотносится с фактами о том, что кальций играет ключевую роль во внутриклеточных процессах, описанных выше, и что многие препараты, модулирующие кальциевые каналы, используются при терапии биполярного расстройства.
Из другого молекулярно-генетического исследования мы получили данные о зависимости ответа на литий от генов ионных каналов другого типа – натриевых (ген ACCN1) [76]. Не было выявлено неожиданных результатов и еще в одном исследовании [77], проведенном также с привлечением данных исследований клеточных генетических механизмов: с терапевтическим ответом на литий ассоциировалось несколько генов, отвечающих за внутриклеточную передачу сигнала, факторы транскрипции, клеточную адгезию, а также гены, контролирующие клеточный цикл, и гены ионотропных рецепторов к глутамату (табл. 3).

При этом некоторые из этих генов напрямую соотносятся с предполагаемыми механизмами действия лития, а некоторые – требуют комментария. Так, вещества, кодируемые генами клеточной адгезии, участвуют в процессах нейрональной пластичности, роста нервных волокон, в частности в гиппокампе, а эти процессы нарушены при депрессивных расстройствах. Вовлеченность в реализацию эффективности лития генов глутаматергических ионотропных рецепторов также неудивительна, поскольку связанные с ними механизмы ассоциируются с быстрым антидепрессивным ответом, наблюдающимся при введении кетамина. В крупномасштабном натуралистическом исследовании STEP-BP (Study of Therapeutic Effects of Intercessory Prayer) с числом наблюдений свыше 4 тыс. была обнаружена взаимосвязь терапевтического ответа на литий с участком на длинном плече хромосомы 4 (4q32), содержащем гены ионных каналов ACCN5 и глутаматных ионотропных рецепторов (GRIA2), экспрессию которых модулирует литий [78].
Под руководством А.Серретти был проведен альтернативный анализ (пока еще не опубликован) данных исследования STEP-BD, дополняющий предыдущий, в котором в отличие от предшествующей работы рассматривались ассоциации между генами и показателем частоты обострений, а не времени до первого обострения (рис. 5).
 По результатам данной работы терапевтический ответ на литий как депрессивных, так и маниакальных состояний при БАР ассоциируется с геном DEPTOR. И это соотносится с данными предшествующих исследований, поскольку активность данного гена связана не только с уровнями стресса и кортизола [79], но и с активностью системы мишени рапамицина млекопитающих (система mTOR). А следует отметить, что данная система связана с глутаматергической и в течение нескольких часов активируется под воздействием малых доз неселективного блокатора глутаматных N-метил-D-аспартат-рецепторов кетамина, приводя к усилению сигнальной функции синаптических белков, формированию новых синаптических окончаний в префронтальной коре, повышая функциональность последних и опосредуя крайне быстро реализующуюся после однократного введения эффективность вещества в отношении депрессивных состояний (подобное действие не характерно для любых других антидепрессантов). Интересные данные были получены при проведении подобного анализа в отношении эффективности вальпроатов: больные, ответившие в плане частоты эпизодов обоих полюсов на терапию солями вальпроевой кислоты, отличались от остальных больных по гену TBL1X, который опосредует межбелковые взаимодействия, вовлечен во внутриклеточные процессы передачи сигнала, процессинг РНК, регулирование процессов координированного передвижения внутриклеточных везикул и сборки цитоскелета.
По результатам данной работы терапевтический ответ на литий как депрессивных, так и маниакальных состояний при БАР ассоциируется с геном DEPTOR. И это соотносится с данными предшествующих исследований, поскольку активность данного гена связана не только с уровнями стресса и кортизола [79], но и с активностью системы мишени рапамицина млекопитающих (система mTOR). А следует отметить, что данная система связана с глутаматергической и в течение нескольких часов активируется под воздействием малых доз неселективного блокатора глутаматных N-метил-D-аспартат-рецепторов кетамина, приводя к усилению сигнальной функции синаптических белков, формированию новых синаптических окончаний в префронтальной коре, повышая функциональность последних и опосредуя крайне быстро реализующуюся после однократного введения эффективность вещества в отношении депрессивных состояний (подобное действие не характерно для любых других антидепрессантов). Интересные данные были получены при проведении подобного анализа в отношении эффективности вальпроатов: больные, ответившие в плане частоты эпизодов обоих полюсов на терапию солями вальпроевой кислоты, отличались от остальных больных по гену TBL1X, который опосредует межбелковые взаимодействия, вовлечен во внутриклеточные процессы передачи сигнала, процессинг РНК, регулирование процессов координированного передвижения внутриклеточных везикул и сборки цитоскелета.
Принимая во внимание то, что несмотря на различия в механизмах действия солей лития и вальпроевой кислоты на каком-то уровне эти механизмы должны пересекаться, были определены общие гены, участвующие в реализации противорецидивной эффективности обоих лекарственных средств. Таковыми оказались гены, участвующие в формировании металлопротеинов (ADAMTS2, MMP16 и ZNF516) и регулирующие синаптическую пластичность и рост нервных окончаний (NAV2). Примечательно, что металлопротеины играют роль в воспалительных процессах, лежащих в основе депрессивных состояний, и с влиянием на них может быть связано нейропротективное действие лития [80–83]. В частности, связывающие нуклеиновые кислоты и регулирующие транскрипцию так называемые «цинковые пальцы» (ген ZNF516) играют важную роль в процессах пролиферации, дифференцировки и апоптоза клеток и являются генами риска БАР и шизофрении [84]. Если понимать, что все эти генетические механизмы не являются самодостаточными, то перед нами предстает комплексная картина генетической предрасположенности
к биполярному расстройству, раскрывающая дополнительные мишени для фармакологического воздействия
(см. рис. 5).
Другой стороной работы стало изучение взаимосвязи побочных эффектов терапии литием с генетическими основами. Результатами данного анализа стало выявление следующих взаимосвязей:
- вегетативные нарушения – экспрессия гена LINGO2;
- неврологические побочные эффекты – гены RASSF5 (регулирует лимфоцитарную адгезию и рост клеток), NR2C1 (компонент рецепторов к стероидным гормонам, который связывается со специфическими участками ДНК и регулирует генную экспрессию) и WDR72 (ассоциируется с нейрокогнитивным функционированием);
- побочные эффекты со стороны психических функций – гены PPARGC1B (стимулирует активность некоторых факторов транскрипции, вовлечен в регулирование циркадных ритмов, нарушение которых, как известно, ассоциируется с обострением аффективных расстройств, и является геном риска аффективных расстройств) и ZNF93 (металлопротеин из группы «цинковых пальцев», регулирующий транскрипцию);
- нарушения сексуальной сферы – участки rs10507341 (13q12.13) и rs282559 гена PARK2 (для PARK2 показана связь со структурными изменениями в базальных ганглиях и некоторыми поведенческими расстройствами, в том числе с сексуальными нарушениями).
Таким образом, литий обладает крайне сложным механизмом действия, многие аспекты которого остаются неясными. Однако молекулярно-генетические исследования восполняют существующие пробелы. В приведенных исследованиях взаимосвязей терапевтического ответа на литий фактически реплицируются сопоставимые данные. Среди приблизительно 28 тыс. генов, содержащихся в геноме человека, с терапевтическим ответом на литий ассоциируются гены ионных каналов, ионотропных рецепторов к глутамату и металлопротеинов, которые регулируют множество аспектов стабилизации моноаминовой трансмиссии, процессов, вовлеченных в жизнеобеспечение и цикл клеток и связанных с повышением нейрональной пластичности и с нейропротекцией.
С этих позиций обнаруженные взаимосвязи представляются неслучайными и логичными, позволяют понять причины высокой индивидуальной вариабельности эффектов лития4 и несколько глубже представить всю комплексность механизмов болезни. В заключение А.Серретти отметил, что мы находимся лишь в начале данного пути и в будущем нам еще предстоит сопоставить колоссальные объемы информации.
Таким образом, хочется отметить, что генетическая регуляция фармакологического ответа при проведении терапии БАР осуществляется на всех уровнях и стадиях действия препаратов, включая регулирование циркулирующих концентраций, особенностей мишеней, с которыми взаимодействуют лекарственные вещества, и череду последующих событий, происходящих как в краткосрочной, так и долгосрочной перспективе. С одной стороны, это указывает на благоразумность учета эффективности разных препаратов у родственников пациентов с БАР при проведении терапии, с другой стороны, вся констелляция факторов рисует перед нами индивидуальный ландшафт наблюдаемых терапевтических и побочных эффектов при проведении купирующей и поддерживающей терапии. Показательными являются данные, представленные К.Гонда, свидетельствующие о разобщении и генетической вариабельности предполагаемых механизмов, лежащих в основе терапевтического и побочного действия серотонинергических антидепрессантов, между которыми не выстраивается прямой взаимосвязи: при нормальных терапевтических концентрациях одного и того же препарата у части больных может отмечаться быстрое терапевтическое действие без нежелательных эффектов, а в других случаях наблюдается противоположная картина. Наряду с этим, очерчивая факторы риска, сопряженные с болезнью и эффективностью либо неэффективностью терапии, фармакогенетические исследования задают новые направления научного поиска и, в частности, поднимают проблематику лечения больных, эндофенотипические особенности которых подразумевают неблагоприятный прогноз. Возможно, по аналогии с данными, озвученными в докладе А.Серретти, обнаружение общих патогенетических звеньев, на уровне которых пересекаются каскады действия разных лекарственных препаратов, позволит определить новые мишени для более успешной терапии резистентных случаев.
Более 10 лет назад завершился фундаментальный проект «Геном человека», и за это время произошло существенное расширение методологической базы и снижение стоимости исследований в области молекулярной генетики. Это естественным образом вылилось в проведение целого пласта исследований, направленных на поиск генов, участвующих в формировании предиспозиции к психическим заболеваниям, имеющим полигенный характер наследования. Накапливаются данные об их тонких генетических механизмах с учетом возможных взаимодействий генов друг с другом, а также со средовыми и эпигенетическими факторами. Прогресс в этой области позволяет дополнить представления о клинической картине БАР и о наблюдающемся при нем дисбалансе в моноаминергических системах, а в сочетании с результатами нейровизуализационных и нейрокогнитивных исследований дает возможность взглянуть на заболевание с высоты эндофенотипов, мало зависящих от постоянно изменяющихся классификаций, что, возможно, позволит увеличить уровни достоверности, доказательности и транслируемости исследовательских работ.
Сведения об авторe
Сюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва.
E-mail: Sjunja@bk.ru
Список исп. литературыСкрыть список1. Harris EC, Barraclough B. Suicide as an outcome for mental disorders. A meta-analysis. Br J Psychiatry 1997; 170 (3): 205–28.
2. Craddock N, Jones I. Genetics of bipolar disorder. J Med Genet 1999; 36 (8): 585–94.
3. Vehmanen L, Kaprio J, Loennqvist J. Twin studies on concordance for bipolar disorder. Psychiatr Fenn 1995; 26: 107–16.
4. Rihmer A et al. Affective temperaments, as measured by TEMPS-A, among nonviolent suicide attempters. J Affect Disord 2009; 116 (1–2): 18–22.
5. Roy A, Sarchiopone M, Carli V. Gene-environment interaction and suicidal behavior. J Psychiatr Pract 2009; 15 (4): 282–8.
6. Gonda X et al. Suicidal behavior in bipolar disorder: epidemiology, characteristics and major risk factors. J Affect Disord 2012; 143 (1–3): 16–26.
7. Dalén P et al. 10-Hydroxylation of nortriptyline in white persons with 0, 1, 2, 3, and 13 functional CYP2D6 genes. Clin Pharmacol Ther 1998; 63: 444–52.
8. Kawanishi C et al. Increased incidence of CYP2D6 gene duplication in patients with persistent mood disorders: ultrarapid metabolism of antidepressants as a cause of nonresponse. A pilot study. Eur J Clin Pharmacol 2004; 59: 803–7.
9. Zackrisson AL, Lindblom B, Ahlner J. High frequency of occurrence of CYP2D6 gene duplication/multiduplication indicating ultrarapid metabolism among suicide cases. Clin Pharmacol Ther 2010; 88: 354–9.
10. Bertilsson L et al. Debrisoquine hydroxylation polymorphism and personality. Lancet 1989; 1 (8637): 555.
11. Mahmood T, Silverstone T. Serotonin and bipolar disorder. J Affect Disord 2001; 66: 1–11.
12. Young LT et al. Reduced brain 5-HT and elevated NE turnover and metabolites in bipolar affective disorder. Biol Psychiatry 1994; 35: 121–7.
13. Leake A et al. Studies on the serotonin uptake binding site in major depressive disorder and control post-mortem brain: neurochemical and clinical correlates. Psychiatry Res 1991; 39: 155–65.
14. O’Connell RA et al. Single-photon emission computed tomography of the brain in acute mania and schizophrenia. J Neuroimaging 1995; 5: 101–4.
15. Gyulai L et al. I-123 iofetamine single-photon computed emission tomography in rapid cycling bipolar disorder: a clinical study. Biol Psychiatry 1997; 41: 152–61.
16. Asberg M et al. CSF monoamine metabolites in melancholia. Acta Psychiatr Scand 1984; 69: 201–19.
17. Swann AC et al. CSF monoamine metabolites in mania. Am J Psychiatry 1983; 140: 396–400.
18. Ellis PM et al. Platelet tritiated imipramine binding in patients suffering from mania. J Affect Disord 1991; 22: 105–10.
19. Meagher JB et al. Changes in platelet 5-hydroxytryptamine uptake in mania. J Affect Disord 1990; 19: 191–6.
20. Lewis DA, McChesney C. Tritiated imipramine binding distinguishes among subtypes of depression. Arch Gen Psychiatry 1985; 42: 485–8.
21. Masoliver E et al. Serotonin transporter linked promoter (polymorphism) in the serotonin transporter gene may be associated with antidepressant-induced mania in bipolar disorder. Psychiatr Genet 2006; 16: 25–9.
22. Frank B et al. Investigation of the human serotonin receptor gene HTR3B in bipolar affective and schizophrenic patients. Am J Med Genet B Neuropsychiatr Genet 2004; 131B: 1–5.
23. Gutierrez B et al. Allelic association analysis of the 5-HT2C receptor gene in bipolar affective disorder. Neurosci Lett 1996; 212: 65–7.
24. Lerer B et al. Variability of 5-HT2C receptor cys23ser polymorphism among European populations and vulnerability to affective disorder. Mol Psychiatry 2001; 6 (5): 579–85.
25. Bellivier F et al. Association between the tryptophan hydroxylase gene and manic-depressive illness. Arch Gen Psychiatry 1998; 55: 33–7.
26. Porcelli S, Fabbri C, Serretti A. Meta-analysis of serotonin transporter gene promoter polymorphism (5-HTTLPR) association with antidepressant efficacy. Eur Neuropsychopharmacol 2012; 22 (4): 239–58.
27. Serretti A et al. Meta-analysis of serotonin transporter gene promoter polymorphism (5-HTTLPR) association with selective serotonin reuptake inhibitor efficacy in depressed patients. Mol Psychiatry 2007; 12: 247–57.
28. Keers R, Aitchison KJ. Pharmacogenetics of antidepressant response. Expert Rev Neurother 2011; 11 (1): 101–25.
29. Joyce PR et al. Age-dependent antidepressant pharmacogenomics: polymorphisms of the serotonin transporter and G protein b3 subunit as predictors of response to fluoxetine and nortriptyline. Int J Neuropsychopharmacol 2003; 6: 339–46.
30. Putzhammer A et al. Evidence of a role for the 5-HTTLPR genotype in the modulation of motor response to antidepressant treatment. Psychopharmacology (Berl) 2005; 178: 303–8.
31. Perlis RH et al. Serotonin transporter polymorphisms and adverse effects with fluoxetine treatment. Biol Psychiatry 2003; 54: 879–83.
32. Mundo E et al. The role of serotonin transporter protein gene in antidepressant-induced mania in bipolar disorder: preliminary findings. Arch Gen Psychiatry 2001; 58 (6): 539–44.
33. Villafuerte SM et al. SSRI response in depression may be influenced by SNPs in HTR1B and HTR1A. Psychiatr Genet 2009; 19: 281–91.
34. Noro M et al. 5HT1A and 5HT2A receptor genes in treatment response phenotypes in major depressive disorder. Int Clin Psychopharmacol 2010; 25: 228–31.
35. Illi A et al. 5-HTR1A, 5-HTR2A, 5-HTR6, TPH1 and TPH2 polymorphisms and major depression. Neuroreport 2009; 20: 1125–8.
36. Peters EJ et al. Investigation of serotonin-related genes in antidepressant response. Mol Psychiatry 2004; 9: 879–89.
37. McMahon FJ et al. Variation in the gene encoding the serotonin 2A receptor is associated with outcome of antidepressant treatment. Am J Hum Genet 2006; 78: 804–14.
38. Viikki M et al. Interaction between two HTR2A polymorphisms and gender is associated with treatment response in MDD. Neurosci Lett 2011; 501: 20–4.
39. Thomas KLH, Ellingrod VL. Pharmacogenetics of selective serotonin reuptake inhibitors and associated adverse drug reactions. Pharmacotherapy 2009; 29 (7): 822–31.
40. Wang H-C et al. TPH1 is associated with major depressive disorder but not with SSRI/SNRI response in Taiwanese patients. Psychopharmacology (Berl) 2011; 213: 773–9.
41. Ham B-J et al. Association between the tryptophan hydroxylase-1 gene A218C polymorphism and citalopram antidepressant response in a Korean population. Prog Neuropsychopharmacol Biol Psychiatry 2007; 31: 104–7.
42. Serretti A. Pharmacogenomics of psychotropic drugs. Pharmacogenomics 2011; 12 (11): 1509–10.
43. Tsai SJ et al. Tryptophan hydroxylase 2 gene is associated with major depression and antidepressant treatment response. Prog Neuropsychopharmacology Biol Psychiatry 2009.
44. McHugh PC et al. A polymorphism of the GTP-cyclohydrolase I feedback regulator gene alters transcriptional activity and may affect response to SSRI antidepressants. Pharmacogenomics J 2011; 11: 207–13.
45. Yu YW et al. Association study of a monoamine oxidase a gene promoter polymorphism with major depressive disorder and antidepressant response. Neuropsychopharmacology 2005; 30: 1719–23.
46. Arias B et al. Analysis of COMT gene (Val 158 Met polymorphism) in the clinical response to SSRIs in depressive patients of European origin. J Affect Disord 2006; 90: 251–6.
47. Benedetti F et al. Effect of catechol-O-methyltransferase Val(108/158)Met polymorphism on antidepressant efficacy of fluvoxamine. Eur Psychiatry 2010; 25: 476–8.
48. Snyder K et al. Catechol O-methyltransferase pharmacogenomics and selective serotonin reuptake inhibitor response. Pharmacogenomics J 2012; 12: 78–85.
49. Chou JC-Y, Fazzio L. Maintenance treatment of bipolar disorder: Applying research to clinical practice. J Psychiatr Pract 2006; 12 (5): 283–99.
50. Zou Y-F et al. Association of brain-derived neurotrophic factor genetic Val66Met polymorphism with severity of depression, efficacy of fluoxetine and its side effects in Chinese major depressive patients. Neuropsychobiology 2010; 61 (2): 71–8.
51. Licinio J et al. Association of a corticotropin-releasing hormone receptor 1 haplotype and antidepressant treatment response in Mexican-Americans. Mol Psychiatry 2004; 9 (12): 1075–82.
52. Uher R et al. Genetic predictors of response to antidepressants in the GENDEP project. Pharmacogenomics J 2009; 9 (4): 225–33.
53. Esposito K et al. Phosphodiesterase genes and antidepressant treatment response: a review. Ann Med 2008; 41 (3): 177–85.
54. Li X et al. In vivo regulation of glycogen synthase kinase-3b (GSK3) by serotonergic activity in mouse brain. Neuropsychopharmacology 2004; 29 (8): 1426–31.
55. Horstmann S et al. Polymorphisms in GRIK4, HTR2A, and FKBP5 show interactive effects in predicting remission to antidepressant treatment. Neuropsychopharmacology 2010; 35 (3): 727–40.
56. Serretti A et al. A preliminary investigation of the influence of CREB1 gene on treatment resistance in major depression. J Affect Disord 2011; 128 (1–2): 56–63.
57. Hedenmalm K et al. Risk factors for extrapyramidal symptoms during treatment with selective serotonin reuptake inhibitors, including cytochrome P-450 enzyme, and serotonin and dopamine transporter and receptor polymorphisms. J Clin Psychopharmacol 2006; 26 (2): 192–7.
58. Laje G et al. Genetic markers of suicidal ideation emerging during citalopram treatment of major depression. Am J Psychiatry 2007; 164 (10): 1530–8.
59. Perlis RH et al. Association between treatment-emergent suicidal ideation with citalopram and polymorphisms near cyclic adenosine monophosphate response element binding protein in the STAR*D study. Arch Gen Psychiatry 2007; 64 (6): 689–97.
60. Cipriani A et al. Lithium in the prevention of suicidal behavior and all-cause mortality in patients with mood disorders: a systematic review of randomized trials. Am J Psychiatry 2005; 162 (10): 1805–19.
61. Baldessarini RJ et al. Decreased risk of suicides and attempts during long-term lithium treatment: a meta-analytic review. Bipolar Disord 2006; 8 (5 Pt 2): 625–39.
62. Yerevanian BI, Choi YM. Impact of psychotropic drugs on suicide and suicidal behaviors. Bipolar Disord 2013; 15 (5): 594–621.
63. Cipriani A et al. Lithium in the prevention of suicide in mood disorders: updated systematic review and meta-analysis. BMJ 2013; 346: f3646.
64. Tondo L et al. Lithium treatment and risk of suicidal behavior in bipolar disorder patients. J Clin Psychiatry 1998; 59 (8): 405–14.
65. Lenox RH, Wang L. Molecular basis of lithium action: integration of lithium-responsive signaling and gene expression networks. Mol Psychiatry 2003; 8 (2): 135–44.
66. Serretti A, Drago A, De Ronchi D. Lithium pharmacodynamics and pharmacogenetics: focus on inositol mono phosphatase (IMPase), inositol poliphosphatase (IPPase) and glycogen sinthase kinase 3 beta (GSK-3b). Curr Med Chem 2009; 16 (15): 1917–48.
67. Jiménez E et al. Genetic variability at IMPA2, INPP1 and GSK3β increases the risk of suicidal behavior in bipolar patients. Eur Neuropsychopharmacol 2013; 23 (11): 1452–62.
68. Coryell W, Schlesser M. The dexamethasone suppression test and suicide prediction. Am J Psychiatry 2001; 158 (5): 748–53.
69. Pompili M et al. The hypothalamic-pituitary-adrenal axis and serotonin abnormalities: a selective overview for the implications of suicide prevention. Eur Arch Psychiatry Clin Neurosci 2010; 260 (8): 583–600.
70. Carballo JJ et al. Family history of suicidal behavior and early traumatic experiences: additive effect on suicidality and course of bipolar illness? J Affect Disord 2008; 109 (1–2): 57–63.
71. De Luca V, Tharmalingam S, Kennedy JL. Association study between the corticotropin-releasing hormone receptor 2 gene and suicidality in bipolar disorder. Eur Psychiatry 2007; 22 (5): 282–7.
72. Wasserman D et al. The CRHR1 gene: a marker for suicidality in depressed males exposed to low stress. Genes Brain Behav 2008; 7 (1): 14–9.
73. Roy A et al. Two HPA axis genes, CRHBP and FKBP5, interact with childhood trauma to increase the risk for suicidal behavior. J Psychiatr Res 2012; 46 (1): 72–9.
74. Willour VL et al. Family-based association of FKBP5 in bipolar disorder. Mol Psychiatry 2009; 14 (3): 261–8.
75. Turecki G. et al. Mapping susceptibility genes for bipolar disorder: a pharmacogenetic approach based on excellent response to lithium. Mol Psychiatry 2001; 6 (5): 570–8.
76. Squassina A et al. Evidence for association of an ACCN1 gene variant with response to lithium treatment in Sardinian patients with bipolar disorder. Pharmacogenomics 2011; 12 (11): 1559–69.
77. McCarthy MJ, Leckband SG, Kelsoe JR. Pharmacogenetics of lithium response in bipolar disorder. Pharmacogenomics 2010; 11 (10): 1439–65.
78. Perlis RH et al. A genomewide association study of response to lithium for prevention of recurrence in bipolar disorder. Am J Psychiatry 2009; 166 (6): 718–25.
79. Mparmpakas D et al. Placental DEPTOR as a stress sensor during pregnancy. Clin Sci (Lond) 2012; 122 (7): 349–59.
80. Tsai L-K et al. The mood stabilizers valproic acid and lithium enhance mesenchymal stem cell migration via distinct mechanisms. Neuropsychopharmacology 2010; 35 (11): 2225–37.
81. Hui W et al. Lithium protects cartilage from cytokine-mediated degradation by reducing collagen-degrading MMP production via inhibition of the P38 mitogen-activated protein kinase pathway. Rheumatology (Oxford) 2010; 49 (11): 2043–53.
82. Fu Y et al. A potential strategy for high-grade gliomas: combination treatment with lithium chloride and BmK CT. Biotechnol Lett 2012; 34 (1): 9–17.
83. Nadri C et al. Elevated urinary ADAM12 protein levels in lithium-treated bipolar patients. J Neural Transm 2007; 114 (4): 473–7.
84. Lee KW et al. Genome wide association studies (GWAS) and copy number variation (CNV) studies of the major psychoses: what have we learnt? Neurosci Biobehav Rev 2012; 36 (1): 556–71.


