Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2014
Современные стратегии лечения аффективных расстройств: обзор материалов 26-го Конгресса Европейской коллегии нейропсихофармакологии №04 2014
Номера страниц в выпуске:19-25
На 26-м Европейском Конгрессе нейропсихофармакологиии (European College of Neuropsychopharmacology, ECNP), проходившем 5–9 октября 2013 г. в Барселоне (Испания), были представлены как результаты исследований, относящиеся к хорошо известным и давно использующимся в клинической практике препаратам, так и новые разработки фармацевтических компаний, относящиеся к терапии депрессивных расстройств.
Резюме. Настоящая публикация представляет собой расширенный обзор и анализ основных докладов и постерных сообщений 26-го Конгресса Европейской коллегии нейропсихофармакологии (5–9 октября 2013 г., Барселона, Испания), посвященных проблемам медикаментозной и немедикаментозной терапии депрессивных расстройств и биполярного аффективного расстройства на современном этапе.
Ключевые слова: депрессивное расстройство, биполярное аффективное расстройство, психофармакотерапия, психотерапия.
Modern treatment strategies of affective disorders: review of the materials
of the 26st European College of Neuropsychopharmacology
A.V.Pavlichenko1, A.A.Hovsepyan2
1N.I.Pirogov Russian National Research Medical University, Moscow;
2Yerevan State Medical University, Department of Psychiatry, Armenia
Summary. This publication provides an overview of plenary symposia and poster sessions of the 26th European College of Neuropsychopharmacology (October 5–9 2013, Barcelona, Spain) concerning management (psychopharmacotherapy, psychotherapy) of depressive disorder and bipolar affective disorder.
Key words: bipolar affective disorder, depressive disorder, psychopharmacotherapy, psychotherapy.
(Испания), были представлены как результаты исследований, относящиеся к хорошо известным и давно использующимся в клинической практике препаратам, так и новые разработки фармацевтических компаний, относящиеся к терапии депрессивных расстройств.
Большое место в материалах конгресса было уделено применению нового лекарственного средства фирмы Lundbeck вортиоксетину (vortioxetin), который относится к группе серотониновых модуляторов и стимуляторов. Препарат сочетает в себе свойства селективного ингибитора обратного захвата серотонина (СИОЗС), высокоселективного агониста 5-HT1A-рецепторов, частичного агониста 5-HT1B-рецепторов и антагониста 5-HT3A и 5-HT7-рецепторов. Согласно результатам исследования L.Haggstrom и соавт., в котором вортиоксетин (15–20 мг) сравнивался с дулоксетином (60 мг) и плацебо у пациентов с рекуррентным депрессивным расстройством (РДР), препарат обнаружил достаточную терапевтическую эффективность: к концу 52-й недели терапии было зарегистрировано снижение баллов по шкале Монтгомери–Асберга для оценки депрессии (Montgomery–Asberg Depression Rating Scale, MADRS) с 16,2 до 5,0. Нежелательные эффекты наблюдались у 78,9% пациентов, однако большинство из них были оценены как легкие или умеренные. Наиболее частыми побочными эффектами, отмечавшимися более чем у 10% пациентов, были тошнота, головокружение, головная боль и назофарингит. В целом 9,9% пациентов прекратили участие в исследовании из-за побочных эффектов (холецистит, холелитиаз, депрессия, головная боль, бессонница, тошнота, беременность и генерализованный зуд). Еще в одном исследовании изучалась эффективность вортиоксетина у пациентов с резистентной депрессией. Оказалось, что при переходе с СИОЗС на вортиоксетин наблюдалось значительное улучшение состояния пациентов на 8-й неделе терапии. Отдельно было прослежено воздействие вортиоксетина на когнитивные симптомы в рамках РДР. Было показано независимое от других депрессивных симптомов позитивное влияние препарата на улучшение когнитивных функций.
В большом исследовании под руководством M.Lemke и B.Barthel (Германия), в котором приняли участие около 3 тыс. амбулаторных пациентов с РДР, было показано, что к концу 24-й недели агомелатин (agomelatin) оказался эффективен у 79% пациентов, причем у 55,3% из них состояние можно было оценить как полную ремиссию. Также была выявлена положительная корреляция между быстротой ответа на лечение и конечным результатом/стойкостью ремиссии. Был зафиксирован высокий уровень комплаенса – 89,6%. Побочные явления были зафиксированы всего у 3,6% пациентов, из них только у 0,2% они привели к отмене препарата. Перспективную работу представила группа исследователей во главе c C.Peretti (Италия), изучавших предикторы раннего ответа на терапию агомелатином на основе данных электроэнцефалограммы, в частности когерентности как количественного показателя активности головного мозга. Сравнение групп респондеров и нонреспондеров, а также здоровых людей показало, что когерентность до начала приема препарата по срединной линии и в правых лобных областях может быть использована в качестве предиктора эффективности агомелатина. Группа французских исследователей (F.Boulle и соавт.) изучала влияние агомелатина на нейрональную пластичность и функции гиппокампа у мышей, подвергшихся длительному стрессу. Оказалось, что даже незначительные социально-стрессовые факторы влияют на поведение и могут вызывать в гиппокампе заметную активацию межклеточных сигнальных каскадов, а также повышение генной транскрипции, связанное с пластичностью. В то же время агомелатин может редуцировать поведенческие расстройства, индуцированные хроническим стрессом, а при длительном применении предотвращает нарушения межклеточных связей, патологическую экспрессию генов и восстанавливает нормальный фенотип у подвергавшихся стрессу мышей.
Исследование греческих ученых под руководством P.Sakka было посвящено изучению эффективности эсциталопрама (escitalopram) в терапии депрессивных состояний, протекающих как на фоне коморбидных неврологических расстройств (болезнь Альцгеймера, эпилепсия, болезнь Паркинсона, рассеянный склероз, инсульт), так и без них.
В целом препарат доказал терапевтическую эффективность у обеих групп пациентов. В то же время к концу исследования в группе пациентов, страдающих коморбидными расстройствами, было зарегистрировано менее выраженное улучшение состояния; у них также была отмечена вдвое большая распространенность нежелательных явлений. В работе румынских коллег D.Podea и R.Georgescu было показано, что 6-месячное использование эсциталопрама у лиц с РДР сопровождается не только снижением депрессивной симптоматики, но и значительным улучшением социального и профессионального функционирования.
Исследование американских психиатров во главе с A.Sambunaris было посвящено изучению нового антидепрессанта левомилнаципрана (levomilnacipran – 1S, 2R-milnacipran), который является СИОЗС, и норадреналина (СИОЗСН), причем его ингибирующая мощность в отношении норадреналина в 2 раза больше, чем в отношении серотонина. По результатам ряда краткосрочных исследований (8 нед) препарат был рекомендован для лечения РДР. Также оказалось, что его применение сопровождается улучшением социального функционирования.
Интересное исследование канадских ученых под руководством A.McIntyre было посвящено изучению эффективности кветиапина у пациентов с двойным диагнозом: РДР и фибромиалгия. Оказалось, что к концу 4-й недели лечения препарат оказывает выраженный антидепрессивный эффект и анальгетическое действие, которое, однако, существенно не отличается от аналогичного действия ряда некоторых антидепрессантов.
Американские исследователи во главе с J.Edwards представили результаты лечения больных с депрессией препаратом вилазодон (vilazodone), сочетающего в себе свойства СИОЗС и парциального агониста 5-HT1A-рецепторов. Особую эффективность препарат показал в устранении симптомов тревоги, что дает основание рекомендовать его при лечении депрессивных состояний с выраженным тревожным синдромом.
Новые данные о хроническом воспалении как одной из причин развития РДР представили испанские ученые [23]. Было отмечено, что высокие концентрации провоспалительных цитокинов могут модулировать нейротрансмиссию, нарушать регуляцию механизмов апоптоза и поражать глюкокортикоидную ось. Кроме того, экзогенное поступление в организм a-интерферона может вызывать нарушения серотонинергической и дофаминергической нейротрансмиссии, а также глюкокортикоидной оси и нейротрофических факторов, что приводит к развитию депрессивной симптоматики. Вследствие этого лица, принимающие противовирусные препараты, находятся в группе риска в отношении развития депрессивных состояний.
Важнейшей задачей фармакологического лечения БАР является подбор индивидуальной терапии для конкретного пациента. Также важно сохранять ремиссию, а для достижения этой цели может потребоваться назначение нескольких препаратов. Кроме того, по сравнению с манией депрессивные состояния в рамках БАР требуют более пристального внимания из-за высокого риска суицида, возможного повышения массы тела и кардиологических проблем.
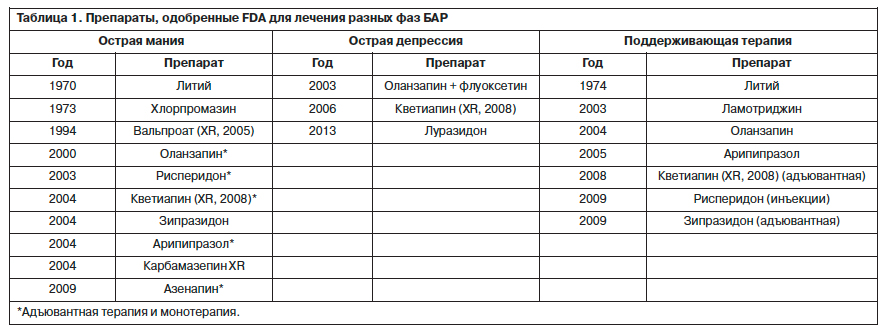
За последние 40 лет Управление по контролю качества пищевых продуктов и лекарств в США (Food and Drug Administration, FDA) одобрило несколько лекарственных средств для лечения разных фаз БАР (табл. 1). В настоящее время удовлетворена потребность практической психиатрии в препаратах для лечения маниакальных состояний, однако текущий арсенал психотропных средств для лечения депрессивных состояний и поддерживающей терапии в рамках БАР остается недостаточным, что заставляет исследователей искать новые препараты, в том числе с иными механизмами действия [11].
Несмотря на общий застой в сфере психофармакотерапии, связанный с недостаточным выходом на рынок новых лекарственных средств, в области лекарственной терапии БАР дела обстоят немного лучше. Так, в августе 2013 г. FDA одобрила препарат луразидон (lurasidon) для купирующей терапии биполярной депрессии. По химической структуре луразидон относится к антипсихотикам, и его действие связано с антагонизмом в отношении D2 и 5-НТ2A-рецепторов. Полагают, что его эффективность при биполярной депрессии связана с антагонизмом в отношении 5-НТ7-рецепторов. Луразидон продемонстрировал эффективность при биполярной депрессии в двух из трех исследований в качестве монотерапии и еще в двух исследованиях в комбинации с другими препаратами (литием и вальпроатом). Показатель NTT (number needed to treat – число больных, которых необходимо пролечить для получения одного благоприятного исхода) в этих исследованиях равнялся 7. Рекомендуемая доза при биполярной депрессии лежит в диапазоне 20–120 мг однократно. Нежелательные явления, включающие тошноту, головную боль и сомнолентность, наблюдались не более чем у 8% больных.
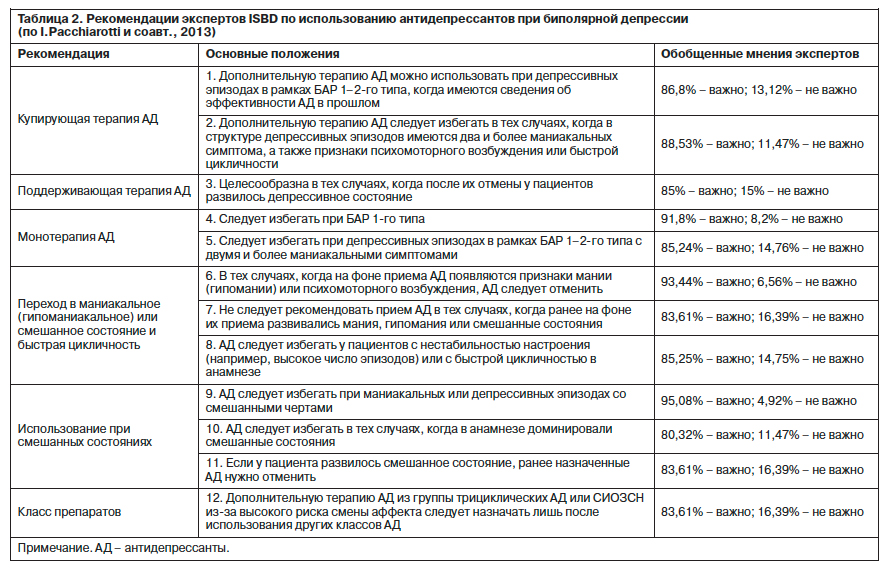
В связи с тем что использование антидепрессантов при БАР по-прежнему вызывает много вопросов, рабочая группа экспертов Международного общества по изучению биполярного расстройства (International Society for Bipolar Disorders, ISBD) опубликовала расширенные рекомендации по этой проблеме (табл. 2).
Эффективность психотропных средств при маниакальных состояниях в рамках БАР недавно была подтверждена в нескольких метаанализах [4, 30]. В одном из них [4], базирующемся на анализе 68 рандомизированных контролируемых исследований (РКИ) с участием более 16 тыс. больных, был составлен рейтинг эффективности (в сравнении с плацебо) антиманиакальных средств (в порядке убывания эффекта препарата): галоперидол (стандартизированная разность средних – 0,56), рисперидон (0,5), оланзапин (0,43), литий (0,37), кветиапин (0,37), арипипразол (0,37), карбамазепин (0,36), асенапин (0,3), вальпроат (0,2), зипразидон (0,2). Терапия оланзапином, рисперидоном и кветиапином значительно реже сопровождалась выбыванием пациентов из исследований, чем использование лития и ламотриджина. Если сравнить эти данные с последним большим метаанализом эффективности психотропных средств для лечения шизофрении [13], где оланзапин (0,59), рисперидон (0,56), галоперидол (0,45), кветиапин (0,44) и арипипразол (0,43) также входили в перечень наиболее эффективных средств, то можно заметить сходства между метаанализами в отношении эффективности многих атипичных антипсихотиков. Но были получены и некоторые различия. В частности, галоперидол был самым эффективным средством при лечении биполярной мании, однако его эффективность при шизофрении была средняя. Кроме того, лица с БАР лучше, чем больные шизофренией, переносят атипичные антипсихотики (например, уровень экстрапирамидных симптомов при терапии биполярной мании оланзапином составил 9,1%, в то время как при шизофрении он был равен 14,5%), но хуже – традиционные антипсихотики (уровень экстрапирамидных симптомов при терапии галоперидолом составил 38,3 и 54,1% соответственно).
В последние годы вновь наблюдается интерес исследователей к солям лития, который был зарегистрирован для лечения БАР еще в 70-х годах прошлого века на основании лишь одного плацебо-контролируемого исследования.
С того времени было проведено еще четыре плацебо-контролируемых исследования, данные о которых были обобщены в метаанализе 2004 г., показавшем, что литий значительно превосходит плацебо в отношении профилактики маниакальных, но не депрессивных эпизодов [9]. В дальнейшем еще в нескольких работах была показана ценность использования лития в терапии БАР. Так, в одном большом международном исследовании изучались больные БАР, которые ранее ответили на терапию кветиапином и в дальнейшем были переведены на препараты лития или плацебо. Оказалось, что его использование намного эффективнее, чем прием плацебо, в плане профилактики как маниакальных, так и депрессивных приступов. Литий был эффективен в тех случаях, когда его плазменная концентрация была больше 0,6 ммоль/л [29]. Еще в одном фармакоэпидемиологическом исследовании, проведенном в Дании, пациенты (4268 человек), у которых впервые в жизни было диагностировано БАР, получали литий или вальпроат. Было обнаружено, что у пациентов, получающих литий, реже, чем у больных другой группы, отмечались госпитализации в стационар, реже наблюдались смены настроения и необходимость в назначении других психо-тропных средств [10].
В настоящее время существует несколько исследований, доказывающих эффективность комбинированной противорецидивной терапии БАР. В частности, в большом международном исследовании BALANCE изучалась противорецидивная эффективность лития у тех больных, которые первоначально ответили на совместный прием лития и вальпроата. Оказалось, что использование данной комбинации в дальнейшем, так же как и монотерапия литием, более эффективно, чем монотерапия вальпроатами, в отношении профилактики любого аффективного эпизода. Кроме того, эта комбинация была более эффективна, чем применение вальпроатов, в отношении профилактики маниакальных приступов, и только литий был эффективен в отношении депрессивных эпизодов. Полученные результаты не зависели от тяжести и фазы болезни, а также сохранялись на протяжении последующих двух лет наблюдений [1]. Еще в одном исследовании было показано, что поддерживающая терапия комбинацией кветиапина и лития (или вальпроата) была значительно более эффективна, чем использование плацебо и лития (или вальпроата), в отношении развития разных аффективных эпизодов (маниакальных, депрессивных, смешанных) вне зависимости от полярности начального приступа [28].
При проведении противорецидивной фармакотерапии БАР целесообразно придерживаться нескольких общих принципов: 1) литий предотвращает маниакальные и депрессивные обострения; 2) арипипразол предотвращает развитие маниакальных состояний; 3) карбамазепин менее эффективен, чем литий, и при его использовании всегда нужно помнить о фармакокинетических взаимодействиях с другими препаратами; 4) оланзапин больше предотвращает развитие маниакальных, чем депрессивных приступов; 5) кветиапин предотвращает как маниакальные, так и депрессивные приступы; 6) вальпроаты, по-видимому, эффективны в профилактике маниакальных обострений; 7) ламотриджин больше предотвращает развитие депрессивных, чем маниакальных приступов [8].
К сожалению, в настоящее время не хватает данных об использовании психотропных средств при смешанных биполярных эпизодах, что в первую очередь связано с тем, что эти вопросы лишь в последнее время стали привлекать внимание исследователей, особенно после выхода 5-го издания Руководства по диагностике и статистике психических расстройств (Diagnostic and Statistical Manual of mental disorders, 5th edition, DSM-5), где критерии диагностики смешанных состояний были существенно пересмотрены. По-видимому, полученные данные об эффективности антиманиакальных или антидепрессивных стратегий терапии не могут быть просто перенесены на терапию смешанных состояний в рамках БАР с преобладанием маниакальных или депрессивных состояний соответственно. Недавно был опубликован метаанализ 9 РКИ, включающий около 1300 пациентов со смешанными эпизодами, который выявил значительное превосходство антипсихотиков II поколения (арипипразол, азенапин, оланзапин, рисперидон, палиперидон) над плацебо как в качестве монотерапии, так и в комбинации со стабилизаторами настроения в отношении редукции смешанных эпизодов с преобладанием маниакальных симптомов. В то же время их эффективность в лечении депрессивных смешанных эпизодов вызывает много вопросов [16]. Есть единичные данные о том, что недавно зарегистрированный FDA для лечения биполярной депрессии препарат луразидон может быть также эффективен при биполярных депрессиях с маниакальными симптомами [15]. Анализ разных показателей по оценочной шкале маний Янга (Young Mania Rating Scale, YMRS) показал, что наличие даже субклинически выраженных смешанных симптомов (повышенная двигательная активность, речевой напор, скачка идей) в структуре биполярной депрессии связано с высокой вероятностью развития индуцированной антидепрессантами мании или гипомании [7]. Также было показано, что почти у 40% пациентов с БАР, получающих антидепрессанты, в дальнейшем развивается хотя бы один смешанный эпизод [24].
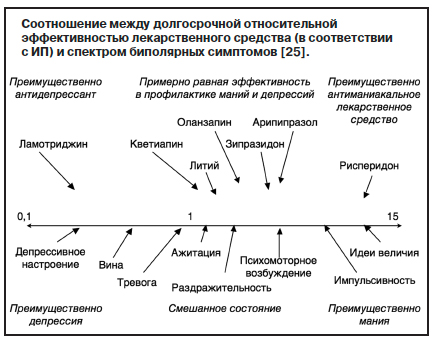 оды болезни и способы лечения в обычной клинической практике. Уровень рецидивов (развитие любых аффективных приступов менее чем через 8 нед после предыдущего эпизода) и обострений (развитие аффективного эпизода через 8 нед и более после предыдущего обострения) составлял 18,2 и 40,5% соответственно. Психотропные средства широко использовались во время всех аффективных эпизодов, а также в эутимном периоде. Процент лиц, не принимающих препараты, варьировал от 11% при маниях до 6,1% в состоянии ремиссии. При маниакальных состояниях чаще всего использовались атипичные антипсихотики (77,6%) и антиконвульсанты, преимущественно литий и вальпроаты (60,8%). При эутимных состояниях врачи использовали атипичные антипсихотики (64,2%), антиконвульсанты (60,8%), бензодиазепины (25,5%) и СИОЗС (25,4%). При биполярной депрессии антидепрессанты использовались в 73,3% наблюдений, атипичные антипсихотики – в 57,2%, антиконвульсанты – в 56,9%, а бензодиазепины – в 30,0% наблюдений. Еще одним результатом исследования явились данные относительно общего количества психотропных средств, применяемых во время разных фаз БАР. Так, при маниях в среднем использовалось 2,8 препарата, при депрессиях – 3,1, при смешанных состояниях – 3,2, а в эутимном периоде – 2,9 препарата [27].С учетом того что многие психотропные средства (в первую очередь атипичные антипсихотики) зарегистрированы при одних и тех же состояниях в рамках БАР (мании, депрессии), врачи часто нуждаются в более четких указаниях, какие именно препараты целесообразнее использовать при доминировании конкретных психопатологических симптомов. На основе показателя NNT был предложен метрический инструмент – индекс полярности (ИП), – с помощью которого можно предположить преимущественный профиль активности препарата при поддерживающей терапии БАР в зависимости от спектра биполярных симптомов (см. рисунок). Если ИП препарата равен 1, то это означает, что он с одинаковой эффективностью предотвращает как депрессивные, так и маниакальные приступы. Если ИП>1, то его лучше использовать для профилактики маниакальных приступов, если ИП<1, то он будет более эффективен при доминировании депрессивных состояний. Чем больше ИП отличается от 1, тем, соответственно, более выражен противорецидивный антиманикальный (или антидепрессивный) профиль препарата. Для препаратов, зарегистрированных FDA для поддерживающей терапии БАР, были получены следующие показатели ИП: рисперидон (12,09), арипипразол (4,38), зипразидон (3,91), оланзапин (2,98), литий (1,39), кветиапин (1,14), ламотриджин (0,14) [18, 27].
оды болезни и способы лечения в обычной клинической практике. Уровень рецидивов (развитие любых аффективных приступов менее чем через 8 нед после предыдущего эпизода) и обострений (развитие аффективного эпизода через 8 нед и более после предыдущего обострения) составлял 18,2 и 40,5% соответственно. Психотропные средства широко использовались во время всех аффективных эпизодов, а также в эутимном периоде. Процент лиц, не принимающих препараты, варьировал от 11% при маниях до 6,1% в состоянии ремиссии. При маниакальных состояниях чаще всего использовались атипичные антипсихотики (77,6%) и антиконвульсанты, преимущественно литий и вальпроаты (60,8%). При эутимных состояниях врачи использовали атипичные антипсихотики (64,2%), антиконвульсанты (60,8%), бензодиазепины (25,5%) и СИОЗС (25,4%). При биполярной депрессии антидепрессанты использовались в 73,3% наблюдений, атипичные антипсихотики – в 57,2%, антиконвульсанты – в 56,9%, а бензодиазепины – в 30,0% наблюдений. Еще одним результатом исследования явились данные относительно общего количества психотропных средств, применяемых во время разных фаз БАР. Так, при маниях в среднем использовалось 2,8 препарата, при депрессиях – 3,1, при смешанных состояниях – 3,2, а в эутимном периоде – 2,9 препарата [27].С учетом того что многие психотропные средства (в первую очередь атипичные антипсихотики) зарегистрированы при одних и тех же состояниях в рамках БАР (мании, депрессии), врачи часто нуждаются в более четких указаниях, какие именно препараты целесообразнее использовать при доминировании конкретных психопатологических симптомов. На основе показателя NNT был предложен метрический инструмент – индекс полярности (ИП), – с помощью которого можно предположить преимущественный профиль активности препарата при поддерживающей терапии БАР в зависимости от спектра биполярных симптомов (см. рисунок). Если ИП препарата равен 1, то это означает, что он с одинаковой эффективностью предотвращает как депрессивные, так и маниакальные приступы. Если ИП>1, то его лучше использовать для профилактики маниакальных приступов, если ИП<1, то он будет более эффективен при доминировании депрессивных состояний. Чем больше ИП отличается от 1, тем, соответственно, более выражен противорецидивный антиманикальный (или антидепрессивный) профиль препарата. Для препаратов, зарегистрированных FDA для поддерживающей терапии БАР, были получены следующие показатели ИП: рисперидон (12,09), арипипразол (4,38), зипразидон (3,91), оланзапин (2,98), литий (1,39), кветиапин (1,14), ламотриджин (0,14) [18, 27].
Еще одной тенденцией последнего времени является акцентирование исследований на изучении особенностей социального и профессионального функционирования. Крупное исследование PERFORM (Prospective Epidemiological Research of Functioning Outcomes Related to Major Depressive Disorder) французских ученых под руководством D.Saragoussi было посвящено изучению функционирования пациентов с депрессией. В исследовании участвовали 1500 пациентов с РДР, уровень функционирования которых оценивали по шкале нетрудоспособности Шихана (Sheehan Disability Scale, SDS) и опроснику продуктивности труда и нарушения деятельности (Work Productivity and Activity Impairment, WPAI). На стадии предварительной оценки накопленные данные подверглись унивариантному и многовариантному анализу, который показал, что нарушения функционирования не только зависят от выраженности депрессивной симптоматики, что было известно и ранее, но и коррелируют с объективными и субъективными когнитивными нарушениями, а также с болевыми синдромами и нарушениями сна.
Существуют убедительные данные о положительном влиянии психообразовательной работы на исходы БАР.
В частности, в ходе 5-летнего катамнестического наблюдения было показано, что присоединение к стандартному фармакологическому лечению краткосрочных психообразовательных программ статистически достоверно снижает число разных аффективных приступов (p<0,02), в том числе депрессивных (p<0,03) и гипоманиакальных (p<0,03), по сравнению с использованием лишь стандартной медикаментозной терапии [5]. Также при этом уменьшается продолжительность самого приступа (p=0,004) и улучшается общий уровень функционирования (p<0,05).
Данные об эффективности когнитивно-бихевиоральной терапии (КБТ) при БАР остаются противоречивыми.
В более раннем РКИ показано, что группа лиц с БАР с частыми обострениями (несмотря на постоянный прием нормотимика), которые также получали сеансы КБТ на протяжении 6 мес (14 сессий), демонстрировали значительно лучший прогноз на протяжении 12 мес наблюдения, чем те пациенты, которые получали лишь стандартный нормотимик. Так как в группе больных, получающих КБТ, значительно реже встречались обострения, длительность приступа была меньше, а уровень функционирования выше, чем в группе сравнения, то был сделан вывод о том, что КБТ (вместе с нормотимиками) является эффективной противорецидивной стратегией при БАР [12]. В более позднем многоцентровом рандомизированном исследовании, которое длилось 18 мес, изучались 2 группы пациентов, находящиеся на стандартной фармакотерапии. Одна группа не получала никакого дополнительного лечения, а другая группа больных получала сеансы КБТ (22 сессии). У более чем 50% пациентов случились рецидивы заболевания, причем разницы между группами не было. Детальный анализ результатов показал, что противорецидивная эффективность КБТ отмечалась лишь у тех пациентов, которые перенесли не более 12 аффективных эпизодов [21].
Прямое сравнение эффективности КБТ в качестве дополнительной терапии (20 индивидуальных сессий) и психообразования (6 групповых сеансов) в рамках РКИ показало, что обе методики приводят к снижению числа аффективных приступов и уменьшению поведенческих паттернов, направленных на поиск отрицания и вины.
В исследовании не было выявлено существенных различий между группами в плане уровня госпитализаций, приверженности терапии, уровня психосоциального функционирования и обращаемости в службы психического здоровья. В то же время общая стоимость сеансов психообразования составила около 180 дол. США, а сессий КБТ – 1200 дол. США [17].
Известно, что важнейшим показателем, влияющим на исходы БАР, является уровень психосоциального функционирования, который снижается по мере прогрессирования болезни, а нейротоксический эффект повторных аффективных эпизодов может являться одной из основных причин устойчивого снижения психосоциального функционирования [20]. Однолетнее катамнестическое исследование пациентов с БАР с первым приступом
(1-я группа) или множественными эпизодами болезни (2-я группа) показало, что общий уровень функционирования, измеренный по шкале FAST, у больных 1-й группы был выше, чем у группы сравнения, включая такие показатели, как автономное проживание, трудоустройство, межличностные отношения и когнитивное функционирование [19]. Были разработаны специальные программы, направленные на коррекцию психосоциального функционирования на разных этапах БАР. В рамках одной из них сравнивалась эффективность метода «функциональной реабилитации» (1-я группа), психообразования (2-я группа) и обычной терапии (3-я группа) пациентов с БАР, находящихся в состоянии ремиссии [22]. В конце исследования (21-я неделя) оказалось, что показатели шкалы FAST статистически достоверно уменьшились у больных 1-й группы по сравнению с пациентами 3-й группы (p=0,002) и по сравнению с больными 2-й группы, хотя здесь разница не была достоверной (p=0,02).
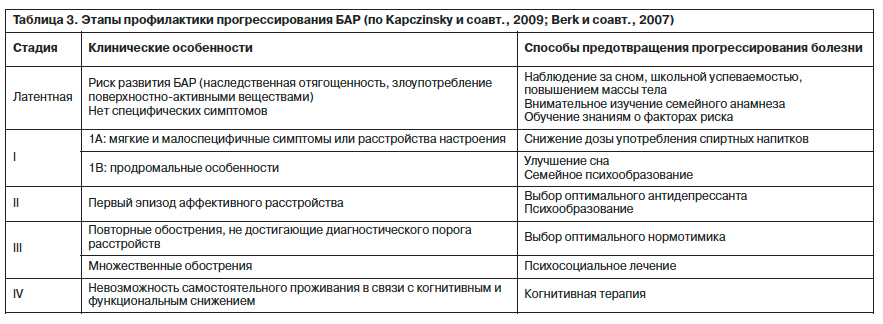
Метод функциональной реабилитации (functional remediation), разработанный в рамках программы по изучению БАР Университетской клиники Барселоны, включает объяснение пациентам особенностей когнитивного снижения при БАР и его влияния на повседневную жизнь, обучение тому, как улучшить внимание, память, управление своим временем, планирование и установление приоритетов в ситуациях обычной жизни [26]. Для усиления результатов лечения целесообразно вовлечение в реабилитационный процесс членов семьи больного. В соответствии с моделью прогрессирования БАР (табл. 3) на ранних стадиях болезни (продром, первый эпизод), когда уровень социального функционирования остается высоким, достаточно ограничиться психообразовательной работой, в то время как на более поздних стадиях (множественные эпизоды, резистентные состояния) целесообразнее использовать методы функциональной реабилитации [14].
Еще одной проблемной точкой в терапии аффективных расстройств является разрыв между результатами разных исследований, где изучается один или два препарата, с одной стороны, и повсеместной практикой, когда врачи используют более двух-трех разных препаратов, в том числе не одобренных для конкретных показаний, на разных этапах терапии, с другой. Широкое использование полифармакотерапии практическими врачами вызвано их недоверием к результатам исследований и недостаточным знанием современных рекомендаций по терапии аффективных расстройств. По-видимому, внедрение в клиническую практику таких простых и удобных инструментов, как ИП, позволит врачам, в том числе при недостатке времени и информации, легко сориентироваться в большом арсенале психотропных средств, которые используются для лечения БАР, и выбрать нужное лекарственное средство.
В заключение следует отметить, что многие выступления, прозвучавшие на ведущем европейском форуме по психофармакотерапии по вопросам лечения аффективных расстройств, заканчивались словами докладчиков о том, что «необходимы дополнительные исследования, чтобы подтвердить полученные результаты». Сам факт того, что по ряду вопросов терапии (например, использование антидепрессантов при биполярной депрессии, лечение резистентных депрессий и т.д.) нет четких рекомендаций, а лишь обобщенные мнения экспертов, может свидетельствовать о том, что многие аспекты терапии рекуррентных депрессий и БАР требуют дальнейшего изучения.
Овсепян Арам Ашотович – каф. психиатрии Ереванского государственного медицинского университета им. Мхитара Гераци, Армения. E-mail: armpsych@mail.ru
Ключевые слова: депрессивное расстройство, биполярное аффективное расстройство, психофармакотерапия, психотерапия.
Modern treatment strategies of affective disorders: review of the materials
of the 26st European College of Neuropsychopharmacology
A.V.Pavlichenko1, A.A.Hovsepyan2
1N.I.Pirogov Russian National Research Medical University, Moscow;
2Yerevan State Medical University, Department of Psychiatry, Armenia
Summary. This publication provides an overview of plenary symposia and poster sessions of the 26th European College of Neuropsychopharmacology (October 5–9 2013, Barcelona, Spain) concerning management (psychopharmacotherapy, psychotherapy) of depressive disorder and bipolar affective disorder.
Key words: bipolar affective disorder, depressive disorder, psychopharmacotherapy, psychotherapy.
Психофармакотерапия депрессивных расстройств
На 26-м Европейском Конгрессе нейропсихофармакологиии (European College of Neuropsychopharmacology, ECNP), проходившем 5–9 октября 2013 г. в Барселоне(Испания), были представлены как результаты исследований, относящиеся к хорошо известным и давно использующимся в клинической практике препаратам, так и новые разработки фармацевтических компаний, относящиеся к терапии депрессивных расстройств.
Большое место в материалах конгресса было уделено применению нового лекарственного средства фирмы Lundbeck вортиоксетину (vortioxetin), который относится к группе серотониновых модуляторов и стимуляторов. Препарат сочетает в себе свойства селективного ингибитора обратного захвата серотонина (СИОЗС), высокоселективного агониста 5-HT1A-рецепторов, частичного агониста 5-HT1B-рецепторов и антагониста 5-HT3A и 5-HT7-рецепторов. Согласно результатам исследования L.Haggstrom и соавт., в котором вортиоксетин (15–20 мг) сравнивался с дулоксетином (60 мг) и плацебо у пациентов с рекуррентным депрессивным расстройством (РДР), препарат обнаружил достаточную терапевтическую эффективность: к концу 52-й недели терапии было зарегистрировано снижение баллов по шкале Монтгомери–Асберга для оценки депрессии (Montgomery–Asberg Depression Rating Scale, MADRS) с 16,2 до 5,0. Нежелательные эффекты наблюдались у 78,9% пациентов, однако большинство из них были оценены как легкие или умеренные. Наиболее частыми побочными эффектами, отмечавшимися более чем у 10% пациентов, были тошнота, головокружение, головная боль и назофарингит. В целом 9,9% пациентов прекратили участие в исследовании из-за побочных эффектов (холецистит, холелитиаз, депрессия, головная боль, бессонница, тошнота, беременность и генерализованный зуд). Еще в одном исследовании изучалась эффективность вортиоксетина у пациентов с резистентной депрессией. Оказалось, что при переходе с СИОЗС на вортиоксетин наблюдалось значительное улучшение состояния пациентов на 8-й неделе терапии. Отдельно было прослежено воздействие вортиоксетина на когнитивные симптомы в рамках РДР. Было показано независимое от других депрессивных симптомов позитивное влияние препарата на улучшение когнитивных функций.
В большом исследовании под руководством M.Lemke и B.Barthel (Германия), в котором приняли участие около 3 тыс. амбулаторных пациентов с РДР, было показано, что к концу 24-й недели агомелатин (agomelatin) оказался эффективен у 79% пациентов, причем у 55,3% из них состояние можно было оценить как полную ремиссию. Также была выявлена положительная корреляция между быстротой ответа на лечение и конечным результатом/стойкостью ремиссии. Был зафиксирован высокий уровень комплаенса – 89,6%. Побочные явления были зафиксированы всего у 3,6% пациентов, из них только у 0,2% они привели к отмене препарата. Перспективную работу представила группа исследователей во главе c C.Peretti (Италия), изучавших предикторы раннего ответа на терапию агомелатином на основе данных электроэнцефалограммы, в частности когерентности как количественного показателя активности головного мозга. Сравнение групп респондеров и нонреспондеров, а также здоровых людей показало, что когерентность до начала приема препарата по срединной линии и в правых лобных областях может быть использована в качестве предиктора эффективности агомелатина. Группа французских исследователей (F.Boulle и соавт.) изучала влияние агомелатина на нейрональную пластичность и функции гиппокампа у мышей, подвергшихся длительному стрессу. Оказалось, что даже незначительные социально-стрессовые факторы влияют на поведение и могут вызывать в гиппокампе заметную активацию межклеточных сигнальных каскадов, а также повышение генной транскрипции, связанное с пластичностью. В то же время агомелатин может редуцировать поведенческие расстройства, индуцированные хроническим стрессом, а при длительном применении предотвращает нарушения межклеточных связей, патологическую экспрессию генов и восстанавливает нормальный фенотип у подвергавшихся стрессу мышей.
Исследование греческих ученых под руководством P.Sakka было посвящено изучению эффективности эсциталопрама (escitalopram) в терапии депрессивных состояний, протекающих как на фоне коморбидных неврологических расстройств (болезнь Альцгеймера, эпилепсия, болезнь Паркинсона, рассеянный склероз, инсульт), так и без них.
В целом препарат доказал терапевтическую эффективность у обеих групп пациентов. В то же время к концу исследования в группе пациентов, страдающих коморбидными расстройствами, было зарегистрировано менее выраженное улучшение состояния; у них также была отмечена вдвое большая распространенность нежелательных явлений. В работе румынских коллег D.Podea и R.Georgescu было показано, что 6-месячное использование эсциталопрама у лиц с РДР сопровождается не только снижением депрессивной симптоматики, но и значительным улучшением социального и профессионального функционирования.
Исследование американских психиатров во главе с A.Sambunaris было посвящено изучению нового антидепрессанта левомилнаципрана (levomilnacipran – 1S, 2R-milnacipran), который является СИОЗС, и норадреналина (СИОЗСН), причем его ингибирующая мощность в отношении норадреналина в 2 раза больше, чем в отношении серотонина. По результатам ряда краткосрочных исследований (8 нед) препарат был рекомендован для лечения РДР. Также оказалось, что его применение сопровождается улучшением социального функционирования.
Интересное исследование канадских ученых под руководством A.McIntyre было посвящено изучению эффективности кветиапина у пациентов с двойным диагнозом: РДР и фибромиалгия. Оказалось, что к концу 4-й недели лечения препарат оказывает выраженный антидепрессивный эффект и анальгетическое действие, которое, однако, существенно не отличается от аналогичного действия ряда некоторых антидепрессантов.
Американские исследователи во главе с J.Edwards представили результаты лечения больных с депрессией препаратом вилазодон (vilazodone), сочетающего в себе свойства СИОЗС и парциального агониста 5-HT1A-рецепторов. Особую эффективность препарат показал в устранении симптомов тревоги, что дает основание рекомендовать его при лечении депрессивных состояний с выраженным тревожным синдромом.
Новые данные о хроническом воспалении как одной из причин развития РДР представили испанские ученые [23]. Было отмечено, что высокие концентрации провоспалительных цитокинов могут модулировать нейротрансмиссию, нарушать регуляцию механизмов апоптоза и поражать глюкокортикоидную ось. Кроме того, экзогенное поступление в организм a-интерферона может вызывать нарушения серотонинергической и дофаминергической нейротрансмиссии, а также глюкокортикоидной оси и нейротрофических факторов, что приводит к развитию депрессивной симптоматики. Вследствие этого лица, принимающие противовирусные препараты, находятся в группе риска в отношении развития депрессивных состояний.
Психофармакотерапия биполярного аффективного расстройства
Терапия биполярного аффективного расстройства (БАР) на современном этапе преследует несколько целей [25]: 1) лечение наиболее тяжелых симптомов (ажитация, психотические симптомы, суицидальное поведение, расторможенность); 2) достижение ремиссии (субклинические и резидуальные симптомы провоцируют обострения, которые в свою очередь предрасполагают к неблагоприятным психосоциальным исходам); 3) профилактика обострений и смены аффекта; 4) обеспечение приверженности терапии; 5) редуцирование побочных эффектов.Важнейшей задачей фармакологического лечения БАР является подбор индивидуальной терапии для конкретного пациента. Также важно сохранять ремиссию, а для достижения этой цели может потребоваться назначение нескольких препаратов. Кроме того, по сравнению с манией депрессивные состояния в рамках БАР требуют более пристального внимания из-за высокого риска суицида, возможного повышения массы тела и кардиологических проблем.
За последние 40 лет Управление по контролю качества пищевых продуктов и лекарств в США (Food and Drug Administration, FDA) одобрило несколько лекарственных средств для лечения разных фаз БАР (табл. 1). В настоящее время удовлетворена потребность практической психиатрии в препаратах для лечения маниакальных состояний, однако текущий арсенал психотропных средств для лечения депрессивных состояний и поддерживающей терапии в рамках БАР остается недостаточным, что заставляет исследователей искать новые препараты, в том числе с иными механизмами действия [11].

Несмотря на общий застой в сфере психофармакотерапии, связанный с недостаточным выходом на рынок новых лекарственных средств, в области лекарственной терапии БАР дела обстоят немного лучше. Так, в августе 2013 г. FDA одобрила препарат луразидон (lurasidon) для купирующей терапии биполярной депрессии. По химической структуре луразидон относится к антипсихотикам, и его действие связано с антагонизмом в отношении D2 и 5-НТ2A-рецепторов. Полагают, что его эффективность при биполярной депрессии связана с антагонизмом в отношении 5-НТ7-рецепторов. Луразидон продемонстрировал эффективность при биполярной депрессии в двух из трех исследований в качестве монотерапии и еще в двух исследованиях в комбинации с другими препаратами (литием и вальпроатом). Показатель NTT (number needed to treat – число больных, которых необходимо пролечить для получения одного благоприятного исхода) в этих исследованиях равнялся 7. Рекомендуемая доза при биполярной депрессии лежит в диапазоне 20–120 мг однократно. Нежелательные явления, включающие тошноту, головную боль и сомнолентность, наблюдались не более чем у 8% больных.
В связи с тем что использование антидепрессантов при БАР по-прежнему вызывает много вопросов, рабочая группа экспертов Международного общества по изучению биполярного расстройства (International Society for Bipolar Disorders, ISBD) опубликовала расширенные рекомендации по этой проблеме (табл. 2).

Эффективность психотропных средств при маниакальных состояниях в рамках БАР недавно была подтверждена в нескольких метаанализах [4, 30]. В одном из них [4], базирующемся на анализе 68 рандомизированных контролируемых исследований (РКИ) с участием более 16 тыс. больных, был составлен рейтинг эффективности (в сравнении с плацебо) антиманиакальных средств (в порядке убывания эффекта препарата): галоперидол (стандартизированная разность средних – 0,56), рисперидон (0,5), оланзапин (0,43), литий (0,37), кветиапин (0,37), арипипразол (0,37), карбамазепин (0,36), асенапин (0,3), вальпроат (0,2), зипразидон (0,2). Терапия оланзапином, рисперидоном и кветиапином значительно реже сопровождалась выбыванием пациентов из исследований, чем использование лития и ламотриджина. Если сравнить эти данные с последним большим метаанализом эффективности психотропных средств для лечения шизофрении [13], где оланзапин (0,59), рисперидон (0,56), галоперидол (0,45), кветиапин (0,44) и арипипразол (0,43) также входили в перечень наиболее эффективных средств, то можно заметить сходства между метаанализами в отношении эффективности многих атипичных антипсихотиков. Но были получены и некоторые различия. В частности, галоперидол был самым эффективным средством при лечении биполярной мании, однако его эффективность при шизофрении была средняя. Кроме того, лица с БАР лучше, чем больные шизофренией, переносят атипичные антипсихотики (например, уровень экстрапирамидных симптомов при терапии биполярной мании оланзапином составил 9,1%, в то время как при шизофрении он был равен 14,5%), но хуже – традиционные антипсихотики (уровень экстрапирамидных симптомов при терапии галоперидолом составил 38,3 и 54,1% соответственно).
В последние годы вновь наблюдается интерес исследователей к солям лития, который был зарегистрирован для лечения БАР еще в 70-х годах прошлого века на основании лишь одного плацебо-контролируемого исследования.
С того времени было проведено еще четыре плацебо-контролируемых исследования, данные о которых были обобщены в метаанализе 2004 г., показавшем, что литий значительно превосходит плацебо в отношении профилактики маниакальных, но не депрессивных эпизодов [9]. В дальнейшем еще в нескольких работах была показана ценность использования лития в терапии БАР. Так, в одном большом международном исследовании изучались больные БАР, которые ранее ответили на терапию кветиапином и в дальнейшем были переведены на препараты лития или плацебо. Оказалось, что его использование намного эффективнее, чем прием плацебо, в плане профилактики как маниакальных, так и депрессивных приступов. Литий был эффективен в тех случаях, когда его плазменная концентрация была больше 0,6 ммоль/л [29]. Еще в одном фармакоэпидемиологическом исследовании, проведенном в Дании, пациенты (4268 человек), у которых впервые в жизни было диагностировано БАР, получали литий или вальпроат. Было обнаружено, что у пациентов, получающих литий, реже, чем у больных другой группы, отмечались госпитализации в стационар, реже наблюдались смены настроения и необходимость в назначении других психо-тропных средств [10].
В настоящее время существует несколько исследований, доказывающих эффективность комбинированной противорецидивной терапии БАР. В частности, в большом международном исследовании BALANCE изучалась противорецидивная эффективность лития у тех больных, которые первоначально ответили на совместный прием лития и вальпроата. Оказалось, что использование данной комбинации в дальнейшем, так же как и монотерапия литием, более эффективно, чем монотерапия вальпроатами, в отношении профилактики любого аффективного эпизода. Кроме того, эта комбинация была более эффективна, чем применение вальпроатов, в отношении профилактики маниакальных приступов, и только литий был эффективен в отношении депрессивных эпизодов. Полученные результаты не зависели от тяжести и фазы болезни, а также сохранялись на протяжении последующих двух лет наблюдений [1]. Еще в одном исследовании было показано, что поддерживающая терапия комбинацией кветиапина и лития (или вальпроата) была значительно более эффективна, чем использование плацебо и лития (или вальпроата), в отношении развития разных аффективных эпизодов (маниакальных, депрессивных, смешанных) вне зависимости от полярности начального приступа [28].
При проведении противорецидивной фармакотерапии БАР целесообразно придерживаться нескольких общих принципов: 1) литий предотвращает маниакальные и депрессивные обострения; 2) арипипразол предотвращает развитие маниакальных состояний; 3) карбамазепин менее эффективен, чем литий, и при его использовании всегда нужно помнить о фармакокинетических взаимодействиях с другими препаратами; 4) оланзапин больше предотвращает развитие маниакальных, чем депрессивных приступов; 5) кветиапин предотвращает как маниакальные, так и депрессивные приступы; 6) вальпроаты, по-видимому, эффективны в профилактике маниакальных обострений; 7) ламотриджин больше предотвращает развитие депрессивных, чем маниакальных приступов [8].
К сожалению, в настоящее время не хватает данных об использовании психотропных средств при смешанных биполярных эпизодах, что в первую очередь связано с тем, что эти вопросы лишь в последнее время стали привлекать внимание исследователей, особенно после выхода 5-го издания Руководства по диагностике и статистике психических расстройств (Diagnostic and Statistical Manual of mental disorders, 5th edition, DSM-5), где критерии диагностики смешанных состояний были существенно пересмотрены. По-видимому, полученные данные об эффективности антиманиакальных или антидепрессивных стратегий терапии не могут быть просто перенесены на терапию смешанных состояний в рамках БАР с преобладанием маниакальных или депрессивных состояний соответственно. Недавно был опубликован метаанализ 9 РКИ, включающий около 1300 пациентов со смешанными эпизодами, который выявил значительное превосходство антипсихотиков II поколения (арипипразол, азенапин, оланзапин, рисперидон, палиперидон) над плацебо как в качестве монотерапии, так и в комбинации со стабилизаторами настроения в отношении редукции смешанных эпизодов с преобладанием маниакальных симптомов. В то же время их эффективность в лечении депрессивных смешанных эпизодов вызывает много вопросов [16]. Есть единичные данные о том, что недавно зарегистрированный FDA для лечения биполярной депрессии препарат луразидон может быть также эффективен при биполярных депрессиях с маниакальными симптомами [15]. Анализ разных показателей по оценочной шкале маний Янга (Young Mania Rating Scale, YMRS) показал, что наличие даже субклинически выраженных смешанных симптомов (повышенная двигательная активность, речевой напор, скачка идей) в структуре биполярной депрессии связано с высокой вероятностью развития индуцированной антидепрессантами мании или гипомании [7]. Также было показано, что почти у 40% пациентов с БАР, получающих антидепрессанты, в дальнейшем развивается хотя бы один смешанный эпизод [24].
 оды болезни и способы лечения в обычной клинической практике. Уровень рецидивов (развитие любых аффективных приступов менее чем через 8 нед после предыдущего эпизода) и обострений (развитие аффективного эпизода через 8 нед и более после предыдущего обострения) составлял 18,2 и 40,5% соответственно. Психотропные средства широко использовались во время всех аффективных эпизодов, а также в эутимном периоде. Процент лиц, не принимающих препараты, варьировал от 11% при маниях до 6,1% в состоянии ремиссии. При маниакальных состояниях чаще всего использовались атипичные антипсихотики (77,6%) и антиконвульсанты, преимущественно литий и вальпроаты (60,8%). При эутимных состояниях врачи использовали атипичные антипсихотики (64,2%), антиконвульсанты (60,8%), бензодиазепины (25,5%) и СИОЗС (25,4%). При биполярной депрессии антидепрессанты использовались в 73,3% наблюдений, атипичные антипсихотики – в 57,2%, антиконвульсанты – в 56,9%, а бензодиазепины – в 30,0% наблюдений. Еще одним результатом исследования явились данные относительно общего количества психотропных средств, применяемых во время разных фаз БАР. Так, при маниях в среднем использовалось 2,8 препарата, при депрессиях – 3,1, при смешанных состояниях – 3,2, а в эутимном периоде – 2,9 препарата [27].С учетом того что многие психотропные средства (в первую очередь атипичные антипсихотики) зарегистрированы при одних и тех же состояниях в рамках БАР (мании, депрессии), врачи часто нуждаются в более четких указаниях, какие именно препараты целесообразнее использовать при доминировании конкретных психопатологических симптомов. На основе показателя NNT был предложен метрический инструмент – индекс полярности (ИП), – с помощью которого можно предположить преимущественный профиль активности препарата при поддерживающей терапии БАР в зависимости от спектра биполярных симптомов (см. рисунок). Если ИП препарата равен 1, то это означает, что он с одинаковой эффективностью предотвращает как депрессивные, так и маниакальные приступы. Если ИП>1, то его лучше использовать для профилактики маниакальных приступов, если ИП<1, то он будет более эффективен при доминировании депрессивных состояний. Чем больше ИП отличается от 1, тем, соответственно, более выражен противорецидивный антиманикальный (или антидепрессивный) профиль препарата. Для препаратов, зарегистрированных FDA для поддерживающей терапии БАР, были получены следующие показатели ИП: рисперидон (12,09), арипипразол (4,38), зипразидон (3,91), оланзапин (2,98), литий (1,39), кветиапин (1,14), ламотриджин (0,14) [18, 27].
оды болезни и способы лечения в обычной клинической практике. Уровень рецидивов (развитие любых аффективных приступов менее чем через 8 нед после предыдущего эпизода) и обострений (развитие аффективного эпизода через 8 нед и более после предыдущего обострения) составлял 18,2 и 40,5% соответственно. Психотропные средства широко использовались во время всех аффективных эпизодов, а также в эутимном периоде. Процент лиц, не принимающих препараты, варьировал от 11% при маниях до 6,1% в состоянии ремиссии. При маниакальных состояниях чаще всего использовались атипичные антипсихотики (77,6%) и антиконвульсанты, преимущественно литий и вальпроаты (60,8%). При эутимных состояниях врачи использовали атипичные антипсихотики (64,2%), антиконвульсанты (60,8%), бензодиазепины (25,5%) и СИОЗС (25,4%). При биполярной депрессии антидепрессанты использовались в 73,3% наблюдений, атипичные антипсихотики – в 57,2%, антиконвульсанты – в 56,9%, а бензодиазепины – в 30,0% наблюдений. Еще одним результатом исследования явились данные относительно общего количества психотропных средств, применяемых во время разных фаз БАР. Так, при маниях в среднем использовалось 2,8 препарата, при депрессиях – 3,1, при смешанных состояниях – 3,2, а в эутимном периоде – 2,9 препарата [27].С учетом того что многие психотропные средства (в первую очередь атипичные антипсихотики) зарегистрированы при одних и тех же состояниях в рамках БАР (мании, депрессии), врачи часто нуждаются в более четких указаниях, какие именно препараты целесообразнее использовать при доминировании конкретных психопатологических симптомов. На основе показателя NNT был предложен метрический инструмент – индекс полярности (ИП), – с помощью которого можно предположить преимущественный профиль активности препарата при поддерживающей терапии БАР в зависимости от спектра биполярных симптомов (см. рисунок). Если ИП препарата равен 1, то это означает, что он с одинаковой эффективностью предотвращает как депрессивные, так и маниакальные приступы. Если ИП>1, то его лучше использовать для профилактики маниакальных приступов, если ИП<1, то он будет более эффективен при доминировании депрессивных состояний. Чем больше ИП отличается от 1, тем, соответственно, более выражен противорецидивный антиманикальный (или антидепрессивный) профиль препарата. Для препаратов, зарегистрированных FDA для поддерживающей терапии БАР, были получены следующие показатели ИП: рисперидон (12,09), арипипразол (4,38), зипразидон (3,91), оланзапин (2,98), литий (1,39), кветиапин (1,14), ламотриджин (0,14) [18, 27].
Немедикаментозные методы
Известно, что несмотря на регулярное появление новых антидепрессантов, проблема терапевтически резистентных депрессий остается одной из наиболее актуальных, так как около 20–30% больных не поддаются лечению общепринятыми антидепрессантами. В данном случае под терапевтически резистентными имеются в виду депрессивные расстройства, не отвечающие не только на монотерапию тем или иным антидепрессантом, но и не поддающиеся таким традиционным методам, как замена антидепрессанта, комбинированная терапия или аугментация нейролептиками, нормотимиками, гормональными препаратами и др., электросудорожная терапия или транскраниальная магнитная стимуляция. В этом отношении любопытной выглядит работа испанских ученых во главе с Serra-Blasco о состоянии когнитивных функций при лечении резистентной депрессии методом глубокой мозговой стимуляции [3]. После вживления электродов под мозолистое тело поясной извилины было проведено сравнение с контрольной группой пациентов с первым эпизодом депрессии, которое показало, что данный метод лечения не влияет на когнитивную функцию. Кроме того, он приводит к улучшению памяти, что может положительно сказаться на психосоциальном функционировании.Еще одной тенденцией последнего времени является акцентирование исследований на изучении особенностей социального и профессионального функционирования. Крупное исследование PERFORM (Prospective Epidemiological Research of Functioning Outcomes Related to Major Depressive Disorder) французских ученых под руководством D.Saragoussi было посвящено изучению функционирования пациентов с депрессией. В исследовании участвовали 1500 пациентов с РДР, уровень функционирования которых оценивали по шкале нетрудоспособности Шихана (Sheehan Disability Scale, SDS) и опроснику продуктивности труда и нарушения деятельности (Work Productivity and Activity Impairment, WPAI). На стадии предварительной оценки накопленные данные подверглись унивариантному и многовариантному анализу, который показал, что нарушения функционирования не только зависят от выраженности депрессивной симптоматики, что было известно и ранее, но и коррелируют с объективными и субъективными когнитивными нарушениями, а также с болевыми синдромами и нарушениями сна.
Существуют убедительные данные о положительном влиянии психообразовательной работы на исходы БАР.
В частности, в ходе 5-летнего катамнестического наблюдения было показано, что присоединение к стандартному фармакологическому лечению краткосрочных психообразовательных программ статистически достоверно снижает число разных аффективных приступов (p<0,02), в том числе депрессивных (p<0,03) и гипоманиакальных (p<0,03), по сравнению с использованием лишь стандартной медикаментозной терапии [5]. Также при этом уменьшается продолжительность самого приступа (p=0,004) и улучшается общий уровень функционирования (p<0,05).
Данные об эффективности когнитивно-бихевиоральной терапии (КБТ) при БАР остаются противоречивыми.
В более раннем РКИ показано, что группа лиц с БАР с частыми обострениями (несмотря на постоянный прием нормотимика), которые также получали сеансы КБТ на протяжении 6 мес (14 сессий), демонстрировали значительно лучший прогноз на протяжении 12 мес наблюдения, чем те пациенты, которые получали лишь стандартный нормотимик. Так как в группе больных, получающих КБТ, значительно реже встречались обострения, длительность приступа была меньше, а уровень функционирования выше, чем в группе сравнения, то был сделан вывод о том, что КБТ (вместе с нормотимиками) является эффективной противорецидивной стратегией при БАР [12]. В более позднем многоцентровом рандомизированном исследовании, которое длилось 18 мес, изучались 2 группы пациентов, находящиеся на стандартной фармакотерапии. Одна группа не получала никакого дополнительного лечения, а другая группа больных получала сеансы КБТ (22 сессии). У более чем 50% пациентов случились рецидивы заболевания, причем разницы между группами не было. Детальный анализ результатов показал, что противорецидивная эффективность КБТ отмечалась лишь у тех пациентов, которые перенесли не более 12 аффективных эпизодов [21].
Прямое сравнение эффективности КБТ в качестве дополнительной терапии (20 индивидуальных сессий) и психообразования (6 групповых сеансов) в рамках РКИ показало, что обе методики приводят к снижению числа аффективных приступов и уменьшению поведенческих паттернов, направленных на поиск отрицания и вины.
В исследовании не было выявлено существенных различий между группами в плане уровня госпитализаций, приверженности терапии, уровня психосоциального функционирования и обращаемости в службы психического здоровья. В то же время общая стоимость сеансов психообразования составила около 180 дол. США, а сессий КБТ – 1200 дол. США [17].
Известно, что важнейшим показателем, влияющим на исходы БАР, является уровень психосоциального функционирования, который снижается по мере прогрессирования болезни, а нейротоксический эффект повторных аффективных эпизодов может являться одной из основных причин устойчивого снижения психосоциального функционирования [20]. Однолетнее катамнестическое исследование пациентов с БАР с первым приступом
(1-я группа) или множественными эпизодами болезни (2-я группа) показало, что общий уровень функционирования, измеренный по шкале FAST, у больных 1-й группы был выше, чем у группы сравнения, включая такие показатели, как автономное проживание, трудоустройство, межличностные отношения и когнитивное функционирование [19]. Были разработаны специальные программы, направленные на коррекцию психосоциального функционирования на разных этапах БАР. В рамках одной из них сравнивалась эффективность метода «функциональной реабилитации» (1-я группа), психообразования (2-я группа) и обычной терапии (3-я группа) пациентов с БАР, находящихся в состоянии ремиссии [22]. В конце исследования (21-я неделя) оказалось, что показатели шкалы FAST статистически достоверно уменьшились у больных 1-й группы по сравнению с пациентами 3-й группы (p=0,002) и по сравнению с больными 2-й группы, хотя здесь разница не была достоверной (p=0,02).

Метод функциональной реабилитации (functional remediation), разработанный в рамках программы по изучению БАР Университетской клиники Барселоны, включает объяснение пациентам особенностей когнитивного снижения при БАР и его влияния на повседневную жизнь, обучение тому, как улучшить внимание, память, управление своим временем, планирование и установление приоритетов в ситуациях обычной жизни [26]. Для усиления результатов лечения целесообразно вовлечение в реабилитационный процесс членов семьи больного. В соответствии с моделью прогрессирования БАР (табл. 3) на ранних стадиях болезни (продром, первый эпизод), когда уровень социального функционирования остается высоким, достаточно ограничиться психообразовательной работой, в то время как на более поздних стадиях (множественные эпизоды, резистентные состояния) целесообразнее использовать методы функциональной реабилитации [14].
Заключение
Обобщая представленные данные о методах современной терапии депрессивных расстройств, следует отметить, что клиницисты в первую очередь нуждаются в быстрых и эффективных методах лечения депрессивных состояний, в том числе резистентных к имеющимся психотропным средствам. В этом отношении перспективным видится использование глубинной мозговой симуляции и кетамина, которые показали свою эффективность в нескольких исследованиях в плане быстроты наступления антидепрессивного эффекта. Кроме того, большее внимание должно уделяться разработке лекарственных средств, действующих на отдельные компоненты депрессивного синдрома (когниция, болевой синдром, инсомния и т.д.). Как отметил на пленарной лекции ведущий испанский нейробиолог F.Artigas, необходимо сократить дистанцию между синтезом новых антидепрессивных средств в лаборатории и их выходом в клиническую практику. Одной из объективных трудностей на этом пути может стать сложность переноса знаний и лечебных стратегий, полученных на модели экспериментальных животных, подвергшихся хроническому стрессу, на пациентов с депрессивными состояниями.Еще одной проблемной точкой в терапии аффективных расстройств является разрыв между результатами разных исследований, где изучается один или два препарата, с одной стороны, и повсеместной практикой, когда врачи используют более двух-трех разных препаратов, в том числе не одобренных для конкретных показаний, на разных этапах терапии, с другой. Широкое использование полифармакотерапии практическими врачами вызвано их недоверием к результатам исследований и недостаточным знанием современных рекомендаций по терапии аффективных расстройств. По-видимому, внедрение в клиническую практику таких простых и удобных инструментов, как ИП, позволит врачам, в том числе при недостатке времени и информации, легко сориентироваться в большом арсенале психотропных средств, которые используются для лечения БАР, и выбрать нужное лекарственное средство.
В заключение следует отметить, что многие выступления, прозвучавшие на ведущем европейском форуме по психофармакотерапии по вопросам лечения аффективных расстройств, заканчивались словами докладчиков о том, что «необходимы дополнительные исследования, чтобы подтвердить полученные результаты». Сам факт того, что по ряду вопросов терапии (например, использование антидепрессантов при биполярной депрессии, лечение резистентных депрессий и т.д.) нет четких рекомендаций, а лишь обобщенные мнения экспертов, может свидетельствовать о том, что многие аспекты терапии рекуррентных депрессий и БАР требуют дальнейшего изучения.
Сведения об авторах
Павличенко Алексей Викторович – канд. мед. наук, доц. каф. психиатрии и мед. психологии ГБОУ ВПО Российский национальный исследовательский медицинский университет им. Н.И.Пирогова, МоскваОвсепян Арам Ашотович – каф. психиатрии Ереванского государственного медицинского университета им. Мхитара Гераци, Армения. E-mail: armpsych@mail.ru
Список исп. литературыСкрыть список1. BALANCE investigators and collaborators. Lithium plus valproate combination therapy versus monotherapy for relapse prevention in bipolar I disorder (BALANCE): a randomised open-label trial. Lancet 2010; 375 (9712): 385–95.
2. Bares M, Brunovsky M, Kopecek M et al. Changes in QEEG prefrontal cordance as a predictor of response to antidepressants in patients with treatment resistant depressive disorder: a pilot study. J Psychiatr Res 2007; 41 (3–4): 319–25. Epub: 2006 Aug 4.
3. Beblo T, Sinnamon G, Baune BT. Specifying the neuropsychology of affective disorders: clinical, demographic and neurobiological factors. Neuropsychol Rev 2011; 21 (4): 337–59. DOI: 10.1007/s11065-011-9171-0. Epub: 2011 Jun 10.
4. Cipriani A et al. Comparative efficacy and acceptability of antimanic drugs in acute mania: a multiple-treatments meta-analysis. Lancet 2011; 378 (9799): 1306–15.
5. Colom F et al. Psychoeducation for bipolar II disorder: an exploratory, 5-year outcome subanalysis. J Affect Disord 2009; 112 (1–3): 30–5.
6. Cook I, Leuchter AF, Morgan M et al. Early Changes in Prefrontal Activity Characterize Clinical Responders to Antidepressants. Neuropsychopharmacology 2002; 27 (1): 120–31.
7. Frye MA et al. Correlates of treatment-emergent mania associated with antidepressant treatment in bipolar depression. Am J Psychiatry 2009; 166 (2): 164–72.
8. Geddes JR et al. Lithium plus valproate combination therapy versus monotherapy for relapse prevention in bipolar I disorder (BALANCE): a randomised open-label trial. Lancet 2010; 375 (9712): 385–95.
9. Geddes JR et al. Long-term lithium therapy for bipolar disorder: systematic review and meta-analysis of randomized controlled trials. Am J Psychiatry 2004; 161 (2): 217–22.
10. Kessing LV et al. Course of illness in depressive and bipolar disorders. Naturalistic study, 1994–1999. Br J Psychiatry 2004; 185: 372–7.
11. Ketter TA et al. Treatments for bipolar disorder: can number needed to treat/harm help inform clinical decisions? Acta Psychiatr Scand 2011; 123 (3): 175–89.
12. Lam DH et al. A randomized controlled study of cognitive therapy for relapse prevention for bipolar affective disorder: outcome of the first year. Arch Gen Psychiatry 2003; 60 (2): 145–52.
13. Leucht S et al. Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet 2013; 382 (9896): 951–62.
14. Martínez-Arán A et al. Functional remediation for bipolar disorder. Clin Pract Epidemiol Ment Health 2011; 7: 112–6.
15. McIntyre RS et al. Lurasidone in bipolar depression with hypomanic symptoms. APA Annual Meeting, 2013.
16. Muralidharan K et al. Efficacy of second generation antipsychotics in treating acute mixed episodes in bipolar disorder: a meta-analysis of placebo-controlled trials. J Affect Disord 2013; 150 (2): 408–14.
17. Parikh SV et al. Psychosocial interventions for bipolar disorder and coping style modification: similar clinical outcomes, similar mechanisms. Can J Psychiatry 2013; 58 (8): 482–6.
18. Popovic D et al. Polarity index of pharmacological agents used for maintenance treatment of bipolar disorder. Eur Neuropsychopharmacol 2012; 22 (5): 339–46.
19. Rosa AR et al. One-year psychosocial functioning in patients in the early vs. late stage of bipolar disorder. Acta Psychiatr Scand 2012; 125 (4): 335–41.
20. Sanchez-Moreno J et al. Functioning and disability in bipolar disorder: an extensive review. Psychother Psychosom 2009; 78 (5): 285–97.
21. Scott J et al. Cognitive-behavioural therapy for severe and recurrent bipolar disorders: randomised controlled trial. Br J Psychiatry 2006; 188: 313–20.
20. Torrent C et al. Efficacy of functional remediation in bipolar disorder: a multicenter randomized controlled study. Am J Psychiatry 2013; 170 (8): 852–9.
23. Udina M, Castellvi P, Moreno-Espana J et al. Interferon-induced depression in chronic hepatitis C: a systematic review and meta-analysis. J Clin Psychiatry 2012; 73: 1128–38.
24. Valenti M et al. Bipolar mixed episodes and antidepressants: a cohort study of bipolar I disorder patients. Bipolar Disord 2011; 13 (2): 145–54.
25. Vieta E. Bipolar Disorder in Clinical Practice. 3rd Ed. CMG London, 2013b.
26. Vieta E. Tertiarism in Psychiatry: The Barcelona Clinic Bipolar Disorders Programme. Rev Psiquiatr Salud Ment (Barc) 2011; 4: 1–4.
27. Vieta E et al. Clinical management and burden of bipolar disorder: results from a multinational longitudinal study (WAVE-bd). Int
J Neuropsychopharmacol 2013a; 16 (8): 1719–32.
28. Vieta E et al. Efficacy and safety of quetiapine in combination with lithium or divalproex for maintenance of patients with bipolar I disorder. J Affect Disord 2008; 109 (3): 251–63.
29. Weisler RH et al. Continuation of quetiapine versus switching to placebo or lithium for maintenance treatment of bipolar I disorder.
J Clin Psychiatry 2011; 72 (11): 1452–64.
30. Yildiz A et al. Efficacy of antimanic treatments: meta-analysis of randomized, controlled trials. Neuropsychopharmacology 2011; 36 (2): 375–89.
25 сентября 2014
Количество просмотров: 4080

