Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2015
Взаимосвязь полиморфизмов генов белков – переносчиков серотонина и дофамина (SLC6A4, SLC6A3) с эффективностью антидепрессантов №01 2015
Ключевые слова: фармакогенетика, депрессия, антидепрессанты, генотипирование, полиморфизм, обратный захват серотонина, обратный захват дофамина.
nivanets@mail.ru
Для цитирования: Иванец Н.Н., Кинкулькина М.А., Тихонова Ю.Г. и др. Взаимосвязь полиморфизмов генов белков – переносчиков серотонина и дофамина (SLC6A4, SLC6A3) с эффективностью антидепрессантов. Психиатрия и психофармакотерапия. 2015; 1: 4–11.
The relationship of polymorphisms of genes proteins – serotonin and dopamine transporter (SLC6A4, SLC6A3) with the effectiveness of antidepressants
N.N.Ivanets, M.A.Kinkulkina, Yu.G.Tihonova, A.A.Ragimov, N.G.Dashkova, O.E.Kuznetsov, A.V.Matveev,
T.A.Izyumina, T.N.Maksimova, S.V.Orlov, A.V.Lukyanova, V.P.Sysoeva
Department of Psychiatry and Narcology, I.M.Sechenov First Moscow State Medical University, Ministry of Health
of Russia. 119991, Russian Federation, Moscow, ul. Trubetskaya, d. 8, str. 2;
Mental Health Research, Education and Clinical Center, I.M.Sechenov First Moscow State Medical University,
Ministry of Health of Russia. 119991, Russian Federation, Moscow, ul. Trubetskaya, d. 8, str. 2;
Blood Center, First Sechenov Medical University Russian Ministry of Health. 119991, Russian Federation, Moscow,
ul. Trubetskaya d. 8, str. 2;
Research Center of Neurology of the Russian Academy of Sciences. 125367, Russian Federation, Moscow,
Volokolamskoe sh., d. 80
In order to determine the relationship of genetic polymorphisms of proteins – serotonin transporter and dopamine with the effects of antidepressant treatment carried out a comprehensive clinical and psychopathological and genetic study of the effectiveness of different antidepressant classes in 100 patients. The effectiveness of antidepressant treatment after 12 weeks of treatment was 75%. Comparative analysis revealed that S-allele carriers polymorphic marker 5-HTTLPR respond better to treatment with tricyclic antidepressants than selective serotonin reuptake inhibitors (SSRIs). Showed a trend toward lower efficacy of SSRIs in carriers of the short allele of polymorphic loci 3'-VNTR protein – the dopamine transporter. Thus, the study found the relationship polymorphism 5-HTTLPR protein – the serotonin transporter with SSRIs. It is advisable to conduct further research to include a larger number of patients and an increase in the number of genetic markers studied.
Key words: pharmacogenetics, depression, antidepressants, genotyping, polymorphism, serotonin reuptake dopamine reuptake.
nivanets@mail.ru
For citation: Ivanets N.N., Kinkulkina M.A., Tihonova Yu.G., Ragimov A.A. et al. The relationship of polymorphisms of genes proteins – serotonin and dopamine transporter (SLC6A4, SLC6A3) with the effectiveness of antidepressants. Psychiatry and psichopharmacotherapy. 2015; 1: 4–11.
Депрессия – наиболее распространенное психическое расстройство. Бремя болезни определяется динамикой: в 50% случаев заболевание приобретает рекуррентное течение [1], – и значительной продолжительностью: средняя длительность депрессивного эпизода составляет 6–10 нед [2], средняя длительность заболевания – 37,7 нед [1]. Основной метод лечения умеренной и тяжелой депрессии – терапия антидепрессивными препаратами (АДП), однако эффективность психофармакотерапии не превышает 40–60% [3]. Полиморфная симптоматика депрессивных расстройств и отсутствие четких унифицированных предикторов эффективности лечения затрудняют процесс подбора терапии, длительность которого может занимать от 2 нед до нескольких месяцев. В последнее десятилетие в мировой психиатрии активно проводятся фармакогенетические исследования АДП, изучающие связь отдельных генетических особенностей с развитием фармакологического ответа (эффективность и переносимость). Фармакогенетический подход дает возможность прогнозировать ответ на терапию на основе измерения биологических (генетических) признаков, что позволит объективизировать процесс подбора АДП, сократить сроки и в конечном итоге повысить эффективность лечения депрессии. Основная сложность фармакогенетических исследований АДП заключается в отсутствии точных знаний о патогенезе депрессии и механизмах развития антидепрессивного эффекта. Нейробиологическая модель развития депрессии предполагает участие множества белков моноаминергических, глутаматергической, гипоталамо-гипофизарно-адреналовой систем, нейротрофинов, цитокинов, белков, регулирующих циркадианные ритмы, и др. Биодоступность препаратов обусловлена активностью ферментных систем, принимающих участие в их метаболизме, и функцией транспортных белков. Число мишеней для фармакогенетических исследований АДП увеличивается, для каждого гена-кандидата описаны десятки, а то и сотни полиморфизмов. Все сказанное выше в значительной степени затрудняет задачу выявления генетических предикторов эффективности терапии депрессии. Наиболее широко фармакогенетические исследования АДП изучали гены системы цитохрома Р450, преимущественно изоферментов CYP2D6, CYP2C19. Результаты работ показывают взаимосвязь переносимости АДП с носительством мутантных аллелей. Дупликация функциональных аллелей приводит к ускорению метаболизма лекарственного вещества и снижению его эффективности [4]. В России также проводились исследования CYP2D6 – выявлена достоверная связь развития побочных эффектов при применении амитриптилина у носителей генотипов CYP2D6*1/*4 и CYP2D6*4/*4 [5, 6].В настоящее время есть ряд исследований, посвященных изучению генетических полиморфизмов серотонинового транспортера (SLC6A4), играющего важную роль в фармакодинамике АДП большинства классов – селективных ингибиторов обратного захвата серотонина (СИОЗС), трициклических антидепрессантов (ТЦА), селективных ингибиторов обратного захвата серотонина и норадреналина. Наиболее изучен VNTR-полиморфизм (Variable Number Tandem Repeat) 5-HTTLPR, локализованный в промоторе гена SLC6A4. 5-HTTLPR представлен длинным (L) и коротким аллелями (S), различающимися наличием/отсутствием участка из 44 нуклеотидных оснований. S-аллель снижает транскрипционную активность гена SLC6A4 и экспрессию белка – переносчика серотонина, что сопровождается уменьшением обратного захвата медиатора.
5-HTTLPR ассоциируется с развитием ряда аффективных расстройств (биполярное расстройство, рекуррентная депрессия, невротические расстройства с депрессивной или тревожной симптоматикой) [7]. Частота аллельных вариантов полиморфизма 5-HTTLPR в популяциях европеоидной и монголоидной рас различается – распространенность носительства S-аллеля составляет 0,42 и 0,79 соответственно [8]. Согласно данным метаанализа A.Serretti и соавт. (2007 г.) у пациентов европеоидной расы, гомозиготных по S-аллелю, антидепрессивный эффект при приеме СИОЗС развивается медленнее, и уровень достижения ремиссии ниже [9]. Для АДП других групп исследования чаще не выявляли достоверной ассоциации с полиморфизмом 5-HTTLPR [10]. Исследования азиатских популяций показывают противоречивые результаты: метаанализ S.Porcelli и соавт. (2012 г.) заключает, что для монголоидной расы прогностическая значимость данного полиморфизма невысока [10]. Изучен еще один VNTR-полиморфизм белка – переносчика серотонина – Stin2, локализованный во 2-м интроне гена SLC6A4. Длинный L-аллель гена содержит 12 тандемных повторов, состоящих из 16–17 нуклеотидных оснований; короткий S-аллель – 9–10 повторов. Частота L-аллеля среди представителей белой расы составляет 0,59; в азиатской популяции – 0,89 [8]. Исследование K.Smits и соавт. (2008 г.) выявило, что короткий аллель ассоциирован с худшим ответом на терапию у представителей монголоидной расы [11]. В обзоре S.Porcelli и соавт. (2011 г.) представлена одна работа, показавшая для европейской популяции взаимосвязь короткого аллеля с риском развития побочных эффектов, но в других исследованиях эта связь не подтверждена [4].
Белок – переносчик дофамина (DAT) играет ключевую роль в процессе регуляции дофаминергической трансмиссии посредством обратного захвата дофамина из синаптической щели и доставки его обратно в пресинаптический терминал. Полиморфизм 3’-VNTR (40bp-VNTR) локализован в 3’-нетранслируемой области гена SLC6A3 и представлен аллельными вариантами – 9 и 10 копий длиной 40 пуриновых оснований. Частота короткого аллеля среди представителей белой расы составляет 0,21–0,29; в азиатской популяции – 0,04–0,06 [12]. 3’-VNTR ассоциируется с развитием ряда психических расстройств – шизофрении [13], зависимости от психоактивных веществ [14], депрессии [15, 16], синдрома гиперактивности с дефицитом внимания [17]. J.Kirchheiner и соавт. (2007 г.) описали наличие хотя бы одного аллеля с 9 повторами как предиктор худшего ответа на терапию АДП [18]. Однако дальнейшее исследование W.Saung и соавт. (2014 г.) не подтвердило эти данные [19]. Цель настоящей работы: на основе комплексного клинико-генетического исследования больных депрессией определить взаимосвязь генетических полиморфизмов белков – переносчиков серотонина (5-HTTLPR, Stin2) и дофамина (3’-VNTR) с эффектами антидепрессивного лечения; выявить генетические маркеры – предикторы эффективности фармакотерапии депрессивных расстройств.
Материалы и методы


В исследование включены 100 больных в возрасте от 18 до 77 лет, получавших терапию АДП. Больные проходили стационарное или амбулаторное лечение в Клинике психиатрии им. С.С.Корсакова Университетской клинической больницы №3 ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России и в научно-консультативном отделении ФГБУН Научный центр неврологии РАН в 2013–2014 гг. В исследование включались больные с диагнозами (по Международной классификации болезней 10-го пересмотра, МКБ-10): депрессивное расстройство [депрессивный эпизод, рекуррентное депрессивное расстройство, биполярное аффективное расстройство, циклотимия, дистимия (F31–39); органическая депрессия (F06.3)]; невротические, связанные со стрессом и соматоформные расстройства (F4), при наличии в клинической картине депрессии и включении в схему терапии АДП. В исследование не включались больные с диагнозами: острое психотическое расстройство, шизофрения, шизоаффективное расстройство, болезнь зависимости от психоактивных веществ, деменция. Исключались больные с острой соматической и неврологической патологией. Для унификации оценки состояния больных разработана формализованная карта исследования, включающая следующие сведения: социально-демографические (пол, возраст, этническая принадлежность, образование, трудовой и семейный статус), клинико-анамнестические (наследственность по психической и соматической патологии); данные о психическом и соматическом состоянии больного до развития депрессии, включая преморбидные личностные особенности; дальнейшее течение психических расстройств на фоне депрессии. Регистрировались анамнестические сведения о характере аффективных расстройств: возраст возникновения первого эпизода депрессии, наличие и характер провоцирующих факторов первой и последующих аффективных фаз (психогении, соматогении, органические вредности), тип течения расстройств (единственный эпизод; монополярная рекуррентная депрессия; биполярное аффективное расстройство, хроническое аффективное расстройство).
 Оценивались частота возникновения и длительность аффективных фаз; длительность межфазовых промежутков. Клинико-психопатологическое обследование больных дополнялось использованием психометрических шкал: шкала оценки депрессии Монтгомери–Асберга (Montgomery–Asberg Depression Rating Scale, MADRS), шкала оценки тревоги Гамильтона (Hamilton Anxiety Rating Scale, HARS), госпитальная шкала депрессии и тревоги (Hospital Anxiety and Depression Scale, HADS), шкала общего клинического впечатления (Clinical Global Impression, CGI), краткая шкала оценки психического статуса (Mini-Mental State Examination, MMSE) (табл. 1). Всем больным проводилась оценка соматического состояния по стандартной программе лабораторной и инструментальной диагностики для больных с депрессиями. Проводилась оценка эффективности и переносимости психофармакотерапии депрессивных расстройств АДП разных классов на этапе купирующей терапии.Состояние каждого больного оценивалось до начала и при проведении психофармакотерапии еженедельно клинически и с применением стандартизированных психометрических шкал. Длительность наблюдения составляла не менее 12 нед. Нежелательные лекарственные явления регистрировались с помощью шкалы оценки побочных эффектов терапии (Udvald for Kliniske Undersogelser Scale, UKU). Терапия АДП оценивалась как эффективная, если отмечалось отчетливое клиническое улучшение состояния и редукция симптомов по шкале MADRS составляла более 50%. Оценивалась скорость уменьшения выраженности психопатологической симптоматики, отмечался факт достижения ремиссии (клинически и по психометрическим шкалам). АДП применялись в качестве единственного препарата (монотерапия), при необходимости (для купирования тревоги, бессонницы) допускалось кратковременное назначение препаратов других клинико-фармакологических групп – нейролептиков в малых дозах, транквилизаторов, снотворных.
Оценивались частота возникновения и длительность аффективных фаз; длительность межфазовых промежутков. Клинико-психопатологическое обследование больных дополнялось использованием психометрических шкал: шкала оценки депрессии Монтгомери–Асберга (Montgomery–Asberg Depression Rating Scale, MADRS), шкала оценки тревоги Гамильтона (Hamilton Anxiety Rating Scale, HARS), госпитальная шкала депрессии и тревоги (Hospital Anxiety and Depression Scale, HADS), шкала общего клинического впечатления (Clinical Global Impression, CGI), краткая шкала оценки психического статуса (Mini-Mental State Examination, MMSE) (табл. 1). Всем больным проводилась оценка соматического состояния по стандартной программе лабораторной и инструментальной диагностики для больных с депрессиями. Проводилась оценка эффективности и переносимости психофармакотерапии депрессивных расстройств АДП разных классов на этапе купирующей терапии.Состояние каждого больного оценивалось до начала и при проведении психофармакотерапии еженедельно клинически и с применением стандартизированных психометрических шкал. Длительность наблюдения составляла не менее 12 нед. Нежелательные лекарственные явления регистрировались с помощью шкалы оценки побочных эффектов терапии (Udvald for Kliniske Undersogelser Scale, UKU). Терапия АДП оценивалась как эффективная, если отмечалось отчетливое клиническое улучшение состояния и редукция симптомов по шкале MADRS составляла более 50%. Оценивалась скорость уменьшения выраженности психопатологической симптоматики, отмечался факт достижения ремиссии (клинически и по психометрическим шкалам). АДП применялись в качестве единственного препарата (монотерапия), при необходимости (для купирования тревоги, бессонницы) допускалось кратковременное назначение препаратов других клинико-фармакологических групп – нейролептиков в малых дозах, транквилизаторов, снотворных. 
Генотипирование
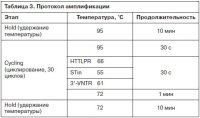
Проводился забор двух видов генетического материала: соскоб с использованием буккального тампона, цельная кровь в пробирку с этилендиаминтетрауксусной кислотой. Образцы цельной крови замораживали и хранили при температуре -30°C до проведения анализа. На первом этапе работы проводилось выделение геномной ДНК от пациентов с помощью наборов реагентов QIAamp DNA Mini Kit из буккального тампона и Arrow Blood DNA 500 из цельной крови (на станции NorDiag Arrow). Для оценки качества и количества нуклеиновых кислот использовали спектрофотометр Biowave DNA. Выход ДНК определялся исходя из ее концентрации, рассчитанной на основании поглощения, измеренного при 260 нм. Чистота определялась с помощью расчета отношения поглощения, измеренного при 260 и 280 нм. Значение чистоты ДНК колебалось в интервале 1,7–1,9. Постановка полимеразной цепной реакции проводилась на приборе Veriti Dx 96-Well Thermal Cycler согласно протоколам производителя компонентов реакционной смеси, содержащей универсальную реакционную смесь TaqMan Universal PCR Master Mix, синтезированные праймеры, деонизованную воду, выделенную геномную ДНК образца. Праймеры были подобраны с помощью программы Primer-BLAST (табл. 2). Протокол амплификации включал несколько стадий (табл. 3).

 После амплификации фрагменты ДНК наносили на 2% агарозный гель, использовался трисборатный буфер, концентрированный с бромидом этидия. Напряженность электрического поля составила 10 В/см. По окончании горизонтального электрофореза гели визуализировали в системе гель-документирования (BioDoc-It Imaging System) в ультрафиолетовом свете. Проведение горизонтального электрофореза для визуализации продуктов позволило скорректировать протокол и компоненты реакции для получения достоверных и последовательных результатов. Детекция продуктов реакции амплификации проводилась на генетическом анализаторе Applied Biosystems 3500xl. Результаты анализировались с помощью специализированного программного обеспечения для фрагментного анализа GeneMapper 5.0. В результате адаптации условий эксперимента (подбор концентраций реагентов реакционной смеси, температурного профиля полимеразной цепной реакции и параметров электрофореза) на образцах геномной ДНК были получены воспроизводимые результаты генотипирования локусов гена белка – переносчика серотонина: 5-HTTLPR и STin, а также VNTR локуса в гене белка – переносчика дофамина.
После амплификации фрагменты ДНК наносили на 2% агарозный гель, использовался трисборатный буфер, концентрированный с бромидом этидия. Напряженность электрического поля составила 10 В/см. По окончании горизонтального электрофореза гели визуализировали в системе гель-документирования (BioDoc-It Imaging System) в ультрафиолетовом свете. Проведение горизонтального электрофореза для визуализации продуктов позволило скорректировать протокол и компоненты реакции для получения достоверных и последовательных результатов. Детекция продуктов реакции амплификации проводилась на генетическом анализаторе Applied Biosystems 3500xl. Результаты анализировались с помощью специализированного программного обеспечения для фрагментного анализа GeneMapper 5.0. В результате адаптации условий эксперимента (подбор концентраций реагентов реакционной смеси, температурного профиля полимеразной цепной реакции и параметров электрофореза) на образцах геномной ДНК были получены воспроизводимые результаты генотипирования локусов гена белка – переносчика серотонина: 5-HTTLPR и STin, а также VNTR локуса в гене белка – переносчика дофамина.
Статистический анализ
Математическая обработка данных проводилась с помощью соответствующих методов статистического анализа: описательная статистика; сравнение выборок с помощью методов непараметрической статистики (критерии Манна–Уитни, Вилкоксона для количественных и порядковых признаков; критерий хи-квадрат с поправкой Йетса и критерий Фишера для качественных и бинарных признаков); определение связи количественных признаков с помощью коэффициента корреляции r Спирмана, g (гамма-корреляция) и t (тау Кендалла).
Результаты
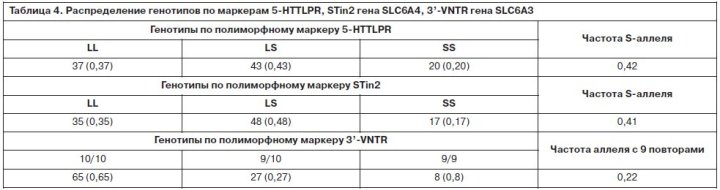
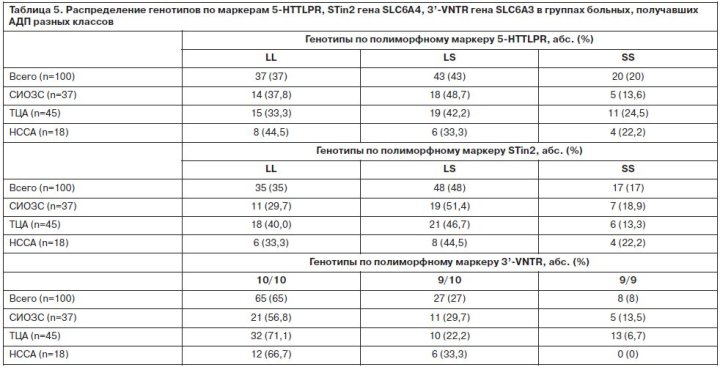
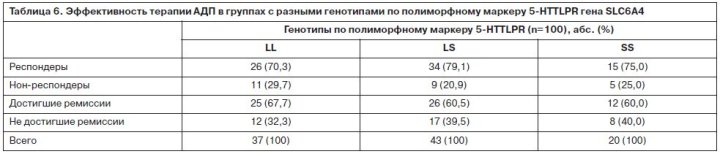
Для лечения депрессий применялись АДП, различные по механизму действия: СИОЗС – 37 пациентов, ТЦА – 45 пациентов, норадренергические и специфические серотонинергические антидепрессанты (НССА) – 18 больных. Выбор АДП проводился в соответствии с синдромальной структурой депрессии, соматическим состоянием больного, возрастом, индивидуальной переносимостью. Доза подбиралась индивидуально, в зависимости от особенностей психического состояния больного и переносимости. Так как группы больных, получавших АДП разных классов, не были рандомизированы, проводилась оценка их сопоставимости. Группы достоверно не отличались по основным социодемографическим (пол, возраст, трудовой и семейный статус, национальность) и клинико-анамнестическим показателям (наследственная отягощенность по соматической и психической патологии, сопутствующая соматическая и неврологическая патология, возраст начала заболевания, тип течения аффективных расстройств, частота возникновения и длительность аффективных фаз; длительность интермиссий). Распределение психопатологических синдромов, тяжесть депрессивных расстройств также значимо не различались при сравнении групп больных, получавших АДП из классов СИОЗС, ТЦА и НССА. Было выявлено, что индекс массы тела в группе больных, получавших ТЦА, достоверно больше, чем в двух других группах (p=0,01). Близким к достоверному был результат сравнения длительности последней ремиссии – в группе ТЦА она была больше, чем в других группах (p=0,07). При анализе генетической структуры больных по 5-HTTLPR, STin2 и 3’-VNTR (табл. 4) выявлено распределение генотипов, характерное для европеоидной популяции. Таким образом, представленная выборка была репрезентативна по основному изучаемому параметру – частотам генотипов и аллелей. Распределение генотипов по изучаемым маркерам в трех группах больных, получавших разные классы АДП, достоверно не отличалось (табл. 5). Эфективность антидепрессивного лечения клинически и при оценке по шкале MADRS после 12 нед терапии составляла 75%, уровень достижения ремиссии – 63%. При анализе взаимосвязи ответа на терапию с полиморфизмом 5-HTTLPR получено, что число респондеров в группах больных с разными генотипами (LL, LS, SS) достоверно не отличается (70, 79, 75% соответственно) (табл. 6). Уровень достижения ремиссии также значимо не отличался в группах с разными аллельными вариантами полиморфизма 5-HTTLPR (68, 61, 60% соответственно). Отдельно проведена оценка влияния носительства S-аллеля по маркеру 5-HTTLPR на эффективность антидепрессивной терапии, но и здесь достоверных результатов получено не было (p=0,41, c2=0,69). Учитывая, что в литературе полиморфизм 5-HTTLPR преимущественно ассоциируется с эффективностью СИОЗС, мы проанализировали взаимосвязь генетических изменений по данному маркеру с числом респондеров в группах больных, принимавших АДП разных классов. Ответ на терапию в группе СИОЗС составлял 64,8%; ТЦА – 79,5%; НССА – 83,3%. Число респондеров при применении СИОЗС было меньше, чем при лечении АДП других классов, но различия не достигали уровня статистической значимости (p=0,53, c2=5,07). При анализе взаимосвязи уровня антидепрессивного ответа и генетических вариантов в группах больных, принимавших разные АДП, было получено распределение, описанное в табл. 7.
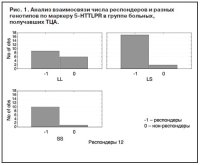
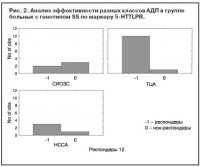 В группе больных, получавших НССА, достоверных отличий между разными генотипами выявлено не было (p=0,81, c2=0,30). Таким образом, при применении ТЦА генотип LL по маркеру 5-HTTLPR являлся отрицательным предиктором эффективности терапии. Проведен сравнительный анализ эффективности терапии АДП разных классов в группах больных с разными генотипами. Выявлено, что больные с генотипом SS хуже отвечают на терапию СИОЗС по сравнению с ТЦА и НССА, причем значимость отличий приближалась к достоверному уровню (p=0,08, c2=4,75) (рис. 2). Наиболее отчетливо эти отличия прослеживаются при сравнении эффективности терапии СИОЗС и ТЦА (p=0,02, c2=4,75). В группе больных с генотипом LS прослеживается тенденция к достоверно худшей эффективности СИОЗС по сравнению с АДП других классов (p=0,08, c2=2,88) (рис. 3).
В группе больных, получавших НССА, достоверных отличий между разными генотипами выявлено не было (p=0,81, c2=0,30). Таким образом, при применении ТЦА генотип LL по маркеру 5-HTTLPR являлся отрицательным предиктором эффективности терапии. Проведен сравнительный анализ эффективности терапии АДП разных классов в группах больных с разными генотипами. Выявлено, что больные с генотипом SS хуже отвечают на терапию СИОЗС по сравнению с ТЦА и НССА, причем значимость отличий приближалась к достоверному уровню (p=0,08, c2=4,75) (рис. 2). Наиболее отчетливо эти отличия прослеживаются при сравнении эффективности терапии СИОЗС и ТЦА (p=0,02, c2=4,75). В группе больных с генотипом LS прослеживается тенденция к достоверно худшей эффективности СИОЗС по сравнению с АДП других классов (p=0,08, c2=2,88) (рис. 3). 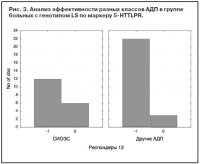
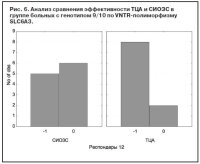
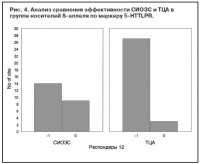 Носители S-аллеля (как гомозиготы, так и гетерозиготы) достоверно хуже отвечали на терапию СИОЗС по сравнению с ТЦА (p=0,01, c2=5,99) (рис. 4). При анализе ассоциации антидепрессивного ответа с полиморфизмом STin2 гена SLC6A4 не получено достоверных подтверждений влияния данного маркера на эффективность АДП любых классов. Сравнение эффективности АДП разных классов среди носителей короткого аллеля (9/10 тандемных повторов) не выявило значимых отличий. Только для генотипа LL (12/12) получено преобладание числа респондеров, получавших ТЦА, по сравнению с СИОЗС (рис. 5), но эти отличия не были достоверными (p=0,103). Анализ VNTR-полиморфизма гена переносчика дофамина SLC6A3 выявил, что для гетерозиготных носителей (генотип 9/10) ТЦА более эффективны, чем СИОЗС, причем уровень достоверности отличий приближался к значимому (p=0,09; c2=2,65) (рис. 6). Эффективность антидепрессивной терапии среди гомозиготных носителей длинных аллелей была приблизительно одинаковой в группах больных, получавших ТЦА, СИОЗС или НССА (p=0,89). Число носителей генотипа 9/9 было недостаточно для проведения сравнительного анализа.
Носители S-аллеля (как гомозиготы, так и гетерозиготы) достоверно хуже отвечали на терапию СИОЗС по сравнению с ТЦА (p=0,01, c2=5,99) (рис. 4). При анализе ассоциации антидепрессивного ответа с полиморфизмом STin2 гена SLC6A4 не получено достоверных подтверждений влияния данного маркера на эффективность АДП любых классов. Сравнение эффективности АДП разных классов среди носителей короткого аллеля (9/10 тандемных повторов) не выявило значимых отличий. Только для генотипа LL (12/12) получено преобладание числа респондеров, получавших ТЦА, по сравнению с СИОЗС (рис. 5), но эти отличия не были достоверными (p=0,103). Анализ VNTR-полиморфизма гена переносчика дофамина SLC6A3 выявил, что для гетерозиготных носителей (генотип 9/10) ТЦА более эффективны, чем СИОЗС, причем уровень достоверности отличий приближался к значимому (p=0,09; c2=2,65) (рис. 6). Эффективность антидепрессивной терапии среди гомозиготных носителей длинных аллелей была приблизительно одинаковой в группах больных, получавших ТЦА, СИОЗС или НССА (p=0,89). Число носителей генотипа 9/9 было недостаточно для проведения сравнительного анализа. 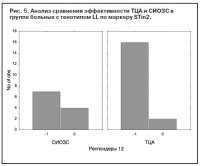
Обсуждение
Результат сравнительного анализа показал, что у больных с разными генотипами по полиморфному локусу 5-HTTLPR эффективность АДП классов СИОЗС и ТЦА достоверно различается. Выявлено, что АДП класса СИОЗС достоверно менее эффективны по сравнению с ТЦА при носительстве S-аллеля и особенно генотипа SS. Результат сравнения эффективности ТЦА у больных с разными генотипами показал худший ответ на терапию при генотипе LL. При анализе ассоциации антидепрессивного ответа с полиморфным локусом STin2 гена SLC6A4 не получено достоверных подтверждений влияния данного полиморфизма на эффективность АДП любых классов. Для подтверждения наличия или отсутствия влияния данного полиморфизма на антидепрессивный ответ необходимо обследование большего числа больных. Анализ мощности исследования и объема выборки по данному маркеру показал, что для получения достоверных результатов группы больных, получавших разные классы АДП, должны включать не менее 65 человек. Анализ VNTR-полиморфизма гена переносчика дофамина SLC6A3 показал тенденцию большей эффективности ТЦА по сравнению с СИОЗС для носителей генотипа 9/10, в то время как при генотипе 10/10 эффективность АДП разных классов (ТЦА, СИОЗС и НССА) была приблизительно одинаковой. Таким образом, проведенное исследование показало влияние полиморфизма 5-HTTLPR белка – переносчика серотонина на эффективность СИОЗС. Носители генотипа с хотя бы одним коротким аллелем лучше отвечают на терапию ТЦА, чем СИОЗС. Также отмечена тенденция к меньшей эффективности СИОЗС у носителей короткого аллеля по полиморфному локусу 3’-VNTR белка – переносчика дофамина. Целесообразно проведение дальнейших исследований с включением большего числа больных и увеличением количества изучаемых генетических маркеров.Сведения об авторах
Иванец Николай Николаевич – чл.-кор. РАН, заслуженный деятель науки РФ, проф., д-р мед. наук, зав. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России; дир. научно-исследовательского отд. «Психическое здоровье» НИЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: nivanets@mail.ru
Кинкулькина Марина Аркадьевна – д-р мед. наук, проф.; проф. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова Минздрава России; зам. дир. по научной и инновационной деятельности научно-исследовательского отд. «Психическое здоровье» НИЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: kinkulkina@gmail.com
Тихонова Юлия Гулямовна – канд. мед. наук, асс. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России; вед. науч. сотр. научно-исследовательского отд. «Психическое здоровье» НИЦ ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова. E-mail: j.tyhonova@gmail.com
Рагимов Алигейдар Агаалекпер оглы – д-р мед. наук, проф., зав. каф. клин. трансфузиологии ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова. E-mail: ra50@mail.ru
Дашкова Наталья Георгиевна – д-р мед. наук, доц., зав. клинико-диагностической лаб. Центра крови ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: dn35@rambler.ru
Кузнецов Олег Евгеньевич – канд. мед. наук, доц. каф. клин. трансфузиологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова.
E-mail: kuznoe@gmail.com
Матвеев Александр Викторович – врач Клинико-диагностической лаб. Центра крови ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: doktormatveev@gmail.com
Изюмина Татьяна Анатольевна – канд. мед. наук, ст. науч. сотр. научно-исследовательского отд. «Психическое здоровье» НИЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова
Максимова Татьяна Николаевна – канд. мед. наук, доц. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России; вед. науч. сотр. научно-исследовательского отд. «Психическое здоровье» НИЦ ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова. E-mail: aks.92_92@mail.ru
Орлов Сергей Валерьевич – канд. мед. наук, зам. глав. врача ФГБУН Научный центр неврологии РАН. E-mail: orlov@neurology.ru
Лукьянова Алена Васильевна – аспирант каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России; лаборант-исследователь научно-исследовательского отд. «Психическое здоровье» НИЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова
Сысоева Вероника Петровна – аспирант каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России; врач-психиатр ФГБУН Научный центр неврологии РАН
Список исп. литературыСкрыть список1. Ferrari AJ, Charlson FJ, Norman RE et al. The epidemiological modelling of major depressive disorder: application for the Global Burden of Disease Study 2010. PLoS One 2013; 8 (7): e69637.
2. Spijker J, de Graaf R, Bijl RV et al. Duration of major depressive episodes in the general population: results from The Netherlands Mental Health Survey and Incidence Study (NEMESIS). Br J Psychiatry 2002; 181: 208–13.
3. Мосолов С.Н. Клиническое применение современных антидепрессантов. СПб.: Медицинское информационное агентство, 1995. / Mosolov S.N. Klinicheskoe primenenie sovremennykh antidepressantov. SPb.: Meditsinskoe informatsionnoe agentstvo, 1995. [in Russian]
4. Porcelli S, Drago A, Fabbri C et al. Pharmacogenetics of antidepressant response. J Psychiatry Neurosci 2011; 36 (2): 87–113.
5. Савельева М.И., Сычев Д.А., Казаков Р.Е. и др. Значение генетического полиморфизма изоферментов цитохрома р450 для персонализированного выбора и режимов дозирования антидепрессантов и антипсихотиков. Клин. мед. 2008; 86 (11): 22–8. / Savel'eva M.I., Sychev D.A., Kazakov R.E. i dr. Znachenie geneticheskogo polimorfizma izofermentov tsitokhroma r450 dlia personalizirovannogo vybora i rezhimov dozirovaniia antidepressantov i antipsikhotikov. Klin. med. 2008; 86 (11): 22–8. [in Russian]
6. Кукес В.Г., Иванец Н.Н., Сычев Д.А. и др. Влияние генетического полиморфизма CYP2D6 и MDR1 на эффективность и безопасность терапии антидепрессантами у пациентов с депрессивными расстройствами в условиях психиатри-ческого стационара. Психиатрия и психофармакотерапия. 2013; 15 (5): 11–5. / Kukes V.G., Ivanets N.N., Sychev D.A. i dr. Vliianie geneticheskogo polimorfizma CYP2D6 i MDR1 na effektivnost' i bezopasnost' terapii antidepressantami u patsientov s depressivnymi rasstroistvami v usloviiakh psikhiatricheskogo statsionara. Psikhiatriia i psikhofarmakoterapiia. 2013; 15 (5): 11–5. [in Russian]
7. Serretti A, Lilli R, Smeraldi E. Pharmacogenetics in affective disorders. Eur J Pharmacol 2002; 438: 117–28.
8. Kunugi H, Hattori M, Kato T et al. Serotonin transporter gene polymorphisms: ethnic difference and possible association with bipolar affective disorder. Mol Psychiatry 1997; 2: 457–62.
9. Serretti A, Kato M, De Ronchi D et al. Meta-analysis of serotonin transporter gene promoter polymorphism (5-HTTLPR) association with selective serotonin reuptake inhibitor efficacy in depressed patients. Mol Psychiatry 2007; 12: 247–57.
10. Porcelli S, Fabbri C, Serretti A. Meta-analysis of serotonin transporter gene promoter polymorphism (5-HTTLPR) association with antidepressant efficacy. Eur Neuropsychopharmacol 2012; 22 (4): 239–58.
11. Smits KM, Smits LJM, Peeters FPML et al. The influence of 5-HTTLPR and STin2 polymorphisms in the serotonin transporter gene on treatment effect of selective serotonin reuptake inhibitors in depressive patients. Psychiatr Genet 2008; 11: 184–90.
12. Kang AM, Palmatier MA, Kidd KK. Global Variation of a 40-bp VNTR in the 3’-Untranslated Region of the Dopamine Transporter Gene (SLC6A3). Biol Psychiatry 1999; 46: 151–60.
13. Sáiz PA, García-Portilla MP, Arango C et al. Genetic polymorphisms in the dopamine-2 receptor (DRD2), dopamine-3 receptor (DRD3), and dopamine transporter (SLC6A3) genes in schizophrenia: Data from an association study. Prog Neuropsychopharmacol Biol Psychiatry 2010; 34 (1): 26–31.
14. Марусин А.В. и др. Ассоциация полиморфизма 1342 A/G в экзоне 9 и длин тандемных повторов (VNTR) в З'-некодирующей области (З'-UTR) гена переносчика дофамина DAT1 (SLC6A3) с риском формирования алкогольной зависимости в Западно-Сибирской популяции русских. Мед. генетика. 2008; 6: 31–5. / Marusin A.V. i dr. Assotsiatsiia polimorfizma 1342 A/G v ekzone 9 i dlin tandemnykh povtorov (VNTR) v Z'-nekodiruiushchei oblasti (Z'-UTR) gena perenoschika dofamina DAT1 (SLC6A3) s riskom formirovaniia alkogol'noi zavisimosti v Zapadno-Sibirskoi populiatsii russkikh. Med. genetika. 2008; 6: 31–5. [in Russian]
15. Гафаров В.В., Воевода М.И., Громова Е.А. и др. Ассоциация депрессии с полиморфизмом генов нейромедиаторной системы головного мозга в открытой популяции среди мужчин 25–64 лет мегаполиса Западной Сибири (г. Новосибирск). Эпидемиологическое исследование по программе ВОЗ «MONICA-psychosocial». Обозрение психиатрии и мед. психологии. 2012; 2: 35–40. / Gafarov V.V., Voevoda M.I., Gromova E.A. i dr. Assotsiatsiia depressii s polimorfizmom genov neiromediatornoi sistemy golovnogo mozga v otkrytoi populiatsii sredi muzhchin 25–64 let megapolisa Zapadnoi Sibiri (g. Novosibirsk). Epidemiologicheskoe issledovanie po programme VOZ «MONICA-psychosocial». Obozrenie psikhiatrii i med. psikhologii. 2012; 2: 35–40. [in Russian]
16. Pinsonneault JK, Han DD, Burdick KE et al. Dopamine transporter gene variant affecting expression in human brain is associated with bipolar disorder. Neuropsychopharmacology 2011; 36 (8): 1644–55.
17. Feng Y, Wigg KG, Makkar R et al. Sequence variation in the 3'-untranslated region of the dopamine transporter gene and attention-deficit hyperactivity disorder (ADHD). Am J Med Genet B Neuropsychiatr Genet 2005; 139B (1): 1–6.
18. Kirchheiner J, Nickchen K, Sasse J et al. A 40-basepair VNTR polymorphism in the dopamine transporter (DAT1) gene and the rapid response to antidepressant treatment. Pharmacogenomics J 2007; 7 (1): 48–55.
19. Saung WT, Narasimhan S, Lohoff FW. Lack of influence of DAT1 and DRD2 gene variants on antidepressant response in generalized anxiety disorder. Hum Psychopharmacol 2014.