Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2015
Научно обоснованная психофармакотерапия генерализованного тревожного расстройства №01 2015
Номера страниц в выпуске:61-66
В настоящее время существует много психотропных средств и психотерапевтических стратегий, доступных для лечения пациентов с генерализованным тревожным расстройством (ГТР). Рандомизированные плацебо-контролируемые исследования, проведенные с позиций доказательной медицины, показали эффективность при ГТР некоторых селективных ингибиторов обратного захвата серотонина (пароксетин, сертралин, эсциталопрам), селективных ингибиторов обратного захвата серотонина и норадреналина (дулоксетин, венлафаксин), прегабалина и кветиапина. К сожалению, не существует «идеального» средства для лечения ГТР, а при выборе конкретного препарата акцент следует делать на профиль его побочных эффектов, особенности коморбидной патологии и предпочтения пациента.
В настоящее время существует много психотропных средств и психотерапевтических стратегий, доступных для лечения пациентов с генерализованным тревожным расстройством (ГТР). Рандомизированные плацебо-контролируемые исследования, проведенные с позиций доказательной медицины, показали эффективность при ГТР некоторых селективных ингибиторов обратного захвата серотонина (пароксетин, сертралин, эсциталопрам), селективных ингибиторов обратного захвата серотонина и норадреналина (дулоксетин, венлафаксин), прегабалина и кветиапина. К сожалению, не существует «идеального» средства для лечения ГТР, а при выборе конкретного препарата акцент следует делать на профиль его побочных эффектов, особенности коморбидной патологии и предпочтения пациента.
Ключевые слова: генерализованное тревожное расстройство, доказательная фармакотерапия, рандомизированные контролируемые исследования.
apavlichenko76@gmail.com
Для цитирования: Павличенко А.В. Научно обоснованная психофармакотерапия генерализованного тревожного расстройства. Психиатрия и психофармакотерапия. 2015; 1: 61–66.
N.I.Pirogov Russian National Research Medical University.
117997, Russian Federation, Moscow, ul. Ostrovitianova, d. 1
There are many psychotropic drugs available now for the treatment of patients with generalized anxiety disorder (GAD). Randomized double-blind placebo-controlled trials provide good evidence for the efficacy of certain selective serotonin reuptake inhibitors (paroxetine, sertraline, escitapopram), serotonin-norepinephrine reuptake inhibitors (duloxetine, venlafaxine), pregabalin and quetiapine. Unfortunately, the “ideal” treatment does not yet exist and the particular choice of treatment should be mainly determined by the tolerability profile of prescribed medication, comorbid conditions as well as patients’ preferences.
Key words: generalized anxiety disorder, evidence-based pharmacotherapy, randomized controlled trials.
apavlichenko76@gmail.com
For citation: Pavlichenko A.V. Evidence-based psychopharmacotherapy of generalized anxiety disorder. Psychiatry and psichopharmacotherapy. 2015; 1: 61–66.
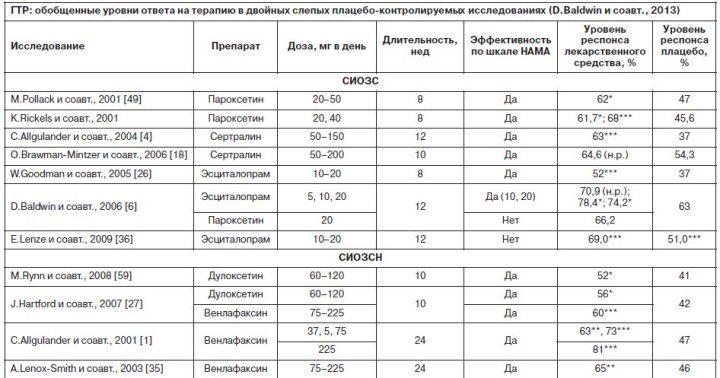
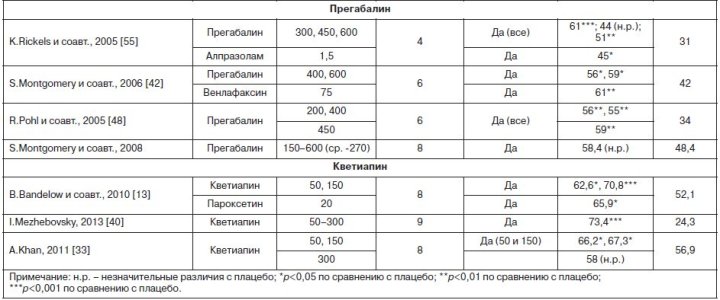
Тем не менее у некоторых пациентов к концу лечения все еще могут наблюдаться симптомы, несмотря на то что они демонстрируют хороший «ответ» на терапию, оцененный как «значительное» или «очень значительное» улучшение по шкале CGI-I. Бензодиазепиновые анксиолитики являются эффективными и действующими достаточно быстро лекарственными средствами для лечения некоторых пациентов с ГТР. Уже достаточно давнее исследование сравнения эффективности диазепама, тразодона и имипрамина при ГТР показало, что у пациентов, принимающих диазепам, отмечалось достаточно быстрая редукция симптомов тревоги в течение первых 2 нед терапии, однако к концу исследования только имипрамин статистически достоверно превосходил плацебо [52]. Кроме того, бензодиазепины мало влияют на сопутствующие депрессивные симптомы и обладают значимыми побочными эффектами (сонливость, нарушения памяти), из-за которых многие больные отказываются от их приема раньше наступления отчетливого противотревожного эффекта [39]. Прием бензодиазепинов также сопровождается ростом толерантности и зависимости. В связи с этим в большинстве рекомендаций врачам советуют придерживаться следующих принципов при назначении бензодиазепинов: непродолжительное (до 4 нед) лечение выраженной тревоги и бессонницы; использование в первые недели приема антидепрессантов [12]; возможно применение в качестве поддерживающей терапии у пациентов с тяжелыми, резистентными и изматывающими симптомами тревоги, которые не ответили на предшествующую терапию не менее двумя препаратами первого выбора, или у тех, кто имел проблемы с переносимостью других классов противотревожных средств. В отличие от депрессии в настоящее время отсутствует четкое понимание того, что составляет симптоматическую ремиссию при ГТР. В частности, в одном исследовании показано, что показатель HAMA от 9 и менее пунктов коррелирует с показателем «пограничные психические расстройства» шкалы CGI [5]. В то же время повторный анализ результатов двойных слепых исследований пароксетина при ГТР показал, что при использовании более строгого критерия (HAMA от 7 и менее) только 36% пациентов достигли ремиссии к концу наблюдений [56]. Метаанализ рандомизированных контролируемых исследований купирующей фармакотерапии ГТР показал [28], что хотя средняя величина эффективности составляет 0,39, существуют значимые различия между препаратами: прегабалин (0,5), гидроксизин (0,45), СИОЗСН (0,42), бензодиазепины (0,38), СИОЗС (0,36), буспирон (0,17). В целом средняя величина эффекта в данной работе оказалось несколько выше, чем в предыдущем метаанализе (0,33), что, возможно, связано с различиями в критериях отбора публикаций [41]. Другое сравнение эффективности разных препаратов, зарегистрированных для лечения ГТР, показало, что в отношении уровня респонса некоторым преимуществом обладает дулоксетин, в отношении глубины ремиссии – эсциталопрам, в то время как прегабалин превосходит другие лекарственные средства в плане переносимости [9]. Однако к подобным анализам, базирующимся на результатах рандомизированных контролируемых исследований, которые отличаются друг от друга по дизайну и целям, следует относиться очень осторожно в плане оценки величины эффекта. Кроме того, изучение гидроксизина базируется на небольшом количестве данных, и он не показан для лечения ГТР.
Сведения об авторе
А.В.Павличенко – канд. мед. наук, доц. каф. психиатрии и медицинской психологии ГБОУ ВПО РНИМУ им. Н.И.Пирогова. E-mail: apavlichenko76@gmail.com
Ключевые слова: генерализованное тревожное расстройство, доказательная фармакотерапия, рандомизированные контролируемые исследования.
apavlichenko76@gmail.com
Для цитирования: Павличенко А.В. Научно обоснованная психофармакотерапия генерализованного тревожного расстройства. Психиатрия и психофармакотерапия. 2015; 1: 61–66.
Evidence-based psychopharmacotherapy of generalized anxiety disorder
A.V.PavlichenkoN.I.Pirogov Russian National Research Medical University.
117997, Russian Federation, Moscow, ul. Ostrovitianova, d. 1
There are many psychotropic drugs available now for the treatment of patients with generalized anxiety disorder (GAD). Randomized double-blind placebo-controlled trials provide good evidence for the efficacy of certain selective serotonin reuptake inhibitors (paroxetine, sertraline, escitapopram), serotonin-norepinephrine reuptake inhibitors (duloxetine, venlafaxine), pregabalin and quetiapine. Unfortunately, the “ideal” treatment does not yet exist and the particular choice of treatment should be mainly determined by the tolerability profile of prescribed medication, comorbid conditions as well as patients’ preferences.
Key words: generalized anxiety disorder, evidence-based pharmacotherapy, randomized controlled trials.
apavlichenko76@gmail.com
For citation: Pavlichenko A.V. Evidence-based psychopharmacotherapy of generalized anxiety disorder. Psychiatry and psichopharmacotherapy. 2015; 1: 61–66.
Введение
Генерализованное тревожное расстройство (ГТР) относится к группе тревожных состояний и характеризуется чрезмерным и неадекватным беспокойством по поводу разных ситуаций, которые не ограничиваются лишь конкретными событиями и продолжаются большую часть времени на протяжении 6 мес и более. У пациентов наблюдаются физические («соматические») и психологические («психические») симптомы – такие как беспокойство, быстрая утомляемость, трудность сконцентрироваться на чем-либо, раздражительность, мышечное напряжение и нарушение сна [23]. ГТР одинаково часто встречается как в популяции, так и в медицинских учреждениях общего профиля. Согласно эпидемиологическим данным распространенность ГТР в течение жизни у жителей Европы колеблется от 1,7 до 3,4% [66]. Коморбидные состояния, главным образом депрессивные и другие тревожные расстройства, обнаруживаются в большинстве случаев [66]. Более того, наличие коморбидной депрессии ассоциируется с более тяжелым и затяжным течением болезни, а также более высокой степенью функционального снижения [30, 64]. ГТР чаще встречается у женщин, чем у мужчин [15], и является самым распространенным тревожным расстройством у лиц в возрасте 55–85 лет [14]. Лица с ГТР нередко посещают разные медицинские учреждения, а его распространенность в первичной сети колеблется в пределах 3,7–7,1%, причем в большинстве случаев оно не распознается врачами [43]. В настоящее время принято считать, что ГТР развивается в результате взаимодействия генетических факторов и факторов внешней среды и сопровождается структурными и функциональными изменениями в нейрональных сетях амигдалы [37]. Существующие на сегодняшний день теории развития ГТР рассматривают его в рамках многофакторной эпигенетической модели, которая включает частые стрессы в детстве, а также врожденную и приобретенную в процессе жизни уязвимость к внешним воздействиям.Научно обоснованная купирующая терапии ГТР
Результаты рандомизированных плацебо-контролируемых исследований показывают, что приблизительно 40–60% пациентов с ГТР «отвечают» на плацебо и 60–75% – на терапию селективными ингибиторами обратного захвата серотонина (СИОЗС): эсциталопрам, пароксетин, сертралин; селективными ингибиторами обратного захвата серотонина и норадреналина (СИОЗСН): дулоксетин, венлафаксин; анксиолитиком прегабалином и атипичным антипсихотиком кветиапином. Оценку снижения тяжести симптомов ГТР традиционно измеряют с помощью шкалы Гамильтона для оценки тревоги (Hamilton Rating Scale for Anxiety, HAMA) и шкалы общего клинического впечатления об улучшении (Clinical Global Impression – Improvement scale, CGI-I) [6, 7]. Рекомендации экспертов по лечению ГТР базируются на доказательствах эффективности препарата, полученных в результате двойных слепых плацебо-контролируемых исследований, при которых активное вещество должно быть эффективнее плацебо на основании оценочных шкал (например, от 2 пунктов и выше по HAMA), а также на основании уровня ответа (респонса) на терапию (на 10% и более лучше, чем плацебо), который обычно определяется как минимум 50% снижение показателей шкалы [44]. Например, среднее снижение показателя HAMA на 15 баллов и более при использовании эсциталопрама в оптимальной дозе 10 мг в день или снижение баллов по шкале HAMA к концу лечения на 61% при лечении прегабалином в оптимальной дозе 300 мг в день [55] (см. таблицу).

Тем не менее у некоторых пациентов к концу лечения все еще могут наблюдаться симптомы, несмотря на то что они демонстрируют хороший «ответ» на терапию, оцененный как «значительное» или «очень значительное» улучшение по шкале CGI-I. Бензодиазепиновые анксиолитики являются эффективными и действующими достаточно быстро лекарственными средствами для лечения некоторых пациентов с ГТР. Уже достаточно давнее исследование сравнения эффективности диазепама, тразодона и имипрамина при ГТР показало, что у пациентов, принимающих диазепам, отмечалось достаточно быстрая редукция симптомов тревоги в течение первых 2 нед терапии, однако к концу исследования только имипрамин статистически достоверно превосходил плацебо [52]. Кроме того, бензодиазепины мало влияют на сопутствующие депрессивные симптомы и обладают значимыми побочными эффектами (сонливость, нарушения памяти), из-за которых многие больные отказываются от их приема раньше наступления отчетливого противотревожного эффекта [39]. Прием бензодиазепинов также сопровождается ростом толерантности и зависимости. В связи с этим в большинстве рекомендаций врачам советуют придерживаться следующих принципов при назначении бензодиазепинов: непродолжительное (до 4 нед) лечение выраженной тревоги и бессонницы; использование в первые недели приема антидепрессантов [12]; возможно применение в качестве поддерживающей терапии у пациентов с тяжелыми, резистентными и изматывающими симптомами тревоги, которые не ответили на предшествующую терапию не менее двумя препаратами первого выбора, или у тех, кто имел проблемы с переносимостью других классов противотревожных средств. В отличие от депрессии в настоящее время отсутствует четкое понимание того, что составляет симптоматическую ремиссию при ГТР. В частности, в одном исследовании показано, что показатель HAMA от 9 и менее пунктов коррелирует с показателем «пограничные психические расстройства» шкалы CGI [5]. В то же время повторный анализ результатов двойных слепых исследований пароксетина при ГТР показал, что при использовании более строгого критерия (HAMA от 7 и менее) только 36% пациентов достигли ремиссии к концу наблюдений [56]. Метаанализ рандомизированных контролируемых исследований купирующей фармакотерапии ГТР показал [28], что хотя средняя величина эффективности составляет 0,39, существуют значимые различия между препаратами: прегабалин (0,5), гидроксизин (0,45), СИОЗСН (0,42), бензодиазепины (0,38), СИОЗС (0,36), буспирон (0,17). В целом средняя величина эффекта в данной работе оказалось несколько выше, чем в предыдущем метаанализе (0,33), что, возможно, связано с различиями в критериях отбора публикаций [41]. Другое сравнение эффективности разных препаратов, зарегистрированных для лечения ГТР, показало, что в отношении уровня респонса некоторым преимуществом обладает дулоксетин, в отношении глубины ремиссии – эсциталопрам, в то время как прегабалин превосходит другие лекарственные средства в плане переносимости [9]. Однако к подобным анализам, базирующимся на результатах рандомизированных контролируемых исследований, которые отличаются друг от друга по дизайну и целям, следует относиться очень осторожно в плане оценки величины эффекта. Кроме того, изучение гидроксизина базируется на небольшом количестве данных, и он не показан для лечения ГТР.
Переносимость
Профиль переносимости препаратов – важный аспект лечения, особенно при проведении поддерживающей терапии хронических состояний. Профиль нежелательных явлений, связанных с приемом СИОЗС и СИОЗСН, в целом довольно близкий, хотя при проведении краткосрочных рандомизированных контролируемых исследований пациенты значительно чаще прекращают лечение в случаях приема пароксетина и венлафаксина, чем эсциталопрама [6]. При длительной терапии СИОЗС и СИОЗСН на первый план выходят такие побочные эффекты препаратов, как сексуальная дисфункция, повышение массы тела, нарушение сна и вероятность развития синдрома отмены при прекращении лечения. Сексуальная дисфункция, связанная с лечением, является наиболее частым осложнением при лечении СИОЗС пациентов с депрессивными состояниями; не совсем ясно, насколько эти данные можно экстраполировать на пациентов с ГТР, которые значительно реже жалуются на утрату сексуального желания. В литературе не встречается указаний на то, что сексуальные нарушения могут быть связаны с приемом прегабалина. Возможно, прибавка массы тела при поддерживающей терапии СИОЗС и СИОЗСН причиняет меньше хлопот, чем при использовании других классов психотропных средств, но она может причинить беспокойство многим пациентам. Так, в одном натуралистическом исследовании было показано, что прибавка массы тела (более 7% от первоначальных показателей) встречается у 4,5% лиц, принимавших сертралин, и у 14,3% лиц, принимавших циталопрам или пароксетин. Еще около 15% пациентов, принимавших кветиапин для лечения депрессии или ГТР, также характеризовались значительной прибавкой массы тела [8]. Данные о прибавке массы тела при терапии ГТР прегабалином в литературе отсутствуют. СИОЗС имеют весьма ограниченный положительный эффект (иногда и вовсе отрицательный) на симптомы инсомнии в отличие от их благоприятного влияния на симптомы тревоги [20]. С другой стороны, двойное слепое плацебо-контролируемое исследование прегабалина продемонстрировало его преимущество над венлафаксином в отношении не только его меньшей способности нарушать сон, но и возможности способствовать улучшению сна при поддерживающем лечении лиц с ГТР [31].Предикторы эффективности фармакологического лечения
К сожалению, пока невозможно точно предсказать, какие пациенты хорошо ответят на тот или иной препарат, а какие – нет. Хотя в литературе встречаются единичные исследования, посвященные, например, корреляциям между нейробиологическими параметрами и симптоматическим улучшением при использовании венлафаксина [65]. Однако в клинической практике способность предсказать ответ на терапию во многом зависит от клинических аспектов болезни, таких как тяжесть симптомов и длительность заболевания. Большая вероятность позитивного ответа на венлафаксин или флуоксетин связана с меньшей длительностью болезни, а также с наличием в качестве коморбидного расстройства дистимии, но не депрессивного эпизода [46]. Другим фактором, связанным с положительным ответом на прием венлафаксина, является отсутствие у больного коморбидных расстройств, депрессии и панического расстройства в анамнезе, а также тяжелой степени психосоциального снижения [58]. В то же время прием в прошлом бензодиазепинов ассоциируется с низким респонсом. Коморбидное депрессивное состояние может способствовать отсроченному началу действия венлафаксина [50], но существенно не влиять на степень редукции тревожных симптомов при использовании эсциталопрама [60] или прегабалина [62]. В настоящее время нет четкого ответа на вопрос, сколько конкретно времени нужно ждать начала действия препарата на симптомы ГТР перед его заменой на другое лекарственное средство. Есть данные, что незначительное снижение тяжести симптомов к концу 2-й недели терапии лоразепамом при ГТР может свидетельствовать об отсутствии эффективности препарата к 6-й неделе [34]. Вторичный анализ данных показал, что редукция общего балла по шкале HAMA на 20% к концу 2-й недели может говорить о вероятном наступлении ремиссии к концу исследования при применении дулоксетина [51], эсциталопрама [6], прегабалина и венлафаксина [9]. Если же ответ на терапию не наблюдается в течение 4–6 нед активного лечения, то вероятность улучшения состояния в дальнейшем у лиц с ГТР крайне низка.Оптимальная длительность лечения
ГТР традиционно считается хроническим состоянием, тяжесть симптомов которого колеблется в течение многих лет. В проспективном натуралистическом исследовании вероятность выздоровления после первого эпизода болезни в течение 12-летнего катамнеза составила лишь 58%, а более чем 40% лиц с ГТР, которые достигали ремиссии, в последующем переживали рецидивы болезни [19]. Принято считать, что продолжение приема антидепрессантов после наступления ремиссии существенно снижает риск последующих обострений у пациентов с рекуррентными депрессиями, хотя ценность длительной противорецидивной терапии при ГТР не столь очевидна, в первую очередь из-за меньшего числа соответствующих исследований. Рекомендации, основанные на принципах доказательной медицины, говорят о необходимости минимум 6-месячного курса терапии после наступления ремиссии [4, 12], другие же исследователи настаивают на более длительных курсах поддерживающего лечения [3, 32]. Из пяти исследований, направленных на изучение противорецидивной терапии при ГТР, в четырех была продемонстрирована целесообразность длительного приема эсциталопрама [3], пароксетина [63], прегабалина [25] и дулоксетина [22]. Еще в одном исследовании было показано противорецидивное действие кветиапина [32]. Так как длительность одного из данных исследований (эсциталопрама) составляла 18 мес [3], то целесообразно продолжить лечение в течение 18 мес после наступления ремиссии. Управление по контролю за качеством пищевых продуктов и лекарств в США (Food and Drug Administration, FDA) рекомендует продолжать противорецидивную терапию ГТР доказавшим свою эффективность препаратом не менее 6 мес. В отличие от этого рекомендации Европейского союза говорят о пользе длительного «открытого» лечения в течение 2–6 мес. По-видимому, лишь вторичный анализ ранее опубликованных рандомизированных контролируемых исследований, который будет включать изучение длительности болезни, частоты рецидивов и характера предыдущей фармакотерапии, поможет уточнить длительность противорецидивной терапии ГТР у разных групп больных [16].Синдром отмены
Симптомы, развивающиеся после отмены антидепрессантов, как правило, нетяжелые и быстро проходят, хотя некоторые пациенты говорят о возникновении выраженных проблем, даже при постепенном снижении дозы препарата. Такие факторы, как длительность лечения, более высокая доза препарата и внезапное прекращение терапии, могут влиять на тяжесть синдрома отмены, хотя частота его возникновения при отмене СИОЗС или СИОЗСН не всегда ясна [6, 7]. Было обнаружено, что быстрая отмена прегабалина ассоциируется с развитием синдрома отмены в некоторых [24, 48], но не во всех исследованиях [45]. По-видимому, при проведении любого фармакологического лечения желательно постепенное снижение дозы препарата для того, чтобы минимизировать риск появления тяжелых симптомов отмены, но полезность этой рекомендации полностью не установлена – необходимы дополнительные исследования, посвященные синдрому отмены.Стратегии терапии при отсутствии первичного респонса
Согласно большинству рекомендаций, исходя из соотношения эффективности и переносимости, препаратами первого выбора при ГТР являются СИОЗС и прегабалин. Препаратами второго выбора являются СИОЗСН и кветиапин. В качестве лекарственных средств, которые могут быть эффективны у некоторых больных с ГТР, относят имипрамин, бензодиазепины и бупропион (частичный агонист 5-НТ1-рецепторов), который более целесообразно использовать перед назначением бензодиазепинов, а не после их приема [21]. Тем не менее не существует четких рекомендаций относительно того, что нужно делать, если пациент с ГТР не ответил на изначальную терапию одним из названных выше препаратов. Конечно, в первую очередь следует проверить, насколько пациент соблюдает режим терапии и правильно ли поставлен диагноз. Также следует помнить о нередком злоупотреблении поверхностно-активными веществами у лиц с ГТР. В качестве возможных интервенций при отсутствии респонса рекомендуют повышение дозы, переход на другой препарат, зарегистрированный при ГТР, добавление второго препарата, комбинирование приема лекарственных средств и психотерапии. В то же время в настоящее время, например, непонятно, насколько увеличение дозы эсциталопрама будет способствовать увеличению респонса [5]. Сравнение пароксетина в дозах 20 и 40 мг при ГТР не выявило различий между ними [54]. Применение фиксированных доз венлафаксина выявило неоднозначные результаты: есть данные как о позитивном влиянии на респонс повышения дозы препарата [53], так и об отсутствии связи [1]. Анализ изучения разных доз кветиапина при ГТР показал, что доза 300 мг менее эффективна, чем доза 150 мг. Повторный анализ обобщенных данных рандомизированных контролируемых исследований прегабалина показал, что большие дозы (200–450 мг в день) имеют большую эффективность, чем меньшие дозы (150 мг в день). Несмотря на риск побочных эффектов (повышение массы тела, метаболический синдром), антипсихотики могут использоваться в качестве альтернативы бензодиазепинам у пациентов с ГТР, не ответивших на начальную терапию. По-видимому, антипсихотики можно использовать у тех больных, кто не ответил ни на терапию СИОЗС, ни на последующую терапию СИОЗСН. В одном небольшом исследовании было показано, что рисперидон и оланзапин могут усилить эффективность СИОЗС [17], в то время как данные о добавлении к антидепрессантам кветиапина носят противоречивый характер [9]. Предварительные результаты большого плацебо-контролируемого исследования использования прегабалина в качестве адъювантной терапии у тех больных, которые имели ограниченный респонс на СИОЗС или СИОЗСН, говорят об эффективности данной стратегии: положительный ответ наблюдался в 50% случаев, в то время как плацебо-терапия была эффективна лишь у 37% больных [57]. Еще одним потенциально эффективным препаратом в качестве адъювантной терапии может являться агомелатин, который доказал свою эффективность при купирующей терапии ГТР [61]. Среди психологических интервенций при ГТР наиболее часто изучалась когнитивно-поведенческая терапия, которая, хотя и превосходит «обычное лечение», не имеет убедительных данных в пользу ее преимуществ над другими видами психотерапии [29]. Комбинация фармакологического и психологического лечения часто упоминается как «золотой стандарт» в лечении всего класса тревожных расстройств, однако в отношении ГТР непонятно, насколько комбинированная фармакотерапия превосходит изолированную [11].Беременность и кормление грудью
При проведении купирующей и поддерживающей терапии женщин репродуктивного возраста важно помнить о возможном тератогенном эффекте препаратов. Согласно обобщенным данным исследования более 4000 женщин, принимавших СИОЗС или СИОЗСН во время беременности, риск тератогенных эффектов этих препаратов в терапевтических дозах обнаружен не был. В то же время новорожденных, матери которых во время беременности принимали СИОЗС и СИОЗСН, рекомендуют наблюдать в течение 48 ч после рождения на предмет таких симптомов, как повышение мышечного тонуса, раздражительность, гипотермия, ненормальное дыхание и петехия, которые могут быть связаны с гиперактивностью серотонина [38]. Согласно длительному проспективному исследованию детей, которые в период внутриутробного развития подвергались воздействию психотропных препаратов, уровни тревоги, депрессии и социальной изоляции у них не отличались от детей, чьи матери не принимали каких-либо психотропных средств во время беременности [47].Заключение
В настоящее время существует много психотропных средств и психотерапевтических стратегий, доступных для лечения пациентов с ГТР. Рандомизированные плацебо-контролируемые исследования, проведенные с позиций доказательной медицины, показали эффективность при ГТР СИОЗС (пароксетин, сертралин, эсциталопрам), СИОЗСН (дулоксетин, венлафаксин), анксиолитика прегабалина и атипичного антипсихотика кветиапина, однако при использовании данных препаратов в широкой клинической практике результаты лечения могут оказаться скромнее. К сожалению, не существует «идеального» препарата для лечения ГТР, и существующие на сегодняшний день стратегии нередко имеют недостаточную эффективность как во время проведения купирующей, так и поддерживающей терапии, а некоторые пациенты испытывают мучительные побочные симптомы. Конкретный выбор препарата зависит от клинических особенностей пациента (таких, например, как существование коморбидной депрессии или положительный ответ на предшествующее лечение), предпочтений пациента относительно той или иной тактики лечения и доступности помощи. Врачи должны объяснять своим пациентам, что ответ на терапию может не наступить быстро и в первые дни возможно даже некоторое ухудшение лечения, а также о необходимости длительной поддерживающей терапии. В настоящее время необходимо развивать фармакологические подходы, направленные на поиск более эффективных и безопасных средств для лечения этого распространенного, приводящего к ограничению функционирования и часто хронического психического расстройства.Сведения об авторе
А.В.Павличенко – канд. мед. наук, доц. каф. психиатрии и медицинской психологии ГБОУ ВПО РНИМУ им. Н.И.Пирогова. E-mail: apavlichenko76@gmail.com
Список исп. литературыСкрыть список1. Allgulander C et al. Venlafaxine extended release (ER) in the treatment of generalized anxiety disorder: Twenty-four-week placebo-controlled dose-ranging study. Br J Psychiatry 2001; 179: 15–22.
2. Allgulander C et al. Efficacy of sertraline in a 12-week trial for generalized anxiety disorder. Am J Psychiatry 2004; 161: 1642–9.
3. Allgulander C et al. Prevention of relapse in generalized anxiety disorder by escitalopram treatment. Int J Neuropsychopharmacol 2006; 9: 495–505.
4. Baldwin D et al. Evidence-based guidelines for the pharmacological treatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. J. Psychopharmacol 2005; 19: 567–96.
5. Baldwin D et al. Escitalopram and paroxetine in the treatment of generalised anxiety disorder: randomised, placebo-controlled, double-blind study. Br J Psychiatry 2006; 189: 264–72.
6. Baldwin D et al. Escitalopram therapy for major depression and anxiety disorders. Ann Pharmacother 2007; 41 (10): 1583–92.
7. Baldwin D et al. Role of pregabalin in the treatment of generalized anxiety disorder. Neuropsychiatr Dis Treat 2007; 3 (2): 185–91.
8. Baldwin D et al. Antipsychotic drugs in the treatment of generalized anxiety disorder. Int Journal of Psychiatry in Clin Pract 2009, 13, SII.
9. Baldwin D et al. Does early improvement predict endpoint response in patients with generalized anxiety disorder treated with pregabalin or venlafaxine XR? Eur Neuropsychopharmacol 2011; 22 (2): 137–1342.
10. Baldwin D et al. Evidence-based pharmacotherapy of generalized anxiety disorder. Essential Evidence-based psychopharmacology. Cambridge University Press, 2013; p. 112–4.
11. Bandelow B et al. Meta-analysis of randomized controlled comparisons of psychopharmacological and psychological treatments for anxiety disorders. World J Biol Psychiatry 2007; 8 (3): 175–87.
12. Bandelow B, Zohar J et al. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the pharmacological treatment of anxiety, obsessive-compulsive and post-traumatic stress disorders – first revision. World J Biol Psychiatry 2008; 9 (4): 248–312.
13. Bandelow B et al. Extended-release quetiapine fumarate (quetiapine XR): a once-daily monotherapy effective in generalized anxiety disorder. Data from a randomized, double-blind, placebo- and active-controlled study. Int J Neuropsychopharmacol 2010; 13 (3): 305–20.
14. Beekman AT et al. Anxiety disorders in later life: a report from the Longitudinal Aging Study Amsterdam. Int J Geriatr Psychiatry 1998; 13 (10): 717–26.
15. Beesdo K et al. Anxiety and anxiety disorders in children and adolescents: developmental issues and implications for DSM-V. Psychiatr Clin North Am 2009; 32 (3): 483–524.
16. Bodkin JA et al. Predictors of relapse in a study of duloxetine treatment for patients with generalized anxiety disorder. Hum Psychopharmacol 2011; 26 (3): 258–66.
17. Brawman-Mintzer O et al. Adjunctive risperidone in generalized anxiety disorder: a double-blind, placebo-controlled study. J Clin Psychiatry 2005, 66: 1321–5.
18. Brawman-Mintzer O et al. Sertraline treatment for generalized anxiety disorder: a randomized, double-blind, placebo-controlled study. J Clin Psychiatry 2006; 67 (6): 874–81.
19. Bruce SE et al. Influence of psychiatric comorbidity on recovery and recurrence in generalized anxiety disorder, social phobia, and panic disorder: a 12-year prospective study. Am J Psychiatry 2005; 162 (6): 1179–87.
20. Carney CE et al. A comparison of rates of residual insomnia symptoms following pharmacotherapy or cognitive-behavioral therapy for major depressive disorder. J Clin Psychiatry 2007; 68 (2): 254–60.
21. Chessick CA et al. Azapirones for generalized anxiety disorder. Cochrane Database Syst Rev 2006; 19 (3): CD006115.
22. Davidson JR et al. Duloxetine treatment for relapse prevention in adults with generalized anxiety disorder: a double-blind placebo-controlled trial. Neuropsychopharmacol 2008; 18 (9): 673–81.
23. Diagnostic and statistical manual of mental disorders. 5th ed. Text revision (DSM-5). Washington, DC: American Psychiatric Press, 2013.
24. Feltner DE et al. A randomized, double-blind, placebo-controlled, fixed-dose, multicenter study of pregabalin in patients with generalized anxiety disorder. J Clin Psychopharmacol 2003; 23 (3): 240–9.
25. Feltner DE et al. Long-term efficacy of pregabalin in generalized anxiety disorder. Int Clin Psychopharmacol 2008; 23 (1): 18–28.
26. Goodman WK et al. Treatment of generalized anxiety disorder with escitalopram: pooled results from double-blind, placebo-controlled trials. J Affect Disord 2005; 87 (2–3): 161–67.
27. Hartford J et al. Duloxetine as an SNRI treatment for generalized anxiety disorder: results from a placebo and active controlled trial. Int Clin Psychopharmacol 2007; 22: 167–74.
28. Hidalgo RB et al. An effect-size analysis of pharmacologic treatments for generalized anxiety disorder. J Psychopharmacol 2007; 21: 864–72.
29. Hunot V et al. Psychological therapies for generalised anxiety disorder. Cochrane Database Syst Rev 2007; 24 (1): CD001848.
30. Judd L, Kessler RC. Comorbidity as a fundamental feature of generalized anxiety disorders: results from the National Comorbidity Study. Acta Psychiatr Scand Suppl 1998; 393: 6–11.
31. Kasper S et al. Efficacy of pregabalin and venlafaxine-XR in generalized anxiety disorder: results of a double-blind, placebo-controlled 8-week trial. Int Clin Psychopharmacol 2009; 24 (2): 87–96.
32. Katzman M et al. Extended release quetiapine fumarate (quetiapine XR) monotherapy as maintenance treatment for generalized anxiety disorder: a long-term, randomized, placebo-controlled trial. Int Clin Psychopharmacol 2011; 26 (1): 11–24.
33. Khan A et al. A randomized, double-blind study of once-daily extended release quetiapine fumarate (quetiapine XR) monotherapy in patients with generalized anxiety disorder. J Clin Psychopharmacol 2011; 31 (4): 418–28.
34. Laakmann G et al. Buspirone and lorazepam in the treatment of generalized anxiety disorder in outpatients. Psychopharmacology (Berl) 1998; 136 (4): 357–66.
35. Lenox-Smith AJ et al. A double-blind, randomised, placebo controlled study of venlafaxine XL in patients with generalised anxiety disorder in primary care. Br J Gen Pract 2003; 53: 772–7.
36. Lenze EJ et al. Escitalopram for older adults with generalized anxiety disorder: a randomized controlled trial. JAMA 2009; 301 (3): 295–303.
37. Leonardo E. Anxiety as a developmental disorder. Neuropsychopharmacology 2008; 33 (1): 134–40.
38. Levinson-Castiel R et al. Neonatal abstinence syndrome after in utero exposure to selective serotonin reuptake inhibitors in term infants. Arch Pediatr Adolesc Med 2006; 160 (2): 173–6.
39. Martin JLR et al. Benzodiazepines in generalized anxiety disorder: heterogeneity of outcomes based on a systematic review and meta-analysis of clinical trials. J Psychopharmacol 2007; 21 (7): 774–82.
40. Mezhebovsky I et al. Double-blind, randomized study of extended release quetiapine fumarate (quetiapine XR) monotherapy in older patients with generalized anxiety disorder. Int J Geriatr Psychiatry 2013; 28 (6): 615–25.
41. Mitte K. A meta-analysis of the efficacy of psycho- and pharmacotherapy in panic disorder with and without agoraphobia. J Affect Disord 2005; 88: 27–45.
42. Montgomery SA et al. Efficacy and safety of pregabalin in the treatment of generalized anxiety disorder: a 6-week, multicenter, randomized, double-blind, placebo-controlled comparison of pregabalin and venlafaxine. J Clin Psychiatry 2006; 67: 771–82.
43. Munk-Jorgensen P et al. Prevalence of generalized anxiety disorder in general practice in Denmark, Finland and Norway. Psychiatr Serv 2006; 57 (12): 1738–44.
44. Nutt D, Sharpe M. Uncritical positive regard? Issues in the efficacy and safety of psychotherapy. J Psychopharmacol 2008; 22: 3–6.
45. Pande AC et al. Pregabalin in generalized anxiety disorder: a placebo-controlled trial. Am J Psychiatry 2003; 160: 533–40.
46. Perugi G et al. Open-label evaluation of venlafaxine sustained release in outpatients with generalized anxiety disorder with comorbid major depression or dysthymia: effectiveness, tolerability and predictors of response. Neuropsychobiology 2002; 46 (3): 145–9.
47. Pinheiro et al. Psychiatric morbidity and alcohol use by pregnant women in a public obstetric service. Rev Saude Publica 2005; 39 (4): 593–8.
48. Pohl RB et al. Efficacy of pregabalin in the treatment of generalized anxiety disorder: double-blind, placebo-controlled comparison of BID versus TID dosing. J Clin Psychopharmacol 2005; 25: 151–8.
49. Pollack MH et al. Paroxetine in the treatment of generalized anxiety disorder: results of a placebo-controlled, flexible-dosage trial. J Clin Psychiatry 2001; 62 (5): 350–7.
50. Pollack MH et al. Predictors of outcome following venlafaxine extended-release treatment of DSM-IV generalized anxiety disorder: a pooled analysis of short- and long-term studies. J Clin Psychopharmacol 2003; 23 (3): 250–9.
51. Pollack MH et al. Early improvement during duloxetine treatment of generalized anxiety disorder predicts response and remission at endpoint. J Psychiatr Res 2008; 42 (14): 1176–84.
52. Rickels K et al. Antidepressants for the treatment of generalized anxiety disorder. A placebo-controlled comparison of imipramine, trazodone, and diazepam. Arch Gen Psychiatry 1993; 50: 884–95.
53. Rickels K et al. Efficacy of extended-release venlafaxine in nondepressed outpatients with generalized anxiety disorder. Am J Psychiatry 2000; 157: 968–74.
54. Rickels K et al. Paroxetine treatment of generalized anxiety disorder: a double-blind, placebo-controlled study. Am J Psychiatry 2003; 160: 749–56.
55. Rickels K et al. Pregabalin for treatment of generalized anxiety disorder: a 4-week, multicenter, double-blind, placebo controlled trial of pregabalin and alprazolam. Arch Gen Psychiatry 2005; 62: 1022–30.
56. Rickels K et al. Remission of generalized anxiety disorder: a review of the paroxetine clinical trials database. J Clin Psychiatry 2006; 67 (1): 41–7.
57. Rickels K et al. Adjunctive therapy with pregabalin in generalized anxiety disorder patients with partial response to SSRI or SNRI treatment. Int Clin Psychopharmacol 2012; 27 (3): 142–50.
58. Rodriguez BF et al. Characteristics and predictors of full and partial recovery from generalized anxiety disorder in primary care patients. J Nerv Ment Dis 2006; 194 (2): 91–7.
59. Rynn M et al. Efficacy and safety of duloxetine in the treatment of generalized anxiety disorder: a flexible-dose, progressive-titration, placebo-controlled trial. Depress Anxiety 2008; 25 (3): 182–9.
60. Stein DJ et al. Escitalopram for the treatment of GAD: efficacy across different subgroups and outcomes. Ann Clin Psychiatry 2005; 17 (2): 71–5.
61. Stein DJ et al. Efficacy of agomelatine in generalized anxiety disorder: a randomized, double-blind, placebo-controlled study. J Clin Psychopharmacol 2008; 28 (5): 561–6.
62. Stein DJ et al. Efficacy of pregabalin in depressive symptoms associated with generalized anxiety disorder: a pooled analysis of 6 studies. Eur Neuropsychopharmacol 2008; 18 (6): 422–30.
63. Stocchi F et al. Efficacy and tolerability of paroxetine for the long-term treatment of generalized anxiety disorder J Clin Psychiatry 2003; 64 (3): 250–8.
64. Tyrer P et al. The Nottingham Study of Neurotic Disorder: predictors of 12-year outcome of dysthymic, panic and generalized anxiety disorder. Psychol Med 2004; 34 (8): 1385–94.
65. Whalen PJ et al. A functional magnetic resonance imaging predictor of treatment response to venlafaxine in generalized anxiety disorder. Biol Psychiatry 2008; 63 (9): 858–63.
66. Wittchen HU. Generalized anxiety disorder: prevalence, burden, and cost to society. Depress Anxiety 2002; 16: 162–71.

