Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2015
Применение Меманталя и оригинального мемантина при умеренной и тяжелой деменции вследствие болезни Альцгеймера: клинический и фармакоэкономический аспекты №02 2015
Номера страниц в выпуске:28-34
В статье изложены результаты отечественного рандомизированного контролируемого сравнительного с перекрестным дизайном исследования Меманталя и оригинального мемантина при умеренной и тяжелой деменции вследствие болезни Альцгеймера. Достоверных различий в действии Меманталя и оригинального мемантина на показатели когнитивного функционирования, поведенческих и психотических симптомов, инструментальной активности, а также в безопасности препаратов не выявлено. При этом перевод пациента на Меманталь позволяет увеличить экономическую доступность терапии деменций в 2 раза.
В статье изложены результаты отечественного рандомизированного контролируемого сравнительного с перекрестным дизайном исследования Меманталя и оригинального мемантина при умеренной и тяжелой деменции вследствие болезни Альцгеймера. Достоверных различий в действии Меманталя и оригинального мемантина на показатели когнитивного функционирования, поведенческих и психотических симптомов, инструментальной активности, а также в безопасности препаратов не выявлено. При этом перевод пациента на Меманталь позволяет увеличить экономическую доступность терапии деменций в 2 раза.
Ключевые слова: болезнь Альцгеймера, мемантин, доступность терапии.
orgmopnd@rambler.ru
Для цитирования: Ширяев О.Ю., Шаповалов Д.Л., Полозова Т.М. и др. Применение Меманталя и оригинального мемантина при умеренной и тяжелой деменции вследствие болезни Альцгеймера: клинический и фармакоэкономический аспекты. Психиатрия
и психофармакотерапия. 2015; 17 (2): 28–34.
Memantal and original memantine in moderate/severe dementia due to Alzheimer’s disease: clinical and pharmacoeconomical aspects
O.Yu.Shiryaev1, D.L.Shapovalov2, T.M.Polozova2, O.V.Goncharova2, N.A.Kuznetsova2, E.V.Cherenkova2, E.Yu.Fedorova2
1N.N.Burdenko Voronezh State Medical University of the Ministry of Health of the Russian Federation. 394036, Russian Federation, Voronezh, ul. Studencheskaia, d. 10;
2Voronezh Regional Clinical Psychoneurological Dispensary. 394071, Russian Federation, Voronezh, ul. 20 let Oktiabria, d. 73
The results of original randomized controlled comparative cross- designed study of generic medication (Memantal) and original memantine in moderate/severe dementia due to Alzheimer’s disease presented. No statistically significant differences in cognitive functions, neuropsychiatric symptoms, instrumental activity and safety revealed. Switching to Memantal from original memantine makes antidement therapy twice more available.
Key words: Alzheimer’s disease, memantine, availability.
orgmopnd@rambler.ru
For citation: Shiryaev O.Yu., Shapovalov D.L., Polozova T.M. et al. Memantal and original memantine in moderate/severe dementia
due to Alzheimer’s disease: clinical and pharmacoeconomical aspects. Psychiatry and psichopharmacotherapy. 2015; 17 (2): 28–34.
Актуальность проблемы
Деменции позднего возраста (ДПВ) – важная проблема не только психиатрии, но и общественного здоровья в целом. В настоящее время в мире насчитывается около 35,6 млн больных ДПВ [1]. Достоверных статистических данных для Российской Федерации нет, но по расчетам [2], основанным на данных сплошных обследований пожилых в Москве [3], соответствующее число может составлять около 1,1 млн. В связи с характерным для большинства развитых стран постарением населения имеется тенденция к росту численности больных с этой патологией, и к 2030 г. общее число больных ДПВ в мире достигнет 65,7 млн человек, а к 2050 г. – 115,4 млн [1]. В РФ к 2020 г. число больных ДПВ составит около 1,4 млн, что сравнимо с числом учтенных больных шизофренией [2]. «Бремя деменции» для общества, как и в случае большинства хронических заболеваний, слагается из прямых затрат на оказание медицинской и социальной помощи и непрямых затрат. Непрямые затраты с трудом поддаются количественной оценке, но можно предположить, что в случае ДПВ их размер особенно велик, так как они формируются упущенной выгодой за счет не только инвалидизации самих пациентов, но и снижения экономической активности лиц (прекращение работы, переход на работу более низкой квалификации или с неполным рабочим днем), осуществляющих уход за пациентами, а возможно и за счет более высокой заболеваемости этих лиц в сравнении с общим населением. С учетом всего сказанного, по существующим оценкам, «бремя деменции» для мировой экономики в 2010 г. составляло 604 млн дол. США [1]. Для РФ медицинские затраты на деменцию (без стоимости лекарств) в 2005 г. составляли не менее 75 млрд руб. [4]. Высокая распространенность ДПВ и значительный ущерб, наносимый этими состояниями, предопределяют актуальность поиска методов их эффективной терапии. По современным представлениям, 70–90% случаев ДПВ вызвано болезнью Альцгеймера (БА) [1], в связи с чем усилия исследователей сосредоточены на разработке методов лечения именно данной нозологии. В настоящее время в литературе выделяют следующие стратегии терапии БА: холинергическая, глутаматергическая, нейропротективная, гормональная, противовоспалительная, антиамилоидная [5]. Часть случаев БА, обусловленная инсулинорезистентностью нейронов, возможно, поддается коррекции антидиабетическими средствами [6] – интраназально вводимым инсулином и антагонистами PPAR-рецепторов. Из этого числа гормональная, противовоспалительная и антиамилоидная стратегии к настоящему времени не вышли из стадии предрегистрационного изучения. Для некоторых антагонистов PPAR-рецепторов показана безопасность при БА [7], а для интраназально вводимого инсулина – и возможность краткосрочного улучшения когнитивных функций пациентов [8]. Основная проблема с внедрением результатов этих исследований в практику состоит в том, что на сегодняшний день не существует способов выявления инсулинорезистентности нейронов, соответственно, невозможно выделить группу пациентов с БА, которым могли бы быть полезны антидиабетические средства. Нейропротективные препараты используют в лечении БА в некоторых странах, включая РФ, но доказательная база их применения недостаточна. Наиболее научно обоснованными и широко используемыми стратегиями терапии БА являются холинергическая и глутаматергическая. Указанные стратегии рекомендованы национальными клиническими руководствами многих европейских стран [9]. Холинергическая стратегия основана на применении ряда лекарственных препаратов одной клинико-фармакологической группы – ингибиторов ацетилхолинэстеразы центрального действия. Для всех ее представителей доказана эффективность при легкой и умеренной деменции в связи с БА [10]. Различия между препаратами при использовании по данному показанию связаны с особенностями переносимости и возможной индивидуальной эффективностью у конкретного пациента (показано, что неэффективность конкретного ингибитора ацетилхолинэстеразы не предопределяет отсутствия эффекта от применения других представителей этой же группы) [11]. Глутаматергическая стратегия основана на применении единственной молекулы – мемантина. Эффективность мемантина наиболее убедительно доказана при умеренной и тяжелой деменции в связи с БА [10, 12, 13]. В перечисленных работах показано, что препарат не только вызывает некоторое улучшение когнитивных функций (которое у соответствующей категории пациентов может быть клинически не значимым), но и способствует сохранению и активизации остаточных навыков самообслуживания, снижает выраженность поведенческих и психотических симптомов деменции, уменьшает потребность в психо-тропных средствах для их купирования. В российском исследовании [4] показано, что мемантин значимо снижает трудозатраты ухаживающего за пациентом лица и позволяет отодвинуть во времени госпитализацию либо помещение в стационарное учреждение социального обслуживания. Учитывая, что 40–70% пациентов с БА оказываются в поле зрения врача-психиатра на стадии умеренной либо тяжелой деменции [4], следовало бы ожидать, что сопоставимая доля пациентов с БА получают терапию мемантином. Однако фактически в психоневрологических диспансерах Москвы мемантин получают не более 5% учтенных пациентов с деменциями [4]. В выборке резидентов домов престарелых в Италии численностью 2215 человек, с распространенностью деменции 50,7%, мемантин был назначен лишь одному больному [14]. В целом по РФ терапию препаратами с доказанной эффективностью (мемантин либо ингибиторы ацетилхолинэстеразы) получают не более 1,6% больных деменциями [2]. Причины столь низкого охвата пациентов с деменциями базисной терапией требуют отдельного обсуждения. В качестве возможных причин можно назвать «терапевтический нигилизм» врачей и аналогичную позицию родственников, обусловленную, в частности, недостатком информации о возможностях современной терапии деменций. Нельзя исключить и роль фармакоэкономической составляющей – оригинальный мемантин является достаточно дорогим лекарственным средством, что особенно значимо для населения РФ в условиях экономического кризиса и системных проблем с обеспечением бесплатными препаратами для амбулаторного приема. Повышение экономической доступности терапии мемантином, в том числе за счет внедрения в практику высококачественных генериков с доказанной терапевтической эквивалентностью, может привести к увеличению охвата пациентов с деменциями базисной терапией. Это в свою очередь потенциально способно снизить как прямые расходы на оказание больным БА стационарной психиатрической помощи, так и непрямые потери (за счет уменьшения трудозатрат ухаживающих родственников). Меманталь является одним из генериков мемантина, клиническая эффективность которого при БА продемонстрирована в работе В.А.Куташева и соавт. [15]. Доказательства терапевтической эквивалентности Меманталя оригинальному мемантину при умеренной и тяжелой деменции в связи с БА в доступной литературе отсутствуют. Также отсутствуют данные сравнительного фармакоэкономического анализа терапии Меманталем и оригинальным мемантином. В связи со сказанным, на базе Воронежского областного клинического психоневрологического диспансера было проведено рандомизированное контролируемое сравнительное с перекрестным дизайном исследование эффективности и безопасности препаратов Меманталь и Акатинол Мемантин при БА на стадии умеренной и тяжелой деменции. Исследование проводилось в период с декабря 2014 г. по апрель 2015 г. с одобрения локального этического комитета. Первичной целью исследования была сравнительная оценка терапевтической эквивалентности Меманталя и оригинального мемантина при применении по зарегистрированным показаниям (умеренная или тяжелая деменция при БА) в обычно применяемых дозах (10 или 20 мг мемантина в сутки) в условиях перекрестного дизайна. В качестве вторичных целей ставилось:
1) оценить переносимость и безопасность применения Меманталя в сравнении с оригинальным мемантином;
2) провести сравнительный фармакоэкономический анализ применения Меманталя и оригинального мемантина.
Дизайн исследования
В исследование были включены 50 пациентов с умеренной либо тяжелой деменцией при БА, которые принимали оригинальный мемантин в дозе 10–20 мг/сут на протяжении не менее чем 1 мес до начала исследования. Диагноз деменции при БА устанавливался в соответствии с диагностическими критериями Международной классификации болезней 10-го пересмотра. Тяжесть деменции определялась по шкале CDR (Clinical Dementia Rating) [16]. Для облегчения работы с избранными оценочными шкалами пациентов с тяжелой деменцией включали в исследование при условии сохранности членораздельной речи и способности ответить на простейшие вопросы соответственно их смыслу. Пациенты рандомизировались в две параллельные группы: 1-я (n=25) – продолжала лечение оригинальным мемантином, 2-я (n=25) – одномоментно переводилась на Меманталь, назначавшийся в той же дозе, что и оригинальный мемантин. Общая длительность исследования составляла 12 нед с визитами каждые 4 нед. Определяли глобальную оценку тяжести деменции по шкале CDR, уровень когнитивного функционирования – по шкале MMSE (Mini-Mental State Examination) [17], выраженность поведенческих и психотических симптомов и дистресса ухаживающего лица – по опроснику Каммингса NPI (NPI-F и NPI-D соответственно) [18], сохранность инструментальной активности в повседневной жизни – по опроснику IADL [19]. Для контроля безопасности на каждом визите проводились измерения артериального давления (АД) и частоты сердечных сокращений, определение глюкозы капиллярной крови натощак экспресс-методом, регистрация нежелательных явлений со слов ухаживающего лица и пациента, если последний мог сформулировать жалобы. Фармакоэкономический анализ проводили в соответствии с рекомендациями [20]. В каждой группе определялась стоимость 1 года терапии исследуемым препаратом (показатели DC1 и DC2 соответственно). На их основе рассчитывались показатели CMR (cost-minimization ratio – в данном случае экономия средств ухаживающего лица при применении Меманталя в сравнении с оригинальным мемантином) и Q (показатель упущенных возможностей – процент пациентов, которые дополнительно могли бы получить антидементную терапию, если в обеих группах был назначен Меманталь, а не оригинальный мемантин). В ходе исследования не допускалось назначения ингибиторов ацетилхолинэстеразы центрального действия, а также любых препаратов, обладающих ноотропным или нейропротективным эффектом. Допускалось использование любых препаратов, показанных для лечения фоновой соматической патологии. Назначение и отмена психо-тропных средств (нейролептики, антидепрессанты, транквилизаторы) не ограничивались, однако каждый случай их первичного назначения, отмены или коррекции дозы подлежал отдельной фиксации и анализу. Статистическую обработку результатов исследования проводили с использованием стандартных методов описательной статистики. Для оценки достоверности различий использовали непараметрический критерий Уилкоксона с 95% доверительным интервалом.
Результаты исследования

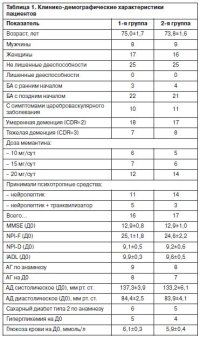
Клинико-демографические характеристики пациентов представлены в табл. 1. Из представленных данных видно, что группы были сопоставимы по основным клиническим и демографическим параметрам; статистически достоверных различий отмечено не было. Выраженность когнитивного снижения, поведенческой и психотической симптоматики, нарушений повседневной активности соответствовала критериям включения. В обеих группах преобладали женщины (1-я группа – 68,0%, 2-я – 64,0%) и пациенты с БА с поздним началом (1-я группа – 88,0%, 2-я – 84,0%), что соответствует современным представлениям об эпидемиологии БА. В связи со спецификой критериев включения в обеих группах большинство (1-я группа – 72,0%, 2-я – 68,0%) составляли пациенты с умеренной деменцией. Клинически симптомокомплекс когнитивного снижения у этих больных соответствовал классическому представлению о лакунарной сенильной деменции, с ведущей ролью грубых амнестических расстройств, при относительной сохранности речи, праксиса, гнозиса и «фасада» способности к общению. Симптомы цереброваскулярной болезни (головные боли, головокружение, эмоциональная лабильность, паркинсоноподобные двигательные нарушения, атактическая походка на фоне хронических сердечно-сосудистых заболеваний, прежде всего артериальной гипертензии – АГ) отмечались у 40% пациентов 1-й группы и 44% – 2-й. Однако, по данным анамнеза, когнитивное снижение у этих пациентов развивалось по стереотипу, характерному БА с поздним началом, – медленно, постепенно, с явлениями «сенильной психопатизации» в преморбиде и последующим нарастанием амнестических расстройств. Не отмечалось эпизодов «ступенеобразного» прогрессирования когнитивного дефицита, не было анамнестических данных по поводу перенесенных острых нарушений мозгового кровообращения. В статусе отсутствовали признаки «очагового» нейропсихологического дефицита (выраженные дисфазия, дисгнозия, диспраксия). Исходя из этого мы сочли возможным включить данных пациентов в исследование с диагнозом «деменция при БА с поздним началом», хотя в обычной клинической практике им, вероятно, была бы диагностирована сосудистая деменция. Наличие в выборке значительного числа таких пациентов скорее всего говорит о потенциально высокой роли «сосудистых факторов риска» в развитии и прогрессировании БА и общей популяции пожилых в РФ. Среди поведенческих и психотических симптомов деменции клинически у пациентов с умеренной деменцией чаще всего отмечались эпизоды спутанности с бессонницей, возбуждением и ложными узнаваниями, а у пациентов с тяжелой деменцией – импульсивная агрессия, инверсия суточного ритма и поведенческие стереотипии (выдвигание и задвигание мебельных ящиков, разрывание одежды, постельного белья). По данным опросника Каммингса, у пациентов с умеренной деменцией высокие оценки частоты и выраженности симптомов (3–4 балла) чаще отмечались по показателям «бред» и «галлюцинации», а у пациентов с тяжелой деменцией – «агрессия» и «нарушения поведения в ночное время». Эти расхождения связаны с разной трактовкой симптоматики ухаживающими лицами, заполнявшими опросник Каммингса, и врачом-психиатром. Так, ложные узнавания ухаживающими лицами расценивались как галлюцинации, а конфабуляции и псевдореминесценции – как бред. В действительности же бредовая симптоматика в виде идей ущерба отмечалась у 5 (20%) пациентов 1-й группы и 4 (16%) – 2-й, а галлюцинаторных переживаний ни у одного из обследованных не было. Инструментальная активность в повседневной жизни у всех пациентов с тяжелой деменцией характеризовалась несостоятельностью во всех основных сферах жизнедеятельности, что давало минимально возможную оценку (8 баллов) по опроснику IADL. У пациентов с умеренной деменцией отмечались частичная сохранность повседневной активности, наиболее часто – способность делать простые домашние дела (мыть посуду, заправлять постель) под присмотром родственников, способность ответить на телефонный звонок, принять заранее разложенные родственником лекарства. Из фоновых соматических заболеваний наиболее часто отмечались АГ (36% пациентов 1-й группы, 32% – 2-й), сахарный диабет типа 2 (24% пациентов 1-й группы, 20% – 2-й), аритмический вариант ишемической болезни сердца с постоянной формой мерцательной аритмии (по 1 пациенту в 1 и 2-й группах), а также хроническая патология органов пищеварения в стадии ремиссии. Повышенные значения АД и гипергликемия отмечались у части пациентов и на момент включения в исследование. Все пациенты с фоновой соматической патологией в течение исследования продолжали ранее назначенное медикаментозное лечение (эналаприл, лизиноприл – по поводу АГ, малые дозы ацетилсалициловой кислоты и нитраты – по поводу ишемической болезни сердца, пероральные антидиабетические средства). Психотропные средства в связи с выраженными, затрудняющими уход поведенческими и психотическими симптомами получали 64% пациентов 1-й группы и 68% – 2-й. Среди нейролептиков использовались галоперидол (0,5–5 мг/сут), промазин (25–75 мг/сут), кветиапин (25–100 мг/сут), рисперидон (0,5–2 мг/сут), среди транквилизаторов – диазепам (2,5–5 мг/сут), нитразепам (5 мг/сут). К моменту начала исследования рекомендованная при умеренной и тяжелой деменции доза мемантина 20 мг/сут была достигнута только у 48% пациентов 1-й группы и 56% – 2-й. Невозможность достижения терапевтической дозы родственники чаще всего объясняли возникновением беспокойства и возбуждения при увеличении дозы мемантина. Динамика показателей эффективности антидементной терапии в ходе исследования отражена в табл. 2.  Как видно из представленных данных, выраженность когнитивного снижения и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно не изменилась. Также ни у одного пациента не было зарегистрировано изменения глобальной оценки тяжести деменции по шкале CDR (конверсии умеренной деменции в легкую или тяжелую) к моменту завершения исследования. При более детальном анализе было установлено, что у всех пациентов с БА с ранним началом (3 больных в 1-й группе и 4 – во 2-й) отмечалось незначительное снижение общего балла MMSE, т.е. дальнейшее прогрессирование когнитивного дефицита. У 11 (44%) пациентов 1-й группы и 10 (40%) – 2-й оценка по MMSE на Д0 и Д84 не отличалась. И, наконец, у 11 (44%) пациентов 1-й группы и 11 (44%) – 2-й в ходе исследования было отмечено незначительное улучшение когнитивных функций, выразившееся в росте оценки по MMSE на 1–2 балла. Полученные данные соответствуют существующим представлениям о возможных эффектах мемантина и курабильности разных подтипов БА и свидетельствуют о том, что Меманталь и оригинальный мемантин в равной степени стабилизировали выраженность когнитивного снижения у пациентов с умеренной и тяжелой деменцией альцгеймеровского типа. Выраженность поведенческих и психотических симптомов деменции (показатель NPI-F) к концу исследования и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно снизилась. При этом достоверных межгрупповых различий выявлено не было. Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Наибольшее снижение отмечалось по позициям опросника: «нарушение поведения в ночное время», «агрессия» и «бред». Случаев, когда назначение психотропных средств потребовалось пациентам, ранее их не получавшим, ни в 1-й, ни во 2-й группе не отмечалось; 2 пациентам 1-й группы и 3 – 2-й группы ранее назначенные нейролептики были отменены в связи с уменьшением тяжести поведенческих и психотических симптомов. Таким образом, как оригинальный мемантин, так и Меманталь в одинаковой степени снижали выраженность поведенческих и психотических симптомов деменции и уменьшали потребность в психотропных средствах. К концу исследования и у пациентов, переведенных на Меманталь, и у пациентов, продолжавших лечение оригинальным мемантином, отмечалось достоверное улучшение уровня активности в повседневной жизни (показатель IADL). Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Оно проявлялось в том, что пациенты, ранее не участвовавшие в поддержании порядка в доме, вновь начинали выполнять некоторые простейшие дела под присмотром родственников. Таким образом, как Меманталь, так и оригинальный мемантин способствовали некоторому улучшению бытовой адаптации больных. Динамика показателей безопасности антидементной терапии в ходе исследования отражена в табл. 3.
Как видно из представленных данных, выраженность когнитивного снижения и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно не изменилась. Также ни у одного пациента не было зарегистрировано изменения глобальной оценки тяжести деменции по шкале CDR (конверсии умеренной деменции в легкую или тяжелую) к моменту завершения исследования. При более детальном анализе было установлено, что у всех пациентов с БА с ранним началом (3 больных в 1-й группе и 4 – во 2-й) отмечалось незначительное снижение общего балла MMSE, т.е. дальнейшее прогрессирование когнитивного дефицита. У 11 (44%) пациентов 1-й группы и 10 (40%) – 2-й оценка по MMSE на Д0 и Д84 не отличалась. И, наконец, у 11 (44%) пациентов 1-й группы и 11 (44%) – 2-й в ходе исследования было отмечено незначительное улучшение когнитивных функций, выразившееся в росте оценки по MMSE на 1–2 балла. Полученные данные соответствуют существующим представлениям о возможных эффектах мемантина и курабильности разных подтипов БА и свидетельствуют о том, что Меманталь и оригинальный мемантин в равной степени стабилизировали выраженность когнитивного снижения у пациентов с умеренной и тяжелой деменцией альцгеймеровского типа. Выраженность поведенческих и психотических симптомов деменции (показатель NPI-F) к концу исследования и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно снизилась. При этом достоверных межгрупповых различий выявлено не было. Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Наибольшее снижение отмечалось по позициям опросника: «нарушение поведения в ночное время», «агрессия» и «бред». Случаев, когда назначение психотропных средств потребовалось пациентам, ранее их не получавшим, ни в 1-й, ни во 2-й группе не отмечалось; 2 пациентам 1-й группы и 3 – 2-й группы ранее назначенные нейролептики были отменены в связи с уменьшением тяжести поведенческих и психотических симптомов. Таким образом, как оригинальный мемантин, так и Меманталь в одинаковой степени снижали выраженность поведенческих и психотических симптомов деменции и уменьшали потребность в психотропных средствах. К концу исследования и у пациентов, переведенных на Меманталь, и у пациентов, продолжавших лечение оригинальным мемантином, отмечалось достоверное улучшение уровня активности в повседневной жизни (показатель IADL). Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Оно проявлялось в том, что пациенты, ранее не участвовавшие в поддержании порядка в доме, вновь начинали выполнять некоторые простейшие дела под присмотром родственников. Таким образом, как Меманталь, так и оригинальный мемантин способствовали некоторому улучшению бытовой адаптации больных. Динамика показателей безопасности антидементной терапии в ходе исследования отражена в табл. 3.  Как видно из приведенных данных, статистически достоверных сдвигов АД и гликемии ни у пациентов, продолжавших лечение оригинальным мемантином, ни у пациентов, переведенных на Меманталь, за все время исследования зарегистрировано не было. Нежелательные лекарственные реакции в связи со спецификой исследованной выборки отмечались редко: у 5 пациентов 1-й группы и 6 – 2-й группы отмечалась головная боль, 3 пациентов 1-й группы и 2 – 2-й группы – запор, 1 пациента 1-й группы и 1 – 2-й группы – кратковременная диарея, 1 пациента 1-й группы и 2 – 2-й группы – симптомы острой респираторно-вирусной инфекции (субфебрильная температура и заложенность носа). Перечисленные состояния, по мнению врачей-исследователей, не были связаны с приемом мемантина. Случаев госпитализации, серьезных нежелательных явлений ни в 1-й, ни во 2-й группе отмечено не было. В целом терапию мемантином участники исследования переносили хорошо, при этом различий в безопасности между оригинальным мемантином и Меманталем выявить не удалось. Фармакоэкономический анализ терапии Меманталем дал следующие результаты. Средняя стоимость 1 года терапии оригинальным мемантином (показатель DC1) составила 32 374,5 руб. Средняя стоимость 1 года терапии Меманталем (показатель DC2) – 15 672,7 руб. Показатель CMR составил 16 701,8 руб. из расчета на 1 год терапии. Соответственно, показатель упущенных возможностей Q – 106,6%. Следовательно, каждый перевод больного с оригинального мемантина на Меманталь позволит еще одному пациенту получить антидементную терапию.
Как видно из приведенных данных, статистически достоверных сдвигов АД и гликемии ни у пациентов, продолжавших лечение оригинальным мемантином, ни у пациентов, переведенных на Меманталь, за все время исследования зарегистрировано не было. Нежелательные лекарственные реакции в связи со спецификой исследованной выборки отмечались редко: у 5 пациентов 1-й группы и 6 – 2-й группы отмечалась головная боль, 3 пациентов 1-й группы и 2 – 2-й группы – запор, 1 пациента 1-й группы и 1 – 2-й группы – кратковременная диарея, 1 пациента 1-й группы и 2 – 2-й группы – симптомы острой респираторно-вирусной инфекции (субфебрильная температура и заложенность носа). Перечисленные состояния, по мнению врачей-исследователей, не были связаны с приемом мемантина. Случаев госпитализации, серьезных нежелательных явлений ни в 1-й, ни во 2-й группе отмечено не было. В целом терапию мемантином участники исследования переносили хорошо, при этом различий в безопасности между оригинальным мемантином и Меманталем выявить не удалось. Фармакоэкономический анализ терапии Меманталем дал следующие результаты. Средняя стоимость 1 года терапии оригинальным мемантином (показатель DC1) составила 32 374,5 руб. Средняя стоимость 1 года терапии Меманталем (показатель DC2) – 15 672,7 руб. Показатель CMR составил 16 701,8 руб. из расчета на 1 год терапии. Соответственно, показатель упущенных возможностей Q – 106,6%. Следовательно, каждый перевод больного с оригинального мемантина на Меманталь позволит еще одному пациенту получить антидементную терапию.
 Как видно из представленных данных, выраженность когнитивного снижения и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно не изменилась. Также ни у одного пациента не было зарегистрировано изменения глобальной оценки тяжести деменции по шкале CDR (конверсии умеренной деменции в легкую или тяжелую) к моменту завершения исследования. При более детальном анализе было установлено, что у всех пациентов с БА с ранним началом (3 больных в 1-й группе и 4 – во 2-й) отмечалось незначительное снижение общего балла MMSE, т.е. дальнейшее прогрессирование когнитивного дефицита. У 11 (44%) пациентов 1-й группы и 10 (40%) – 2-й оценка по MMSE на Д0 и Д84 не отличалась. И, наконец, у 11 (44%) пациентов 1-й группы и 11 (44%) – 2-й в ходе исследования было отмечено незначительное улучшение когнитивных функций, выразившееся в росте оценки по MMSE на 1–2 балла. Полученные данные соответствуют существующим представлениям о возможных эффектах мемантина и курабильности разных подтипов БА и свидетельствуют о том, что Меманталь и оригинальный мемантин в равной степени стабилизировали выраженность когнитивного снижения у пациентов с умеренной и тяжелой деменцией альцгеймеровского типа. Выраженность поведенческих и психотических симптомов деменции (показатель NPI-F) к концу исследования и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно снизилась. При этом достоверных межгрупповых различий выявлено не было. Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Наибольшее снижение отмечалось по позициям опросника: «нарушение поведения в ночное время», «агрессия» и «бред». Случаев, когда назначение психотропных средств потребовалось пациентам, ранее их не получавшим, ни в 1-й, ни во 2-й группе не отмечалось; 2 пациентам 1-й группы и 3 – 2-й группы ранее назначенные нейролептики были отменены в связи с уменьшением тяжести поведенческих и психотических симптомов. Таким образом, как оригинальный мемантин, так и Меманталь в одинаковой степени снижали выраженность поведенческих и психотических симптомов деменции и уменьшали потребность в психотропных средствах. К концу исследования и у пациентов, переведенных на Меманталь, и у пациентов, продолжавших лечение оригинальным мемантином, отмечалось достоверное улучшение уровня активности в повседневной жизни (показатель IADL). Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Оно проявлялось в том, что пациенты, ранее не участвовавшие в поддержании порядка в доме, вновь начинали выполнять некоторые простейшие дела под присмотром родственников. Таким образом, как Меманталь, так и оригинальный мемантин способствовали некоторому улучшению бытовой адаптации больных. Динамика показателей безопасности антидементной терапии в ходе исследования отражена в табл. 3.
Как видно из представленных данных, выраженность когнитивного снижения и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно не изменилась. Также ни у одного пациента не было зарегистрировано изменения глобальной оценки тяжести деменции по шкале CDR (конверсии умеренной деменции в легкую или тяжелую) к моменту завершения исследования. При более детальном анализе было установлено, что у всех пациентов с БА с ранним началом (3 больных в 1-й группе и 4 – во 2-й) отмечалось незначительное снижение общего балла MMSE, т.е. дальнейшее прогрессирование когнитивного дефицита. У 11 (44%) пациентов 1-й группы и 10 (40%) – 2-й оценка по MMSE на Д0 и Д84 не отличалась. И, наконец, у 11 (44%) пациентов 1-й группы и 11 (44%) – 2-й в ходе исследования было отмечено незначительное улучшение когнитивных функций, выразившееся в росте оценки по MMSE на 1–2 балла. Полученные данные соответствуют существующим представлениям о возможных эффектах мемантина и курабильности разных подтипов БА и свидетельствуют о том, что Меманталь и оригинальный мемантин в равной степени стабилизировали выраженность когнитивного снижения у пациентов с умеренной и тяжелой деменцией альцгеймеровского типа. Выраженность поведенческих и психотических симптомов деменции (показатель NPI-F) к концу исследования и у пациентов, продолжавших лечение оригинальным мемантином, и у пациентов, переведенных на Меманталь, достоверно снизилась. При этом достоверных межгрупповых различий выявлено не было. Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Наибольшее снижение отмечалось по позициям опросника: «нарушение поведения в ночное время», «агрессия» и «бред». Случаев, когда назначение психотропных средств потребовалось пациентам, ранее их не получавшим, ни в 1-й, ни во 2-й группе не отмечалось; 2 пациентам 1-й группы и 3 – 2-й группы ранее назначенные нейролептики были отменены в связи с уменьшением тяжести поведенческих и психотических симптомов. Таким образом, как оригинальный мемантин, так и Меманталь в одинаковой степени снижали выраженность поведенческих и психотических симптомов деменции и уменьшали потребность в психотропных средствах. К концу исследования и у пациентов, переведенных на Меманталь, и у пациентов, продолжавших лечение оригинальным мемантином, отмечалось достоверное улучшение уровня активности в повседневной жизни (показатель IADL). Улучшение было заметнее у пациентов с более высокими исходными значениями показателя. Оно проявлялось в том, что пациенты, ранее не участвовавшие в поддержании порядка в доме, вновь начинали выполнять некоторые простейшие дела под присмотром родственников. Таким образом, как Меманталь, так и оригинальный мемантин способствовали некоторому улучшению бытовой адаптации больных. Динамика показателей безопасности антидементной терапии в ходе исследования отражена в табл. 3.  Как видно из приведенных данных, статистически достоверных сдвигов АД и гликемии ни у пациентов, продолжавших лечение оригинальным мемантином, ни у пациентов, переведенных на Меманталь, за все время исследования зарегистрировано не было. Нежелательные лекарственные реакции в связи со спецификой исследованной выборки отмечались редко: у 5 пациентов 1-й группы и 6 – 2-й группы отмечалась головная боль, 3 пациентов 1-й группы и 2 – 2-й группы – запор, 1 пациента 1-й группы и 1 – 2-й группы – кратковременная диарея, 1 пациента 1-й группы и 2 – 2-й группы – симптомы острой респираторно-вирусной инфекции (субфебрильная температура и заложенность носа). Перечисленные состояния, по мнению врачей-исследователей, не были связаны с приемом мемантина. Случаев госпитализации, серьезных нежелательных явлений ни в 1-й, ни во 2-й группе отмечено не было. В целом терапию мемантином участники исследования переносили хорошо, при этом различий в безопасности между оригинальным мемантином и Меманталем выявить не удалось. Фармакоэкономический анализ терапии Меманталем дал следующие результаты. Средняя стоимость 1 года терапии оригинальным мемантином (показатель DC1) составила 32 374,5 руб. Средняя стоимость 1 года терапии Меманталем (показатель DC2) – 15 672,7 руб. Показатель CMR составил 16 701,8 руб. из расчета на 1 год терапии. Соответственно, показатель упущенных возможностей Q – 106,6%. Следовательно, каждый перевод больного с оригинального мемантина на Меманталь позволит еще одному пациенту получить антидементную терапию.
Как видно из приведенных данных, статистически достоверных сдвигов АД и гликемии ни у пациентов, продолжавших лечение оригинальным мемантином, ни у пациентов, переведенных на Меманталь, за все время исследования зарегистрировано не было. Нежелательные лекарственные реакции в связи со спецификой исследованной выборки отмечались редко: у 5 пациентов 1-й группы и 6 – 2-й группы отмечалась головная боль, 3 пациентов 1-й группы и 2 – 2-й группы – запор, 1 пациента 1-й группы и 1 – 2-й группы – кратковременная диарея, 1 пациента 1-й группы и 2 – 2-й группы – симптомы острой респираторно-вирусной инфекции (субфебрильная температура и заложенность носа). Перечисленные состояния, по мнению врачей-исследователей, не были связаны с приемом мемантина. Случаев госпитализации, серьезных нежелательных явлений ни в 1-й, ни во 2-й группе отмечено не было. В целом терапию мемантином участники исследования переносили хорошо, при этом различий в безопасности между оригинальным мемантином и Меманталем выявить не удалось. Фармакоэкономический анализ терапии Меманталем дал следующие результаты. Средняя стоимость 1 года терапии оригинальным мемантином (показатель DC1) составила 32 374,5 руб. Средняя стоимость 1 года терапии Меманталем (показатель DC2) – 15 672,7 руб. Показатель CMR составил 16 701,8 руб. из расчета на 1 год терапии. Соответственно, показатель упущенных возможностей Q – 106,6%. Следовательно, каждый перевод больного с оригинального мемантина на Меманталь позволит еще одному пациенту получить антидементную терапию.Обсуждение результатов
Динамика состояния участников исследования, получавших как Меманталь, так и оригинальный мемантин, соответствует представлениям о возможных эффектах мемантина при умеренной и тяжелой деменции вследствие БА, отраженным в некоторых работах [10, 12, 13]. По-видимому, из полученных эффектов наиболее клинически значимы стабилизация прогрессирования когнитивного дефицита и снижение потребности в психотропных средствах, в равной степени проявившиеся у Меманталя и оригинального мемантина. Значимых различий показателей безопасности Меманталя и оригинального мемантина в ходе исследования также выявлено не было. К методическим ограничениям настоящего исследования можно отнести сравнительно малый размер выборки, который мог быть недостаточен для выявления тонких различий в эффективности и безопасности исследуемых препаратов, а также тот факт, что при наборе пациентов в исследование не проводилась нейровизуализация. Последнее могло привести к накоплению в выборке «недовыявленных» случаев сосудистой деменции. Тем не менее, по нашему мнению, возможные эффекты данных методических ограничений вряд ли были клинически значимы. Результаты фармакоэкономического анализа убедительно демонстрируют, что применение Меманталя позволяет сделать антидементную терапию доступной более широкому кругу пациентов. Учитывая констатированный в некоторых работах [2, 4, 14] крайне низкий охват пациентов с БА базисной терапией, полученные результаты свидетельствуют об актуальности применения Меманталя для практического здравоохранения, в том числе дополнительного лекарственного обеспечения льготных категорий пациентов.
Выводы
1. Меманталь по основным показателям эффективности у пациентов с умеренной и тяжелой деменцией при БА терапевтически эквивалентен оригинальному мемантину.
2. Безопасность терапии Меманталем и оригинальным мемантином существенно не отличается.
3. Применение Меманталя в 2 раза увеличивает экономическую доступность антидементной терапии в сравнении с применением оригинального мемантина.
Сведения об авторах
Ширяев Олег Юрьевич – д-р мед. наук, проф., зав. каф. психиатрии с наркологией ГБОУ ВПО ВГМУ им. Н.Н.Бурденко
Шаповалов Денис Леонидович – канд. мед. наук, зам. глав. врача по медицинской части КУЗ ВО ВОКПД. E-mail: orgmopnd@rambler.ru
Полозова Татьяна Михайловна – канд. мед. наук, участковый врач-психиатр КУЗ ВО ВОКПД
Гончарова Оксана Владимировна – зав. клинико-экспертным отд. стационарного корпуса №1 КУЗ ВО ВОКПД
Кузнецова Наталья Александровна – участковый врач-психиатр КУЗ ВО ВОКПД
Черенкова Елена Васильевна – участковый врач-психиатр КУЗ ВО ВОКПД
Федорова Елена Юрьевна – врач-психиатр консультативного отд. КУЗ ВО ВОКПД
Список исп. литературыСкрыть список1. Деменция: приоритет общественного здравоохранения (официальный доклад). ВОЗ, 2013. / Dementsiia: prioritet obshchestvennogo zdravookhraneniia (ofitsial'nyi doklad). VOZ, 2013. [in Russian]
2. Белоусов Ю.Б., Зырянов С.К., Белоусов Д.Ю., Бекетов А.С. Клинико-экономические аспекты терапии болезни Альцгеймера в России. Качественная клин. практика. 2009; 1: 3–28. / Belousov Iu.B., Zyrianov S.K., Belousov D.Iu., Beketov A.S. Kliniko-ekonomicheskie aspekty terapii bolezni Al'tsgeimera v Rossii. Kachestvennaia klin. praktika. 2009; 1: 3–28. [in Russian]
3. Калын Я.Б., Брацун А.Л. Деменция альцгеймеровского типа: эпидемиология и факторы риска. Психиатрия и психофармакотерапия. 2001; 2: 13–9. / Kalyn Ia.B., Bratsun A.L. Dementsiia al'tsgeimerovskogo tipa: epidemiologiia i faktory riska. Psychiatry and psichopharmacotherapy. 2001; 2: 13–9. [in Russian]
4. Любов Е.Б., Еналиев И.Р., Крюченкова Т.П. Клинико-эпидемиологические, фармакоэпидемиологические и экономические аспекты старческих деменций. Соц. и клин. психиатрия. 2010; 20 (2): 33–8. / Liubov E.B., Enaliev I.R., Kriuchenkova T.P. Kliniko-epidemiologicheskie, farmakoepidemiologicheskie i ekonomicheskie aspekty starcheskikh dementsii. Sots. i klin. psikhiatriia. 2010; 20 (2): 33–8. [in Russian]
5. Гаврилова С.И. Фармакотерапия болезни Альцгеймера. М.: ВНЦПЗ РАМН, 2007. / Gavrilova S.I. Farmakoterapiia bolezni Al'tsgeimera. M.: VNTsPZ RAMN, 2007. [in Russian]
6 Blázquez E. Insulin in the brain: its pathophysiological implications for states related with central insulin resistance, type 2 diabetes and Alzheimer's disease. Front Endocrinol (Lausanne) 2014; 10 (5): 161–5.
7. Geldmacher DS. A randomized pilot clinical trial of the safety of pioglitazone in treatment of patients with Alzheimer disease. Arch Neurol 2011; 68 (1): 45–50.
8. Hölscher C. First clinical data of the neuroprotective effects of nasal insulin application in patients with Alzheimer's disease. Alzheimers Dement 2014; 10 (2), Suppl. 1: 33–7.
9. A NICE-SCIE guideline on supporting people with dementia and their carers in health and social care. The British Psychological Society and Gaskell, 2007.
10. Buckley JS. A Risk-Benefit Assessment of Dementia Medications: Systematic Review of the Evidence. Drugs Aging 2015 [Epub ahead of print].
11. Spaletta G. Cognitive and affective changes in mild to moderate Alzheimer's disease patients undergoing switch of cholinesterase inhibitors: a 6-month observational study. PLoS One 2014; 9 (2) [Epub ahead of print].
12. Robinson D, Keating G. Memantine: a review of its use in Alzheimer’s disease. Drugs 2006; 66 (11): 1515–34.
13. Winblad B, Jones R, Wirth Y et al. Memantine in moderate to severe Alzheimer’s disease: a meta-analysis of randomised clinical trials. Dement Geriatr Cogn Disord 2007; 24 (1): 20–7.
14. Cherubini A. Underrecognition and undertreatment of dementia in Italian nursing homes. J Am Med Dir Assoc 2012; 13 (8): 759.
15. Куташев В.А., Самсонов А.С. Комплаентность и качество терапии болезни Альцгеймера при приеме Меманталя. РМЖ. Психиатрия. 2014; 11: 1603–7. / Kutashev V.A., Samsonov A.S. Komplaentnost' i kachestvo terapii bolezni Al'tsgeimera pri prieme Memantalia. RMZh. Psikhiatriia. 2014; 11: 1603–7. [in Russian]
16. Morris JC. The Clinical Dementia Rating (CDR): Current vision and scoring rules. Neurology 1993; 43: 2412–4.
17. Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12 (3): 189–98.
18. Cummings JL. The Neuropsychiatric Inventory: assessing psychopathology in dementia patients. Neurology 1997; 48 (5), Suppl. 6: 10–6.
19. Lawton MP, Brody EM. Assessment of older people: Self-mantaining and instrumental activities of daily living. Gerontologist 1969; 9: 179–86.
20. Авксентьева М.В., Воробьев П.А., Герасимов В.Б. Экономическая оценка эффективности лекарственной терапии (фармакоэкономический анализ). М.: Ньюдиамед, 2000. / Avksent'eva M.V., Vorob'ev P.A., Gerasimov V.B. Ekonomicheskaia otsenka effektivnosti lekarstvennoi terapii (farmakoekonomicheskii analiz). M.: N'iudiamed, 2000. [in Russian]

