Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина











Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2015
Взаимосвязь полиморфизмов генов белков-переносчиков серотонина и дофамина (SLC6A4, SLC6A3) с переносимостью антидепрессантов разных классов №03 2015
Номера страниц в выпуске:13-21
С целью определения взаимосвязи генетических полиморфизмов белков-переносчиков серотонина и дофамина с переносимостью антидепрессивного лечения проведено комплексное клинико-психопатологическое и генетическое исследование переносимости терапии антидепрессантами разных классов у 103 больных. При сравнительном анализе для антидепрессантов класса селективных ингибиторов обратного захвата серотонина (СИОЗС) выявлена статистически значимая взаимосвязь полиморфизма 5-HTTLPR с переносимостью терапии – большая частота и выраженность побочных эффектов при генотипе SS по сравнению с генотипами LL и LS. Для полиморфного маркера STin2 получена ассоциация большей частоты и тяжести побочных эффектов при терапии СИОЗС у больных с генотипом LL по сравнению с генотипами SS и SL. Таким образом, проведенное исследование выявило взаимосвязь полиморфизмов 5-HTTLPR и STin2 белка-переносчика серотонина с переносимостью СИОЗС. Целесообразно проведение дальнейших исследований с включением большего числа больных и увеличением количества изучаемых генетических маркеров.
Ключевые слова: фармакогенетика, генотипирование, полиморфизм, 5-HTTLPR, STin2, 3’-VNTR, обратный захвата серотонина, обратный захват дофамина, антидепрессанты, переносимость, побочные эффекты.
С целью определения взаимосвязи генетических полиморфизмов белков-переносчиков серотонина и дофамина с переносимостью антидепрессивного лечения проведено комплексное клинико-психопатологическое и генетическое исследование переносимости терапии антидепрессантами разных классов у 103 больных. При сравнительном анализе для антидепрессантов класса селективных ингибиторов обратного захвата серотонина (СИОЗС) выявлена статистически значимая взаимосвязь полиморфизма 5-HTTLPR с переносимостью терапии – большая частота и выраженность побочных эффектов при генотипе SS по сравнению с генотипами LL и LS. Для полиморфного маркера STin2 получена ассоциация большей частоты и тяжести побочных эффектов при терапии СИОЗС у больных с генотипом LL по сравнению с генотипами SS и SL. Таким образом, проведенное исследование выявило взаимосвязь полиморфизмов 5-HTTLPR и STin2 белка-переносчика серотонина с переносимостью СИОЗС. Целесообразно проведение дальнейших исследований с включением большего числа больных и увеличением количества изучаемых генетических маркеров.
Ключевые слова: фармакогенетика, генотипирование, полиморфизм, 5-HTTLPR, STin2, 3’-VNTR, обратный захвата серотонина, обратный захват дофамина, антидепрессанты, переносимость, побочные эффекты.
nivanets@mail.ru
Для цитирования: Иванец Н.Н., Кинкулькина М.А., Тихонова Ю.Г. и др. Взаимосвязь полиморфизмов генов белков-переносчиков серотонина и дофамина (SLC6A4, SLC6A3) с переносимостью антидепрессантов разных классов. Психиатрия и психофармакотерапия. 2015; 17(3): 13–21.
Association of serotonin and dopamine transporters genes (SLC6A4, SLC6A3) polymorphisms with tolerance of different classes of antidepressants
N.N.Ivanets1, М.А.Kinkulkina1, Yu.G.Tikhonova1, T.I.Avdeeva1, А.А.Ragimov1, N.G.Dashkova1, О.Е.Kuznetsov1, А.V.Matveev1, Т.А.Izyumina1, Т.N.Maximova1, S.V.Orlov2, А.V.Lukyanova1
1I.M.Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation. 119991, Russian Federation, Moscow, ul. Trubetskaia, d. 8, str. 2;
2Research Center of Neurology of the Russian Academy of Sciences. 125367, Russian Federation, Moscow, Volokolamskoe sh., d. 80
The aim of this study was to examine the association between polymorphisms in the serotonin and dopamine transporters genes and tolerance of different classes of antidepressants. The clinical trial and genotyping conducted in 103 patients with depressive disorders. Comparative analysis revealed a statistically significant correlation between polymorphism 5-HTTLPR and tolerance of SSRIs – higher frequency and severity of side effects with SS genotype compared with LL and SL genotypes. The study found association between polymorphism STin2 and SSRIs tolerance – most frequency and severity of side effects with genotype LL, compared with SS and SL. It is advisable to conduct further research to include a larger number of patients and an increase in the number of genetic markers studied.
Key words: pharmacogenetics, genotyping, genetic polymorphisms, 5-HTTLPR, STin2, 3’-VNTR, serotonin transporter, dopamine transporter, antidepressants, tolerability, side effects.
nivanets@mail.ru
For citation: Ivanets N.N., Kinkulkina М.А., Tikhonova Yu.G. et al. Association of serotonin and dopamine transporters genes (SLC6A4, SLC6A3) polymorphisms with tolerance of different classes of antidepressants. Psychiatry and psychopharmacotherapy. 2015; 17(3): 13–21.
При прогнозировании эффекта антидепрессивной терапии актуальна оценка не только эффективности препарата, но и его переносимости. Учитывая необходимость длительного приема антидепрессантов как на купирующем, так и на противорецидивном этапах, важно минимизировать число нежелательных лекарственных реакций (НЛР) для сохранения приверженности пациента терапии и повышения в итоге эффективности лечения депрессии. В процессе подбора терапии, принимая во внимание отсроченный тимоаналептический эффект антидепрессантов, наряду с анализом предикторов эффективности лечения необходимо учитывать факторы, обусловливающие плохую переносимость того или иного препарата. В реальной клинической практике врачи прогнозируют вероятность развития побочных эффектов, оценивая отягощенность больного соматической и сопутствующей психической патологией, антропометрические показатели, возраст больного, анамнестические сведения о наследственной переносимости. Распространение методов молекулярной медицины и внедрение их в клинические исследования доказали генетическую детерминацию развития НЛР, что привело к необходимости поиска генетических предикторов переносимости терапии, в том числе антидепрессивной.
При изучении связи генетических дефектов с риском развития побочных эффектов антидепрессантов преимущественное внимание уделяется белкам, участвующим в процессах биотрансформации лекарственных препаратов (система цитохрома Р-450), и транспортному белку Р-гликопротеину [1]. Фармакогенетические исследования изоферментов CYP2D6, CYP2C19 показали взаимосвязь низкой переносимости антидепрессантов с носительством мутантных аллелей; дупликация функциональных аллелей приводит к ускорению метаболизма лекарственного вещества и снижению его эффективности [1]. Полиморфизмы в гене MDR1, кодирующем Р-гликопротеин, влияют на биодоступность таких антидепрессантов, как амитриптилин, циталопрам, имипрамин, доксепин, флуоксетин, флувоксамин, нортриптилин, пароксетин, венлафаксин [2]. В России проводились исследования CYP2D6 – выявлен достоверно более высокий риск развития побочных эффектов при применении амитриптилина у носителей генотипов CYP2D6*1/*4 и CYP2D6*4/*4 [3, 4] – и Р-гликопротеина – показано влияние генотипа С3435ТТ на число НЛР [5].
Оценка значимости генетических изменений, модулирующих процессы формирования непосредственно антидепрессивного ответа, достаточно сложна вследствие многоплановости механизмов действия антидепрессантов, большого числа участвующих в реализации антидепрессивного ответа белков и их генетических альтераций. Наиболее значимые результаты получены при изучении белка-переносчика серотонина. Доказано влияние полиморфизма 5-HTTLPR на эффективность антидепрессивной терапии [6, 7]. Предполагается также, что полиморфизм 5-HTTLPR ассоциирован с переносимостью антидепрессантов. Исследование K.Smits и соавт. (2007 г.) выявило, что пациенты с генотипами SS и LS при применении селективных ингибиторов обратного захвата серотонина (СИОЗС) имеют более высокий риск развития побочных эффектов (особенно кожных реакций, повышения массы тела и астении) по сравнению с LL-генотипом [8]. В работе R.Perlis и соавт. (2003 г.) у носителей SS-генотипа чаще развивалась бессонница и усиливалась тревога при применении флуоксетина [9], а в работе A.Ferreira и соавт. (2009 г.) S-аллель ассоциировался с риском инверсии фазы [10]. В другом исследовании получены значимые результаты, что пожилые пациенты – носители S-аллеля – лучше переносят миртазапин по сравнению с пароксетином [11]. J.Popp и соавт. (2007 г.) выявили, что при применении СИОЗС пациенты с SS-генотипом чаще страдают от побочных эффектов, чем лица с генотипами LS и LL [12]. Противоположные результаты показало исследование депрессии, развивающейся после перенесенной черепно-мозговой травмы, – выявлен больший риск развития побочных эффектов при применении циталопрама у носителей LS-генотипа по сравнению с SS-генотипом [13]. Однако в последних работах, в том числе крупном исследовании GENDEP (Genome-Based Therapeutic Drugs for Depression), не выявлена взаимосвязь 5-HTTLPR-полиморфизма с переносимостью антидепрессивной терапии [14, 15].
Для другого полиморфизма белка-переносчика серотонина STin2 получено лишь несколько значимых результатов влияния на переносимость антидепрессантов. J.Popp и соавт. (2007 г.) показали, что при применении трициклических антидепрессантов (ТЦА) и СИОЗС риск развития побочных эффектов значительно выше у гомозиготных носителей коротких аллелей (52,6%), чем у гетерозиготных носителей (12,5%) или гомозиготных носителей аллелей с 12 повторами (0%); р=0,004 [12]. Для миртазапина значимой связи в том же исследовании выявлено не было. В работе K.Smits и соавт. (2008 г.) не получено достоверной взаимосвязи полиморфизма STin2 и переносимости СИОЗС [16].
Что касается полиморфизма 3’-VNTR (40bp-VNTR) белка-переносчика дофамина, то для него не описаны результаты сравнения разных его генотипов с переносимостью антидепрессантов, но выявленная в некоторых исследованиях ассоциация с эффективностью антидепрессивной терапии [17, 18] не позволяет исключить его из числа предполагаемых генетических маркеров развития побочных эффектов.
Цель настоящей работы – на основе комплексного клинико-генетического исследования больных депрессией определить взаимосвязь генетических полиморфизмов белков-переносчиков серотонина (5-HTTLPR, STin2) и дофамина (3’-VNTR) с переносимостью антидепрессивного лечения; выявить генетические маркеры – предикторы развития побочных эффектов при фармакотерапии депрессивных расстройств.
Материал и методы

Проведено проспективное наблюдательное исследование больных депрессией, проходивших стационарное и амбулаторное лечение в Клинике психиатрии им. С.С.Корсакова УКБ №3 ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова» и в научно-консультативном отделении ФГБНУ «Научный центр неврологии» в 2013–2014 гг. В исследование включались больные с депрессивными расстройствами, получавшие терапию антидепрессантами разных классов. В исследование не включались больные с шизофренией, острыми галлюцинаторно-бредовыми психозами, наркоманией и алкоголизмом, деменцией, острой соматической и неврологической патологией. Антидепрессанты применялись в качестве единственного антидепрессивного препарата (монотерапия), при необходимости (для купирования тревоги, бессонницы) допускалось кратковременное назначение препаратов других клинико-фармакологических групп – нейролептиков в малых дозах, транквилизаторов, снотворных. При смене антидепрессанта в срок до 12 нед терапии, добавлении другого антидепрессанта больной исключался из исследования.
Для оценки состояния пациентов использовался клинико-психопатологический метод; применялись стандартизированные психометрические шкалы: шкала оценки депрессии Монтгомери–Асберга (MADRS), шкала оценки тревоги Гамильтона (HARS), госпитальная шкала депрессии и тревоги (HADS), шкала общего клинического впечатления (CGI), краткая шкала оценки психического статуса (MMSE). Всем больным проводилась оценка соматического состояния по стандартной программе лабораторной и инструментальной диагностики для больных депрессиями.
Проводилась оценка переносимости психофармакотерапии депрессивных расстройств антидепрессантами разных классов. Состояние каждого больного оценивалось до начала и при проведении психофармакотерапии еженедельно клинически и с применением стандартизированных психометрических шкал. Длительность наблюдения составляла не менее 12 нед. НЛР регистрировались с помощью шкалы оценки побочных эффектов терапии (UKU).
Генетические исследования. Проводился забор двух видов генетического материала: соскоб буккального эпителия, цельная кровь. На I этапе работы проводилось выделение геномной ДНК от пациентов с помощью наборов реагентов QIAamp DNA Mini Kit из буккального тампона и Arrow Blood DNA 500 – из цельной крови (на станции NorDiag Arrow). Постановка полимеразной цепной реакции проводилась на приборе Veriti Dx 96-Well Thermal Cycler согласно протоколам производителя компонентов реакционной смеси (мастер-микса, праймеров) с учетом их корректировки для получения достоверных и последовательных результатов (в том числе с дальнейшим проведением горизонтального электрофореза для визуализации продуктов). Праймеры были подобраны с помощью программы Primer-BLAST (табл. 1). Детекция продуктов реакции амплификации проводилась на генетическом анализаторе Applied Biosystems 3500xL. Результаты анализировались с помощью специализированного программного обеспечения для фрагментного анализа GeneMapper 5.0.
Статистический анализ. Математическая обработка данных проводилась с помощью соответствующих методов статистического анализа: описательная статистика; сравнение выборок с помощью методов непараметрической статистики (критерии Манна–Уитни, Краскела– Уоллиса; критерий c2 с поправкой Йетса и критерий Фишера для качественных и бинарных признаков); определение связи количественных признаков с помощью коэффициента корреляции r Спирмана, g (гамма-корреляция) и t (тау Кендалла).
Результаты и обсуждение


Клинико-психопатологическое обследование
В соответствии с критериями отбора в исследование были включены 106 пациентов. В течение 12 нед терапии из исследования были исключены 3 больных: 2 пациента – вследствие недостаточной эффективности и отмены антидепрессанта, 1 больной не явился на очередной визит. Таким образом, в окончательный анализ вошли 103 пациента.
Для лечения депрессий применялись антидепрессанты, разные по механизму действия: СИОЗС – 38 пациентов, ТЦА – 46, норадренергические и специфические серотонинергические антидепрессанты (НССА) – 19 больных. Выбор антидепрессанта проводился в соответствии с синдромальной структурой депрессии, соматическим состоянием больного, возрастом, индивидуальной переносимостью. Доза подбиралась индивидуально в зависимости от особенностей психического состояния больного и переносимости.
Применялись антидепрессанты:
• амитриптилин (62,5–200 мг/сут; средняя суточная доза – 100±43,8 мг);
• кломипрамин – (50–250 мг/сут; средняя суточная доза – 100±79,1 мг);
• пипофезин – (50–225 мг/сут; средняя суточная доза – 105,6±53,9 мг);
• миртазапин (30–60 мг/сут; средняя суточная доза – 36±17,9 мг);
• миансерин (30–60 мг/сут; средняя суточная доза – 37,5±16,3 мг);
• пароксетин (10–40 мг/сут; средняя суточная доза – 25,4±35,4 мг);
• флувоксамин (50–300 мг/сут; средняя суточная доза – 145,8±62 мг);
• флуоксетин (20–40 мг/сут; средняя суточная доза – 33,3±11,5 мг);
• циталопрам (10–20 мг/сут; средняя суточная доза – 15±7,1 мг);
• эсциталопрам (10 мг/сут);
• сертралин (50–100 мг/сут; средняя суточная доза – 90±22,4 мг).
Так как группы больных, получавших антидепрессанты разных классов, не были рандомизированы, проводилась оценка их сопоставимости (табл. 2). Было выявлено несколько отличий: большие значения индекса массы тела (ИМТ) в группе ТЦА (р=0,01, критерий Краскела–Уоллиса); большая длительность последней ремиссии в группе ТЦА (р=0,03, критерий Краскела–Уоллиса). По другим социодемографическим (пол, возраст, трудовой и семейный статус, национальность) и клинико-анамнестическим показателям (наследственная отягощенность по соматической и психической патологии, сопутствующая соматическая и неврологическая патология, тип течения аффективных расстройств, частота возникновения и длительность аффективных фаз) группы значимо не отличались.
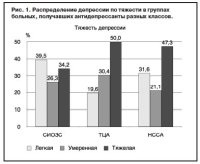
Клиническая картина текущей аффективной психопатологической симптоматики также существенно не отличалась в трех группах. Тяжесть депрессии до начала терапии в группе СИОЗС была несколько меньше, чем в группах ТЦА и НССА, – чаще наблюдались легкие формы (39,5% по сравнению с 19,6 и 31,6% соответственно), реже – тяжелые депрессии (34,2% по сравнению с 50 и 47,3% соответственно); рис. 1. Не было выявлено статистически значимых отличий в группах больных, получавших различную терапию, при сравнении средних значений выраженности симптоматики при оценке по шкале MADRS (СИОЗС – 27,3, ТЦА – 30,0, НССА – 29,3). При субъективной оценке по шкале HADS тяжесть депрессии в трех группах также отличалась незначительно (СИОЗС – 10,8, ТЦА – 11,3, НССА – 11,2).


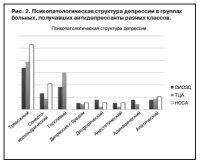
Не было выявлено статистически значимых отличий при анализе психопатологической структуры депрессии в группах, получавших разные антидепрессанты (рис. 2). Во всех группах преобладали тревожные депрессии (СИОЗС – 34,1%, ТЦА – 39,2%, НССА – 52,6%). Тоскливая депрессия была диагностирована приблизительно у 1/3 пациентов, получавших ТЦА, и у 18,4%, получавших СИОЗС. В группе НССА пациенты не выявляли меланхолической симптоматики, но чаще высказывали соматические жалобы с ипохондрической фиксацией на своих переживаниях (21,1%). Другие депрессивные синдромы (апато-адинамический, дисфорический, анестетический, депрессия с бредом, конгруэнтным аффекту) встречались с частотой от 2,2 до 10,5% без достоверных отличий при сравнении трех групп.
Генотипирование

При анализе генетической структуры больных по 5-HTTLPR, STin2 и 3’-VNTR (табл. 3) выявлено распределение генотипов, характерное для европеоидной популяции. По данным литературы, распространенность носительства S-аллеля полиморфизма 5-HTTLPR среди представителей европеоидной расы составляет 0,42; частота S-аллеля полиморфизма STin2 – 0,41 [19]; частота короткого аллеля полиморфизма 3’-VNTR – 0,21–0,29 [20]. Таким образом, представленная выборка была репрезентативна по основному изучаемому параметру – частотам генотипов и аллелей. Распределение генотипов по изучаемым маркерам в трех группах больных, получавших разные классы антидепрессантов, достоверно не отличалось (табл. 4).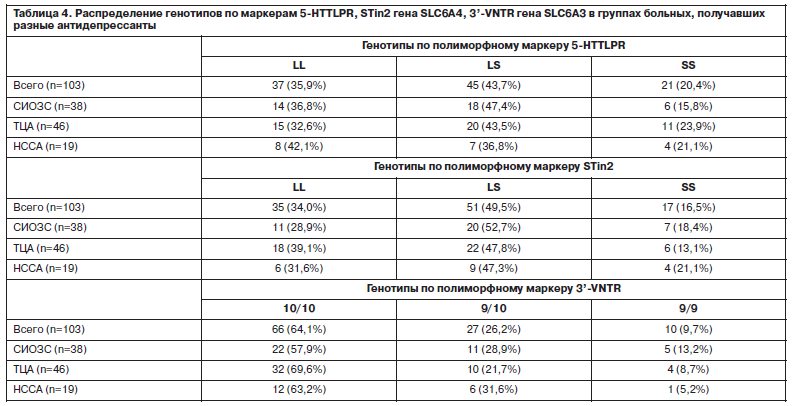

Переносимость антидепрессивной терапии

При оценке переносимости антидепрессивной терапии учитывались частота возникновения и характер побочных эффектов. Учитывались все НЛР, выявленные при целенаправленном расспросе или сообщенные пациентами самостоятельно. НЛР регистрировались еженедельно с помощью структурированной шкалы побочных эффектов UKU.
После начала антидепрессивной терапии на появление НЛР пожаловались 66 (64,1%) пациентов. Чаще всего побочные эффекты наблюдались при применении антидепрессантов групп ТЦА (73,9%) и НССА (78,9%). В группе СИОЗС побочные эффекты отмечались статистически значимо реже – 44,7% (c2; р=0,01); рис. 3. В табл. 5 представлено общее число наблюдаемых побочных эффектов с указанием наиболее часто встречаемых.
Больные, получавшие СИОЗС, чаще всего жаловались на тошноту/рвоту (15,8%), усиление или появление тревоги и бессонницы (13,1%). Применение ТЦА сопровождалось сухостью во рту (43,3%), запорами (23,9%), сонливостью/седацией (23,9%), тремором (17,4%). При использовании миртазапина и миансерина чаще всего наблюдались сонливость/седация (42,1%), ксеростомия (26,3%), запоры (21,1%), тошнота/рвота (15,8%), головная боль (15,8%).
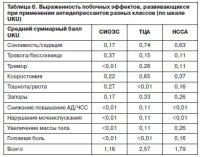
При оценке выраженности НЛР по шкале UKU выявлена наибольшая тяжесть побочных эффектов в группе ТЦА (средний суммарный балл по шкале UKU – 2,57) и наименьшая – в группе СИОЗС (1,16); табл. 6. Максимальные значения среднего балла UKU зарегистрированы в группе ТЦА – сонливость/седация (0,74) и ксеростомия (0,65). Из других значимых побочных эффектов, встречаемых в группе ТЦА, отметим запоры (0,33) и тремор (0,26). Таким образом, сонливость/седация, ксеростомия, запоры и тремор наблюдались при применении ТЦА наиболее часто и в наибольшей степени выраженности.

В группе СИОЗС побочные эффекты были наиболее легкими. Наибольшее страдание пациентам доставляло усиление или появление после начала терапии тревоги и нарушений сна (0,37). В меньшей степени больных беспокоили тошнота/рвота (0,27) и сухость во рту (0,22).
При применении миртазапина и миансерина чаще и с большей интенсивностью наблюдались сонливость/седация (0,63). Стоит отметить, что большинство больных расценивали это седативное действие как благоприятное, так как в структуре депрессивных переживаний были ярко выражены симптомы тревоги и бессонницы. В большей степени, чем в других группах (сравнение статистически незначимо), больные, получавшие миртазапин и миансерин, жаловались на увеличение массы тела (0,26) и головную боль (0,16).
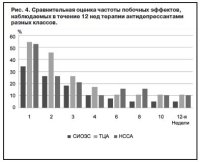
Оценка переносимости антидепрессантов на протяжении 12 нед терапии показала, что наибольшее число НЛР наблюдалось на 1–2-й неделе терапии. К 4-й неделе побочные эффекты антидепрессантов уменьшались и до 12-й недели терапии сохранялись лишь у небольшого процента больных: СИОЗС – 5,2%, ТЦА – 10,9%, НССА – 10,5% (рис. 4).

Для установления факторов, влияющих на возникновение НЛР и их выраженность, была проведена сравнительная оценка взаимосвязи разных признаков, включая: анамнестические данные (социально-демографические, соматический, психиатрический анамнез); характеристики заболевания (длительность аффективного расстройства, возраст дебюта, тип течения, частота возникновения и длительность аффективных фаз); состояние до начала психофармакотерапии и динамика на фоне лечения депрессии (с учетом психометрической оценки по шкале депрессии); особенности лечения (фармакопрепараты и их дозировки); генетические маркеры (полиморфизмы 5-HTTLPR, STin2, 3’-VNTR). Как было отмечено раньше, значимо чаще (р=0,01) побочные эффекты наблюдались в группе больных, получающих ТЦА и НССА, по сравнению с СИОЗС (см. рис. 3). Учитывая это, поиск предикторов переносимости проводился отдельно для антидепрессантов разных классов.
На частоту развития побочных эффектов при применении СИОЗС влияет тип течения аффективного заболевания (c2; р=0,02); рис. 5. Сравнительный анализ выявил тенденцию к уменьшению частоты НЛР в ряду: хроническое течение > биполярное течение > рекуррентное течение > первый депрессивный эпизод. При этом на переносимость терапии не влияли другие характеристики аффективного заболевания (длительность, возраст начала, число фаз, длительность ремиссий, тяжесть настоящей депрессии). Не выявлено значимых ассоциаций переносимости терапии с показателями ИМТ, полом, возрастом, сопутствующей соматической патологией, дозировками препаратов.
При анализе взаимосвязи частоты побочных эффектов и генетических вариантов выявлено, что больные с генотипом SS по маркеру 5-HTTLPR хуже переносят терапию препаратами класса СИОЗС по сравнению с генотипами LL и LS (точный критерий Фишера; р=0,02); рис. 6. Схожая значимая ассоциация выявлена при сравнении выраженности НЛР с генотипами по маркеру 5-HTTLPR (критерий Манна–Уитни; р=0,005); см. рис. 6. Для полиморфного маркера STin2 получена взаимосвязь большей частоты (c2; р=0,03) и тяжести (критерий Манна–Уитни; р=0,02) побочных эффектов с генотипом LL (рис. 7).


В группе ТЦА установлены следующие факторы, влияющие на вероятность развития НЛР: ИМТ, возраст, тип течения аффективного заболевания. Значения ИМТ были ассоциированы с риском развития побочных эффектов при применении ТЦА (критерий Манна–Уитни; р=0,01); рис. 8, но не коррелировали с выраженностью НЛР. Выявлено, что вероятность развития побочных эффектов повышается с возрастом; показатели сравнения приближались, но не достигали уровня статистической значимости (критерий Манна–Уитни; р=0,08); рис. 9. Достоверно реже НЛР развивались у больных с впервые возникшей депрессией (c2; р=0,04) (рис. 10). Взаимосвязи развития побочных эффектов при применении ТЦА с анализируемыми генетическими маркерами не обнаружено.
При внутригрупповом сравнительном анализе переносимости терапии миртазапином и миансерином достоверных ассоциаций с какими-либо клинико-анамнестическими, демографическими или генетическими характеристиками не получено.

Таким образом, было установлено, что при терапии антидепрессантами класса СИОЗС прогностическую значимость в определении риска развития побочных эффектов имеют генетические изменения белка-переносчика серотонина. Полиморфизм 5-HTTLPR, известный своим влиянием на антидепрессивный ответ, изучается и как предполагаемый предиктор переносимости антидепрессантов. Результаты 5 исследований выявили взаимосвязь 5-HTTLPR и вероятности развития НЛР [8–12]; другие 2 исследования – нет [14, 15]. Метаанализа исследований, изучавших данную взаимосвязь, не проводилось. Полученные нами данные о худшей переносимости СИОЗС носителями генотипа 5-HTTLPR SS по сравнению с генотипами LL и LS согласуются с результатами многих зарубежных исследований [8–12].
S-аллель снижает транскрипционную активность гена SLC6A4 и экспрессию белка-переносчика серотонина, таким образом угнетая процесс обратного захвата медиатора, являющегося основной мишенью СИОЗС. Можно предположить, что в условиях снижения концентрации основного субстрата лекарственных веществ активизируются дополнительные механизмы действия: взаимодействие с холинорецепторами, серотониновыми рецепторами и пр., что и обусловливает развитие побочных эффектов. Учитывая данные исследований об ассоциированной с S-аллелем низкой эффективности СИОЗС [1, 6, 7], можно утверждать, что применение антидепрессантов данного класса у носителей SS-генотипа не только малоэффективно, но и небезопасно, и рекомендовать в таких ситуациях использование препаратов с иным механизмом действия.

В нашем исследовании для СИОЗС не выявлены другие предикторы переносимости терапии, кроме генетических, и такого признака, как тип течения аффективного заболевания. Для проверки прогностической значимости данных факторов необходимо проведение дальнейших исследований на большей выборке больных. В перспективе полученные результаты могут служить основанием для разработки и внедрения в психиатрическую практику методов фармакогенетического тестирования.
Что касается полиморфизма STin2, то в литературе представлено крайне мало данных о возможной взаимосвязи с переносимостью антидепрессивной терапии [12, 16]. В нашем исследовании выявлена статистически значимая взаимосвязь большей частоты и тяжести побочных эффектов с генотипом LL. Учитывая полученные результаты, целесообразно продолжение изучения данного полиморфизма и включение его в дальнейшие исследования.


При терапии антидепрессантами класса ТЦА не было выявлено статистически значимых ассоциаций переносимости терапии с анализируемыми генетическими признаками. Здесь прогностическую значимость проявили такие показатели, как масса тела, возраст, тип течения заболевания. Поиск генетических маркеров для данного класса антидепрессантов более сложен, чем для СИОЗС, из-за неизбирательности их действия, и при продолжении фармакогенетических исследований целесообразно включение большего круга маркеров (в том числе транспортер норадреналина, адренорецепторы).
Сведения об авторах
Иванец Николай Николаевич – д-р мед. наук, проф., чл.-кор. РАН, засл. деят. науки РФ, зав. каф. психиатрии и наркологии, дир. НОКЦ Психическое здоровье ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: nivanets@mail.ru
Кинкулькина Марина Аркадьевна – д-р мед. наук, проф. каф. психиатрии и наркологии, зам. дир. по научной и инновационной деятельности НОКЦ Психическое здоровье ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: kinkulkina@gmail.com
Тихонова Юлия Гулямовна – канд. мед. наук, ассистент каф. психиатрии и наркологии, вед. науч. сотр. НИО Психического здоровья НОКЦ Психическое здоровье ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: j.tyhonova@gmail.com
Авдеева Татьяна Ивановна – д-р мед. наук, доц. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: t.i.avdeeva@gmail.com
Рагимов Алигейдар Агаалекпер-оглы – д-р мед. наук, проф., зав. каф. клин. трансфузиологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: ra50@mail.ru
Дашкова Наталья Георгиевна – д-р мед. наук, доц., зав. клинико-диагностической лаб. Центра крови ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: dn35@rambler.ru
Кузнецов Олег Евгеньевич – канд. мед. наук, доц. каф. клин. трансфузиологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: kuznoe@gmail.com
Матвеев Александр Викторович – врач клинико-диагностической лаб. Центра крови ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: doktormatveev@gmail.com
Изюмина Татьяна Анатольевна – канд. мед. наук, ст. науч. сотр. НИО Психического здоровья НОКЦ Психическое здоровье ГБОУ ВПО Первый МГМУ им. И.М.Сеченова
Максимова Татьяна Николаевна – канд. мед. наук, доц. каф. психиатрии и наркологии, вед. науч. сотр. НИО Психического здоровья НОКЦ Психическое здоровье ГБОУ ВПО Первый МГМУ им. И.М.Сеченова
Орлов Сергей Валерьевич – канд. мед. наук, зам. глав. врача ФГБУН Научный центр неврологии РАН. E-mail: orlov@neurology.ru
Лукьянова Алена Васильевна – аспирант каф. психиатрии и наркологии, лаборант-исследователь НИО Психического здоровья НОКЦ Психическое здоровье ГБОУ ВПО Первый МГМУ им. И.М.Сеченова
Список исп. литературыСкрыть список1. Porcelli S, Drago A, Fabbri C et al. Pharmacogenetics of antidepressant response. J Psychiatry Neurosci 2011; 36 (2): 87–113.
2. O'Brien FE, Dinan TG, Griffin BT, Cryan JF. Interactions between antidepressants and P-glycoprotein at the blood-brain barrier: clinical significance of in vitro and in vivo findings. Br J Pharmacol 2012; 165 (2): 289–312.
3. Савельева М.И., Сычев Д.А., Казаков Р.Е. и др. Значение генетического полиморфизма изоферментов цитохрома Р450 для персонализированного выбора и режимов дозирования антидепрессантов и антипсихотиков. Клин. медицина. 2008; 86 (11): 22–8. / Savel'eva M.I., Sychev D.A., Kazakov R.E. i dr. Znachenie geneticheskogo polimorfizma izofermentov tsitokhroma R450 dlia personalizirovannogo vybora i rezhimov dozirovaniia antidepressantov i antipsikhotikov. Klin. meditsina. 2008; 86 (11): 22–8. [in Russian]
4. Кукес В.Г., Иванец Н.Н., Сычев Д.А. и др. Влияние генетического полиморфизма CYP2D6 и MDR1 на эффективность и безопасность терапии антидепрессантами у пациентов с депрессивными расстройствами в условиях психиатрического стационара. Психиатрия и психофармакотерапия. 2013; 15 (5): 11–5. / Kukes V.G., Ivanets N.N., Sychev D.A. i dr. Vliianie geneticheskogo polimorfizma CYP2D6 i MDR1 na effektivnost' i bezopasnost' terapii antidepressantami u patsientov s depressivnymi rasstroistvami v usloviiakh psikhiatricheskogo statsionara. Psikhiatriia i psikhofarmakoterapiia. 2013; 15 (5): 11–5. [in Russian]
5. Ташенова А.И., Исмагилов Т.Г., Савельева М.И., Кукес В.Г. Влияние полиморфизма гена MDR1, кодирующего Р-гликопротеин, на развитие неблагоприятных побочных реакций при применении антидепрессантов в условиях стационара психиатрического профиля. Биомедицина. 2010; 1 (4): 46–50. / Tashenova A.I., Ismagilov T.G., Savel'eva M.I., Kukes V.G. Vliianie polimorfizma gena MDR1, kodiruiushchego R-glikoprotein, na razvitie neblagopriiatnykh pobochnykh reaktsii pri primenenii antidepressantov v usloviiakh statsionara psikhiatricheskogo profilia. Biomeditsina. 2010; 1 (4): 46–50. [in Russian]
6. Serretti A, Kato M, De Ronchi D et al. Meta-analysis of serotonin transporter gene promoter polymorphism (5-HTTLPR) association with selective serotonin reuptake inhibitor efficacy in depressed patients. Mol Psychiatry 2007; 12: 247–57.
7. Porcelli S, Fabbri C, Serretti A. Meta-analysis of serotonin transporter gene promoter polymorphism (5-HTTLPR) association with antidepressant efficacy. Eur Neuropsychopharmacol 2012; 22 (4): 239–58.
8. Smits K, Smits L, Peeters F et al. Serotonin transporter polymorphisms and the occurrence of adverse events during treatment with selective serotonin reuptake inhibitors. Int Clin Psychopharmacol 2007; 22 (3): 137–43.
9. Perlis RH, Mischoulon D, Smoller JW et al. Serotonin transporter polymorphisms and adverse effects with fluoxetine treatment. Biol Psychiatry 2003; 54 (9): 879–83.
10. Ferreira Ade A, Neves FS, da Rocha FF et al. The role of 5-HTTLPR polymorphism in antidepressant-associated mania in bipolar disorder. J Affect Disord 2009; 112 (1–3): 267–72.
11. Jr Murphy GM, Hollander SB, Rodrigues HE et al. Effects of the serotonin transporter gene promoter polymorphism on mirtazapine and paroxetine efficacy and adverse events in geriatric major depression. Arch Gen Psychiatry 2004; 61 (11): 1163–9.
12. Popp J, Leucht S, Heres S, Steimer W. Serotonin transporter polymorphisms and side effects in antidepressant therapy – a pilot study. Pharmacogenomics 2006; 7 (2): 159–66.
13. Lanctot KL, Rapoport MJ, Chan F et al. Genetic predictors of response to treatment with citalopram in depression secondary to traumatic brain injury. Brain Inj 2010; 24 (7–8): 959–69.
14. Hodgson K, Uher R, Crawford AA et al. Genetic predictors of antidepressant side effects: a grouped candidate gene approach in the Genome-Based Therapeutic Drugs for Depression (GENDEP) study.
J Psychopharmacol 2014; 28 (2): 142–50.
15. Ng C, Sarris J, Singh A et al. Pharmacogenetic polymorphisms and response to escitalopram and venlafaxine over 8 weeks in major depression. Hum Psychopharmacol 2013; 28 (5): 516–22.
16. Smits KM, Smits LJ, Peeters FP et al. The influence of 5-HTTLPR and STin2 polymorphisms in the serotonin transporter gene on treatment effect of selective serotonin reuptake inhibitors in depressive patients. Psychiatr Genet 2008; 11: 184–90.
17. Kirchheiner J, Nickchen K, Sasse J et al. A 40-basepair VNTR polymorphism in the dopamine transporter (DAT1) gene and the rapid response to antidepressant treatment. Pharmacogenomics 2007; 7 (1): 48–55.
18. Lavretsky H, Siddarth P, Kumar A, Reynolds CF 3rd. The effects of dopamine and serotonin transporter polymorphisms on clinical features and treatment response in geriatric depression: a pilot study. Int J Geriatr 2008; 23 (1): 55–9.
19. Kunugi H, Hattori M, Kato T et al. Serotonin transporter gene polymorphisms: ethnic difference and possible association with bipolar affective disorder. Mol Psychiatry 1997; 2: 457–62.
20. Kang AM, Palmatier MA, Kidd KK. Global Variation of a 40-bp VNTR in the 3’-Untranslated Region of the Dopamine Transporter Gene (SLC6A3). Biol Psychiatry 1999; 46: 151–60.
17 сентября 2015
Количество просмотров: 4403


