Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина


Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05-06 2015
Сравнительная оценка эффективности Вальдоксана (агомелатина), флуоксетина и комбинации флуоксетина с мелаксеном у пациентов с проявлениями соматогенной депрессии с помощью фармакоэлектроэнцефалографии №05-06 2015
Номера страниц в выпуске:13-19
С целью сравнительной оценки эффективности фармакотерапии соматогенного депрессивного расстройства у пациентов с гастроэнтерологической патологией были обследованы 45 человек. Их разделили на 3 клинические группы, в которые в схему базисной терапии основного соматического заболевания были включены современные антидепрессанты: Вальдоксан, флуоксетин и комбинация флуоксетина с мелаксеном. Установлено, что по окончании 6-недельного наблюдения наиболее выраженная положительная динамика редукции депрессивной симптоматики наблюдалась на фоне приема Вальдоксана и комбинации флуоксетина с мелаксеном, что подтверждалось не только уменьшением количества баллов по шкале депрессии Гамильтона (HDRS-17), но и нормализацией распределения ритмов электроэнцефалограммы головного мозга у пациентов.
Ключевые слова: депрессия, шкала HDRS-17, Вальдоксан, флуоксетин, мелаксен, электроэнцефалография.
С целью сравнительной оценки эффективности фармакотерапии соматогенного депрессивного расстройства у пациентов с гастроэнтерологической патологией были обследованы 45 человек. Их разделили на 3 клинические группы, в которые в схему базисной терапии основного соматического заболевания были включены современные антидепрессанты: Вальдоксан, флуоксетин и комбинация флуоксетина с мелаксеном. Установлено, что по окончании 6-недельного наблюдения наиболее выраженная положительная динамика редукции депрессивной симптоматики наблюдалась на фоне приема Вальдоксана и комбинации флуоксетина с мелаксеном, что подтверждалось не только уменьшением количества баллов по шкале депрессии Гамильтона (HDRS-17), но и нормализацией распределения ритмов электроэнцефалограммы головного мозга у пациентов.
Ключевые слова: депрессия, шкала HDRS-17, Вальдоксан, флуоксетин, мелаксен, электроэнцефалография.
zaika1947@qip.ru
Для цитирования: Заика В.Г., Куделина О.М. Сравнительная оценка эффективности Вальдоксана (агомелатина), флуоксетина и комбинации флуоксетина с мелаксеном у пациентов с проявлениями соматогенной депрессии с помощью фармакоэлектроэнцефалографии. Психиатрия и психофармакотерапия. 2015; 17 (5–6): 13–19.
Comparative evaluation of the effectiveness of Valdoksan (agomelatin), fluoxetine and fluoxetine with melaksen combination in patients with somatogenic depression оn the base of pharmako-EEG
V.G.Zaika, O.M.Kudelina
Rostov State Medical University. 344022, Russian Federation, Rostov-on-Don, per. Nakhichevanskii, d. 29
With the purpose of comparative estimation of pharmacotherapy's efficiency of the somatogenic moderate severity depressive disorder in patients with gastroenterological pathology 45 patients were examined. They were divided into three clinical groups, which in addition to basic therapy of gastroenterological pathology treated with antidepressants: Valdoksan, fluoxetine and fluoxetine with melaksen combination. It was established that after the 6-week'scourse of treatment the greatest dynamics in reduction of depressive symptoms was observed in groups of Valdoksan and fluoxetine + melaksen that confirmed not only the reduction of amount of points on a scale HDRS-17 but also normalization of distribution of EEG-rhythms.
Key words: depression, a scale HDRS-17, Valdoksan, fluoxetine, melaksen, EEG.
zaika1947@qip.ru
For citation: Zaika V.G., Kudelina O.M. Comparative evaluation of the effectiveness of Valdoksan (agomelatin), fluoxetine and fluoxetine with melaksen combination in patients with somatogenic depression оn the base of pharmako-EEG. Psychiatry and Psychopharmacotherapy. 2015; 17 (5–6): 13–19.
Введение
Известно, что психическое здоровье человека очень тесно связано с его соматическим состоянием, поэтому необходимо учитывать тот факт, что большинство пациентов, получающих лечение в стационарах, страдают депрессиями, которые, в свою очередь, вовремя не распознаются и, соответственно, больные просто не попадают в поле зрения специалистов, а продолжают лечение по поводу основного заболевания. Именно это и определяет значимость сложившейся проблемы для каждого практикующего врача. В ряду внутренних болезней с хроническим рецидивирующим течением одно из лидирующих положений занимают заболевания желудочно-кишечного тракта (ЖКТ). Сочетание данной патологии с аффективными расстройствами способствует созданию так называемого «порочного круга», который оказывает прямое влияние на поддержание и формирование соматической патологии [9]. Кроме того, лечение депрессии в современной медицинской практике по-прежнему остается весьма актуальной проблемой [11, 25]. В настоящее время немаловажной задачей является адекватный и правильный выбор лекарственного препарата (ЛП) для осуществления фармакологической коррекции текущего нарушения психического здоровья пациента, в частности, депрессивного расстройства. На сегодняшний день к ЛП первого ряда относятся селективные ингибиторы обратного захвата серотонина [21, 26]. В отличие от традиционных трициклических антидепрессантов они имеют ряд преимуществ, а именно: более точную направленность действия, значительно лучшую переносимость, безопасность и т.д. Заподозрить у пациентов с хронической соматической патологией депрессию можно при наличии жалоб, которые они предъявляют. Пациенты жалуются на частую смену настроения, постоянное чувство усталости, снижение аппетита, чувство внутренней напряженности, тревожности, пессимистически оценивают лечение и т.д. Важно отметить, что депрессивные расстройства весьма часто сопровождаются нарушениями сна. Данный симптом может быть спровоцирован длительным хроническим стрессом (например, если он связан с постоянным болевым синдромом при патологии ЖКТ), который может привести к достаточно выраженному рассогласованию суточных ритмов. В этом случае пациенты нередко жалуются на трудности при засыпании, беспокойство в течение ночи, а также раннее пробуждение и невозможность заснуть повторно, что очень негативно отражается на их общем самочувствии.
По итогам многих исследований данной проблемы было выявлено, что достаточно часто депрессивные расстройства сопровождаются нарушением секреции эпифизарного гормона – мелатонина [1, 4, 28, 29]. Установлено, что терапия мелатонином не только положительно влияет на нормализацию сна, но и позитивно отражается на интеллектуально-мнестических функциях и психоэмоциональной сфере (отмечается снижение эмоциональной лабильности и тревожности, улучшение настроения, уменьшение чувства усталости) у исследуемых пациентов. Это дает основание полагать, что назначение ЛП, обладающих мелатониномиметическим эффектом, при лечении пациентов с депрессивными расстройствами может дать положительный результат.
До сих пор в основе патогенеза депрессии лежит классическая моноаминовая гипотеза, которая не может до конца объяснить развитие данной аффективной патологии. Поэтому становится очевидным, что все антидепрессанты, которые влияют только на моноаминовую нейротрансмиссию, являются недостаточно эффективными. Таким образом, в настоящее время существует определенная потребность в изыскании и применении более эффективных и быстрых антидепрессантов. Одним из таких ЛП нового поколения является Вальдоксан (действующее вещество – агомелатин, «Лаборатории Сервье», Франция), который принципиально отличается от других представителей этой группы своим механизмом действия, так как имеет высокий аффинитет к мелатониновым МТ1- и МТ2-рецепторам. Также показано выраженное антагонистическое воздействие препарата на 5НТ2С-рецепторы, что является основой антидепрессивного эффекта [2, 5, 6, 15, 16, 21, 23, 24, 26].
Оценка психического состояния депрессивных больных обычно проводится специалистом во время осмотра, а также при применении оценочных шкал. Помимо клинической беседы с пациентом для того, чтобы оценить результат назначенной терапии, в современной медицинской практике есть и лабораторные методы. Одним из новых методов, который используется для прогнозирования эффективности терапии депрессии, является количественная фармакоэлектроэнцефалография (КФЭЭГ) [18, 19, 31]. Она позволяет неинвазивным путем получить информацию о влиянии лекарственного вещества, поэтому в настоящее время применение ЭЭГ для предикции эффективности планируемой фармакотерапии является весьма актуальным. Это в полной мере относится и к депрессивным расстройствам, сопутствующим и осложняющим течение соматической патологии. Цель исследования – сравнить эффективность фармакотерапии Вальдоксаном, флуоксетином и комбинацией флуоксетина с мелаксеном у пациентов с соматогенным депрессивным расстройством клинически и с помощью ФЭЭГ.
Материалы и методы
В клиническое исследование по результатам психиатрического скрининга были включены 45 человек, в том числе 16 мужчин и 29 женщин. Средний возраст больных составил 39,2±5,3 года. Все они наблюдались в отделении гастроэнтерологии и эндоскопии клиники РостГМУ в период с 2011 по 2013 г. с диагнозами: хронический гепатит, хронический колит невыясненной этиологии, неспецифический язвенный колит, синдром раздраженного кишечника, хронический холецистит. Выявление коморбидного депрессивного расстройства производилось при клиническом обследовании и соответствии критериям Международной классификации болезней 10-го пересмотра (F34.1, F41.2, F43.21, F45.0), а тяжесть состояния оценивалась с помощью шкалы депрессии Гамильтона (HDRS-17). Критериями исключения являлись острые и хронические психические заболевания, высокий суицидальный риск, лекарственная и алкогольная зависимость в анамнезе, последствия черепно-мозговой травмы и другие органические заболевания мозга, эпилепсия, беременность и период лактации, декомпенсированные заболевания печени, почек и сердечно-сосудистой системы, эндокринная патология. После получения информированного согласия все пациенты были разделены на 3 клинические группы: группа Ф (n=15) – пациенты получали дополнительно к основной терапии флуоксетин в дозе 20 мг/сут однократно утром после еды; группа В (n=15) – Вальдоксан в дозе 25 мг/сут однократно за 1 ч до сна; группа ФМ (n=15) – комбинацию флуоксетина 20 мг/сут однократно утром после еды и мелаксена в дозе 3 мг/сут однократно за 1 ч до сна. До начала фармакотерапии антидепрессантами средний балл по шкале HDRS-17 во всех наблюдаемых группах соответствовал средней степени тяжести депрессивного расстройства (17–24 балла HDRS-17), составив в группе Ф 20,3±2,5 балла, В – 19,9±3,4 и ФМ – 19,3±2,06. Для больных, получавших какие-либо психотропные препараты до начала исследования, проводился 7-дневный период «отмывания» с целью исключения взаимодействия препаратов. Психотерапии не проводилось.
Группа контроля (К) состояла из 17 потенциально здоровых лиц – 10 женщин и 7 мужчин (n=17). Средний возраст наблюдаемых в этой группе составил 39,2±10,1 года (группа К). В контрольную группу Д были включены все обследуемые пациенты до начала фармакотерапии (n=45).
Завершили полностью 6-недельное исследование 40 пациентов. В группе В выбыл 1 пациент – обострение основного заболевания. В группах Ф и ФМ выбыли по 2 пациента, причинами являлись обострение основного заболевания – 3 человека, отзыв согласия – 1 пациент. В качестве критериев эффективности проводимой фармакотерапии учитывались данные шкалы HDRS-17 до проведения фармакотерапии, а также через 2, 4 и 6 нед приема ЛП. Параллельно пациентам после оценки клинического состояния проводилась регистрация биоэлектрической активности головного мозга (ГМ) до начала фармакотерапии и после окончания 6 нед наблюдения. Регистрацию ЭЭГ ГМ проводили с помощью энцефалографа-анализатора ЭЭГА-21/26 «Энцефалан 131-03» (Россия). Оценивался показатель – относительное значение мощности (ОЗМ) в процентах (%) для частотных диапазонов ЭЭГ ГМ – дельта (D), тета (θ), альфа (a) и бета (b).
Для оценки результатов использовали метод количественного анализа структуры ЭЭГ [15]. Статистическая обработка полученных данных проводилась с использованием общепринятых методов параметрической статистики (t-критерий Стьюдента) при помощи пакета статистических программ Statistica 6.0 (Statsoft, USA).
Результаты

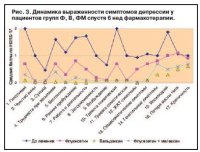
Спустя 2 нед от начала фармакотерапии Вальдоксаном средний суммарный балл в группе В уменьшился на 42,2%. Больные в этой группе все еще отмечали некоторое присутствие ощущения усталости и неспособности к деятельности. Однако самочувствие пациентов на фоне данного ЛП значительно улучшилось. В 80% случаев такие жалобы, как трудности при засыпании и бессонница в течение ночи, уменьшились, но еще беспокоили ранние пробуждения и невозможность заснуть повторно (рис. 1). На 4-й неделе лечения было отмечено наступление терапевтического эффекта, что подтверждалось не только снижением суммарного балла, в данной группе он составил 67,3%, но и общим самочувствием пациентов – они отмечали заметное ослабление гастроэнтерологических жалоб. Настроение нормализовалось, пациенты с удовольствием контактировали с исследователем, улыбались и чувствовали себя намного активнее. Более не отмечалось жалоб на раннее пробуждение, уменьшилось либо практически пропало чувство внутренней напряженности и тревоги. Мысли и ощущения усталости, неспособности к деятельности также практически не беспокоили, улучшился аппетит и отмечалась прибавка массы тела (рис. 2). Больные, принимавшие комбинацию флуоксетина с мелаксеном, отмечали улучшение, но оно было менее выраженным: по истечении 4-недельного курса приема препарата только у 56,5% больных наблюдалось стойкое улучшение общего самочувствия. Ощущения усталости и мысли о неспособности к деятельности уже практически не беспокоили, хотя все еще сохранялись жалобы на трудности при засыпании. При этом бессонницы в течение ночи, раннего пробуждения, чувства внутренней напряженности и тревоги, отсутствия аппетита и тяжести в желудке не отмечали. Пациенты в группе Ф, принимавшие один флуоксетин, на 4-й неделе наблюдения отмечали лишь частичное улучшение, респондеры составили только 42,86%. У остальных пациентов присутствовали жалобы на пониженное настроение, ощущение усталости, слабости. Сохранялись проблемы с засыпанием и ранним пробуждением, но бессонница как таковая беспокоила уже меньше, также уменьшились тревога и особая озабоченность своим здоровьем – больные сообщали об этом только при расспросе, а не спонтанно, как при первичном визите, отмечалось снижение полового влечения.

Положительная динамика балльной оценки выраженности депрессии сохранялась у больных всех обследуемых групп и в дальнейшем, в частности на 6-й неделе наблюдения. Суммарный балл в группе Ф составил 7,9±1,5 (р<0,01), на 61,1% ниже исходного уровня; в группе В – 4,1±0,3 (р<0,01), на 79,4% ниже, чем исходный средний балл; в группе ФМ – 5,4±0,9 (р<0,01), на 72% меньше, чем при 1-м визите пациентов. Прежде всего следует отметить ситуацию в группе В, где ни у одного из пациентов не усилились проявления тревоги в начале терапии и субъективно и объективно отмечалась положительная динамика соматического состояния (рис. 3). Достаточно позитивным было положение и в группе ФМ, где результат у всех пациентов по шкале HDRS был ниже 9 баллов, и все они в целом чувствовали себя хорошо. Однако при беседе у них все еще отмечались жалобы на периодические трудности с засыпанием, а также беспокоило снижение полового влечения. В группе Ф у 5 пациентов в начале терапии усилились тревожные опасения по поводу соматического заболевания, в связи с этим дополнительно в течение 2 нед назначали феназепам по 0,25 мг вечером. По сравнению с предыдущим визитом у 60% больных этой группы состояние соответствовало легкой степени тяжести депрессии (7–16 баллов) и только у 6 (40%) пациентов полученные оценки были ниже 7 баллов. У многих больных все еще сохранялась разнообразная симптоматика депрессивного расстройства: периодически появлялись мысли и ощущения неспособности к деятельности, у ряда лиц отмечалось раннее пробуждение и неспособность заснуть повторно, а также присутствовало повышенное внимание на проявления гастроэнтерологического заболевания. Таким образом, по итогам 6-недельного курса наблюдения можно сказать, что только две клинические группы (В и ФМ) пациентов достигли стойкого улучшения текущего аффективного состояния. Этого не наблюдалось у пациентов в группе Ф, которым был назначен один флуоксетин, – им все еще требовалось дальнейшее наблюдение и продолжение фармакотерапии данным препаратом. Параллельно с клиническим обследованием пациентам клинических групп, принимавших назначенные ЛП, дважды производили регистрацию ЭЭГ – перед проведением исследования и после его завершения. Изучали показатели ОЗМ ЭЭГ-ритмов и оценивали, каким образом получаемая фармакотерапия отражается на биоэлектрической активности ГМ. Для более объективной оценки полученные данные ЭЭГ сравнивались с результатами контрольных групп сравнения (группы К и Д).

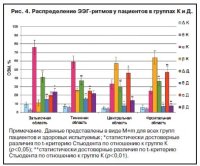
При анализе ОЗМ ЭЭГ-ритмов у пациентов с депрессивным расстройством до начала фармакотерапии мы наблюдали отличия от таковых в норме. Как известно, a-ритм у здорового человека (группа К) доминирует в затылочной области ГМ и далее убывает от затылка к фронтальным отделам [7, 8, 11], b-ритм в основном регистрируется во фронтальных отделах ГМ. Он одинаков в обоих полушариях, и его отсутствие не является признаком патологии [8], тогда как D-ритм у здорового взрослого человека в покое практически не регистрируется, но его можно наблюдать в IV стадию сна, от чего он получил название «медленноволновый», или «D-сон». Напротив, θ-ритм может регистрироваться у человека и в норме – например, при эмоциональных переживаниях, на фоне умственного перенапряжения, его иногда так и называют – «стресс-ритм», или «ритм напряжения» [14]. В нашем случае при регистрации и последующем анализе его ОЗМ оно было выражено незначительно.
При депрессии мы отмечали перераспределение мощности a-ритма, его максимальные значения фиксировались во фронтальном и центральном отведениях, где в 1,8 и 1,4 раза (р<0,01) соответственно превышали показатели в группе К, а в области затылка, наоборот, достоверно снизились на 64,2% (р<0,01). Одновременно с этим b-ритм также претерпел изменения, на фоне данной патологии отмечалось достоверное уменьшение во всех отделах ГМ: так во фронтальной области его ОЗМ снизилось на 87,4% (р<0,01) по отношению к нормальным показателям. В свою очередь активность D-ритма наглядно выросла 80% (р<0,01) во всех зонах регистрации, а в некоторых отведениях даже доминировала над a-ритмом (например, затылочном и теменном); θ-ритм также незначительно увеличился, но не так существенно, как D-ритм (рис. 4).
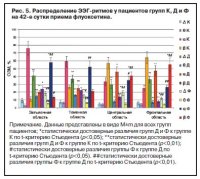
Спустя 6 нед фармакотерапии показатели биоэлектрической активности исследуемых пациентов претерпели значимые изменения. На фоне фармакотерапии флуоксетином анализ ОЗМ ЭЭГ-ритмов показал, что картина биоэлектрической активности ГМ у пациентов, страдающих депрессивным расстройством, практически нормализовалась. Но все же имелись некоторые отличия от показателей и группы Д, и группы К. Данный ЛП повлиял на мощность a-ритма: хотя ритм и приобрел правильное распределение по сравнению с группой Д, но его показатели ОЗМ так и не достигли фоновых значений в некоторых отведениях. Они были достоверно ниже в затылочной (в 1,4 раза; р<0,05) и теменной областях (на 22%; р<0,05), а в центральной и фронтальной зонах регистрации достигли исходных данных. Если говорить о b-ритме, то он тоже приблизился к показателям нормы, однако его мощность все еще оставалась достоверно низкой, особенно во фронтальной и центральной областях. Влияние флуоксетина на D-ритм оказалось несколько иным, нежели на предыдущие ритмы. Он сохранил достаточно высокие значения ОЗМ во всех регистрируемых отведениях и достоверно превышал показатели нормы вдвое (р<0,01). А θ-ритм снизился до нормальных значений, и каких-либо существенных изменений его мощности выявлено не было (рис. 5).

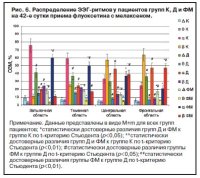
Аналогичную картину мы наблюдали и при регистрации ЭЭГ у пациентов, которые получали комбинацию флуоксетина с мелаксеном. Как видно из приведенных данных, мелаксен практически не оказал выраженного влияния ни на один ЭЭГ-ритм ГМ (рис. 6).
В свою очередь, при обработке данных ЭЭГ у пациентов, получавших Вальдоксан, были получены результаты, которые имели некоторые отличия от двух предыдущих групп. ЭЭГ-картина на фоне приема Вальдоксана практически приблизилась к фоновым значениям. Так, a-ритм имел правильное распределение, он достоверно доминировал в области затылка и даже на 14,4% превышал показатели в группе К; b-ритм также приблизился к показателям нормы во всех отведениях. Анализ D-ритма показал достоверное уменьшение его ОЗМ во всех регистрируемых областях ГМ, которые стали равнозначными с показателями в группе К и, естественно, имели достоверные отличия от показателей при депрессии (группа Д); θ-ритм достиг фоновых значений (рис. 7).
Обсуждение
При сравнительной оценке эффективности фармакотерапии соматогенного депрессивного расстройства средней степени тяжести у пациентов с хронической гастроэнтерологической патологией наилучший результат отмечался у пациентов, принимавших Вальдоксан. Для данного ЛП весьма характерен достаточно быстрый регресс базовой симптоматики депрессии, что наглядно отражает проведенный анализ среднего суммарного балла по шкале HDRS по отношению к двум другим схемам фармакотерапии (флуоксетин и комбинация флуоксетина с мелаксеном), когда наступление терапевтического эффекта (редукция среднего суммарного балла более чем на 50% от исходных данных) наблюдалось уже на 4-й неделе лечения. Как показало наше исследование, Вальдоксан обладает достаточно выраженным анксиолитическим эффектом, который довольно быстро купирует тревожный компонент при депрессивном расстройстве, это согласуется с другими авторами [2, 16, 22]. Также нельзя не отметить тот факт, что этот ЛП способствует оптимизации архитектуры сна и избавляет пациентов от симптомов инсомнии, которые наиболее часто сопровождают депрессию, а в некоторых случаях даже могут быть причиной возникновения повторного эпизода данного аффективного расстройства [16, 22, 27]. Помимо сказанного при анализе биоэлектрической активности ГМ у пациентов по окончании 6 нед фармакотерапии было выявлено, что Вальдоксан способствует нормализации распределения ЭЭГ-ритмов. Он модулирует усиление мощности a-ритма, особенно в затылочной и теменной областях, повышает ОЗМ b-ритма во фронтальном и центральном отведениях, а также способствует уменьшению мощности D- и θ-ритма по сравнению с показателями при депрессии.

Поскольку до настоящего момента определение ЭЭГ-профиля Вальдоксана не проводилось, кроме изучения его влияния на архитектуру сна у пациентов с большим депрессивным расстройством [24], можно сказать, что подобное воздействие на биоэлектрическую активность ГМ присуще ЛП, имеющим в своем арсенале психотропных эффектов анксиолитический компонент [18, 19]. По нашему мнению, реализация данного эффекта, вероятно, заключается в его прямом мелатониномиметическом воздействии на МТ1- и МТ2-рецепторы и особенно антагонизме к серотониновым 5НТ2C-рецепторам, что, по-видимому, имеет достаточно принципиальное значение для реализации антидепрессивной активности Вальдоксана [2].
Схема лечения комбинацией флуоксетина с мелаксеном также показала достаточно хорошую эффективность, однако влияние на ритмику ГМ и редукция симптомов депрессии в данной группе происходили медленнее, хотя наступление терапевтического эффекта к концу наблюдения отмечалось у всех пациентов. На наш взгляд, это можно связать с включением в схему лечения мелаксена. Многими авторами показано, что мелатонин является неспецифическим фактором защиты организма от воздействия стрессогенных факторов, он способствует ослаблению спровоцированной эмоциональной реактивности, проявляет тем самым свою защитную антистрессорную функцию. Поэтому включение в схему лечения мелаксена с другими антидепрессантами, в частности флуоксетином, оказывает положительное воздействие и приводит к более быстрому наступлению терапевтического эффекта при лечении данной аффективной патологии, что также согласуется с мнением других исследователей [1, 4, 29].
В отличие от предыдущих схем лечения использование одного лишь флуоксетина, по нашим данным, было явно недостаточно, и по окончании 6-недельного исследования больные в этой группе все еще нуждались в продолжении курса фармакотерапии и дальнейшем наблюдении. Можно сказать, что флуоксетин не дает в полной мере восстановиться ЭЭГ-ритмам ГМ, но тем не менее способствует их правильному распределению, что также нашло подтверждение в ранее проведенных исследованиях о влиянии данного ЛП на ритмическую активность ГМ [13, 18, 19].
Выводы

1. КФЭЭГ является удобным методом оценки изменений функционального состояния ГМ на фоне соматической патологии. Кроме этого, данный метод позволяет объективизировать оценку эффективности терапии и получить информацию о психотропном действии того или иного лекарственного вещества.
2. По результатам проведенного клинического исследования, улучшение состояния пациентов с сопутствующим депрессивным расстройством, возникшим на фоне гастроэнтерологической патологии, наступает быстрее при включении в схему базовой терапии Вальдоксана по сравнению с назначением флуоксетина или комбинации флуоксетина с мелаксеном. Это подтверждается более значимым и быстрым регрессом депрессивной симптоматики. Сравнительный анализ результатов КФЭЭГ показал, что Вальдоксан оказывает более выраженное влияние на ритмическую активность ГМ у пациентов с депрессией, которое заключается в нормализации распределения ЭЭГ-ритмов на фоне депрессии, по сравнению с комбинацией флуоксетина с мелаксеном или монотерапией флуоксетином. Вальдоксан обладает благоприятным профилем переносимости и безопасности и обеспечивает высокий уровень комплаентности пациентов. Таким образом, Вальдоксан является эффективным и относительно безопасным препаратом, который может быть рекомендован для лечения соматогенных депрессивных расстройств в терапевтических дозировках (25–50 мг на ночь) курсом не менее 6 нед.
Сведения об авторах
Заика В.Г. – кафедра психиатрии ГБОУ ВПО РостГМУ. E-mail: zaika1947@qip.ru
Куделина О.М. – кафедра фармакологии и клинической фармакологии ГБОУ ВПО РостГМУ. E-mail: kuomi81@mail.ru
Список исп. литературыСкрыть список1. Арушанян Э.Б. Антистрессорные возможности эпифизарного мелатонина. В кн.: Мелатонин в норме и патологии. М., 2004; с. 198–222. / Arushanian E.B. Antistressornye vozmozhnosti epifizarnogo melatonina. V kn.: Melatonin v norme i patologii. M., 2004; s. 198–222. [in Russian]
2. Арушанян Э.Б. Мелатонинергический антидепрессант вальдоксан. Эксперим. и клин. фармакология. 2011; 74 (7): 41–5. / Arushanian E.B. Melatoninergicheskii antidepressant val'doksan. Eksperim. i klin. farmakologiia. 2011; 74 (7): 41–5. [in Russian]
3. Бочкарев В.К., Панюшкина С.В. Электроэнцефалографические исследования при пограничных состояниях. Пограничные психические расстройства. Под ред. Ю.А.Александровского. М.: Медицина, 2000. / Bochkarev V.K., Paniushkina S.V. Elektroentsefalograficheskie issledovaniia pri pogranichnykh sostoianiiakh. Pogranichnye psikhicheskie rasstroistva. Pod red. Iu.A.Aleksandrovskogo. M.: Meditsina, 2000. [in Russian]
4. Левин Я.И. Мелатонин (мелаксен) в терапии инсомнии. РМЖ. 2005; 13 (7): 498–501. / Levin Ia.I. Melatonin (melaksen) v terapii insomnii. RMZh. 2005; 13 (7): 498–501. [in Russian]
5. Медведев В.Э. Терапия непсихотических депрессий в рамках инволюционной истерии (опыт применения Вальдоксана). Психиатрия и психофармакотерапия. 2011; 13 (4): 14–8. / Medvedev V.E. Terapiia nepsikhoticheskikh depressii v ramkakh involiutsionnoi isterii (opyt primeneniia Val'doksana). Psychiatry and Psychopharmacotherapy. 2011; 13 (4): 14–8. [in Russian]
6. Медведев В.Э., Гушанская Е.В., Тер-Исраелян А.Ю. Терапия депрессий с явлениями ангедонии (опыт применения Вальдоксана). Психиатрия и психофармакотерапия. 2014; 16 (3): 45–9. / Medvedev V.E., Gushanskaia E.V., Ter-Israelian A.Iu. Terapiia depressii s iavleniiami angedonii (opyt primeneniia Val'doksana). Psychiatry and Psychopharmacotherapy. 2014; 16 (3): 45–9. [in Russian]
7. Зенков Л.Р. Клиническая электроэнцефалография с элементами эпилептологии. М.: МЕДпресс-информ, 2004. / Zenkov L.R. Klinicheskaia elektroentsefalografiia s elementami epileptologii. M.: MEDpress-inform, 2004. [in Russian]
8. Поворинский А.Г., Заболотных В.А. Пособие по клинической электроэнцефалографии. М.: Наука, 1987. / Povorinskii A.G., Zabolotnykh V.A. Posobie po klinicheskoi elektroentsefalografii. M.: Nauka, 1987. [in Russian]
9. Хадзегова Ф.Р. Особенности состояния сердечно-сосудистой системы, вегетативного и психологического статуса у пациентов с синдромом раздраженного кишечника. Автореф. … канд. мед. наук. М., 2008. / Khadzegova F.R. Osobennosti sostoianiia serdechno-sosudistoi sistemy, vegetativnogo i psikhologicheskogo statusa u patsientov s sindromom razdrazhennogo kishechnika. Avtoref. … kand. med. nauk. M., 2008. [in Russian]
10. Andrisano C, Chiesa A, Serretti A. Newer antidepressants and panic disorder: a meta-analysis. Int Clin Psychopharmacol 2013; 28: 33–45.
11. Barsky AJ, Orav EJ, Bates DW. Somatization Increases Medical Utilization and Costs Independent of Psychiatric and Medical Comorbidity. Arch Gen Psychiatry 2005; 62: 903–10.
12. Bazanova OM, Aftanas LI. Individual measures of electroencephalogram alpha activity and non-verbal creativity. Neurosci Behav Physiol 2008; 38 (3): 227–35.
13. Bruder GE, Sedoruk JP, Stewart JW et al. EEG alpha measures predict therapeutic response to an SSRI antidepressant: Pre and post treatment findings. Biol Psychiatry 2008; 12 (63): 1171–7.
14. Cantero JL, Atienza M, Stickgold R et al. Sleep-dependent theta oscillations in the human hippocampus and neocortex. J Neurosci 2003; 23: 10897–903.
15. Dubovsky SL, Warren C. Agomelatine, a melatonin agonist with antidepressant properties. Expert Opin Investig Drugs 2009; 18 (10): 1533–40.
16. Eser D, Baghai NC, Moller HJ. Evidence of agomelatinés antidepressant efficacy: the key points. Int Clin Psychopharmacol 2007; 22 (2): 15–9.
17. Im CH, Hwang HJ, Che H, Lee S. An EEG-based real-time cortical rhythmic activity monitoring system. Physiol Meas 2007; 9 (28): 1101–13.
18. Itil TM. Quantitative pharmaco-electroencephalography. Psychotropic Drugs and the Human EEG. Mod Probl Pharmacopsych 1974; 8: 43–75.
19. Itil TM. The discovery of psychotropic drugs by computer analyzed cerebral bioelectrical potentials (CEEG). Drug Dev Res 2004; 1 (4): 373–407.
20. Hanoum N, Mocaer E, Boyer PA. Differential effects of the novel antidepressant (S 20098) versus fluoxetine on 5-HT1A receptors in the rat brain. Neuropharmacology 2004; 47: 515–26.
21. Herzallah MM, Moustafa AA, Natsheh JY et al. Learning from negative feedback in patients with major depressive disorder is attenuated by SSRI antidepressants. Front Integr Neurosci 2013; 7: 1–9.
22. Kasper S, Hamon M. Beyond the monoaminergic hypothesis: agomelatine, a new antidepressant with an innovative mechanism of action. World J Biol Psychiat 2009; 10 (2): 117–26.
23. Kennedy SH, Rizvi SJ. Agomelatine in the treatment of MDD. CNS Drug 2010; 24: 479–99.
24. Millan MJ, Gobert A, Lejeune F. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydroxytryptamine2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. J Pharmacol Exp Ther 2003; 306: 954–64.
25. Nakao M, Shinozaki Y, Ahern DK, Barsky AJ. Anxiety as a predictor of improvements in somatic symptoms and health anxiety associated with cognitive-behavioral intervention in hypochondriasis. Psychother Psychosom 2011; 80: 151–8.
26. Nemeroff CB, Thase ME. A double-blind, placebocontrolled comparison of venlafaxine and fluoxetine treatment in depressed outpatients. J Psychiatr Res 2007; 41: 351–60.
27. Quera Salva MA, Lemoine P, Guilleminault C. Impact of the novel antidepressant agomelatine on disturbed sleep-wake cycles in depressed patients. Hum Psychopharmacol Clin Exp 2010; 25: 222–9.
28. Quera Salva MA, Hartley S, Barbot F et al. Circadian rhythms, melatonin and depression. Curr Pharm Des 2011; 17 (15): 1459–70.
29. Srinivasan V, Smits M, Spence W. Melatonin in mood disorders. World J Biol Psychiat 2006; 7 (3): 138–52.
30. Stahl SM. Novel mechanism of antidepressant action: norepinephrine and dopamine disinhibition (NDDI) plus melatoninergic agonism. Int J Neuropsycopharmacol 2007; 10: 575–8.
31. Suffin SC, Emory WH, Gutierrez G. A QEEG database method for predicting pharmacotherapeutic outcome in refractory major depressive disorders. Am Physic Sur 2007; 4 (12): 104–8.

