Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина








Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05-06 2015
Оценка прогностической значимости генетических изменений CYP2D6 при развитии побочных эффектов антидепрессивного лечения №05-06 2015
Номера страниц в выпуске:46-51
С целью определения ассоциации генетических полиморфизмов CYP2D6 с эффективностью и переносимостью антидепрессивной терапии проведено комплексное клинико-психопатологическое и генетическое исследование 98 пациентов с депрессией, получавших разные антидепрессанты. Выявлено, что больные с генотипом CYP2D6*4/*4 достоверно хуже переносят антидепрессанты, в биотрансформации которых принимает участие изофермент CYP2D6. В то же время наше исследование не доказало прогностической значимости для развития побочных эффектов генетических вариантов с одним нулевым аллелем *4 или дефектных аллелей *10 и *41. Для подтверждения или опровержения этих результатов необходимы дальнейшие исследования на большей выборке пациентов.
Ключевые слова: фармакогенетика, депрессия, антидепрессанты, цитохром Р450, CYP2D6.
С целью определения ассоциации генетических полиморфизмов CYP2D6 с эффективностью и переносимостью антидепрессивной терапии проведено комплексное клинико-психопатологическое и генетическое исследование 98 пациентов с депрессией, получавших разные антидепрессанты. Выявлено, что больные с генотипом CYP2D6*4/*4 достоверно хуже переносят антидепрессанты, в биотрансформации которых принимает участие изофермент CYP2D6. В то же время наше исследование не доказало прогностической значимости для развития побочных эффектов генетических вариантов с одним нулевым аллелем *4 или дефектных аллелей *10 и *41. Для подтверждения или опровержения этих результатов необходимы дальнейшие исследования на большей выборке пациентов.
Ключевые слова: фармакогенетика, депрессия, антидепрессанты, цитохром Р450, CYP2D6.
nivanets@mail.ru
Для цитирования: Иванец Н.Н., Кинкулькина М.А., Тихонова Ю.Г. и др. Оценка прогностической значимости генетических изменений CYP2D6 при развитии побочных эффектов антидепрессивного лечения. Психиатрия и психофармакотерапия. 2016; 17 (5–6): 46–51.
Analysis of prognostic value of CYP2D6 polymorphisms in the occurrence of adverse events of antidepressant treatment
N.N.Ivanets, М.А.Kinkulkina, Yu.G.Tikhonova, T.I.Avdeeva, А.А.Ragimov, N.G.Dashkova, О.Е.Kuznetsov, А.V.Matveev
I.M.Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation. 119991, Russian Federation, Moscow, ul. Trubetskaia, d. 8, str. 2.
The aim of this study was to examine the association of CYP2D6 polymorphisms with efficacy and tolerability of antidepressants. The clinical trial and genotyping conducted in 98 patients treated with different antidepressants. It was found that patients with genotype CYP2D6*4/*4 significance worse tolerate antidepressants metabolized by isozyme CYP2D6. Study did not reveal genetic variants with a single allele *4, *10 or *41 as predictors for the side effects of antidepressant. To confirm or refute these results, further studies are needed on a large sample of patients.
Key words: pharmacogenetics, depression, antidepressants, cytochrome P450, CYP2D6.
nivanets@mail.ru
For citation: Ivanets N.N., Kinkulkina M.A., Tikhonova Yu.G. et al. Analysis of prognostic value of CYP2D6 polymorphisms in the occurrence of adverse events of antidepressant treatment. Psychiatry and Psychopharmacotherapy. 2016; 17 (5–6): 46–51.

Введение
Цитохром P450 (CYP) представляет собой группу изоферментов, участвующих в окислительной биотрансформации ксенобиотиков и эндогенных биоорганических веществ. Изофермент Р450 2D6 (CYP2D6) катализирует метаболизм до 25% лекарственных препаратов, таких как антидепрессанты (амитриптилин, кломипрамин, дезипрамин, имипрамин, флуоксетин, флувоксамин, пароксетин, дулоксетин, венлафаксин, миансерин, миртазапин, мапротилин, сертралин, циталопрам), нейролептики, наркотические анальгетики, b-адреноблокаторы и антиаритмики [1, 2].
Для гена CYP2D6 описано более 100 аллельных вариантов, у некоторых из них выявлена способность модулировать фармакокинетику лекарственных препаратов посредством изменения активности фермента [3]. Полиморфизм CYP2D6, как правило, представлен гаплотипом, определяемым специфической комбинацией однонуклеотидных полиморфизмов (single nucleotide polymorphism – SNP) и/или другими изменениями нуклеотидной последовательности (дупликация, делеция) [4]. Аллельные варианты классифицированы как функциональные (CYP2D6*1 и *2), дефектные (наиболее распространенные из них – CYP2D6*10, *17 и *41) и нефункциональные (медленные) [5] (CYP2D6*3-*6) [1–4, 6]. Носители разных аллельных вариантов распределены по 4 фенотипическим группам. «Медленные» метаболизаторы (poor metabolizers – PM) – гомозиготные носители молчащих аллелей *3, *4, *6 или делеции аллеля *5 [1, 2]. Распространенность среди представителей европеоидной расы – 5–10% и в несколько раз меньше среди азиатской и негроидной рас. Частота аллеля CYP2D6*4 в европейских популяциях варьирует от 20 до 25%, но у азиатских и африканских народов не превышает 1–2% [1, 2, 4, 6]. «Промежуточные» метаболизаторы (intermediate metabolizers – IM) – носители либо одного нефукционального аллеля, либо двух дефектных (*9, *10, *17 и *41) [2]. Распространенность среди европеоидов составляет 10–15%; монголоидов – превышает 50% преимущественно за счет аллеля *10 и среди африканских народов, у которых преобладает аллель *17, достигает 30% [2]. «Быстрые» (сверхактивные) метаболизаторы (ultrarapid metabolizers – UM) – носители комбинации удвоения гена с любым активным аллелем или нескольких дупликаций. Распространенность – 1–10% среди европейцев с большей частотой в южных странах Европы [2, 6, 7]. «Распространенные» (активные, средние, нормальные) метаболизаторы (extensive metabolizers – EM) – гомозиготные носители двух аллелей, кодирующих активный фермент (*1/*1; *1/*2; *2/*2), или носители одного удвоенного аллеля в комбинации с одним дефектным (*3; *4; *5; *6). Это наиболее распространенный фенотип среди европеоидов – 60–85% [1, 2, 6–8].
В России описаны IM – гетерозиготные носители CYP2D6*3, *4, *5, *6, *7, *9, *10, *41; PM – гомозиготные носители мутантных аллелей; UM – дупликация функциональных аллелей *1, *2 [5]. Частота носительства аллельного варианта CYP2D6*4 (гомозиготное и гетерозиготное носительство) в российской популяции составляет до 30%, частота дупликаций *1, *2 – до 3,4% [5, 9]. Распространенность разных генетических вариантов в России меняется в зависимости от этнической принадлежности. Так, нефункциональный аллель *4 был выявлен у 17,5% русских по сравнению с 9,5% у татар и 7,1% у башкир [10].
В клинической практике для UM требуется назначение более высоких доз, в то время как для PM характерен высокий риск развития побочных эффектов – по оценкам S.Chen и соавт. (1996 г.), более чем в 2 раза (44% против 21% у гетерозиготных или гомозиготных носителей активных аллелей) [11]. У PM снижен клиренс нортриптилина, кломипрамина, дезипрамина, имипрамина, амитриптилина, пароксетина, флувоксамина, флуоксетина и венлафаксина [2, 8, 12]. Эффективная среднесуточная доза амитриптилина и нортриптилина варьирует для обладателей PM и UM от 10 до 500 мг/сут, кломипрамина – от 25 до 300 мг/сут [8]. В обзоре J.Kirchheiner (2001 г.) при терапии европеоидов с «медленным» метаболизмом рекомендовано снижение дозировок трициклических антидепрессантов (ТЦА) на 50–80% и на 30% – селективных ингибиторов обратного захвата серотонина (СИОЗС). Для UM рекомендовано увеличение среднетерапевтических дозировок нортриптилина на 260%, миансерина – на 300% [12]. Управление по контролю пищевых продуктов и лекарств в США (FDA – Food and Drug Administration) регламентировало применение фармакогенетического тестирования CYP2D6 в инструкции по применению амитриптилина, циталопрама, кломипрамина, дезипрамина, флуоксетина, флувоксамина, имипрамина, нефазодона, пароксетина, венлафаксина [13].
В России выполнено несколько работ, изучавших влияние полиморфизма CYP2D6 на переносимость антидепрессантов. Выявлено достоверно более частое развитие побочных эффектов при применении антидепрессантов у носителей аллеля CYP2D6*4 [14–16].
Материалы и методы

В открытое проспективное наблюдательное исследование включены 98 пациентов с депрессивными расстройствами, получавшие терапию антидепрессантами. Больные проходили стационарное или амбулаторное лечение в Клинике психиатрии им. С.С.Корсакова Университетской клинической больницы №3 ГБОУ ВПО Первый МГМУ им. И.М.Сеченова и научно-консультативном отделении ФГБУ Научный центр неврологии РАН в 2013–2014 гг. Исследование было одобрено Локальным комитетом по этике ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. Все лица подписали информированное согласие на участие.
Критериями невключения больных в исследование были: шизофрения, острые галлюцинаторно-бредовые психозы, болезнь зависимости, деменция, острая соматическая и неврологическая патология. Антидепрессанты применялись в качестве единственного антидепрессивного препарата (монотерапия), при необходимости (для купирования тревоги, бессонницы) допускалось кратковременное назначение препаратов других клинико-фармакологических групп – нейролептиков в малых дозах, транквилизаторов, снотворных.

Оценка эффективности антидепрессантов проводилась с момента назначения антидепрессанта еженедельно с применением клинико-психопатологического метода и психометрических шкал: Шкала оценки депрессии Монтгомери–Асберга (MADRS – Montgomery–Asberg Depression Rating Scale), Госпитальная шкала депрессии и тревоги (HADS – Hospital Anxiety and Depression Scale). Длительность наблюдения составляла не менее 12 нед. Антидепрессивная терапия оценивалась как эффективная, если отмечалось отчетливое клиническое улучшение состояния и редукция симптомов по шкале MADRS составляла более 50%. Изучалась скорость уменьшения выраженности психопатологической симптоматики, отмечался факт достижения ремиссии (клинически и по психометрическим шкалам).
При оценке переносимости антидепрессивной терапии учитывались частота возникновения и характер побочных эффектов, все нежелательные лекарственные реакции (НЛР), выявленные при целенаправленном расспросе или сообщенные пациентами самостоятельно. НЛР регистрировались еженедельно с помощью Структурированной шкалы побочных эффектов (UKU Side-Effect Rating Scale).
Генетические исследования

У пациентов для проведения лабораторных исследований брали два вида материала: соскоб с использованием буккального тампона, цельная кровь в пробирку с этилендиаминтетраацетатом. Образцы цельной крови замораживали и хранили при температуре -30°С до проведения анализа.
На I этапе работы проводилось выделение геномной ДНК от пациентов с помощью наборов реагентов «QIAamp DNA MiniKit» из буккального тампона и «ArrowBlood DNA 500» из цельной крови (на станции «NorDiag Arrow»). Для оценки качества и количества нуклеиновых кислот применяли спекрофотометр «Biowave DNA». Выход ДНК определялся, исходя из ее концентрации, рассчитанной на основании поглощения, измеренного при 260 нм. Чистота определялась с помощью расчета отношения поглощения, измеренного при 260 и 280 нм. В данном исследовании чистота ДНК находилась в интервале 1,7–1,9.
Далее проводили постановку полимеразной цепной реакции (ПЦР) в режиме реального времени на амплификаторе «CFX-96» («BIO-RAD») с использованием наборов реагентов для генотипирования «SNPs TaqMan» по 11 точкам (C_27102425_10; C_27102414_10; C_27102431_D0; C_11484460_40; C_34816116_20; C_25986767_70; C_27861809_10; C_7586657_20; C_7586662_10; C_11711720C_30; C_11711720D_40), согласно протоколу производителя компонентов реакционной смеси, содержащей универсальную реакционную смесь «TaqManUniversal PCR MasterMix», деионизированную воду, выделенную геномную ДНК образца. Для проведения ПЦР необходима концентрация выделенной ДНК образца в пределах 1–20 ng на реакцию. Все образцы были доведены деионизированной водой до концентрации 5 ng на реакцию для получения достоверных и воспроизводимых результатов с четкой кластеризацией. Подготовку реакционной смеси проводили по схеме (табл. 1).

Протокол амплификации включал несколько стадий (табл. 2).
Результаты анализировались с помощью программного обеспечения по двум каналам VIC и FAM.
Статистический анализ
Математическая обработка данных проводилась с помощью пакета программ Statistica 8.0. Параметры выборки оценивались стандартными методами описательной статистики для распределения, отличного от нормального [17]. Сравнительный анализ проводился с помощью методов непараметрической статистики. Распределение генотипов и частот аллелей в группах сравнения анализировалось с помощью критерия c2 с поправкой Йетса, критерия Фишера (для групп менее 5 человек) и метода максимального правдоподобия (для трех независимых групп). Проверка влияния полиморфизмов на выраженность побочных эффектов проводилась с использованием U-теста Манна–Уитни и теста Краскела–Уоллиса.
Результаты

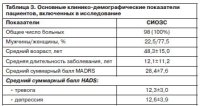
В табл. 3 представлены основные клинико-демографические параметры выборки. Более 3/4 больных, включенных в исследование, были женщины.
Средний возраст составлял примерно 48 лет. Больные (n=37) получали терапию СИОЗС (табл. 4), 43 – ТЦА, 18 – норадренергические и специфические серотонинергические антидепрессанты (НССА).
В табл. 4 представлено также сродство изофермента CYP2D6 к изучаемым препаратам. Преимущественный путь биотрансформации большинства антидепрессантов протекает с участием CYP2D6, в меньшей степени это актуально для сертралина и циталопрама. Пипофезин, относимый к ТЦА, метаболизируется преимущественно CYP3A4.
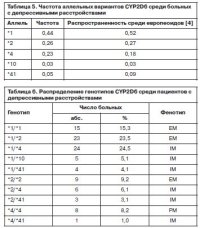
Распределение аллельных вариантов и генотипов CYP2D6 среди пациентов, включенных в исследование, представлено в табл. 5, 6.
Частота аллеля дикого типа *1 наблюдалась в нашем исследовании несколько реже, чем в среднем в европейской популяции, – 0,44 по сравнению с 0,52. Частота нефункционального аллеля *4 в нашей выборке – 0,23; по данным литературы, этот показатель составляет от 0,12 до 0,21 [7]. Распределение частот аллелей *2, *10, *41 – было схожим со значениями, определенными для представителей белой расы [4]. Фенотип EM выявлен у 48,0% пациентов, получавших терапию антидепрессантами (см. табл. 6). IM определен у 43,9% больных. PM – у 8,2%.
Проведен анализ взаимосвязи генотипов или аллелей с тяжестью депрессии, возрастом дебюта, длительностью и типом течения заболевания, частотой аффективных фаз, сопутствующей психической или соматической патологией, демографическими или антропометрическими показателями. Статистически значимых данных не получено. При сравнительном анализе факторов, влияющих на эффективность терапии, не выявлено ассоциации генетических изменений с числом респондеров, уровнем достижения ремиссии и скоростью развития антидепрессивного ответа. Анализ взаимосвязи проведен для каждого класса антидепрессантов (ТЦА, СИОЗС, НССА) и отдельно – пипофезина. Статистически значимых ассоциаций не получено.
При анализе взаимосвязи частоты НЛР и генетических вариантов CYP2D6 установлено, что носители аллеля *4 чаще жаловались на появление побочных эффектов при терапии антидепрессантами (исключая пипофезин), чем больные без аллеля *4 (75,8% по сравнению с 59,2%), но это отличие не достигало уровня статистической значимости (c2; р=0,112); рис. 1, а. Для группы пациентов, получавших пипофезин, получено, что частота развития побочных эффектов приблизительно одинакова как среди носителей PM, так и больных с другими генотипами (c2; р=0,838); рис. 1, б.
Генотип *4/*4 статистически значимо ассоциирован с риском развития побочных эффектов (рис. 2).

При сравнении частоты НЛР обнаружено, что больные с гомозиготным носительством *4 хуже переносят терапию антидепрессантами (кроме пипофезина) по сравнению с гетерозиготными носителями и пациентами без аллеля *4 (точный критерий Фишера; р=0,045); см. рис. 2, а. У носителей генотипа *4/*4 также развиваются более выраженные побочные эффекты при терапии антидепрессантами, метаболизируемыми CYP2D6 (критерий Манна–Уитни; р=0,000); см. рис. 2, б.
При анализе дозировок антидепрессантов разных классов (в том числе пипофезина) выявлена прямая связь частоты и выраженности побочных эффектов с применяемыми дозами препаратов независимо от генетических признаков. В то же время больным с генотипом *4/*4 антидепрессанты назначались только в минимальных и средних дозах (табл. 7) – сравнение этой группы лиц с носителями других аллельных вариантов выявило статистически значимые отличия (c2; р=0,016); рис. 3.
В нашем исследовании не получено доказательств худшей переносимости антидепрессантов больными с IM по сравнению с EM (c2); р=0,137. Такое сравнение было статистически значимым только для PM, причем у них побочные эффекты развивались не только чаще (c2; р=0,046), но и с большей тяжестью (критерий Краскелла–Уоллиса; р=0,009); рис. 4.
Обсуждение

В проведенном исследовании мы рассмотрели наиболее распространенные среди европеоидов аллельные варианты CYP2D6, ассоциируемые с замедлением метаболизма антидепрессантов [1, 2, 4, 6, 7]. Частота носительства нулевого аллеля *4 составила 0,23; частота дефектных аллелей *10 и *41 – 0,03 и 0,05 соответственно. Распределение частот генотипов больных, включенных в исследование, не соответствовало равновесию Харди– Вайнберга (р=0,100). В задачи данной работы не входило изучение распространенности генетических изменений CYP2D6 в популяции или их взаимосвязи с заболеванием. В целом показатели частот аллелей в нашей выборке схожи со значениями, описанными в литературе для европейской расы [1, 4, 6, 7]. Распространенность PM (т.е. носителей двух нулевых аллелей) в нашей выборке составила 8,2%, что также соответствует данным литературы. Носители одного аллеля *4 и носители дефектных аллелей *10 и *41 были определены как IM. Распространенность аллелей *10 и *41 была недостаточной для получения достоверных результатов при математической обработке, и носителей этих генетических вариантов рассматривали в группе IM.

Результаты проведенного исследования показали достоверно худшую переносимость антидепрессивного лечения у носителей генотипа CYP2D6*4/*4. У 100% носителей PM наблюдались побочные эффекты при применении антидепрессантов (кроме пипофезина), выраженность их была высока, несмотря на то что таким больным назначались малые или средние дозы антидепрессантов. В клинической практике таким пациентам более целесообразно назначение антидепрессантов в низких дозах, либо антидепрессантов, метаболизируемых другими изоферментами системы цитохрома Р450 (пипофезин, ребоксетин). Возможно также применение небольших доз милнаципрана, тразодона, сертралина и циталопрама, так как в их биотрансформации помимо CYP2D6 принимают участие и другие изоферменты. Полученные результаты согласуются с данными многих исследований, проведенных как в России, так и за рубежом [1, 7, 9, 10, 12, 15–16]. Учитывая достаточно высокую распространенность PM среди представителей европеоидной расы – 2–10% [1, 2, 4, 6], в нашем исследовании – 8,2%, – в клинической практике целесообразно применение фармакогенетического тестирования аллельного варианта CYP2D6*4 перед началом психофармакотерапии. Это согласуется с результатами фармакоэкономического исследования, проведенного в Санкт-Петербурге в условиях психиатрического стационара, где показана экономическая обоснованность применения генотипирования CYP2D6 [18].


Результаты, полученные в проведенном исследовании, показали, что носители одного нефункционального аллеля также чаще жаловались на НЛР, но прогностическая значимость такого аллельного варианта не доказана (р=0,112). Не выявлено взаимосвязи худшей переносимости и с аллелями *10 и *41, но такой результат нельзя считать достоверным вследствие малого числа больных с подобными генотипами. Не обнаружено ассоциации какого-либо генетического варианта с эффективностью антидепрессивной терапии.
Таким образом, проведенное исследование доказало, что гомозиготное носительство аллельного варианта CYP2D6*4 является достоверным предиктором худшей переносимости антидепрессантов, метаболизируемых CYP2D6. Таким больным целесообразно назначение антидепрессантов в низких дозах или таких препаратов, как пипофезин, ребоксетин.
По результатам исследования носители с одним нефункциональным аллелем *4 хуже переносили терапию антидепрессантами, чем носители генетических вариантов без аллеля *4, но статистическая значимость такого сравнения не доказана (р=0,112). Для подтверждения или опровержения этих результатов целесообразно проведение дальнейших исследований на большей выборке пациентов.
Сведения об авторах
Иванец Николай Николаевич – чл.-кор. РАН, засл. деят. науки РФ, проф., д-р мед. наук, зав. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова; дир. НОКЦ «Психическое здоровье» ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: nivanets@mail.ru
Кинкулькина Марина Аркадьевна – д-р мед. наук, проф. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова; зам. дир. по научной и инновационной деятельности НОКЦ «Психическое здоровье» ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: kinkulkina@gmail.com
Тихонова Юлия Гулямовна – канд. мед. наук, ассистент каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова, вед. науч. сотр. НИО «Психическое здоровье» НИЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: j.tyhonova@gmail.com
Авдеева Татьяна Ивановна – д-р мед. наук, доц. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: t.i.avdeeva@gmail.com
Рагимов Алигейдар Агаалекпер-оглы – д-р мед. наук, проф., зав. каф. клин. трансфузиологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: ra50@mail.ru
Дашкова Наталья Георгиевна – д-р мед. наук, доц., зав. клинико-диагностической лаб. Центра крови ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: dn35@rambler.ru
Кузнецов Олег Евгеньевич – канд. мед. наук, доц. каф. клин. трансфузиологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: kuznoe@gmail.com
Матвеев Александр Викторович – врач клинико-диагностической лаб. Центра крови ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: doktormatveev@gmail.com
Список исп. литературыСкрыть список1. Zanger UM, Raimundo S, Eichelbaum M. Cytochrome P450 2D6: overview and update on pharmacology, genetics, biochemistry. Naunyn Schmiedebergs Arch Pharmacol 2004; 369 (1): 23–37.
2. Samer CF, Ing Lorenzini K, Rollason V et al. Applications of CYP450 Testing in the Clinical Setting Mol Diagn Ther 2013; 17 (3): 165–84.
3. http://www.cypalleles.ki.se/cyp2d6.htm
4. Hicks JK, Swen JJ, Thorn CF et al. Clinical Pharmacogenetics Implementation Consortium guideline for CYP2D6 and CYP2C19 genotypes and dosing of tricyclic antidepressants. Clin Pharmacol Ther 2013; 93 (5): 402–8.
5. Сычев Д.А. Рекомендации по применению фармакогенетического тестирования в клинической практике. Качественная клин. практика. 2011; 1: 3–10. / Sychev D.A. Rekomendatsii po primeneniiu farmakogeneticheskogo testirovaniia v klinicheskoi praktike. Kachestvennaia klin. praktika. 2011; 1: 3–10. [in Russian]
6. Wang D, Poi MJ, Sun X et al. Common CYP2D6 polymorphisms affecting alternative splicing and transcription: long-range haplotypes with two regulatory variants modulate CYP2D6 activity. Hum Mol Genet 2014; 23 (1): 268–78.
7. Ingelman-Sundberg M. Genetic polymorphisms of cytochrome P450 2D6 (CYP2D6): clinical consequences, evolutionary aspects and functional diversity. Pharmacogenomics J 2005; 5 (1): 6–13.
8. Bertilsson L, Dahl ML, Dalén P, Al-Shurbaji A. Molecular genetics of CYP2D6: clinical relevance with focus on psychotropic drugs. Br J Clin Pharmacol 2002; 53 (2): 111–22.
9. Gaikovitch EA, Cascorbi I, Mrozikiewicz PM et al. Polymorphisms of drug-metabolizing enzymes CYP2C9, CYP2C19, CYP2D6, CYP1A1, NAT2 and of P-glycoprotein in a Russian population. Eur J Clin Pharmacol 2003; 59 (4): 303–12.
10. Мустафина О.Е., Туктарова И.А., Каримов Д.Д. и др. Полиморфизм генов CYP2D6, CYP3A5, CYP3A4 в популяциях русских, татар и башкир. Генетика. 2015; 51 (1): 109–20. / Mustafina O.E., Tuktarova I.A., Karimov D.D. i dr. Polimorfizm genov CYP2D6, CYP3A5, CYP3A4 v populiatsiiakh russkikh, tatar i bashkir. Genetika. 2015; 51 (1): 109–20. [in Russian]
11. Chen S et al. The cytochrome P450 2D6 (CYP2D6) enzyme polymorphism: screening costs and influence on clinical outcomes in psychiatry. Clin Pharmacol Ther 1996; 60 (5): 522–34.
12. Kirchheiner J, Brøsen K, Dahl ML et al. CYP2D6 and CYP2C19 genotype-based dose recommendations for antidepressants: a first step towards subpopulation-specific dosages. J Acta Psychiatr Scand 2001; 104 (3): 173–92.
13. http://www.fda.gov/Drugs/ScienceResearch/ResearchAreas /Pharmacogenetics/ucm083378.htm
14. Кукес В.Г., Иванец Н.Н., Сычев Д.А. и др. Влияние генетического полиморфизма CYP2D6 и MDR1 на эффективность и безопасность терапии антидепрессантами у пациентов с депрессивными расстройствами в условиях психиатрического стационара. Психиатрия и психофармакотерапия. 2013; 5: 27–34. / Kukes V.G., Ivanets N.N., Sychev D.A. et al. The influence of CYP2D6 and MDR1 genetic polymorphism on the antidepressant therapy efficacy and safety in patients with depressive disorders in a psychiatric hospital. Psychiatry and Psychopharmacotherapy. 2013; 5: 27–34. [in Russian]
15. Савельева М.И., Сычев Д.А., Казаков Р.Е. и др. Значение генетического полиморфизма изоферментов цитохрома р450 для персонализированного выбора и режимов дозирования антидепрессантов и антипсихотиков. Клин. медицина. 2008; 86 (11): 22–8. / Savel'eva M.I., Sychev D.A., Kazakov R.E. i dr. Znachenie geneticheskogo polimorfizma izofermentov tsitokhroma r450 dlia personalizirovannogo vybora i rezhimov dozirovaniia antidepressantov i antipsikhotikov. Klin. meditsina. 2008; 86 (11): 22–8. [in Russian]
16. Ромодановский Д.П. Полиморфизм гена CYP2D6 и безопасность применения антидепрессантов в условиях реальной клинической практики. Автореф. дис. … канд. мед. наук. М., 2011; с. 23. / Romodanovskii D.P. Polimorfizm gena CYP2D6 i bezopasnost' primeneniia antidepressantov v usloviiakh real'noi klinicheskoi praktiki. Avtoref. dis. … kand. med. nauk. M., 2011; s. 23. [in Russian]
17. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета программ Statistica. М.: МедиаСфера, 2002. / Rebrova O.Iu. Statisticheskii analiz meditsinskikh dannykh. Primenenie paketa programm Statistica. M.: MediaSfera, 2002. [in Russian]
18. Курылев А.А., Вилюм И.А., Андреев Б.В., Колбин А.С. Фармакоэкономическая оценка эффективности применения генотипирования полиморфизмов CYP2D6 в клинической практике психиатрического стационара. Фармакоэкономика. 2012; 5 (4): 15–8. / Kurylev A.A., Vilium I.A., Andreev B.V., Kolbin A.S. Farmakoekonomicheskaia otsenka effektivnosti primeneniia genotipirovaniia polimorfizmov CYP2D6 v klinicheskoi praktike psikhiatricheskogo statsionara. Farmakoekonomika. 2012; 5 (4): 15–8. [in Russian]


