Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина




Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05-06 2015
Перспективы в терапии расстройств сна №05-06 2015
Номера страниц в выпуске:52-58
Данный обзор подготовлен по материалам 27-го Конгресса Европейской коллегии нейропсихофармакотерапии (октябрь 2014 г., Берлин) участником проекта «Восточноевропейская академия Всемирной психиатрической ассоциации» и компании «Сервье» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»).
Сон – один из ключевых физиологических процессов, обеспечивающих нормальное функционирование организма человека. Именно поэтому расстройства сна приводят к системным нарушениям, затрагивая все сферы функционирования, вызывая разные соматические расстройства, негативно отражаясь на психических функциях и социальной активности пациентов, что отражает их высокую субъективную значимость для каждого больного.
info@serbsky.ru
Для цитирования: Марачев М.П. Перспективы в терапии расстройств сна. Психиатрия и психофармакотерапия. 2015; 17 (5–6): 52–58.
Perspectives in the treatment sleep disorders
М.P.Marachev
Department Treatment Mental and Behavioral Disorders of the Serbsky Federal Medical Research Center of Psychiatry and Narcology of the Ministry of Health of the Russian Federation. 119992, Russian Federation, Moscow, Kropotkinsky per., d. 23
info@serbsky.ru
For citation: Marachev М.P. Perspectives in the treatment sleep disorders. Psychiatry and Psychopharmacotherapy. 2015; 17 (5–6): 52–58.
Сон – один из ключевых физиологических процессов, обеспечивающих нормальное функционирование организма человека. Именно поэтому расстройства сна приводят к системным нарушениям, затрагивая все сферы функционирования, вызывая разные соматические расстройства, негативно отражаясь на психических функциях и социальной активности пациентов, что отражает их высокую субъективную значимость для каждого больного.
Согласно Международной классификации расстройств сна 3-го пересмотра (МКРС-3) в настоящее время выделяют 7 основных групп нарушений [1]:
1) инсомнии;
2) расстройства дыхания, связанные со сном;
3) гиперсомнии центрального генеза;
4) расстройства цикла «сон–бодрствование», связанные с циркадианными ритмами;
5) парасомнии;
6) связанные со сном двигательные расстройства;
7) другие расстройства сна.
Среди перечисленных расстройств наибольший удельный вес имеет инсомния, распространенность которой с применением разных диагностических критериев колеблется в пределах от 6 до 75%. Однозначно оценить представленность инсомнии в популяции затруднительно из-за разности в диагностических подходах и методологии исследований. Было показано, что изолированное использование классификаций нарушений сна приводит к значительным несоответствиям в полученных результатах:
21,8% – при применении DSM-IV (Diagnostic and Statistical Manual of mental disorders – Руководства по диагностике и статистике психических расстройств), 14% – МКРС и 3,6% – Международной классификации болезней 10-го пересмотра (МКБ-10). В соответствии с DSM-V около 1/3 взрослого населения жалуются на симптомы инсомнии, 10–15% из них ощущают последствия нарушений сна днем и 6–10% подходят под критерии расстройства сна [2]. Эпидемиологические данные зарубежной литературы основываются преимущественно на кросс-секционных исследованиях, проводимых при помощи телефонного опроса большой выборки населения (от нескольких тысяч до десятков тысяч респондентов). Применяемые опросники, как правило, включают в себя диагностические критерии трех имеющихся классификаций (DSM, МКБ, МКРС); табл. 1.

Среди отечественных работ, посвященных распространенности нарушений сна, можно выделить опрос жителей Москвы (около 5,5 тыс. человек), проведенный в 1989 г. [7], который показал, что 45% респондентов не были удовлетворены своим ночным сном. Согласно более современным данным наличие симптомов инсомнии обнаруживается у 20% населения, из которых на вопрос: «Бывают ли у вас нарушения сна часто или постоянно?» – 16% выбрали ответ «часто», а 4% заявили о постоянных проблемах со сном [8].
Многолетнее изучение инсомнии позволило установить факторы риска, среди которых наибольшую статистическую значимость имеют: женский пол (в пропорции 1,44:1); пожилой возраст; люди, имеющие среднее и незаконченное высшее образование; низкий социально-экономический уровень; разведенные; лица с коморбидными соматическими и/или психическими расстройствами [2, 3, 9].
Наличие нарушений ночного сна связано с худшим результатом лечения психической и соматической патологии в краткосрочной и долгосрочной перспективе, а также повышенным риском развития метаболического синдрома, гипертонической болезни, ишемической болезни сердца и злоупотребления психоактивными веществами [3]. В то время как наиболее часто встречающимися последствиями инсомнии становятся: дневная усталость (48%), ощущение психологического дискомфорта (дистресс) – 40%, физический дискомфорт (22%) [5].
Оценка фактического бремени инсомнии ставит перед учеными еще более сложную задачу по сопоставлению полученных результатов, однако имеющиеся данные свидетельствуют о высокой социальной значимости этой проблемы. Согласно европейским данным, общие затраты на инсомнию составляют около 2 млрд дол. США (1999 г.); для США эта цифра равна 13,9 млрд (на 1995 г.). Опрос 948 канадцев показал, что общие затраты на инсомнию за 2009 г. составили около 6,6 млрд канадских долларов (приблизительно 5,9 млрд дол. США). В эту цифру входят прямые затраты на вызванные симптомами инсомнии обращения за медицинской помощью (191,2 млн), транспортные расходы (36,6 млн), выписанные врачом лекарственные средства (16,5 млн), средства безрецептурного отпуска (1,8 млн), покупка алкоголя и других снотворных средств (339,8 млн). Ежегодные непрямые затраты, связанные с абсентеизмом (отсутствие на рабочем месте без обращения к врачу), оцениваются в 970,6 млн, в то время как стоимость снижения продуктивности сотрудника на работе (презентеизм) оценивается в 5 млрд дол. США. Средняя стоимость на человека составляет 5010 дол. США с синдромом инсомнии и 1431 дол. США – с симптомами инсомнии [10].
Среди лиц, страдающих нарушениями сна, от 10 до 28% используют рецептурные лекарственные средства, 9–15% пациентов предпочитают препараты растительного происхождения [3, 5, 11]; 5,7% – корректируют инсомнические нарушения лекарствами, находящимися в свободной продаже, и около 4,6% решают проблемы инсомнии, употребляя алкоголь [3]. Установлено, что лекарственную терапию получают чаще лица, чья средняя продолжительность ночного сна составляет больше или меньше 7 ч, а уровень образования находится в прямой зависимости от количества лекарственных назначений: чем выше, тем чаще назначались гипнотики [12]. Среди нелекарственных методов терапии наибольшее распространение получили такие стратегии совладения с инсомнией, как чтение перед сном, прослушивание музыки, разные методики релаксации [5].
Вплоть до второй половины XIX в. наиболее распространенным методом коррекции нарушений сна был алкоголь. С появлением в 1869 г. хлоралгидрата началась новая эра в терапии инсомнических нарушений. В последующие 100 лет с этой целью применялись барбитураты (1903 г.), бензодиазепины (1960 г.), производные бензодиазепинов (препараты группы Z). В начале 2000-х годов возникли лекарства с новым механизмом действия (агонисты мелатонина), ориентированные на синхронизацию циркадианных ритмов, которые в отличие от предыдущих поколений гипнотиков не вызывали седацию. В последние годы ведутся исследования относительно применения лекарств, влияющих на орексиновую систему в качестве медикаментозной коррекции инсомнических проявлений.
В клиническом руководстве, разработанном Американской академией медицины сна [13], приводятся следующие виды и последовательность терапии хронической инсомнии. Терапевтические интервенции ведутся в двух основных направлениях: с одной стороны, психологическая и поведенческая терапия, а с другой – методы фармакологической коррекции. К психологическим и поведенческим методам относятся: когнитивно-поведенческая психотерапия; ограничение сна; парадоксальная интенция; терапия, основанная на биологической обратной связи; обучение правилам гигиены сна. Фармакологическое лечение рекомендуется совмещать с психотерапевтическими вмешательствами. Препаратами 1-й линии становятся бензодиазепины, их производные (зопиклон и др.) и мелатонинергические средства. Антидепрессанты применяются в случае наличия коморбидной психической патологии в виде тревоги или депрессии (тразодон, амитриптилин, миртазапин, доксепин), при неэффективности лечения применяются комбинации антидепрессантов с бензодиазепинами или мелатонинергическими средствами. Использование антиконвульсантов (габапентин, тиагабин) или антипсихотиков (кветиапин, оланзапин) с седативным эффектом оправдано при наличии психической патологии с коморбидными нарушениями сна. Применение безрецептурных средств (например, гистаминергических), растительных препаратов и биодобавок (мелатонин) для длительной терапии бессонницы считается неоправданным из-за отсутствия достаточного количества данных относительно их действенности и переносимости. Ранее одобренные лекарства (барбитураты, хлоралгидрат) в настоящее время не рекомендуются к использованию для терапии нарушений сна.
Нейромедиаторные механизмы, вовлеченные в процессы возбуждения и торможения центральной нервной системы и как следствие – оказывающие влияние на цикл «сон–бодрствование», многообразны. Основной медиатор торможения в центральной нервной системе – g-аминомасляная кислота (ГАМК), в связи с этим среди лекарств, влияющих на процесс засыпания, главной терапевтической мишенью является ГАМКергическая система, а именно ГАМКА-рецепторы (a1-субъединица). На ГАМКА-рецепторы действуют такие препараты, как бензодиазепины, барбитураты, нейростероиды, этанол и средства для общего наркоза (изофлуран, пропофол). Общим недостатком для этих лекарств в контексте терапии нарушений сна является системное седативное действие. Современные производные бензодиазепинов обладают большей селективностью, так как действуют только на a1-субъединицу ГАМКА-рецептора. Такие препараты получили название «Z» (по первой букве названия действующего вещества). Предпринимались попытки создания других селективных агонистов ГАМКА-рецепторов (индиплон, адипиплон, габоксодол), однако их исследования были остановлены на разных стадиях изучения в связи с выраженностью побочных явлений.
Одну из ключевых ролей в индукции пробуждения играет гистаминергическая система. Так, антигистаминные препараты I поколения, взаимодействующие с Н1-рецепторами гистамина, вызывали выраженную седацию, что привело к применению некоторых из них в качестве гипнотиков. Перспективными для дальнейшего изучения становятся Н3-рецепторы. Их агонисты имеют седативный эффект, тогда как антагонисты приводят к активизации. Предполагается, что селективные Н3-антагонисты (такие как ципроксифан, тиоперамид, питолизант) могут использоваться в терапии состояний выраженной дневной сонливости и нарколепсии.
Норадренергическая система также частично задействована в механизмах пробуждения посредством активации a1-андренорецепторов и частично за счет ингибиторных влияний a2-адренорецепторов на вентролатеральное преоптическое ядро.
О регуляторных свойствах дофаминергической системы можно судить по эффективности психостимуляторов (амфетамины, метилфенидат, кокаин и др.), механизм действия которых связан с увеличением центральной нейротрансмиссии дофамина. Несмотря на активирующее влияние этой системы, известно, что при болезни Паркинсона, которая приводит к утрате данных нейронов, агонисты D2-дофаминовых рецепторов способны вызывать сонливость. С другой стороны, снижение активности дофаминергических нейронов, расположенных в мезэнцефало-гипоталамической области, которые иннервируют спинной мозг, приводит к двум парасомническим расстройствам: синдрому усталости нижних конечностей и синдрому беспокойных ног. Оба этих состояния купируются при применении дофаминергических препаратов.
Серотониновые нейроны, расположенные в ядре шва и стволе мозга, играют важную роль в возбуждающих процессах. И 5НТ2а-, и 5НТ2с-рецепторы вовлечены в регуляцию возбуждения. Агонисты 5НТ2а-рецепторов демонстрируют возбуждающие свойства, в то время как антагонисты – седативные, и некоторые из них (эпливансерин, APD125) проходят клинические испытания как препараты для терапии инсомнии. С другой стороны, активация 5НТ2с-рецепторов приводит к увеличению седации за счет возбуждения ГАМКергических интеронейронов в стволе мозга, а антагонисты этих же рецепторов увеличивают активность в голубом пятне и вентральной покрышечной области, что способствует увеличению уровня возбуждения.
Орексиновая система наряду с гистаминовой участвует в регуляции цикла «сон–бодрствование»: агонисты орексиновых (ОР) рецепторов вызывают активацию, антагонисты приводят к седативному действию.
Среди отдельных веществ, обладающих гипногенным действием, можно выделить мелатонин, который используется в качестве биодобавки в терапии вторичных нарушений сна, таких как синдром «Jet leg», или сменная работа с ночным графиком. Другим обособленным веществом является аденозин, концентрация которого в мозге увеличивается в результате длительного бодрствования, и вызванные им метаболические изменения приводят к развитию сонливости и нарастающему желанию заснуть. Выдвигалась гипотеза, согласно которой аденозин может ингибировать активность нейронов, отвечающих за бодрствование (холинергические нейроны в базальных отделах переднего мозга). Более того, антагонизм аденозиновых рецепторов в этих участках может лежать в основе эффектов бодрствования кофеина и теофеллина. Таким образом, препараты, взаимодействующие с этими рецепторами, могут иметь терапевтический потенциал в лечении расстройств сна: агонисты – в качестве гипнотиков, антагонисты – в качестве активаторов мозговой активности [14].
Вопросам новых лекарственных средств и исследованиям перспективных терапевтических мишеней для лечения расстройств сна был посвящен один из симпозиумов на прошедшем в октябре 2014 г. 27-м Конгрессе Европейской коллегии психофармакологии (Берлин, Германия) под названием «Новые терапевтические возможности в терапии расстройств сна».
Работа симпозиума началась с доклада руководителя лаборатории отдела нейробиологической психиатрии Университета Макгилла G.Gobbi (Монреаль, Канада) под названием «Новый селективный частичный агонист мелатониновых МТ2-рецепторов для лечения инсомнии». Начав с общих закономерностей течения ночного сна, G.Gobbi подчеркнула противоречивость имеющихся данных относительно способности мелатонина индуцировать сон. По результатам нескольких метаанализов, экзогенный мелатонин лишь незначительно влияет на засыпание (3,9 мин), качество (3,1%) и продолжительность сна (13,7 мин) [15] и не оказывает клинически значимого действия на симптомы вторичной инсомнии (например, «Jet leg» и/или сменная работа) [16]. В то же время в экспериментах на животных показана способность мелатонина снижать время засыпания и увеличивать как REM-, так и NREM-фазы сна. Оба этих эффекта блокируются при использовании антагониста ГАМКА-рецепторов, что может свидетельствовать о гипотонической активности мелатонина за счет действия на ГАМКА-рецепторную систему [17]. В других исследованиях подобных данных получить не удалось, так при сравнении мелатонина, золпидема и диазепама – мелатонин не показал способности к улучшению сна, однако подтвердил способность к модулированию ультрадианных циклов сна [18, 19]. Имея такие противоречивые данные относительно влияния мелатонина на сон, одним из главных вопросов становится установление роли отдельных рецепторов в нормализации инсомнии.

В своем докладе G.Gobbi подробно остановилась на результатах исследований селективного частичного агониста МТ2-рецепторов мелатонина (UCM924). Его применение способствовало увеличению продолжительности сна (NREM), укорочению засыпания и снижению уровня бодрствования в отличие от мелатонина, который влиял только на укорочение периода засыпания. Примечательно, что агонист МТ1/МТ2-рецепторов не обнаруживал никаких влияний на цикл «сон–бодрствование» [20] (табл. 2).
МТ2-рецепторы располагаются в ретикуло-таламической области мозга, способствуя NREM-сну через усиление ритмической активности ретикуло-таламических нейронов, отвечающих за NREM (медленноволновой сон) [21].
С целью дополнительного изучения вклада рецепторов мелатонина в механизмы регуляции сна было проведено исследование на трех видах трансгенных мышей (инактивированных по МТ1/МТ2-рецептору и обоим типам рецепторов одновременно). При помощи электроэнцефалографии и электромиографии записывались паттерны, характеризующие «сон–бодрствование» в течение 24-часового периода цикла «день–ночь». МТ1-инактивированные мыши показывали снижение (-37,3%) 24-часовых периодов REM, тогда как МТ2-инактивированные мыши – уменьшение (-17,3%) 24-часового NREM-периода сна и увеличение времени бодрствования (14,8%). Мыши, у которых были инактивированы оба рецептора (МТ1/МТ2), показали повышение (8,9%) времени, проведенного в бодрствовании. Результаты исследования показывают, что генетическая инактивация МТ1/МТ2-рецепторов приводит к увеличению времени бодрствования, за счет редукции NREM-сна из-за отсутствия МТ2-рецепторов и редуцированию REM-сна благодаря отсутствию МТ1-рецепторов [22] (табл. 3).

С учетом слабого влияния агонистов МТ1/МТ2-рецепторов (включая мелатонин) на цикл «сон–бодрствование» и отсутствия значимого ухудшения сна при инактивации обоих типов мелатониновых рецепторов можно сделать вывод об их разной роли в регуляции сна (МТ2-рецепторы влияют на NREM-фазу сна, тогда как МТ1-рецепторы – REM-сон).
Второй доклад касался орексиновой/гипокретиновой системы и ее роли в механизмах засыпания и пробуждения. A.Gotter – главный научный сотрудник отдела нейронаук Научно-исследовательской лаборатории Merck – остановился на потенциале применения антагонистов рецепторов ОР в терапии нарушений сна.
Нейропептиды ОР А и ОР В (также известные как гипокретин 1 и гипокретин 2) были открыты в 1998 г. как регуляторы пищевого поведения. В головном мозге человека имеется около 50 тыс. ОР-продуцирующих нейронов, расположенных в латеральной области гипоталамуса. У млекопитающих действие ОР осуществляется при помощи связывания с двумя G-белковыми рецепторами: ОР1 и ОР2, и если ОА имеет приблизительно равную активность в отношении ОР1 и ОР2, то ОР В имеет в 10 раз большую чувствительность в отношении ОР2.
В результате всестороннего изучения было обнаружено множество физиологических эффектов ОР, доказана его ключевая роль в регуляции цикла «сон–бодрствование», процессах энергетического гомеостаза, подкрепляющего поведения (reward system), наркотической зависимости, состояниях повышенной возбудимости (arousal), регуляции эмоций.
Было установлено, что дефицит ОР приводит к нарколепсии у человека и животных. Это открытие повлекло за собой увеличение количества исследований в области изучения потенциального применения ОР в терапии расстройств сна. Установлено, что процесс пробуждения опосредуется в основном за счет активации ОР2-рецепторов, тогда как инактивация этого типа рецепторов приводит к развитию нарколепсии у собак, мышей и человека, а инактивация ОР1 – развитию «фенотипа легкой сонливости» [23].
В связи с тем, что «нарколепсия–катаплексия» – расстройство, относящееся к циклу «сон–бодрствование», – опосредуется отсутствием ОР, представляется логичным рассматривать заместительную терапию с применением агонистов ОР-рецепторов как потенциально эффективную в лечении этих расстройств. В подтверждение этого было показано, что гиперпродукция ОР-белков у трансгенных мышей с отсутствующими ОР-нейронами предупреждает развитие синдрома нарколепсии [24]. Внутрижелудочковое введение ОР мышам приводило к поддержанию бодрствования, подавлению сна и блокировало приступы катаплексии [24]. Если агонисты ОР способны нивелировать проявления нарколепсии, то антагонисты имеют потенциал в терапии инсомнии. A.Gotter в своем докладе остановился на клиникофармакологических особенностях двойных антагонистов ОР-рецепторов (ДАОР). Было установлено, что применение ДАОР приводит к возникновению сна, не отличающегося по архитектуре фаз от физиологического [25]. В отличие от ГАМКА-модуляторов (эсзопиклона и золпидема) ДАОР не нарушает количественную электроэнцефалограмму крыс во время разных фаз сна [26].
Особый акцент A.Gotter сделал на фармакодинамических и фармакокинетических особенностях ДАОР по сравнению с ГАМКергическими препаратами. Если для наступления клинического эффекта бензодиазепинов необходимо около 27% занятости рецепторов, то для ДАОР этот показатель находится в диапазоне от 63 до 83%. С учетом приведенных нами фармакодинамических особенностей длительный период полувыведения (T1/2) бензодиазепинов обусловливает наличие таких побочных явлений, как дневная сонливость и нарушение когнитивных функций, тогда как препараты ДАОР (Т1/2 около 8 ч) позволяют поддерживать физиологический сон в течение всего периода отдыха, не вызывая побочных эффектов на следующий день [27].
Последующее изучение эффектов ДАОР на процессы сна позволило установить, что препарат не влияет на способность к пробуждению в ответ на пороговые и надпороговые раздражители, это следовало из результатов исследований на лабораторных животных (собаки, макаки Резус), которые просыпались в ответ на надпороговые стимулы (звук сирены) и переставали просыпаться в ответ на субпороговые (шум вентилятора) [28]. Изучение влияния ДАОР на когнитивные функции позволило сделать вывод об отсутствии значимых изменений в когнитивной сфере при применении его в широких терапевтических дозировках в отличие от модуляторов ГАМК [29]. Анализ минимально эффективной дозы для индуцирования сна показал, что ДАОР в дозе 1 мг уже приводит к клиническому эффекту, тогда как для эсзопиклона эта цифра равна 3 мг, диазепама – 5 мг [30]. Кроме того, применение ДАОР не приводит к взаимодействию с алкоголем и не вызывает моторных нарушений у крыс [31].
Хотя большинство современных научных работ по изучению антагонистов ОР сосредоточены на ДАОР, уже сейчас имеются положительные результаты сравнительного исследования ДАОР и селективного антагониста ОР2-рецепторов. Результаты данного исследования не обнаружили различий по эффективности этих веществ в редукции инсомнических нарушений.

Несмотря на большой фармакологический потенциал в терапии инсомнии, к настоящему времени только один препарат (антагонист ОР-рецепторов) одобрен в США к применению в клинической практике. Другие активные молекулы либо находятся на разных стадиях клинических исследований, либо их изучение остановлено в связи с неблагоприятным профилем безопасности (табл. 4).
Таким образом, антагонисты ОР могут использоваться для создания новых лекарственных средств с иным (по сравнению с имеющимися гипнотиками) механизмом действия. Препараты ДАОР ослабляют процессы пробуждения, способствуют засыпанию и поддержанию сна в соответствии с физиологической нормой, а высокая степень связывания с рецепторами и длительный Т1/2 позволяют избежать побочных явлений на следующий день и обеспечить необходимый по продолжительности сон.
Третий доклад был посвящен новому мультимодальному препарату – пиромелатину. Профессор Тель-Авивского университета кафедры нейробиологии N.Zisapel описала механизм действия нового лекарства. Пиромелатин является агонистом МТ1/МТ2-рецепторов мелатонина (снотворное действие, хронобиотическое) и 5НТ1А/D-рецепторов серотонина (анксиолитическое, анальгетическое, содействие засыпанию). Таким образом, пиромелатин имеет два основных гипнотических свойства: ингибирующее действие на пробуждение и синхронизирующий эффект. По результатам преклинических токсикологических испытаний были продемонстрированы широкие рамки безопасности препарата, отрицательные результаты на генотоксичность, отсутствие влияний на сердечно-сосудистую систему и дыхание. Его биодоступность составляет около 75% (у крыс), а Т1/2 – 2,8±1,4 ч.
В исследовании на крысах были продемонстрированы усиление NREM-сна (глубокий сон), а также ослабление b-ритма (пробуждение) наряду с укорочением периода засыпания и продолжительности сна [33]. В продолжении доклада N.Zisapel остановилась на данных клинических испытаний, которые свидетельствуют, что пиромелатин показал хороший профиль безопасности и переносимости, достоверно приводил к увеличению сонливости у испытуемых, не обнаружил способности к кумуляции и не ухудшал связанную со сном консолидацию памяти [34, 35].
Результаты клинического исследования II фазы по оценке эффективности и безопасности пиромелатина у лиц с инсомнией (n=130) длительностью 30 дней с применением двух доз препарата (20 и 50 мг) свидетельствовали об объективном улучшении сна, снижении количества пробуждений (для обеих дозировок) и увеличении общего времени сна. При этом достоверное увеличение общего времени сна отмечалось только при применении 50 мг. Были подтверждены хорошие показатели безопасности и переносимости препарата [36].
Резюмируя свой доклад, N.Zisapel отметила, что пиромелатин может быть использован в лечении инсомнии. Его применение приводит к поддержанию нормального сна и восстановлению архитектуры сна, а данные о безопасности и переносимости не обнаружили значимых отклонений от нормы.
В заключительном докладе J-S.Lin – руководитель лаборатории интегративной физиологии и стимулирующих систем мозга Нейро-научного исследовательского центра (Лион, Франция) – осветил вопросы гистаминовой регуляции процессов засыпания и пробуждения.
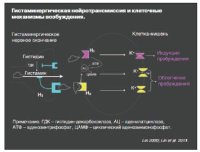
Исследования последних лет показывают, что наряду с ОР неменьшую роль в контроле цикла «сон–бодрствование» играет гистамин. Оба нейромодулятора по-разному, но синергично, осуществляют гипоталамический контроль над процессами засыпания и бодрствования. Если гистамин в основном отвечает за корковую активацию и познавательную деятельность в процессе бодрствования, то ОР активнее вовлечен в механизмы поведенческого возбуждения, мышечного тонуса, двигательной активности, пищевого поведения и эмоционального реагирования. Если рассматривать эти взаимосвязи в контексте нарушения функции сна, то дефицит ОР (как было описано) приводит к нарколепсии, тогда как снижение нейротрасмиссии гистамина приводит к гиперсомнии и чувству дневной сонливости [37]. На клеточном уровне гистаминергическая регуляция осуществляется посредством трех типов рецепторов – это постсинаптические Н1, Н2-рецепторы, отвечающие за индукцию и облегчение пробуждения, и пресинаптический Н3-рецептор, который осуществляет регуляцию гистамина по механизму отрицательной обратной связи (см. рисунок).

Фармакологическая модуляция Н3-рецепторов гистамина может иметь терапевтический потенциал в лечении нарушений сна. Было показано, что агонисты Н3-рецепторов улучшают сон, тогда как обратные агонисты приводят к бодрствованию [38]. Выявлено, что у мышей с дефицитом гистамина наблюдаются сомнолентность и трудности в поддержании состояния бодрствования. С другой стороны, мыши с инактивированными Н3-рецепторами, у которых концентрация гистамина стабильно повышена, показывают улучшение процесса пробуждения в ответ на мотивационный тест. Таким образом, дефицит гистамина является одной из главных причин сонливости [39]. С учетом значительной роли Н3-рецепторов в процессах бодрствования была выдвинута гипотеза, согласно которой антагонисты Н3-рецепторов усиливают синаптическую гистаминовую передачу, что влечет за собой активацию постсинаптических Н1-рецепторов, ответственных за бодрствование. Такое действие может обладать терапевтическим потенциалом в отношении нарколепсии/катаплексии [40]. При сравнительном исследовании таких возбуждающих препаратов, как амфетамин, модафенил и кофеин с антагонистами Н3-рецепторов, был продемонстрирован сопоставимый активирующий эффект, однако только для антагонистов Н3-рецепторов было характерно улучшение дневного бодрствования при сохранении нормального ночного сна и отсутствии эффекта рикошета сна. Похожие результаты были получены при изучении другого антагониста Н3-рецепторов гистамина – питолизанта (GSK189254). Его применение в дозировке 3 и 10 мг/кг у ОР-инактивированных мышей позволило улучшить показатели бодрствования и снизить медленноволновую и парадоксальную фазу сна подобно эффекту модафенила в дозировке 64 мг/кг. Однако в отличие от последнего применение питолизанта привело к сокращению нарколептических эпизодов [41]. Такое потенциально полезное действие антагонистов Н3-рецепторов по улучшению показателей бодрствования, по-видимому, связано с отличным от классического (эффекты психостимуляторов) механизмом действия. Об этом свидетельствует наличие эффекта от психостимуляторов у мышей с инактивированными рецепторами гистамина [42].
Имеющиеся данные относительно действенности антагонистов Н3-рецепторов на явления сонливости получены в основном в экспериментах на лабораторных животных и нуждаются в дальнейшем изучении. Однако уже сейчас имеются данные, доказывающие клиническую эффективность обратимых агонистов гистамина (питолизант) при использовании у подростков с хронической сонливостью, продемонстрировавшие значимое уменьшение сонливости, а также снижение частоты и тяжести катаплексических приступов [43].
Дополнительным плюсом в применении антагонистов Н3-рецепторов гистамина может стать их положительное действие на когнитивные процессы (обучение, память), опосредованное действием на холинергическую и норадренергическую нейромедиаторные системы.
Сонливость связана с разными патологическими состояниями, такими как нарушение дыхания во сне, выраженная дневная сонливость с ночной инсомнией, болезнь Паркинсона и нарколепсия или состояния, связанные со стилем жизни, включая дневную сонливость при сменном графике работы или с «Jet leg». Все это свидетельствует о необходимости поиска новых фармакологических препаратов, позволяющих решать эти проблемы, избегая побочных явлений, имеющихся у уже применяемых лекарственных средств. В этой связи очевидны преимущества антагонистов Н3-рецепторов, обусловленные хорошей изученностью гистаминовой нейротрансмиссии и ее взаимодействий с другими нейромедиаторными системами, более специфичным воздействием на симптомы сонливости с одновременным улучшением когнитивных функций.
Прошедший симпозиум показал перспективы развития фармакологических средств для терапии инсомнии и других расстройств сна. При помощи современных лабораторных и клинических исследований расширяются знания о механизмах действия нейротропных лигандов на активирующие и тормозящие процессы головного мозга, появляются новые данные о патогенетических основах нарушений сна. В то же время, несмотря на разнообразие потенциальных мишеней, новые лекарственные препараты в большинстве своем отсеиваются на разных этапах клинических исследований, то в связи с низкой эффективностью, то по причинам недостаточной безопасности. Что отражает закономерный разрыв между научными данными и наличием эффективных лекарственных средств, доступных для коррекции расстройств сна в клинической практике.
Сведения об авторе:
Марачев Максим Павлович – канд. мед. наук, старший науч. сотр. отдела терапии психических и поведенческих расстройств ФГБУ Федеральный медицинский исследовательский центр психиатрии и наркологии им. В.П.Сербского Минздрава России. E-mail: info@serbsky.ru
Список исп. литературыСкрыть список1. American Academy of Sleep Medicine. International classification of sleep disorders, 3d ed.: diagnostic and coding manual. Westchester, IL: American Academy of Sleep Medicine, 2014.
2. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, 5th ed. (DSM-V). Washington, DC: American Psychiatric Association, 2013.
3. Morin CM, LeBlanc M, Belanger L et al. Prevalence of insomnia and its treatment in Canada. Can J Psychiatry 2011; 56 (9): 540–8.
4. Leger D, Guilleminault C, Dreyfus JP et al. Prevalence of insomnia in a survey of 12,778 adults in France. J Sleep Res 2000; 9: 35–42.
5. Morin CM, LeBlanc M, Daley M et al. Epidemiology of insomnia: Prevalence, self-help treatments, consultations, and determinants of help-seeking behaviors. Sleep Med 2006; 7 (2): 123–30.
6. Ohayon MM, Reynolds CF. Epidemiological and clinical relevance of insomnia diagnosis algorithms according to the DSM-IV and the International Classification of Sleep Disorders (ICSD) Sleep Med 2009; 10 (9): 952–60.
7. Вейн А.М., Хехт К. Сон человека: Физиология и патология. М.: Медицина, 1989. / Vein A.M., Khekht K. Son cheloveka: Fiziologiia i patologiia. M.: Meditsina, 1989. [in Russian]
8. Голенков А.В., Полуэктов М.Г. Распространенность нарушений сна у жителей Чувашии (данные сплошного анкетного опроса). Korsakova/2011/6/11/NEV_2011_06_064. / Golenkov A.V., Poluektov M.G. Rasprostranennost' narushenii sna u zhitelei Chuvashii (dannye sploshnogo anketnogo oprosa). Korsakova/2011/6/11/NEV_2011_06_064. [in Russian]
9. Buysse DJ. Insomnia. JAMA 2013; 309: 706–16.
10. Morin CM, LeBlanc M, Grégoire JP, Savard J. The economic burden of insomnia: direct and indirect costs for individuals with insomnia syndrome, insomnia symptoms, and good sleepers. Sleep 2009; 32: 55–64.
11. Simon GE, VonKorff M. Prevalence, burden, and treatment of insomnia in primary care. Am J Psychiatry 1997; 154 (10): 1417–23.
12. Chong Yi, Fryar CD, Gu Q. Prescription Sleep Aid Use Among Adults: United States, 2005–2010. Nat Health Nutr Exam Surv 2013; 127.
13. Schutte-Rodin S, Broch L, Buysse D et al. Clinical Guideline for the Evaluation and Management of Chronic Insomnia in Adults. J Clin Sleep Med 2008; 4 (5): 487–504.
14. Szabadi E. Drugs for sleep disorders: mechanisms and therapeutic prospects. Br J Clin Pharmacol 2006.
15. Brzezinski A, Vangel MG, Wurtman RJ et al. Effects of exogenous melatonin on sleep: a meta-analysis. Sleep Med Rev 2005; 9 (1): 41–50.
16. Buscemi N, Vandermeer B et al. Efficacy and safety of exogenous melatonin for secondary sleep disorders and sleep disorders accompanying sleep restriction: meta-analysis. BMJ 2006; 332: 385.
17. Wang F, Li J, Wu C et al. The GABA(A) receptor mediates the hypnotic activity of melatonin in rats. Pharmacol Biochem Behav 2003; 74 (3): 573–8.
18. Mailliet F, Galloux P, Poisson D. Comparative effects of melatonin, zolpidem and diazepam on sleep, body temperature, blood pressure and heart rate measured by radiotelemetry in Wistar rats. Psychopharmacology (Berl) 2001; 156 (4): 417–26.
19. Wang F, Zou D, Li JC et al. The role of melatonin receptor and GABAA receptor in the sleeping time prolonged by melatonin in mice. Zhongguo Ying Yong Sheng Li Xue Za Zhi 2003; 19 (4): 402–5.
20. Ochoa-Sanchez R, Comai S, Spadoni G et al. Melatonin, selective and non-selective MT1/MT2 receptors agonists: differential effects on the 24-h vigilance states. Neurosci Lett 2014; 561: 156–61. Doi: 10.1016/j.neulet.2013.12.069. Epub 2014 Jan 7
21. Ochoa-Sanchez R, Comai S, Lacoste B et al. Promotion of non-rapid eye movement sleep and activation of reticular thalamic neurons by a novel MT2 melatonin receptor ligand. J Neurosci 2011; 31 (50): 18439–52. Doi: 10.1523/JNEUROSCI.2676-11.2011.
22. Comai S, Ochoa-Sanchez R, Gobbi G. Sleep-wake characterization of double MT1/MT2 receptor knockout mice and comparison with MT1 and MT2 receptor knockout mice. Behav Brain Res 2013; 243: 231–8.
23. Sakurai T, Mieda M, Tsujino N. The orexin system: roles in sleep/wake regulation. Acad Sci 2010; 1200: 149–61;
24. Sakurai T. The neural circuit of orexin (hypocretin): maintaining sleep and wakefulness. Nat Rev Neurosci 2007; 8 (3): 171–81.
25. Mieda M et al. Orexin peptides prevent cataplexy and improve wakefulness in an orexin neuron-ablated model of narcolepsy in mice. Proc Natl Acad Sci USA 2004; 101: 4649–54.
26. Gotter AL, Garson SL, Stevens J et al. Differential sleep-promoting effects of dual orexin receptor antagonists and GABAA receptor modulators. BMC Neurosci 2014; 15: 109.
27. Fox SV, Gotter AL, Tye SJ et al. Quantitative Electroencephalography Within Sleep/Wake States Differentiates GABAA Modulators Eszopiclone and Zolpidem From Dual Orexin Receptor Antagonists in Rats. Neuropsychopharmacology 2013; 38: 2401–8.
28. Gotter AL, Winrow CJ et al. The duration of sleep promoting efficacy by dual orexin receptor antagonists is dependent upon receptor occupancy threshold. BMC Neurosci 2013; 14: 90.
29. Tannenbaum PL, Stevens J, Renger JJ. Orexin receptor antagonist-induced sleep does not impair the ability to wake in response to emotionally salient acoustic stimuli in dogs. Front Behav Neurosci 2014; 16.
30. Uslaner JM, Tye SJ, Eddins DM et al. 179ra44 Orexin receptor antagonists differ from standard sleep drugs by promoting sleep at doses that do not disrupt cognition. Sci Transl Med 2013; 5 (179).
31. Uslaner JM et al. Orexin Receptor Antagonists Differ from Standard Sleep Drugs by Promoting Sleep at Doses That Do Not Disrupt Cognition. Sci Transl Med 2013; 5: 179ra44.
32. Ramirez AD, Gotter AL et al. Dual orexin receptor antagonists show distinct effects on locomotor performance, ethanol interaction and sleep architecture relative to gamma-aminobutyric acid-A receptor modulators. Front Neurosci 2013; 7: 254.
33. Jacobson LH, Callander GE, Hoyer D. Suvorexant for the treatment of insomnia. Exp Rev Clin Pharmacol 2014; 7 (6): 711–30.
34. Laudon M, Urade Y, Huang Z. A Novel Melatonin Agonist: Effects On Sleep And EEG Power Spectra In Rats. Sleep 2008; 31 (Abstr., Suppl. A34).
35. Yalkinoglu O, Zisapel N, Nir T. Phase-I study of the safety, tolerability, pharmacokinetics and sleep promoting activity of Neu-P11, a novel putative insomnia drug in healthy humans. Sleep 2010; 33: A220.
36. Laudon, M, Katz, A, Metzger, D et al. Tolerability, pharmacokinetic and pharmacodynamic evaluation of multiple ascending doses of Neu-P11 in insomnia patients. Sleep 2012; 35 (Abstr., Suppl. A221).
37. Neurim pharmaceuticals announces positive phase 2 clinical trial results of piromelatine for the treatment of insomnia Zurich, February 18, 2013.
38. Anaclet C, Parmentier R et al. Orexin/Hypocretin and Histamine: Distinct Roles in the Control of Wakefulness Demonstrated Using Knock-Out Mouse Models. J Neurosci 2009; 2604-09.
39. Lin JS, Sakai K, Vanni-Mercier G et al. Involvement of histaminergic neurons in arousal mechanisms demonstrated with H3-receptor ligands in the cat. Brain Res 1990; 523 (2): 325–30.
40. Gondard E, Anaclet C, Akaoka H et al. Enhanced Histaminergic Neurotransmission and Sleep-Wake Alterations, a Study in Histamine H3-Receptor Knock-Out Mice. Neuropsychopharmacology 2013; 38: 1015–31.
41. Lin JS, Sergeeva OA, Haas HL. Histamine H3 Receptors and Sleep-Wake Regulation. J Pharmacol Experim Ther 2011; 336 (1): 17–23.
42. Guo RX, Anaclet C, Roberts JC et al. Differential effects of acute and repeat dosing with the H3 antagonist GSK189254 on the sleep-wake cycle and narcoleptic episodes in Ox−/−mice. Br J Pharmacol 2009; 157:104–117.
43. Parmentiera R, Anacleta C, Guhennecc C et al. The brain H3-receptor as a novel therapeutic target for vigilance and sleep-wake disorders. Biochem Pharmacol 2007; 73 (Issue 8, 15): 1157–71.
44. Inocente C, Arnulf I, Bastuji H et al. Pitolisant, an inverse agonist of the histamine H3 receptor: an alternative stimulant for narcolepsy-cataplexy in teenagers with refractory sleepiness. Clin Neuropharmacol 2012; 35 (2): 55–60.


