Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2016
Современные тенденции в диагностике и лечении посттравматического стрессового расстройства (обзор) №01 2016
Номера страниц в выпуске:52-60
Данный обзор подготовлен по материалам 27-го Конгресса Европейской коллегии нейропсихофармакотерапии (октябрь 2014 г., Берлин) участником проекта «Восточноевропейская академия Всемирной психиатрической ассоциации» и компании «Сервье» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»).
Подход в лечении посттравматического стрессового расстройства существенно изменился благодаря данным современных исследований нейровизуализации, которые позволяют не только исследовать предикторы, но и выявить новые направления в психофармакотерапии этой психопатологии.
Ключевые слова: Европейский колледж нейропсихофармакологии, конгресс, посттравматическое стрессовое расстойство.
Подход в лечении посттравматического стрессового расстройства существенно изменился благодаря данным современных исследований нейровизуализации, которые позволяют не только исследовать предикторы, но и выявить новые направления в психофармакотерапии этой психопатологии.
Ключевые слова: Европейский колледж нейропсихофармакологии, конгресс, посттравматическое стрессовое расстойство.
iryna.frankova@gmail.com
Для цитирования: Франкова И.А. Современные тенденции в диагностике и лечении посттравматического стрессового расстройства (обзор). Психиатрия и психофармакотерапия. 2016; 18 (1): 52–60.
Current courses for diagnostics and treatment of Post-Traumatic Stress Disorder (review)
I.A.Frankova
A.A.Bogomolets National Medical University. 01601, Ukraine, Kyiv, T.Shevchenko bul’var, d. 13
This review describes the current view on posttraumatic stress disorder based on data from nowadays neuroimaging studies, that allows not only to investigate predictors of this psychopathology, but also to identify new approaches to the psychopharmacological treatment.
Key words: European College of neuropsychopharmacology, congress, post-traumatic stress disorder.
iryna.frankova@gmail.com
For citation: Frankova I.A. Current courses for diagnostics and treatment of Post-Traumatic Stress Disorder (review). Psychiatry and Psychopharmacotherapy. 2016; 18 (1): 52–60.
Проблемы диагностики
Пятое издание статистического руководства по психическим расстройствам (DSM-5 – Diagnostic and StatisticalManual of mental disorders) было выпущено в мае 2013 г. Хотя DSM-5 включило в себя крупные новшества в некоторых диагностических категориях (например, расстройства, связанные с развитием нервной системы, и нейрокогнитивные расстройства), основные диагностические критерии для наиболее распространенных психических расстройств у взрослых остаются неизменными в сравнении с предыдущим изданием DSM-IV-TR (2000 г.).
Едва ли слово было изменено в описании и количестве симптомов, необходимых для удовлетворения диагностических критериев для большого депрессивного расстройства (БДР), дистимии, биполярного аффективного расстройства, циклотимии, генерализованного тревожного расстройства, панического и обсессивно-компульсивного расстройства (ОКР).
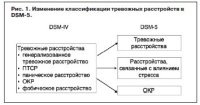
В отличие от этих заболеваний определение посттравматического стрессового расстройства (ПТСР) подверглось значительным изменениям, которые включили перемещение ПТСР из семейства тревожных расстройств в отдельную главу расстройств, связанных с травмой и влиянием стресса, которая в настоящее время включает в себя также расстройства адаптации [1].

Данные нововведения появились с изменением общего подхода к классификации психических расстройств. В DSM-IV-TR к тревожным расстройствам относили генерализованное тревожное расстройство, ПТСР, паническое, фобическое растройства и ОКР [2]. Главным критерием такого рода объединения данных расстройств был фенотипический подход в зависимости отклинических симптомов. В DSM-5 был введен новый, особенный подход – эндофенотипический. Это попытка ученых взглянуть за границы симптомов – данный подход учитывает генетические предпосылки разных заболеваний и, собственно, комплекс симптомов. В таком случае базис классификации меняется в отношении «тревоги» в DSM-5, и тревожные расстройства, ОКР и новая категория расстройств, связанных с травмой и влиянием стресса, основываясь на даных генетических исследований, становятся тремя разными категориями. Уникальность расстройств, связанных с травмой и влиянием стресса, в том, что всегда достоверно известно начало заболевания (рис. 1).
В DSM-5 ПТСР претерпело и ряд других изменений. Например, произошел пересмотр критерия А, помимо прямого воздействия травмы или стресса также теперь учитывается опосредованное влияние вследствие травматизации родных и близких, а также людей, в чьи профессиональные обязанности входит работа, потенциально связанная со стрессом, например, работа с детьми, пережившими насилие [3].
Также появилось три дополнительных симптома (вместо 17–20), произошло разделение кластера уклоняющегося поведения на два отдельных: избегание и негативные изменения когнитивных функций и настроения; 8 из оригинальных 17 симптомов, которые оставались практически неизменными в течение более 25 лет (с DSM-III-R, 1987), были существенно изменены, представляя теперь сложную формулировку и очевидные изменения в значении. Например, «чувство утраты перспективы в будущем» (склонность не рассчитывать на карьеру, брак, возможность иметь детей или нормальную продолжительность жизни) было изменено на «постоянные и преувеличенные негативные убеждения или ожидания от себя, других или окружающего мира (например, «я плохой», «никому нельзя доверять», «мир полностью опасный», «вся моя нервная система полностью разрушена»). Классический симптом эмоционального онемения – «ограниченный диапазон доступных для переживания эмоций» (например, невозможность испытывать чувство влюбленности, любви) был изменен на «стойкая неспособность испытывать положительные эмоции» (например, неспособность испытывать счастье, удовлетворение или любящие чувства). Были добавлены такие симптомы, как приписывание вины (себе или другим), устойчивые отрицательные эмоциональные состояния и рисковое поведение. Возможно, многие из этих изменений связаны с депрессивными симптомами и симптомами дисфории, не специфичными для ПТСР.
Основная цель пересмотра любых психиатрических определений – повышение точности диагностики и клинической эффективности. Хотя существуют убедительные доказательства результативности удаления критерия A2 из DSM-IV-TR (ответ на травму в виде «страха, беспомощности и ужаса»), по данным разных исследований; практически все другие изменения становятся объектом ограничений новых диагностических критериев.
В настоящее время врачи и исследователи, работающие с ПТСР, сталкиваются с проблемами перехода от DSM-IV-TR к DSM-5, так как отсутствует систематизированное сравнение последних опубликованных критериев ПТСР с предыдущим определением; также рекомендованные новые версии скрининговых шкал (PLC-5, CAPS-5 – Clinical-administered PTSD Scale) прошли исключительно предварительную валидизацию, остается до конца неизвестным, как повлияет их применение на изменение уровня распространенности ПТСР среди населения. Неизвестно, улучшит ли использование новых критериев клиническую эффективность, и сколько людей, которые отвечали критериям ПТСР, в соответствии с предыдущим определением будут отвечать новым критериям.
Первое прямое сравнение диагностических критериев ПТСР DSM-5 и DSM-IV-TR, основанное на применении наиболее известных инструментов скрининга в большой выборке военных, обнаружило, что более 30% солдат, которые соответствовали критериям постановки диагноза ПТСР при помощи DSM-IV-TR, не отвечают критериям DSM-5, а эквивалентное число отвечали критериям ПТСР только при использовании DSM-5 [1]. С клинической точки зрения, эти наблюдения поднимают вопрос о том, будет ли применение новых критериев улучшать диагностику и оказание помощи при ПТСР. Актуальность этих данных повышает тот факт, что к 2017 г. ожидается выход Международной классификации болезней 11-го пересмотра.
ПТСР– состояние психического здоровья, которое запускается вследствие воздействия травматического события. Более 90% взрослых по крайней мере один раз в жизни сталкивались с травматическими событиями (например, нападение, стихийное бедствие, дорожно-транспортное происшествие, военные действия, утрата близких). А у 8% из них развивается ПТСР. Это расстройство может сохраняться в течение нескольких лет и осложняется тревожными состояниями, нервными срывами и аддиктивным поведением, что разрушает адаптивные способности жертв, подвергшихся травматическим событиям.
Особый интерес представляет изучение отношения между ПТСР, общим функционированием и качеством жизни (КЖ) пациентов. В ходе сравнения КЖ групп пациентов с/без ПТСР ученые попытались определить переменные, влияющие на КЖ у ветеранов войны во Вьетнаме. В исследовании приняли участие 39 ветеранов с ПТСР и
43 ветерана без ПТСР, набор происходил в Госпитале для ветеранов в Сеуле [4].
Пациенты с ПТСР имели более низкий уровень образования и больше сопутствующих психических расстройств, продемонстрировали значительно более высокий уровень снижения КЖ в целом, а также отдельно по пунктам: общее состояние здоровья, физическое, психологическое благополучие, социальные отношения. Все домены КЖ были значительно ниже, чем в группе ветеранов без ПТСР.
Коморбидность и сопутствующие заболевания при ПТСР
Как упоминалось ранее, лица с ПТСР имеют высокий уровень сопутствующих психических расстройств. Наиболее распространенными сопутствующими психиатрическими расстройствами стали депрессия (66,7%), злоупотребление алкоголем и/или зависимость (33,3%), высокий риск суицидального поведения (25,6%), паническое расстройство (12,8%), дистимическое расстройство (10,3%), генерализованное тревожное расстройство (10,3%).
Существуют также данные о высокой распространенности ОКР у пациентов с ПТСР. ПТСР и ОКР имеют сходные элементы в симптоматике и этиологии. И ПТСР, и ОКР имеют повторяющиеся навязчивые мысли, которые вызывают стресс и которые трудно нейтрализовать; присутствует избегающее поведение, направленное на необходимость избегать любых ситуаций, которые потенциально могут причинить страдания; и включают в себя модели поведения (ритуалы), выполняющиеся для того, чтобы уменьшить беспокойство (M.DeSilvaand, 1999, 2001). ПТСР и ОКР также связаны с негативными мыслями и воспоминаниями, вызывающими и усиливающими тревогу, и приводят к маркировке стимулов и ситуаций как угрожающих (Dinn и соавт., 1999).
Другие, однако, полагают, что повторяющиеся идеи, мысли и образы при ОКР перекрывают текущие навязчивые воспоминания ПТСР и не указывают на коморбидность этих двух заболеваний (Solomon и соавт, 1991; Lipinski, Pope, 1994; Huppert и соавт., 2005).
Недавние исследования поставили перед собой цель изучить, каковы величина и значимость коморбидности ОКР и ПТСР после травматического события. Среди пациентов с ОКР перекрестные исследования показали, что диапазон ПТСР составляет от 12 до 75% (Huppert и соавт., 2005).
Следующее исследование стало первой попыткой систематически оценить распространенность ОКР в выборке лиц с ПТСР. При обследовании населения с ПТСР вследствие боевых операций – было выявлено удивительно большое количество обсессий – у 41% обследованных с ПТСР было диагностировано сопутствующее ОКР, возникшее после воздействия стресса или травматических событий. Эти результаты показывают, что из-за воздействия травматических событий, связанных с боевыми действиями, многие участники (59%) начинают испытывать обсессивно-компульсивные симптомы. Кроме того, для большинства тех, кто ощущает обсесивно-компульсивные симптомы (72%), эти симптомы будут достаточно серьезными, чтобы отвечать критериям ОКР [5].
Исходя из того что ОКР, которое возникает в 45% случаев после воздействия травмы в бою, коморбидно с ПТСР, ученые предполагают, что необходим более тщательный подход к диагностике и обнаружению ОКР при ПТСР.
Следует отметить, что в DSM-5 были введены новые диагностические шкалы для ОКР: ОСD-D-адаптированная шкала из опросника обсессий и компульсий – Florida Obsessive-Compulsive Inventory (FOCI). Для ПТСР– РTSD-D-разработанная шкала на основе краткого опросника стрессовых событий при ПТСР (Stressful Events Survey – PTSD Short Scale). Психометрические свойства и клиническую значимость диагностических шкал в DSM-5 для ОКР и ПТСР еще предстоит определить.
Для изучения конкурентной и дискриминантной валидности, а также надежности и чувствительности диагностических шкал для ОКР и ПТСР, используя диагностические критерии DSM-5, была обследована выборка больных, обращающихся за амбулаторной помощью в Германии [6].
В ходе проведенного исследования было установлено, что обе DSM-5-диагностических шкалы для ОКР и ПТСР показали высокую внутреннюю согласованность, а также корреляцию с концептуально подобными шкалами. Конкурентная и дискриминантная валидность была ниже по сравнению с другими диагностическими шкалами для измерения данных тревожных расстройств. Кроме того, все же чувствительность к изменению не наблюдалась, это может быть объяснено ограниченным размером выборки, которая составляла всего 102 больных, а также небольшим количеством случаев и адаптацией диагностических шкал для немецких пациентов.
Становится очевидным, что необходимы дальнейшее тестирование и оценка психометрических свойств диагностических шкал ОКР и ПТСР, разработаных для DSM-5, а также проведение неклинических и клинических исследований на больших выборках больных.
ПТСР – комплексное полигенное психическое заболевание, находящееся под влиянием средовых и генетических факторов. Травматические события, которые могут вызвать ПТСР, включают массовые сцены убийства, международные, гражданские, политические, этнические и религиозные войны, геноциды, природные и техногенные катастрофы, серьезные несчастные случаи, террористические акты, лишение свободы, торговлю людьми, сексуальное насилие, серьезную медицинскую болезнь, травму, операцию, похищение людей и т.д. Пациентов с ПТСР характеризуют тяжелое эмоциональное состояние, резкое снижение адаптивных способностей и когнитивных функций. Они, как правило, с трудом социализируются, изолируются от общества, возникает высокий риск появления наркотической и алкогольной зависимостей.
Существует доказательство увеличения потребления алкоголя и сигарет после пережитого стресса [7]. Повышение употребления психоактивных веществ (ПАВ) может свидетельствовать о ранней стадии развития психических расстройств, связанных употреблением ПАВ. Знания о факторах, которые связаны с увеличением употребления ПАВ, помогут установить лиц, подверженных риску, и разработать ранние превентивные меры. Исследования среди населения в целом показывают, что ПТСР и депрессии становятся потенциальными факторами риска для увеличения применения ПАВ [8].
Группой исследователей из Германии была изучена корреляция между увеличением ежедневного употребления алкогольных напитков и сигарет и повышением симптомов ПТСР и депрессии в период после военной службы [9]. Всего 360 солдат мужского пола были обследованы непосредственно перед и через 12 мес послевоенной службы. Для получения данных применяли стандартизированное диагностическое интервью (WMH-CIDI) и стандартизированные анкеты. Информация о потреблении алкоголя и сигарет оценивалась в рамках комплексных разделов диагностического интервью об употреблении ПАВ. Вопросы касались количества и частоты потребления алкоголя и сигарет в предыдущие 12 мес, в дальнейшем были рассчитаны среднее суточное потребление этанола (г) и сигарет (количество сигарет). Для оценки симптоматики ПТСР применялись анкета диагностики ПТСР (PCL – PTSD Check List) и скрининговый опросник депрессии (DSQ-34).
Были получены следующие результаты. Средняя сумма ежедневного потребления алкоголя составила 15,9 г (SD=1,3 г), среднее количество сигарет в день – 8,8 (SD=0,5 г). В целом по выборке ежедневное потребление алкоголя сократилось – среднее снижение на 3,0 г (SD=1,2 г), а ежедневное потребление никотина с течением времени увеличилось – среднее увеличение на 1,1 сигареты (SD=0,4).
Однако после коррекции данных с учетом травматического опыта во время военной службы – увеличение баллов по анкете PCL было связано со средним увеличением на 0,6 г повседневного употребления спирта (р=0,005) и средним увеличением на 0,3 сигареты в день (р=0,009). Обе корреляции были статистически значимыми. Увеличение симптомов депрессии не было связано с повышением употребления алкоголя или сигарет в повседневной жизни (p>0,05).Общее увеличение среднесуточного употребления ПАВ в контексте военной службы ограничивается выкуриванием сигарет и является незначимым по величине.
Таким образом, в ходе исследования было установлено, что повышение курения и, особенно, употребления алкоголя происходит только в тех подгруппах солдат, в которых усилились симптомы ПТСР в связи с военной службой.
Будущие исследования должны изучить основные механизмы связи между симптомами ПТСР и увеличением употребления ПАВ. Эти знания в будущем могут служить базой для разработки раннего вмешательства, предотвращения развития или обострения проблем с употреблением ПАВ, так как психические расстройства, связанные с злоупотреблением наркотическими веществами в свою очередь приводят к возникновению аутодеструктивного поведения и повышают суицидальный риск.
В недавних исследованиях был обнаружен также значительный уровень коморбидности между ПТСР и расстройствами пищевого поведения. ПТСР ассоциирован с такими проявлениями расстройств пищевого поведения, как ожирение, недостаточная масса тела, а также нарушение привычек питания – пропуск приема пищи или повышенное употребление газированной воды и пищи быстрого приготовления. Также отмечались такие симптомы, как чувство вины после переедания или заедание в ответ на стресс [10].
У пациентов, страдающих ПТСР в сравнении с больными, пережившими травматическое событие, но без диагноза ПТСР, были обнаружены повышенный индекс массы тела и уровень холестерина в крови. Эти изменения в массе тела и пищевом поведении вместе с низким уровнем физических нагрузок, злоупотреблением алкоголем и ПАВ способствуют ухудшению общего состояния здоровья и повышению показателей сердечной деятельности (артериальное давление, частота сердечных сокращений), а также повышают риск возникновения метаболических заболеваний у пациентов с ПТСР относительно тех, у кого не выражены расстройства пищевого поведения. Данное исследование подтверждает справедливость данных о снижении КЖ в отношении общего состояния физического здоровья у пациентов с ПТСР [11].
ПТСР может быть одной из главных причин, которая влияет на КЖ в целом. Страдания, связанные с ПТСР, выходят за рамки признаков и симптомов психиатрического заболевания, они широко распространяются на области функциональной, профессиональной и социальной адаптации в окружающей среде.
Нейроанатомия при ПТСР
Комлекс исследований показал, что наряду с общим снижением КЖ, общего состояния здоровья у больных с ПТСР отмечаются локальные или диффузные изменения объема головного мозга, что впоследствии приводит к специфическим когнитивным нарушениям. Высокие показатели коморбидности аффективных расстройств и расстройств, связанных с употреблением ПАВ, часто связаны с ПТСР, что еще более усложняет текущие исследования в данном направлении.
Несколько исследований нейровизуализации при ПТСР показали структурные различия в конкретных регионах серого вещества (например, передней части поясной извилины, гиппокампа и миндалевидного тела), а также уменьшение объемов коры головного мозга. Не так давно изменения белого вещества стали мишенью для обширных исследований при ПТСР. В целом сокращение объема белого вещества чаще отмечалось, чем его увеличение [12]. Хотя эти исследования показывают перспективы для дальнейшего изучения ПТСР, наиболее важным в них становится поиск доказательств клинических коррелятов между симптоматикой ПТСР, измерением когнитивных функций и представленными результатами нейровизуализации. Было выдвинуто предположение, что изменения межполушарной связи белого вещества – патофизиологический механизм, приводящий к возникновению симптомов ПТСР и дефициту памяти [13].
В текущих исследованиях ученые постарались сосредоточить свое внимание на количественных показателях, подкорковых и корковых объемах извилин, нейропсихологической оценке, включая оценки IQ (тест Векслера – Wechsler Adult Intelligence Scale – WAIS-R), а также клинических данных. Целью исследования стал поиск конкретных доказательств воздействия ПТСР на показатели объема корковых структур. Была проанализирована разница между группой из 18 пациентов с ПТСР, не имеющих опыта употребления наркотических средств, и 18 человек контрольной группы, подобранных по возрасту [14]. Внимание было сосредоточено на количественных показателях корковых, подкорковых и мозжечковых структурах наряду с нейропсихологической оценкой показателей высшей нервной деятельности.
Результаты показали, что объем коркового серого вещества меньше у пациентов с ПТСР по сравнению с контрольной группой, особенно в лобной и затылочной долях, и является клинически значимым.
Это уменьшение объема коррелирует с клиническими проявлениями. При нейропсихологическом обследовании отмечалось наличие дефицита определенных типов памяти (вербальной, краткосрочной и зрительно-пространственной) и способности концентрировать внимание, в частности, при выполнении сложных задач, которые требуют навыков интеграции разных функций.С другой стороны, было обнаружено увеличение объема спинномозговой жидкости, что указывает на процесс атрофии, эти данные уже сообщались ранее в научной литературе.
Принято считать, что ПТСР характеризуется повышенной активизацией миндалины [15]. Тем не менее эта общая гипотеза в основном базируется на конкретных исследованиях, которые предъявляют стимулы, связанные со страхом/травмой, следовательно, перед исследователями встала задача тщательно изучить общий эмоциональный опыт при ПТСР. Были более детально исследованы другие представляющие интерес области (Regions of Interest), связанные с регуляцией эмоций и ПТСР, такие как гиппокамп, дорсальная зона передней поясной коры (dACC) и подколенная зона передней поясной коры (sgACC). Поскольку важно дифференцировать изменения, связанные с ПТСР, от последствий воздействия стресса/травмы, пациенты с ПТСР сравнивались с группой контроля, участники которой подвергались воздействию стресса, и отдельно – группой здоровых людей.
В исследование были включены 3 группы участников: 1) 29 мужчин, военнослужащих, с диагнозом ПТСР, но не принимавших медикаментозное лечение; 2) 28 мужчин, группа контроля, военнослужащие, без диагноза ПТСР (ВК); 3) 25 мужчин, не имеющих отношение к военной службе (здоровая группа контроля – ЗК) [16]. Всем участникам исследования проводилось функциональное магнитно-резонансное томографирование (фМРТ), во время которого демонстрировались общие нейтральные, негативные и позитивные эмоциональные снимки. Был выполнен анализ всего головного мозга, чтобы исследовать области, которые активируются заданиями.
Затем группы сравнивали по их реакции на положительные или отрицательные по сравнению с нейтральными картинками в 4 областях, представляющих интерес. Кроме того, анализ всего мозга был проведен для того, чтобы изучить группы различий за пределами областей, представляющих интерес. Анализ психофизиологических взаимодействий был выполнен для исследования изменений по отношению к отрицательным снимкам в сравнении с нейтральными. Из-за высокого уровня, сопутствующего БДР в группе ПТСР, отдельно были сопоставлены больные с/без БДР.

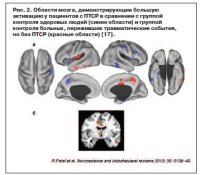
Все группы показали активацию эмоциональной сети, в том числе повышенную двустороннюю активацию миндалины в ответ на отрицательные и положительные изображения, но активация миндалевидного тела не отличалась между группами. Тем не менее у больных с ПТСР по сравнению с группой ЗК на негативный материал наблюдалась повышенная активация dACC. Деактивация медиальной зоны верхней лобной извилины по отношению к негативным картинкам наблюдалась только в группе ЗК, и это существенно отличалось от групп военнослужащих (с ПТСР и ВК). Участники группы с ПТСР показали увеличение функциональных связей между миндалиной и медиальной зоной верхней лобной извилины. Когда пациенты с/без БДР были сопоставлены, у больных с ПТСР и БДР наблюдалось снижение активации sgACC по отношению ко всем картинкам (рис. 2).
Результаты данного исследования не подтверждают общую гипотезу о том, что ПТСР характеризуется общей повышенной активацией миндалины. Вместо этого пациенты с ПТСР продемонстрировали увеличение активации dACC в ответ на демонстрацию отрицательных раздражителей. Предполагается, что эта зона принимает участие в регуляции разнообразных автономных функций, таких как регулирование артериального давления и сердечного ритма. Она также участвует в выполнении когнитивных функций, таких как принятие решений, управление импульсивностью, эмоциями.
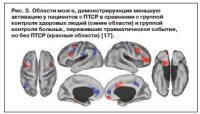
У военнослужащих отсутствовала дезактивация медиальной зоны верхней лобной извилины во время презентации негативных стимулов. Медиальная зона верхней лобной извилины участвует в процессе переключения внимания и контроле исполнительных функций, ответственных за принятие решения, и отключается во время обработки эмоций. Кроме того, только в группе с ПТСР было замечено увеличение функциональных связей между медиальной зоной верхней лобной извилины и миндалиной во время демонстрации негативных изображений. Наконец, снижение активации sgACC было связано с диагнозом БДР в рамках группы участников исследования с ПТСР. sgACC часто участвует в БДР [18], но здесь нейробиологический профиль БДР отличается, так как наблюдался среди пациентов с ПТСР (рис. 3). Именно поэтому будущие исследования ПТСР должны учитывать влияние сопутствующего БДР.
Группой исследователей из Нидерландов в 2014 г. было установлено, что у пациентов с ПТСР по сравнению с группами контроля при проведении фМРТ в состоянии покоя были зарегистрированы изменения в функциональных связях между такими регионами мозга, как миндалина и медиальная префронтальная кора [19]. Наблюдалось снижение объема левой нижней орбитофронтальной извилиныу пациентов с ПТСР по сравнению с группой контроля (р=0,019). В частности, снижение объема функциональных связей между левой нижней орбитофронтальной извилиной и левой покрышкой, правой передней поясной извилиной, двусторонней медиальной поясой извилиной, гиппокампом слева, парагипокампальной извилиной слева, правой миндалиной, медиальной затылочной, нижней затылочной извилинами слева и предклиньем слева.

Таким образом, у больных с ПТСР отмечаются снижение синхронизации между орбитофронтальной зоной и лимбической системой и уменьшение интегрированности в сети нейронов орбитофронтальной области. Орбитофронтальная зона участвует в регуляции эмоций, данные изменения структуры и функции орбитофронтальной зоной уже сообщались ранее в исследованиях у пациентов с ПТСР. Полученные результаты предполагают, что пациенты с ПТСР страдают из-за дисфункционального контроля лобных областей мозга над областями мозга, отвечающими за регуляцию эмоций. Дальнейшее исследование топологии сети и целостности потенциально может быть полезным для прогнозирования реакции на терапию.
Упомянутые данные, что у пациентов с ПТСР наблюдается нарушение способности к эмоциональной обработке и уклонению по отношению к эмоционально негативно окрашенным стимулам, подтверждают также исследования электрической активности головного мозга [20].
Измерения электрической активности проводились с помощью фиксации связанных с событиями потенциалов при электроэнцефалографии (event-relatedpotentials – ERPs). Связанные с событиями потенциалы – это измерение напряжения, генерируемого в структурах головного мозга в ответ на определенные события или стимулы (сенсорные, когнитивные или двигательные). Более формально, это любой стереотипный электрофизиологический ответ на раздражитель. Данный способ изучения мозга обеспечивает неинвазивный способ оценки функционирования мозга у больных с когнитивными нарушениями.
Связанные с событиями потенциалы регистрировались у 14 пациентов с ПТСР и 14 здоровых человек группы контроля в процессе просмотра эмоционально окрашенных картинок (позитивные, нейтральные, негативные) и проведения теста на выбор ответа (с регистрацией времени, затраченного на ответ).
В отличие от результатов в контрольной группе больные с ПТСР показали идентичные ответы мозга по всем эмоциональным категориям; в то время как в контрольной группе в ответ на отрицательные стимулы регистрировались ответы, большие по величине.
Одним из возможных объяснений этого феномена становится сбой в функциональных связях, т.е. миндалине не удается модулировать активность коры на те или иные стимулы разной валентности. Это подтверждается исследованиями с применением фМРТ, которые обнаруживают разрушенные функциональные связи между миндалиной и медиальной префронтальной корой [21].
Недавние исследования демонстрируют наличие значимой корреляции деятельности, связанной с эмоциями между фронтальной t- и b-активностью в теменной зоне в контрольной группе, но не у пациентов с ПТСР [22]. Вместе взятые эти данные подтверждают мнение о нарушении модуляции эмоционального восприятия, вызванные сенсибилизацией и нарушением адаптации к негативным раздражителям при ПТСР. Мы интерпретируем эти находки в контексте тенденции к сверхобобщению при ПТСР.
Предикторы ПТСР
Предположительно, когнитивные нарушения, которыми характеризуется ПТСР, могут возникнуть в результате дисфункции синаптической пластичности. Аксональное наведение, аксональный поиск пути (англ. – аxon guidance, axon pathfinding) – сложный процесс роста аксона к своей цели, зависящий от множества факторов. В период развития нервной системы аксоны преодолевают большие расстояния, с исключительной точностью достигая определенных частей других клеток, формируя сложную архитектуру связей. Изучение взаимодействий, влияющих на выбор пути, важно для лучшего понимания того, как строится мозг, что могло определить его эволюцию, какие факторы способствуют развитию психопатологии.
Neuroprotein Netrin G1 (NTNG1) – аксональное наведение, которое способствует росту аксонов и регулирует образование и функцию синапсов. Комплексин-2 является членом семьи комплексинпресинаптических регуляторных белков. Этот белок регулирует высвобождение нейромедиаторов из нейронов, и его дефицит вызывает когнитивные и поведенческие отклонения, а также он вовлечен в патогенез и прогрессирование многих заболеваний.
Сферой интереса ученых из Армении стало изучение возможной связи NTNG1- и комплексин-2-генетических полиморфизмов, а также уровня в крови комплексина-2 с восприимчивостью к ПТСР. Исследование включило 130 ветеранов боевых действий с ПТСР и равное число по возрасту и полу здоровой контрольной группы [23]. Диагностика больных с ПТСР была проведена при помощи структурированного клинического интервью. Для диагностического и статистического руководства по психическим расстройствам (SCID-I) и шкалы клинической диагностики ПТСР (CAPS). Эксперименты проводились с использованием плазмы крови и образцов геномной ДНК испытуемых. Методологически дизайн был основан на иммуноферментном анализе (ELISA) и полимеразной цепной реакции.
В соответствии с полученными результатами уровень комплексина-2 в сыворотке крови у пациентов с ПТСР был значительно ниже по сравнению с контрольной группой здоровых людей (в 1,2 раза меньше; р<0,03), в то время как NTNG1 rs628117- и CPLX2 rs3892909-генотипы были одинаково распределены в обоих группах. Частота и количество носителей CPLX2-генов rs1366116-T-мутантной аллели были значительно выше у пациентов с ПТСР по сравнению с группой контроля (р=0,006, р=0,02), а также у носителей CPLX2-генов rs1366116-T-мутантной аллели уровни в крови комплексина-2 были в среднем в 1,6 раза ниже (р=0,0029), чем в стандартных аллелях гомозигот. На основании полученных результатов были сделаны выводы, что в патогенез ПТСР вовлечены изменения в синаптической пластичности и что ген CPLX2 rs1366116-T-мутантный аллель представляет фактор риска для возникновения ПТСР.
Благодаря применению своевременного и всестороннего медицинского обследования становится возможным раннее обнаружение пациентов, подверженных риску возникновения ПТСР, что в перспективе может позволить предотвратить развитие данного заболевания. В этом контексте нейротрофический фактор мозга (BDNF – Brain-Derived Neurotrophic Factor) также является весьма перспективным биологическим индикатором ПТСР. Хотя снижение уровня BDNF в плазме сообщалось в отношении лиц с ПТСР, никакой доступной информации не было обнаружено об его содержании в сыворотке крови в ранний период после травмы. С данной целью было проведено проспектовое исследование, которое заключалось в измерении сывороточных уровней BDNF в течение 72 ч после травматического события для определения силы BDNF как предиктора возникновения ПТСР [24]. В проспективном исследовании учувствовали 12 добровольцев, разделенных на 2 группы: 1-я –7 субъектов (в пределах 72 ч подвергшихся травмирующим событиям) и 2-я – 5 субъектов без воздействия травмы в качестве контрольной группы. Изучались оценка по клиническим шкалам: опросник истории травматических событий (THQ – Trauma History Questionnaire) в 1-й день исследования, оценка дистресса, вызванного травматическим событием (PDI – Peritraumatic Distress Inventory) в 1-й день исследования, анкета диссоциативного травматического опыта (PDEQ – Peritraumatic Dissociative Experiences Questionnaire) в 1-й день исследования, структурированное клиническое интервью для DSM-IV в дни 1, 30 и 90-й; и анкета диагностики ПТСР (PCL-S – PTSD CheckList − Specific) в дни 30 и 90-й, а также забор образцов венозной крови и спинномозговой жидкости. BDNF в сыворотке количественно оценивали методом ELISA (RayBio®).
По результатам была выявлена хорошая корреляция (r=0,99) между уровнем BDNF в сыворотке плазмы и спинномозговой жидкости. Сывороточные уровни BDNF были ниже у больных с ПТСР по сравнению с контрольной группой: 8,0±3,0 ng/L по сравнению с 22,0±1,5 ng/L в группе контроля (р<0,0001). Улучшение оценок по клиническим шкалам оценки ПТСР (Post-Traumatic Stress Disorder – PTSD на 30 и 90-й день исследования) коррелирует с уровнем BDNF (r=0,63).
Данное исследование предполагает, что BDNF может быть вовлечен в патофизиологию ПТСР и сывороточный уровень BDNF может рассматриваться как предиктор развития этой патологии.
Нейроэндокринные изменения также являются фактором риска развития ПТСР. Это прежде всего гормоны, которые можно определять простым анализом крови. Было обнаружено, что больные с ПТСР имеют пониженный уровень глюкокортикоидного гормона кортизола в крови и усиленное глюкокортикоидное торможение по механизмам обратной связи. У ученых возник закономерный вопрос – низкий уровень кортизола в ответ на травму это последствие травматического события, так называемый «нейротоксический эффект травмы»? Либо это существующее ранее явление, которое предрасполагает к патологической реакции на стресс?
Было обнаружено, что параллельно могут существовать два типа ответа на хронический стресс. В первом случае отмечаются гиперответ и повышение уровня кортизола.
В другом варианте в связи с дефектом в ответе гипоталамуса снижен синтез серотонина и как следствие – в крови определяется дефицит уровня кортизола – на основании этого было выдвинуто предположение, что пониженный уровень кортизола становится важным предиктором ПТСР.
Современные исследования в данной области касаются вопросов соотношения уровня кортизола в сыворотке крови и выраженности симптомов ПТСР. Для определения корреляции между показателями шкал ПТСР и уровнем кортизола в сыворотке крови производилось измерение утреннего и вечернего уровня кортизола до и после применения теста супрессии дексаметазона. Оценка тяжести симптомов ПТСР проводилась при помощи шкалы клинической диагностики ПТСР (CAPS I, II) и шкалы оценки влияния травматического события (IES) [25].
Уровень коморбидности при ПТСР составлял 66,6%. Он включал депрессию (50%), ОКР (14,6%), специфические фобии (27,1%), социальную фобию (18,8%), соматоформные расстройства (6,3%), панические расстройства (4,2%), тревожные расстройства (2,1%) и психические расстройства, связанные с употреблением ПАВ (4,2%). Сопутствующие заболевания увеличивают тяжесть ПТСР, но уровень кортизола в сыворотке крови ни утром, ни вечером не был связан с сопутствующими заболеваниями. Негативная корреляция была установлена между базальным (утренним) уровнем кортизола в сыворотке крови и степенью тяжести симптомов по шкале CAPS II, навязчивые симптомы и симптомы избегающего поведения (r=-0,31, р=0,04; r=-0,30, р=0,05); также негативная корреляция была между вечерним уровнем кортизола в сыворотке крови и оценкой по шкале IES (r=-0,30, р=0,05); уровнем кортизола в сыворотке после введения дексаметазона и тяжестью симптомов навязчивости по шкале СAPS I (r=-0,37, р=0,01).
Уровень кортизола в сыворотке крови был отрицательно связан с обсессивными симптомами и избегающим поведением при ПТСР. В предыдущих исследованиях [26] данная отрицательная корреляция также прослеживалась. Все эти результаты свидетельствуют о том, что, возможно, уровень кортизола в сыворотке крови у взрослых с ПТСР специфично связан с симптоматикой ПТСР. Эти данные не позволяют окончательно установить причинно-следственную связь. Тем не менее они показывают специфичность патологических нарушений гипоталамо-гипофизарно-надпочечниковой оси при ПТСР.
Психофармакотерапии ПТСР
В 2008 г. S.Mohamed и R.Rosenheck [27] определили лекарственные средства, принимаемые ветеранами войны с ПТСР на протяжени года, чтобы определить продолжительность и вариативность применения психотропных препаратов. Они обнаружили, что 80% больных получали психотропные препараты; 89% были прописаны антидепрессанты, 61% – анксиолитики или снотворные и успокоительные и 34% – антипсихотические препараты. Большая вероятность применения лекарств была связана с более широким использованием услуг в области психического здоровья и наличия сопутствующих психических расстройств. Предикторами назначения медикаментов в каждой из трех групп препаратов были сопутствующие диагнозы: депрессивные расстройства были связаны с использованием антидепрессантов, тревожные расстройства – анксиолитическим или седативными снотворными и психотические расстройства – назначением антипсихотических препаратов. Психотропные препараты разных классов лекарств широко используются в лечении ПТСР у ветеранов войны [27].
Таким образом, авторы пришли к выводу что значительное количество предписанных лекарств скорее всего нацелено на конкретные симптомы (например, бессонница, беспокойство, ночные кошмары или ретроспекции), а не диагностику заболевания и его лечение [28]. Новые исследования эффективности такой симптоматической терапии необходимы для определения влияния психотропных медикаментов на динамику разных симптомов ПТСР.
Также в последнее время значительное внимание уделяется поиску этиологического лечения ПТСР. Основываясь на фундаментальных исследованиях в области патофизиологии, благодаря современным диагностическим возможностям разрабатываются революционно новые подходы в психофармакотерапии ПТСР.
ПТСР является распространенным побочным следствием воздействия травмирующего события. Существует несколько эффективных интервенций, которые препятствуют развитию ПТСР при применении их в ранние сроки после травмы, так называемые «золотые часы».
Факторы риска для развития ПТСР включают нарушение регуляции в центральной системе управления страхом. Острые угрожающие жизни ситуации вызывают страх и реакции физиологического стресса, которые становятся патологическими, когда сила стресса выходит за пределы адаптивных способностей человека и влияние стресса продолжительно во времени. Кортикотропин-рилизинг-фактор (CRF) является ключевым регулятором страха, тревоги, стресс-реакции и контролирует гипоталамо-гипофизарно-надпочечниковую ось (HPA) [29]. Нейрональная экспрессия CRF регулируется фактором транскрипции CREB и его кофактор CRTC3 (CRTC3 – CREB regulated transcription coactivator 3 представляет собой белок, который у человека кодируется геном CRTC3). CREB (cAMP response element-binding protein) – транскрипционный фактор. Он связывается с определенными последовательностями ДНК, которые называются CRE (cAMP response elements), регулируя (усиливая или ослабляя) транскрипцию соответствующих генов. В ходе исследований было доказано, что нейропептид окситоцин оказывает анксиолитическое [30] и антистресс-воздействие [31], например, в гипоталамо-паравентрикулярном ядре (PVN).
Тем не менее лежащие в основе молекулярные механизмы этих эффектов неизвестны, но важны для поисков фармакологического воздействия, которые могут смягчить преувеличенную реакцию на стресс. Было выдвинуто предположение, что окситоцин ингибирует активность оси HPA непосредственно через изменение экспрессии гена CRF и предотвращение CRTC-транслокации.
Результаты исследования показали, что окситоцин контролирует экспрессию гена CRF путем модуляции уровня ядерного CRTC3, таким образом ослабляя/задерживая синтез CRF во время начальной фазы острой стрессовой реакции. Взятые вместе результаты показывают, что окситоцин действует на ген CRF, модулируя острый отклик системы на стресс. Таким образом, лекарственные средства, такие как окситоцин, которые нацелены на CRTC3-активность, могут представлять новых кандидатов для лечения расстройств, связанных со стрессом.
Интраназальный окситоцин (ИО) является перспективной новой стратегией терапии предотвращения ПТСР в ранние сроки после травмы, так как он непосредственно направлен на факторы риска, связанные с развитием ПТСР [32].
Было изучено воздействие одного интраназального введения ИO. Введение ИО производилось больным, недавно подвергшимся влиянию травматических событий с повышенным риском развития ПТСР [33].
В рандомизированном двойном слепом плацебо-контролируемом исследовании принял участие 41 человек (17 мужчин). Отбор участников производился в отделении неотложной помощи, оценивались последствия влияния потенциально травматического события в соответствии с DSM-IV.
Риск развития ПТСР с помощью анкеты измерения острых симптомов ПТСР
Для изучения нейронной реактивности в отношении разных эмоциональных выражений лица (т.е. страшное, счастливое, нейтральное) использовали фМРТ. Участникам было проведено фМРТ в течение 11 дней после травмы либо введения ИО (40 Ед/мл) или введения плацебо. На II этапе исследования были оценены эффекты терапии ИО для каждого выражения лица отдельно. Регионами интереса в данном исследовании стали левая и правая миндалина, левая и правая веретенообразная извилина, а также левая и правая нижняя лобная извилина.
При всех условиях и для всех участников тест с лицами вызвал определенную активность в областях мозга, отвечающих за обработку лиц (т.е. веретенообразная извилина и миндалины билатерально). По сравнению с плацебо интраназальным введение ИО уменьшало химическую активность в правой нижней лобной извилине независимо от эмоциональной окраски мимики демонстрируемых лиц; в правой веретенообразной извилине – во время обработки счастливых и ужасных лиц; и в левой веретенообразной извилине – во время обработки счастливых лиц.
Полученные результаты свидетельствуют о том, что ИO модулирует реактивность областей мозга, участвующих в регуляции страха, путем уменьшения реактивности правой нижней лобной извилины и веретенообразной извилины в процессе обработки лиц. Эффект ИО в веретенообразной извилине специфичен для обработки устрашающих (левая и правая веретенообразная извилина) и счастливых лиц (правая веретенообразная извилина).
Кроме того, поскольку применялась одна доза ИО, в дальнейшем дозозависимые исследования должны исследовать возможные дифференциальные последствия многократных доз введения ИО на реактивность мозга в этой группе населения.
Стресс вызывает структурные изменения в структуре головного мозга и способствует возникновению ПТСР. Геномная реакция на стресс частично состоит в изменении деятельности транспозонов (transposable element – transposon) – участков ДНК, способных к передвижению (транспозиции). Механизмы действия стресса и формирования ПТСР у человека связаны с деятельностью ретротранспозонов LINE1, L1 в разных тканях. Эндогенная ретротранспозиция элементов L1 была предложена в качестве одного из потенциальных механизмов, генерирующих различия генома нейрона. Элементы L1 способны к вставке в новых местах генома, что может привести к пагубным результатам. Наибольший интерес представляет изучение этих процессов в головном мозге из-за индивидуальной изменчивости нервных процессов с целью поиска эффективной фармакотерапии. Гиппокамп – очень пластичная область мозга, особенно чувствительна к воздействию нагрузок от окружающей среды. Целью проведеной работы было изучение влияния стресса на изменение паттернов вставки LINE1 в гиппокампе [34].
Использовалась модель эмоционального стресса для формирования ПТСР в двух линиях крыс с генетически обусловленными различиями в уровне возбудимости нервной системы (низкой и высокой). Изучалось влияние болевого стресса (3 типов: краткосрочный, долгосрочный и массивный стресс) на полиморфизм паттерна вставки
LINE1 ретротранспозонов в зубчатой извилине гиппокампа.
L1-вставки в промотор гена GRIN1 – подтип глутаматчувствительных рецепротов N-метил-D-аспартата (NMDA), субъединицы 1 – изучался двухшаговой полимеразной цепной реакцией. Рецепторы глутамата NMDA играют ключевую роль в синаптической пластичности, синаптогенезе, эксайтотоксичности, приобретении памяти и способности к обучению. Эти рецепторы опосредуют нейронные функции глутамата в синапсах. NMDA-опосредованная нейротрансмиссия в гиппокампе участвует в когнитивных и эмоциональных нарушениях из-за расстройств, вызванных стрессом. Субъединица 1 NMDA-рецептора является одной из основных молекул в комплексе рецептора NMDA. Экспрессия GRIN1 связана с эффективностью нейротрансмиссии и состоянием нервной системы. Авторы полагают, что вставки L1-ретротранспозона в промотор гена GRIN1 будут изменять экспрессию GRIN1.
Было установлено, что паттерн вставки L1 зависит от уровня возбудимости нервной системы, интенсивности и длительности воздействия напряжения. Наиболее переменный спектр активности транспозонов L1 обнаруживается под действием массивного стресса у крыс с низкой возбудимостью нервной системы. Было выдвинуто предположение, что вставки L1-ретротранспозона принимают участие в регуляции экспрессии генов, связанных с реакцией на стресс и формировании психопатологии.
Патофизиология ПТСР связана с преобладанием процессов перевозбуждения. Предположительно, в основе патологических изменений при ПТСР лежит феномен эксайтотоксичности. В 1994 г. J.Olney предложил гипотезу эксайтотоксической смерти нейронов. Физиологически стрессовая ситуация сопровождается выделением миллимолярных концентраций глутамата, который присутствует в синаптической щели в течение нескольких миллисекунд. Избыток глутамата выводится спустя 30 мин, но при продолжающемся стрессовом воздействии возбуждение нейронов не проходит, уровень глутамата не снижается, возникает патологическая гиперстимуляция глутаматчувствительных NMDA-рецепротов. В результате процессов перевозбуждения нейронов и микроглии происходит экзоцитоз (выход содержимого клетки наружу). Известно, что при выделении избытков глутамата микроиглою посредством экзоцитоза также может напрямую повреждать нейроны. В результате экзоцитоза происходят резкое увеличение концентрации внеклеточного глутамата, дополнительная гиперактивация глутаматных рецепторов и последующая серия нейродегенеративных реакций клетки. Таким образом, последствием эксайтотоксичности является оксидативный стресс. Под влиянием фосфолипаз происходит распад фосфолипидных комплексов наружной мембраны, мембран митохондрий, внутриклеточных органелл. Возникает цепная реакция перекисного окисления липидов. Конечные продукты перекисного окисления липидов: малоновый диальдегид, ненасыщенные жирные кислоты (особенно арахидоновая) и свободные радикалы кислорода. Нейроны особенно чувствительны по отношению к оксидативному стрессу. Избыток свободных радикалов опасен для фосфолипидов мембран нейронов и приводит к нарушениям передачи сигнала, обработки информации.
Клинически эксайтотоксичность характеризуется разными видами хронических и/или острых стрессовых реакций, вегетативными расстройствами, неврологической патологией, которые диагностируются клинически при объективном обследовании (неврологический статус, психический статус, патологические рефлексы, расстройства психики и когнитивных способностей).
Некоторые антидепрессанты воздействуют на глутаматергическую систему. Так, механизмы действия ингибиторов обратного захвата серотонина способны блокировать многие изменения глутаматергической нейротрансмиссии в гиппокампе, вызванные стрессом. Однако антидепрессанты не оказывают влияния на повышенный уровень глутамата и не предотвращают процессы эксайтотоксичности. На этапах транспорта и захвата в метаболизме глутамата участвует органический селен (Se). При недостатке Se наблюдались необратимые повреждения нервной ткани, возникшие изначально на фоне оксидативного стресса. Один из наиболее активных ферментов из системы антиоксидантов – Se-зависимый фермент глутатионпероксидаза (GPx). Обязательным условием работы GPx является присутствие Se. В ходе проспективного рандомизированного плацебо-контролируемого исследования, проведенного у Латвийского контингента международных операций до и после участия в миротворческой миссии в Афганистане, было установлено что в результате применения органического Se значимо повышается активность GPx и снижается липидная переоксидация. Применение органического Se может быть рекомендовано с целью коррекции оксидативного стресса и его последствий у пациентов с риском развития ПТСР. В целях профилактики ПТСР и снижения степени его тяжести органический Se может быть рекомендован в дозировке 200 мкг в день длительно в течение 6 мес [35].
Нарушения, которые оказывают расстройства, связанные с влиянием стресса на функционирование в социальной, профессиональной и семейной сфере, и снижение удовлетворенности КЖ, подчеркивают важность поиска и разработки новых стратегий в психофармакотерапии на разных этапах воздействия травмы, которые помогут вернуть пациентов к нормальной жизни, оставив травматическое событие в прошлом, для того, чтобы вспоминать его, но не переживать постоянно.
Данный обзор подготовлен по материалам 27-го Конгресса Европейской коллегии нейропсихофармакологии (октябрь 2014 г., Берлин) участниками Образовательной программы Восточно-Европейской академии Всемирной психиатрической ассоциации и компании «Сервье» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»).
Сведения об авторе
Франкова Ирина Александровна – ассистент каф. психосоматической медицины и психотерапии НМУ им. А.А.Богомольца.
E-mail: iryna.frankova@gmail.com
Список исп. литературыСкрыть список1. Hoge CW, Rivie LA, Wilk JE et al. The prevalence of post-traumatic stress disorder in US combat soldiers: a head-to-had comparison of DSM-5 versus DSM-IV-TR symptom criteria with the PTSD checklist. Lancet Psychiatry 2014; 1 (Issue 4): 269–77.
2. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, fourth Edition: (DSM-IV-TR). Washington DC: American Psychiatric Publishing, 2000.
3. American Psychiatric Association. Diagnostical and Statistical Manual of Mental Disorders, 5th Edition: (DSM-5). Arlington, VA: American Psychiatric Publishing, 2013.
4. Choi JH, So HS, Kim TY et al. Seoul Veterans Hospital, Dept. of Neuropsychiatry, Seoul, South-Korea; The relationship between posttraumatic stress disorder and the quality of life among the Vietnam war veterans. Neuropsychopharmacology 2014; 24: S678.
5. Nacasch N, Fostick L, Zohar J. High prevalence of obsessive-compulsive disorder among posttraumatic stress disorder patients Published Online: April 07, 2011.
6. Knappe S, Mark T, Hoye J et al. Beesdo-Baum. Limited psychometric properties of the DSM-5 dimensional assessment scales for OCD and PTSD. Eur Neuropsychopharmacol 2014; 24: S598.
7. Swendsen J, Conway KP, Degenhardt L et al. Mental disorders as risk factors for substance use, abuse and dependence: results from the 10-year follow-up of the National Comorbidity Survey. 2010; 105: 1117–28.
8. Vlahov D, Galea S, Ahern J et al. Consumption of cigarettes, alco- hol, and marijuana among New York City residents six months after the September 11 terrorist attacks. Am J Drug Alcohol Abuse 2004; 30: 385–407.
9. Trautmann S, Schönfeld S, Behrendt S, Wittchen HU. Increase in PTSD but not depression symptoms is associated with increases in alcohol and cigarette consumption after military deployment. Eur Neuropsychopharmacol 2014; 24: S700–S701.
10. Godfrey KM, Lindamer LA, Mostoufi S, Afari N. Post- traumatic stress disorder and health: a preliminary study of group differences in health and health behaviors. Ann Gen Psychiatry 2013; 12: 30.
11. Bertelloni C, Carmassi C, Manni C et al. Impairment in eating habits among 512 earthquake survivors: role of gender and DSM-5 PTSD. Eur Neuropsychopharmacol 2014; 24: S604–S605.
12. Daniels JK, Lamke JP, Gaebler M et al. White matter integrity and its relationship to PTSD and childhood trauma-a systematic review and meta-analysis. Depress Anxiety 2013; 30 (3): 207–16.
13. Saar-Ashkenazy R, Guez J, Jacob Y et al. Diffusion tensor imaging in posttraumatic patients: the role of the corpus-callosum in PTSD symptomatology and memory impairments. Eur Neuropsychopharmacol 2014; 24: S321.
14. Koukouna D, Bossini L, Casolaro I et al. The impact of trauma on global and specific function as evidenced by neuroimaging of post-traumatic stress disorder subjects. Eur Neuropsychopharmacol 2014; 24: S589.
15. Shin LM, Rauch SL, Pitman RK. Amygdala, medial prefrontal cortex, and hippocampal function in PTSD. Ann NY Acad Sci 2006; 1071: 67−79.
16. Van Rooij SJH, Rademaker AR, Kennis M et al. Neural correlates of non-trauma related emotional processing in war veterans with posttraumatic stress disorder. Eur Neuropsychopharmacol 2014; 24: S81.
17. Patel R, Spreng RN, Shin LM, Girard TA. Neurocircuitry models of posttrauamtic stress disorder and beyond: A meta-analysis of functional neuroimaging studies. NeurosciBiobehav Rev 2012; 36: 2130–42.
18. Drevets WC, Price JL, Jr. Simpson JR et al. Subgenual prefrontal cortex abnormalities in mood disorders. Nature 1997; 386: 824–7.
19. Bullmore E, Sporns O. Complex brain networks: graph theoretical analysis of structural and functional systems. Nat Rev Neurosci 2009; 10: 186–98.
20. Van Rooij SJH, Rademaker AR, Kennis M et al. Geuze. Altered event-related potentials during visual emotional stimulation in posttraumatic stress disorder. Eur Neuropsychopharmacol 2014; 24: S296–S297.
21. Pascual-Marqui RD. Standardized low-resolution brain electromagnetic tomography (sLORETA): technical details. Methods Find Exp Clin Pharmacol 2002; 24 (Suppl. D): 5–12.
22. Cohen JE, Shalev H, Admon R et al. Emotional brain rhythms and their impairment in post-traumatic patients. Hum Brain Mapp 2012; 14 (10): 21516.
23. Avetyan D, Mkrtchyan G, Boyajyan A. Synaptic plasticity changes in combat veterans with posttraumatic stress disorder. Eur Neuropsychopharmacol 2014; 24: S585.
24. Belhadj-Tahar H, Vilamot B, Granberg M, Passamar M. Brain-derived neurotrophic factor (BDNF) as a predictive factor for post-traumatic stress disorder (PTSD). Eur Neuropsychopharmacol 2014; 24: S594–S595.
25. Horn CA, Pietrzak RH, Corsi-Travali S, Neumeister A. Linking plasma cortisol levels to phenotypic heterogeneity of posttraumatic stress symptomatology. Psychoneuroendocrinology 2014; 39: 88–93.
26. Dekel S, Ein-Dor T, Gordon KM et al. Cortisol and PTSD symptoms among male and female high-exposure 9/11 survivors. J Trauma Stress 2013; 26(5): 621–5.
27. Mohamed S, Rosenheck RA. Pharmacotherapy of PTSD in the U.S. Department of Veterans Affairs: Diagnostic- and Symptom-Guided Drug Selection. 1. J Clin Psychiatry 2008; e1–7.
28. Kozarić-Kovačić D. Psychopharmacotherapy of Posttraumatic Stress Disorder. Croat Med J 2008; 49(4): 459–75.
29. Jurek B, Slattery DA, Liu Y et al. Oxytocin controls the CRF gene via CRTC3: implications for stress-related disorders. Eur Neuropsychopharmacol 2014; 24: S580–S581.
30. Jurek B, Slattery DA, Maloumby R et al. Differential contribution of hypothalamic MAPK activity to anxiety-like behaviour in virgin and lactating rats. PloS ONE 2012; 7: e37060.
31. Neumann ID, Wigger A, Torner L et al. Brain oxytocin inhibits basal and stress-induced activity of the hypothalamo-pituitary-adrenal axis in male and female rats: partial action within the paraventricular nucleus. J Neuroendocrinol 2000; 12: 235–43.
32. Frijling JL, Van Zuiden M, Koch SBJ et al. Efficacy of oxytocin administration early after psychotrauma in preventing the development of PTSD: study protocol of a randomized controlled trial. BMC psychiatry 2014; 14(1): 92.
33. Frijling JL, Van Zuiden M, Koch SBJ et al. Olff. Intranasal oxytocin modulates neural processing of emotional faces in recently traumatised individuals at increased risk for PTSD. Eur Neuropsychopharmacol 2014; 24: S602.
34. Zachepilo TG, Kalendar RN, Schulman AH et al. Emotionally painful stress causes changes in L1 insertion pattern in the hippocampus in rats with different nervous system excitability Eur Neuropsychopharmacol 2014; 24: S163.
35. Войцеховскис В.В., Войцеховска Ю.Г., Шкестерс А. и др. Возможности применения органического селена у пациентов с риском развития ПТСР. Биомедицинская химия. 2014; 1: 125–32. / VoitsekhovskisV.V., VoitsekhovskaIu.G., ShkestersA. idr. Vozmozhnosti primeneniia organicheskogo selena u patsientov s riskom razvitiia PTSR. Biomeditsinskaia khimiia. 2014; 1: 125–32. [in Russian]
10 февраля 2016
Количество просмотров: 4121


