Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2016
Хемореактомное моделирование эффектов этифоксина №05 2016
Номера страниц в выпуске:10-17
Впервые проведено моделирование биологических свойств этифоксина (действующее начало препарата Стрезам). Для данной молекулы получены достоверные оценки более 2500 биологических активностей и проведено сравнение с контрольным препаратом – лоразепамом (бензодиазепин). Результаты хемореактомного моделирования позволяют предположить существенные различия между фармакологическими эффектами этифоксина и исследованного бензодиазепина: 1) в селективности связывания рецепторов различных нейротрансмиттеров; 2) противовоспалительном действии; 3) действии на гемодинамику и состояние стенок сосудов; 4) наличии побочного действия; 5) фармакокинетических параметрах. Полученные результаты соответствуют имеющимся экспериментальным и клиническим данным и указывают на перспективные направления терапевтических применений этифоксина.
Ключевые слова: хемореактомный анализ, биоинформатика, этифоксин.
unesco.gromova@gmail.com
Ключевые слова: хемореактомный анализ, биоинформатика, этифоксин.
unesco.gromova@gmail.com
Впервые проведено моделирование биологических свойств этифоксина (действующее начало препарата Стрезам). Для данной молекулы получены достоверные оценки более 2500 биологических активностей и проведено сравнение с контрольным препаратом – лоразепамом (бензодиазепин). Результаты хемореактомного моделирования позволяют предположить существенные различия между фармакологическими эффектами этифоксина и исследованного бензодиазепина: 1) в селективности связывания рецепторов различных нейротрансмиттеров; 2) противовоспалительном действии; 3) действии на гемодинамику и состояние стенок сосудов; 4) наличии побочного действия; 5) фармакокинетических параметрах. Полученные результаты соответствуют имеющимся экспериментальным и клиническим данным и указывают на перспективные направления терапевтических применений этифоксина.
Ключевые слова: хемореактомный анализ, биоинформатика, этифоксин.
unesco.gromova@gmail.com
Для цитирования: Торшин И.Ю., Громова О.А., Федотова Л.Э., Громов А.Н. Хемореактомное моделирование эффектов этифоксина. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2016; 18 (5): 10–17.
For the first time the simulation of biological properties etifoxine (Stresam active principle of the drug). For this may molecule obtained reliable estimates of more than 2500 biological activities and a comparison with the control preparation – lorazepam (benzodiazepine). Hemoreaktomic simulation results suggest significant differences etifoxine between pharmacological effects and investigated benzodiazepine in: 1) receptor binding selectivity of various neurotransmitters; 2) anti-inflammatory effect; 3) action on hemodynamics and the condition of the vessel walls; 4) the presence of side effects; 5) pharmacokinetic parameters. The results correspond to the available experimental and clinical data, and point to promising eg etifoxine board of therapeutic applications.
Key words: hemoreaktomic analysis, bioinformatics, etifoxine.
unesco.gromova@gmail.com
For citation: Torshin I.Yu., Gromova O.A., Fedotova L.E., Gromov A.N. Hemoreactomic etifoxine modeling effects. Psychiatry and Psycho-pharmacotherapy (P.B.Gannushkin Journal). 2016; 18 (5): 10–17.
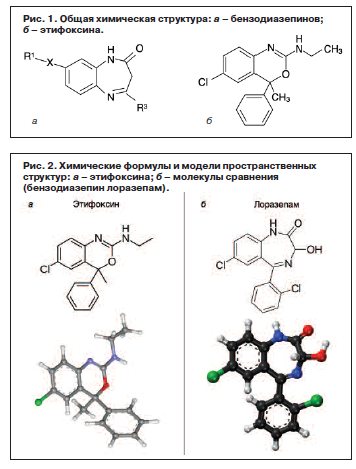 Этифоксин модулирует ГАМКергическую трансмиссию и используется как анксиолитическое (противотревожное) лекарственное средство. С химической точки зрения молекула этифоксина не является производным бензодиазепинов (рис. 1). Тем не менее этифоксин не только превосходит большинство бензодиазепинов по выраженности ГАМКергического транквилизирующего эффекта, но и обладает другими полезными свойствами (например, антиконвульсантными) [1]. Показаниями для назначения этифоксина считаются тревожные состояния, страх, внутреннее напряжение, депрессивный настрой пациента.
Этифоксин модулирует ГАМКергическую трансмиссию и используется как анксиолитическое (противотревожное) лекарственное средство. С химической точки зрения молекула этифоксина не является производным бензодиазепинов (рис. 1). Тем не менее этифоксин не только превосходит большинство бензодиазепинов по выраженности ГАМКергического транквилизирующего эффекта, но и обладает другими полезными свойствами (например, антиконвульсантными) [1]. Показаниями для назначения этифоксина считаются тревожные состояния, страх, внутреннее напряжение, депрессивный настрой пациента.
Основным фармакологическим действием этифоксина является усиление ГАМКергической трансмиссии посредством активации А-рецептора ГАМК. В отличие от бензодиазепинов этифоксин связывается с аллостерическим сайтом в молекуле ГАМК-рецептора, что приводит к усилению активности последнего под воздействием эндогенного ГАМК. Кроме того, этифоксин осуществляет модуляцию ГАМКергической активности за счет активации синтеза нейростероидов, которые, как известно, повышают чувствительность ГАМКА-рецепторов к ГАМК [2].
Приводимые факты общеизвестны. Более детального сравнения фармакодинамических и фармакокинетических свойств этифоксина и бензодиазепинов не проводилось. Известны отдельные детали: например, то, что этифоксин взаимодействует с аллостерическим сайтом ГАМКА-рецепторов, а бензодиазепины – с основным сайтом или что бензодиазепины способствуют формированию пониженного артериального давления (АД), а этифоксин – нет, и т.п.
В настоящей работе представлены результаты сравнительного анализа свойств этифоксина и примера молекулы бензодиазепина с использованием нового направления в постгеномной медицине – хемореактомного моделирования. Оценка эффективности и безопасности лекарственных средств на основе их молекулярной структуры является важнейшей задачей постгеномной медицины.
В рамках постгеномной парадигмы множество всех генов организма данного вида (геном) предоставляет информацию для синтеза всех белков организма (протеом), активность которых приводит к образованию всех метаболитов организма (метаболом) через осуществление всей совокупности химических реакций, протекающих в организме (реактом) [3].
Молекула потенциального лекарственного средства «мимикрирует» под определенные метаболиты (вследствие наличия тех или иных сходств в химической структуре) и, связываясь с теми или иными белками протеома, производит соответствующие данному лекарству эффекты (как позитивные, так и негативные), что и позволяет выявить хемореактомный анализ. Таким образом, совокупность всей имеющейся для анализируемой молекулы информации о взаимодействии с белками протеома (профиль сродства) позволяет сделать обоснованные выводы о потенциальных эффектах этой молекулы.
В настоящей работе проводится анализ фармакологических «возможностей» химической структуры этифоксина на основе хемоинформационного подхода – т.е. сравнения химической структуры молекулы этифоксина (молекулярной структуры с недостаточно изученными молекулярно-фармакологическими свойствами) с миллионами других молекул, для которых молекулярно-фармакологические свойства известны. Данное сравнение проведено с использованием современных методов хемоинформационного анализа [4, 5], которые разрабатываются в научной школе академика РАН Ю.И.Журавлева [4–9].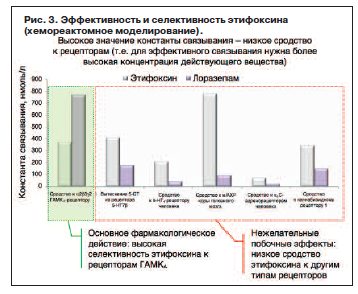 Хемоинформатика – область исследований на стыке структурной химии, фармакологии и биоинформатики, в которой взаимосвязи типа «химическая структура – свойство вещества» исследуются методами современной информатики. Хемоинформационный анализ позволяет найти молекулы, схожие с исследуемой, и, соответственно, предположить физиологические, фармакологические и другие свойства исследуемой молекулы на основе имеющейся информации о свойствах молекул, наиболее близких по структуре.
Хемоинформатика – область исследований на стыке структурной химии, фармакологии и биоинформатики, в которой взаимосвязи типа «химическая структура – свойство вещества» исследуются методами современной информатики. Хемоинформационный анализ позволяет найти молекулы, схожие с исследуемой, и, соответственно, предположить физиологические, фармакологические и другие свойства исследуемой молекулы на основе имеющейся информации о свойствах молекул, наиболее близких по структуре.
Особый подраздел хемоинформатики, хемореактомный анализ, направлен на оценку биологических активностей исследуемой молекулы (в частности, моделирование профиля сродства исследуемой молекулярной структуры к различным белкам протеома). В настоящей работе был проведен сравнительный хемореактомный анализ молекул этифоксина и бензодиазепина лоразепама (рис. 2).
При проведении хемоинформационного анализа использован новый математический метод, основанный на комбинаторной теории разрешимости [4–7]. Она представляет собой развитие алгебраического подхода к задачам распознавания, является современным инструментом для исследования признаковых описаний объектов. В случае задачи установления молекул, химическая структура которых схожа с заданной, объектами исследования становятся хемографы. Хемограф (χ-граф) – особая разновидность графа (т.е. математического объекта, являющегося совокупностью множества вершин и множества ребер – связей между вершинами). Хемографом называется конечный, связный, неориентированный, размеченный граф без петель с кликовым числом, не превышающим 3. В рамках комбинаторной теории разрешимости χ-графы рассматриваются как объекты, а их инварианты (или кортежи инвариантов) – как признаковые описания объектов [4]. В применении к хемографам практически важны теоремы о полноте кортежей-инвариантов произвольного хемографа и соответствия критерия полноты инварианта критерию разрешимости/регулярности [5], основной результат которых можно записать в следующей форме:
(1)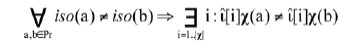 где Pr ⊂ Iн ¥ Iк – множество прецедентов графов (полученный из заданного набора молекулярных структур), Iн – множество начальных информаций (вектора îc), Iк – множество конечных (финальных) информаций, iso(G) – метка, указывающая на принадлежность графа G к некоторому классу изоморфных графов (очевидна из описаний молекулы в базе данных химических структур) в Iк, c – множество элементарных χ-инвариантов (фрагментов химической структуры), îc – кортеж-инвариант (список фрагментов структур, применимый к структуре любой молекулы). Если условие (1) выполнено для заданного множества χ, то χ обеспечивает разрешимость задачи над Pr и позволяет систематически исследовать все фрагменты углеродных скелетов органических молекул. Если множество Pr регулярно, т.е. не содержит двух идентичных хемографов (молекул), то множество χ устанавливается на основе стандартного подхода к вычислению характеристической функции множества информативных значений признаков T(a) [11] для множества χ, так что T(a), a ∈ c определяется на основе выбора элемента кортеж-инварианта (т.е. типа фрагмента углеродного скелета) с наибольшим рангом информативности a:(2)
где Pr ⊂ Iн ¥ Iк – множество прецедентов графов (полученный из заданного набора молекулярных структур), Iн – множество начальных информаций (вектора îc), Iк – множество конечных (финальных) информаций, iso(G) – метка, указывающая на принадлежность графа G к некоторому классу изоморфных графов (очевидна из описаний молекулы в базе данных химических структур) в Iк, c – множество элементарных χ-инвариантов (фрагментов химической структуры), îc – кортеж-инвариант (список фрагментов структур, применимый к структуре любой молекулы). Если условие (1) выполнено для заданного множества χ, то χ обеспечивает разрешимость задачи над Pr и позволяет систематически исследовать все фрагменты углеродных скелетов органических молекул. Если множество Pr регулярно, т.е. не содержит двух идентичных хемографов (молекул), то множество χ устанавливается на основе стандартного подхода к вычислению характеристической функции множества информативных значений признаков T(a) [11] для множества χ, так что T(a), a ∈ c определяется на основе выбора элемента кортеж-инварианта (т.е. типа фрагмента углеродного скелета) с наибольшим рангом информативности a:(2)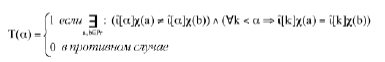
Данная процедура помогает найти такой кортеж-инвариант, который бы позволял отличать каждый хемограф (молекулу) в Pr от всех остальных. Тестирование (1, 2) проводилось на случайных выборках по 50 тыс. попарно различных структур молекул из базы данных PubChem [10] с использованием бинарных кортеж-инвариантов над множеством χ-цепей (цепных фрагментов химической структуры) длины n (n=1..7). В результате вычислений было установлено, что при n=7 аккуратность различения одной молекулы от другой составила 99,4% и даже при более коротких длинах χ-цепей (n=4,5) достигались довольно высокие показатели аккуратности (93–97%).
С использованием полученного множества χ и метрики Хэмминга функция расстояния между хемографами dχ над бинарными χ-инвариантами определяется следующим образом:
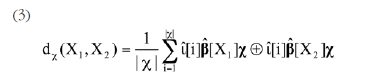 Данное выражение, отражающее «химическое расстояние» между двумя произвольными молекулами, и было использовано для решения задачи поиска молекул, структурно схожих с этифоксином.
Данное выражение, отражающее «химическое расстояние» между двумя произвольными молекулами, и было использовано для решения задачи поиска молекул, структурно схожих с этифоксином.
Таким образом, на первом этапе хемоинформационного анализа с использованием расстояния dχ устанавливается список наиболее близких к этифоксину химических структур. На втором этапе хемоинформационного анализа для каждой молекулы из баз данных извлекается вся имеющаяся информация о биологических свойствах этой молекулы и проводится хемореактомный анализ.
 Собственно хемореактомный анализ направлен на вычисление количественных оценок различных типов биологических активностей и прежде всего моделирование профиля сродства исследуемой молекулярной структуры к разным белкам протеома человека. Профиль сродства необходим для последующего экспертного анализа потенциальных позитивных и негативных эффектов исследуемой молекулы. Элементами множества Iн являются вектора îc, соответствующие бинарным или численным кортеж-инвариантам хемографов, которые обладают свойством локальной полноты. При этом могут использоваться не только тупиковые кортеж-инварианты, полученные в результате комбинаторного тестирования локальной полноты (1, 2), но и кортежи большей мощности (например, включающие все виды элементарных c-инвариантов, возможные для заданного словаря меток хемографа и найденные в исследованном множестве хемографов и т.д.). Элементами множества Iк являются вектора îc, соответствующие теоретико-множественным формам профилей сродства (квантильные, вероятностные, ранговые, бинарные).
Собственно хемореактомный анализ направлен на вычисление количественных оценок различных типов биологических активностей и прежде всего моделирование профиля сродства исследуемой молекулярной структуры к разным белкам протеома человека. Профиль сродства необходим для последующего экспертного анализа потенциальных позитивных и негативных эффектов исследуемой молекулы. Элементами множества Iн являются вектора îc, соответствующие бинарным или численным кортеж-инвариантам хемографов, которые обладают свойством локальной полноты. При этом могут использоваться не только тупиковые кортеж-инварианты, полученные в результате комбинаторного тестирования локальной полноты (1, 2), но и кортежи большей мощности (например, включающие все виды элементарных c-инвариантов, возможные для заданного словаря меток хемографа и найденные в исследованном множестве хемографов и т.д.). Элементами множества Iк являются вектора îc, соответствующие теоретико-множественным формам профилей сродства (квантильные, вероятностные, ранговые, бинарные).
После вычисления условий (1, 2) для каждого из исследуемых биологических свойств рассчитываются значения соответствующих констант (константа связывания, константа ингибирования и др.). Для этого в базах данных отбираются все схожие молекулы, для которых это свойство было измерено, и строится эмпирическая функция распределения значений константы. Представленные далее в таблицах оценки значений разных констант были получены как математическое ожидание и дисперсия соответствующих эмпирических функций распределения, которые использовались после соответствующей фильтрации посредством i-спектров и анализа модальности (т.е. числа пиков).
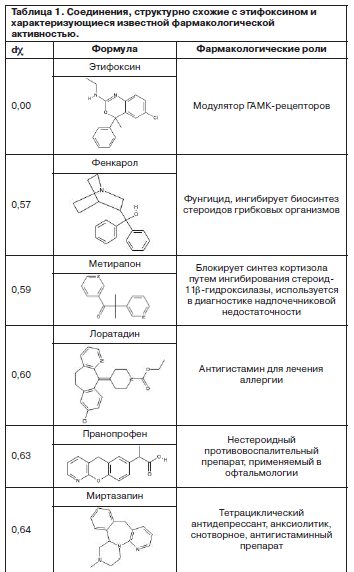 С использованием описанного метода хемоинформационного анализа были проведены сравнения химической структуры этифоксина с молекулами в базе данных метаболома человека и молекулами в базах данных лекарственных средств. В качестве модели метаболома человека использовалась база данных Human Metabolome Database (база данных метаболома человека) [11], содержащая информацию о более чем 40 тыс. молекул. Данные молекулы определяются измерением в плазме крови человека и помимо физиологических эндометаболитов также включают экзогенные метаболиты: лекарственные средства и продукты их биотрансформаций. В табл. 1 представлены наиболее интересные результаты анализа сходства молекулы этифоксина с известными фармакологически активными веществами.
С использованием описанного метода хемоинформационного анализа были проведены сравнения химической структуры этифоксина с молекулами в базе данных метаболома человека и молекулами в базах данных лекарственных средств. В качестве модели метаболома человека использовалась база данных Human Metabolome Database (база данных метаболома человека) [11], содержащая информацию о более чем 40 тыс. молекул. Данные молекулы определяются измерением в плазме крови человека и помимо физиологических эндометаболитов также включают экзогенные метаболиты: лекарственные средства и продукты их биотрансформаций. В табл. 1 представлены наиболее интересные результаты анализа сходства молекулы этифоксина с известными фармакологически активными веществами.
Анализ схожих с этифоксином молекул (см. табл. 1) систематически указывает на возможные фармакологические эффекты препарата: фунгицидный, модуляцию биосинтеза стероидов, антигистаминный и противовоспалительный, модуляцию холинергической нейротрансмиссии. Эти потенциальные эффекты этифоксина были подтверждены в результате проведения хемореактомного моделирования молекулы этифоксина, для которой были получены достоверные оценки более 2500 биологических активностей и проведено сравнение с контрольным препаратом – лоразепамом (бензодиазепин).
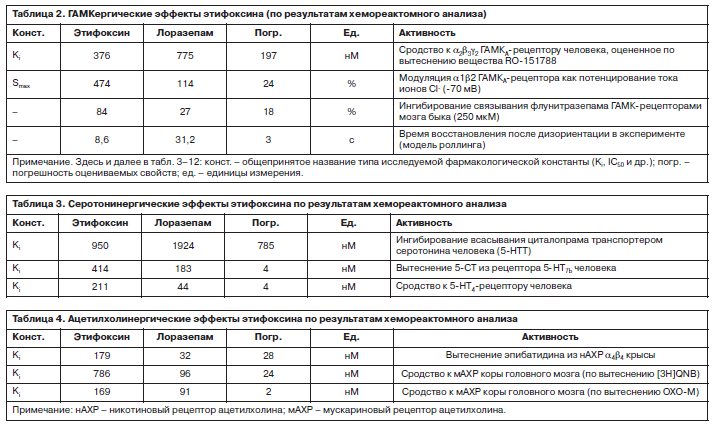
Результаты хемореактомного моделирования указали на возможности модуляции этифоксином рецепторов нейротрансмиттеров (ГАМК, серотонина, ацетилхолина, катехоламинов и каннабиоидных рецепторов), противовоспалительное, противодиабетическое, противоопухолевое и противогрибковое действие, возможные воздействия на гемодинамику и стенки сосудов. Проведенный анализ также позволил провести оценки фармакокинетических параметров и побочного фармакодинамического действия этифоксина в сравнении с бензодиазепиновым «контрольным» препаратом.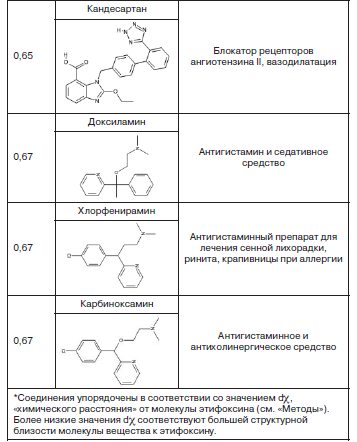 Приведенные в табл. 2 хемореактомные оценки ГАМКергических свойств этифоксина подтверждают гораздо больший (по сравнению с бензодиазепинами) эффект этифоксина в стимуляции ГАМК-рецепторов. При этом этифоксин проявляет и более высокое сродство к рецептору, и более высокую степень активации рецепторов. Данное свойство молекулы обусловливает подтвержденные фармакологические эффекты этифоксина: связывания с субъединицами b2, b3 комплекса рецептора ГАМК [12], усиления связывания ГАМК с ГАМК-рецепторами [13], что важно для лечения расстройств адаптации с тревогой [14] и аллодинии [15].
Приведенные в табл. 2 хемореактомные оценки ГАМКергических свойств этифоксина подтверждают гораздо больший (по сравнению с бензодиазепинами) эффект этифоксина в стимуляции ГАМК-рецепторов. При этом этифоксин проявляет и более высокое сродство к рецептору, и более высокую степень активации рецепторов. Данное свойство молекулы обусловливает подтвержденные фармакологические эффекты этифоксина: связывания с субъединицами b2, b3 комплекса рецептора ГАМК [12], усиления связывания ГАМК с ГАМК-рецепторами [13], что важно для лечения расстройств адаптации с тревогой [14] и аллодинии [15].
Более короткое время восстановления после дизориентации (см. табл. 2) указывает на то, что этифоксин поддерживает «восстанавливающий рефлекс» вестибулярной системы, который корректирует ориентацию тела после моделирования дезориентации. Действительно, в эксперименте этифоксин влияет на восстанавливающий рефлекс в пентобарбиталовой модели потери ориентации [16]. В соответствии с результатами моделирования (см. табл. 2) лоразепам может существенно удлинять время восстановления после дезориентации (что, заметим, полностью соответствует понятию о лоразепаме как сильнодействующем снотворном с атаксическими эффектами [17]).
дезориентации. Действительно, в эксперименте этифоксин влияет на восстанавливающий рефлекс в пентобарбиталовой модели потери ориентации [16]. В соответствии с результатами моделирования (см. табл. 2) лоразепам может существенно удлинять время восстановления после дезориентации (что, заметим, полностью соответствует понятию о лоразепаме как сильнодействующем снотворном с атаксическими эффектами [17]).
Таким образом, этифоксин более эффективно взаимодействует с рецепторами ГАМК и вызывает большую ГАМКергическую активность в сравнении с лоразепамом. ГАМКергическая активность этифоксина сопровождается меньшим (по сравнению с бензодиазепинами) снотворным эффектом.
Хемореактомный анализ показал, что этифоксин помимо модуляции ГАМК-рецепторов может регулировать активность и других нейротрансмиттерных рецепторов: серотонина, ацетилхолина, катехоламинов и каннабиоидных рецепторов. При этом значения констант связывания этифоксина с исследованными рецепторами нейротрансмиттеров были заметно выше, т.е. сродство этифоксина к названным рецепторам было существенно ниже по сравнению с контрольной молекулой бензодиазепина (лоразепам).
 В частности, этифоксин характеризуется меньшим сродством к серотониновым рецепторам 5-HT7 и 5-HT4 (табл. 3), чем лоразепам. Рецепторы подтипа 5-HT7 вовлечены в регуляцию температуры тела, циркадного ритма, сна, процессов обучения и памяти, настроения. Серотониновые рецепторы 5-HT4 играют роль в регуляции процессов памяти, настроения, аппетита, функций желудочно-кишечного тракта. В то же время ингибирование всасывания циталопрама (препарат из группы селективных ингибиторов обратного захвата серотонина) транспортером серотонина человека (см. табл. 3) позволяет предположить наличие у этифоксина эффекта, схожего с действием препаратов из группы селективных ингибиторов обратного захвата серотонина (которые также используются для лечения тревожных расстройств и депрессии).
В частности, этифоксин характеризуется меньшим сродством к серотониновым рецепторам 5-HT7 и 5-HT4 (табл. 3), чем лоразепам. Рецепторы подтипа 5-HT7 вовлечены в регуляцию температуры тела, циркадного ритма, сна, процессов обучения и памяти, настроения. Серотониновые рецепторы 5-HT4 играют роль в регуляции процессов памяти, настроения, аппетита, функций желудочно-кишечного тракта. В то же время ингибирование всасывания циталопрама (препарат из группы селективных ингибиторов обратного захвата серотонина) транспортером серотонина человека (см. табл. 3) позволяет предположить наличие у этифоксина эффекта, схожего с действием препаратов из группы селективных ингибиторов обратного захвата серотонина (которые также используются для лечения тревожных расстройств и депрессии).
Этифоксин характеризуется меньшим (по сравнению с лоразепамом) сродством к никотиновым и мускариновым рецепторам к ацетилхолину (табл. 4). Никотиновый ацетилхолиновый рецептор – подвид ацетилхолиновых рецепторов, который обеспечивает передачу нервного импульса через синапсы и активируется непосредственно ацетилхолином, а также никотином. Этот рецептор входит в группу рецептор-ионных каналов, подобных ГАМК- и глициновым рецепторам. Мускариновые рецепторы активируют внутриклеточную передачу сигнала посредством G-белков и аденилатциклаз, а также принимают участие в передаче и модуляции сокращения гладкой мускулатуры, вазодилатации, снижении частоты сердечных сокращений, повышении секреции в железах. В центральной нервной системе мускариновые рецепторы оказывают влияние на регуляцию сна, внимания, обучения и памяти.
Весьма высокое сродство лоразепама к ацетилхолиновым рецепторам (константы порядка Ki 32…91 нмоль/л) соответствует слабому атропиноподобному действию (Ki атропина – 0,9 нмоль/л). Блокада ацетилхолиновых рецепторов проявляется как вялость, дезориентация, головокружение, атаксия, эпизоды амнезии, сухость во рту и др. Такие эффекты действительно наблюдаются при приеме бензодиазепинов (в частности, лоразепама [17]) и ограничивают применение бензодиазепинов, например, у водителей транспортных средств; людей, работа которых требует быстрой реакции и повышенной концентрации внимания, и т.п.
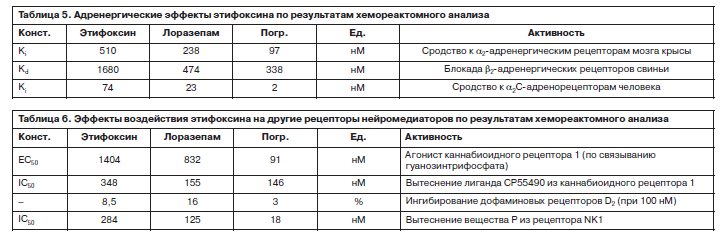 Этифоксин характеризуется меньшим, чем лоразепам, сродством к адренорецепторам (табл. 5). Это может приводить к заметно меньшему по сравнению с бензодиазепинами влиянию этифоксина на регуляцию АД (см. далее).
Этифоксин характеризуется меньшим, чем лоразепам, сродством к адренорецепторам (табл. 5). Это может приводить к заметно меньшему по сравнению с бензодиазепинами влиянию этифоксина на регуляцию АД (см. далее).
Этифоксин характеризуется меньшим сродством и к другим типам рецепторов: каннабиоидным, дофаминовым, рецепторам вещества Р (табл. 6). Например, каннабиоидные рецепторы 1-го типа (CB1) потенцируют исследовательское поведение в новых ситуациях [18]. Меньшая степень воздействия этифоксина на CB1-рецепторы соответствует тому, что этифоксин не вызывает амнезию и седативный эффект, характерный для лоразепама и других бензодиазепинов [19].
Таким образом, этифоксин выгодно отличается по эффективности и селективности воздействия. Хемореактомное моделирование указало на сниженное (по сравнению с контрольной молекулой бензодиазепина лоразепама) сродство этифоксина к другим типам нейротрансмиттерных рецепторов на фоне высокого сродства и степени активации ГАМК-рецепторов. Более низкое сродство к рецепторам других типов соответствует меньшей степени проявления разных побочных эффектов психотропного характера, которые характерны для бензодиазепинов (рис. 3).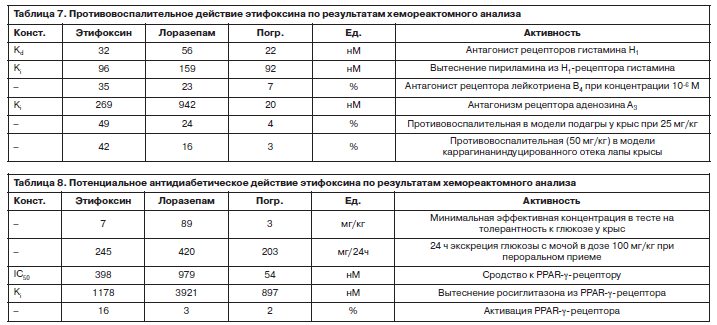 Хемореактомный анализ показал, что молекула этифоксина по сравнению с лоразепамом более эффективна как антагонист рецепторов гистамина H1, В4 лейкотриена, А3 аденозина и может проявлять более выраженную противовоспалительную активность на моделях воспаления (табл. 7). Заметим, что селективные антагонисты рецепторов А3 аденозина исследуются как потенциальные противовоспалительные средства [20]. Эти выводы, следующие из результатов хемореактомного анализа, подтверждаются установленным противовоспалительным действием этифоксина при экспериментальном аутоиммунном энцефалите [21] и в модели отека мозга [22].
Хемореактомный анализ показал, что молекула этифоксина по сравнению с лоразепамом более эффективна как антагонист рецепторов гистамина H1, В4 лейкотриена, А3 аденозина и может проявлять более выраженную противовоспалительную активность на моделях воспаления (табл. 7). Заметим, что селективные антагонисты рецепторов А3 аденозина исследуются как потенциальные противовоспалительные средства [20]. Эти выводы, следующие из результатов хемореактомного анализа, подтверждаются установленным противовоспалительным действием этифоксина при экспериментальном аутоиммунном энцефалите [21] и в модели отека мозга [22].
Белки-рецепторы типа PPAR (активированный рецептор пролифераторов пероксисом) необходимы для переработки избыточного холестерина и снижения уровня глюкозы в крови. Белки PPAR (рис. 4) активируют процессы b-окисления жирных кислот, и агонисты PPAR-g используются при гипергликемии и гиперлипидемии [23]. Этифоксин может связываться с PPAR-g, являться частичным агонистом PPAR-g и таким образом проявлять слабое антидиабетическое действие.
В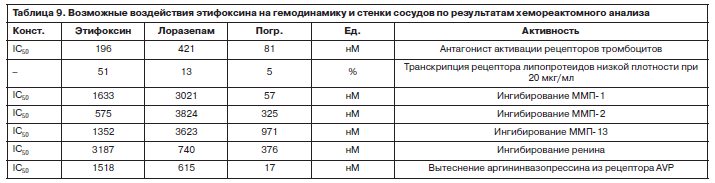 Проведенный хемореактомный анализ указал на возможность того, что этифоксин может способствовать улучшению гемодинамики (табл. 9) за счет антиагрегантного действия (снижения активации рецепторов тромбоцитов), улучшения липидного профиля (усиления экспрессии рецептора липопротеидов низкой плотности) и состояния сосудистой стенки (ингибирование матричных металлопротеаз – ММП-1, ММП-2, MMП-13, способствующих деградации соединительной ткани сосудов).
Проведенный хемореактомный анализ указал на возможность того, что этифоксин может способствовать улучшению гемодинамики (табл. 9) за счет антиагрегантного действия (снижения активации рецепторов тромбоцитов), улучшения липидного профиля (усиления экспрессии рецептора липопротеидов низкой плотности) и состояния сосудистой стенки (ингибирование матричных металлопротеаз – ММП-1, ММП-2, MMП-13, способствующих деградации соединительной ткани сосудов).
Отдельно следует отметить, что этифоксин, потенциально, гораздо слабее влияет на регуляцию АД, чем лоразепам. Хорошо известно, что в дополнение к ГАМКергическому действию бензодиазепины могут вызывать гипотонию и другие нарушения регуляции парасимпатической нервной системы [24]. Проведенный анализ показал, что этифоксин, как было отмечено выше, значительно слабее взаимодействует с адренорецепторами. Кроме того, он в значительно меньшей степени, чем лоразепам, может вызывать ингибирование ренина и вытеснять аргининвазопрессин из AVP-рецептора (см. табл. 9). Соответственно, этифоксин не будет способствовать развитию гипотонии. Напротив, бензодиазепины имеют отчетливый гипотонический эффект и в сочетании с гипотензивными средствами могут критически низко снижать АД.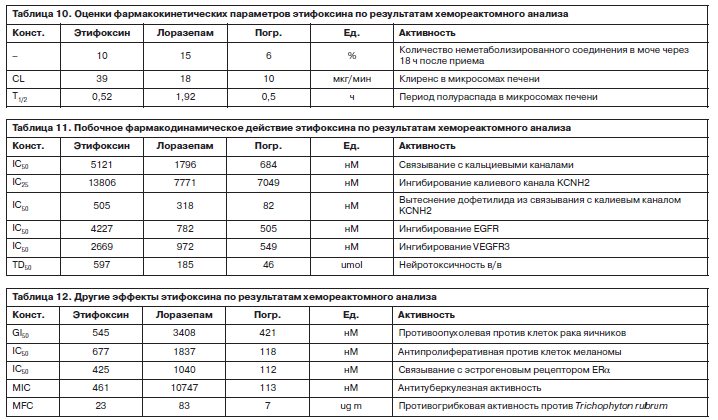 Из фармакокинетических исследований известно, что этифоксин быстро всасывается из желудочно-кишечного тракта, быстро метаболизируется в печени. Время достижения максимальной концентрации в крови – 2–3 ч, период полувыведения (T1/2) – около 6 ч [1]. Эти данные соответствуют результатам хемореактомного моделирования (табл. 10).
Из фармакокинетических исследований известно, что этифоксин быстро всасывается из желудочно-кишечного тракта, быстро метаболизируется в печени. Время достижения максимальной концентрации в крови – 2–3 ч, период полувыведения (T1/2) – около 6 ч [1]. Эти данные соответствуют результатам хемореактомного моделирования (табл. 10).
Например, при T1/2~6 ч через 18 ч в организме будет оставаться не более 10–15% исходного вещества. Этому отчасти соответствует количество неметаболизированного соединения в моче через 18 ч после приема (10%). Быстрая метаболизация этифоксина в печени соответствует более высокому (по сравнению с лоразепамом) клиренсу и более короткому периоду полураспада молекулы в микросомах печени.
Моделирование других фармакодинамических свойств этифоксина (прежде всего по степени связывания с различными «нежелательными» таргетными белками; табл. 11) указало, что этифоксин существенно слабее по сравнению с лоразепамом взаимодействует с белками, ассоциированными с нежелательными побочными эффектами.
При оценке нежелательных эффектов отметим более низкое связывание этифоксина с калиевым каналом KCNH2 и более слабое ингибирование препаратом активности KCNH2. Данный калиевый канал является важным «антитаргетным» белком, взаимодействий с которым следует избегать при разработке лекарственных средств [25]. Нарушения активности KCNH2 приводят к формированию смертельно опасного «синдрома длинного QT», повышающего риск внезапной остановки сердца вследствие спонтанно развивающейся аритмии. Общеизвестно, что многие клинически используемые препараты имеют нежелательную тенденцию к ингибированию KCNH2, что существенно сужает спектр их применения [26, 27].
Также в процессе хемореактомного анализа были установлены достаточно неожиданные потенциальные эффекты этифоксина (табл. 12). Например, по сравнению с лоразепамом молекула этифоксина может характеризоваться существенно более высокой противоопухолевой, антипролиферативной, противотуберкулезной и противогрибковой активностью. В частности, по сравнению с лоразепамом константа MIC противотуберкулезного действия более чем в 20 раз ниже и находится в субмикромолярном диапазоне значений (461 нмоль/л; см. табл. 12). Иначе говоря, этифоксин может проявлять заметное противотуберкулезное действие.
К сожалению, в литературе не имеется данных по этим потенциальным эффектам молекулы этифоксина. Заметная степень сходства молекулы этифоксина с молекулой фунгицида фенкарола (см. табл. 1) позволяет предположить, что этифоксин способен ингибировать биосинтез стероидов грибковых организмов. Антипролиферативное действие также может быть обусловлено модуляцией гомеостаза эстрогенов – моделирование указало на существенно более высокое связывание с эстрогеновым рецептором для этифоксина, чем для лоразепама (см. табл. 12).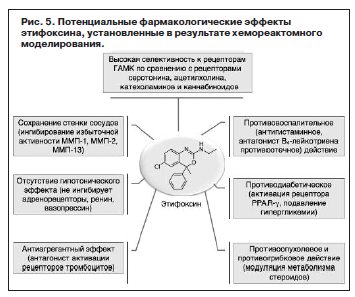 Впервые проведены хемореактомный анализ биологических свойств этифоксина (действующее начала препарата Стрезам) и сравнение с «контрольной молекулой» бензодиазепина (лоразепам). Для обеих молекул рассчитаны достоверные значения более чем для 2500 видов различных биологических активностей. Результаты хемореактомного моделирования позволяют предположить существенные различия между этифоксином и бензодиазепинами в связывании рецепторов нейротрансмиттеров (катехоламиновых, серотониновых, ацетилхолиновых, каннабиоидных), противовоспалительном действии, воздействиях на гемодинамику и стенки сосудов, антипролиферативном действии. Установлены выгодные отличия молекулы этифоксина по фармакодинамическим и фармакокинетическим параметрам, указывающие на более слабые побочные эффекты психотропного характера. Полученные результаты позволяют предположить возможное противовоспалительное, противодиабетическое, противоопухолевое и противогрибковое действия этифоксина, а также положительное воздействие препарата на гемодинамику и на состояние стенок сосудов (рис. 5). Также этифоксин с меньшей вероятностью способен вызывать побочные эффекты, ассоциированные с частичной блокадой ацетилхолиновых рецепторов (вялость, дезориентацию, головокружение, атаксию, эпизоды амнезии, сухость во рту).
Впервые проведены хемореактомный анализ биологических свойств этифоксина (действующее начала препарата Стрезам) и сравнение с «контрольной молекулой» бензодиазепина (лоразепам). Для обеих молекул рассчитаны достоверные значения более чем для 2500 видов различных биологических активностей. Результаты хемореактомного моделирования позволяют предположить существенные различия между этифоксином и бензодиазепинами в связывании рецепторов нейротрансмиттеров (катехоламиновых, серотониновых, ацетилхолиновых, каннабиоидных), противовоспалительном действии, воздействиях на гемодинамику и стенки сосудов, антипролиферативном действии. Установлены выгодные отличия молекулы этифоксина по фармакодинамическим и фармакокинетическим параметрам, указывающие на более слабые побочные эффекты психотропного характера. Полученные результаты позволяют предположить возможное противовоспалительное, противодиабетическое, противоопухолевое и противогрибковое действия этифоксина, а также положительное воздействие препарата на гемодинамику и на состояние стенок сосудов (рис. 5). Также этифоксин с меньшей вероятностью способен вызывать побочные эффекты, ассоциированные с частичной блокадой ацетилхолиновых рецепторов (вялость, дезориентацию, головокружение, атаксию, эпизоды амнезии, сухость во рту).
Сведения об авторах
Торшин Иван Юрьевич – канд. физ.-мат. наук, доц. каф. «Интеллектуальные системы» ФГАОУ ВО МФТИ
Громова Ольга Алексеевна – д-р мед. наук, проф. каф. фармакологии и клинической фармакологии ГБОУ ВПО ИвГМА. E-mail: unesco.gromova@gmail.com
Федотова Любовь Эдуардовна – канд. мед. наук, доц. каф. фармакологии и клинической фармакологии ГБОУ ВПО ИвГМА
Громов Андрей Николаевич – науч. сотр. ФГБУ ФИЦ ИУ РАН. E-mail: agromov@gmail.com
Ключевые слова: хемореактомный анализ, биоинформатика, этифоксин.
unesco.gromova@gmail.com
Для цитирования: Торшин И.Ю., Громова О.А., Федотова Л.Э., Громов А.Н. Хемореактомное моделирование эффектов этифоксина. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2016; 18 (5): 10–17.
Hemoreactomic etifoxine modeling effects
I.Yu.Torshin1, O.A.Gromova2, L.E.Fedotova2, A.N.Gromov3
1 Moscow Institute of Physics and Technology. 141700, Russian Federation, Dolgoprudnyi, Institutskii per., d. 9;
2 Ivanovo State Medical Academy of the Ministry of Health of the Russian Federation. 153000, Russian Federation, Ivanovo, Sheremetevskii pr-t, d. 8;
3 Federal Research Centre "Information and Management". 119333, Russian Federation, Moscow, ul. Vavilova, d. 40
For the first time the simulation of biological properties etifoxine (Stresam active principle of the drug). For this may molecule obtained reliable estimates of more than 2500 biological activities and a comparison with the control preparation – lorazepam (benzodiazepine). Hemoreaktomic simulation results suggest significant differences etifoxine between pharmacological effects and investigated benzodiazepine in: 1) receptor binding selectivity of various neurotransmitters; 2) anti-inflammatory effect; 3) action on hemodynamics and the condition of the vessel walls; 4) the presence of side effects; 5) pharmacokinetic parameters. The results correspond to the available experimental and clinical data, and point to promising eg etifoxine board of therapeutic applications.
Key words: hemoreaktomic analysis, bioinformatics, etifoxine.
unesco.gromova@gmail.com
For citation: Torshin I.Yu., Gromova O.A., Fedotova L.E., Gromov A.N. Hemoreactomic etifoxine modeling effects. Psychiatry and Psycho-pharmacotherapy (P.B.Gannushkin Journal). 2016; 18 (5): 10–17.
Введение
 Этифоксин модулирует ГАМКергическую трансмиссию и используется как анксиолитическое (противотревожное) лекарственное средство. С химической точки зрения молекула этифоксина не является производным бензодиазепинов (рис. 1). Тем не менее этифоксин не только превосходит большинство бензодиазепинов по выраженности ГАМКергического транквилизирующего эффекта, но и обладает другими полезными свойствами (например, антиконвульсантными) [1]. Показаниями для назначения этифоксина считаются тревожные состояния, страх, внутреннее напряжение, депрессивный настрой пациента.
Этифоксин модулирует ГАМКергическую трансмиссию и используется как анксиолитическое (противотревожное) лекарственное средство. С химической точки зрения молекула этифоксина не является производным бензодиазепинов (рис. 1). Тем не менее этифоксин не только превосходит большинство бензодиазепинов по выраженности ГАМКергического транквилизирующего эффекта, но и обладает другими полезными свойствами (например, антиконвульсантными) [1]. Показаниями для назначения этифоксина считаются тревожные состояния, страх, внутреннее напряжение, депрессивный настрой пациента.Основным фармакологическим действием этифоксина является усиление ГАМКергической трансмиссии посредством активации А-рецептора ГАМК. В отличие от бензодиазепинов этифоксин связывается с аллостерическим сайтом в молекуле ГАМК-рецептора, что приводит к усилению активности последнего под воздействием эндогенного ГАМК. Кроме того, этифоксин осуществляет модуляцию ГАМКергической активности за счет активации синтеза нейростероидов, которые, как известно, повышают чувствительность ГАМКА-рецепторов к ГАМК [2].
Приводимые факты общеизвестны. Более детального сравнения фармакодинамических и фармакокинетических свойств этифоксина и бензодиазепинов не проводилось. Известны отдельные детали: например, то, что этифоксин взаимодействует с аллостерическим сайтом ГАМКА-рецепторов, а бензодиазепины – с основным сайтом или что бензодиазепины способствуют формированию пониженного артериального давления (АД), а этифоксин – нет, и т.п.
В настоящей работе представлены результаты сравнительного анализа свойств этифоксина и примера молекулы бензодиазепина с использованием нового направления в постгеномной медицине – хемореактомного моделирования. Оценка эффективности и безопасности лекарственных средств на основе их молекулярной структуры является важнейшей задачей постгеномной медицины.
В рамках постгеномной парадигмы множество всех генов организма данного вида (геном) предоставляет информацию для синтеза всех белков организма (протеом), активность которых приводит к образованию всех метаболитов организма (метаболом) через осуществление всей совокупности химических реакций, протекающих в организме (реактом) [3].
Молекула потенциального лекарственного средства «мимикрирует» под определенные метаболиты (вследствие наличия тех или иных сходств в химической структуре) и, связываясь с теми или иными белками протеома, производит соответствующие данному лекарству эффекты (как позитивные, так и негативные), что и позволяет выявить хемореактомный анализ. Таким образом, совокупность всей имеющейся для анализируемой молекулы информации о взаимодействии с белками протеома (профиль сродства) позволяет сделать обоснованные выводы о потенциальных эффектах этой молекулы.
В настоящей работе проводится анализ фармакологических «возможностей» химической структуры этифоксина на основе хемоинформационного подхода – т.е. сравнения химической структуры молекулы этифоксина (молекулярной структуры с недостаточно изученными молекулярно-фармакологическими свойствами) с миллионами других молекул, для которых молекулярно-фармакологические свойства известны. Данное сравнение проведено с использованием современных методов хемоинформационного анализа [4, 5], которые разрабатываются в научной школе академика РАН Ю.И.Журавлева [4–9].
Материалы и методы
 Хемоинформатика – область исследований на стыке структурной химии, фармакологии и биоинформатики, в которой взаимосвязи типа «химическая структура – свойство вещества» исследуются методами современной информатики. Хемоинформационный анализ позволяет найти молекулы, схожие с исследуемой, и, соответственно, предположить физиологические, фармакологические и другие свойства исследуемой молекулы на основе имеющейся информации о свойствах молекул, наиболее близких по структуре.
Хемоинформатика – область исследований на стыке структурной химии, фармакологии и биоинформатики, в которой взаимосвязи типа «химическая структура – свойство вещества» исследуются методами современной информатики. Хемоинформационный анализ позволяет найти молекулы, схожие с исследуемой, и, соответственно, предположить физиологические, фармакологические и другие свойства исследуемой молекулы на основе имеющейся информации о свойствах молекул, наиболее близких по структуре.Особый подраздел хемоинформатики, хемореактомный анализ, направлен на оценку биологических активностей исследуемой молекулы (в частности, моделирование профиля сродства исследуемой молекулярной структуры к различным белкам протеома). В настоящей работе был проведен сравнительный хемореактомный анализ молекул этифоксина и бензодиазепина лоразепама (рис. 2).
При проведении хемоинформационного анализа использован новый математический метод, основанный на комбинаторной теории разрешимости [4–7]. Она представляет собой развитие алгебраического подхода к задачам распознавания, является современным инструментом для исследования признаковых описаний объектов. В случае задачи установления молекул, химическая структура которых схожа с заданной, объектами исследования становятся хемографы. Хемограф (χ-граф) – особая разновидность графа (т.е. математического объекта, являющегося совокупностью множества вершин и множества ребер – связей между вершинами). Хемографом называется конечный, связный, неориентированный, размеченный граф без петель с кликовым числом, не превышающим 3. В рамках комбинаторной теории разрешимости χ-графы рассматриваются как объекты, а их инварианты (или кортежи инвариантов) – как признаковые описания объектов [4]. В применении к хемографам практически важны теоремы о полноте кортежей-инвариантов произвольного хемографа и соответствия критерия полноты инварианта критерию разрешимости/регулярности [5], основной результат которых можно записать в следующей форме:
(1)
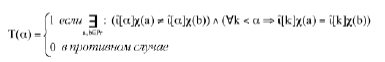
Данная процедура помогает найти такой кортеж-инвариант, который бы позволял отличать каждый хемограф (молекулу) в Pr от всех остальных. Тестирование (1, 2) проводилось на случайных выборках по 50 тыс. попарно различных структур молекул из базы данных PubChem [10] с использованием бинарных кортеж-инвариантов над множеством χ-цепей (цепных фрагментов химической структуры) длины n (n=1..7). В результате вычислений было установлено, что при n=7 аккуратность различения одной молекулы от другой составила 99,4% и даже при более коротких длинах χ-цепей (n=4,5) достигались довольно высокие показатели аккуратности (93–97%).
С использованием полученного множества χ и метрики Хэмминга функция расстояния между хемографами dχ над бинарными χ-инвариантами определяется следующим образом:
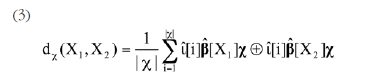 Данное выражение, отражающее «химическое расстояние» между двумя произвольными молекулами, и было использовано для решения задачи поиска молекул, структурно схожих с этифоксином.
Данное выражение, отражающее «химическое расстояние» между двумя произвольными молекулами, и было использовано для решения задачи поиска молекул, структурно схожих с этифоксином.Таким образом, на первом этапе хемоинформационного анализа с использованием расстояния dχ устанавливается список наиболее близких к этифоксину химических структур. На втором этапе хемоинформационного анализа для каждой молекулы из баз данных извлекается вся имеющаяся информация о биологических свойствах этой молекулы и проводится хемореактомный анализ.
 Собственно хемореактомный анализ направлен на вычисление количественных оценок различных типов биологических активностей и прежде всего моделирование профиля сродства исследуемой молекулярной структуры к разным белкам протеома человека. Профиль сродства необходим для последующего экспертного анализа потенциальных позитивных и негативных эффектов исследуемой молекулы. Элементами множества Iн являются вектора îc, соответствующие бинарным или численным кортеж-инвариантам хемографов, которые обладают свойством локальной полноты. При этом могут использоваться не только тупиковые кортеж-инварианты, полученные в результате комбинаторного тестирования локальной полноты (1, 2), но и кортежи большей мощности (например, включающие все виды элементарных c-инвариантов, возможные для заданного словаря меток хемографа и найденные в исследованном множестве хемографов и т.д.). Элементами множества Iк являются вектора îc, соответствующие теоретико-множественным формам профилей сродства (квантильные, вероятностные, ранговые, бинарные).
Собственно хемореактомный анализ направлен на вычисление количественных оценок различных типов биологических активностей и прежде всего моделирование профиля сродства исследуемой молекулярной структуры к разным белкам протеома человека. Профиль сродства необходим для последующего экспертного анализа потенциальных позитивных и негативных эффектов исследуемой молекулы. Элементами множества Iн являются вектора îc, соответствующие бинарным или численным кортеж-инвариантам хемографов, которые обладают свойством локальной полноты. При этом могут использоваться не только тупиковые кортеж-инварианты, полученные в результате комбинаторного тестирования локальной полноты (1, 2), но и кортежи большей мощности (например, включающие все виды элементарных c-инвариантов, возможные для заданного словаря меток хемографа и найденные в исследованном множестве хемографов и т.д.). Элементами множества Iк являются вектора îc, соответствующие теоретико-множественным формам профилей сродства (квантильные, вероятностные, ранговые, бинарные).После вычисления условий (1, 2) для каждого из исследуемых биологических свойств рассчитываются значения соответствующих констант (константа связывания, константа ингибирования и др.). Для этого в базах данных отбираются все схожие молекулы, для которых это свойство было измерено, и строится эмпирическая функция распределения значений константы. Представленные далее в таблицах оценки значений разных констант были получены как математическое ожидание и дисперсия соответствующих эмпирических функций распределения, которые использовались после соответствующей фильтрации посредством i-спектров и анализа модальности (т.е. числа пиков).
Результаты
 С использованием описанного метода хемоинформационного анализа были проведены сравнения химической структуры этифоксина с молекулами в базе данных метаболома человека и молекулами в базах данных лекарственных средств. В качестве модели метаболома человека использовалась база данных Human Metabolome Database (база данных метаболома человека) [11], содержащая информацию о более чем 40 тыс. молекул. Данные молекулы определяются измерением в плазме крови человека и помимо физиологических эндометаболитов также включают экзогенные метаболиты: лекарственные средства и продукты их биотрансформаций. В табл. 1 представлены наиболее интересные результаты анализа сходства молекулы этифоксина с известными фармакологически активными веществами.
С использованием описанного метода хемоинформационного анализа были проведены сравнения химической структуры этифоксина с молекулами в базе данных метаболома человека и молекулами в базах данных лекарственных средств. В качестве модели метаболома человека использовалась база данных Human Metabolome Database (база данных метаболома человека) [11], содержащая информацию о более чем 40 тыс. молекул. Данные молекулы определяются измерением в плазме крови человека и помимо физиологических эндометаболитов также включают экзогенные метаболиты: лекарственные средства и продукты их биотрансформаций. В табл. 1 представлены наиболее интересные результаты анализа сходства молекулы этифоксина с известными фармакологически активными веществами.Анализ схожих с этифоксином молекул (см. табл. 1) систематически указывает на возможные фармакологические эффекты препарата: фунгицидный, модуляцию биосинтеза стероидов, антигистаминный и противовоспалительный, модуляцию холинергической нейротрансмиссии. Эти потенциальные эффекты этифоксина были подтверждены в результате проведения хемореактомного моделирования молекулы этифоксина, для которой были получены достоверные оценки более 2500 биологических активностей и проведено сравнение с контрольным препаратом – лоразепамом (бензодиазепин).
Результаты хемореактомного моделирования указали на возможности модуляции этифоксином рецепторов нейротрансмиттеров (ГАМК, серотонина, ацетилхолина, катехоламинов и каннабиоидных рецепторов), противовоспалительное, противодиабетическое, противоопухолевое и противогрибковое действие, возможные воздействия на гемодинамику и стенки сосудов. Проведенный анализ также позволил провести оценки фармакокинетических параметров и побочного фармакодинамического действия этифоксина в сравнении с бензодиазепиновым «контрольным» препаратом.
Модуляция активности рецепторов различных нейротрансмиттеров этифоксином
Модуляция рецепторов ГАМК является основным молекулярным механизмом фармакологического действия этифоксина. Оценки биологических активностей этифоксина, полученные в результате проведения хемореактомного анализа, подтвердили ГАМКергическое действие препарата (табл. 2). Приведенные в табл. 2 хемореактомные оценки ГАМКергических свойств этифоксина подтверждают гораздо больший (по сравнению с бензодиазепинами) эффект этифоксина в стимуляции ГАМК-рецепторов. При этом этифоксин проявляет и более высокое сродство к рецептору, и более высокую степень активации рецепторов. Данное свойство молекулы обусловливает подтвержденные фармакологические эффекты этифоксина: связывания с субъединицами b2, b3 комплекса рецептора ГАМК [12], усиления связывания ГАМК с ГАМК-рецепторами [13], что важно для лечения расстройств адаптации с тревогой [14] и аллодинии [15].
Приведенные в табл. 2 хемореактомные оценки ГАМКергических свойств этифоксина подтверждают гораздо больший (по сравнению с бензодиазепинами) эффект этифоксина в стимуляции ГАМК-рецепторов. При этом этифоксин проявляет и более высокое сродство к рецептору, и более высокую степень активации рецепторов. Данное свойство молекулы обусловливает подтвержденные фармакологические эффекты этифоксина: связывания с субъединицами b2, b3 комплекса рецептора ГАМК [12], усиления связывания ГАМК с ГАМК-рецепторами [13], что важно для лечения расстройств адаптации с тревогой [14] и аллодинии [15].Более короткое время восстановления после дизориентации (см. табл. 2) указывает на то, что этифоксин поддерживает «восстанавливающий рефлекс» вестибулярной системы, который корректирует ориентацию тела после моделирования
 дезориентации. Действительно, в эксперименте этифоксин влияет на восстанавливающий рефлекс в пентобарбиталовой модели потери ориентации [16]. В соответствии с результатами моделирования (см. табл. 2) лоразепам может существенно удлинять время восстановления после дезориентации (что, заметим, полностью соответствует понятию о лоразепаме как сильнодействующем снотворном с атаксическими эффектами [17]).
дезориентации. Действительно, в эксперименте этифоксин влияет на восстанавливающий рефлекс в пентобарбиталовой модели потери ориентации [16]. В соответствии с результатами моделирования (см. табл. 2) лоразепам может существенно удлинять время восстановления после дезориентации (что, заметим, полностью соответствует понятию о лоразепаме как сильнодействующем снотворном с атаксическими эффектами [17]).Таким образом, этифоксин более эффективно взаимодействует с рецепторами ГАМК и вызывает большую ГАМКергическую активность в сравнении с лоразепамом. ГАМКергическая активность этифоксина сопровождается меньшим (по сравнению с бензодиазепинами) снотворным эффектом.
Хемореактомный анализ показал, что этифоксин помимо модуляции ГАМК-рецепторов может регулировать активность и других нейротрансмиттерных рецепторов: серотонина, ацетилхолина, катехоламинов и каннабиоидных рецепторов. При этом значения констант связывания этифоксина с исследованными рецепторами нейротрансмиттеров были заметно выше, т.е. сродство этифоксина к названным рецепторам было существенно ниже по сравнению с контрольной молекулой бензодиазепина (лоразепам).
 В частности, этифоксин характеризуется меньшим сродством к серотониновым рецепторам 5-HT7 и 5-HT4 (табл. 3), чем лоразепам. Рецепторы подтипа 5-HT7 вовлечены в регуляцию температуры тела, циркадного ритма, сна, процессов обучения и памяти, настроения. Серотониновые рецепторы 5-HT4 играют роль в регуляции процессов памяти, настроения, аппетита, функций желудочно-кишечного тракта. В то же время ингибирование всасывания циталопрама (препарат из группы селективных ингибиторов обратного захвата серотонина) транспортером серотонина человека (см. табл. 3) позволяет предположить наличие у этифоксина эффекта, схожего с действием препаратов из группы селективных ингибиторов обратного захвата серотонина (которые также используются для лечения тревожных расстройств и депрессии).
В частности, этифоксин характеризуется меньшим сродством к серотониновым рецепторам 5-HT7 и 5-HT4 (табл. 3), чем лоразепам. Рецепторы подтипа 5-HT7 вовлечены в регуляцию температуры тела, циркадного ритма, сна, процессов обучения и памяти, настроения. Серотониновые рецепторы 5-HT4 играют роль в регуляции процессов памяти, настроения, аппетита, функций желудочно-кишечного тракта. В то же время ингибирование всасывания циталопрама (препарат из группы селективных ингибиторов обратного захвата серотонина) транспортером серотонина человека (см. табл. 3) позволяет предположить наличие у этифоксина эффекта, схожего с действием препаратов из группы селективных ингибиторов обратного захвата серотонина (которые также используются для лечения тревожных расстройств и депрессии).Этифоксин характеризуется меньшим (по сравнению с лоразепамом) сродством к никотиновым и мускариновым рецепторам к ацетилхолину (табл. 4). Никотиновый ацетилхолиновый рецептор – подвид ацетилхолиновых рецепторов, который обеспечивает передачу нервного импульса через синапсы и активируется непосредственно ацетилхолином, а также никотином. Этот рецептор входит в группу рецептор-ионных каналов, подобных ГАМК- и глициновым рецепторам. Мускариновые рецепторы активируют внутриклеточную передачу сигнала посредством G-белков и аденилатциклаз, а также принимают участие в передаче и модуляции сокращения гладкой мускулатуры, вазодилатации, снижении частоты сердечных сокращений, повышении секреции в железах. В центральной нервной системе мускариновые рецепторы оказывают влияние на регуляцию сна, внимания, обучения и памяти.
Весьма высокое сродство лоразепама к ацетилхолиновым рецепторам (константы порядка Ki 32…91 нмоль/л) соответствует слабому атропиноподобному действию (Ki атропина – 0,9 нмоль/л). Блокада ацетилхолиновых рецепторов проявляется как вялость, дезориентация, головокружение, атаксия, эпизоды амнезии, сухость во рту и др. Такие эффекты действительно наблюдаются при приеме бензодиазепинов (в частности, лоразепама [17]) и ограничивают применение бензодиазепинов, например, у водителей транспортных средств; людей, работа которых требует быстрой реакции и повышенной концентрации внимания, и т.п.
 Этифоксин характеризуется меньшим, чем лоразепам, сродством к адренорецепторам (табл. 5). Это может приводить к заметно меньшему по сравнению с бензодиазепинами влиянию этифоксина на регуляцию АД (см. далее).
Этифоксин характеризуется меньшим, чем лоразепам, сродством к адренорецепторам (табл. 5). Это может приводить к заметно меньшему по сравнению с бензодиазепинами влиянию этифоксина на регуляцию АД (см. далее).Этифоксин характеризуется меньшим сродством и к другим типам рецепторов: каннабиоидным, дофаминовым, рецепторам вещества Р (табл. 6). Например, каннабиоидные рецепторы 1-го типа (CB1) потенцируют исследовательское поведение в новых ситуациях [18]. Меньшая степень воздействия этифоксина на CB1-рецепторы соответствует тому, что этифоксин не вызывает амнезию и седативный эффект, характерный для лоразепама и других бензодиазепинов [19].
Таким образом, этифоксин выгодно отличается по эффективности и селективности воздействия. Хемореактомное моделирование указало на сниженное (по сравнению с контрольной молекулой бензодиазепина лоразепама) сродство этифоксина к другим типам нейротрансмиттерных рецепторов на фоне высокого сродства и степени активации ГАМК-рецепторов. Более низкое сродство к рецепторам других типов соответствует меньшей степени проявления разных побочных эффектов психотропного характера, которые характерны для бензодиазепинов (рис. 3).
О противовоспалительных эффектах этифоксина
 Хемореактомный анализ показал, что молекула этифоксина по сравнению с лоразепамом более эффективна как антагонист рецепторов гистамина H1, В4 лейкотриена, А3 аденозина и может проявлять более выраженную противовоспалительную активность на моделях воспаления (табл. 7). Заметим, что селективные антагонисты рецепторов А3 аденозина исследуются как потенциальные противовоспалительные средства [20]. Эти выводы, следующие из результатов хемореактомного анализа, подтверждаются установленным противовоспалительным действием этифоксина при экспериментальном аутоиммунном энцефалите [21] и в модели отека мозга [22].
Хемореактомный анализ показал, что молекула этифоксина по сравнению с лоразепамом более эффективна как антагонист рецепторов гистамина H1, В4 лейкотриена, А3 аденозина и может проявлять более выраженную противовоспалительную активность на моделях воспаления (табл. 7). Заметим, что селективные антагонисты рецепторов А3 аденозина исследуются как потенциальные противовоспалительные средства [20]. Эти выводы, следующие из результатов хемореактомного анализа, подтверждаются установленным противовоспалительным действием этифоксина при экспериментальном аутоиммунном энцефалите [21] и в модели отека мозга [22].
Возможное антидиабетическое действие этифоксина
Хемореактомный анализ указал на то, что этифоксин может быть гораздо более эффективен, чем лоразепам, в снижении толерантности к глюкозе (табл. 8). Этот антидиабетический эффект, вероятно, осуществляется за счет связывания и активации PPAR-g-рецептора – известного таргетного белка для воздействия антидиабетических средств (например, росиглитазона).Белки-рецепторы типа PPAR (активированный рецептор пролифераторов пероксисом) необходимы для переработки избыточного холестерина и снижения уровня глюкозы в крови. Белки PPAR (рис. 4) активируют процессы b-окисления жирных кислот, и агонисты PPAR-g используются при гипергликемии и гиперлипидемии [23]. Этифоксин может связываться с PPAR-g, являться частичным агонистом PPAR-g и таким образом проявлять слабое антидиабетическое действие.
В
озможные воздействия этифоксина на гемодинамику и стенки сосудов
 Проведенный хемореактомный анализ указал на возможность того, что этифоксин может способствовать улучшению гемодинамики (табл. 9) за счет антиагрегантного действия (снижения активации рецепторов тромбоцитов), улучшения липидного профиля (усиления экспрессии рецептора липопротеидов низкой плотности) и состояния сосудистой стенки (ингибирование матричных металлопротеаз – ММП-1, ММП-2, MMП-13, способствующих деградации соединительной ткани сосудов).
Проведенный хемореактомный анализ указал на возможность того, что этифоксин может способствовать улучшению гемодинамики (табл. 9) за счет антиагрегантного действия (снижения активации рецепторов тромбоцитов), улучшения липидного профиля (усиления экспрессии рецептора липопротеидов низкой плотности) и состояния сосудистой стенки (ингибирование матричных металлопротеаз – ММП-1, ММП-2, MMП-13, способствующих деградации соединительной ткани сосудов).Отдельно следует отметить, что этифоксин, потенциально, гораздо слабее влияет на регуляцию АД, чем лоразепам. Хорошо известно, что в дополнение к ГАМКергическому действию бензодиазепины могут вызывать гипотонию и другие нарушения регуляции парасимпатической нервной системы [24]. Проведенный анализ показал, что этифоксин, как было отмечено выше, значительно слабее взаимодействует с адренорецепторами. Кроме того, он в значительно меньшей степени, чем лоразепам, может вызывать ингибирование ренина и вытеснять аргининвазопрессин из AVP-рецептора (см. табл. 9). Соответственно, этифоксин не будет способствовать развитию гипотонии. Напротив, бензодиазепины имеют отчетливый гипотонический эффект и в сочетании с гипотензивными средствами могут критически низко снижать АД.
Оценки фармакокинетических и фармакодинамических свойств
 Из фармакокинетических исследований известно, что этифоксин быстро всасывается из желудочно-кишечного тракта, быстро метаболизируется в печени. Время достижения максимальной концентрации в крови – 2–3 ч, период полувыведения (T1/2) – около 6 ч [1]. Эти данные соответствуют результатам хемореактомного моделирования (табл. 10).
Из фармакокинетических исследований известно, что этифоксин быстро всасывается из желудочно-кишечного тракта, быстро метаболизируется в печени. Время достижения максимальной концентрации в крови – 2–3 ч, период полувыведения (T1/2) – около 6 ч [1]. Эти данные соответствуют результатам хемореактомного моделирования (табл. 10).Например, при T1/2~6 ч через 18 ч в организме будет оставаться не более 10–15% исходного вещества. Этому отчасти соответствует количество неметаболизированного соединения в моче через 18 ч после приема (10%). Быстрая метаболизация этифоксина в печени соответствует более высокому (по сравнению с лоразепамом) клиренсу и более короткому периоду полураспада молекулы в микросомах печени.
Моделирование других фармакодинамических свойств этифоксина (прежде всего по степени связывания с различными «нежелательными» таргетными белками; табл. 11) указало, что этифоксин существенно слабее по сравнению с лоразепамом взаимодействует с белками, ассоциированными с нежелательными побочными эффектами.
При оценке нежелательных эффектов отметим более низкое связывание этифоксина с калиевым каналом KCNH2 и более слабое ингибирование препаратом активности KCNH2. Данный калиевый канал является важным «антитаргетным» белком, взаимодействий с которым следует избегать при разработке лекарственных средств [25]. Нарушения активности KCNH2 приводят к формированию смертельно опасного «синдрома длинного QT», повышающего риск внезапной остановки сердца вследствие спонтанно развивающейся аритмии. Общеизвестно, что многие клинически используемые препараты имеют нежелательную тенденцию к ингибированию KCNH2, что существенно сужает спектр их применения [26, 27].
Также в процессе хемореактомного анализа были установлены достаточно неожиданные потенциальные эффекты этифоксина (табл. 12). Например, по сравнению с лоразепамом молекула этифоксина может характеризоваться существенно более высокой противоопухолевой, антипролиферативной, противотуберкулезной и противогрибковой активностью. В частности, по сравнению с лоразепамом константа MIC противотуберкулезного действия более чем в 20 раз ниже и находится в субмикромолярном диапазоне значений (461 нмоль/л; см. табл. 12). Иначе говоря, этифоксин может проявлять заметное противотуберкулезное действие.
К сожалению, в литературе не имеется данных по этим потенциальным эффектам молекулы этифоксина. Заметная степень сходства молекулы этифоксина с молекулой фунгицида фенкарола (см. табл. 1) позволяет предположить, что этифоксин способен ингибировать биосинтез стероидов грибковых организмов. Антипролиферативное действие также может быть обусловлено модуляцией гомеостаза эстрогенов – моделирование указало на существенно более высокое связывание с эстрогеновым рецептором для этифоксина, чем для лоразепама (см. табл. 12).
Заключение
 Впервые проведены хемореактомный анализ биологических свойств этифоксина (действующее начала препарата Стрезам) и сравнение с «контрольной молекулой» бензодиазепина (лоразепам). Для обеих молекул рассчитаны достоверные значения более чем для 2500 видов различных биологических активностей. Результаты хемореактомного моделирования позволяют предположить существенные различия между этифоксином и бензодиазепинами в связывании рецепторов нейротрансмиттеров (катехоламиновых, серотониновых, ацетилхолиновых, каннабиоидных), противовоспалительном действии, воздействиях на гемодинамику и стенки сосудов, антипролиферативном действии. Установлены выгодные отличия молекулы этифоксина по фармакодинамическим и фармакокинетическим параметрам, указывающие на более слабые побочные эффекты психотропного характера. Полученные результаты позволяют предположить возможное противовоспалительное, противодиабетическое, противоопухолевое и противогрибковое действия этифоксина, а также положительное воздействие препарата на гемодинамику и на состояние стенок сосудов (рис. 5). Также этифоксин с меньшей вероятностью способен вызывать побочные эффекты, ассоциированные с частичной блокадой ацетилхолиновых рецепторов (вялость, дезориентацию, головокружение, атаксию, эпизоды амнезии, сухость во рту).
Впервые проведены хемореактомный анализ биологических свойств этифоксина (действующее начала препарата Стрезам) и сравнение с «контрольной молекулой» бензодиазепина (лоразепам). Для обеих молекул рассчитаны достоверные значения более чем для 2500 видов различных биологических активностей. Результаты хемореактомного моделирования позволяют предположить существенные различия между этифоксином и бензодиазепинами в связывании рецепторов нейротрансмиттеров (катехоламиновых, серотониновых, ацетилхолиновых, каннабиоидных), противовоспалительном действии, воздействиях на гемодинамику и стенки сосудов, антипролиферативном действии. Установлены выгодные отличия молекулы этифоксина по фармакодинамическим и фармакокинетическим параметрам, указывающие на более слабые побочные эффекты психотропного характера. Полученные результаты позволяют предположить возможное противовоспалительное, противодиабетическое, противоопухолевое и противогрибковое действия этифоксина, а также положительное воздействие препарата на гемодинамику и на состояние стенок сосудов (рис. 5). Также этифоксин с меньшей вероятностью способен вызывать побочные эффекты, ассоциированные с частичной блокадой ацетилхолиновых рецепторов (вялость, дезориентацию, головокружение, атаксию, эпизоды амнезии, сухость во рту).Сведения об авторах
Торшин Иван Юрьевич – канд. физ.-мат. наук, доц. каф. «Интеллектуальные системы» ФГАОУ ВО МФТИ
Громова Ольга Алексеевна – д-р мед. наук, проф. каф. фармакологии и клинической фармакологии ГБОУ ВПО ИвГМА. E-mail: unesco.gromova@gmail.com
Федотова Любовь Эдуардовна – канд. мед. наук, доц. каф. фармакологии и клинической фармакологии ГБОУ ВПО ИвГМА
Громов Андрей Николаевич – науч. сотр. ФГБУ ФИЦ ИУ РАН. E-mail: agromov@gmail.com
Список исп. литературыСкрыть список1. Kruse HJ, Kuch H. Etifoxine: evaluation of its anticonvulsant profile in mice in comparison with sodium valproate, phenytoin and clobazam. Arzneimittelforschun 1985; 35 (1): 133–5.
2. Beльтищeв Д.Ю. Диагностика и фармакотерапия тревожного варианта расстройства адаптации: анксиолитик этифоксин (Стрезам) в клинических и экспериментальных исследованиях. Соц. и клинич. психиатрия. 2010; 1: 86–90. / Bel'tishchev D.Iu. Diagnostika i farmakoterapiia trevozhnogo varianta rasstroistva adaptatsii: anksiolitik etifoksin (Strezam) v klinicheskikh i eksperimental'nykh issledovaniiakh. Sots. i klinich. psikhiatriia. 2010; 1: 86–90. [in Russian]
3. Torshin I.Yu. Bioinformatics in the post-genomic era: sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books, NY, 2009.
4. Torshin I.Y., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 1: fundamentals of modern chemical bonding theory and the concept of the chemograph. Pattern Recognition and Image Analysis (Advances in Mathematical Theory and Applications) 2014; 24 (1): 11–23.
5. Torshin I.Y., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 2: Local completeness of invariants of chemographs in view of the combinatorial theory of solvability. Pattern Recognition and Image Analysis (Advances in Mathematical Theory and Applications) 2014; 24 (2): 196–208.
6. Журавлев Ю.И., Рудаков К.В., Торшин И.Ю. Алгебраические критерии локальной разрешимости и регулярности как инструмент исследования морфологии аминокислотных последовательностей. Труды МФТИ. 2011; 3 (4): 67–76. / Zhuravlev Iu.I., Rudakov K.V., Torshin I.Iu. Algebraicheskie kriterii lokal'noi razreshimosti i reguliarnosti kak instrument issledovaniia morfologii aminokislotnykh posledovatel'nostei. Trudy MFTI. 2011; 3 (4): 67–76. [in Russian]
7. Рудаков К.В., Торшин И.Ю. Об отборе информативных значений признаков на базе критериев разрешимости в задаче распознавания вторичной структуры белка. ДАН. 2011; 441 (1): 1–5. / Rudakov K.V., Torshin I.Iu. Ob otbore informativnykh znachenii priznakov na baze kriteriev razreshimosti v zadache raspoznavaniia vtorichnoi struktury belka. DAN. 2011; 441 (1): 1–5. [in Russian]
8. Torshin I.Yu. On solvability, regularity, and locality of the problem of genome annotation. Pattern Recognition and Image Analysis 2010; 20 (3): 386–95.
9. Журавлев Ю.И. Теоретико-множественные методы в алгебре логики. Проблемы кибернетики. 1962; 8 (1): 25–45. / Zhuravlev Iu.I. Teoretiko-mnozhestvennye metody v algebre logiki. Problemy kibernetiki. 1962; 8 (1): 25–45. [in Russian]
10. Bolton E, Wang Y, Thiessen PA, Bryant SH. PubChem: Integrated Platform of Small Molecules and Biological Activities. Chapter 12 in Annual Reports in Computational Chemistry, Vol. 4, American Chemical Society, Washington, DC, 2008. pubchem.ncbi.nlm.nih.gov
11. Wishart DS, Tzur D, Knox C et al. HMDB: the Human Metabolome Database. Nucleic Acids Res 2007; 35 (Databas: D521–D526).
12. Choi YM, Kim KH. Etifoxine for pain patients with anxiety. Korean J Pain 2015; 28 (1): 4–10.
13. Bouillot C, Bonnefoi F, Liger F, Zimmer L. A microPET comparison of the effects of etifoxine and diazepam on [(11)C]flumazenil uptake in rat brains. Neurosci Lett 2016;612:74–9.
14. Stein DJ. Etifoxine versus alprazolam for the treatment of adjustment disorder with anxiety: a randomized controlled trial. Adv Ther 2015; 32 (1): 57–68.
15. Zeitler A, Kamoun N, Goyon S et al. Favoring inhibitory synaptic drive mediated by GABA receptors in the basolateral nucleus of the amygdala efficiently reduces pain symptoms in neuropathic mice. Eur J Neurosci 2016; Eur J Neur: 101111/ejn13217.
16. Verleye M, Heulard I, Nuss P, Gillardin JM. Effects of stress and etifoxine on pentobarbital-induced loss of righting reflex in Balb/cByJ and C57BL/6J mice. Neurosci Lett 2003; 353 (2): 127–30.
17. Ozawa M, Nakada Y, Sugimachi K et al. Interaction of the hypnotic lormetazepam with central benzodiazepine receptor subtypes omega 1, omega 2 and omega 3. Nihon Yakurigaku Zasshi 1991; 98 (5): 399–408.
18. Haring M, Kaiser N, Monory K, Lutz B. Circuit specific functions of cannabinoid CB1 receptor in the balance of investigatory drive and exploration. PLoS One 2011; 6 (11): e26617 doi.
19. Micallef J, Soubrouillard C, Guet F et al. A double blind parallel group placebo controlled comparison of sedative and mnesic effects of etifoxine and lorazepam in healthy subjects [corrected]. Fundam Clin Pharmacol 2001; 15 (3): 209–16.
20. Miwatashi S, Arikawa Y, Matsumoto T et al. Synthesis and biological activities of 4-phenyl-5-pyridyl-1,3-thiazole derivatives as selective adenosine A3 antagonists. Chem Pharm Bull (Tokyo) 2008; 56 (8): 1126–37.
21. Ravikumar B, Crawford D, Dellovade T et al. Differential efficacy of the TSPO ligands etifoxine and XBD-173 in two rodent models of Multiple Sclerosis. Neuropharmacology 2016; Neuropharm: S0028-3908(16)3012.
22. Girard P, Pansart Y, Gillardin JM. Preventive and curative effects of etifoxine in a rat model of brain oedema. Clin Exp Pharmacol Physiol 2009; 36 (7): 655–61.
23. Gaikwad AB, Viswanad B, Ramarao P. PPAR gamma agonists partially restores hyperglycemia induced aggravation of vascular dysfunction to angiotensin II in thoracic aorta isolated from rats with insulin resistance. Pharmacol Res 2007; 55 (5): 400–7. Epub 2007.
24. Lechin F, van der Dijs B, Benaim M. Benzodiazepines: tolerability in elderly patients. Psychother Psychosom 1996; 65 (4): 171–82.
25. Braga RC, Alves VM, Silva MF et al. Tuning HERG out: antitarget QSAR models for drug development. Curr Top Med Chem 2014; 14 (11): 1399–415.
26. Sanguinetti MC, Tristani-Firouzi M. hERG potassium channels and cardiac arrhythmia. Nature 2006; 440 (7083): 463–9.
27. Торшин И.Ю., Громова О.А. Экспертный анализ данных в молекулярной фармакологии. М.: МЦНМО, 2012. / Torshin I.Iu., Gromova O.A. Ekspertnyi analiz dannykh v molekuliarnoi farmakologii. M.: MTSNMO, 2012. [in Russian]

