Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2016
Обзор данных сетевого метаанализа эффективности антидепрессантов нового поколения №06 2016
Номера страниц в выпуске:21-25
В статье представлены результаты сетевого метаанализа эффективности терапии десятью широко используемыми для купирования большого депрессивного расстройства антидепрессантами. В метаанализ были включены данные о результатах лечения 16 389 пациентов. Средний балл по шкале HDRS составил от 16 до 30. Агомелатин обладал статистически значимо меньшим риском досрочного прекращения участия в исследовании из-за побочных эффектов. При использовании составного показателя эффективности (с учетом доли респондеров и ремиттеров) и переносимости наиболее эффективными оказались агомелатин, эсциталопрам и миртазапин.
Ключевые слова: сетевой метаанализ, антидепрессанты, агомелатин.
frolova_vi@pfur.ru
Ключевые слова: сетевой метаанализ, антидепрессанты, агомелатин.
frolova_vi@pfur.ru
В статье представлены результаты сетевого метаанализа эффективности терапии десятью широко используемыми для купирования большого депрессивного расстройства антидепрессантами. В метаанализ были включены данные о результатах лечения 16 389 пациентов. Средний балл по шкале HDRS составил от 16 до 30. Агомелатин обладал статистически значимо меньшим риском досрочного прекращения участия в исследовании из-за побочных эффектов. При использовании составного показателя эффективности (с учетом доли респондеров и ремиттеров) и переносимости наиболее эффективными оказались агомелатин, эсциталопрам и миртазапин.
Ключевые слова: сетевой метаанализ, антидепрессанты, агомелатин.
frolova_vi@pfur.ru
Для цитирования: Фролова В.И. Обзор данных сетевого метаанализа эффективности антидепрессантов нового поколения. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2016; 18 (6): 21–25.
The article presents the results of a network meta-analysis of the efficacy of ten commonly used for the relief of major depressive disorder with antidepressants. In a meta-analysis of the data has been included on the results of treatment of 16 389 patients. The average score on the HDRS scale ranged from 16 to 30. Agomelatine had a significantly lower risk of early termination of the study because of side effects. When using a composite performance indicator (including the share of responders and remitterov) and tolerability of agomelatine were the most effective, escitalopram and mirtazapine.
Key words: network meta-analysis, antidepressants, agomelatine.
frolova_vi@pfur.ru
For citation: Frolova V.I. Network meta-analysis of new generation antidepressants. Psychiatry and Psychopharmacotherapy (P.B.Gannushkin Journal). 2016; 18 (6): 21–25.
Существование в парадигме доказательной медицины, основанной не только на клинических суждениях, но и на релевантном научном обосновании, а также учете индивидуальных интересов и потребностей пациентов, требует от современного специалиста постоянного обновления знаний.
Несмотря на то что рандомизированные клинические исследования (РКИ) выявляют наиболее очевидные из доступных доказательств относительного эффекта терапии для определенных пар сравнения, иногда данные о прямых сравнениях препаратов могут быть недоступны. В таких случаях для определения относительной эффективности одного антидепрессанта в сравнении с другим мы обращаемся к непрямому сравнению с использованием сетевого метаанализа.
Систематические метаанализы являются формой исследований, позволяющей концентрированно охватить большой срез результатов научных работ, и впоследствии становятся основой для составления рекомендаций и руководств по лечению.
Метаанализ – статистический анализ большого объема полученных в результате отдельных исследований данных с целью их интеграции. В отличие от совокупного анализа, где объектами всех обязательно схожих по методологии исследований являются субъекты, а исходная информация обо всех пациентах используется как часть одного большого исследования, при метаанализе изучается определенное число исследований и используется стандартная оценка размера эффекта для каждого исследования; при этом возможны включение исследований с разной методологией и ограниченный субанализ (регрессивный метаанализ).
Сетевой метаанализ – это метод, при котором несколько метаанализов прямых сравнений 2 препаратов оцениваются одновременно; при этом могут быть синтезированы данные как прямых, так и непрямых сравнений из различных исследований, базирующиеся на одном препарате сравнения. В этом аспекте сетевой метаанализ преодолевает ограничения традиционных «попарных» метаанализов.
Таким образом, метаанализы формируют доказательную базу высочайшего качества для сравнения стратегий лечения [1]. Способность критически оценивать метаанализы и результаты клинических исследований является неотъемлемым аспектом современной клинической практики для обеспечения наилучшего возможного лечения для пациентов.
А.Khoo и соавт. (2015 г.) провели сетевой метаанализ эффективности терапии десятью широко используемыми для купирования большого депрессивного расстройства (БДР) антидепрессантами [2].
Целью являлось определение наиболее эффективного антидепрессанта для лечения БДР. Осуществлялся систематический поиск в PubMed, Embase, Cochrane Library вплоть до июня 2015 г. Включались статьи на английском языке; использовалась высокочувствительная стратегия поиска Cochrane, позволявшая выявлять рандомизированные исследования с использованием индекса медицинских наименований, а также названий 10 антидепрессантов в сочетании с термином БДР.
Авторы включали прямые сравнительные РКИ длительностью как минимум 6 нед, в которых оценивалась монотерапия БДР 2 из следующих 10 антидепрессантов: агомелатином, дулоксетином, эсциталопрамом, флувоксамином, флуоксетином, миртазапином, пароксетином, сертралином, тразодоном, венлафаксином.
В исследованиях участвовали пациенты старше 18 лет с БДР умеренной или тяжелой степени по критериям DSM (DSM-III, DSM-III-R, DSM-IV, DSM-IV-TR). Исследования проводились в амбулаторных и стационарных учреждениях. В анализ не включались исследования с участием детей, подростков и беременных. Также в анализ не включались исследования, критерии включения которых допускали наличие у пациентов психической коморбидности (биполярного аффективного расстройства, психотических расстройств, злоупотребления психоактивными веществами). Отбор исследований производился двумя авторами; спорные вопросы решались достижением консенсуса.
Конечная точка интереса в исследованиях составляла 8 нед – рекомендованная длительность купирующей терапии БДР. Если данные о 8 нед терапии были недоступны, авторы использовали информацию о длительности лечения от 6 до 12 нед (в зависимости от конечных точек в исследовании).
В качестве критериев эффективности среди прочих оценивалась доля пациентов, ответивших на терапию и достигших ремиссии (по шкалам HDRS или MADRS). Ответ на терапию определялся как снижение общего балла по шкале HDRS или MADRS на 50% и более от исходного. Достижение ремиссии оценивалось как 7 баллов и ниже по шкале HDRS (версия, состоящая из 17 пунктов) или 8 баллов и ниже (более длинные версии шкалы HDRS) либо 12 и менее баллов по шкале MADRS.
Переносимость оценивалась по показателю доли досрочно прекративших участие в исследовании из-за нежелательных явлений (НЯ).
Сбор данных осуществлялся двумя авторами независимо друг от друга; оценивались год выхода публикации, популяция участвовавших в исследовании (размер выборки, возраст, пол, тяжесть заболевания), интервенция, препарат сравнения, эффекты терапии (доли респондеров и ремиттеров, среднее изменение общего балла по шкале HDRS, досрочное прекращение участия в исследовании по причине НЯ), характеристики исследования (длительность, временные интервалы проведения обследования, тип медицинского учреждения, его локализация), источник финансирования.
Риск систематической погрешности оценивался отдельно для каждого включенного в анализ исследования с использованием Cochrane Collaboration Risk of Bias Tool, базирующейся на шести доменах: генерации последовательностей, сокрытии порядка распределения пациентов по группам, заслеплении участников исследования и персонала, заслеплении оценивающих результат, неполных данных о результатах, избирательном репортировании. Авторы также учитывали другие типы ошибок, например спонсорство. Суждение о риске систематической погрешности выносилось для каждого домена на основании трех категорий: высокий риск, низкий риск, неясный риск погрешности.
Прямое сравнение. Попарный метаанализ был выполнен с использованием STATA (version 13.0).
Непрямое и смешанное сравнение. Частотный сетевой метаанализ с использованием мультивариативной модели метаанализа (mvmeta) был выполнен с использованием STATA (version 13.0).
Статистическая гетерогенность каждого из парных сравнений оценивалась авторами методом хи-квадрат. В сетевом метаанализе для каждого прямого сравнения доказывались стандартные колебания гетерогенности.
Оценка несоответствия данных. Допущение непротиворечивости данных (согласованность между прямыми и непрямыми источниками доказательности), лежащее в основе сетевого метаанализа, может быть нарушено как в частях сети (контуры сравнения), так и сети в целом. В исследовании проводились как локальные, так и глобальные тесты для оценки несоответствия данных.
Сетевая метарегрессия осуществлялась с использованием следующих изменяющих эффект параметров как возможных источников клинической гетерогенности и гетерогенности результатов клинических исследований: время проведения анализа, возраст, тяжесть заболевания, вид лечебного учреждения.
Общее число пациентов составило 16 389 человек. Средний возраст больных – от 36 до 75 лет; 67% женщины. С участием только пожилых пациентов (в возрасте от 55 или 65 лет) проводились 8 из 76 исследований. Длительность исследований варьировала от 6 до 24 нед; длительность большинства составила 8 нед. Анализ данных во включенных в анализ исследованиях осуществлялся через 6, 7, 8 и 12 нед от начала терапии.
Средний балл по шкале HDRS варьировал от 16 до 30. В большинство исследований включали пациентов с умеренным и тяжелым БДР. В 19 исследованиях указывалась доля пациентов с тяжелым БДР, составлявшая от 5 до 60%; 5 исследований были выполнены с участием пациентов с тяжелым БДР.
 Оценка риска систематической погрешности. Большинство исследований были оценены как имеющие высокий или неясный риск систематической погрешности как минимум в одном домене Cochrane Collaboration Risk of Bias Tool. Во многих исследованиях нет информации о процедуре рандомизации и сокрытии порядка распределения пациентов по группам. Почти 80% исследований (61 из 76) оплачивались производителями препаратов.
Оценка риска систематической погрешности. Большинство исследований были оценены как имеющие высокий или неясный риск систематической погрешности как минимум в одном домене Cochrane Collaboration Risk of Bias Tool. Во многих исследованиях нет информации о процедуре рандомизации и сокрытии порядка распределения пациентов по группам. Почти 80% исследований (61 из 76) оплачивались производителями препаратов.
Ответ на терапию. В 63 исследованиях были представлены данные о доле ответивших на терапию. Агомелатин, эсциталопрам, миртазапин и венлафаксин оказались значительно более эффективными, чем флуоксетин, в достижении 50% редукции общего балла по шкалам HDRS и MADRS по сравнению с исходным. В сравнении с флуоксетином у миртазапина и агомелатина был самый большой эффект лечения на долю ответивших на терапию (отношение шансов – ОШ 1,56; 95% доверительный интервал – ДИ 1,24–1,97 и ОШ 1,46; 95% ДИ 1,18–1,81); далее в порядке убывания эффекта лечения оказались венлафаксин, эсциталопрам, пароксетин, сертралин.
Ремиссия. В 50 исследованиях доля достигших ремиссии указывалась как конечная точка, но эти данные для флувоксамина были недоступны. Доля достигших ремиссии для агомелатина и венлафаксина значительно превышала таковую для флуоксетина и сертралина. У агомелатина в сравнении с флуоксетином оказался максимальный эффект лечения на долю достигших ремиссии; затем в порядке убывания величины эффекта лечения оказались венлафаксин, миртазапин, эсциталопрам. Результаты миртазапина и эсциталопрама незначимы.
Переносимость. Агомелатин обладал статистически значимо меньшим риском досрочного прекращения участия в исследовании из-за побочных эффектов в сравнении со всеми остальными препаратами, кроме сертралина. В последнем случае отличие не было статистически значимым (СР 1,58; 95% ДИ 0,96–2,59). На фоне терапии эсциталопрамом и сертралином риск досрочного прекращения участия в исследовании был значительно ниже, чем у пароксетина и венлафаксина. Несмотря на то что терапия эсциталопрамом и сертралином также переносилась лучше, чем лечение флуоксетином, разница не достигала статистически значимых величин. В сравнении с флуоксетином терапия дулоксетином сопровождалась максимальным риском досрочного прекращения из-за НЯ (ОШ 2,23; 95% ДИ 1,52–3,28); на втором месте оказался венлафаксин (ОШ 1,41; 95% ДИ 1,10–1,81). Дулоксетин обладал худшей переносимостью, чем остальные препараты, особенно эсциталопрам, миртазапин, пароксетин, сертралин и венлафаксин (статистически значимая разница).
Таким образом, согласно данным, представленным в исследовании, четырьмя наиболее эффективными препаратами с точки зрения ответа на терапию (со значениями SUCRA) оказались миртазапин (89,6%), венлафаксин (79,4%), агомелатин (79,8%) и эсциталопрам (64,5%). Что касается достижения ремиссии, наиболее эффективны препараты агомелатин (86,8%), венлафаксин (74,1%), миртазапин (69,8%) и эсциталопрам (63,1%).
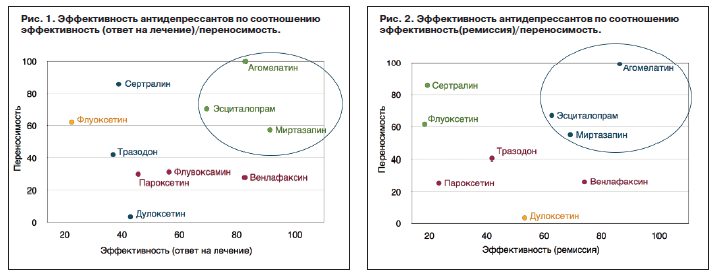
При условии, что доли ответивших на терапию и достигших ремиссии пациентов были приняты в качестве критерия эффективности, с учетом переносимости по графикам кластерного распределения агомелатин, эсциталопрам и миртазапин оказались наиболее эффективными препаратами (рис. 1, 2).
Анализ сетевой метарегрессии выявил, что время проведения обследования (6, 7, 8 или 12 нед), а также тип медицинского учреждения (амбулаторное или стационарное) не оказывало значимого влияния на предполагаемую эффективность терапии.
С целью оценки влияния характеристик пациентов на результаты терапии отдельно были проанализированы данные пожилых больных, а также пациентов с тяжелым БДР (определяемым как 25 и более баллов по шкале HDRS или 30 и более баллов по шкале MADRS на исходном визите). Не было выявлено значимой разницы в предполагаемой эффективности терапии по сравнению с основным анализом. Схожим образом анализ чувствительности характеристик исследования (например, риск систематической ошибки) также не привел к значимым изменениям результата.
Для сравнений, по которым были доступны результаты двух и более исследований, парные соотношения шансов из сетевого метаанализа сравнивались с соотношениями шансов с использованием традиционного метаанализа. В большинстве случаев результаты сравнения из традиционного метаанализа совпадали с таковыми из сетевого метаанализа.
Доказано, что агомелатин, эсциталопрам, миртазапин и венлафаксин более эффективны в достижении ответа на терапию и ремиссии.
Методы оценки А.Khoo и соавт. (2015 г.) можно признать систематическими и полными. Учитывая большое число вариантов лечения, метаанализ прямых сравнений ограничивается доступностью результатов прямых РКИ, в которых участвуют определенные пары препаратов. Дополнительный количественный метод сетевого метаанализа позволяет преодолеть это ограничение путем объединения результатов прямых и непрямых сравнений и обеспечивает более точный суммарный эффект лечения.
Потенциальные систематические ошибки могут возникать и из-за гетерогенности исследований; например различия в выборках (возраст и тяжесть заболевания) или дизайнах исследований (временные точки проведения обследований). Однако в данной работе авторы провели сетевую метарегрессию и выявили, что эти переменные не оказывали значимого влияния на результаты нашего исследования.
Следует указать, что результаты представленного метаанализа созвучны с данными S.Kasper и соавт. (2013 г.), которые для сравнения антидепрессивного эффекта агомелатина с селективными ингибиторами обратного захвата серотонина (СИОЗС) и селективными ингибиторами обратного захвата норадреналина использовали совокупный анализ индивидуальных данных пациентов. Оценка состояния проводилась по шкале HAMD-17 [3]. В анализ было включено 6 исследований: агомелатин в сравнении с венлафаксином, сертралином, флуоксетином, пароксетином и эсциталопрамом. Всего было рандомизировано 2034 пациента (возраст 47,6±14,9 года; 73% женщины; общий балл по шкале HAMD17=26,9±3,0). В окончательный анализ привлекли данные о 1997 пациентах (1001 человек получал агомелатин, 996 – СИОЗС/селективные ингибиторы обратного захвата серотонина и норадреналина – СИОЗСН). Была выявлена значимая разница между общим баллом по шкале HAMD-17. Более сильная редукция общего балла HAMD-17 наблюдалась в группе получавших агомелатин (95% ДИ 0,18–1,53; р=0,013). Доля ответивших на лечение также оказалась больше на фоне терапии агомелатином как по шкале HAMD-17 (р=0,012), так и по шкале CGI-I (р=0,032), что подтверждает клиническую релевантность полученных данных. Результаты не зависели от исходной тяжести депрессии.
Как и в работе А.Khoo и соавт. (2015 г.), агомелатин обладал лучшей переносимостью, чем СИОЗС и СИОЗСН: значительно меньше пациентов, получавших агомелатин, досрочно прекратили участие в исследовании из-за НЯ (р<0,001) как на первой неделе терапии, так и в каждой точке оценки исследования. Такие же результаты были получены при анализе досрочного выбывания из исследования по причине гастроинтестинальных НЯ [3].
Сводный метаанализ отдаленных результатов 4 сравнительных исследований агомелатина в сравнении с флуоксетином, сертралином и эсциталопрамом (2 исследования) представили в 2013 г. К.Demyttenaere и соавт. [4]. К концу 24-недельного периода лечения финальный общий балл по шкале HAMD-17 был значительно ниже у пациентов, получавших агомелатин, по сравнению с пациентами, принимавшими СИОЗС. Такие же результаты получены в группе пациентов с тяжелой депрессией (р=0,014 и 0,040 соответственно). Частота ответа на лечение/доля респондеров по шкале HAMD в конце 24-недельного периода была значительно выше среди пациентов, получавших агомелатин, по сравнению с пациентами, получавшими СИОЗС, как и в группе больных с тяжелой депрессией (р=0,031 и 0,048 соответственно). Частота ремиссии по шкале HAMD в конце 24-недельного периода терапии была численно, но статистически незначимо выше у пациентов, получавших агомелатин, по сравнению с пациентами, получавшими СИОЗС. Финальный балл по шкале CGI-I был значительно ниже у пациентов, получавших агомелатин. Доля респондеров и частота ремиссии по шкале CGI-I оказались численно, но статистически незначимо выше у пациентов, получавших агомелатин. Число пациентов, у которых во время лечения возникло как минимум одно НЯ, приведшее к отмене терапии, составило 9,4% среди больных, получавших СИОЗС, и 6,6% среди тех, кто получал агомелатин (р=0,065).
Целью систематического обзора и метаанализа опубликованных и неопубликованных двойных слепых рандомизированных исследований, выполненных D.Taylor и соавт. (2014 г.), являлась оценка эффективности агомелатина у пациентов с депрессией [5]. Исследования объединялись с помощью модели случайных эффектов DerSimonian и Laird для сравнений с плацебо и антидепрессантом – препаратом сравнения. Основной критерий эффективности (изменение баллов оценочной шкалы) суммировался со стандартизованной разностью средних (СРС; измерение размера эффекта) и дополнительными измерениями результата с относительными рисками. Все результаты были представлены с 95% ДИ. Статистическая гетерогенность исследовалась с помощью визуального изучения воронкообразного графика и I2-статистики. Модификаторы эффекта исследовались метарегрессией.
D.Taylor и соавт. (2014 г.) обнаружили 20 исследований (7450 пациентов), соответствующих критериям включения (11 в опубликованной литературе, 4 из файла Европейского агентства по лекарственным средствам и 5 от производителя). Почти во всех исследованиях применялась шкала HAMD-17 (балл 0–50). Агомелатин по эффективности значительно превосходил плацебо с размером эффекта (СРС) в 0,24 (95% ДИ от 0,12 до 0,35) и относительным риском ответа 1,25 (от 1,11 до 1,4). В сравнении с другими антидепрессантами агомелатин показал тенденцию к превосходящей эффективности (СРС 0,00, от -0,09 до 0,10).
Таким образом, по соотношению показателей эффективности и переносимости одним из лидеров среди антидепрессантов является агомелатин, что подтверждается результатами применения препарата в реальной клинической практике [6–13].
Сведения об авторе
Фролова Вероника Игоревна – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР
ФГАОУ ВО РУДН. E-mail: frolova_vi@pfur.ru
Ключевые слова: сетевой метаанализ, антидепрессанты, агомелатин.
frolova_vi@pfur.ru
Для цитирования: Фролова В.И. Обзор данных сетевого метаанализа эффективности антидепрессантов нового поколения. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2016; 18 (6): 21–25.
Network meta-analysis of new generation antidepressants
V.I.Frolova
People’s Friendship University of Russia. 117198, Russian Federation, Moscow, ul. Miklukho-Maklaia, d. 6
The article presents the results of a network meta-analysis of the efficacy of ten commonly used for the relief of major depressive disorder with antidepressants. In a meta-analysis of the data has been included on the results of treatment of 16 389 patients. The average score on the HDRS scale ranged from 16 to 30. Agomelatine had a significantly lower risk of early termination of the study because of side effects. When using a composite performance indicator (including the share of responders and remitterov) and tolerability of agomelatine were the most effective, escitalopram and mirtazapine.
Key words: network meta-analysis, antidepressants, agomelatine.
frolova_vi@pfur.ru
For citation: Frolova V.I. Network meta-analysis of new generation antidepressants. Psychiatry and Psychopharmacotherapy (P.B.Gannushkin Journal). 2016; 18 (6): 21–25.
Существование в парадигме доказательной медицины, основанной не только на клинических суждениях, но и на релевантном научном обосновании, а также учете индивидуальных интересов и потребностей пациентов, требует от современного специалиста постоянного обновления знаний.
Несмотря на то что рандомизированные клинические исследования (РКИ) выявляют наиболее очевидные из доступных доказательств относительного эффекта терапии для определенных пар сравнения, иногда данные о прямых сравнениях препаратов могут быть недоступны. В таких случаях для определения относительной эффективности одного антидепрессанта в сравнении с другим мы обращаемся к непрямому сравнению с использованием сетевого метаанализа.
Систематические метаанализы являются формой исследований, позволяющей концентрированно охватить большой срез результатов научных работ, и впоследствии становятся основой для составления рекомендаций и руководств по лечению.
Метаанализ – статистический анализ большого объема полученных в результате отдельных исследований данных с целью их интеграции. В отличие от совокупного анализа, где объектами всех обязательно схожих по методологии исследований являются субъекты, а исходная информация обо всех пациентах используется как часть одного большого исследования, при метаанализе изучается определенное число исследований и используется стандартная оценка размера эффекта для каждого исследования; при этом возможны включение исследований с разной методологией и ограниченный субанализ (регрессивный метаанализ).
Сетевой метаанализ – это метод, при котором несколько метаанализов прямых сравнений 2 препаратов оцениваются одновременно; при этом могут быть синтезированы данные как прямых, так и непрямых сравнений из различных исследований, базирующиеся на одном препарате сравнения. В этом аспекте сетевой метаанализ преодолевает ограничения традиционных «попарных» метаанализов.
Таким образом, метаанализы формируют доказательную базу высочайшего качества для сравнения стратегий лечения [1]. Способность критически оценивать метаанализы и результаты клинических исследований является неотъемлемым аспектом современной клинической практики для обеспечения наилучшего возможного лечения для пациентов.
А.Khoo и соавт. (2015 г.) провели сетевой метаанализ эффективности терапии десятью широко используемыми для купирования большого депрессивного расстройства (БДР) антидепрессантами [2].
Целью являлось определение наиболее эффективного антидепрессанта для лечения БДР. Осуществлялся систематический поиск в PubMed, Embase, Cochrane Library вплоть до июня 2015 г. Включались статьи на английском языке; использовалась высокочувствительная стратегия поиска Cochrane, позволявшая выявлять рандомизированные исследования с использованием индекса медицинских наименований, а также названий 10 антидепрессантов в сочетании с термином БДР.
Авторы включали прямые сравнительные РКИ длительностью как минимум 6 нед, в которых оценивалась монотерапия БДР 2 из следующих 10 антидепрессантов: агомелатином, дулоксетином, эсциталопрамом, флувоксамином, флуоксетином, миртазапином, пароксетином, сертралином, тразодоном, венлафаксином.
В исследованиях участвовали пациенты старше 18 лет с БДР умеренной или тяжелой степени по критериям DSM (DSM-III, DSM-III-R, DSM-IV, DSM-IV-TR). Исследования проводились в амбулаторных и стационарных учреждениях. В анализ не включались исследования с участием детей, подростков и беременных. Также в анализ не включались исследования, критерии включения которых допускали наличие у пациентов психической коморбидности (биполярного аффективного расстройства, психотических расстройств, злоупотребления психоактивными веществами). Отбор исследований производился двумя авторами; спорные вопросы решались достижением консенсуса.
Конечная точка интереса в исследованиях составляла 8 нед – рекомендованная длительность купирующей терапии БДР. Если данные о 8 нед терапии были недоступны, авторы использовали информацию о длительности лечения от 6 до 12 нед (в зависимости от конечных точек в исследовании).
В качестве критериев эффективности среди прочих оценивалась доля пациентов, ответивших на терапию и достигших ремиссии (по шкалам HDRS или MADRS). Ответ на терапию определялся как снижение общего балла по шкале HDRS или MADRS на 50% и более от исходного. Достижение ремиссии оценивалось как 7 баллов и ниже по шкале HDRS (версия, состоящая из 17 пунктов) или 8 баллов и ниже (более длинные версии шкалы HDRS) либо 12 и менее баллов по шкале MADRS.
Переносимость оценивалась по показателю доли досрочно прекративших участие в исследовании из-за нежелательных явлений (НЯ).
Сбор данных осуществлялся двумя авторами независимо друг от друга; оценивались год выхода публикации, популяция участвовавших в исследовании (размер выборки, возраст, пол, тяжесть заболевания), интервенция, препарат сравнения, эффекты терапии (доли респондеров и ремиттеров, среднее изменение общего балла по шкале HDRS, досрочное прекращение участия в исследовании по причине НЯ), характеристики исследования (длительность, временные интервалы проведения обследования, тип медицинского учреждения, его локализация), источник финансирования.
Риск систематической погрешности оценивался отдельно для каждого включенного в анализ исследования с использованием Cochrane Collaboration Risk of Bias Tool, базирующейся на шести доменах: генерации последовательностей, сокрытии порядка распределения пациентов по группам, заслеплении участников исследования и персонала, заслеплении оценивающих результат, неполных данных о результатах, избирательном репортировании. Авторы также учитывали другие типы ошибок, например спонсорство. Суждение о риске систематической погрешности выносилось для каждого домена на основании трех категорий: высокий риск, низкий риск, неясный риск погрешности.
Прямое сравнение. Попарный метаанализ был выполнен с использованием STATA (version 13.0).
Непрямое и смешанное сравнение. Частотный сетевой метаанализ с использованием мультивариативной модели метаанализа (mvmeta) был выполнен с использованием STATA (version 13.0).
Статистическая гетерогенность каждого из парных сравнений оценивалась авторами методом хи-квадрат. В сетевом метаанализе для каждого прямого сравнения доказывались стандартные колебания гетерогенности.
Оценка несоответствия данных. Допущение непротиворечивости данных (согласованность между прямыми и непрямыми источниками доказательности), лежащее в основе сетевого метаанализа, может быть нарушено как в частях сети (контуры сравнения), так и сети в целом. В исследовании проводились как локальные, так и глобальные тесты для оценки несоответствия данных.
Сетевая метарегрессия осуществлялась с использованием следующих изменяющих эффект параметров как возможных источников клинической гетерогенности и гетерогенности результатов клинических исследований: время проведения анализа, возраст, тяжесть заболевания, вид лечебного учреждения.
Результаты
Анализ опубликованных данных включал результаты 6469 исследований. Оценка каждой публикации по названию и содержанию позволил выделить 94 потенциально релевантных публикации. В конечном итоге для анализа были выбраны 76 исследований, проведенных с 1989 по 2014 г. Большинство исследований проведено на Европейском и Североамериканском континентах; только 10% исследований включало пациентов из Азии.Общее число пациентов составило 16 389 человек. Средний возраст больных – от 36 до 75 лет; 67% женщины. С участием только пожилых пациентов (в возрасте от 55 или 65 лет) проводились 8 из 76 исследований. Длительность исследований варьировала от 6 до 24 нед; длительность большинства составила 8 нед. Анализ данных во включенных в анализ исследованиях осуществлялся через 6, 7, 8 и 12 нед от начала терапии.
Средний балл по шкале HDRS варьировал от 16 до 30. В большинство исследований включали пациентов с умеренным и тяжелым БДР. В 19 исследованиях указывалась доля пациентов с тяжелым БДР, составлявшая от 5 до 60%; 5 исследований были выполнены с участием пациентов с тяжелым БДР.
 Оценка риска систематической погрешности. Большинство исследований были оценены как имеющие высокий или неясный риск систематической погрешности как минимум в одном домене Cochrane Collaboration Risk of Bias Tool. Во многих исследованиях нет информации о процедуре рандомизации и сокрытии порядка распределения пациентов по группам. Почти 80% исследований (61 из 76) оплачивались производителями препаратов.
Оценка риска систематической погрешности. Большинство исследований были оценены как имеющие высокий или неясный риск систематической погрешности как минимум в одном домене Cochrane Collaboration Risk of Bias Tool. Во многих исследованиях нет информации о процедуре рандомизации и сокрытии порядка распределения пациентов по группам. Почти 80% исследований (61 из 76) оплачивались производителями препаратов.Ответ на терапию. В 63 исследованиях были представлены данные о доле ответивших на терапию. Агомелатин, эсциталопрам, миртазапин и венлафаксин оказались значительно более эффективными, чем флуоксетин, в достижении 50% редукции общего балла по шкалам HDRS и MADRS по сравнению с исходным. В сравнении с флуоксетином у миртазапина и агомелатина был самый большой эффект лечения на долю ответивших на терапию (отношение шансов – ОШ 1,56; 95% доверительный интервал – ДИ 1,24–1,97 и ОШ 1,46; 95% ДИ 1,18–1,81); далее в порядке убывания эффекта лечения оказались венлафаксин, эсциталопрам, пароксетин, сертралин.
Ремиссия. В 50 исследованиях доля достигших ремиссии указывалась как конечная точка, но эти данные для флувоксамина были недоступны. Доля достигших ремиссии для агомелатина и венлафаксина значительно превышала таковую для флуоксетина и сертралина. У агомелатина в сравнении с флуоксетином оказался максимальный эффект лечения на долю достигших ремиссии; затем в порядке убывания величины эффекта лечения оказались венлафаксин, миртазапин, эсциталопрам. Результаты миртазапина и эсциталопрама незначимы.
Переносимость. Агомелатин обладал статистически значимо меньшим риском досрочного прекращения участия в исследовании из-за побочных эффектов в сравнении со всеми остальными препаратами, кроме сертралина. В последнем случае отличие не было статистически значимым (СР 1,58; 95% ДИ 0,96–2,59). На фоне терапии эсциталопрамом и сертралином риск досрочного прекращения участия в исследовании был значительно ниже, чем у пароксетина и венлафаксина. Несмотря на то что терапия эсциталопрамом и сертралином также переносилась лучше, чем лечение флуоксетином, разница не достигала статистически значимых величин. В сравнении с флуоксетином терапия дулоксетином сопровождалась максимальным риском досрочного прекращения из-за НЯ (ОШ 2,23; 95% ДИ 1,52–3,28); на втором месте оказался венлафаксин (ОШ 1,41; 95% ДИ 1,10–1,81). Дулоксетин обладал худшей переносимостью, чем остальные препараты, особенно эсциталопрам, миртазапин, пароксетин, сертралин и венлафаксин (статистически значимая разница).
Таким образом, согласно данным, представленным в исследовании, четырьмя наиболее эффективными препаратами с точки зрения ответа на терапию (со значениями SUCRA) оказались миртазапин (89,6%), венлафаксин (79,4%), агомелатин (79,8%) и эсциталопрам (64,5%). Что касается достижения ремиссии, наиболее эффективны препараты агомелатин (86,8%), венлафаксин (74,1%), миртазапин (69,8%) и эсциталопрам (63,1%).
При условии, что доли ответивших на терапию и достигших ремиссии пациентов были приняты в качестве критерия эффективности, с учетом переносимости по графикам кластерного распределения агомелатин, эсциталопрам и миртазапин оказались наиболее эффективными препаратами (рис. 1, 2).
Анализ сетевой метарегрессии выявил, что время проведения обследования (6, 7, 8 или 12 нед), а также тип медицинского учреждения (амбулаторное или стационарное) не оказывало значимого влияния на предполагаемую эффективность терапии.
С целью оценки влияния характеристик пациентов на результаты терапии отдельно были проанализированы данные пожилых больных, а также пациентов с тяжелым БДР (определяемым как 25 и более баллов по шкале HDRS или 30 и более баллов по шкале MADRS на исходном визите). Не было выявлено значимой разницы в предполагаемой эффективности терапии по сравнению с основным анализом. Схожим образом анализ чувствительности характеристик исследования (например, риск систематической ошибки) также не привел к значимым изменениям результата.
Для сравнений, по которым были доступны результаты двух и более исследований, парные соотношения шансов из сетевого метаанализа сравнивались с соотношениями шансов с использованием традиционного метаанализа. В большинстве случаев результаты сравнения из традиционного метаанализа совпадали с таковыми из сетевого метаанализа.
Обсуждение
Сетевой метаанализ А.Khoo и соавт. (2015 г.) показал, что наиболее эффективными препаратами с учетом доли пациентов, ответивших на терапию, и доли пациентов, достигнувших ремиссии, оказались миртазапин и агомелатин соответственно. Агомелатин, сертралин и эсциталопрам переносились лучше остальных препаратов, включенных в анализ; худшая переносимость была у дулоксетина и венлафаксина. При использовании составного показателя эффективности (доли ответивших на терапию и достигнувших ремиссии) и переносимости наиболее эффективными препаратами оказались опять же агомелатин, эсциталопрам и миртазапин.Доказано, что агомелатин, эсциталопрам, миртазапин и венлафаксин более эффективны в достижении ответа на терапию и ремиссии.
Методы оценки А.Khoo и соавт. (2015 г.) можно признать систематическими и полными. Учитывая большое число вариантов лечения, метаанализ прямых сравнений ограничивается доступностью результатов прямых РКИ, в которых участвуют определенные пары препаратов. Дополнительный количественный метод сетевого метаанализа позволяет преодолеть это ограничение путем объединения результатов прямых и непрямых сравнений и обеспечивает более точный суммарный эффект лечения.
Потенциальные систематические ошибки могут возникать и из-за гетерогенности исследований; например различия в выборках (возраст и тяжесть заболевания) или дизайнах исследований (временные точки проведения обследований). Однако в данной работе авторы провели сетевую метарегрессию и выявили, что эти переменные не оказывали значимого влияния на результаты нашего исследования.
Следует указать, что результаты представленного метаанализа созвучны с данными S.Kasper и соавт. (2013 г.), которые для сравнения антидепрессивного эффекта агомелатина с селективными ингибиторами обратного захвата серотонина (СИОЗС) и селективными ингибиторами обратного захвата норадреналина использовали совокупный анализ индивидуальных данных пациентов. Оценка состояния проводилась по шкале HAMD-17 [3]. В анализ было включено 6 исследований: агомелатин в сравнении с венлафаксином, сертралином, флуоксетином, пароксетином и эсциталопрамом. Всего было рандомизировано 2034 пациента (возраст 47,6±14,9 года; 73% женщины; общий балл по шкале HAMD17=26,9±3,0). В окончательный анализ привлекли данные о 1997 пациентах (1001 человек получал агомелатин, 996 – СИОЗС/селективные ингибиторы обратного захвата серотонина и норадреналина – СИОЗСН). Была выявлена значимая разница между общим баллом по шкале HAMD-17. Более сильная редукция общего балла HAMD-17 наблюдалась в группе получавших агомелатин (95% ДИ 0,18–1,53; р=0,013). Доля ответивших на лечение также оказалась больше на фоне терапии агомелатином как по шкале HAMD-17 (р=0,012), так и по шкале CGI-I (р=0,032), что подтверждает клиническую релевантность полученных данных. Результаты не зависели от исходной тяжести депрессии.
Как и в работе А.Khoo и соавт. (2015 г.), агомелатин обладал лучшей переносимостью, чем СИОЗС и СИОЗСН: значительно меньше пациентов, получавших агомелатин, досрочно прекратили участие в исследовании из-за НЯ (р<0,001) как на первой неделе терапии, так и в каждой точке оценки исследования. Такие же результаты были получены при анализе досрочного выбывания из исследования по причине гастроинтестинальных НЯ [3].
Сводный метаанализ отдаленных результатов 4 сравнительных исследований агомелатина в сравнении с флуоксетином, сертралином и эсциталопрамом (2 исследования) представили в 2013 г. К.Demyttenaere и соавт. [4]. К концу 24-недельного периода лечения финальный общий балл по шкале HAMD-17 был значительно ниже у пациентов, получавших агомелатин, по сравнению с пациентами, принимавшими СИОЗС. Такие же результаты получены в группе пациентов с тяжелой депрессией (р=0,014 и 0,040 соответственно). Частота ответа на лечение/доля респондеров по шкале HAMD в конце 24-недельного периода была значительно выше среди пациентов, получавших агомелатин, по сравнению с пациентами, получавшими СИОЗС, как и в группе больных с тяжелой депрессией (р=0,031 и 0,048 соответственно). Частота ремиссии по шкале HAMD в конце 24-недельного периода терапии была численно, но статистически незначимо выше у пациентов, получавших агомелатин, по сравнению с пациентами, получавшими СИОЗС. Финальный балл по шкале CGI-I был значительно ниже у пациентов, получавших агомелатин. Доля респондеров и частота ремиссии по шкале CGI-I оказались численно, но статистически незначимо выше у пациентов, получавших агомелатин. Число пациентов, у которых во время лечения возникло как минимум одно НЯ, приведшее к отмене терапии, составило 9,4% среди больных, получавших СИОЗС, и 6,6% среди тех, кто получал агомелатин (р=0,065).
Целью систематического обзора и метаанализа опубликованных и неопубликованных двойных слепых рандомизированных исследований, выполненных D.Taylor и соавт. (2014 г.), являлась оценка эффективности агомелатина у пациентов с депрессией [5]. Исследования объединялись с помощью модели случайных эффектов DerSimonian и Laird для сравнений с плацебо и антидепрессантом – препаратом сравнения. Основной критерий эффективности (изменение баллов оценочной шкалы) суммировался со стандартизованной разностью средних (СРС; измерение размера эффекта) и дополнительными измерениями результата с относительными рисками. Все результаты были представлены с 95% ДИ. Статистическая гетерогенность исследовалась с помощью визуального изучения воронкообразного графика и I2-статистики. Модификаторы эффекта исследовались метарегрессией.
D.Taylor и соавт. (2014 г.) обнаружили 20 исследований (7450 пациентов), соответствующих критериям включения (11 в опубликованной литературе, 4 из файла Европейского агентства по лекарственным средствам и 5 от производителя). Почти во всех исследованиях применялась шкала HAMD-17 (балл 0–50). Агомелатин по эффективности значительно превосходил плацебо с размером эффекта (СРС) в 0,24 (95% ДИ от 0,12 до 0,35) и относительным риском ответа 1,25 (от 1,11 до 1,4). В сравнении с другими антидепрессантами агомелатин показал тенденцию к превосходящей эффективности (СРС 0,00, от -0,09 до 0,10).
Вывод
В ходе сетевого метаанализа разнообразных критериев эффективности, а также переносимости 10 современных антидепрессантов получены достоверные данные о преимуществах для получения ответа на терапию и достижения ремиссии агомелатином. Агомелатин и миртазапин обладали преимуществом при использовании «составного» (складывающегося из доли пациентов, ответивших на терапию, и доли пациентов, достигших ремиссии) результата лечения, а также переносимости.Таким образом, по соотношению показателей эффективности и переносимости одним из лидеров среди антидепрессантов является агомелатин, что подтверждается результатами применения препарата в реальной клинической практике [6–13].
Сведения об авторе
Фролова Вероника Игоревна – канд. мед. наук, доц. каф. психиатрии, психотерапии и психосоматической патологии ФПКМР
ФГАОУ ВО РУДН. E-mail: frolova_vi@pfur.ru
Список исп. литературыСкрыть список1. Медведев В.Э. Метаанализ при оценке антидепрессивной эффективности. Дневник психиатра. 2015; 3: 19–21. / Medvedev V.E. Metaanaliz pri otsenke antidepressivnoi effektivnosti. Dnevnik psikhiatra. 2015; 3: 19–21. [in Russian]
2. Khoo AL, Zhou HJ, Teng M et al. Network Meta-Analysis and Cost-Effectiveness Generation Antidepressants. CNS Drugs 2015; 29 (8): 695–712; doi: 10.1007/s40263-015-0267-6.
3. Kasper S, Corruble E, Hale A et al. Antidepressant efficacy of agomelatine versus SSRI/SNRI: results from a pooled analysis of head-to-head studies without a placebo control. Int Clin Psychopharmacol 2013; 28: 12–9; doi: 10.1097/YIC.0b013e328359768e.
4. Demyttenaere K, Corruble E, Hale A et al. A pooled analysis of six month comparative efficacy and tolerability in four randomized clinical trials: agomelatine versus escitalopram, fluoxetine, and sertraline. C N S Spectrums 2013; 18: 163–70; doi:10.1017/S109285 2913000060.
5. Taylor D, Sparshatt A, Varma S, Olofinjana O. Antidepressant efficacy of agomelatine: meta-analysis of published and unpublished studies. BMJ 2014; 348: g1888; doi: 10.1136/bmj.g1888.
6. Гушанская Е.В., Фролова В.И., Медведев В.Э. Терапия тревожной депрессии (опыт применения Вальдоксана). Журн. психиатрии и психофармакотерапии. 2015; 1: 17–21. / Gushanskaia E.V., Frolova V.I., Medvedev V.E. Terapiia trevozhnoi depressii (opyt primeneniia Val'doksana). Zhurn. psikhiatrii i psikhofarmakoterapii. 2015; 1: 17–21. [in Russian]
7. Медведев В.Э. Применение Вальдоксана (агомелатин) в комбинированной терапии умеренно выраженных и тяжелых депрессий непсихотического уровня. Журн. неврологии и психиатрии им. С.С.Корсакова. 2012; 5 (Вып. 1): 37–40. / Medvedev V.E. Primenenie Val'doksana (agomelatin) v kombinirovannoi terapii umerenno vyrazhennykh i tiazhelykh depressii nepsikhoticheskogo urovnia. Zhurn. nevrologii i psikhiatrii im. S.S.Korsakova. 2012; 5 (Vyp. 1): 37–40. [in Russian]
8. Медведев В.Э. Комбинированная терапия депрессии Вальдоксаном (агомелатин) и антипсихотиками. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2012; 14 (2): 20–3. / Medvedev V.E. Kombinirovannaia terapiia depressii Val'doksanom (agomelatin) i antipsikhotikami. Psikhiatriia i psikhofarmakoterapiia (Zhurnal im. P.B.Gannushkina). 2012; 14 (2): 20–3. [in Russian]
9. Медведев В.Э. Перспективы использования мелатонинергических препаратов в терапии депрессий у пациентов с сердечно-сосудистыми заболеваниями. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2010; 12 (3): 17–22. / Medvedev V.E. Perspektivy ispol'zovaniia melatoninergicheskikh preparatov v terapii depressii u patsientov s serdechno-sosudistymi zabolevaniiami. Psikhiatriia i psikhofarmakoterapiia (Zhurnal im. P.B.Gannushkina). 2010; 12 (3): 17–22. [in Russian]
10. Медведев В.Э. Терапия непсихотических депрессий в рамках инволюционной истерии (опыт применения Вальдоксана). Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2011; 13 (4): 14–8. / Medvedev V.E. Terapiia nepsikhoticheskikh depressii v ramkakh involiutsionnoi isterii (opyt primeneniia Val'doksana). Psikhiatriia i psikhofarmakoterapiia (Zhurnal im. P.B.Gannushkina). 2011; 13 (4): 14–8. [in Russian]
11. Медведев В.Э. Лечение большого депрессивного расстройства легкой и средней степени тяжести Вальдоксаном (агомелатин) в кардиологической практике: результаты обсервационной национальной мультицентровой программы ПУЛЬС. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2014; 2014; 16 (5): 30–5. / Medvedev V.E. Lechenie bol'shogo depressivnogo rasstroistva legkoi i srednei stepeni tiazhesti Val'doksanom (agomelatin) v kardiologicheskoi praktike: rezul'taty observatsionnoi natsional'noi mul'titsentrovoi programmy PUL''S. Psikhiatriia i psikhofarmakoterapiia (Zhurnal im. P.B.Gannushkina). 2014; 16 (5): 30–5. [in Russian]
12. Медведев В.Э. Монотерапия дисфорической депрессии Вальдоксаном. Психиатрия и психофармакотерапия (Журнал им. П.Б.Ганнушкина). 2016; 18 (1): 20–3. / Medvedev V.E. Monoterapiia disforicheskoi depressii Val'doksanom. Psikhiatriia i psikhofarmakoterapiia (Zhurnal im. P.B.Gannushkina). 2016; 18 (1): 20–3. [in Russian]
13. Медведев В.Э., Ретюнский К.Ю., Овчинников А.А. и др. Корреляции между оценкой степени тяжести депрессии и эффективностью и переносимостью терапии агомелатином в повседневной российской клинической практике (клиническое исследование «ЭМОЦИЯ»). Журн. неврологии и психиатрии им. С.С.Корсакова. 2016; 12. (В печати.) / Medvedev V.E., Retiunskii K.Iu., Ovchinnikov A.A. i dr. Korreliatsii mezhdu otsenkoi stepeni tiazhesti depressii i effektivnost'iu i perenosimost'iu terapii agomelatinom v povsednevnoi rossiiskoi klinicheskoi praktike (klinicheskoe issledovanie «EMOTSIA»). Zhurn. nevrologii i psikhiatrii im. S.S.Korsakova. 2016; 12. (V pechati.) [in Russian]
10 ноября 2016
Количество просмотров: 2740

