Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2017
Жизнь на грани: социальный стресс, травма и психопатология №02 2017
Номера страниц в выпуске:52-57
Целью данного обзора является обсуждение влияния стресса на возникновение нейропсихической патологии с акцентом на воздействие стресса на функции нейронов, архитектуру мозга, нейробиологические механизмы, нейроэндокринные и обменные нарушения. Будут представлены новые терапевтические агенты для лечения и профилактики расстройств, вызванных воздействием стресса, и новые мишени для антидепрессантов.
Ключевые слова: конгресс Европейской коллегии нейропсихофармакологии, стресс, посттравматическое стрессовое расстройство.
Для цитирования: Франкова И.А. Жизнь на грани: социальный стресс, травма и психопатология. Психиатрия и психофармакотерапия. 2017; 19 (2): 52–57.
Ключевые слова: конгресс Европейской коллегии нейропсихофармакологии, стресс, посттравматическое стрессовое расстройство.
Для цитирования: Франкова И.А. Жизнь на грани: социальный стресс, травма и психопатология. Психиатрия и психофармакотерапия. 2017; 19 (2): 52–57.
Целью данного обзора является обсуждение влияния стресса на возникновение нейропсихической патологии с акцентом на воздействие стресса на функции нейронов, архитектуру мозга, нейробиологические механизмы, нейроэндокринные и обменные нарушения. Будут представлены новые терапевтические агенты для лечения и профилактики расстройств, вызванных воздействием стресса, и новые мишени для антидепрессантов.
Ключевые слова: конгресс Европейской коллегии нейропсихофармакологии, стресс, посттравматическое стрессовое расстройство.
Для цитирования: Франкова И.А. Жизнь на грани: социальный стресс, травма и психопатология. Психиатрия и психофармакотерапия. 2017; 19 (2): 52–57.
I.A.Frankova
A.A.Bogomolets National Medical University. 01601, Ukraine, Kyiv, b-r Tarasa Shevchenko, d. 13
iryna.frankova@gmail.com
This review aims to discuss the role of stress as a risk factor in neuropsychiatric pathology, with a focus on the effects of stress on neuronal function, brain architecture, neurobiological mechanisms, and neuroendocrine disorders. It will be suggested new putative therapeutic agents for the treatment and prevention of stress related disorders and new targets for antidepressant drugs.
Key words: European college of neuropsychopharmacology congress, stress, post-traumatic stress disorder.
For citation: Frankova I.A. Life on the brink: social stress, trauma and psychopathology (29th European college of neuropsychopharmaclogy congress materials review). Psychiatry and Psychopharmacotherapy. 2017; 19 (2): 52–57.
Данный обзор подготовлен по материалам 29-го конгресса Европейского колледжа нейропсихофармакологии (сентябрь 2016 г., Вена) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании “Сервье”» (East European Educational WPA – Servier Academy – EEEWPA-Servier Academy) специально для психиатрических журналов Зоны 10 Всемирной психиатрической ассоциации.
Большинство людей неизбежно сталкиваются со стрессом, по крайней мере, время от времени. Неблагоприятные события представляют собой серьезную угрозу для психического здоровья. Реакция на стресс может содействовать адаптивной пластичности, улучшая когнитивную сферу, если физиологическая реакция на стресс эффективно активируется и своевременно дезактивируется. В случае дисрегуляции стресс оказывает неадекватный и вредоносный эффект, сопутствует возникновению дезадаптации и психопатологии. Актуальность темы стресса в наши дни не оставляет сомнений. На 29-м конгрессе Европейской коллегии нейропсихофармакологии стрессу были посвящены 4 симпозиума и 1 пленарная лекция. Материалы с 2 симпозиумов детально представлены в данном обзоре.
В рамках симпозиума «Жизнь на грани: социальный стресс и психопатология» свой доклад представлял Maurizio Popoli из Института Милана, Италия (лаборатория нейропсихофармакологии и функциональной нейрогеномики). Он начал с базовых концепций, сформулированных еще в 1930 г. Гансом Селье: «Стресс – это неспецифический ответ тела на любое требование, представленное ему (физиологический ответ мозга и тела)». Стресс это не то, что случилось с нами, а то, как мы реагируем на это событие. Иными словами, в повседневной жизни важно не только количество стресса, с которым мы сталкиваемся, но и как мы на него реагируем – адаптивным либо дезадаптивным способом. Именно дезадаптация приводит к расстройствам, связанным со стрессом. Сейчас для нас очевидно, что стресс – это фактор риска для множества психических и соматических заболеваний (см. таблицу).
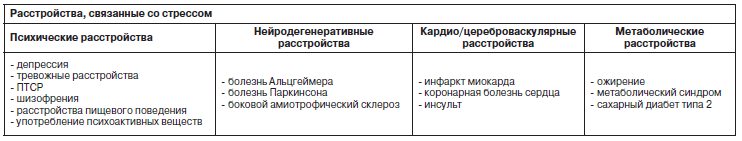
Если обратиться к физиологии, выделяют 2 типа ответа на стресс: быстрый и медленный. Задача быстрого ответа в первой фазе – увеличить скорость всех процессов в организме, которые могут быть полезны для системы «бегства или борьбы» (больше энергии высвобождается из мышц, происходит мощная стимуляция сердечно-сосудистой, иммунной системы и памяти). Вторая фаза намного медленнее и может занимать часы, дни и даже недели, ее задача – подавить все, что было активизировано в первой фазе (рис. 1).
 Адаптивный способ реагирования на стресс характеризуется своевременностью смены быстрого типа ответа на медленный.
Адаптивный способ реагирования на стресс характеризуется своевременностью смены быстрого типа ответа на медленный.
При разных психических нарушениях и заболеваниях, вызванных стрессом, на клеточном уровне меняется нейронная архитектура, возникают атрофия и сжатие апикальных дендритов в гиппокампе и префронтальной коре (ПФК). Это клинически подтверждает обратная корреляция между плотностью дендритов, синаптических шипиков (spines) гиппокампа и выраженностью тревоги/депрессии. Обнаружена также прямая корреляция между длительностью депрессивного эпизода и снижением объема плотности дендритов в упомянутых зонах головного мозга (ГМ).
Что же приводит к атрофии дендритов и снижению объема нейронов? Острый стресс вызывает активацию гипоталамо-гипофизарно-надпочечниковой оси (ГГНО), что приводит к повышению уровня кортикостероидов, связываясь с глюкокортикоидными и минералокортикоидными рецепторами, кортикостероиды вызывают увеличение глутамата в ПФК и фронтальной коре (ФК), используя механизм, который зависит от фосфориляции синапсина I в первую фазу стресса.
Глутамат – это главный возбуждающий медиатор, g-аминомасляная кислота (ГАМК) – главный тормоз для медиаторов, проводящих возбуждение в ГМ. ГАМК находится в постоянной конкуренции с глутаматом. В нормальном состоянии эта конкуренция приводит к паритету и тонкому равновесию возбуждения и торможения в нашем мозге. Торможение – это не отсутствие возбуждения, а активный процесс, требующий собственных нервных клеток, синапсов, медиаторов, энергии на торможение наш мозг тратит больше, чем на возбуждение. ГАМК – это простая молекула, получающаяся, как это ни парадоксально, из глутамата, если от него отщепить углекислый газ. Для того чтобы ГАМК работала именно как медиатор, она должна сформироваться в пресинаптическом окончании, окончании аксона. Дальше она выделяется, когда приходит нервный импульс, и воздействует на рецепторы. Описано два типа рецепторов к ГАМК, которые названы ГАМКА и ГАМКB-рецепторы. И тот, и другой в норме обязательно вызывают торможение.
В сочетании острый стресс и кортикостерон оказывают дестабилизирующее воздействие на глутаматергическую систему, в значительной степени увеличивая высвобождение глутамата, потенцируя возбуждение и синаптическую передачу нервного импульса, что приводит к вытягиванию дендритов. Этот феномен, являясь адаптивным при кратковременном влиянии стресса, становится патологическим при хронификации травматической ситуации.
Таким образом, действие стресса в сочетании с повышением уровня кортизола и нарушением передачи нервного импульса в глутаматергической системе (85% синапсов в ПФК и гиппокампе – глутаматергические) приводит к изменениям нейронной архитектуры. Если же за 2 нед до эксперимента со стрессом назначить антидепрессанты, то такого рода реакция глутамата в ответ на кортикостерон и в быструю, и медленную фазу блокируется. Антидепрессанты заметно снижают вызванное деполяризацией высвобождение глутамата, но не высвобождают ГАМК. Эти данные свидетельствуют о том, что антидепрессанты стабилизируют нейротрансмиссию глутамата в гиппокампе и представляют собой полезный инструмент для изучения взаимосвязи между функциональными и молекулярными процессами в нервных окончаниях. Похожее воздействие на нервную систему оказывают и физические упражнения.
M.Popoli описал эксперимент, позволяющий воспроизвести эти данные в эксперименте на грызунах. Недавно он показал, что 40-минутный протокол воздействия острого стресса (footshock – удар электрического тока по ногам) быстро усиливает вызванное деполяризацией высвобождение глутамата и передачу импульса в ПФК и ФК за счет увеличения циркуляции уровня кортизола. Связываясь с синаптическими рецепторами, кортизол вызывает быстрое (не геномное) усиление оборота пресинаптических везикул с глутаматом в перфорированных синапсах и увеличение размера пула готовых к выбросу (readily releasable pool) везикул, который вызывает усиление высвобождения глутамата из синаптических окончаний. В соответствующих исследованиях было показано, что острый футшок-стресс также резко (на 42,6%) увеличивает общее количество неперфорированных синапсов в ПФК, эффект снова же частично может быть предотвращен предварительным приемом антидепрессантов. Эти находки являются доказательством того, что стресс-зависимый синаптогенез асимметричных синапсов можно обнаружить уже через
40 мин после начала действия стресса. Кроме того, наблюдались значительная атрофия и ремоделирование атипичных дендритов в ПФК уже через 24 ч после футшок-стресса, которое сохраняется в течение 14 дней.
Таким образом, острый стресс может вызвать быстрые структурные/функциональные изменения в глутаматергических синапсах, а также приводить к устойчивому ремоделированию нейронной архитектуры.
Предыдущие исследования показали, что хронический стресс вызывает атрофию дендритов у грызунов в некоторых областях ГМ, и лишь несколько исследований показали аналогичные эффекты после воздействия острого стресса, в основном в гиппокампе. Взятые вместе, наши текущие и предыдущие исследования показывают, что последствия острого стресса далеко не только острые. Один эпизод стресса, которого невозможно избежать, может вызвать устойчивое увеличение размера пула готовых к выбросу везикул с глутаматом и усиление высвобождения глутамата в ПФК/ФК в течение по крайней мере 24 ч, что является основой быстрого ответа на стресс. Но также острый стресс вызывает продолжительные последствия и изменения в синаптических шипиках и плотности дендритов – аномальное повышение передачи нервного возбуждения является причиной дендритной атрофии в соответствующих синапсах от начала действия стресса и вплоть до 14 дней после. Текущие результаты согласуются с гипотезой, что острый стресс влияет на функцию и морфологию синапсов.
В отличие от хронического стресса, долгосрочные последствия острого стресса были мало или вообще не исследованы до сих пор. Традиционные исследования хронического стресса на грызунах просто рассматривали конечную точку многочисленных адаптаций, возникающих в процессе ответа мозга и тела на стресс, редко обращаясь к самому важному вопросу: как система добирается до точки, где физиологические реакции на стресс превращаются в неадаптивные, которые могут предрасполагать к психопатологии? Полученные результаты доказывают, что единичная травма достаточна, чтобы вызвать посттравматическое стрессовое расстройство (ПТСР) у людей. Изучение долгосрочных результатов воздействия острого стресса в моделях грызунов с наблюдением их поведения, функциональных и молекулярных изменений может позволить идентифицировать критические «точки поворота» в ответ на стресс и пролить свет на патофизиологию расстройств, вызванных стрессом. Понимание детерминант долгосрочных последствий острого стресса может помочь выделить нейронные механизмы и эффекторы (органы или клетки, которые активизируются в ответ на стимул), которые срабатывают неправильно во время реакции на стресс.
Острый стресс вызывает устойчивую активацию возбуждающих синапсов в ПФК/ФК, по крайней мере на 24 ч. Стрессиндуцированные пластические изменения в функциональных/структурных/молекулярных свойствах синапсов (изменение концентрации синапсина I) могут повлиять на последующую историю синапса (продленная во времени стрессовая реакция, ПТСР). Не все реагируют одинаковым образом на стимуляцию стрессом. Отслеживаемые пластические изменения можно условно разделить на 2 типа: уязвимый и устойчивый. Идентификация поворота, ключевые критические точки дихотомии в ответе мозга на стресс (адаптивная/неадаптивная, уязвимые против устойчивых) – эта концепция может лечь в основу исследований, направленных на поиск таргетного лечения.
Nuno Sousa, профессор Университета Мино (Португалия), в своем докладе «Динамика изменений в мозге под действием стресса» поддержал важность изучения предрасположенности индивида и дифференциации типа ответа на действие острого стресса. Последующий шаг – определить, будет ли сформированный паттерн достаточным, чтобы справиться со стрессом, и что меняется в цепи взаимодействий и структуре мозга. Стрессоры могут быть реальные или мнимые. Более того, стресс-факторы не только субъектзависимые (значение атрибуции), но и имеют разную временную динамику (повторяющиеся, краткосрочные или длительные), могут меняться по интенсивности (по крайней мере, в восприятии индивида). То есть стресс-факторы могут быть умеренными и относительно безвредными или иметь немедленные и/или долгосрочные последствия для благосостояния субъекта. Большинство людей время от времени неизбежно сталкиваются со стрессом. Тем не менее крайне важно подчеркнуть, что не всегда стресс является чем-то «плохим» и/или вредным. На самом деле стресс имеет решающее значение для нашего собственного выживания как вида, будучи неразрывно связанным с эволюцией – выживанием путем адаптации. Все животные, даже растения, имеют реакции на стресс.
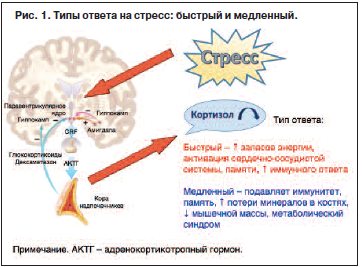
N.Sousa предложил динамическую рабочую модель целостного взгляда на сдвиг «вперед-назад» от здорового к стрессовому состоянию ГМ. В этой рабочей модели существуют 4 независимых шага, хотя они взаимодействуют между собой: 1) ответ; 2) восприимчивость; 3) переход; 4) поддержание. Эти шаги демонстрируют динамику перехода от острого к хроническому стрессу (рис. 2). Наиболее важно обратить внимание на определение ключевых узлов хронификации процесса и «точек невозврата».
Реакция на стресс зависит от ряда факторов: время, индивидуальная изменчивость, предсказуемость, управляемость. Время (сроки) рассматривается с точки зрения не только динамики эффектов на ГМ в зависимости от длительности воздействия стресса, но и того, как мозг будет дирижировать в ответ на стресс-факторы в разных состояниях. Индивидуальная изменчивость имеет важное значение, она выражает, как разные люди реагируют на стресс. Симптомы варьируются от тревожного и/или подавленного настроения, гнева и/или раздражительности до пищеварительных или кожных осложнений или даже иммунной супрессии. Важно отметить, что существуют значительные различия в том, как отдельные субъекты справляются со стрессом. Эти различия являются важнейшими элементами неадекватного ответа на стресс и влияют на психическое и физическое здоровье. Предсказуемо реакция на стресс эволюционировала, чтобы жестко контролироваться и регулироваться. Другими словами, если индивид многократно сталкивается с одним и тем же стрессором, организм обычно развивает адаптивную реакцию. Значительное количество исследований использует протоколы длительного стресса, в задачи которых входит измерение ответа на этот стрессор и способности субъекта к нему адаптироваться. Четвертый фактор – управляемость. Как показывают работы из разных лабораторий, контроль над стрессором имеет решающее значение для установки его вредного воздействия. Исследования доказывают, что животные, имеющие контроль над стрессором, не проявляют каких-либо серьезных признаков или симптомов стресса, а бесконтрольность ситуации вызывает значительную дезадаптацию.
Описанные выше детерминанты индивидуальной восприимчивости в разных проявлениях регулируют переход реакции на стресс в хроническую форму или выздоровление (уязвимость/резистентность); см. рис. 2. Таким образом, мониторинг этих факторов имеет решающее значение для правильной интерпретации последствий стресса в ГМ. В этом случае основной задачей исследования стала способность определить предикторы таких индивидуальных паттернов реагирования.
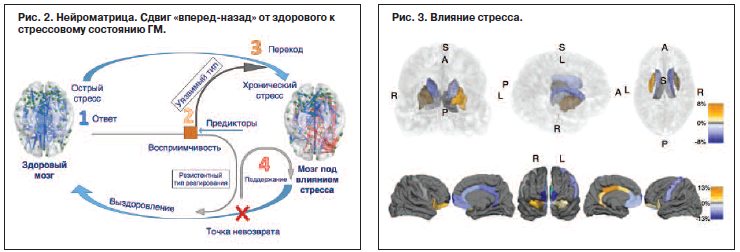
С данной целью был проведен эксперимент. Сравнение данных, полученных при помощи функциональной магнитно-резонансной томографии (фМРТ), проводилось в группе контроля и группе исследования (которая подвергалась действию стресса). В группе исследования стресс воздействовал на активацию медиальной ПФК, хвостатого ядра (целенаправленное поведение) и скорлупы (putamen), вместе они представляют собой неостриатум. Спустя 6 нед при повторном обследовании фМРТ исследователи увидели те же результаты, разные для группы исследования и контроля.
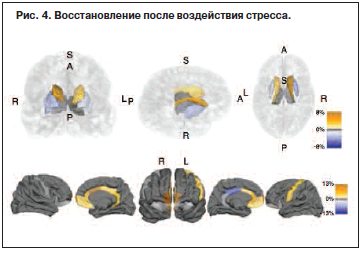 При структурных измерениях объема ГМ в специфичной кортико-стриарной системе были обнаружены зоны, которые после воздействия стресса увеличиваются в объеме – путамен и орбитало-префронтальная кора (на рис. 3 отмечены оранжевым цветом), – и участки, которые уменьшаются в размере (на рис. 4 отмечены синим цветом), – хвостатое ядро и медиально-префронтальная кора. На рис. 4 представлены данные обследований фМРТ той же выборки пациентов на этапе восстановления после стресса, которые демонстрируют, насколько кортико-стриарная сеть способна к чрезвычайной нейропластичности.
При структурных измерениях объема ГМ в специфичной кортико-стриарной системе были обнаружены зоны, которые после воздействия стресса увеличиваются в объеме – путамен и орбитало-префронтальная кора (на рис. 3 отмечены оранжевым цветом), – и участки, которые уменьшаются в размере (на рис. 4 отмечены синим цветом), – хвостатое ядро и медиально-префронтальная кора. На рис. 4 представлены данные обследований фМРТ той же выборки пациентов на этапе восстановления после стресса, которые демонстрируют, насколько кортико-стриарная сеть способна к чрезвычайной нейропластичности.
Интеграция данных о локализации нарушений структурных и функциональных связей между разными зонами ГМ дала возможность ученым воссоздать и сравнить функциональный коннектом (карта нейронных соединений) контрольной группы и группы исследования после воздействия стресса при помощи моделирования нейронных сетей (network modeling). Кластерный анализ позволил разделить группу обследования на 2 подгруппы: респондеры с высоким или низким уровнем кортизола. Возвращаясь к вопросу восприимчивости к стрессу, следует отметить, что эти 2 подгруппы соответствуют уязвимому и резистентному типу реагирования на стресс (см. рис. 2). При сравнении коннектома группа респондеров с высоким уровнем кортизола показала увеличение нейронных связей (connectivity) на функциональном уровне и срединное смещение хода волокон белого вещества на структурном уровне. При применении лонгитюдного наблюдения отмечено, что в острой фазе изменения происходят в нейронных сетях в основном на субкортикальном уровне, а спустя 3–7 дней сдвигаются на кортикальный уровень. Важна не только активация определенных сетей, но и дезактивация. Эти процессы в значительной степени также зависят от возраста. В конце своего доклада N.Sousa поставил важный вопрос: можем ли мы предсказать тип ответа на стресс?
Мы пробовали найти ответ на данный вопрос в презентациях других докладчиков. Например, David A.Slattery (Франкфурт, Германия) в своем докладе подчеркнул, что изучение этиологии расстройств, вызванных действием стресса (в частности ПТСР и социального тревожного расстройства), на молекулярном уровне позволит определить детерминанты индивидуальной восприимчивости к стрессу, разработать новое эффективное и селективное лечение. Предыдущие исследования в области лечения данных расстройств видели мишенями воздействия моноаминергические и ГАМКA-рецепторы. Доктор D.Slattery предлагает сместить внимание на нейропептиды – по его мнению, жизнеспособные новые кандидаты для фармакотерапии стрессовых расстройств.
В чем преимущество нейропептидов? Они сосредоточены в небольшой части ГМ, но легко попадают во все отделы из-за широко распространенной сети рецепторов к ним. Нейропептид С – это аминокислотный пептид, который обнаруживается у животных всех видов, вырабатывается с помощью нейронов в миндалине, в основном глутаматергическими или позитивными клетками кортикотропин-рилизинг-фактора (CRF). Исследования на животных показывают, что нейропептид С подавляет тревогу, аппетит, вызывает бессонницу и гиперактивность, в том числе гиперсексуальность, и играет важную роль в торможении обусловленного страха. Клинические исследования в 2002 г. показали, что носители T-аллелей рецепторов нейропептида С (разные формы одного и того же гена, расположенные в одинаковых участках гомологичных хромосом и определяющие альтернативные варианты развития одного и того же признака) связаны с повышенным риском возникновения панических расстройств и чрезмерной интерпретацией страха. Однонуклеотидный полиморфизм (отличие в последовательности ДНК размером в один нуклеотид в геноме в результате точечных мутаций) рецепторов нейропептида С (NPSR1) у человека вызывает изменение аминокислоты аспарагин на изолейцин, и это приводит к десятикратному увеличению активности рецепторов, не меняя общий уровень их экспрессии.
Доклинические исследования на животных указывают, что введение нейропептида С непосредственно в центральную нервную систему вызывает сильный анксиолитический и возбуждающий эффект, введение внутрь амигдалы приводит к снижению тревоги и угасанию сигнального и контекстного страха у грызунов. У людей же наоборот, если система нейропептида С активна, мы видим паническое расстройство. Это несоответствие можно объяснить тем, что все доклинические исследования проводились на нормальных животных (никаких дополнительных манипуляций, стимулирующих страх, с ними не проводили). Соответственно, была создана модель, где у животного вызывали тревожное состояние, воздействуя стрессом.
В ходе исследования (лабиринты, обусловливание страха звуковыми сигналами) были выделены несколько групп в зависимости от ведущего поведения. К 1-й группе отнесли тех мышей или крыс, которые большую часть времени держались в конструкции около безопасных стенок – поведение, связанное с высокой тревогой (high anxiety-related behavior, HAB), их возможность активно справляться со стрессом, так же как и возможность подавлять страх, была снижена, а экспрессия страха – преувеличена. Вторая группа характеризовалась поведением с низкой тревогой (low anxiety-related behavior, LAB) – грызуны намного чаще выходили на открытые незащищенные пространства в лабиринтах. Далее грызунов скрещивали исключительно внутри своих групп (HAB и LAB). На вопрос, имеет ли это разделение в поведении грызунов корреляцию с изменениями в системе нейропептида С, ученые ответили однозначно. У категории грызунов с высокой поведенческой тревогой был обнаружен один общий однонуклеотидный полиморфизм, ассоциированный с поверхностной экспрессией рецепторов (NPSR1), который повреждал стабильность матричной РНК, структуру и синтез белка и вносил изменения в активность промотора in vitro и экспрессии in vivo. Ученые увидели, что центральное введение нейропептида С намного эффективнее справляется с тревогой и тушит страх у грызунов с высокой поведенческой тревогой (HAB), тогда как анксиолитический эффект классических транквилизаторов (диазепам) на этих мышей отсутствовал.
Таким образом, была протестирована гипотеза о том, что селективное размножение мышей с низкой и высокой поведенческой тревожностью приводит к генетическим, экспрессивным и функциональным различиям в системе нейропептид С – рецептор (NPS-NPSR1), а введение нейропептида С обладает анксиолитическим эффектом в группе HAB.
Окситоцин также представляет интерес в качестве альтернативного лечения тревожных расстройств и в большей степени влияет на социальное поведение. Долгое время он считался «материнским гормоном», но в 1990-х годах исследования показали, что окситоцин способен снижать тревогу и повышать социальное поведение (забота о потомстве, сексуальный инстинкт, социальная память). Но имеет ли он влияние на социальную тревогу или страх?
В преклинических исследованиях введение окситоцина эффективно снижало социально обусловленный страх (social fear conditioning) и социальное избегание в той же мере, что и введение бензодиазепина или длительное назначение пароксетина. Но в отличие от нейропептида С окситоцин не влиял на выраженность тревоги и страха, обусловленного звуковыми сигналами (cued fear conditioning), в то время как нейропептид С был эффективен в обеих ситуациях. Следует иметь в виду, что окситоцин в низких дозировках не влиял ни на поведение, ни на физиологию, свою эффективность он демонстрирует только при назначении в высоких дозах. Обзоры длительного назначения окситоцина показывают, что анксиолитическое действие отличается в зависимости от пола. Для женского пола эффект более выражен, но необходимы дальнейшие исследования в этом вопросе. Окситоцин, введенный до начала действия стресса, замедляет внутриклеточное увеличение выработки CRF и кортизола, т.е. впоследствии снижает интенсивность реакции активации, ориентировки, тревоги, страха, беспокойства, напряжения. Таким образом, окситоцин и нейропептид С представляются многообещающими кандидатами в лечении тревожных расстройств.
Одним из ключевых симптомов ПТСР кроме наличия травматического события в анамнезе является повторное переживание наряду с избегающим поведением, симптомами онемения или оцепенения и повышенной возбудимостью. Симптомы повторного переживания или «травматическая память» включают в себя: навязчивые воспоминания, образы и мысли, вторгающиеся в жизнь, навязчивые кошмарные сны о событии. Эти симптомы обладают «реальностью» (иллюзии, галлюцинации, «флешбэки», диссоциативные «видения/представления») и приводят к интенсивным психологическим и физиологическим реакциям. Прошлое всегда преследует в настоящем, человек как бы проживает травму снова.
Следуя за процессами, которые лежат в основе формирования памяти на событие, краткосрочная память при помощи процесса консолидации закрепляется в долгосрочной памяти. Имеет место и обратный процесс – реконсолидация. Консолидация, или интеграция нового опыта (нестабильные воспоминания) в долгосрочную (стабильную) память, требует синтеза протеинов (белковых молекул) в клетках амигдалы. А что если препятствовать процессу консолидации памяти? Будет ли амнезия травматических событий сокращать либо повышать риск ПТСР у пациентов с травматическим поражением ГМ? Проспективное исследование показало, что у лишь 6% пациентов без памяти о травматических событиях и с амнезией на 24 ч после травмы были выявлены симптомы ПТСР спустя 6 мес в сравнении с 23% пациентов с сохранившейся памятью о травме. Амнезия и фармакологическое разрушение травматической памяти могут быть эффективны для снижения риска возникновения ПТСР. Таким образом, влияя на переход памяти из краткосрочной в долгосрочную, мы можем способствовать профилактике ПТСР. Известно, что консолидация в гиппокампе происходит в основном ночью, во время сна, и целью будущих исследований может стать корреляция депривации сна в первую ночь после травмы и риска возникновения ПТСР.
Как уже обсуждалось выше, в острую фазу стресса происходит активация ГГНО, медиатором которой является кортизол. Исходя из доклинических исследований, мы знаем, что в зависимости от типа реакции на стресс респонденты делятся на 2 категории, уровень кортизола будет либо повышен, либо снижен, тревога будет высокой или сниженной. Может показаться, что резистентный тип реакции либо отсутствие тревоги в ответ на травматическое событие – это хорошо, но в действительности это не так. Адекватный ответ ГГНО и, как следствие, высокий уровень кортизола – это общий адаптационный синдром, он является естественным способом организма пережить стресс. И наоборот: низкий уровень кортизола – это явление, которое предрасполагает к патологической реакции на стресс и является следствием дефекта гипоталамуса.
Этот тезис подтвердился в преклинических исследованиях – инъекция гидрокортизона была эффективной, только если применялась в первые 6 ч («золотые часы») после травматического события; 100–140 мг препарата может снизить уровень ПТСР с 60 до 16%. Если сниженный уровень кортизола ассоциирован с ПТСР, каков будет эффект назначения бензодиазепинов (диазепама, гидазепама)? Бензодиазепины, усиливая эффект ГАМК на ГАМКA-рецепторы (идентично действует алкоголь), вызывают седативный, гипнотический и анксиолитический эффект, фактически блокируя работу ГГНО. Медицинское сообщество выступает против раннего назначения бензодиазепинов и считает, что они мешают прохождению естественной адаптационной реакции организма, исследования подкрепляют это данными о том, что раннее назначение бензодиазепинов увеличивает риск развития ПТСР (E.Celpin и соавт., 1996, T.Mellman и соавт., 2002). И наоборот, исследование на грызунах показало, что ряд препаратов, назначенных сразу же после воздействия стресса, способствовали уменьшению симптомов ПТСР. Выделяют следующие группы препаратов по механизму действия: блокируют процесс консолидации (анизомицин), восполняют недостаток кортизола (гидрокортизон в высоких дозах, окситоцин), антидепрессанты (агомелатин, эсциталопрам, сертралин). Обратный эффект имели кортизол в малых дозах, альпразолам, кетамин, алкоголь.
E-mail: iryna.frankova@gmail.com
Ключевые слова: конгресс Европейской коллегии нейропсихофармакологии, стресс, посттравматическое стрессовое расстройство.
Для цитирования: Франкова И.А. Жизнь на грани: социальный стресс, травма и психопатология. Психиатрия и психофармакотерапия. 2017; 19 (2): 52–57.
Life on the brink: social stress, trauma and psychopathology (29th European college of neuropsychopharmaclogy congress materials review)
I.A.Frankova
A.A.Bogomolets National Medical University. 01601, Ukraine, Kyiv, b-r Tarasa Shevchenko, d. 13
iryna.frankova@gmail.com
This review aims to discuss the role of stress as a risk factor in neuropsychiatric pathology, with a focus on the effects of stress on neuronal function, brain architecture, neurobiological mechanisms, and neuroendocrine disorders. It will be suggested new putative therapeutic agents for the treatment and prevention of stress related disorders and new targets for antidepressant drugs.
Key words: European college of neuropsychopharmacology congress, stress, post-traumatic stress disorder.
For citation: Frankova I.A. Life on the brink: social stress, trauma and psychopathology (29th European college of neuropsychopharmaclogy congress materials review). Psychiatry and Psychopharmacotherapy. 2017; 19 (2): 52–57.
Данный обзор подготовлен по материалам 29-го конгресса Европейского колледжа нейропсихофармакологии (сентябрь 2016 г., Вена) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании “Сервье”» (East European Educational WPA – Servier Academy – EEEWPA-Servier Academy) специально для психиатрических журналов Зоны 10 Всемирной психиатрической ассоциации.
Большинство людей неизбежно сталкиваются со стрессом, по крайней мере, время от времени. Неблагоприятные события представляют собой серьезную угрозу для психического здоровья. Реакция на стресс может содействовать адаптивной пластичности, улучшая когнитивную сферу, если физиологическая реакция на стресс эффективно активируется и своевременно дезактивируется. В случае дисрегуляции стресс оказывает неадекватный и вредоносный эффект, сопутствует возникновению дезадаптации и психопатологии. Актуальность темы стресса в наши дни не оставляет сомнений. На 29-м конгрессе Европейской коллегии нейропсихофармакологии стрессу были посвящены 4 симпозиума и 1 пленарная лекция. Материалы с 2 симпозиумов детально представлены в данном обзоре.
В рамках симпозиума «Жизнь на грани: социальный стресс и психопатология» свой доклад представлял Maurizio Popoli из Института Милана, Италия (лаборатория нейропсихофармакологии и функциональной нейрогеномики). Он начал с базовых концепций, сформулированных еще в 1930 г. Гансом Селье: «Стресс – это неспецифический ответ тела на любое требование, представленное ему (физиологический ответ мозга и тела)». Стресс это не то, что случилось с нами, а то, как мы реагируем на это событие. Иными словами, в повседневной жизни важно не только количество стресса, с которым мы сталкиваемся, но и как мы на него реагируем – адаптивным либо дезадаптивным способом. Именно дезадаптация приводит к расстройствам, связанным со стрессом. Сейчас для нас очевидно, что стресс – это фактор риска для множества психических и соматических заболеваний (см. таблицу).

Если обратиться к физиологии, выделяют 2 типа ответа на стресс: быстрый и медленный. Задача быстрого ответа в первой фазе – увеличить скорость всех процессов в организме, которые могут быть полезны для системы «бегства или борьбы» (больше энергии высвобождается из мышц, происходит мощная стимуляция сердечно-сосудистой, иммунной системы и памяти). Вторая фаза намного медленнее и может занимать часы, дни и даже недели, ее задача – подавить все, что было активизировано в первой фазе (рис. 1).
 Адаптивный способ реагирования на стресс характеризуется своевременностью смены быстрого типа ответа на медленный.
Адаптивный способ реагирования на стресс характеризуется своевременностью смены быстрого типа ответа на медленный.При разных психических нарушениях и заболеваниях, вызванных стрессом, на клеточном уровне меняется нейронная архитектура, возникают атрофия и сжатие апикальных дендритов в гиппокампе и префронтальной коре (ПФК). Это клинически подтверждает обратная корреляция между плотностью дендритов, синаптических шипиков (spines) гиппокампа и выраженностью тревоги/депрессии. Обнаружена также прямая корреляция между длительностью депрессивного эпизода и снижением объема плотности дендритов в упомянутых зонах головного мозга (ГМ).
Что же приводит к атрофии дендритов и снижению объема нейронов? Острый стресс вызывает активацию гипоталамо-гипофизарно-надпочечниковой оси (ГГНО), что приводит к повышению уровня кортикостероидов, связываясь с глюкокортикоидными и минералокортикоидными рецепторами, кортикостероиды вызывают увеличение глутамата в ПФК и фронтальной коре (ФК), используя механизм, который зависит от фосфориляции синапсина I в первую фазу стресса.
Глутамат – это главный возбуждающий медиатор, g-аминомасляная кислота (ГАМК) – главный тормоз для медиаторов, проводящих возбуждение в ГМ. ГАМК находится в постоянной конкуренции с глутаматом. В нормальном состоянии эта конкуренция приводит к паритету и тонкому равновесию возбуждения и торможения в нашем мозге. Торможение – это не отсутствие возбуждения, а активный процесс, требующий собственных нервных клеток, синапсов, медиаторов, энергии на торможение наш мозг тратит больше, чем на возбуждение. ГАМК – это простая молекула, получающаяся, как это ни парадоксально, из глутамата, если от него отщепить углекислый газ. Для того чтобы ГАМК работала именно как медиатор, она должна сформироваться в пресинаптическом окончании, окончании аксона. Дальше она выделяется, когда приходит нервный импульс, и воздействует на рецепторы. Описано два типа рецепторов к ГАМК, которые названы ГАМКА и ГАМКB-рецепторы. И тот, и другой в норме обязательно вызывают торможение.
В сочетании острый стресс и кортикостерон оказывают дестабилизирующее воздействие на глутаматергическую систему, в значительной степени увеличивая высвобождение глутамата, потенцируя возбуждение и синаптическую передачу нервного импульса, что приводит к вытягиванию дендритов. Этот феномен, являясь адаптивным при кратковременном влиянии стресса, становится патологическим при хронификации травматической ситуации.
Таким образом, действие стресса в сочетании с повышением уровня кортизола и нарушением передачи нервного импульса в глутаматергической системе (85% синапсов в ПФК и гиппокампе – глутаматергические) приводит к изменениям нейронной архитектуры. Если же за 2 нед до эксперимента со стрессом назначить антидепрессанты, то такого рода реакция глутамата в ответ на кортикостерон и в быструю, и медленную фазу блокируется. Антидепрессанты заметно снижают вызванное деполяризацией высвобождение глутамата, но не высвобождают ГАМК. Эти данные свидетельствуют о том, что антидепрессанты стабилизируют нейротрансмиссию глутамата в гиппокампе и представляют собой полезный инструмент для изучения взаимосвязи между функциональными и молекулярными процессами в нервных окончаниях. Похожее воздействие на нервную систему оказывают и физические упражнения.
M.Popoli описал эксперимент, позволяющий воспроизвести эти данные в эксперименте на грызунах. Недавно он показал, что 40-минутный протокол воздействия острого стресса (footshock – удар электрического тока по ногам) быстро усиливает вызванное деполяризацией высвобождение глутамата и передачу импульса в ПФК и ФК за счет увеличения циркуляции уровня кортизола. Связываясь с синаптическими рецепторами, кортизол вызывает быстрое (не геномное) усиление оборота пресинаптических везикул с глутаматом в перфорированных синапсах и увеличение размера пула готовых к выбросу (readily releasable pool) везикул, который вызывает усиление высвобождения глутамата из синаптических окончаний. В соответствующих исследованиях было показано, что острый футшок-стресс также резко (на 42,6%) увеличивает общее количество неперфорированных синапсов в ПФК, эффект снова же частично может быть предотвращен предварительным приемом антидепрессантов. Эти находки являются доказательством того, что стресс-зависимый синаптогенез асимметричных синапсов можно обнаружить уже через
40 мин после начала действия стресса. Кроме того, наблюдались значительная атрофия и ремоделирование атипичных дендритов в ПФК уже через 24 ч после футшок-стресса, которое сохраняется в течение 14 дней.
Таким образом, острый стресс может вызвать быстрые структурные/функциональные изменения в глутаматергических синапсах, а также приводить к устойчивому ремоделированию нейронной архитектуры.
Предыдущие исследования показали, что хронический стресс вызывает атрофию дендритов у грызунов в некоторых областях ГМ, и лишь несколько исследований показали аналогичные эффекты после воздействия острого стресса, в основном в гиппокампе. Взятые вместе, наши текущие и предыдущие исследования показывают, что последствия острого стресса далеко не только острые. Один эпизод стресса, которого невозможно избежать, может вызвать устойчивое увеличение размера пула готовых к выбросу везикул с глутаматом и усиление высвобождения глутамата в ПФК/ФК в течение по крайней мере 24 ч, что является основой быстрого ответа на стресс. Но также острый стресс вызывает продолжительные последствия и изменения в синаптических шипиках и плотности дендритов – аномальное повышение передачи нервного возбуждения является причиной дендритной атрофии в соответствующих синапсах от начала действия стресса и вплоть до 14 дней после. Текущие результаты согласуются с гипотезой, что острый стресс влияет на функцию и морфологию синапсов.
В отличие от хронического стресса, долгосрочные последствия острого стресса были мало или вообще не исследованы до сих пор. Традиционные исследования хронического стресса на грызунах просто рассматривали конечную точку многочисленных адаптаций, возникающих в процессе ответа мозга и тела на стресс, редко обращаясь к самому важному вопросу: как система добирается до точки, где физиологические реакции на стресс превращаются в неадаптивные, которые могут предрасполагать к психопатологии? Полученные результаты доказывают, что единичная травма достаточна, чтобы вызвать посттравматическое стрессовое расстройство (ПТСР) у людей. Изучение долгосрочных результатов воздействия острого стресса в моделях грызунов с наблюдением их поведения, функциональных и молекулярных изменений может позволить идентифицировать критические «точки поворота» в ответ на стресс и пролить свет на патофизиологию расстройств, вызванных стрессом. Понимание детерминант долгосрочных последствий острого стресса может помочь выделить нейронные механизмы и эффекторы (органы или клетки, которые активизируются в ответ на стимул), которые срабатывают неправильно во время реакции на стресс.
Острый стресс вызывает устойчивую активацию возбуждающих синапсов в ПФК/ФК, по крайней мере на 24 ч. Стрессиндуцированные пластические изменения в функциональных/структурных/молекулярных свойствах синапсов (изменение концентрации синапсина I) могут повлиять на последующую историю синапса (продленная во времени стрессовая реакция, ПТСР). Не все реагируют одинаковым образом на стимуляцию стрессом. Отслеживаемые пластические изменения можно условно разделить на 2 типа: уязвимый и устойчивый. Идентификация поворота, ключевые критические точки дихотомии в ответе мозга на стресс (адаптивная/неадаптивная, уязвимые против устойчивых) – эта концепция может лечь в основу исследований, направленных на поиск таргетного лечения.
Nuno Sousa, профессор Университета Мино (Португалия), в своем докладе «Динамика изменений в мозге под действием стресса» поддержал важность изучения предрасположенности индивида и дифференциации типа ответа на действие острого стресса. Последующий шаг – определить, будет ли сформированный паттерн достаточным, чтобы справиться со стрессом, и что меняется в цепи взаимодействий и структуре мозга. Стрессоры могут быть реальные или мнимые. Более того, стресс-факторы не только субъектзависимые (значение атрибуции), но и имеют разную временную динамику (повторяющиеся, краткосрочные или длительные), могут меняться по интенсивности (по крайней мере, в восприятии индивида). То есть стресс-факторы могут быть умеренными и относительно безвредными или иметь немедленные и/или долгосрочные последствия для благосостояния субъекта. Большинство людей время от времени неизбежно сталкиваются со стрессом. Тем не менее крайне важно подчеркнуть, что не всегда стресс является чем-то «плохим» и/или вредным. На самом деле стресс имеет решающее значение для нашего собственного выживания как вида, будучи неразрывно связанным с эволюцией – выживанием путем адаптации. Все животные, даже растения, имеют реакции на стресс.
N.Sousa предложил динамическую рабочую модель целостного взгляда на сдвиг «вперед-назад» от здорового к стрессовому состоянию ГМ. В этой рабочей модели существуют 4 независимых шага, хотя они взаимодействуют между собой: 1) ответ; 2) восприимчивость; 3) переход; 4) поддержание. Эти шаги демонстрируют динамику перехода от острого к хроническому стрессу (рис. 2). Наиболее важно обратить внимание на определение ключевых узлов хронификации процесса и «точек невозврата».
Реакция на стресс зависит от ряда факторов: время, индивидуальная изменчивость, предсказуемость, управляемость. Время (сроки) рассматривается с точки зрения не только динамики эффектов на ГМ в зависимости от длительности воздействия стресса, но и того, как мозг будет дирижировать в ответ на стресс-факторы в разных состояниях. Индивидуальная изменчивость имеет важное значение, она выражает, как разные люди реагируют на стресс. Симптомы варьируются от тревожного и/или подавленного настроения, гнева и/или раздражительности до пищеварительных или кожных осложнений или даже иммунной супрессии. Важно отметить, что существуют значительные различия в том, как отдельные субъекты справляются со стрессом. Эти различия являются важнейшими элементами неадекватного ответа на стресс и влияют на психическое и физическое здоровье. Предсказуемо реакция на стресс эволюционировала, чтобы жестко контролироваться и регулироваться. Другими словами, если индивид многократно сталкивается с одним и тем же стрессором, организм обычно развивает адаптивную реакцию. Значительное количество исследований использует протоколы длительного стресса, в задачи которых входит измерение ответа на этот стрессор и способности субъекта к нему адаптироваться. Четвертый фактор – управляемость. Как показывают работы из разных лабораторий, контроль над стрессором имеет решающее значение для установки его вредного воздействия. Исследования доказывают, что животные, имеющие контроль над стрессором, не проявляют каких-либо серьезных признаков или симптомов стресса, а бесконтрольность ситуации вызывает значительную дезадаптацию.
Описанные выше детерминанты индивидуальной восприимчивости в разных проявлениях регулируют переход реакции на стресс в хроническую форму или выздоровление (уязвимость/резистентность); см. рис. 2. Таким образом, мониторинг этих факторов имеет решающее значение для правильной интерпретации последствий стресса в ГМ. В этом случае основной задачей исследования стала способность определить предикторы таких индивидуальных паттернов реагирования.

С данной целью был проведен эксперимент. Сравнение данных, полученных при помощи функциональной магнитно-резонансной томографии (фМРТ), проводилось в группе контроля и группе исследования (которая подвергалась действию стресса). В группе исследования стресс воздействовал на активацию медиальной ПФК, хвостатого ядра (целенаправленное поведение) и скорлупы (putamen), вместе они представляют собой неостриатум. Спустя 6 нед при повторном обследовании фМРТ исследователи увидели те же результаты, разные для группы исследования и контроля.
 При структурных измерениях объема ГМ в специфичной кортико-стриарной системе были обнаружены зоны, которые после воздействия стресса увеличиваются в объеме – путамен и орбитало-префронтальная кора (на рис. 3 отмечены оранжевым цветом), – и участки, которые уменьшаются в размере (на рис. 4 отмечены синим цветом), – хвостатое ядро и медиально-префронтальная кора. На рис. 4 представлены данные обследований фМРТ той же выборки пациентов на этапе восстановления после стресса, которые демонстрируют, насколько кортико-стриарная сеть способна к чрезвычайной нейропластичности.
При структурных измерениях объема ГМ в специфичной кортико-стриарной системе были обнаружены зоны, которые после воздействия стресса увеличиваются в объеме – путамен и орбитало-префронтальная кора (на рис. 3 отмечены оранжевым цветом), – и участки, которые уменьшаются в размере (на рис. 4 отмечены синим цветом), – хвостатое ядро и медиально-префронтальная кора. На рис. 4 представлены данные обследований фМРТ той же выборки пациентов на этапе восстановления после стресса, которые демонстрируют, насколько кортико-стриарная сеть способна к чрезвычайной нейропластичности.Интеграция данных о локализации нарушений структурных и функциональных связей между разными зонами ГМ дала возможность ученым воссоздать и сравнить функциональный коннектом (карта нейронных соединений) контрольной группы и группы исследования после воздействия стресса при помощи моделирования нейронных сетей (network modeling). Кластерный анализ позволил разделить группу обследования на 2 подгруппы: респондеры с высоким или низким уровнем кортизола. Возвращаясь к вопросу восприимчивости к стрессу, следует отметить, что эти 2 подгруппы соответствуют уязвимому и резистентному типу реагирования на стресс (см. рис. 2). При сравнении коннектома группа респондеров с высоким уровнем кортизола показала увеличение нейронных связей (connectivity) на функциональном уровне и срединное смещение хода волокон белого вещества на структурном уровне. При применении лонгитюдного наблюдения отмечено, что в острой фазе изменения происходят в нейронных сетях в основном на субкортикальном уровне, а спустя 3–7 дней сдвигаются на кортикальный уровень. Важна не только активация определенных сетей, но и дезактивация. Эти процессы в значительной степени также зависят от возраста. В конце своего доклада N.Sousa поставил важный вопрос: можем ли мы предсказать тип ответа на стресс?
Мы пробовали найти ответ на данный вопрос в презентациях других докладчиков. Например, David A.Slattery (Франкфурт, Германия) в своем докладе подчеркнул, что изучение этиологии расстройств, вызванных действием стресса (в частности ПТСР и социального тревожного расстройства), на молекулярном уровне позволит определить детерминанты индивидуальной восприимчивости к стрессу, разработать новое эффективное и селективное лечение. Предыдущие исследования в области лечения данных расстройств видели мишенями воздействия моноаминергические и ГАМКA-рецепторы. Доктор D.Slattery предлагает сместить внимание на нейропептиды – по его мнению, жизнеспособные новые кандидаты для фармакотерапии стрессовых расстройств.
В чем преимущество нейропептидов? Они сосредоточены в небольшой части ГМ, но легко попадают во все отделы из-за широко распространенной сети рецепторов к ним. Нейропептид С – это аминокислотный пептид, который обнаруживается у животных всех видов, вырабатывается с помощью нейронов в миндалине, в основном глутаматергическими или позитивными клетками кортикотропин-рилизинг-фактора (CRF). Исследования на животных показывают, что нейропептид С подавляет тревогу, аппетит, вызывает бессонницу и гиперактивность, в том числе гиперсексуальность, и играет важную роль в торможении обусловленного страха. Клинические исследования в 2002 г. показали, что носители T-аллелей рецепторов нейропептида С (разные формы одного и того же гена, расположенные в одинаковых участках гомологичных хромосом и определяющие альтернативные варианты развития одного и того же признака) связаны с повышенным риском возникновения панических расстройств и чрезмерной интерпретацией страха. Однонуклеотидный полиморфизм (отличие в последовательности ДНК размером в один нуклеотид в геноме в результате точечных мутаций) рецепторов нейропептида С (NPSR1) у человека вызывает изменение аминокислоты аспарагин на изолейцин, и это приводит к десятикратному увеличению активности рецепторов, не меняя общий уровень их экспрессии.
Доклинические исследования на животных указывают, что введение нейропептида С непосредственно в центральную нервную систему вызывает сильный анксиолитический и возбуждающий эффект, введение внутрь амигдалы приводит к снижению тревоги и угасанию сигнального и контекстного страха у грызунов. У людей же наоборот, если система нейропептида С активна, мы видим паническое расстройство. Это несоответствие можно объяснить тем, что все доклинические исследования проводились на нормальных животных (никаких дополнительных манипуляций, стимулирующих страх, с ними не проводили). Соответственно, была создана модель, где у животного вызывали тревожное состояние, воздействуя стрессом.
В ходе исследования (лабиринты, обусловливание страха звуковыми сигналами) были выделены несколько групп в зависимости от ведущего поведения. К 1-й группе отнесли тех мышей или крыс, которые большую часть времени держались в конструкции около безопасных стенок – поведение, связанное с высокой тревогой (high anxiety-related behavior, HAB), их возможность активно справляться со стрессом, так же как и возможность подавлять страх, была снижена, а экспрессия страха – преувеличена. Вторая группа характеризовалась поведением с низкой тревогой (low anxiety-related behavior, LAB) – грызуны намного чаще выходили на открытые незащищенные пространства в лабиринтах. Далее грызунов скрещивали исключительно внутри своих групп (HAB и LAB). На вопрос, имеет ли это разделение в поведении грызунов корреляцию с изменениями в системе нейропептида С, ученые ответили однозначно. У категории грызунов с высокой поведенческой тревогой был обнаружен один общий однонуклеотидный полиморфизм, ассоциированный с поверхностной экспрессией рецепторов (NPSR1), который повреждал стабильность матричной РНК, структуру и синтез белка и вносил изменения в активность промотора in vitro и экспрессии in vivo. Ученые увидели, что центральное введение нейропептида С намного эффективнее справляется с тревогой и тушит страх у грызунов с высокой поведенческой тревогой (HAB), тогда как анксиолитический эффект классических транквилизаторов (диазепам) на этих мышей отсутствовал.
Таким образом, была протестирована гипотеза о том, что селективное размножение мышей с низкой и высокой поведенческой тревожностью приводит к генетическим, экспрессивным и функциональным различиям в системе нейропептид С – рецептор (NPS-NPSR1), а введение нейропептида С обладает анксиолитическим эффектом в группе HAB.
Окситоцин также представляет интерес в качестве альтернативного лечения тревожных расстройств и в большей степени влияет на социальное поведение. Долгое время он считался «материнским гормоном», но в 1990-х годах исследования показали, что окситоцин способен снижать тревогу и повышать социальное поведение (забота о потомстве, сексуальный инстинкт, социальная память). Но имеет ли он влияние на социальную тревогу или страх?
В преклинических исследованиях введение окситоцина эффективно снижало социально обусловленный страх (social fear conditioning) и социальное избегание в той же мере, что и введение бензодиазепина или длительное назначение пароксетина. Но в отличие от нейропептида С окситоцин не влиял на выраженность тревоги и страха, обусловленного звуковыми сигналами (cued fear conditioning), в то время как нейропептид С был эффективен в обеих ситуациях. Следует иметь в виду, что окситоцин в низких дозировках не влиял ни на поведение, ни на физиологию, свою эффективность он демонстрирует только при назначении в высоких дозах. Обзоры длительного назначения окситоцина показывают, что анксиолитическое действие отличается в зависимости от пола. Для женского пола эффект более выражен, но необходимы дальнейшие исследования в этом вопросе. Окситоцин, введенный до начала действия стресса, замедляет внутриклеточное увеличение выработки CRF и кортизола, т.е. впоследствии снижает интенсивность реакции активации, ориентировки, тревоги, страха, беспокойства, напряжения. Таким образом, окситоцин и нейропептид С представляются многообещающими кандидатами в лечении тревожных расстройств.
От теории к практике
В рамках симпозиума «Новые стратегии и мишени в лечении посттравматического стрессового расстройства», председателями которого были Eric Vermetten и Joseph Zohar, слушатели познакомились с рядом практических докладов. Lior Carmi (Тель-Авив, Израиль) представил концепцию «золотых часов» (golden hours) в лечении ПТСР. Отличие от других тревожных заболеваний и уникальность этого расстройства в том, что оно имеет четкое начало, точку отсчета, а конкретно – время воздействия стресс-фактора, после которого наступает значительное ухудшение состояния индивида. Может ли психиатр предотвратить развитие ПТСР? Давайте задумаемся, какие существуют интервенции и стратегии лечения острого стрессового расстройства, направленные на профилактику ПТСР, а какие могут усугубить симптоматику.Одним из ключевых симптомов ПТСР кроме наличия травматического события в анамнезе является повторное переживание наряду с избегающим поведением, симптомами онемения или оцепенения и повышенной возбудимостью. Симптомы повторного переживания или «травматическая память» включают в себя: навязчивые воспоминания, образы и мысли, вторгающиеся в жизнь, навязчивые кошмарные сны о событии. Эти симптомы обладают «реальностью» (иллюзии, галлюцинации, «флешбэки», диссоциативные «видения/представления») и приводят к интенсивным психологическим и физиологическим реакциям. Прошлое всегда преследует в настоящем, человек как бы проживает травму снова.
Следуя за процессами, которые лежат в основе формирования памяти на событие, краткосрочная память при помощи процесса консолидации закрепляется в долгосрочной памяти. Имеет место и обратный процесс – реконсолидация. Консолидация, или интеграция нового опыта (нестабильные воспоминания) в долгосрочную (стабильную) память, требует синтеза протеинов (белковых молекул) в клетках амигдалы. А что если препятствовать процессу консолидации памяти? Будет ли амнезия травматических событий сокращать либо повышать риск ПТСР у пациентов с травматическим поражением ГМ? Проспективное исследование показало, что у лишь 6% пациентов без памяти о травматических событиях и с амнезией на 24 ч после травмы были выявлены симптомы ПТСР спустя 6 мес в сравнении с 23% пациентов с сохранившейся памятью о травме. Амнезия и фармакологическое разрушение травматической памяти могут быть эффективны для снижения риска возникновения ПТСР. Таким образом, влияя на переход памяти из краткосрочной в долгосрочную, мы можем способствовать профилактике ПТСР. Известно, что консолидация в гиппокампе происходит в основном ночью, во время сна, и целью будущих исследований может стать корреляция депривации сна в первую ночь после травмы и риска возникновения ПТСР.
Как уже обсуждалось выше, в острую фазу стресса происходит активация ГГНО, медиатором которой является кортизол. Исходя из доклинических исследований, мы знаем, что в зависимости от типа реакции на стресс респонденты делятся на 2 категории, уровень кортизола будет либо повышен, либо снижен, тревога будет высокой или сниженной. Может показаться, что резистентный тип реакции либо отсутствие тревоги в ответ на травматическое событие – это хорошо, но в действительности это не так. Адекватный ответ ГГНО и, как следствие, высокий уровень кортизола – это общий адаптационный синдром, он является естественным способом организма пережить стресс. И наоборот: низкий уровень кортизола – это явление, которое предрасполагает к патологической реакции на стресс и является следствием дефекта гипоталамуса.
Этот тезис подтвердился в преклинических исследованиях – инъекция гидрокортизона была эффективной, только если применялась в первые 6 ч («золотые часы») после травматического события; 100–140 мг препарата может снизить уровень ПТСР с 60 до 16%. Если сниженный уровень кортизола ассоциирован с ПТСР, каков будет эффект назначения бензодиазепинов (диазепама, гидазепама)? Бензодиазепины, усиливая эффект ГАМК на ГАМКA-рецепторы (идентично действует алкоголь), вызывают седативный, гипнотический и анксиолитический эффект, фактически блокируя работу ГГНО. Медицинское сообщество выступает против раннего назначения бензодиазепинов и считает, что они мешают прохождению естественной адаптационной реакции организма, исследования подкрепляют это данными о том, что раннее назначение бензодиазепинов увеличивает риск развития ПТСР (E.Celpin и соавт., 1996, T.Mellman и соавт., 2002). И наоборот, исследование на грызунах показало, что ряд препаратов, назначенных сразу же после воздействия стресса, способствовали уменьшению симптомов ПТСР. Выделяют следующие группы препаратов по механизму действия: блокируют процесс консолидации (анизомицин), восполняют недостаток кортизола (гидрокортизон в высоких дозах, окситоцин), антидепрессанты (агомелатин, эсциталопрам, сертралин). Обратный эффект имели кортизол в малых дозах, альпразолам, кетамин, алкоголь.
Заключение
Влияние стрессовых событий на функции мозга и тела представляет собой важный фактор риска для развития нейропсихических расстройств. Разные интервенции могут иметь различные окна возможностей, и соответственно одни и те же интервенции могут исцелить или нанести вредоносный эффект, в зависимости от изменения времени назначения. Влияние стресса происходит в нескольких измерениях одновременно (анатомия, электрофизиология, поведение, социальная интеракция). Понимание взаимодействий между стрессом, тканью мозга и социальным поведением помогло проложить путь к разработке будущих стратегий лечения.Сведения об авторе
Франкова Ирина Александровна – ассистент каф. психосоматической медицины и психотерапии НМУ им. А.А.Богомольца.E-mail: iryna.frankova@gmail.com
Список исп. литературыСкрыть список1. Carmi L. Clinical intervention in golden hours – state of the art. In: TNM symposium – Novel strategies towards targeted interventions in PTSD. Vienna: Programme of the 29th ECNP Congress, 2016;
p. 21.
2. Gil S et al. Does memory of a traumatic event increase the risk for
posttraumatic stress disorder in patients with traumatic brain injury? A prospective study. Am J Psychiatry 2005; 162 (5): 963–9.
3. Musazzi L et al. The action of antidepressants on the glutamate system: regulation of glutamate release and glutamate receptors. Biol Psychiatry 2013; 73 (12): 1180–8.
4. Nader K, Schafe GE, Le Doux J. E. Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval. Nature 2000; 406 (6797): 722–6.
5. Neumann ID, Slattery DA. Oxytocin in general anxiety and social fear: a translational approach. Biol Psychiatry 2016; 79 (3): 213–21.
6. Peters S et al. Dose-dependent effects of chronic central infusion of oxytocin on anxiety, oxytocin receptor binding and stress-related parameters in mice. Psychoneuroendocrinology 2014; 42: 225–36.
7. Popoli M. Stress and antidepressants: time-dependent changes in synaptic function and brain architecture. In: Symposium: Life on the brink: social stress and psychopathology. Vienna: Programme of the 29th ECNP Congress, 2016; p. 12.
8. Sheline YI et al. Hippocampal atrophy in recurrent major depression. Proceed Natl Acad Sci 1996; 93 (9): 3908–13.
9. Slattery DА. Assessing the role of oxytocin and neuropeptide S in fear and anxiety-related behavior. Symposium: Life on the brink: social stress and psychopathology. Vienna: Programme of the 29th ECNP Congress, 2016; p. 12.
10. Soetanto A et al. Association of anxiety and depression with microtubule-associated protein 2 and synaptopodin-immunolabeled dendrite and spine densities in hippocampal CA3 of older humans. Arch Gen Psychiatry 2010; 67 (5): 448–57.
11. Sousa N. The temporal dynamics in the stressed brain. Symposium: Life on the brink: social stress and psychopathology. Vienna: Programme of the 29th ECNP Congress, 2016; p. 12.
27 июня 2017
Количество просмотров: 2794


