Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2018
Ламотриджин в лечении эпилепсии и расстройств биполярного спектра: две основные терапевтические мишени №02 2018
Номера страниц в выпуске:36-49
Ламотриджин – это современный противоэпилептический препарат II поколения, обладающий меньшим количеством побочных эффектов и лучшей переносимостью по сравнению с препаратами I поколения, такими как карбамазепин и вальпроат. К важным преимуществам ламотриджина перед этими препаратами относится отсутствие долгосрочных негативных последствий его применения, в частности нейтральность по отношению к массе тела пациента, отсутствие органной токсичности (например, гепато- и гематотоксичности), негативного влияния на когнитивные функции. Ламотриджин также эффективен и безопасен в лечении эпилепсии у беременных и женщин детородного возраста, детей и подростков, лиц пожилого и старческого возраста.
В психиатрии ламотриджин эффективен в профилактике фаз обоего знака (как депрессивных и смешанных, так и, в меньшей мере, маниакальных и гипоманиакальных) при биполярном аффективном расстройстве (БАР), циклотимии и других расстройствах биполярного спектра, а также в лечении острой биполярной депрессии. Ламотриджин также эффективен при быстроциклическом течении БАР и отягощенных различными коморбидностями (алкоголизмом, тревожными расстройствами, расстройствами обсессивно-компульсивного спектра, синдромом деперсонализации-дереализации) формах БАР.
Ключевые слова: ламотриджин, Сейзар, эпилепсия, биполярное аффективное расстройство, расстройства биполярного спектра, биполярная депрессия, циклотимия, быстроциклическое течение, коморбидность, алкоголизм, тревожные расстройства, расстройства обсессивно-компульсивного спектра, синдром деперсонализации-дереализации.
Для цитирования: Беккер Р.А., Быков Ю.В. Ламотриджин в лечении эпилепсии и расстройств биполярного спектра: две основные терапевтические мишени. Психиатрия и психофармакотерапия. 2018; 20 (2): 36–50.
В психиатрии ламотриджин эффективен в профилактике фаз обоего знака (как депрессивных и смешанных, так и, в меньшей мере, маниакальных и гипоманиакальных) при биполярном аффективном расстройстве (БАР), циклотимии и других расстройствах биполярного спектра, а также в лечении острой биполярной депрессии. Ламотриджин также эффективен при быстроциклическом течении БАР и отягощенных различными коморбидностями (алкоголизмом, тревожными расстройствами, расстройствами обсессивно-компульсивного спектра, синдромом деперсонализации-дереализации) формах БАР.
Ключевые слова: ламотриджин, Сейзар, эпилепсия, биполярное аффективное расстройство, расстройства биполярного спектра, биполярная депрессия, циклотимия, быстроциклическое течение, коморбидность, алкоголизм, тревожные расстройства, расстройства обсессивно-компульсивного спектра, синдром деперсонализации-дереализации.
Для цитирования: Беккер Р.А., Быков Ю.В. Ламотриджин в лечении эпилепсии и расстройств биполярного спектра: две основные терапевтические мишени. Психиатрия и психофармакотерапия. 2018; 20 (2): 36–50.
Ламотриджин – это современный противоэпилептический препарат II поколения, обладающий меньшим количеством побочных эффектов и лучшей переносимостью по сравнению с препаратами I поколения, такими как карбамазепин и вальпроат. К важным преимуществам ламотриджина перед этими препаратами относится отсутствие долгосрочных негативных последствий его применения, в частности нейтральность по отношению к массе тела пациента, отсутствие органной токсичности (например, гепато- и гематотоксичности), негативного влияния на когнитивные функции. Ламотриджин также эффективен и безопасен в лечении эпилепсии у беременных и женщин детородного возраста, детей и подростков, лиц пожилого и старческого возраста.
В психиатрии ламотриджин эффективен в профилактике фаз обоего знака (как депрессивных и смешанных, так и, в меньшей мере, маниакальных и гипоманиакальных) при биполярном аффективном расстройстве (БАР), циклотимии и других расстройствах биполярного спектра, а также в лечении острой биполярной депрессии. Ламотриджин также эффективен при быстроциклическом течении БАР и отягощенных различными коморбидностями (алкоголизмом, тревожными расстройствами, расстройствами обсессивно-компульсивного спектра, синдромом деперсонализации-дереализации) формах БАР.
Ключевые слова: ламотриджин, Сейзар, эпилепсия, биполярное аффективное расстройство, расстройства биполярного спектра, биполярная депрессия, циклотимия, быстроциклическое течение, коморбидность, алкоголизм, тревожные расстройства, расстройства обсессивно-компульсивного спектра, синдром деперсонализации-дереализации.
Для цитирования: Беккер Р.А., Быков Ю.В. Ламотриджин в лечении эпилепсии и расстройств биполярного спектра: две основные терапевтические мишени. Психиатрия и психофармакотерапия. 2018; 20 (2): 36–50.
1David Ben Gurion University in Negev. 8410501, Israel, Be’er Sheva;
2Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310yubykov@gmail.com
Lamotrigine is a modern second-generation antiepileptic drug with fewer side effects and better tolerability than first-generation drugs, such as carbamazepine and valproate. Important advantages of lamotrigine over older drugs include the absence of long-term adverse effects of its use, in particular its neutrality with respect to the body weight of the patient, its lack of organ toxicity (eg, hepatotoxicity and hematotoxicity), the absence of negative effects on cognitive function. Lamotrigine is also safe and effective in the treatment of epilepsy in pregnant women and in women of childbearing age, in children and adolescents, in the elderly.
In psychiatry lamotrigine is effective in preventing affective episodes of both polarity (mainly depressive and mixed, and, to a lesser extent, manic and hypomanic) in bipolar affective disorder (BP), cyclothymia and other bipolar spectrum disorders, as well as in the treatment of acute bipolar depression. Lamotrigine is also effective in the rapid cycling BP and in BP with various comorbidities (alcoholism, anxiety disorders, obsessive-compulsive spectrum disorders, depersonalization-derealization syndrome).
Key words: lamotrigine, Seizar, epilepsy, bipolar affective disorder, bipolar spectrum disorders, bipolar depression, cyclothymia, rapid cycling bipolar, comorbidity, alcoholism, anxiety disorders, obsessive-compulsive spectrum disorders, depersonalization-derealization syndrome.
For citation: Bekker R.A., Bykov Yu.V. Lamotrigine in the treatment of epilepsy and bipolar spectrum disorders: two main therapeutic indications. Psychiatry and Psychopharmacotherapy. 2018; 20 (2): 36–50.
 Ламотриджин – это противоэпилептический препарат (ПЭП) II поколения, обладающий лучшим профилем переносимости и безопасности и меньшими побочными эффектами (ПЭ) по сравнению с препаратами I поколения (фенобарбиталом, фенитоином, примидоном, карбамазепином, вальпроатом). Он успешно используется в неврологии для лечения эпилепсии уже более двух десятилетий. Вначале препарат применялся только в качестве адъювантного (дополнительного) средства или средства 2-й линии при лечении фокальных и парциальных форм эпилепсии, резистентных к терапии другими препаратами, имевшими на момент начала его применения большую доказательную базу. Однако по мере накопления доказательной базы по его эффективности он стал использоваться все шире, как в комбинациях с другими ПЭП, так и в монотерапии, при разных формах эпилепсии. На сегодняшний день препарат широко используется в лечении фокальных, парциальных и генерализованных форм эпилепсии как у взрослых, так и у детей и подростков, а также у больных пожилого и старческого возраста, как в сочетании с другими ПЭП, так и в монотерапии (A.Cohen и соавт., 1987; J.Pellock, 1997).
Ламотриджин – это противоэпилептический препарат (ПЭП) II поколения, обладающий лучшим профилем переносимости и безопасности и меньшими побочными эффектами (ПЭ) по сравнению с препаратами I поколения (фенобарбиталом, фенитоином, примидоном, карбамазепином, вальпроатом). Он успешно используется в неврологии для лечения эпилепсии уже более двух десятилетий. Вначале препарат применялся только в качестве адъювантного (дополнительного) средства или средства 2-й линии при лечении фокальных и парциальных форм эпилепсии, резистентных к терапии другими препаратами, имевшими на момент начала его применения большую доказательную базу. Однако по мере накопления доказательной базы по его эффективности он стал использоваться все шире, как в комбинациях с другими ПЭП, так и в монотерапии, при разных формах эпилепсии. На сегодняшний день препарат широко используется в лечении фокальных, парциальных и генерализованных форм эпилепсии как у взрослых, так и у детей и подростков, а также у больных пожилого и старческого возраста, как в сочетании с другими ПЭП, так и в монотерапии (A.Cohen и соавт., 1987; J.Pellock, 1997).
Благодаря своему хорошему профилю безопасности, в частности отсутствию тератогенного действия, а также эмбрио- и фетотоксичности, ламотриджин также считается препаратом 1-й линии для лечения различных форм эпилепсии у женщин детородного возраста и беременных (EURAP Study Group, 2006). Кроме того, ламотриджин также официально утвержден Управлением по контролю пищевых продуктов и лекарств в США (Food and Drug Administration – FDA) для поддерживающего профилактического лечения биполярного аффективного расстройства (БАР) I и II типов, а также для профилактического лечения при быстроциклическом течении БАР I и II типов. Важно подчеркнуть, что ламотриджин утвержден FDA в этом качестве для профилактики как депрессивных, так и маниакальных, гипоманиакальных и смешанных аффективных эпизодов.
Применение ламотриджина в психиатрии по off-label показаниям (т.е. по показаниям, официально не утвержденным FDA) включает в себя его применение при лечении острой биполярной депрессии и острых смешанных эпизодов с преобладанием депрессивной симптоматики, униполярной терапевтически резистентной депрессии, в качестве адъювантного средства при терапевтически резистентном обсессивно-компульсивном расстройстве (ОКР) и других расстройствах обсессивно-компульсивного спектра (РОКС), синдроме деперсонализации-дереализации (ДП/ДР), длительном расстройстве восприятия после употребления галлюциногенов (так называемом HPPD), в качестве адъюванта к антипсихотикам (АП) при шизоаффективном расстройстве и шизофрении, в качестве средства уменьшения агрессивности и импульсивности при пограничном расстройстве личности (ПРЛ), а также при некоторых тревожных расстройствах, в частности при посттравматическом стрессовом расстройстве (ПТСР) [N.Betchel, A.Saadabadi, 2018]. Применение ламотриджина по off-label показаниям в неврологии включает в себя его использование для профилактики приступов мигрени, кластерных головных болей, а также при лечении нейропатических болей, невралгии тройничного нерва, периферических нейропатий и радикулопатий, фибромиалгии (N.Betchel, A.Saadabadi, 2018).
На сегодняшний день ламотриджин является наиболее часто назначаемым в мире ПЭП как среди ПЭП II поколения, так и в целом. В Великобритании, по данным 2007 г., на ламотриджин приходилось 65% всех новых рецептов на ПЭП (R.Ackers и соавт., 2007). Широко применяется ламотриджин также в детской и подростковой практике. Так, в Нидерландах, по данным 2008 г., на ламотриджин приходилось 12% всех выписываемых детям и подросткам рецептов на ПЭП (N.Van de Vrie-Hoekstra и соавт., 2008).
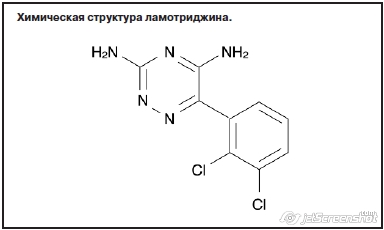
Химически ламотриджин представляет собой производное фенилтриазина – 3,5-диамино-6-(2,3-дихлорфенил)-1,2,4-триазин (см. рисунок). Впервые он был синтезирован еще в начале 1980-х годов. Уже с середины 1990-х годов, по мере накопления доказательной базы по его эффективности и безопасности, ламотриджин превратился из адъювантного препарата или препарата 2-й линии для лечения эпилепсии, резистентной к более старым препаратам, имевшим на тот момент большую доказательную базу, в основной ПЭП как для монотерапии, так и для комбинированной терапии различных форм эпилепсии: первичной генерализованной, фокальной и парциальной как у взрослых, так и у детей и подростков, а также у лиц пожилого и старческого возраста (K.Goa, и соавт., 1993; E.Mullens, 1998; V.Biton и соавт., 2005; F.Vajda и соавт., 2013).
В Ирландии ламотриджин получил официальное одобрение для применения при лечении эпилепсии у взрослых в 1990 г., а в Великобритании – в 1991 г. В США FDA выдало разрешение на применение ламотриджина для лечения эпилепсии у взрослых в 1994 г. (R.Weisler и соавт., 2008).
В 1998 г. официальные показания FDA к применению ламотриджина были расширены: он получил одобрение для применения в качестве адъювантного лечения при синдроме Леннокса–Гасто (R.Weisler и соавт., 2008).
В 2003 г. ламотриджин получил одобрение FDA для применения в качестве профилактического поддерживающего лечения БАР I и II типа, профилактики как депрессивных, так и маниакальных, гипоманиакальных и смешанных эпизодов (S.Jacob, A.Nair, 2016). В том же 2003 г. ламотриджин также получил одобрение FDA для применения в качестве адъювантной терапии при фокальных и парциальных эпилептических припадках у детей и использования в качестве дополнительной терапии для частичных припадков у детей в возрасте до 2 лет (S.Kayani, D.Sirsi, 2012).
Позднее, по мере накопления данных об отсутствии у ламотриджина значимой тератогенности, эмбрио- и фетотоксичности, ламотриджин был специально рекомендован для применения у женщин детородного возраста с эпилепсией или БАР, а также для беременных с эпилепсией или БАР (M.Goldenberg, 2010).
Совсем недавно ламотриджин завоевал широкую популярность в качестве нормотимика – НТ (стабилизатора настроения), выступающего в качестве эффективной и нередко лучше переносимой альтернативы вальпроатам, литию и карбамазепину при профилактическом лечении БАР I и II типа, циклотимии и других расстройств биполярного спектра (РБС). Особенно эффективно профилактическое применение ламотриджина у тех больных с БАР, чья болезнь характеризуется преобладанием депрессий (F.Vajda и соавт., 2013).
Связывание ламотриджина с белками плазмы крови умеренное (около 55%). Объем распределения (Vd) равен 0,9–1,2 л/кг у здоровых добровольцев и 1,28–1,36 л/кг у пациентов с эпилепсией и/или при наличии сопутствующей терапии (A.Alabi и соавт., 2016). Ламотриджин подвергается глюкуронизации в печени при помощи фермента глюкуронилтрансферазы (UGT). В результате образуется неактивный метаболит ламотриджина 2N-глюкуронид, который затем выводится в основном через почки с мочой. Ламотриджин не индуцирует свой собственный метаболизм (не повышает активность глюкуронилтрансферазы). Поэтому при длительном приеме его концентрация остается такой же, как и в начале приема, и коррекции дозы не требуется. Это выгодно отличает ламотриджин от таких препаратов, как карбамазепин, фенобарбитал, фенитоин, которые при длительном приеме индуцируют свой собственный метаболизм, что вынуждает повышать их дозировку или увеличивать кратность приема в сутки.
На скорость глюкуронизации ламотриджина в печени существенно влияет прием ряда других лекарств, в частности других ПЭП. Так, при одновременном применении ламотриджина с индукторами микросомальных ферментов печени (барбитураты, карбамазепин, фенитоин, примидон, рифампицин и др.) метаболизм ламотриджина ускоряется, концентрация его в крови снижается (что требует повышения его дозы). T1/2 ламотриджина на фоне приема этих препаратов может укорачиваться до 8–20 ч (что вынуждает принимать его на фоне этих препаратов дважды в сутки) [S.Jacob, A.Nair, 2016]. Напротив, совместное применение ламотриджина с вальпроатами, угнетающими активность микросомальных ферментов печени и тормозящими метаболизм ламотриджина, приводит к повышению концентрации ламотриджина в плазме крови в среднем в 2 раза (что требует соответствующего снижения его дозы) и увеличению его T1/2 до 60 ч (S.Jacob, A.Nair, 2016).
Клиренс ламотриджина выше у детей и пожилых людей по сравнению со взрослыми (E.Perucca, 2006). В III триместре беременности концентрация ламотриджина в плазме крови повышается в среднем на 90% по сравнению с исходным уровнем до беременности, что может привести к необходимости коррекции дозы (P.Pennell и соавт., 2008). В связи с тем, что ламотриджин подвергается глюкуронизации, а не окислительному метаболизму с участием ферментов системы смешанных оксидаз цитохрома P450 и не является ни индуктором, ни ингибитором этой системы, он не влияет на уровень естественных или экзогенных половых гормонов и не снижает эффективности комбинированных оральных контрацептивов (КОК). В свою очередь, КОК меньше влияют на его метаболизм, чем полагали ранее (P.Phelps, 2018). Это обусловливает его преимущества в лечении эпилепсии у женщин детородного возраста, многие из которых прибегают к гормональной контрацепции (Г.Н.Авакян, 2007; P.Phelps, 2018).
Ламотриджин выводится в основном с мочой в виде неактивного ламотриджина 2N-глюкуронида (S.Kayani, D.Sirsi, 2012).
Так, в частности, при сочетании ламотриджина с такими индукторами его глюкуронизации, как фенобарбитал, фенитоин, примидон, карбамазепин, окскарбазепин, рифампицин, ритонавир/лопинавир, атазанавир/ритонавир, его клиренс значительно увеличивается, концентрация в крови снижается, а T1/2 укорачивается (U.Ebert и соавт., 2000; H.Hachad и соавт., 2002; E.Perucca, 2006). Мощным индуктором глюкуронизации ламотриджина является также такой ПЭП, как метосуксимид (метоксимид) – при его совместном применении с ламотриджином концентрация последнего в плазме крови снижается в среднем на 70% (T.May и соавт., 1999).
Напротив, вальпроат является ингибитором глюкуронилтрансферазы и вследствие этого тормозит метаболизм ламотриджина, повышая его концентрацию в плазме крови в среднем в 2 раза и удлиняя его T1/2 в среднем до 60 ч (H.Hachad и соавт., 2002). Некоторыми авторами зарегистрировано также значительное снижение концентрации ламотриджина при одновременном приеме его с КОК (A.Sabers и соавт., 2001; J.Sidhu и соавт., 2006; J.Christensen и соавт., 2007). Однако более поздние исследования показали отсутствие клинически значимого взаимодействия между ламотриджином и КОК (Г.Н.Авакян, 2007; P.Phelps, 2018).
Описаны также случаи провокации развития серотонинового синдрома при сочетании ламотриджина с селективным ингибитором обратного захвата серотонина (СИОЗС) сертралином, вероятно, связанные с непрямым потенцирующим воздействием ламотриджина на серотонинергическую систему мозга (K.Kaufman, R.Gerner, 1998).
Режим дозирования ламотриджина зависит от показаний к его применению, возраста и массы тела пациента и наличия или отсутствия в схеме лечения других препаратов, ускоряющих или, наоборот, замедляющих метаболизм (глюкуронизацию) ламотриджина.
При применении ламотриджина желательно проверять его концентрацию в плазме крови и корректировать дозу в соответствии с ней, так как метаболизм ламотриджина подвержен значительным межиндивидуальным вариациям. Терапевтическим диапазоном концентраций ламотриджина принято считать диапазон от 2,5–5 до 15 мг/л. Концентрации в этом диапазоне наиболее часто наблюдаются у пациентов, получающих терапевтические дозы препарата (E.Perucca, 2000; S.Johannessen, T.Tomson, 2006). При концентрации ламотриджина ниже 5 мг/л возрастает риск неэффективности терапии, а при концентрации выше 15 мг/л возрастает риск неврологических ПЭ и дерматологической токсичности (M.Sondergaard Khinchi и соавт., 2008).
Режим дозирования ламотриджина различен для разных показаний к его применению и от того, использовался ли он в монотерапии или в комбинации с другими препаратами (M.Goldenberg, 2010; N.Betchel, A.Saadabadi, 2018).
При эпилепсии и других судорожных синдромах (официальная инструкция, 2016):
1. Начальная доза ламотриджина при его применении в монотерапии (не в комбинации с карбамазепином или окскарбазепином, фенитоином, примидоном, фенобарбиталом, рифампицином, ритонавиром/лопинавиром, атазанавиром/ритонавиром или, наоборот, вальпроевой кислотой) должна составлять 25 мг ежедневно. Такую дозу следует поддерживать в течение первых 2 нед лечения. Затем с 3-й недели дозу следует увеличить до 50 мг/сут и также поддерживать ее в течение 2 нед. С 5-й недели дозировку ламотриджина следует увеличивать до достижения запланированной целевой дозы или получения оптимального терапевтического эффекта максимально на 50–100 мг каждые 1–2 нед. Обычная поддерживающая доза ламотриджина в монотерапии при эпилепсии составляет 100–200 мг/сут в 1 или 2 приема. Некоторым пациентам для достижения оптимального терапевтического эффекта требуются дозы ламотриджина вплоть до 500 мг/сут.
2. При одновременном использовании ламотриджина с вальпроатом, который тормозит его метаболизм и повышает концентрацию в плазме крови в среднем в 2 раза начальная и конечная дозы ламотриджина должны быть снижены в 2 раза, а наращивание производиться в 2 раза медленнее. А именно: начальная доза ламотриджина должна составлять 25 мг через день или 12,5 мг ежедневно. Такую дозу следует поддерживать на протяжении первых 2 нед. C 3-й недели дозу ламотриджина следует увеличить до 25 мг в день также на протяжении 2 нед.
С 5-й недели дозу ламотриджина следует увеличивать максимально на 25–50 мг каждые 1–2 нед до достижения запланированной целевой дозы или получения оптимального терапевтического эффекта. Обычные поддерживающие дозировки ламотриджина на фоне вальпроата составляют от 100 до 200 мг/сут в 1 или 2 приема. Некоторым больным даже при одновременном приеме вальпроатов могут потребоваться дозы вплоть до 400 мг/сут.
3. При одновременном приеме ламотриджина с такими индукторами его глюкуронизации, как карбамазепин и окскарбазепин, фенитоин, фенобарбитал, рифампицин, ритонавир/лопинавир, атазанавир/ритонавир, без одновременного приема вальпроатов начальная и конечная дозы ламотриджина могут быть в 2 раза выше, а скорость его наращивания может быть увеличена в 2 раза. Лечение ламотриджином в этих обстоятельствах можно начинать с дозы 50 мг/сут в 2 приема в течение первых 2 нед. С 3-й недели дозу ламотриджина можно увеличить до 100 мг/сут в 2 приема. С 5-й недели дозу ламотриджина можно увеличивать максимально на 100 мг каждые 1–2 нед до достижения запланированной целевой дозы или получения оптимального терапевтического эффекта. Обычные терапевтические дозы ламотриджина на фоне одновременного приема индукторов его глюкуронизации составляют от 200 до 400 мг/сут. Некоторым больным для достижения оптимального терапевтического эффекта при одновременном приеме индукторов глюкуронизации ламотриджина могут потребоваться дозы вплоть до 700 мг/сут.
При поддерживающей терапии БАР I и II типа рекомендованные целевые дозы ламотриджина в монотерапии составляют от 100–200 до 400 мг/сут. Некоторым больным может потребоваться вплоть до 700 мг/сут. При определении начальной и конечной дозы и режима наращивания дозировок следует ориентироваться на приведенный график наращивания и учитывать одновременно принимаемые препараты, могущие являться индукторами его метаболизма (карбамазепин, окскарбазепин, фенобарбитал, фенитоин) или, напротив, ингибиторами его метаболизма (вальпроат) [M.Goldenberg, 2010].
Не следует превышать рекомендованные начальные и конечные дозы или проводить наращивание быстрее, чем это рекомендуется официальной инструкцией к препарату, из-за риска возникновения у пациентов кожного зуда и сыпи и повышения риска развития синдрома Лайелла или синдрома Стивенса–Джонсона (M.Goldenberg, 2010).
Как официальная инструкция к препарату, так и авторы ряда статей не рекомендуют пытаться возобновлять терапию ламотриджином у пациентов, у которых ранее пришлось прекратить ее из-за возникновения кожного зуда или сыпи, если только потенциальные выгоды явно не перевешивают возможные риски, и не рекомендуют пытаться возобновлять терапию ламотриджином у пациентов, у которых в анамнезе возникал синдром Лайелла или синдром Стивенса–Джонсона при применении ламотриджина (M.Goldenberg, 2010).
Однако последние исследования показывают, что с учетом уникальных терапевтических преимуществ ламотриджина осторожное возобновление лечения им с меньших доз и с более медленным по сравнению с предписанным инструкцией наращиванием доз может быть безопасным и оправданным у больных, у которых ранее лечение пришлось прекратить из-за возникновения кожного зуда или сыпи. Более того, по последним данным, осторожное возобновление терапии ламотриджином начиная с 2,5–5 мг/сут с постепенным наращиванием дозы препарата со скоростью не быстрее 5 мг каждые 2 нед может быть безопасным и оправданным даже у больных, у которых в прошлом при попытке применения ламотриджина по стандартному протоколу развивался синдром Стивенса–Джонсона или синдром Лайелла (P.Phelps, 2018).
По данным литературы, у пациенток, начинающих или прекращающих прием эстрогенсодержащих КОК, может потребоваться коррекция поддерживающих доз ламотриджина (M.Goldenberg, 2010). Однако последние исследования указывают на то, что взаимодействие ламотриджина с КОК гораздо менее значимо, чем было принято считать ранее, и что коррекция дозы ламотриджина при начале и окончании приема КОК может не требоваться (P.Phelps, 2018).
Важно отметить, что кожная сыпь и зуд, возникающие при терапии ламотриджином, дозозависимы и, как правило, носят не аллергический, а дерматотоксический характер. Наличие аллергического анамнеза и даже синдрома Стивенса–Джонсона или синдрома Лайелла в анамнезе при применении других препаратов, в том числе других ПЭП, не позволяет предсказать возможное развитие кожного зуда и/или сыпи или синдрома Лайелла, синдрома Стивенса–Джонсона при терапии ламотриджином, не повышает их вероятность и не является противопоказанием к его применению (P.Phelps, 2018). Особенно часто кожный зуд и сыпь возникают при чрезмерно быстром наращивании дозы ламотриджина или чрезмерно высокой его начальной дозе. Поэтому предупредить или снизить риск возникновения кожной сыпи и зуда можно путем уменьшения начальной дозы и скорости титрования дозы препарата (M.Yerby, 2000).
Следует различать так называемую доброкачественную кожную сыпь или зуд, могущие возникнуть в начале терапии ламотриджином, особенно при чрезмерно высокой начальной дозе или быстром наращивании дозы, и кожную сыпь, потенциально угрожающую перерасти в синдром Стивенса–Джонсона или синдром Лайелла. При возникновении доброкачественной кожной сыпи или зуда обычно рекомендуется отмена или по крайней мере резкое снижение дозы ламотриджина (не менее чем на 1–2 ступени вниз по схеме), назначение антигистаминных средств, глюкокортикоидных мазей и, после некоторого периода ожидания, возможно более осторожное и плавное возобновление терапии им с меньшей дозы и с более медленным наращиванием (P.Phelps, 2018).
К угрожающим признакам, обозначающим высокую опасность развития синдрома Стивенса–Джонсона или синдрома Лайелла у данного больного, относится сильный кожный зуд, выраженная эритема (покраснение сыпи), быстрое ее распространение по телу или появление волдырей, вовлечение наряду с кожей слизистых оболочек, а также одновременное или почти одновременное с сыпью появление лимфаденопатии, субфебрильной или фебрильной температуры, общего недомогания или усталости, возникновение или усиление психических нарушений (тревоги, бессонницы, возбуждения, помрачения сознания) [P.Phelps, 2018]. В подобных случаях необходимы немедленная полная отмена ламотриджина, назначение наряду с антигистаминными средствами и глюкокортикоидными мазями также высоких доз системных глюкокортикоидов, а также иммуноглобулин внутривенно, циклоспорин или такролимус, инфузионная и дезинтоксикационная терапия, тщательное стационарное наблюдение, при присоединении вторичной инфекции – борьба с ней (P.Phelps, 2018). Тем не менее даже у больных, перенесших этот синдром, порой оказывается и возможным и показанным осторожное возобновление приема ламотриджина с 2,5–5 мг с последующим наращиванием со скоростью 5 мг каждые 2 нед (P.Phelps, 2018).
Помимо кожной сыпи, зуда и лимфаденопатии у 8–20% пациентов, особенно в начале терапии или при быстром наращивании доз, могут наблюдаться неврологические ПЭ (диплопия, атаксия, головокружение), а также такие ПЭ, как сонливость или бессонница, возбуждение, тревога, тошнота, астения, головные боли (A.Sabers, L.Gram, 2000; S.Kayani, D.Sirsi, 2012). Среди других более редких ПЭ, зафиксированных в 12 рандомизированных клинических исследованиях (РКИ) у пациентов с БАР, отмечены сухость во рту (6,3%), диарея (6,2%) и тремор (3,9%) [A.Alabi и соавт., 2016].
Изредка отмечаются парадоксальное ухудшение течения БАР, парадоксальная депрессия или провокация маниакальных, гипоманиакальных или смешанных состояний или быстрой цикличности ламотриджином (эффект, подобный эффекту применения при БАР антидепрессантов – АД) [P.Phelps, 2018]. Это не всегда является основанием для отмены ламотриджина и может служить скорее основанием для добавления АД при возникновении парадоксальной депрессии, или для добавления второго НТ с антиманиакальным действием (лития, вальпроата либо карбамазепина), или атипичного АП (ААП) при провокации ламотриджином маниакального, гипоманиакального, смешанного или быстроциклического состояния (P.Phelps, 2018).
Первоначально предполагалось, что механизм противосудорожного действия ламотриджина связан с его антагонизмом по отношению к фолату (такой же и даже более выраженный антагонизм по отношению к фолату имеется у вальпроатов, с чем и связывают развитие дефектов нервной трубки у плода при их применении во время беременности), поскольку фолат является проконвульсантом. Более того, ламотриджин даже синтезировался изначально в качестве потенциального антагониста фолатов, но менее токсичного, чем вальпроат (F.Vajda и соавт., 2013). Однако позже было показано, что противосудорожное действие ламотриджина связано не с его антагонизмом к фолатам, а с ингибированием потенциалзависимых натриевых каналов и возникающим вследствие этого угнетением высвобождения возбуждающих аминокислот (глутамата и аспартата) и моноаминов (M.Leach и соавт., 1986; M.Brodie, 1992; T.Ketter и соавт., 2003; C.Hahn и соавт., 2004; V.Biton, 2006; С.Г.Бурчинский, 2010).
Важно то, что угнетающее действие ламотриджина на потенциалзависимые натриевые каналы и выделение возбуждающих аминокислот и моноаминов проявляется только в перевозбужденных или генерирующих спонтанную эпилептогенную активность нейронах. При нормальном функционировании нейронов этот эффект не возникает (B.Meldrium, 1996; J.Langosch, 1999). Это обусловливает меньшее потенциальное негативное влияние ламотриджина на когнитивные функции и психическую деятельность больных эпилепсией (или даже полное отсутствие такого негативного влияния) по сравнению с ПЭП I поколения, такими как фенобарбитал, карбамазепин, примидон, фенитоин, вальпроат, относительно неизбирательно угнетающими активность нейронов, вне зависимости от исходной степени их возбуждения (B.Meldrium, 1996; J.Langosch, 1999).
Важно, что в результате этого воздействия ламотриджина снижается патологическая гиперактивность глутаматергических нейронов гиппокампа в зоне CA1, т.е. в той области, которая в значительной степени ответственна за регуляцию эмоциональной сферы, а также когнитивных функций и корково-подкорковых взаимоотношений (R.Martin, 1999; R.Hirschfeld, 2003). Это приводит к тому, что ламотриджин не только профилактирует возникновение припадков у больных с эпилепсией, но и способствует улучшению их настроения и когнитивного функционирования, купированию нередко коморбидных с эпилепсией депрессивных, тревожных и дисфорических проявлений (R.Martin, 1999; R.Hirschfeld, 2003).
Кроме того, ламотриджин оказывает косвенное ингибирующее воздействие на вольтажзависимые кальциевые каналы (A.Stefani и соавт., 1996). Исследования также показывают, что ламотриджин оказывает свое противосудорожное действие благодаря угнетению выделения возбуждающих аминокислот, что приводит к снижению активности постсинаптических NMDA- (глутаматных) и AMPA- (каинатных и пропионовых) рецепторов (C.Lee и соавт., 2008; S.Stahl, 2013).
Ламотриджин оказывает разнонаправленное влияние на метаболизм глюкозы и мозговой кровоток в различных регионах центральной нервной системы (преимущественно в паралимбической области, таламусе и различных областях коры больших полушарий). Косвенным механизмом благодаря снижению выделения глутамата и аспартата ламотриджин повышает содержание в центральной нервной системе их физиологического антагониста – основного тормозного медиатора, g-аминомасляной кислоты, также обладающей противосудорожными свойствами (T.Kimbrell, 1998; T.Ketter и соавт., 2003; C.Hahn и соавт., 2004; S.Stahl, 2013).
Важно, что ламотриджин избирательно подавляет патологическую гиперактивность нейронов, не влияя на их нормальное физиологическое функционирование. Это имеет важные последствия не только для стабилизации деятельности нейронов и предотвращения эпилептических приступов, но и для благоприятного по сравнению с более старыми и менее избирательными ПЭП профиля когнитивной и поведенческой токсичности ламотриджина (C.Hahn и соавт., 2004; S.Stahl, 2013). Дополнительный недавно описанный механизм действия ламотриджина включает в себя предотвращение гиперполяризации мембран нейронов за счет угнетения тока внутренней гиперполяризации (Ih) [N.Poolos и соавт., 2002; C.Zona и соавт., 2002).
На сегодняшний день ламотриджин имеет убедительно доказанную эффективность в качестве ПЭП (как в монотерапии, так и в составе комбинированной терапии) при первично-генерализованных тонико-клонических, простых и сложных парциальных, вторично генерализованных припадках, абсансах и атипичных абсансах, миоклонических припадках, а также при синдроме Леннокса–Гасто у пациентов в возрасте от 2 лет и старше (D.Coulter, 1997; C.Zheng и соавт., 2010; M.Goldenberg, 2010; S.Kayani, D.Sirsi, 2012; S.Yasumoto и соавт., 2016). Не менее важно, что ламотриджин также эффективен при ассоциированных с эпилепсией психических нарушениях: эпилептической депрессии, эпилептической дисфории, эпилептических психозах, психомоторных и соматовегетативных эквивалентах припадков (S.Stahl, 2013).
Кроме того, ламотриджин эффективен у взрослых (старше 16 лет) с парциальными припадками в качестве альтернативной (и нередко лучше переносимой) монотерапии или в качестве адъювантного средства при неэффективности или недостаточной эффективности монотерапии такими более старыми ПЭП, как карбамазепин, фенитоин, фенобарбитал, примидон или вальпроевая кислота (M.Goldenberg, 2010). Ламотриджин также эффективен при лечении частично или полностью резистентных к другим ПЭП форм эпилепсии (A.Celebi и соавт., 2008). Ламотриджин может использоваться в качестве ПЭП 1-й линии терапии при детской абсанс-эпилепсии (G.Holmes и соавт., 2008).
Ламотриджин эффективен и при атипичных абсансах, атипичных судорожных припадках, тонических припадках без клонической фазы, атонических припадках (приступах внезапного падения) [H.Ebrahimi, F.Ebrahimi, 2012]. Некоторая эффективность документирована для ламотриджина и при миоклонической форме эпилепсии. Вместе с тем в некоторых случаях ламотриджин ухудшает течение ювенильной миоклонической формы эпилепсии и миоклонической эпилепсии у детей младшего возраста (H.Ebrahimi, F.Ebrahimi, 2012). Благодаря своему нейропротективному, антиглутаматергическому действию ламотриджин эффективно тормозит нарастание когнитивных нарушений (эпилептической деменции) и специфических эпилептоидных изменений личности при эпилепсии (S.Stahl, 2013).
Одиннадцать двойных слепых плацебо-контролируемых РКИ показали, что ламотриджин эффективен и хорошо переносится при добавлении к текущей противоэпилептической терапии (J.Leach, M.Brodie, 1995). Другими РКИ показано, что ламотриджин также является безопасным и эффективным как при переходе на монотерапию им с другого ПЭП (F.Gilliam и соавт., 1998), так и в качестве начальной монотерапии (M.Brodie и соавт., 1995; T.Steiner и соавт., 1999).
Одним из важных преимуществ ламотриджина при лечении эпилепсии является то, что он вызывает намного меньше когнитивных нарушений, проявлений поведенческой токсичности или выраженного седативного эффекта по сравнению с другими ПЭП и обладает выраженными нейропротективными свойствами, способностью тормозить прогрессирование когнитивных нарушений, связанных с эпилепсией (S.Stahl, 2013). Кроме того, как в экспериментах на животных, так и в РКИ показано, что применение ламотриджина при эпилепсии снижает смертность и увеличивает продолжительность и качество жизни (S.Greenhill, R.Jones, 2010) вне зависимости от режима лечения (монотерапия или комбинированное лечение) [H.Allain и соавт., 2007]. Важными преимуществами ламотриджина перед многими другими ПЭП при лечении эпилепсии является также его нейтральность в отношении массы тела больного (не увеличивает, как вальпроаты, но и не снижает, как топирамат и зонисамид), отсутствие у него органной токсичности (в частности, свойственной вальпроатам и карбамазепину гепато- и гематотоксичности) [S.Stahl, 2013].
Ниже мы рассмотрим особенности применения, а также эффективность и безопасность использования ламотриджина в особых подгруппах больных: у женщин детородного возраста и беременных, детей и подростков, лиц пожилого и старческого возраста.
Кроме того, для применения ламотриджина у женщин важно также и то, что препарат в отличие от вальпроатов не приводит к повышению массы тела и риска развития синдрома поликистозных яичников (T.Betts и соавт., 2003), а в отличие от карбамазепина не индуцирует печеночный метаболизм КОК, не снижает их эффективности. Метаболизм ламотриджина не имеет гендерной специфичности, и препарат высокоэффективен в лечении эпилепсии у женщин в частности и в особенности во время беременности (Г.Н.Авакян и соавт., 2003).
Для лечения женщин с эпилепсией, находящихся в менопаузе, важно то, что ламотриджин в отличие от ряда других ПЭП (в частности, фенитоина) не снижает абсорбцию и не увеличивает катаболизм витамина D, не оказывает влияния на какие-либо другие параметры метаболизма костной ткани, не повышает риск развития остеопороза (Г.Н.Авакян и соавт., 2003; S.Stahl, 2013).
В связи с высокой безопасностью ламотриджина для плода, отсутствием у него тератогенного, эмбрио- и фетотоксического действия ряд авторов считают, что препарат должен применяться у женщин детородного возраста (у которых возможна случайная беременность) и беременных женщин чаще, чем любые другие ПЭП (A.Sabers, L.Gram, 2000). В отличие от вальпроатов и карбамазепина ламотриджин не оказывает существенного влияния на гормональный и липидный профили, в частности на уровни половых гормонов и триглицеридов, у женщин, в том числе у беременных (A.Sabers и соавт., 2001). Вместе с тем эстрогены способны снижать уровень ламотриджина в крови, что может привести к необходимости повышения дозы препарата у женщин, принимающих эстрогенсодержащие КОК (A.Sabers и соавт., 2001). Однако последние данные говорят о том, что взаимодействие ламотриджина и эстрогенсодержащих КОК, по всей вероятности, гораздо менее клинически значимо, чем считалось ранее (P.Phelps, 2018).
В одном двойном слепом плацебо-контролируемом РКИ 1999 г. сравнивали эффективность ламотриджина и плацебо при добавлении к стандартной ПЭП терапии у детей и подростков с парциальными припадками. В этом исследовании приняли участие 199 детей и подростков в возрасте от 2 до 16 лет (M.Duchowny и соавт., 1999). Целевая доза ламотриджина гибко варьировала в зависимости от того, к какому ПЭП добавлялся ламотриджин (вальпроаты, фенобарбитал, карбамазепин и др.). Почти в 1/2 (50%) случаев было отмечено снижение частоты припадков более чем на 50% при добавлении ламотриджина по сравнению с добавлением плацебо (M.Duchowny и соавт., 1999).
В одном российском открытом исследовании 2003 г. приняли участие 123 пациента в возрасте от 4 мес до 17 лет. Положительный эффект лечения, определявшийся как уменьшение частоты припадков не менее чем на 50%, достигался в среднем у 78,5% пациентов с разными формами эпилепсии. У 20,6% от общего числа пациентов была достигнута полная ремиссия (полное подавление припадков). При разных формах эпилепсии эффективность ламотриджина была различной и колебалась от 50% при синдроме Уэста до практически 100% при идиопатической генуинной эпилепсии. Частота ПЭ в данном исследовании составила около 14%. Это соответствует аналогичным показателям для других новейших ПЭП и значительно лучше, чем при применении ПЭП I поколения (Д.А.Харламов и соавт., 2003).
В другом более свежем российском открытом исследовании 2013 г. приняли участие 25 пациентов в возрасте от 2 до 18 лет с идиопатическими фокальными (n=10) и генерализованными (n=15) формами эпилепсии. Пациенты получали ламотриджин либо в качестве монотерапии (n=5), либо в составе комбинированной противоэпилептической терапии (n=20). Полная ремиссия (полное подавление припадков) было достигнуто у 18 (72%) из 25 пациентов, а значительное улучшение (снижение частоты припадков не менее чем на 50%) – у 5 (20%) из 25. У 1 (4%) пациента эффект от лечения отсутствовал, и еще у одного (также 4% от общего числа случаев) было отмечено ухудшение состояния. Данное исследование подтвердило высокую эффективность и хорошую переносимость ламотриджина как в монотерапии, так и в составе комбинированной терапии с другими ПЭП в лечении идиопатических фокальных и генерализованных форм эпилепсии у детей и подростков (К.Ю.Мухин и соавт., 2013).
Ламотриджин в связи с его хорошей переносимостью и малым количеством ПЭ, отсутствием органной токсичности (в частности, гепато- и гематотоксичности), влияния на массу тела и липидный профиль крови, способности повышать кардиометаболический риск (что бывает при применении вальпроатов), влияния на активность тромбоцитов и свертываемость крови (которое есть у вальпроатов), активность ферментов системы цитохрома P450 и метаболизм других лекарств (а пожилые больные нередко принимают много лекарств для лечения сопутствующих заболеваний) должен являться препаратом первого выбора при лечении эпилепсии у больных пожилого и старческого возраста (С.Р.Нурмухаметова, Р.В.Магжанов, 2013; S.Stahl, 2013). В случае необходимости применения ламотриджина у пожилых больных не в монотерапии, а в комбинации с другими ПЭП вследствие недостаточной эффективности монотерапии данным препаратом следует рассматривать именно ламотриджин в качестве базового препарата комбинации (С.Р.Нурмухаметова, Р.В.Магжанов, 2013; S.Stahl, 2013).
Для применения ламотриджина при эпилепсии у больных пожилого и старческого возраста в качестве предпочтительного препарата важно также то, что ламотриджин, несмотря на то что является мощным ПЭП, не обладает когнитивными ПЭ (а это важно с учетом возрастного когнитивного снижения) и что он обладает линейной и предсказуемой фармакокинетикой, а метаболизм его заключается в глюкуронизации, а не в окислении. Между тем скорость глюкуронизации в отличие от скорости микросомального окисления мало изменяется с возрастом (J.Poza, 2007). Не менее важно отсутствие у ламотриджина свойственного фенитоину и некоторым другим ПЭП негативного влияния на обмен витамина D, фосфора и кальция и минеральную плотность костей, отсутствие у него склонности повышать риск развития возрастного остеопороза и переломов костей (S.Stahl, 2013).
В другом, более позднем, двойном слепом плацебо-контролируемом РКИ 1998 г. изучали эффективность ламотриджина по сравнению с плацебо в качестве адъювантного лечения при резистентных формах генерализованной эпилепсии у детей и подростков. В этом РКИ приняли участие 30 детей и подростков. У большинства пациентов наблюдалось статистически значимое снижение частоты припадков при добавлении к исходному ПЭП ламотриджина по сравнению с добавлением плацебо. Важно, что снижение частоты припадков при добавлении ламотриджина по сравнению с плацебо наблюдалось в том числе и у детей и подростков с синдромом Леннокса–Гасто – одной из самых тяжелых и плохо поддающихся лечению форм детской и подростковой эпилепсии (A.Eriksson и соавт., 1998).
В еще одном исследовании 2000 г. изучали эффективность ламотриджина в качестве адъювантной терапии или альтернативной монотерапии у пациентов с эпилепсией, резистентных к лечению карбамазепином или вальпроатом. В этом исследовании приняли участие 126 пациентов. Из них у 50% при добавлении ламотриджина в качестве адъювантного ПЭП и у 53% при переводе на ламотриджин как альтернативный ПЭП был достигнут положительный терапевтический эффект (уменьшение частоты припадков не менее чем на 50% по сравнению с исходной частотой, до начала исследования) [S.Jozwiak, A.Terczynski, 2000].
В небольшом двойном слепом РКИ 2001 г. приняли участие 12 пациентов в возрасте от 4 лет до 21 года с резистентными к другим ПЭП формами генерализованной эпилепсии. Ламотриджин назначался в дозах от 1 до 8 мг/кг. Это привело к купированию судорог у 1/2 пациентов (A.Eriksson и соавт., 2001).
Ламотриджин имеет уникальную особенность, отличающую его от всех других известных НТ. Он обладает способностью в большей мере профилактировать возникновение депрессивных, чем маниакальных или гипоманиакальных фаз, в то время как все другие НТ имеют более или менее выраженный перекос в сторону более эффективного подавления маниакальных и гипоманиакальных фаз (наиболее «гармоничным» и «антидепрессивным» среди них является литий, но даже он имеет отклонение в сторону лучшего подавления маний и гипоманий, чем депрессий) [S.Stahl, 2013].
Возможно, эта особенность ламотриджина, отличающая его от других НТ, связана с его стабилизирующим воздействием на активность глутаматергических нейронов области CA1 гиппокампа, что приводит к нормализации работы кортико-лимбической сети, которая нарушена при биполярной депрессии (J.Reid и соавт., 2013). Исследования также выявили наличие у ламотриджина ряда вторичных фармакологических эффектов, в известной мере объясняющих его сильную антидепрессивную активность и преимущественную эффективность при депрессивной фазе БАР. В частности, показано наличие у ламотриджина способности неселективно ингибировать обратный захват моноаминов (в том числе серотонина, норадреналина и дофамина), а также слабого ингибирующего действия на активность моноаминооксидаз A и B, что в сумме приводит к повышению концентраций всех трех моноаминов в синаптической щели и усилению моноаминергической нейротрансмиссии (А.К.Сариев, 1987; E.Southam, 1998; M.Sagud и соавт., 2008; Е.Н.Якушева и соавт., 2015).
Благодаря своему антиглутаматергическому действию ламотриджин также защищает нейроны от эксайтотоксического действия глутамата и избыточного входящего тока ионов кальция, т.е. оказывает нейропротективное действие. Возможно, что его терапевтический эффект при БАР связан в том числе и с этим, так как при БАР наблюдается повышенная глутаматергическая активность, окислительный и свободнорадикальный стресс и эксайтотоксическая гибель нейронов от апоптоза (А.К.Сариев и соавт., 1999; S.Stahl, 2013). Кроме того, ламотриджин повышает экспрессию BDNF и его концентрацию в ликворе, плазме крови и ткани мозга, что потенциально приводит к нейротрофическим эффектам, угнетению апоптоза и стимулированию нейрогенеза, предотвращению атрофии гиппокампа и лимбики при БАР (S.Stahl, 2013). Возможно, что ламотриджин имеет и другие, пока неизвестные механизмы действия, которые объясняют его эффективность при БАР (П.А.Баранов и соавт., 2010).
При сравнительном изучении эффективности и безопасности ламотриджина по сравнению с другими ПЭП, в том числе и нового поколения, при лечении БАР было показано, что ламотриджин обладает целым рядом преимуществ. В частности, доказательная база для его применения при БАР гораздо более убедительна, чем для топирамата, леветирацетама, зонисамида, габапентина или прегабалина (S.Stahl, 2013). Его эффективность в подавлении депрессивных фаз выше, чем у вальпроатов или карбамазепина (M.Brodie, 1995; S.Stahl, 2013). Он не оказывает нежелательного влияния на массу тела (не повышает, как вальпроаты или литий, но и не снижает, как топирамат и зонисамид), неблагоприятного влияния на когнитивные функции, свойственного многим другим НТ, особенно топирамату, не обладает выраженным седативным эффектом и поведенческой токсичностью, не имеет органной токсичности (в частности, гепато- и гематотоксичности, свойственной карбамазепину и вальпроату, кардио-, тирео- и нефротоксичности, свойственной литию) [M.Brodie, 1995; S.Stahl, 2013]. Ламотриджин также не оказывает негативного влияния на состояние волос и ногтей, не вызывает появления угрей, не ухудшает течения псориаза, что нередко имеет место при применении вальпроатов или лития (S.Stahl, 2013).
Ламотриджин также эффективен в профилактике аффективных фаз не только при БАР I, но и при БАР II (которое часто характеризуется именно преобладанием депрессий или смешанных фаз), а также при так называемом атипичном БАР или РБС (например, при депрессиях, которые внешне выглядят как «униполярные», но имеют определенные признаки, вызывающие подозрение на возможную биполярность, например, «атипичный» характер вегетативных признаков, начало в молодом возрасте, сезонный характер, возникновение реакции активации, тревоги, раздражительности или бессонницы при попытке применения монотерапии АД, семейный анамнез БАР и т.п.) [S.Stahl, 2013]. Также ламотриджин эффективен при циклотимии и быстроциклическом течении БАР, а также при кратковременных, но часто рецидивирующих, внешне «как бы униполярных» депрессиях (U.Malt, T.Fladvad, 2001; S.Stahl, 2013).
Благодаря хорошей переносимости и малому количеству проблематичных ПЭ, а также высокой эффективности в подавлении депрессий, которые субъективно доставляют больным больше страданий, чем гипоманиакальные состояния, пациенты с БАР имеют в среднем более высокую комплаентность длительному приему ламотриджина и реже бросают его, чем другие НТ (S.Stahl, 2013).
Ранее принято было считать, что острый антидепрессивный эффект ламотриджина при биполярных депрессиях наступает медленнее, чем при применении АД, в том числе и из-за необходимости его медленного наращивания ввиду риска кожного зуда или сыпи. Однако последние данные исследований показывают, что при правильном применении антидепрессивный эффект ламотриджина наступает не намного медленнее, чем при применении АД, и что больные с биполярной депрессией, имея возможность выбора, нередко сами предпочитают ламотриджин по сравнению с АД, поскольку он обычно лучше переносится, не вызывает в отличие от СИОЗС и селективных ингибиторов обратного захвата серотонина и норадреналина сексуальных дисфункций, не дает в отличие от миртазапина прибавки массы тела и т.д. (P.Phelps, 2018). Кроме того, применение ламотриджина в отличие от применения АД не ассоциируется с риском инверсии фазы в манию или гипоманию, развития смешанного состояния или быстрого цикла и риском долгосрочного ухудшения течения БАР, имеет более высокую вероятность с самого начала оказать «правильный» эффект, т.е. вывести больного в ремиссию, минуя промежуточные этапы «болтанки» фаз или инверсии фазы (P.Phelps, 2018).
В тех же случаях, когда из-за тяжести депрессивного состояния или суицидального риска у больного с БАР нет возможности и времени дожидаться наступления антидепрессивного эффекта от ламотриджина, правильнее рассматривать не отказ от применения ламотриджина в пользу применения АД, а применение, параллельно с ламотриджином, более быстродействующих препаратов, таких как литий, ААП (кветиапин или оланзапин), инфузии кетамина либо применение электросудорожной терапии (P.Phelps, 2018).
Доказательная база по эффективности ламотриджина в монотерапии при острой биполярной депрессии в рамках БАР I, II, атипичного БАР и РБС весьма убедительна и подтверждена множеством двойных слепых плацебо-контролируемых РКИ (J.Calabrese и соавт., 1999; M.Frye и соавт., 2003; S.Stahl, 2013; P.Phelps, 2018). Еще в предрегистрационном периоде эффективность ламотриджина в монотерапии при острой биполярной депрессии изучалась в 5 РКИ продолжительностью от 7 до 10 нед (J.Calabrese и соавт., 2008). Метаанализ этих РКИ показал, что положительный эффект от лечения ламотриджином при острой биполярной депрессии наблюдался у статистически достоверно гораздо большего числа пациентов, чем при применении плацебо (J.Calabrese и соавт., 2008).
В одном двойном слепом плацебо-контролируемом сравнительном РКИ 2000 г. монотерапию ламотриджином при острой биполярной депрессии сравнивали не только с плацебо, но и с монотерапией габапентином. В этом исследовании принял участие 31 пациент с острой биполярной депрессией. При этом ламотриджин показал статистически достоверно лучшую антидепрессивную эффективность не только по сравнению с плацебо, но и по сравнению с габапентином (M.Frye и соавт., 2000). Позже, в 2002 г., эти данные были реплицированы в другом двойном слепом плацебо-контролируемом сравнительном РКИ с большей выборкой (n=45). При этом частота положительного ответа на монотерапию составила 53% для ламотриджина, 28% – габапентина и 22% – плацебо (p=0,01) [G.Obrocea и соавт., 2002].
Имеются также данные об успешном применении адъювантной терапии ламотриджином при резистентной к стандартному лечению (НТ+АД) биполярной депрессии (A.Nierenberg и соавт., 2006). Пациенты (n=66) с большим депрессивным эпизодом в рамках БАР, не давшие положительного ответа на комбинацию АД и НТ, были рандомизированы к получению в течение 16 нед адъювантно к прежней терапии либо ламотриджина, либо инозитола, либо рисперидона. При этом частота положительного ответа на лечение была самой высокой для добавления ламотриджина (23,8% по сравнению с 17,4% для добавления инозитола и всего 4,6% для добавления рисперидона) [A.Nierenberg и соавт., 2006]. Это указывает на потенциальное превосходство добавления ламотриджина перед данными двумя вариантами преодоления резистентности при биполярной депрессии (добавлением инозитола либо рисперидона) [A.Nierenberg и соавт., 2006].
В еще одном небольшом РКИ 2003 г. изучалось дополнительное назначение ламотриджина при резистентной к комбинации СИОЗС с другим НТ биполярной депрессии (L.Barbosa и соавт., 2003). В этом исследовании приняли участие 23 пациента с резистентной биполярной депрессией. Все они были рандомизированы к приему либо ламотриджина (100 мг/сут, n=13), либо плацебо (n=10) в дополнение к 20 мг/сут флуоксетина и ранее принимаемому второму НТ, в течение 6 нед. При этом в группе ламотриджина было достигнуто статистически достоверное значительное улучшение показателей депрессии по шкале HAM-D по сравнению с группой плацебо (L.Barbosa и соавт., 2003).
В одном небольшом открытом исследовании изучалась эффективность монотерапии ламотриджином по сравнению с монотерапией литием в профилактике фаз обоего знака при быстроциклическом течении БАР (при котором обычно отмечается преобладание депрессий и которое является весьма трудным для терапии состоянием) [J.Walden и соавт., 2000]. В этом исследовании приняли участие 14 пациентов. Они лечились либо ламотриджином, либо литием в течение 12 мес. По истечении этого периода было обнаружено, что в группе ламотриджина 86% пациентов более не отвечают критериям диагностики быстроциклической формы БАР (т.е. перенесли менее 4 эпизодов любого знака за год, что указывает на замедление цикла). В том числе 43% пациента, леченных ламотриджином, вообще не имели ни одного аффективного эпизода за год. В группе лития лишь у 43% пациентов отмечалось замедление цикла, а полного подавления быстрых фаз не было отмечено ни у одного больного (J.Walden и соавт., 2000).
Как указывает известный психофармаколог С.Шталь, особенно удачными получаются результаты лечения резистентных форм биполярных депрессий при сочетании ламотриджина именно с литием. Возможно, это связано с тем, что оба эти НТ имеют наиболее выраженный среди всех НТ «острый» антидепрессивный эффект, или с тем, что при этом взаимно потенцируется их влияние на глутаматергическую систему и секрецию BDNF. Менее удачна, но также результативна комбинация ламотриджина с вальпроатом (возможно, вследствие фармакокинетического взаимодействия, повышения концентрации ламотриджина в крови или взаимного потенцирования действия на секрецию BDNF) и еще менее удачна комбинация с карбамазепином (S.Stahl, 2013).
В то же время, хотя формальных исследований полезности ламотриджина именно при смешанных состояниях не проводилось, клинический опыт свидетельствует, что добавление ламотриджина в качестве второго НТ к НТ с антиманиакальным действием (литию или вальпроатам) или к ААП часто оказывается полезным при смешанных состояниях и способствует более быстрой редукции их «депрессивной стороны» (S.Stahl, 2013).
В недавних исследованиях также были продемонстрированы долгосрочная эффективность и безопасность ламотриджина в лечении и профилактике резистентных форм биполярной депрессии в рамках БАР II и более высокие показатели достижения ремиссии и восстановления социального функционирования при сочетании АД с ламотриджином по сравнению с терапией АД в сочетании с другим НТ (A.Nierenberg и соавт., 2006; V.Sharma и соавт., 2008). Важно, что ламотриджин в отличие от АД при биполярной депрессии не подвержен феномену тахифилаксии (потери эффективности при длительном приеме), не ухудшает долгосрочное течение БАР, не провоцирует инверсию фазы в манию или гипоманию, развитие быстрого цикла или смешанного состояния (S.Stahl, 2013). Так, в частности, при долгосрочном наблюдении действия ламотриджина при биполярной депрессии ремиссия поддерживалась в течение всего срока наблюдения – до 1 года (M.Frye и соавт., 2003). Кроме того, описана высокая эффективность ламотриджина в профилактике фаз обоего знака при БАР, резистентном к монотерапии, в сочетании с препаратами лития или вальпроатами для дополнительной профилактики развития маниакальных и гипоманиакальных фаз (в отношении которых эффективность ламотриджина в монотерапии часто недостаточна, в то время как эффективность вальпроатов или лития часто оказывается недостаточной в отношении депрессий) [M.Kotler, M.Matar, 1998; C.Bowden, 2003; S.Stahl, 2013).
В двух 18-месячных двойных слепых плацебо-контролируемых РКИ 2003 г. сравнивали поддерживающую монотерапию литием и ламотриджином при БАР I. В одном исследовании 463 пациента с БАР I, находящихся в настоящее время в большом депрессивном эпизоде или недавно его перенесшие, были предварительно стабилизированы на ламотриджине в открытом режиме в течение 8–16 нед. Затем все эти больные были подвергнуты двойной слепой рандомизации к приему либо ламотриджина (n=221), либо лития (n=121), либо плацебо (n=121) в режиме монотерапии на срок до 18 мес. При этом ламотриджин и литий статистически достоверно не отличались друг от друга по эффективности подавления фаз обоего знака, и оба были статистически достоверно эффективнее плацебо (J.Calabrese и соавт., 2003).
В другом исследовании с меньшей выборкой (175 пациентов, все также с БАР I типа) использовалась похожая схема. В нем участвовали, наоборот, пациенты с недавними или текущими маниакальными или гипоманиакальными эпизодами. Все они были после предварительной стабилизации психического состояния подвергнуты рандомизации к получению либо ламотриджина, либо лития, либо плацебо. При этом было показано статистически достоверное преимущество как ламотриджина, так и лития перед плацебо по времени до возникновения очередного аффективного эпизода любого знака, вызвавшего необходимость медицинского вмешательства (C.Bowden и соавт., 2003). При этом также было показано, что ламотриджин статистически достоверно более эффективен в профилактике эпизодов депрессии и субдепрессии, в то время как литий статистически достоверно более эффективен в профилактике эпизодов мании и гипомании (C.Bowden и соавт., 2003).
Среди наиболее часто встречающихся коморбидных психических и наркологических расстройств при РБС такие заболевания, как алкоголизм и другие наркомании, различные тревожные расстройства, в частности ПТСР (не всегда явное, нередко как последствие тщательно скрываемых или даже неосознаваемых детских психических травм), ОКР и другие РОКС, ПРЛ, а также синдром ДП/ДР, нередко впервые возникающий в период биполярной депрессии (S.Stahl, 2013; P.Phelps, 2018). Среди неврологических расстройств повышенную частоту коморбидности с БАР и другими РБС имеют, в частности, мигрень, фибромиалгия (S.Stahl, 2013; P.Phelps, 2018).
Наличие этих коморбидных расстройств не только усложняет клиническую картину БАР или другого РБС и затрудняет диагностику и дифференциальную диагностику, но и усложняет и удорожает лечение, приводит к нередкой резистентности симптоматики как РБС, так и коморбидных заболеваний, необходимости многокомпонентного лечения и учета возможных неблагоприятных взаимодействий компонентов терапии между собой, а также возможного неблагоприятного воздействия важного компонента лечения одного из заболеваний (например, АД, назначенного по поводу коморбидного тревожного расстройства или мигрени) на течение другого заболевания (например, РБС) [S.Stahl, 2013; P.Phelps, 2018]. Отсюда понятно стремление практикующих врачей по возможности минимизировать применение различных препаратов в подобных случаях, осложненных РБС, за счет выбора такого основного препарата для лечения РБС, который бы оказывал попутное воздействие и на имеющуюся коморбидную симптоматику, даже если его применение для лечения собственно этой коморбидной симптоматики в изолированной ее форме (в отсутствие РБС) официально не утверждено FDA (S.Stahl, 2013; P.Phelps, 2018).
Как мы уже упоминали в начале данной статьи, ламотриджин давно и успешно применяется off-label при многих из этих заболеваний, в частности при мигрени, фибромиалгии, синдроме ДП/ДР (вместе с СИОЗС, селективными ингибиторами обратного захвата серотонина и норадреналина или кломипрамином), ПТСР, ПРЛ, в качестве адъюванта к серотонинергическим АД при резистентных формах ОКР и РОКС, резистентных тревожных расстройствах и др. Это дает основания предпочтительно применять именно ламотриджин и при осложненных данными заболеваниями формах БАР и РБС. И действительно, ламотриджин эффективен, в частности при синдроме ДП/ДР, возникшем на фоне биполярной депрессии (M.Sierra, 2009; S.Stahl, 2013). При сочетании БАР или РБС с ОКР или РОКС или с тревожным расстройством (особенно с ПТСР) ламотриджин способствует уменьшению выраженности и снижению частоты не только аффективных эпизодов (прежде всего депрессий), но и тревоги и навязчивостей, т.е. симптоматики обоих заболеваний (S.Stahl, 2013; P.Phelps, 2018). При сочетании БАР или РБС с мигренью или фибромиалгией ламотриджин наряду с редукцией аффективных нарушений способствует урежению и уменьшению интенсивности приступов мигрени, снижению выраженности болевого фибромиалгического синдрома (S.Stahl, 2013; P.Phelps, 2018).
Например, при сочетании БАР или РБС и алкоголизма ламотриджин не только стабилизирует настроение и уменьшает частоту и тяжесть аффективных фаз, но и уменьшает потребление алкоголя и способствует редукции патологического влечения к нему (S.Stahl, 2013; P.Phelps, 2018).
Важным преимуществом ламотриджина перед другими ПЭП при лечении эпилепсии являются также его линейная фармакокинетика, отсутствие тератогенности, эмбрио- и фетотоксичности. Это позволяет особенно рекомендовать его в лечении эпилепсии у беременных женщин и в целом у женщин детородного возраста. Ламотриджин также эффективен и безопасен в лечении различных форм эпилепсии у детей и подростков, лиц пожилого и старческого возраста.
Кроме того, ламотриджин эффективен и безопасен в профилактике аффективных фаз обоего знака (особенно депрессивных и смешанных, в меньшей степени – маниакальных и гипоманиакальных) при БАР и шизоаффективном расстройстве, циклотимии и других РБС, в лечении острой биполярной депрессии, а также при быстроциклическом течении БАР. В терапии острых маниакальных и гипоманиакальных фаз ламотриджин не показал статистически достоверного отличия от плацебо, однако при смешанных состояниях он способствует более быстрой и полной редукции их «депрессивной стороны».
Важно подчеркнуть, что ламотриджин является единственным НТ, статистически достоверно с большей эффективностью подавляющим депрессивные фазы, чем маниакальные и гипоманиакальные. Все остальные НТ имеют более или менее выраженную тенденцию к лучшему подавлению маниакальных и гипоманиакальных фаз, чем депрессивных. Это делает ламотриджин особенно показанным при БАР с преобладанием депрессивных фаз (нередкая клиническая ситуация при БАР II типа, атипичном БАР и при так называемых РБС).
Особым показанием к применению именно ламотриджина при БАР и других РБС являются также случаи так называемого отягощенного коморбидностями БАР или РБС, в частности, клинические ситуации, когда на фоне биполярной депрессии развивается синдром ДП/ДР, а также случаи сочетания БАР или РБС с выраженной тревогой или тревожными расстройствами, ОКР или РОКС, алкоголизмом, ПРЛ, мигренью, фибромиалгией.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
В психиатрии ламотриджин эффективен в профилактике фаз обоего знака (как депрессивных и смешанных, так и, в меньшей мере, маниакальных и гипоманиакальных) при биполярном аффективном расстройстве (БАР), циклотимии и других расстройствах биполярного спектра, а также в лечении острой биполярной депрессии. Ламотриджин также эффективен при быстроциклическом течении БАР и отягощенных различными коморбидностями (алкоголизмом, тревожными расстройствами, расстройствами обсессивно-компульсивного спектра, синдромом деперсонализации-дереализации) формах БАР.
Ключевые слова: ламотриджин, Сейзар, эпилепсия, биполярное аффективное расстройство, расстройства биполярного спектра, биполярная депрессия, циклотимия, быстроциклическое течение, коморбидность, алкоголизм, тревожные расстройства, расстройства обсессивно-компульсивного спектра, синдром деперсонализации-дереализации.
Для цитирования: Беккер Р.А., Быков Ю.В. Ламотриджин в лечении эпилепсии и расстройств биполярного спектра: две основные терапевтические мишени. Психиатрия и психофармакотерапия. 2018; 20 (2): 36–50.
Lamotrigine in the treatment of epilepsy and bipolar spectrum disorders: two main therapeutic indications
R.A.Bekker1, Yu.V.Bykov21David Ben Gurion University in Negev. 8410501, Israel, Be’er Sheva;
2Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310yubykov@gmail.com
Lamotrigine is a modern second-generation antiepileptic drug with fewer side effects and better tolerability than first-generation drugs, such as carbamazepine and valproate. Important advantages of lamotrigine over older drugs include the absence of long-term adverse effects of its use, in particular its neutrality with respect to the body weight of the patient, its lack of organ toxicity (eg, hepatotoxicity and hematotoxicity), the absence of negative effects on cognitive function. Lamotrigine is also safe and effective in the treatment of epilepsy in pregnant women and in women of childbearing age, in children and adolescents, in the elderly.
In psychiatry lamotrigine is effective in preventing affective episodes of both polarity (mainly depressive and mixed, and, to a lesser extent, manic and hypomanic) in bipolar affective disorder (BP), cyclothymia and other bipolar spectrum disorders, as well as in the treatment of acute bipolar depression. Lamotrigine is also effective in the rapid cycling BP and in BP with various comorbidities (alcoholism, anxiety disorders, obsessive-compulsive spectrum disorders, depersonalization-derealization syndrome).
Key words: lamotrigine, Seizar, epilepsy, bipolar affective disorder, bipolar spectrum disorders, bipolar depression, cyclothymia, rapid cycling bipolar, comorbidity, alcoholism, anxiety disorders, obsessive-compulsive spectrum disorders, depersonalization-derealization syndrome.
For citation: Bekker R.A., Bykov Yu.V. Lamotrigine in the treatment of epilepsy and bipolar spectrum disorders: two main therapeutic indications. Psychiatry and Psychopharmacotherapy. 2018; 20 (2): 36–50.
Введение
 Ламотриджин – это противоэпилептический препарат (ПЭП) II поколения, обладающий лучшим профилем переносимости и безопасности и меньшими побочными эффектами (ПЭ) по сравнению с препаратами I поколения (фенобарбиталом, фенитоином, примидоном, карбамазепином, вальпроатом). Он успешно используется в неврологии для лечения эпилепсии уже более двух десятилетий. Вначале препарат применялся только в качестве адъювантного (дополнительного) средства или средства 2-й линии при лечении фокальных и парциальных форм эпилепсии, резистентных к терапии другими препаратами, имевшими на момент начала его применения большую доказательную базу. Однако по мере накопления доказательной базы по его эффективности он стал использоваться все шире, как в комбинациях с другими ПЭП, так и в монотерапии, при разных формах эпилепсии. На сегодняшний день препарат широко используется в лечении фокальных, парциальных и генерализованных форм эпилепсии как у взрослых, так и у детей и подростков, а также у больных пожилого и старческого возраста, как в сочетании с другими ПЭП, так и в монотерапии (A.Cohen и соавт., 1987; J.Pellock, 1997).
Ламотриджин – это противоэпилептический препарат (ПЭП) II поколения, обладающий лучшим профилем переносимости и безопасности и меньшими побочными эффектами (ПЭ) по сравнению с препаратами I поколения (фенобарбиталом, фенитоином, примидоном, карбамазепином, вальпроатом). Он успешно используется в неврологии для лечения эпилепсии уже более двух десятилетий. Вначале препарат применялся только в качестве адъювантного (дополнительного) средства или средства 2-й линии при лечении фокальных и парциальных форм эпилепсии, резистентных к терапии другими препаратами, имевшими на момент начала его применения большую доказательную базу. Однако по мере накопления доказательной базы по его эффективности он стал использоваться все шире, как в комбинациях с другими ПЭП, так и в монотерапии, при разных формах эпилепсии. На сегодняшний день препарат широко используется в лечении фокальных, парциальных и генерализованных форм эпилепсии как у взрослых, так и у детей и подростков, а также у больных пожилого и старческого возраста, как в сочетании с другими ПЭП, так и в монотерапии (A.Cohen и соавт., 1987; J.Pellock, 1997).Благодаря своему хорошему профилю безопасности, в частности отсутствию тератогенного действия, а также эмбрио- и фетотоксичности, ламотриджин также считается препаратом 1-й линии для лечения различных форм эпилепсии у женщин детородного возраста и беременных (EURAP Study Group, 2006). Кроме того, ламотриджин также официально утвержден Управлением по контролю пищевых продуктов и лекарств в США (Food and Drug Administration – FDA) для поддерживающего профилактического лечения биполярного аффективного расстройства (БАР) I и II типов, а также для профилактического лечения при быстроциклическом течении БАР I и II типов. Важно подчеркнуть, что ламотриджин утвержден FDA в этом качестве для профилактики как депрессивных, так и маниакальных, гипоманиакальных и смешанных аффективных эпизодов.
Применение ламотриджина в психиатрии по off-label показаниям (т.е. по показаниям, официально не утвержденным FDA) включает в себя его применение при лечении острой биполярной депрессии и острых смешанных эпизодов с преобладанием депрессивной симптоматики, униполярной терапевтически резистентной депрессии, в качестве адъювантного средства при терапевтически резистентном обсессивно-компульсивном расстройстве (ОКР) и других расстройствах обсессивно-компульсивного спектра (РОКС), синдроме деперсонализации-дереализации (ДП/ДР), длительном расстройстве восприятия после употребления галлюциногенов (так называемом HPPD), в качестве адъюванта к антипсихотикам (АП) при шизоаффективном расстройстве и шизофрении, в качестве средства уменьшения агрессивности и импульсивности при пограничном расстройстве личности (ПРЛ), а также при некоторых тревожных расстройствах, в частности при посттравматическом стрессовом расстройстве (ПТСР) [N.Betchel, A.Saadabadi, 2018]. Применение ламотриджина по off-label показаниям в неврологии включает в себя его использование для профилактики приступов мигрени, кластерных головных болей, а также при лечении нейропатических болей, невралгии тройничного нерва, периферических нейропатий и радикулопатий, фибромиалгии (N.Betchel, A.Saadabadi, 2018).
На сегодняшний день ламотриджин является наиболее часто назначаемым в мире ПЭП как среди ПЭП II поколения, так и в целом. В Великобритании, по данным 2007 г., на ламотриджин приходилось 65% всех новых рецептов на ПЭП (R.Ackers и соавт., 2007). Широко применяется ламотриджин также в детской и подростковой практике. Так, в Нидерландах, по данным 2008 г., на ламотриджин приходилось 12% всех выписываемых детям и подросткам рецептов на ПЭП (N.Van de Vrie-Hoekstra и соавт., 2008).
Химически ламотриджин представляет собой производное фенилтриазина – 3,5-диамино-6-(2,3-дихлорфенил)-1,2,4-триазин (см. рисунок). Впервые он был синтезирован еще в начале 1980-х годов. Уже с середины 1990-х годов, по мере накопления доказательной базы по его эффективности и безопасности, ламотриджин превратился из адъювантного препарата или препарата 2-й линии для лечения эпилепсии, резистентной к более старым препаратам, имевшим на тот момент большую доказательную базу, в основной ПЭП как для монотерапии, так и для комбинированной терапии различных форм эпилепсии: первичной генерализованной, фокальной и парциальной как у взрослых, так и у детей и подростков, а также у лиц пожилого и старческого возраста (K.Goa, и соавт., 1993; E.Mullens, 1998; V.Biton и соавт., 2005; F.Vajda и соавт., 2013).
В Ирландии ламотриджин получил официальное одобрение для применения при лечении эпилепсии у взрослых в 1990 г., а в Великобритании – в 1991 г. В США FDA выдало разрешение на применение ламотриджина для лечения эпилепсии у взрослых в 1994 г. (R.Weisler и соавт., 2008).
В 1998 г. официальные показания FDA к применению ламотриджина были расширены: он получил одобрение для применения в качестве адъювантного лечения при синдроме Леннокса–Гасто (R.Weisler и соавт., 2008).
В 2003 г. ламотриджин получил одобрение FDA для применения в качестве профилактического поддерживающего лечения БАР I и II типа, профилактики как депрессивных, так и маниакальных, гипоманиакальных и смешанных эпизодов (S.Jacob, A.Nair, 2016). В том же 2003 г. ламотриджин также получил одобрение FDA для применения в качестве адъювантной терапии при фокальных и парциальных эпилептических припадках у детей и использования в качестве дополнительной терапии для частичных припадков у детей в возрасте до 2 лет (S.Kayani, D.Sirsi, 2012).
Позднее, по мере накопления данных об отсутствии у ламотриджина значимой тератогенности, эмбрио- и фетотоксичности, ламотриджин был специально рекомендован для применения у женщин детородного возраста с эпилепсией или БАР, а также для беременных с эпилепсией или БАР (M.Goldenberg, 2010).
Совсем недавно ламотриджин завоевал широкую популярность в качестве нормотимика – НТ (стабилизатора настроения), выступающего в качестве эффективной и нередко лучше переносимой альтернативы вальпроатам, литию и карбамазепину при профилактическом лечении БАР I и II типа, циклотимии и других расстройств биполярного спектра (РБС). Особенно эффективно профилактическое применение ламотриджина у тех больных с БАР, чья болезнь характеризуется преобладанием депрессий (F.Vajda и соавт., 2013).
Фармакокинетика и фармакодинамика
Ламотриджин характеризуется линейной фармакокинетикой. Он быстро и хорошо всасывается при приеме внутрь (общая биодоступность при пероральном приеме составляет 98%, пиковая концентрация – Cmax в плазме крови достигается через 1–3 ч после приема) [A.Alabi и соавт., 2016]. Период полувыведения (T1/2) ламотриджина при применении его в монотерапии (в отсутствие приема препаратов, являющихся индукторами его глюкуронизации) достаточно большой (от 24 до 30 ч), что позволяет принимать его один раз в сутки и повышает удобство терапии и комплаентность (M.Splinter, 2005). У детей T1/2 ламотриджина значительно короче и подвержен большим межиндивидуальным колебаниям. У детей в возрасте от 10 мес до 5 лет T1/2 ламотриджина колеблется от 7 до 20 ч, а в возрасте от 5 до 11 лет – от 7 до 66 ч (S.Kayani, D.Sirsi, 2012).Связывание ламотриджина с белками плазмы крови умеренное (около 55%). Объем распределения (Vd) равен 0,9–1,2 л/кг у здоровых добровольцев и 1,28–1,36 л/кг у пациентов с эпилепсией и/или при наличии сопутствующей терапии (A.Alabi и соавт., 2016). Ламотриджин подвергается глюкуронизации в печени при помощи фермента глюкуронилтрансферазы (UGT). В результате образуется неактивный метаболит ламотриджина 2N-глюкуронид, который затем выводится в основном через почки с мочой. Ламотриджин не индуцирует свой собственный метаболизм (не повышает активность глюкуронилтрансферазы). Поэтому при длительном приеме его концентрация остается такой же, как и в начале приема, и коррекции дозы не требуется. Это выгодно отличает ламотриджин от таких препаратов, как карбамазепин, фенобарбитал, фенитоин, которые при длительном приеме индуцируют свой собственный метаболизм, что вынуждает повышать их дозировку или увеличивать кратность приема в сутки.
На скорость глюкуронизации ламотриджина в печени существенно влияет прием ряда других лекарств, в частности других ПЭП. Так, при одновременном применении ламотриджина с индукторами микросомальных ферментов печени (барбитураты, карбамазепин, фенитоин, примидон, рифампицин и др.) метаболизм ламотриджина ускоряется, концентрация его в крови снижается (что требует повышения его дозы). T1/2 ламотриджина на фоне приема этих препаратов может укорачиваться до 8–20 ч (что вынуждает принимать его на фоне этих препаратов дважды в сутки) [S.Jacob, A.Nair, 2016]. Напротив, совместное применение ламотриджина с вальпроатами, угнетающими активность микросомальных ферментов печени и тормозящими метаболизм ламотриджина, приводит к повышению концентрации ламотриджина в плазме крови в среднем в 2 раза (что требует соответствующего снижения его дозы) и увеличению его T1/2 до 60 ч (S.Jacob, A.Nair, 2016).
Клиренс ламотриджина выше у детей и пожилых людей по сравнению со взрослыми (E.Perucca, 2006). В III триместре беременности концентрация ламотриджина в плазме крови повышается в среднем на 90% по сравнению с исходным уровнем до беременности, что может привести к необходимости коррекции дозы (P.Pennell и соавт., 2008). В связи с тем, что ламотриджин подвергается глюкуронизации, а не окислительному метаболизму с участием ферментов системы смешанных оксидаз цитохрома P450 и не является ни индуктором, ни ингибитором этой системы, он не влияет на уровень естественных или экзогенных половых гормонов и не снижает эффективности комбинированных оральных контрацептивов (КОК). В свою очередь, КОК меньше влияют на его метаболизм, чем полагали ранее (P.Phelps, 2018). Это обусловливает его преимущества в лечении эпилепсии у женщин детородного возраста, многие из которых прибегают к гормональной контрацепции (Г.Н.Авакян, 2007; P.Phelps, 2018).
Ламотриджин выводится в основном с мочой в виде неактивного ламотриджина 2N-глюкуронида (S.Kayani, D.Sirsi, 2012).
Взаимодействие с другими препаратами
Межлекарственные взаимодействия ламотриджина, как и ряда других новых ПЭП, в среднем менее выражены по сравнению с теми, которые были характерны для более старых ПЭП (фенобарбитала, примидона, фенитоина, карбамазепина, вальпроатов). Тем не менее между ламотриджином и некоторыми другими препаратами, в том числе упомянутыми более старыми ПЭП, могут отмечаться значительные межлекарственные взаимодействия, связанные с индуцирующим или наоборот ингибирующим (угнетающим) воздействием этих препаратов на печеночный микросомальный фермент глюкуронилтрансферазу (UGT), принимающую участие в глюкуронизации ламотриджина и других препаратов (F.Ng и соавт., 2007).Так, в частности, при сочетании ламотриджина с такими индукторами его глюкуронизации, как фенобарбитал, фенитоин, примидон, карбамазепин, окскарбазепин, рифампицин, ритонавир/лопинавир, атазанавир/ритонавир, его клиренс значительно увеличивается, концентрация в крови снижается, а T1/2 укорачивается (U.Ebert и соавт., 2000; H.Hachad и соавт., 2002; E.Perucca, 2006). Мощным индуктором глюкуронизации ламотриджина является также такой ПЭП, как метосуксимид (метоксимид) – при его совместном применении с ламотриджином концентрация последнего в плазме крови снижается в среднем на 70% (T.May и соавт., 1999).
Напротив, вальпроат является ингибитором глюкуронилтрансферазы и вследствие этого тормозит метаболизм ламотриджина, повышая его концентрацию в плазме крови в среднем в 2 раза и удлиняя его T1/2 в среднем до 60 ч (H.Hachad и соавт., 2002). Некоторыми авторами зарегистрировано также значительное снижение концентрации ламотриджина при одновременном приеме его с КОК (A.Sabers и соавт., 2001; J.Sidhu и соавт., 2006; J.Christensen и соавт., 2007). Однако более поздние исследования показали отсутствие клинически значимого взаимодействия между ламотриджином и КОК (Г.Н.Авакян, 2007; P.Phelps, 2018).
Описаны также случаи провокации развития серотонинового синдрома при сочетании ламотриджина с селективным ингибитором обратного захвата серотонина (СИОЗС) сертралином, вероятно, связанные с непрямым потенцирующим воздействием ламотриджина на серотонинергическую систему мозга (K.Kaufman, R.Gerner, 1998).
Режим дозирования
Ламотриджин на Западе доступен в разных формах выпуска: в виде обычных таблеток, жевательных и рассасывающихся (орально диспергируемых) таблеток, а также в пролонгированной форме выпуска в таблетках, покрытых оболочкой. В обычных таблетках он выпускается в дозировках 25, 50, 100, 150 и 200 мг. В виде жевательных и рассасывающихся (орально диспергируемых) он доступен в дозировках 2, 5 и 25 мг (в основном для применения в детской практике). В виде таблеток пролонгированного действия – в дозировках 25, 50, 100 и 200 мг (N.Betchel, A.Saadabadi, 2018). Не все из этих форм выпуска и дозировок в настоящее время доступны в России.Режим дозирования ламотриджина зависит от показаний к его применению, возраста и массы тела пациента и наличия или отсутствия в схеме лечения других препаратов, ускоряющих или, наоборот, замедляющих метаболизм (глюкуронизацию) ламотриджина.
При применении ламотриджина желательно проверять его концентрацию в плазме крови и корректировать дозу в соответствии с ней, так как метаболизм ламотриджина подвержен значительным межиндивидуальным вариациям. Терапевтическим диапазоном концентраций ламотриджина принято считать диапазон от 2,5–5 до 15 мг/л. Концентрации в этом диапазоне наиболее часто наблюдаются у пациентов, получающих терапевтические дозы препарата (E.Perucca, 2000; S.Johannessen, T.Tomson, 2006). При концентрации ламотриджина ниже 5 мг/л возрастает риск неэффективности терапии, а при концентрации выше 15 мг/л возрастает риск неврологических ПЭ и дерматологической токсичности (M.Sondergaard Khinchi и соавт., 2008).
Режим дозирования ламотриджина различен для разных показаний к его применению и от того, использовался ли он в монотерапии или в комбинации с другими препаратами (M.Goldenberg, 2010; N.Betchel, A.Saadabadi, 2018).
При эпилепсии и других судорожных синдромах (официальная инструкция, 2016):
1. Начальная доза ламотриджина при его применении в монотерапии (не в комбинации с карбамазепином или окскарбазепином, фенитоином, примидоном, фенобарбиталом, рифампицином, ритонавиром/лопинавиром, атазанавиром/ритонавиром или, наоборот, вальпроевой кислотой) должна составлять 25 мг ежедневно. Такую дозу следует поддерживать в течение первых 2 нед лечения. Затем с 3-й недели дозу следует увеличить до 50 мг/сут и также поддерживать ее в течение 2 нед. С 5-й недели дозировку ламотриджина следует увеличивать до достижения запланированной целевой дозы или получения оптимального терапевтического эффекта максимально на 50–100 мг каждые 1–2 нед. Обычная поддерживающая доза ламотриджина в монотерапии при эпилепсии составляет 100–200 мг/сут в 1 или 2 приема. Некоторым пациентам для достижения оптимального терапевтического эффекта требуются дозы ламотриджина вплоть до 500 мг/сут.
2. При одновременном использовании ламотриджина с вальпроатом, который тормозит его метаболизм и повышает концентрацию в плазме крови в среднем в 2 раза начальная и конечная дозы ламотриджина должны быть снижены в 2 раза, а наращивание производиться в 2 раза медленнее. А именно: начальная доза ламотриджина должна составлять 25 мг через день или 12,5 мг ежедневно. Такую дозу следует поддерживать на протяжении первых 2 нед. C 3-й недели дозу ламотриджина следует увеличить до 25 мг в день также на протяжении 2 нед.
С 5-й недели дозу ламотриджина следует увеличивать максимально на 25–50 мг каждые 1–2 нед до достижения запланированной целевой дозы или получения оптимального терапевтического эффекта. Обычные поддерживающие дозировки ламотриджина на фоне вальпроата составляют от 100 до 200 мг/сут в 1 или 2 приема. Некоторым больным даже при одновременном приеме вальпроатов могут потребоваться дозы вплоть до 400 мг/сут.
3. При одновременном приеме ламотриджина с такими индукторами его глюкуронизации, как карбамазепин и окскарбазепин, фенитоин, фенобарбитал, рифампицин, ритонавир/лопинавир, атазанавир/ритонавир, без одновременного приема вальпроатов начальная и конечная дозы ламотриджина могут быть в 2 раза выше, а скорость его наращивания может быть увеличена в 2 раза. Лечение ламотриджином в этих обстоятельствах можно начинать с дозы 50 мг/сут в 2 приема в течение первых 2 нед. С 3-й недели дозу ламотриджина можно увеличить до 100 мг/сут в 2 приема. С 5-й недели дозу ламотриджина можно увеличивать максимально на 100 мг каждые 1–2 нед до достижения запланированной целевой дозы или получения оптимального терапевтического эффекта. Обычные терапевтические дозы ламотриджина на фоне одновременного приема индукторов его глюкуронизации составляют от 200 до 400 мг/сут. Некоторым больным для достижения оптимального терапевтического эффекта при одновременном приеме индукторов глюкуронизации ламотриджина могут потребоваться дозы вплоть до 700 мг/сут.
При поддерживающей терапии БАР I и II типа рекомендованные целевые дозы ламотриджина в монотерапии составляют от 100–200 до 400 мг/сут. Некоторым больным может потребоваться вплоть до 700 мг/сут. При определении начальной и конечной дозы и режима наращивания дозировок следует ориентироваться на приведенный график наращивания и учитывать одновременно принимаемые препараты, могущие являться индукторами его метаболизма (карбамазепин, окскарбазепин, фенобарбитал, фенитоин) или, напротив, ингибиторами его метаболизма (вальпроат) [M.Goldenberg, 2010].
Не следует превышать рекомендованные начальные и конечные дозы или проводить наращивание быстрее, чем это рекомендуется официальной инструкцией к препарату, из-за риска возникновения у пациентов кожного зуда и сыпи и повышения риска развития синдрома Лайелла или синдрома Стивенса–Джонсона (M.Goldenberg, 2010).
Как официальная инструкция к препарату, так и авторы ряда статей не рекомендуют пытаться возобновлять терапию ламотриджином у пациентов, у которых ранее пришлось прекратить ее из-за возникновения кожного зуда или сыпи, если только потенциальные выгоды явно не перевешивают возможные риски, и не рекомендуют пытаться возобновлять терапию ламотриджином у пациентов, у которых в анамнезе возникал синдром Лайелла или синдром Стивенса–Джонсона при применении ламотриджина (M.Goldenberg, 2010).
Однако последние исследования показывают, что с учетом уникальных терапевтических преимуществ ламотриджина осторожное возобновление лечения им с меньших доз и с более медленным по сравнению с предписанным инструкцией наращиванием доз может быть безопасным и оправданным у больных, у которых ранее лечение пришлось прекратить из-за возникновения кожного зуда или сыпи. Более того, по последним данным, осторожное возобновление терапии ламотриджином начиная с 2,5–5 мг/сут с постепенным наращиванием дозы препарата со скоростью не быстрее 5 мг каждые 2 нед может быть безопасным и оправданным даже у больных, у которых в прошлом при попытке применения ламотриджина по стандартному протоколу развивался синдром Стивенса–Джонсона или синдром Лайелла (P.Phelps, 2018).
По данным литературы, у пациенток, начинающих или прекращающих прием эстрогенсодержащих КОК, может потребоваться коррекция поддерживающих доз ламотриджина (M.Goldenberg, 2010). Однако последние исследования указывают на то, что взаимодействие ламотриджина с КОК гораздо менее значимо, чем было принято считать ранее, и что коррекция дозы ламотриджина при начале и окончании приема КОК может не требоваться (P.Phelps, 2018).
Побочные эффекты
Ламотриджин в целом хорошо переносится и имеет сравнительно мало ПЭ. В среднем он вызывает меньше ПЭ и лучше переносится, чем ПЭП I поколения, такие как фенитоин, фенобарбитал, примидон и карбамазепин (Г.Н.Авакян, 2007). Наиболее серьезным ПЭ ламотриджина является возникновение кожного зуда и/или сыпи, а также лимфаденопатии. Этот ПЭ наблюдается с частотой приблизительно 10–12% и обычно развивается в первые 12–16 нед терапии (после 16 нед риск возникновения сыпи снижается до статистически незначимого) [A.Sabers, L.Gram, 2000]. Приблизительно у 0,1% взрослых больных и 1% детей, пролеченных ламотриджином, сыпь принимает тяжелый и угрожающий характер и может привести к развитию синдрома Лайелла (токсического эпидермального некролиза) или синдрома Стивенса–Джонсона (D.Goldsmith и соавт., 2003; S.Varghese и соавт., 2006; M.Mockenhaupt, 2011).Важно отметить, что кожная сыпь и зуд, возникающие при терапии ламотриджином, дозозависимы и, как правило, носят не аллергический, а дерматотоксический характер. Наличие аллергического анамнеза и даже синдрома Стивенса–Джонсона или синдрома Лайелла в анамнезе при применении других препаратов, в том числе других ПЭП, не позволяет предсказать возможное развитие кожного зуда и/или сыпи или синдрома Лайелла, синдрома Стивенса–Джонсона при терапии ламотриджином, не повышает их вероятность и не является противопоказанием к его применению (P.Phelps, 2018). Особенно часто кожный зуд и сыпь возникают при чрезмерно быстром наращивании дозы ламотриджина или чрезмерно высокой его начальной дозе. Поэтому предупредить или снизить риск возникновения кожной сыпи и зуда можно путем уменьшения начальной дозы и скорости титрования дозы препарата (M.Yerby, 2000).
Следует различать так называемую доброкачественную кожную сыпь или зуд, могущие возникнуть в начале терапии ламотриджином, особенно при чрезмерно высокой начальной дозе или быстром наращивании дозы, и кожную сыпь, потенциально угрожающую перерасти в синдром Стивенса–Джонсона или синдром Лайелла. При возникновении доброкачественной кожной сыпи или зуда обычно рекомендуется отмена или по крайней мере резкое снижение дозы ламотриджина (не менее чем на 1–2 ступени вниз по схеме), назначение антигистаминных средств, глюкокортикоидных мазей и, после некоторого периода ожидания, возможно более осторожное и плавное возобновление терапии им с меньшей дозы и с более медленным наращиванием (P.Phelps, 2018).
К угрожающим признакам, обозначающим высокую опасность развития синдрома Стивенса–Джонсона или синдрома Лайелла у данного больного, относится сильный кожный зуд, выраженная эритема (покраснение сыпи), быстрое ее распространение по телу или появление волдырей, вовлечение наряду с кожей слизистых оболочек, а также одновременное или почти одновременное с сыпью появление лимфаденопатии, субфебрильной или фебрильной температуры, общего недомогания или усталости, возникновение или усиление психических нарушений (тревоги, бессонницы, возбуждения, помрачения сознания) [P.Phelps, 2018]. В подобных случаях необходимы немедленная полная отмена ламотриджина, назначение наряду с антигистаминными средствами и глюкокортикоидными мазями также высоких доз системных глюкокортикоидов, а также иммуноглобулин внутривенно, циклоспорин или такролимус, инфузионная и дезинтоксикационная терапия, тщательное стационарное наблюдение, при присоединении вторичной инфекции – борьба с ней (P.Phelps, 2018). Тем не менее даже у больных, перенесших этот синдром, порой оказывается и возможным и показанным осторожное возобновление приема ламотриджина с 2,5–5 мг с последующим наращиванием со скоростью 5 мг каждые 2 нед (P.Phelps, 2018).
Помимо кожной сыпи, зуда и лимфаденопатии у 8–20% пациентов, особенно в начале терапии или при быстром наращивании доз, могут наблюдаться неврологические ПЭ (диплопия, атаксия, головокружение), а также такие ПЭ, как сонливость или бессонница, возбуждение, тревога, тошнота, астения, головные боли (A.Sabers, L.Gram, 2000; S.Kayani, D.Sirsi, 2012). Среди других более редких ПЭ, зафиксированных в 12 рандомизированных клинических исследованиях (РКИ) у пациентов с БАР, отмечены сухость во рту (6,3%), диарея (6,2%) и тремор (3,9%) [A.Alabi и соавт., 2016].
Изредка отмечаются парадоксальное ухудшение течения БАР, парадоксальная депрессия или провокация маниакальных, гипоманиакальных или смешанных состояний или быстрой цикличности ламотриджином (эффект, подобный эффекту применения при БАР антидепрессантов – АД) [P.Phelps, 2018]. Это не всегда является основанием для отмены ламотриджина и может служить скорее основанием для добавления АД при возникновении парадоксальной депрессии, или для добавления второго НТ с антиманиакальным действием (лития, вальпроата либо карбамазепина), или атипичного АП (ААП) при провокации ламотриджином маниакального, гипоманиакального, смешанного или быстроциклического состояния (P.Phelps, 2018).
Эпилепсия
Механизм противосудорожного действияПервоначально предполагалось, что механизм противосудорожного действия ламотриджина связан с его антагонизмом по отношению к фолату (такой же и даже более выраженный антагонизм по отношению к фолату имеется у вальпроатов, с чем и связывают развитие дефектов нервной трубки у плода при их применении во время беременности), поскольку фолат является проконвульсантом. Более того, ламотриджин даже синтезировался изначально в качестве потенциального антагониста фолатов, но менее токсичного, чем вальпроат (F.Vajda и соавт., 2013). Однако позже было показано, что противосудорожное действие ламотриджина связано не с его антагонизмом к фолатам, а с ингибированием потенциалзависимых натриевых каналов и возникающим вследствие этого угнетением высвобождения возбуждающих аминокислот (глутамата и аспартата) и моноаминов (M.Leach и соавт., 1986; M.Brodie, 1992; T.Ketter и соавт., 2003; C.Hahn и соавт., 2004; V.Biton, 2006; С.Г.Бурчинский, 2010).
Важно то, что угнетающее действие ламотриджина на потенциалзависимые натриевые каналы и выделение возбуждающих аминокислот и моноаминов проявляется только в перевозбужденных или генерирующих спонтанную эпилептогенную активность нейронах. При нормальном функционировании нейронов этот эффект не возникает (B.Meldrium, 1996; J.Langosch, 1999). Это обусловливает меньшее потенциальное негативное влияние ламотриджина на когнитивные функции и психическую деятельность больных эпилепсией (или даже полное отсутствие такого негативного влияния) по сравнению с ПЭП I поколения, такими как фенобарбитал, карбамазепин, примидон, фенитоин, вальпроат, относительно неизбирательно угнетающими активность нейронов, вне зависимости от исходной степени их возбуждения (B.Meldrium, 1996; J.Langosch, 1999).
Важно, что в результате этого воздействия ламотриджина снижается патологическая гиперактивность глутаматергических нейронов гиппокампа в зоне CA1, т.е. в той области, которая в значительной степени ответственна за регуляцию эмоциональной сферы, а также когнитивных функций и корково-подкорковых взаимоотношений (R.Martin, 1999; R.Hirschfeld, 2003). Это приводит к тому, что ламотриджин не только профилактирует возникновение припадков у больных с эпилепсией, но и способствует улучшению их настроения и когнитивного функционирования, купированию нередко коморбидных с эпилепсией депрессивных, тревожных и дисфорических проявлений (R.Martin, 1999; R.Hirschfeld, 2003).
Кроме того, ламотриджин оказывает косвенное ингибирующее воздействие на вольтажзависимые кальциевые каналы (A.Stefani и соавт., 1996). Исследования также показывают, что ламотриджин оказывает свое противосудорожное действие благодаря угнетению выделения возбуждающих аминокислот, что приводит к снижению активности постсинаптических NMDA- (глутаматных) и AMPA- (каинатных и пропионовых) рецепторов (C.Lee и соавт., 2008; S.Stahl, 2013).
Ламотриджин оказывает разнонаправленное влияние на метаболизм глюкозы и мозговой кровоток в различных регионах центральной нервной системы (преимущественно в паралимбической области, таламусе и различных областях коры больших полушарий). Косвенным механизмом благодаря снижению выделения глутамата и аспартата ламотриджин повышает содержание в центральной нервной системе их физиологического антагониста – основного тормозного медиатора, g-аминомасляной кислоты, также обладающей противосудорожными свойствами (T.Kimbrell, 1998; T.Ketter и соавт., 2003; C.Hahn и соавт., 2004; S.Stahl, 2013).
Важно, что ламотриджин избирательно подавляет патологическую гиперактивность нейронов, не влияя на их нормальное физиологическое функционирование. Это имеет важные последствия не только для стабилизации деятельности нейронов и предотвращения эпилептических приступов, но и для благоприятного по сравнению с более старыми и менее избирательными ПЭП профиля когнитивной и поведенческой токсичности ламотриджина (C.Hahn и соавт., 2004; S.Stahl, 2013). Дополнительный недавно описанный механизм действия ламотриджина включает в себя предотвращение гиперполяризации мембран нейронов за счет угнетения тока внутренней гиперполяризации (Ih) [N.Poolos и соавт., 2002; C.Zona и соавт., 2002).
Доказательная база эффективности ламотриджина при различных формах эпилепсии
Впервые о положительном эффекте ламотриджина при эпилепсии сообщил С.Бинни еще в 1986 г. (C.Binnie и соавт., 1986). В этом открытом исследовании 16 пациентов с эпилепсией принимали ламотриджин в дозе 120 или 240 мг. У большинства участников было зарегистрировано снижение частоты и длительности судорожных припадков начиная с первых суток лечения.На сегодняшний день ламотриджин имеет убедительно доказанную эффективность в качестве ПЭП (как в монотерапии, так и в составе комбинированной терапии) при первично-генерализованных тонико-клонических, простых и сложных парциальных, вторично генерализованных припадках, абсансах и атипичных абсансах, миоклонических припадках, а также при синдроме Леннокса–Гасто у пациентов в возрасте от 2 лет и старше (D.Coulter, 1997; C.Zheng и соавт., 2010; M.Goldenberg, 2010; S.Kayani, D.Sirsi, 2012; S.Yasumoto и соавт., 2016). Не менее важно, что ламотриджин также эффективен при ассоциированных с эпилепсией психических нарушениях: эпилептической депрессии, эпилептической дисфории, эпилептических психозах, психомоторных и соматовегетативных эквивалентах припадков (S.Stahl, 2013).
Кроме того, ламотриджин эффективен у взрослых (старше 16 лет) с парциальными припадками в качестве альтернативной (и нередко лучше переносимой) монотерапии или в качестве адъювантного средства при неэффективности или недостаточной эффективности монотерапии такими более старыми ПЭП, как карбамазепин, фенитоин, фенобарбитал, примидон или вальпроевая кислота (M.Goldenberg, 2010). Ламотриджин также эффективен при лечении частично или полностью резистентных к другим ПЭП форм эпилепсии (A.Celebi и соавт., 2008). Ламотриджин может использоваться в качестве ПЭП 1-й линии терапии при детской абсанс-эпилепсии (G.Holmes и соавт., 2008).
Ламотриджин эффективен и при атипичных абсансах, атипичных судорожных припадках, тонических припадках без клонической фазы, атонических припадках (приступах внезапного падения) [H.Ebrahimi, F.Ebrahimi, 2012]. Некоторая эффективность документирована для ламотриджина и при миоклонической форме эпилепсии. Вместе с тем в некоторых случаях ламотриджин ухудшает течение ювенильной миоклонической формы эпилепсии и миоклонической эпилепсии у детей младшего возраста (H.Ebrahimi, F.Ebrahimi, 2012). Благодаря своему нейропротективному, антиглутаматергическому действию ламотриджин эффективно тормозит нарастание когнитивных нарушений (эпилептической деменции) и специфических эпилептоидных изменений личности при эпилепсии (S.Stahl, 2013).
Одиннадцать двойных слепых плацебо-контролируемых РКИ показали, что ламотриджин эффективен и хорошо переносится при добавлении к текущей противоэпилептической терапии (J.Leach, M.Brodie, 1995). Другими РКИ показано, что ламотриджин также является безопасным и эффективным как при переходе на монотерапию им с другого ПЭП (F.Gilliam и соавт., 1998), так и в качестве начальной монотерапии (M.Brodie и соавт., 1995; T.Steiner и соавт., 1999).
Одним из важных преимуществ ламотриджина при лечении эпилепсии является то, что он вызывает намного меньше когнитивных нарушений, проявлений поведенческой токсичности или выраженного седативного эффекта по сравнению с другими ПЭП и обладает выраженными нейропротективными свойствами, способностью тормозить прогрессирование когнитивных нарушений, связанных с эпилепсией (S.Stahl, 2013). Кроме того, как в экспериментах на животных, так и в РКИ показано, что применение ламотриджина при эпилепсии снижает смертность и увеличивает продолжительность и качество жизни (S.Greenhill, R.Jones, 2010) вне зависимости от режима лечения (монотерапия или комбинированное лечение) [H.Allain и соавт., 2007]. Важными преимуществами ламотриджина перед многими другими ПЭП при лечении эпилепсии является также его нейтральность в отношении массы тела больного (не увеличивает, как вальпроаты, но и не снижает, как топирамат и зонисамид), отсутствие у него органной токсичности (в частности, свойственной вальпроатам и карбамазепину гепато- и гематотоксичности) [S.Stahl, 2013].
Ниже мы рассмотрим особенности применения, а также эффективность и безопасность использования ламотриджина в особых подгруппах больных: у женщин детородного возраста и беременных, детей и подростков, лиц пожилого и старческого возраста.
Эпилепсия у женщин и беременных
Во множестве работ показано, что ламотриджин обладает массой преимуществ перед большинством других ПЭП при применении у женщин детородного возраста и беременных. В частности, он не обладает тератогенностью, эмбрио- и фетотоксичностью в отличие от вальпроатов и карбамазепина (не вызывает дефектов развития нервной трубки, как вальпроаты и карбамазепин, не повышает риск развития у ребенка аутизма, как вальпроаты, не вызывает выкидышей на ранних стадиях, как вальпроаты, так как не является сильным антагонистом фолатов) [Г.Н.Авакян и соавт., 2003; S.Stahl, 2013]. В связи с этим ламотриджин, в отличие от карбамазепина и вальпроатов, не противопоказан при беременности, в том числе и в I триместре, в период активного органогенеза [Г.Н.Авакян и соавт., 2003; S.Stahl, 2013]. Отсутствие у ламотриджина тератогенного действия подтверждается тем, что, по данным исследований, риск пороков развития плода при приеме ламотриджина в монотерапии в I триместре беременности невысок и не превышает среднепопуляционного риска – 2–3% (P.Tennis и соавт., 2002). Не отмечено также ассоциации приема ламотриджина в I триместре беременности с развитием каких-либо определенных аномалий развития плода (P.Tennis и соавт., 2002).Кроме того, для применения ламотриджина у женщин важно также и то, что препарат в отличие от вальпроатов не приводит к повышению массы тела и риска развития синдрома поликистозных яичников (T.Betts и соавт., 2003), а в отличие от карбамазепина не индуцирует печеночный метаболизм КОК, не снижает их эффективности. Метаболизм ламотриджина не имеет гендерной специфичности, и препарат высокоэффективен в лечении эпилепсии у женщин в частности и в особенности во время беременности (Г.Н.Авакян и соавт., 2003).
Для лечения женщин с эпилепсией, находящихся в менопаузе, важно то, что ламотриджин в отличие от ряда других ПЭП (в частности, фенитоина) не снижает абсорбцию и не увеличивает катаболизм витамина D, не оказывает влияния на какие-либо другие параметры метаболизма костной ткани, не повышает риск развития остеопороза (Г.Н.Авакян и соавт., 2003; S.Stahl, 2013).
В связи с высокой безопасностью ламотриджина для плода, отсутствием у него тератогенного, эмбрио- и фетотоксического действия ряд авторов считают, что препарат должен применяться у женщин детородного возраста (у которых возможна случайная беременность) и беременных женщин чаще, чем любые другие ПЭП (A.Sabers, L.Gram, 2000). В отличие от вальпроатов и карбамазепина ламотриджин не оказывает существенного влияния на гормональный и липидный профили, в частности на уровни половых гормонов и триглицеридов, у женщин, в том числе у беременных (A.Sabers и соавт., 2001). Вместе с тем эстрогены способны снижать уровень ламотриджина в крови, что может привести к необходимости повышения дозы препарата у женщин, принимающих эстрогенсодержащие КОК (A.Sabers и соавт., 2001). Однако последние данные говорят о том, что взаимодействие ламотриджина и эстрогенсодержащих КОК, по всей вероятности, гораздо менее клинически значимо, чем считалось ранее (P.Phelps, 2018).
Эпилепсия у детей и подростков
Метаанализ, в который вошли 9 РКИ с участием 1016 детей и подростков, показал, что ламотриджин в монотерапии в этой возрастной группе обеспечивает значительно лучшее подавление эпилептических припадков (гораздо меньший процент больных, у которых припадки сохранялись) по сравнению с карбамазепином. При этом у пациентов, получавших монотерапию ламотриджином, отмечалась значительно более низкая частота возникновения ПЭ, чем у пациентов, получавших монотерапию карбамазепином (Y.Liu и соавт., 2016). Авторы данного метаанализа сделали вывод, что ламотриджин является идеальным альтернативным ПЭП для детей и подростков, которые не реагируют или в недостаточной мере реагируют на традиционные ПЭП либо которые плохо переносят, либо вообще не переносят традиционные ПЭП (испытывают выраженные ПЭ при их приеме) [Y.Liu и соавт., 2016].В одном двойном слепом плацебо-контролируемом РКИ 1999 г. сравнивали эффективность ламотриджина и плацебо при добавлении к стандартной ПЭП терапии у детей и подростков с парциальными припадками. В этом исследовании приняли участие 199 детей и подростков в возрасте от 2 до 16 лет (M.Duchowny и соавт., 1999). Целевая доза ламотриджина гибко варьировала в зависимости от того, к какому ПЭП добавлялся ламотриджин (вальпроаты, фенобарбитал, карбамазепин и др.). Почти в 1/2 (50%) случаев было отмечено снижение частоты припадков более чем на 50% при добавлении ламотриджина по сравнению с добавлением плацебо (M.Duchowny и соавт., 1999).
В одном российском открытом исследовании 2003 г. приняли участие 123 пациента в возрасте от 4 мес до 17 лет. Положительный эффект лечения, определявшийся как уменьшение частоты припадков не менее чем на 50%, достигался в среднем у 78,5% пациентов с разными формами эпилепсии. У 20,6% от общего числа пациентов была достигнута полная ремиссия (полное подавление припадков). При разных формах эпилепсии эффективность ламотриджина была различной и колебалась от 50% при синдроме Уэста до практически 100% при идиопатической генуинной эпилепсии. Частота ПЭ в данном исследовании составила около 14%. Это соответствует аналогичным показателям для других новейших ПЭП и значительно лучше, чем при применении ПЭП I поколения (Д.А.Харламов и соавт., 2003).
В другом более свежем российском открытом исследовании 2013 г. приняли участие 25 пациентов в возрасте от 2 до 18 лет с идиопатическими фокальными (n=10) и генерализованными (n=15) формами эпилепсии. Пациенты получали ламотриджин либо в качестве монотерапии (n=5), либо в составе комбинированной противоэпилептической терапии (n=20). Полная ремиссия (полное подавление припадков) было достигнуто у 18 (72%) из 25 пациентов, а значительное улучшение (снижение частоты припадков не менее чем на 50%) – у 5 (20%) из 25. У 1 (4%) пациента эффект от лечения отсутствовал, и еще у одного (также 4% от общего числа случаев) было отмечено ухудшение состояния. Данное исследование подтвердило высокую эффективность и хорошую переносимость ламотриджина как в монотерапии, так и в составе комбинированной терапии с другими ПЭП в лечении идиопатических фокальных и генерализованных форм эпилепсии у детей и подростков (К.Ю.Мухин и соавт., 2013).
Эпилепсия у лиц пожилого и старческого возраста
У больных пожилого и старческого возраста могут наблюдаться все типы эпилептических приступов. В международных рекомендациях по лечению пациентов пожилого и старческого возраста с парциальными припадками в качестве наиболее рекомендуемых препаратов указываются габапентин, ламотриджин, карбамазепин (С.Р.Нурмухаметова, Р.В.Магжанов, 2013; P.Phelps, 2018).Ламотриджин в связи с его хорошей переносимостью и малым количеством ПЭ, отсутствием органной токсичности (в частности, гепато- и гематотоксичности), влияния на массу тела и липидный профиль крови, способности повышать кардиометаболический риск (что бывает при применении вальпроатов), влияния на активность тромбоцитов и свертываемость крови (которое есть у вальпроатов), активность ферментов системы цитохрома P450 и метаболизм других лекарств (а пожилые больные нередко принимают много лекарств для лечения сопутствующих заболеваний) должен являться препаратом первого выбора при лечении эпилепсии у больных пожилого и старческого возраста (С.Р.Нурмухаметова, Р.В.Магжанов, 2013; S.Stahl, 2013). В случае необходимости применения ламотриджина у пожилых больных не в монотерапии, а в комбинации с другими ПЭП вследствие недостаточной эффективности монотерапии данным препаратом следует рассматривать именно ламотриджин в качестве базового препарата комбинации (С.Р.Нурмухаметова, Р.В.Магжанов, 2013; S.Stahl, 2013).
Для применения ламотриджина при эпилепсии у больных пожилого и старческого возраста в качестве предпочтительного препарата важно также то, что ламотриджин, несмотря на то что является мощным ПЭП, не обладает когнитивными ПЭ (а это важно с учетом возрастного когнитивного снижения) и что он обладает линейной и предсказуемой фармакокинетикой, а метаболизм его заключается в глюкуронизации, а не в окислении. Между тем скорость глюкуронизации в отличие от скорости микросомального окисления мало изменяется с возрастом (J.Poza, 2007). Не менее важно отсутствие у ламотриджина свойственного фенитоину и некоторым другим ПЭП негативного влияния на обмен витамина D, фосфора и кальция и минеральную плотность костей, отсутствие у него склонности повышать риск развития возрастного остеопороза и переломов костей (S.Stahl, 2013).
Резистентная эпилепсия
Ламотриджин эффективен при эпилепсии, частично или полностью резистентной к другим ПЭП. Так, в одном крупном многоцентровом двойном слепом плацебо-контролируемом РКИ 1993 г. изучали эффективность ламотриджина по сравнению с плацебо в качестве адъювантной терапии у пациентов с парциальными припадками, в недостаточной степени реагирующими на другие ПЭП. Пациенты получали 150 или 300 мг/сут ламотриджина в зависимости от их сопутствующих ПЭП (с учетом индукции или, наоборот, торможения глюкуронизации ламотриджина). Доза препарата подбиралась таким образом, чтобы достигалась целевая концентрация 1–3 мг/л ламотриджина в крови. При этом у большинства пациентов было отмечено значительное (p<0,001) снижение общего количества приступов на фоне терапии ламотриджином по сравнению с плацебо (G.Schapel и соавт., 1993).В другом, более позднем, двойном слепом плацебо-контролируемом РКИ 1998 г. изучали эффективность ламотриджина по сравнению с плацебо в качестве адъювантного лечения при резистентных формах генерализованной эпилепсии у детей и подростков. В этом РКИ приняли участие 30 детей и подростков. У большинства пациентов наблюдалось статистически значимое снижение частоты припадков при добавлении к исходному ПЭП ламотриджина по сравнению с добавлением плацебо. Важно, что снижение частоты припадков при добавлении ламотриджина по сравнению с плацебо наблюдалось в том числе и у детей и подростков с синдромом Леннокса–Гасто – одной из самых тяжелых и плохо поддающихся лечению форм детской и подростковой эпилепсии (A.Eriksson и соавт., 1998).
В еще одном исследовании 2000 г. изучали эффективность ламотриджина в качестве адъювантной терапии или альтернативной монотерапии у пациентов с эпилепсией, резистентных к лечению карбамазепином или вальпроатом. В этом исследовании приняли участие 126 пациентов. Из них у 50% при добавлении ламотриджина в качестве адъювантного ПЭП и у 53% при переводе на ламотриджин как альтернативный ПЭП был достигнут положительный терапевтический эффект (уменьшение частоты припадков не менее чем на 50% по сравнению с исходной частотой, до начала исследования) [S.Jozwiak, A.Terczynski, 2000].
В небольшом двойном слепом РКИ 2001 г. приняли участие 12 пациентов в возрасте от 4 лет до 21 года с резистентными к другим ПЭП формами генерализованной эпилепсии. Ламотриджин назначался в дозах от 1 до 8 мг/кг. Это привело к купированию судорог у 1/2 пациентов (A.Eriksson и соавт., 2001).
Расстройства биполярного спектра
Механизм терапевтического эффекта при РБСЛамотриджин имеет уникальную особенность, отличающую его от всех других известных НТ. Он обладает способностью в большей мере профилактировать возникновение депрессивных, чем маниакальных или гипоманиакальных фаз, в то время как все другие НТ имеют более или менее выраженный перекос в сторону более эффективного подавления маниакальных и гипоманиакальных фаз (наиболее «гармоничным» и «антидепрессивным» среди них является литий, но даже он имеет отклонение в сторону лучшего подавления маний и гипоманий, чем депрессий) [S.Stahl, 2013].
Возможно, эта особенность ламотриджина, отличающая его от других НТ, связана с его стабилизирующим воздействием на активность глутаматергических нейронов области CA1 гиппокампа, что приводит к нормализации работы кортико-лимбической сети, которая нарушена при биполярной депрессии (J.Reid и соавт., 2013). Исследования также выявили наличие у ламотриджина ряда вторичных фармакологических эффектов, в известной мере объясняющих его сильную антидепрессивную активность и преимущественную эффективность при депрессивной фазе БАР. В частности, показано наличие у ламотриджина способности неселективно ингибировать обратный захват моноаминов (в том числе серотонина, норадреналина и дофамина), а также слабого ингибирующего действия на активность моноаминооксидаз A и B, что в сумме приводит к повышению концентраций всех трех моноаминов в синаптической щели и усилению моноаминергической нейротрансмиссии (А.К.Сариев, 1987; E.Southam, 1998; M.Sagud и соавт., 2008; Е.Н.Якушева и соавт., 2015).
Благодаря своему антиглутаматергическому действию ламотриджин также защищает нейроны от эксайтотоксического действия глутамата и избыточного входящего тока ионов кальция, т.е. оказывает нейропротективное действие. Возможно, что его терапевтический эффект при БАР связан в том числе и с этим, так как при БАР наблюдается повышенная глутаматергическая активность, окислительный и свободнорадикальный стресс и эксайтотоксическая гибель нейронов от апоптоза (А.К.Сариев и соавт., 1999; S.Stahl, 2013). Кроме того, ламотриджин повышает экспрессию BDNF и его концентрацию в ликворе, плазме крови и ткани мозга, что потенциально приводит к нейротрофическим эффектам, угнетению апоптоза и стимулированию нейрогенеза, предотвращению атрофии гиппокампа и лимбики при БАР (S.Stahl, 2013). Возможно, что ламотриджин имеет и другие, пока неизвестные механизмы действия, которые объясняют его эффективность при БАР (П.А.Баранов и соавт., 2010).
Доказательная база по эффективности ламотриджина при РБС
Ламотриджин является одним из самых широко используемых НТ при лечении БАР, особенно при преобладании депрессивных или смешанно-депрессивных фаз (R.Weisler и соавт., 2008). Как в США, так и в Евросоюзе ламотриджин официально одобрен для профилактики аффективных фаз обоего знака (депрессивных, маниакальных и гипоманиакальных и смешанных) у пациентов с БАР I и II типа и особенно рекомендуется при течении болезни с преобладанием депрессивных или смешанно-депрессивных фаз (G.Goodwin и соавт., 2004). Важно подчеркнуть, что ламотриджин высокоэффективен при быстроциклическом течении БАР (течении с частой сменой фаз), т.е. как раз при той клинической форме, которая особенно трудно поддается лечению и при которой результаты применения лития или карбамазепина часто оказываются разочаровывающими, а использование АД или типичных АП способно усугубить быструю цикличность настроения (K.Fountoulakis, E.Vieta, 2008; A.Sumegi, 2008; S.Stahl, 2013).При сравнительном изучении эффективности и безопасности ламотриджина по сравнению с другими ПЭП, в том числе и нового поколения, при лечении БАР было показано, что ламотриджин обладает целым рядом преимуществ. В частности, доказательная база для его применения при БАР гораздо более убедительна, чем для топирамата, леветирацетама, зонисамида, габапентина или прегабалина (S.Stahl, 2013). Его эффективность в подавлении депрессивных фаз выше, чем у вальпроатов или карбамазепина (M.Brodie, 1995; S.Stahl, 2013). Он не оказывает нежелательного влияния на массу тела (не повышает, как вальпроаты или литий, но и не снижает, как топирамат и зонисамид), неблагоприятного влияния на когнитивные функции, свойственного многим другим НТ, особенно топирамату, не обладает выраженным седативным эффектом и поведенческой токсичностью, не имеет органной токсичности (в частности, гепато- и гематотоксичности, свойственной карбамазепину и вальпроату, кардио-, тирео- и нефротоксичности, свойственной литию) [M.Brodie, 1995; S.Stahl, 2013]. Ламотриджин также не оказывает негативного влияния на состояние волос и ногтей, не вызывает появления угрей, не ухудшает течения псориаза, что нередко имеет место при применении вальпроатов или лития (S.Stahl, 2013).
Ламотриджин также эффективен в профилактике аффективных фаз не только при БАР I, но и при БАР II (которое часто характеризуется именно преобладанием депрессий или смешанных фаз), а также при так называемом атипичном БАР или РБС (например, при депрессиях, которые внешне выглядят как «униполярные», но имеют определенные признаки, вызывающие подозрение на возможную биполярность, например, «атипичный» характер вегетативных признаков, начало в молодом возрасте, сезонный характер, возникновение реакции активации, тревоги, раздражительности или бессонницы при попытке применения монотерапии АД, семейный анамнез БАР и т.п.) [S.Stahl, 2013]. Также ламотриджин эффективен при циклотимии и быстроциклическом течении БАР, а также при кратковременных, но часто рецидивирующих, внешне «как бы униполярных» депрессиях (U.Malt, T.Fladvad, 2001; S.Stahl, 2013).
Благодаря хорошей переносимости и малому количеству проблематичных ПЭ, а также высокой эффективности в подавлении депрессий, которые субъективно доставляют больным больше страданий, чем гипоманиакальные состояния, пациенты с БАР имеют в среднем более высокую комплаентность длительному приему ламотриджина и реже бросают его, чем другие НТ (S.Stahl, 2013).
Острая биполярная депрессия
Данные множества исследований свидетельствуют о том, что ламотриджин, по-видимому, обладает более выраженным острым антидепрессивным действием, чем карбамазепин или вальпроат и, возможно, даже более выраженным, чем литий (U.Malt, T.Fladvad, 2001; S.Stahl, 2013). В то же время его острый антиманиакальный эффект (который не следует путать с профилактическим нормотимическим) слаб и неубедителен или вовсе отсутствует (U.Malt, T.Fladvad, 2001; S.Stahl, 2013).Ранее принято было считать, что острый антидепрессивный эффект ламотриджина при биполярных депрессиях наступает медленнее, чем при применении АД, в том числе и из-за необходимости его медленного наращивания ввиду риска кожного зуда или сыпи. Однако последние данные исследований показывают, что при правильном применении антидепрессивный эффект ламотриджина наступает не намного медленнее, чем при применении АД, и что больные с биполярной депрессией, имея возможность выбора, нередко сами предпочитают ламотриджин по сравнению с АД, поскольку он обычно лучше переносится, не вызывает в отличие от СИОЗС и селективных ингибиторов обратного захвата серотонина и норадреналина сексуальных дисфункций, не дает в отличие от миртазапина прибавки массы тела и т.д. (P.Phelps, 2018). Кроме того, применение ламотриджина в отличие от применения АД не ассоциируется с риском инверсии фазы в манию или гипоманию, развития смешанного состояния или быстрого цикла и риском долгосрочного ухудшения течения БАР, имеет более высокую вероятность с самого начала оказать «правильный» эффект, т.е. вывести больного в ремиссию, минуя промежуточные этапы «болтанки» фаз или инверсии фазы (P.Phelps, 2018).
В тех же случаях, когда из-за тяжести депрессивного состояния или суицидального риска у больного с БАР нет возможности и времени дожидаться наступления антидепрессивного эффекта от ламотриджина, правильнее рассматривать не отказ от применения ламотриджина в пользу применения АД, а применение, параллельно с ламотриджином, более быстродействующих препаратов, таких как литий, ААП (кветиапин или оланзапин), инфузии кетамина либо применение электросудорожной терапии (P.Phelps, 2018).
Доказательная база по эффективности ламотриджина в монотерапии при острой биполярной депрессии в рамках БАР I, II, атипичного БАР и РБС весьма убедительна и подтверждена множеством двойных слепых плацебо-контролируемых РКИ (J.Calabrese и соавт., 1999; M.Frye и соавт., 2003; S.Stahl, 2013; P.Phelps, 2018). Еще в предрегистрационном периоде эффективность ламотриджина в монотерапии при острой биполярной депрессии изучалась в 5 РКИ продолжительностью от 7 до 10 нед (J.Calabrese и соавт., 2008). Метаанализ этих РКИ показал, что положительный эффект от лечения ламотриджином при острой биполярной депрессии наблюдался у статистически достоверно гораздо большего числа пациентов, чем при применении плацебо (J.Calabrese и соавт., 2008).
В одном двойном слепом плацебо-контролируемом сравнительном РКИ 2000 г. монотерапию ламотриджином при острой биполярной депрессии сравнивали не только с плацебо, но и с монотерапией габапентином. В этом исследовании принял участие 31 пациент с острой биполярной депрессией. При этом ламотриджин показал статистически достоверно лучшую антидепрессивную эффективность не только по сравнению с плацебо, но и по сравнению с габапентином (M.Frye и соавт., 2000). Позже, в 2002 г., эти данные были реплицированы в другом двойном слепом плацебо-контролируемом сравнительном РКИ с большей выборкой (n=45). При этом частота положительного ответа на монотерапию составила 53% для ламотриджина, 28% – габапентина и 22% – плацебо (p=0,01) [G.Obrocea и соавт., 2002].
Имеются также данные об успешном применении адъювантной терапии ламотриджином при резистентной к стандартному лечению (НТ+АД) биполярной депрессии (A.Nierenberg и соавт., 2006). Пациенты (n=66) с большим депрессивным эпизодом в рамках БАР, не давшие положительного ответа на комбинацию АД и НТ, были рандомизированы к получению в течение 16 нед адъювантно к прежней терапии либо ламотриджина, либо инозитола, либо рисперидона. При этом частота положительного ответа на лечение была самой высокой для добавления ламотриджина (23,8% по сравнению с 17,4% для добавления инозитола и всего 4,6% для добавления рисперидона) [A.Nierenberg и соавт., 2006]. Это указывает на потенциальное превосходство добавления ламотриджина перед данными двумя вариантами преодоления резистентности при биполярной депрессии (добавлением инозитола либо рисперидона) [A.Nierenberg и соавт., 2006].
В еще одном небольшом РКИ 2003 г. изучалось дополнительное назначение ламотриджина при резистентной к комбинации СИОЗС с другим НТ биполярной депрессии (L.Barbosa и соавт., 2003). В этом исследовании приняли участие 23 пациента с резистентной биполярной депрессией. Все они были рандомизированы к приему либо ламотриджина (100 мг/сут, n=13), либо плацебо (n=10) в дополнение к 20 мг/сут флуоксетина и ранее принимаемому второму НТ, в течение 6 нед. При этом в группе ламотриджина было достигнуто статистически достоверное значительное улучшение показателей депрессии по шкале HAM-D по сравнению с группой плацебо (L.Barbosa и соавт., 2003).
В одном небольшом открытом исследовании изучалась эффективность монотерапии ламотриджином по сравнению с монотерапией литием в профилактике фаз обоего знака при быстроциклическом течении БАР (при котором обычно отмечается преобладание депрессий и которое является весьма трудным для терапии состоянием) [J.Walden и соавт., 2000]. В этом исследовании приняли участие 14 пациентов. Они лечились либо ламотриджином, либо литием в течение 12 мес. По истечении этого периода было обнаружено, что в группе ламотриджина 86% пациентов более не отвечают критериям диагностики быстроциклической формы БАР (т.е. перенесли менее 4 эпизодов любого знака за год, что указывает на замедление цикла). В том числе 43% пациента, леченных ламотриджином, вообще не имели ни одного аффективного эпизода за год. В группе лития лишь у 43% пациентов отмечалось замедление цикла, а полного подавления быстрых фаз не было отмечено ни у одного больного (J.Walden и соавт., 2000).
Как указывает известный психофармаколог С.Шталь, особенно удачными получаются результаты лечения резистентных форм биполярных депрессий при сочетании ламотриджина именно с литием. Возможно, это связано с тем, что оба эти НТ имеют наиболее выраженный среди всех НТ «острый» антидепрессивный эффект, или с тем, что при этом взаимно потенцируется их влияние на глутаматергическую систему и секрецию BDNF. Менее удачна, но также результативна комбинация ламотриджина с вальпроатом (возможно, вследствие фармакокинетического взаимодействия, повышения концентрации ламотриджина в крови или взаимного потенцирования действия на секрецию BDNF) и еще менее удачна комбинация с карбамазепином (S.Stahl, 2013).
Острые маниакальные, гипоманиакальные и смешанные состояния
Острая антиманиакальная эффективность ламотриджина (которую не следует путать с профилактической нормотимической в отношении маний и гипоманий), в противоположность острой антидепрессивной, слаба, неубедительна и строго не доказана. Монотерапия ламотриджином изучалась у пациентов с острыми маниакальными и гипоманиакальными состояниями в 5 РКИ. Ни в одном из них ламотриджин не превосходил по эффективности плацебо (C.Bowden, V.Singh, 2012). В обзоре Лакшми Ятама 2004 г. описаны 3 других РКИ ламотриджина при острых маниакальных и гипоманиакальных состояниях, также не показавшие отличий от плацебо (L.Yatham, 2004). Одним из упомянутых в этом обзоре РКИ было 8-недельное исследование с участием 16 пациентов с маниакальными и гипоманиакальными состояниями, резистентными к применению лития. В этом РКИ было установлено, что ламотриджин при острой мании или гипомании не более полезен, чем плацебо. В двух других процитированных Лакшми Ятамом исследованиях также не было установлено какого-либо превосходства ламотриджина над плацебо при лечении острых маниакальных или гипоманиакальных состояний. Одно из этих исследований проводилось в течение 3 нед и сравнивало ламотриджин (50 мг/сут, n=84) с литием, доза которого титровалась до достижения уровня в плазме крови от 0,8 до 1,3 ммоль/л (n=36), и плацебо (n=95). Во втором исследовании, проводившемся на протяжении 6 нед, ламотриджин (200 мг/сут, n=74) сравнивали с литием (n=78) и плацебо (n=77) в качестве адъювантов к АП при острых маниакальных и гипоманиакальных состояниях.В то же время, хотя формальных исследований полезности ламотриджина именно при смешанных состояниях не проводилось, клинический опыт свидетельствует, что добавление ламотриджина в качестве второго НТ к НТ с антиманиакальным действием (литию или вальпроатам) или к ААП часто оказывается полезным при смешанных состояниях и способствует более быстрой редукции их «депрессивной стороны» (S.Stahl, 2013).
Профилактическая терапия РБС
Эффективность ламотриджина в качестве средства профилактики аффективных фаз обоего знака (прежде всего депрессивных, но также маниакальных, гипоманиакальных и смешанных) при БАР I и II типа, атипичном БАР, циклотимии и других РБС строго доказана множеством исследований и неоднократно подтверждалась выводами множества метаанализов (S.Beynon и соавт., 2009; E.Vieta и соавт., 2011). В то же время монотерапия ламотриджином при БАР и РБС имеет преимущества перед монотерапией большинством других НТ и ААП при длительном применении с точки зрения переносимости, безопасности, органной и метаболической токсичности (D.Goldsmith и соавт., 2004).В недавних исследованиях также были продемонстрированы долгосрочная эффективность и безопасность ламотриджина в лечении и профилактике резистентных форм биполярной депрессии в рамках БАР II и более высокие показатели достижения ремиссии и восстановления социального функционирования при сочетании АД с ламотриджином по сравнению с терапией АД в сочетании с другим НТ (A.Nierenberg и соавт., 2006; V.Sharma и соавт., 2008). Важно, что ламотриджин в отличие от АД при биполярной депрессии не подвержен феномену тахифилаксии (потери эффективности при длительном приеме), не ухудшает долгосрочное течение БАР, не провоцирует инверсию фазы в манию или гипоманию, развитие быстрого цикла или смешанного состояния (S.Stahl, 2013). Так, в частности, при долгосрочном наблюдении действия ламотриджина при биполярной депрессии ремиссия поддерживалась в течение всего срока наблюдения – до 1 года (M.Frye и соавт., 2003). Кроме того, описана высокая эффективность ламотриджина в профилактике фаз обоего знака при БАР, резистентном к монотерапии, в сочетании с препаратами лития или вальпроатами для дополнительной профилактики развития маниакальных и гипоманиакальных фаз (в отношении которых эффективность ламотриджина в монотерапии часто недостаточна, в то время как эффективность вальпроатов или лития часто оказывается недостаточной в отношении депрессий) [M.Kotler, M.Matar, 1998; C.Bowden, 2003; S.Stahl, 2013).
В двух 18-месячных двойных слепых плацебо-контролируемых РКИ 2003 г. сравнивали поддерживающую монотерапию литием и ламотриджином при БАР I. В одном исследовании 463 пациента с БАР I, находящихся в настоящее время в большом депрессивном эпизоде или недавно его перенесшие, были предварительно стабилизированы на ламотриджине в открытом режиме в течение 8–16 нед. Затем все эти больные были подвергнуты двойной слепой рандомизации к приему либо ламотриджина (n=221), либо лития (n=121), либо плацебо (n=121) в режиме монотерапии на срок до 18 мес. При этом ламотриджин и литий статистически достоверно не отличались друг от друга по эффективности подавления фаз обоего знака, и оба были статистически достоверно эффективнее плацебо (J.Calabrese и соавт., 2003).
В другом исследовании с меньшей выборкой (175 пациентов, все также с БАР I типа) использовалась похожая схема. В нем участвовали, наоборот, пациенты с недавними или текущими маниакальными или гипоманиакальными эпизодами. Все они были после предварительной стабилизации психического состояния подвергнуты рандомизации к получению либо ламотриджина, либо лития, либо плацебо. При этом было показано статистически достоверное преимущество как ламотриджина, так и лития перед плацебо по времени до возникновения очередного аффективного эпизода любого знака, вызвавшего необходимость медицинского вмешательства (C.Bowden и соавт., 2003). При этом также было показано, что ламотриджин статистически достоверно более эффективен в профилактике эпизодов депрессии и субдепрессии, в то время как литий статистически достоверно более эффективен в профилактике эпизодов мании и гипомании (C.Bowden и соавт., 2003).
Осложненные различными коморбидностями формы РБС
В клинической практике достаточно редко встречается ситуация, когда у больного с БАР, циклотимией или другим РБС имеется только оно в чистом виде. По современным данным, до 70% больных с РБС имеют хотя бы одно коморбидное психическое, наркологическое или неврологическое расстройство, и до 25–30% больных с РБС имеют два и более коморбидных психических, наркологических или неврологических расстройства (S.Stahl, 2013; P.Phelps, 2018).Среди наиболее часто встречающихся коморбидных психических и наркологических расстройств при РБС такие заболевания, как алкоголизм и другие наркомании, различные тревожные расстройства, в частности ПТСР (не всегда явное, нередко как последствие тщательно скрываемых или даже неосознаваемых детских психических травм), ОКР и другие РОКС, ПРЛ, а также синдром ДП/ДР, нередко впервые возникающий в период биполярной депрессии (S.Stahl, 2013; P.Phelps, 2018). Среди неврологических расстройств повышенную частоту коморбидности с БАР и другими РБС имеют, в частности, мигрень, фибромиалгия (S.Stahl, 2013; P.Phelps, 2018).
Наличие этих коморбидных расстройств не только усложняет клиническую картину БАР или другого РБС и затрудняет диагностику и дифференциальную диагностику, но и усложняет и удорожает лечение, приводит к нередкой резистентности симптоматики как РБС, так и коморбидных заболеваний, необходимости многокомпонентного лечения и учета возможных неблагоприятных взаимодействий компонентов терапии между собой, а также возможного неблагоприятного воздействия важного компонента лечения одного из заболеваний (например, АД, назначенного по поводу коморбидного тревожного расстройства или мигрени) на течение другого заболевания (например, РБС) [S.Stahl, 2013; P.Phelps, 2018]. Отсюда понятно стремление практикующих врачей по возможности минимизировать применение различных препаратов в подобных случаях, осложненных РБС, за счет выбора такого основного препарата для лечения РБС, который бы оказывал попутное воздействие и на имеющуюся коморбидную симптоматику, даже если его применение для лечения собственно этой коморбидной симптоматики в изолированной ее форме (в отсутствие РБС) официально не утверждено FDA (S.Stahl, 2013; P.Phelps, 2018).
Как мы уже упоминали в начале данной статьи, ламотриджин давно и успешно применяется off-label при многих из этих заболеваний, в частности при мигрени, фибромиалгии, синдроме ДП/ДР (вместе с СИОЗС, селективными ингибиторами обратного захвата серотонина и норадреналина или кломипрамином), ПТСР, ПРЛ, в качестве адъюванта к серотонинергическим АД при резистентных формах ОКР и РОКС, резистентных тревожных расстройствах и др. Это дает основания предпочтительно применять именно ламотриджин и при осложненных данными заболеваниями формах БАР и РБС. И действительно, ламотриджин эффективен, в частности при синдроме ДП/ДР, возникшем на фоне биполярной депрессии (M.Sierra, 2009; S.Stahl, 2013). При сочетании БАР или РБС с ОКР или РОКС или с тревожным расстройством (особенно с ПТСР) ламотриджин способствует уменьшению выраженности и снижению частоты не только аффективных эпизодов (прежде всего депрессий), но и тревоги и навязчивостей, т.е. симптоматики обоих заболеваний (S.Stahl, 2013; P.Phelps, 2018). При сочетании БАР или РБС с мигренью или фибромиалгией ламотриджин наряду с редукцией аффективных нарушений способствует урежению и уменьшению интенсивности приступов мигрени, снижению выраженности болевого фибромиалгического синдрома (S.Stahl, 2013; P.Phelps, 2018).
Например, при сочетании БАР или РБС и алкоголизма ламотриджин не только стабилизирует настроение и уменьшает частоту и тяжесть аффективных фаз, но и уменьшает потребление алкоголя и способствует редукции патологического влечения к нему (S.Stahl, 2013; P.Phelps, 2018).
Заключение
Как видно из приведенных нами данных литературы, ламотриджин является высокоэффективным и безопасным средством лечения различных форм эпилепсии как в монотерапии, так и в составе комбинированной терапии с другими ПЭП. Важным преимуществом монотерапии ламотриджином перед монотерапией многими другими ПЭП при лечении эпилепсии является его очень хорошая переносимость и отсутствие у него каких-либо долгосрочных негативных ПЭ, в частности нейтральность по отношению к массе тела больного (он ее не повышает, как, например, вальпроат, но и не снижает, как, например, топирамат или зонисамид), отсутствие негативного влияния на когнитивные функции, память и обучаемость, органной токсичности (в частности, свойственной вальпроату и карбамазепину гемато- и гепатотоксичности), склонности провоцировать развитие синдрома поликистозных яичников, которая свойственна вальпроату, и др.Важным преимуществом ламотриджина перед другими ПЭП при лечении эпилепсии являются также его линейная фармакокинетика, отсутствие тератогенности, эмбрио- и фетотоксичности. Это позволяет особенно рекомендовать его в лечении эпилепсии у беременных женщин и в целом у женщин детородного возраста. Ламотриджин также эффективен и безопасен в лечении различных форм эпилепсии у детей и подростков, лиц пожилого и старческого возраста.
Кроме того, ламотриджин эффективен и безопасен в профилактике аффективных фаз обоего знака (особенно депрессивных и смешанных, в меньшей степени – маниакальных и гипоманиакальных) при БАР и шизоаффективном расстройстве, циклотимии и других РБС, в лечении острой биполярной депрессии, а также при быстроциклическом течении БАР. В терапии острых маниакальных и гипоманиакальных фаз ламотриджин не показал статистически достоверного отличия от плацебо, однако при смешанных состояниях он способствует более быстрой и полной редукции их «депрессивной стороны».
Важно подчеркнуть, что ламотриджин является единственным НТ, статистически достоверно с большей эффективностью подавляющим депрессивные фазы, чем маниакальные и гипоманиакальные. Все остальные НТ имеют более или менее выраженную тенденцию к лучшему подавлению маниакальных и гипоманиакальных фаз, чем депрессивных. Это делает ламотриджин особенно показанным при БАР с преобладанием депрессивных фаз (нередкая клиническая ситуация при БАР II типа, атипичном БАР и при так называемых РБС).
Особым показанием к применению именно ламотриджина при БАР и других РБС являются также случаи так называемого отягощенного коморбидностями БАР или РБС, в частности, клинические ситуации, когда на фоне биполярной депрессии развивается синдром ДП/ДР, а также случаи сочетания БАР или РБС с выраженной тревогой или тревожными расстройствами, ОКР или РОКС, алкоголизмом, ПРЛ, мигренью, фибромиалгией.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Список исп. литературыСкрыть список1. Авакян Г. Ламотриджин в лечении эпилепсии у женщин. Врач. 2007; 5: 44–7. / Avakian G. Lamotridzhin v lechenii epilepsii u zhenshchin. Vrach. 2007; 5: 44–7. [in Russian]
2. Авакян Г.Н., Юдельсон Я.Б., Маслова Н.Н., Гусев Е.И. Патогенез и лечение эпилепсии. /Журн. невропатологии и психиатрии. 2003; 9: 9–15. / Avakyan G.N., Iudel'son Ia.B., Maslova N.N., Gusev E.I. Patogenez i lechenie epilepsii. /Zhurn. nevropatologii i psikhiatrii. 2003; 9: 9–15. [in Russian]
3. Баранов П.А., Апполонова С.А. и др. Влияние мексидола на соотношение 6-бета-гидроксикортизол/свободный кортизол. Возможная индукция CYP 3A4. Эксперимент. и клин. фармакология. 2010; 73 (11): 39–40. / Baranov P.A., Appolonova S.A. i dr. Vliianie meksidola na sootnoshenie 6-beta-gidroksikortizol/svobodnyi kortizol. Vozmozhnaia induktsiia CYP 3A4. Eksperiment. i klin. farmakologiia. 2010; 73 (11): 39–40. [in Russian]
4. Бурчинский С.Г. Антиконвульсанты в фармакотерапии биполярных расстройств. Междунар. неврологический журн. 2010; 6: 110–5. / Burchinskii S.G. Antikonvul'santy v farmakoterapii bipoliarnykh rasstroistv. Mezhdunar. nevrologicheskii zhurn. 2010; 6: 110–5. [in Russian]
5. Бурчинский С.Г. Антиконвульсанты нового поколения и стандарты монотерапии эпилепсии. Междунар. неврологический журн. 2007; 6 (16). / Burchinskii S.G. Antikonvul'santy novogo pokoleniia i standarty monoterapii epilepsii. Mezhdunar. nevrologicheskii zhurn. 2007; 6 (16). [in Russian]
6. Мухин К.Ю., Пылаева О.А., Миронов М.Б. Эффективность и переносимость Ламитора (Ламотриджин) в лечении идиопатических фокальных и генерализованных форм эпилепсии в монотерапии и политерапии детей и подростков. Рус. журн. детской неврологии. 2013; VIII (1): 3–12. / Mukhin K.Iu., Pylaeva O.A., Mironov M.B. Effektivnost' i perenosimost' Lamitora (Lamotridzhin) v lechenii idiopaticheskikh fokal'nykh i generalizovannykh form epilepsii v monoterapii i politerapii detei i podrostkov. Rus. zhurn. detskoi nevrologii. 2013; VIII (1): 3–12. [in Russian]
7. Ламиктал. Официальная инструкция к препарату. Опубликовано в справочнике Видаль (https://www.vidal.ru/drugs/ lamictal__18625). / Lamiktal. Ofitsial'naia instruktsiia k preparatu. Opublikovano v spravochnike Vidal' (https://www.vidal.ru/drugs/ lamictal__18625). [in Russian]
8. Нурмухаметова С.Р., Магжанов Р.В. Опыт применения ламотриджина при лечении эпилепсии у пожилых. Эпилепсия и пароксизмальные состояния. 2013; 5 (1): 48–50. / Nurmukhametova S.R., Magzhanov R.V. Opyt primeneniia lamotridzhina pri lechenii epilepsii u pozhilykh. Epilepsiia i paroksizmal'nye sostoianiia. 2013; 5 (1): 48–50. [in Russian]
9. Сариев А.К., Жердев В.П., Литвин А.А. и др. Кинетика выведения мексидола и его глюкуроноконъюгата с мочой больных. Эксперим. и клин. фармакология. 1999; 62 (5): 42–6. / Sariev A.K., Zherdev V.P., Litvin A.A. i dr. Kinetika vyvedeniia meksidola i ego gliukuronokon"iugata s mochoi bol'nykh. Eksperim. i klin. farmakologiia. 1999; 62 (5): 42–6. [in Russian]
10. Сариев А.К. Фармакокинетика производных 3-оксипиридина в эксперименте. Дис. … канд. мед. наук. М., 1987. / Sariev A.K. Farmakokinetika proizvodnykh 3-oksipiridina v eksperimente. Dis. … kand. med. nauk. M., 1987. [in Russian]
11. Харламов Д.А., Зенков Л.Р., Сарапулова А.А. и др. Ламотриджин в лечении фармакорезистентной эпилепсии у детей. Неврологический журн. 2003; 8 (4): 30. / Kharlamov D.A., Zenkov L.R., Sarapulova A.A. i dr. Lamotridzhin v lechenii farmakorezistentnoi epilepsii u detei. Nevrologicheskii zhurn. 2003; 8 (4): 30. [in Russian]
12. Якушева Е.Н., Щулькин А.В., Черных И.В. Оценка принадлежности мексидола к субстратам, ингибиторам или индукторам гликопротеина-Р. Эксперим. и клин. фармакология. 2015; 78 (5): 19–23. / Iakusheva E.N., Shchul'kin A.V., Chernykh I.V. Otsenka prinadlezhnosti meksidola k substratam, ingibitoram ili induktoram glikoproteina-R. Eksperim. i klin. farmakologiia. 2015; 78 (5): 19–23. [in Russian]
13. Ackers R, Murray ML, Besag F et al. Prioritizing children's medicines for research: a pharmacoepidemiological study of antiepileptic drugs. Br J Clin Pharmacol 2007; 63: 689–97.
14. Alabi A, Todd A, Husband A, Reilly J. Safety profile of lamotrigine in overdose. Ther Adv Psychopharmacol 2016; 6 (6): 369–81.
15. Allain H, Schück S, Nachit-Ouinekh F et al. Improvement in quality of life after initiation of lamotrigine therapy in patients with epilepsy in a naturalistic treatment setting. Seizure 2007; 16 (2): 173–84.
16. Barbosa L, Berk M, Vorster M. A double-blind, randomized, placebo-controlled trial of augmentation with lamotrigine or placebo in patients concomitantly treated with fluoxetine for resistant major depressive episodes. J Clin Psychiatry 2003; 64: 403–7.
17. Betchel NT, Saadabadi A. Lamotrigine. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2018.
18. Betts T, Yarrow H, Dutton N et al. A study of anticonvulsant medication on ovarian function in a group of women with epilepsy who have only ever taken on anticonvulsant compared with a group of women without epilepsy. Seizure 2003; 12: 323–9.
19. Beynon S, Soares-Weiser K, Woolacott N et al. Pharmacological interventions for the prevention of relapse in bipolar disorder: a systematic review of controlled trials. J Psychopharmacol 2009; 23: 574–91.
20. Binnie CD, van Emde Boas W, Kasteleijn-Nolste-Trenite DG et al. Acute effects of lamotrigine (BW430C) in persons with epilepsy. Epilepsia 1986; 27: 248–54.
21. Biton V, Sackellares JC, Vuong A et al. Double-blind, placebo-controlled study of lamotrigine in primary generalized tonic-clonic seizures. Neurology 2005; 65: 1737–43.
22. Biton V. Pharmacokinetics, toxicology and safety of lamotrigine in epilepsy. Expert Opin Drug Metab Toxicol 2006; 2 (6): 1009–18.
23. Bowden CL, Calabrese JR, Sachs G et al. A placebo-controlled 18-month trial of lamotrigine and lithium maintenance treatment in recently manic or hypomanic patients with bipolar I disorder. Arch Gen Psychiatry 2003; 60: 392–400.
24. Bowden CL, Singh V. Lamotrigine (Lamictal IR) for the treatment of bipolar disorder. Expert Opin. Pharmacother 2012; 13 (17): 2565–71.
25. Bowden CL, Calabrese JR, Sachs G et al. A placebo-controlled
18-month trial of lamotrigine and lithium maintenance treatment in recently manic or hypomanic patients with bipolar I disorder. Arch Gen Psychiatry 2003; 60 (4): 392–400.
26. Bowden CL. Acute and maintenance treatment with mood stabilizers. Int J Neuropsychopharmacol 2003; 6: 269–75.
27. Brodie MJ, Richens A, Yuen AW. Double-blind comparison of lamotrigine and carbamazepine in newly diagnosed epilepsy. Lancet 1995; 345: 476–9.
28. Brodie MJ. Lamotrigine. Lancet 1992; 339: 1397–400.
29. Calabrese JR et al. A double-blind, placebo-controlled study of lamotrigine monotherapy in outpatients with bipolar I depression.
J Clin Psychiat 1999; 60: 79–88.
30. Calabrese JR, Bowden CL, Sachs G et al. A placebo-controlled 18-month trial of lamotrigine and lithium maintenance treatment in recently depressed patients with bipolar I disorder. J Clin Psychiatry 2003; 64: 1013–24.
31. Calabrese JR, Huffman RF, White RL et al. Lamotrigine in the acute treatment of bipolar depression: results of five double-blind, placebo-controlled clinical trials. Bipolar Dis 2008; 10: 323–33.
32. Celebi A, Yalnmzoglu D, Turanli G et al. Lamotrigine in children with refractory epilepsy. Turk J Pediatr 2008; 5054: 26–31.
33. Christensen J, Petrenaite V, Atterman J et al. Oral contraceptives induce lamotrigine metabolism: evidence fr om a double-blind, placebo-controlled trial. Epilepsia 2007; 48 (3): 484–9.
34. Cohen AF, Land GS, Breimer DD et al. Lamotrigine, a new anticonvulsant: pharmacokinetics in normal humans. Clin Pharmacol Ther 1987; 42: 535–41.
35. Coulter DA. Antiepileptic drug cellular mechanisms of action: wh ere does lamotrigine fit in? J Child Neurol 1997; 12 (Suppl. 1): S2–S9.
36. Duchowny M, Pellock JM, Graf WD et al. A placebo-controlled trial of lamotrigine add-on therapy for partial seizures in children. Lamictal Pediatric Partial Seizure Study Group. Neurology 1999; 53 (8): 1724–31.
37. Ebert U, Thong NQ, Oertel R et al. Effects of rifampicin and cimetidine on pharmacokinetics and pharmacodynamics of lamotrigine in healthy subjects. Eur J Clin Pharmacol 2000; 56: 299–304.
38. Ebrahimi HA, Ebrahimi F. The effect of lamotrigine on epilepsy. Iran
J Neurol 2012; 11 (4): 162–3.
39. Eriksson AS, Knutsson E, Nergårdh A. The effect of lamotrigine on epileptiform discharges in young patients with drug-resistant epilepsy. Epilepsia 2001; 42 (2): 230–6.
40. Eriksson AS, Nergårdh A, Hoppu K. The efficacy of lamotrigine in children and adolescents with refractory generalized epilepsy: a randomized, double-blind, crossover study. Epilepsia 1998; 39 (5): 495–501.
41. EURAP Study Group. Seizure control and treatment in pregnancy: observations from the EURAP epilepsy pregnancy registry. Neurology 2006; 66: 354–60.
42. Fountoulakis KN, Vieta E. Treatment of bipolar disorder: a systematic review of available data and clinical perspectives. Int J Neuropsychopharmacol 2008; 11: 999–1029.
43. Frye M et al. Previous episode burden and response to treatment in bipolar I disorder. Am Psychiat Ass Ann Meet 2003; p. 165.
44. Frye MA, Ketter TA, Kimbrell TA et al. A placebo-controlled study of lamotrigine and gabapentin monotherapy in refractory mood disorders. J Clin Psychopharmacol 2000; 20: 607–14.
45. Gamble C, Williamson PR, Chadwick DW, Marson AG. A meta-analysis of individual patient responses to lamotrigine or carbamazepine monotherapy. Neurology 2006; 66 (9): 1310–7.
46. Gamble CL, Williamson PR, Marson AG. Lamotrigine versus carbamazepine monotherapy for epilepsy. Cochrane Database Syst Rev 2006; 1: CD001031.
47. Gilliam F, Vazquez B, Sackellares J et al. An active-control trial of lamotrigine monotherapy for partial seizures. Neurology 1998; 51: 1018–25.
48. Goa K, Ross SR, Chrisp P. Lamotrigine. A review of its pharmacological properties and clinical efficacy in epilepsy. Drugs 1993; 46: 152–76.
49. Goldenberg M. Overview of drugs used for epilepsy and seizures: etiology, diagnosis, and treatment. P T 2010; 35 (7): 392–415.
50. Goldsmith DR, Wagstaff AJ, Ibbotson T, Perry CM. Spotlight on lamotrigine in bipolar disorder. CNS Drugs 2004; 18 (1): 63–7.
51. Goldsmith DR, Wagstaff AJ, Ibbotson T, Perry CM. Lamotrigine: a review of its use in bipolar disorder. Drugs 2003; 63 (19): 2029–50.
52. Goodwin GM, Bowden CL, Calabrese JR et al. A pooled analysis of 2 placebo-controlled 18-month trials of lamotrigine and lithium maintenance in bipolar I disorder. J Clin Psychiatry 2004; 65 (3): 432–41.
53. Greenhill SD, Jones RS. Diverse antiepileptic drugs increase the ratio of background synaptic inhibition to excitation and decrease neuronal excitability in neurones of the rat entorhinal cortex in vitro. Neuroscience 2010; 167 (2): 456–74.
54. Hachad H, Ragueneau-Majlessi I, Levy RH. New antiepileptic drugs: review on drug interactions. Ther Drug Monit 2002; 24: 91–103.
55. Hahn CG, Gyulai L, Baldassano CF et al. The current understanding of lamotrigine as a mood stabilizer. J Clin Psychiatry 2004; 65: 791–804.
56. Hirschfeld R et al. Screening for bipolar disorder in the community.
J Clin Psychiat 2003; 64: 53–9.
57. Holmes GL, Frank LM, Sheth RD et al. Lamotrigine monotherapy for newly diagnosed typical absence seizures in children. Epilepsy Res 2008; 82 (2–3): 124–32.
58. Jacob S, Nair AB. An Updated Overview on Therapeutic Drug Monitoring of Recent Antiepileptic Drugs. Drugs R D 2016; 16 (4): 303–16.
59. Johannessen SI, Tomson T. Pharmacokinetic variability of newer antiepileptic drugs: when is monitoring needed? Clin Pharmacokinet 2006; 45 (11): 1061–75.
60. Jozwiak S, Terczynski A. Open study evaluating lamotrigine efficacy and safety in add-on treatment and consecutive monotherapy in patients with carbamazepine- or valproate-resistant epilepsy. Seizure 2000; 9 (7): 486–92.
61. Kaufman KR, Gerner R. Lamotrigine toxicity secondary to sertraline. Seizure 1998; 7: 163–5.
62. Kayani S, Sirsi D. The safety and tolerability of newer antiepileptic drugs in children and adolescents. J Cent Nerv Syst Dis 2012; 4: 51–63.
63. Ketter TA, Manji HK, Post RM. Potential mechanisms of action of lamotrigine in the treatment of bipolar disorders. J Clin Psychopharmacol 2003; 23 (5): 484–95.
64. Kimbrell T. Neuroimaging of response to lamotrigine and gabapentin. Am Psychiat Ass Meet 1998; p. 149–50.
65. Kotler M, Matar M. Lamotrigine in the treatment of resistant bipolar disorder. Clin Neuropharmacol 1998; 21: 65–7.
66. Kuzniecky R et al. Modulation of cerebral GABA by topiramate, lamotrigine and gabapentin in healthy adults. Neurology 2002; 58: 368–72.
67. Langosch JM. Influence of lamotrigine on synaptic transmission, neuronal excitability and LTP in guinea pig hippocampal slices. Eur Neuropsychopharmacol 1999; 9 (Suppl. 5): S244.
68. Leach JP, Brodie MJ. Lamotrigine: clinical use in antiepileptic drugs. 4th ed. Raven Press, NY, 1995.
69. Leach MJ, Marden CM, Miller AA. Pharmacological studies on lamotrigine, a novel potential antiepileptic drug: II. Neurochemical studies on the mechanism of action. Epilepsia 1986; 27: 490–7.
70. Lee CY, Fu WM, Chen CC et al. Lamotrigine inhibits postsynaptic AMPA receptor and glutamate release in the dentate gyrus. Epilepsia 2008; 49: 888–97.
71. Liu YT, Zhang LL, Huang L, Zeng LN. Lamotrigine monotherapy in children with epilepsy: a systematic review. Article in Chinese. Zhongguo Dang Dai Er Ke Za Zhi 2016; 18 (7): 582–8.
72. Maidment ID. Lamotrigine – an effective mood stabilizer? Ann Pharmacother 1999; 33: 864–7.
73. Malt UF, Fladvad T. Lamotrigine in the treatment of mental disorders. Article in Norwegian. Tidsskr Nor Laegeforen 2001; 121 (12): 1473–7.
74. Martin R. Cognitive effects of topiramate, gabapentin and lamotrigine in healthy young adults. Neurology 1999; 52: 321–7.
75. May TW, Rambeck B, Jurgens U. Influence of oxcarbazepine and methsuximide on lamotrigine concentrations in epileptic patients with and without valproic acid comedication: results of a retrospective study. Ther Drug Monit 1999; 21 (2): 175–81.
76. Meldrium B. Update on the mechanisms of action of antiepileptic drugs. J Epilepsia 1996; 37: 4.
77. Mockenhaupt M. The current understanding of Stevens-Johnson syndrome and toxic epidermal necrolysis. Expert Rev Clin Immunol 2011; 7 (6): 803–13; quiz 814–5.
78. Mullens EL. Clinical experience with lamotrigine monotherapy in adults with newly diagnosed epilepsy. Clin Drug Invest 1998; 16: 125–33.
79. Ng F, Hallam K, Lucas N, Berk M. The role of lamotrigine in the management of bipolar disorder. Neuropsychiatr Dis Treat 2007; 3 (4): 463–74.
80. Nierenberg AA, Ostacher MJ, Calabrese JR et al. Treatment-resistant bipolar depression: a STEP-BD equipoise randomized effectiveness trial of antidepressant augmentation with lamotrigine, inositol, or risperidone. Am J Psychiatry 2006; 163: 210–16.
81. Obrocea G, Dunn R, Frye MA et al. Clinical predictors of response to lamotrigine and gabapentin monotherapy in refractory affective disorders. Biol Psychiatry 2002; 51: 253–60.
82. Pellock JM. Lamotrigine. J Child Neurol 1997; 12: S1.
83. Pennell PB, Hovinga CA. Antiepileptic drug therapy in pregnancy I: gestation-induced effects on AED pharmacokinetics. Int Rev Neurobiol 2008; 83: 227–40.
84. Perucca E. Clinical pharmacokinetics of new-generation antiepileptic drugs at the extremes of age. Clin Pharmacokinet 2006; 45 (4): 351–63.
85. Perucca E. Clinically relevant drug interactions with antiepileptic drugs. Br J Clin Pharmacol 2006; 61: 246–55.
86. Perucca E. Is there a role for therapeutic drug monitoring of new anticonvulsants? Clin Pharmacokinet 2000; 38 (3): 191–204.
87. Phelps P. Lamotrigine Update. Parts 1 and 2. www.psychopharmacologyinstitute.com
88. Poolos NP, Migliore M, Johnston D. Pharmacological upregulation of h-channels reduces the excitability of pyramidal neuron dendrites. Nat Neurosci 2002; 5: 767–74.
89. Poza JJ. Management of epilepsy in the elderly. Neuropsychiatr Dis Treat 2007; 3 (6): 723–8.
90. Reid JG, Gitlin MJ, Altshuler LL. Lamotrigine in psychiatric disorders.
J Clin Psychiatry 2013; 74 (7): 675–84.
91. Sabers A, Buchholt JM, Uldall P et al. Lamotrigine plasma levels reduced by oral contraceptives. Epilepsy Res 2001; 47: 151–4.
92. Sabers A, Gram L. Newer anticonvulsants: comparative review of drug interactions and adverse effects. Drugs 2000; 60 (1): 23–33.
93. Sagud M, Pivac N, Mustapic M et al. The effect of lamotrigine on platelet serotonin concentration in patients with bipolar depression. Psychopharmacology (Berl) 2008; 197 (4): 683–5.
94. Schapel GJ, Beran RG, Vajda FJ et al. Double-blind, placebo controlled, crossover study of lamotrigine in treatment resistant partial seizures. J Neurol Neurosurg Psychiatry 1993; 56 (5): 448–53.
95. Sharma V, Khan M, Corpse C. Role of lamotrigine in the management of treatment-resistant bipolar II depression: a chart review. J Affect Dis 2008; 111 (1): 100–5.
96. Sidhu J, Job S, Singh S et al. The pharmacokinetic and pharmacodynamic consequences of the co-administration of lamotrigine and a combined oral contraceptive in healthy female subjects. Br J Clin Pharmacol 2006; 61: 191–9.
97. Sierra M. Depersonalization: A New Look at a Neglected Syndrome. Cambridge University Press. 1st Ed. 2009. ISBN 978-0521874984.
98. Sondergaard Khinchi M, Nielsen KA et al. Lamotrigine therapeutic thresholds. Seizure 2008; 17 (5): 391–5.
99. Southam E. Lamotrigine inhibits monoamine uptake in vitro and modulates 5-hydroxytryptamine uptake in rats. Eur J Pharmacol 1998; 358: 19–24.
100. Splinter M. Pharmacokinetic properties of new antiepileptic drugs. J Pharm Practice 2005; 18: 444–60.
101. Stahl SM. Stahl’s essential psychopharmacology: neuroscientific basis and practical applications. Cambridge university press, 2013.
102. Stefani A, Spadoni F, Siniscalchi A, Bernardi G. Lamotrigine inhibits Ca2+ currents in cortical neurons: functional implications. Eur
J Pharmacol 1996; 307 (1): 113–6.
103. Steiner TJ, Dellaportas CI, Findley LJ et al. Lamotrigine monotherapy in newly diagnosed untreated epilepsy: A double-blind comparison with phenytoin. Epilepsia 1999; 40: 601–7.
104. Sumegi A. Mood stabilizers – past, present and future. Neuropsychopharmacol Hung 2008; 10: 31–42.
105. Tennis P, John A, Messenheimer R. Preliminary result on frequency of mayor malformation following Lamotrigine monotherapy or polytherapy exposure during pregnancy. Neurology 2002, 58 (Suppl. 3).
106. Vajda FJ, Dodd S, Horgan D. Lamotrigine in epilepsy, pregnancy and psychiatry – a drug for all seasons? J Clin Neurosci 2013; 20 (1): 13–6.
107. Van de Vrie-Hoekstra NW, De Vries TW, Van den Berg PB et al. Antiepileptic drug utilization in children from 1997–2005 – a study from the Netherlands. Eur J Clin Pharmacol 2008; 64: 1013–20.
108. Varghese SP, Haith LR, Patton ML et al. Lamotrigine-induced toxic epidermal necrolysis in three patients treated for bipolar disorder. Pharmacotherapy 2006; 26 (5): 699–704.
109. Vieta E, Gunther O, Locklear J et al. Effectiveness of psychotropic medications in the maintenance phase of bipolar disorder: a meta-analysis of randomized controlled trials. Int J Neuropsychopharmacol 2011; 14 (8): 1029–49.
110. Walden J, Schaerer L, Schloesser S et al. An open longitudinal study of patients with bipolar rapid cycling treated with lithium or lamotrigine for mood stabilization. Bipolar Dis 2000; 2: 336–9.
111. Weisler RH, Calabrese JR, Bowden CL et al. Discovery and development of lamotrigine for bipolar disorder: a story of serendipity, clinical observations, risk taking, and persistence. J Affect Dis 2008; 108 (1–2): 1–9.
112. Yasumoto S, Shimizu M, Sato K et al. Lamotrigine monotherapy for newly diagnosed typical absence seizures in children: a multi-center, uncontrolled, open-label study. Brain Dev 2016; 38 (4): 407–13.
113. Yatham LN. Newer anticonvulsants in the treatment of bipolar disorder. J Clin Psychiatry 2004; 65 (Suppl. 10): 28–35.
114. Yerby MS. Quality of life, epilepsy advances, and the evolving role of anticonvulsants in women with epilepsy. Neurology 2000; 55
(5 Suppl. 1): 21–31.
115. Zheng C, Yang K, Liu Q et al. The anticonvulsive drug lamotrigine blocks neuronal {alpha}4{beta}2 nicotinic acetylcholine receptors. J Pharmacol Exp Ther 2010; 335: 401–8.
116. Zona C, Tancredi V, Longone P et al. Neocortical potassium currents are enhanced by the antiepileptic drug lamotrigine. Epilepsia 2002; 43: 685–90.
10 апреля 2018
Количество просмотров: 8182

