Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03-04 2018
Особенности психофармакотерапии в период беременности и лактации №03-04 2018
Номера страниц в выпуске:34-42
Данный обзор подготовлен по материалам 25-го конгресса Европейской психиатрической ассоциации (апрель 2017 г., Флоренция) участниками проекта «Восточно-Европейская академия Всемирной психиатрической ассоциации и компании "Сервье"» специально для психиатрических журналов зоны 10 ВПА (East European Educational WPA-Servier Academy – EEE WPA-Servier Academy).
Статья посвящена проблеме психофармакотерапии в период беременности и лактации, а также нозологическому и клиническому разнообразию психопатологических проявлений у обоих родителей во время гестации и в первый год жизни ребенка.
Ключевые слова: психофармакотерапия, беременность, лактация.
Для цитирования: Марачев М.П. Особенности психофармакотерапии в период беременности и лактации. Психиатрия и психофармакотерапия. 2018; 20 (3–4): 34–42.
Статья посвящена проблеме психофармакотерапии в период беременности и лактации, а также нозологическому и клиническому разнообразию психопатологических проявлений у обоих родителей во время гестации и в первый год жизни ребенка.
Ключевые слова: психофармакотерапия, беременность, лактация.
Для цитирования: Марачев М.П. Особенности психофармакотерапии в период беременности и лактации. Психиатрия и психофармакотерапия. 2018; 20 (3–4): 34–42.
Данный обзор подготовлен по материалам 25-го конгресса Европейской психиатрической ассоциации (апрель 2017 г., Флоренция) участниками проекта «Восточно-Европейская академия Всемирной психиатрической ассоциации и компании "Сервье"» специально для психиатрических журналов зоны 10 ВПА (East European Educational WPA-Servier Academy – EEE WPA-Servier Academy).
Статья посвящена проблеме психофармакотерапии в период беременности и лактации, а также нозологическому и клиническому разнообразию психопатологических проявлений у обоих родителей во время гестации и в первый год жизни ребенка.
Ключевые слова: психофармакотерапия, беременность, лактация.
Для цитирования: Марачев М.П. Особенности психофармакотерапии в период беременности и лактации. Психиатрия и психофармакотерапия. 2018; 20 (3–4): 34–42.
V.P.Serbsky Federal Medical Research Center of Psychiatry and Narcology of the Ministry of Health of the Russian Federation. 119991, Russian Federation, Moscow, Kropotkinskii per., d. 23marachevm@gmail.com
The article is devoted to the problem of psychopharmacotherapy during pregnancy and lactation, as well as nosological and clinical diversity of psychopathological manifestations in both parents during the gestation period and the first year of the child's life.
Key words: psychopharmacotherapy, pregnancy, lactation.
For citation: Marachev M.P. Features of psychopharmacotherapy during pregnancy and lactation. Psychiatry and Psychopharmacotherapy. 2018; 20 (3–4): 34–42.
Вопросы перинатальной психопатологии вызывают устойчивый интерес среди врачей-психиатров, о чем свидетельствует большое число слушателей симпозиумов и воркшопов, посвященных этой тематике, на европейских психиатрических конгрессах (EPA, ECNP) последних лет. Серия из двух обзорных статей будет посвящена психофармакотерапии в период беременности и лактации, а также нозологическому и клиническому разнообразию психопатологических проявлений у обоих родителей во время гестации и первый год жизни ребенка.
Первым описаниям расстройств, связанных с беременностью, более 2 тыс. лет. В 400 г. до н.э. Гиппократ описал случай «послеродового делирия» с тяжелой бессонницей и беспокойством, развившийся у женщины в течение недели после рождения близнецов [1, 2]. Швейцарский врач F.Plater (XVI в.) описывал бред и гневливость в послеродовом периоде. А в работах немецкого акушера F.Osiander (XVIII в.) встречается подробное описание послеродовой мании с быстрым началом и нарастанием симптоматики в виде дезорганизованности речи, сильного волнения, возбуждения, а также ненормального содержания мыслей по поводу материнства (например, «ребенок все еще в матке», «ребенок – Иисус Христос», «ребенок может летать») [3]. Донозологические гипотезы патогенеза перинатальных расстройств отличались своеобразием. Так, например, итальянский врач T.Ruggier (XI в.) допускал наличие связи между маткой и меланхолией: «Если матка слишком влажная, то мозг заполняется водой и влага подходит к глазам, приводя к невольному плачу» [4]. Французский гинеколог L.Berger (XVIII в.) полагал, что такие симптомы, как головная боль или ступор, в послеродовой период развивались вследствие раздражающего воздействия грудного молока на мозг роженицы. C подавлением или невозможностью лактации связывал развитие психических расстройств и J.Esquirol (XVIII в.) [5].
Первые попытки классифицировать перинатальную психопатологию были сделаны на рубеже XIX и XX вв. Все расстройства были разделены на 3 группы:
1) связанные с беременностью;
2) послеродовые (первые 6 нед после родов);
3) лактационные (начиная с 7-й недели после родов) [6].
Термин «послеродовой психоз» был включен в DSM-II (1968 г.) как диагноз исключения [7]. Однако из DSM-IV-TR нозология была исключена как самостоятельная категория [8]. В современном медицинском сообществе существуют разногласия относительно того, является ли послеродовой психоз независимым психическим расстройством или роды провоцируют психотические эпизоды у женщин, имеющих предрасположенность. Так, D.Sit и соавт. (2006 г.) предположили, что послеродовой психоз является фактически биполярным аффективным расстройством (БАР), вызванным резким изменением уровня гормонов в послеродовом периоде, что соответствует ранее полученным данным, согласно которым 72–88% женщин с психотическими расстройствами после родов имеют биполярное или шизоаффективное расстройство и только 12% – шизофрению [9–11].
Проблемы перинатальной психопатологии можно условно разделить на две основных составляющие. Это, с одной стороны, наличие психических расстройств, чаще хронических (например, БАР, шизофрения, униполярная депрессия и др.), у женщин детородного возраста, планирующих беременность или беременных. С другой – это манифестация психических расстройств или обострение хронических заболеваний в последние 2 нед беременности или после родов. К настоящему моменту нет согласованного мнения исследователей относительно продолжительности послеродового периода оценки состояния, в литературе можно встретить временной интервал в 4 нед, 3 мес (используется чаще всего) и 12 мес [12].
Одной из самых трудных клинических задач является подбор медикаментозной терапии для коррекции сопутствующей психической патологии в период беременности и лактации. Именно этой проблематике был посвящен воркшоп под названием «Медикаментозная коррекция аффективных расстройств и психозов у беременных и кормящих» на минувшем конгрессе Европейской психиатрической ассоциации во Флоренции. Мероприятие проведено под председательством специалиста в области перинатальной психиатрии доктором A.Wieck (отдел клинической психологии Университета Манчестера, Великобритания). В лекции последовательно раскрывались вопросы эпидемиологии основных психических расстройств во время беременности и после родов, безопасность применения психотропных лекарственных средств и принципы терапии основными группами медикаментов (стабилизаторы настроения, антипсихотики, антидепрессанты, гипнотики) во время гестации и лактации.
По данным Всемирной организации здравоохранения, одна из трех женщин в развивающихся странах и одна из десяти в развитых имеют проблемы с психическим здоровьем во время беременности или послеродовом периоде [13]. Наиболее распространенной патологией являются тревожные и депрессивные расстройства как в гестационный период (13 и 12% соответственно), так и после родов (15 и 20%). Среди тревожных расстройств чаще встречаются: паническое, генерализованное тревожное расстройство, обсессивно-компульсивное и посттравматическое расстройства, а также токофобия (патологическая боязнь родов). Распространенность депрессии колеблется в пределах от 3 до 5%. Известно, что психотические эпизоды, особенно в структуре БАР I типа, имеют большую вероятность рецидивирования или манифестации в перинатальный период, чем психозы в рамках шизофрении [14, 15]. В среднем распространенность психозов составляет 1–2 случая на 1 тыс., при этом около 1/2 всех случаев приходится на женщин без психопатологического анамнеза [16].
Доктор A.Wieck привела эпидемиологические данные, согласно которым в период с 2006 по 2008 г. на 100 тыс. родов в Великобритании приходилось 1,27 материнских смертей, связанных с психическими расстройствами, что объясняется недостаточным выявлением и отсутствием адекватной терапии [15]. Другой значимой проблемой является отсутствие контроля со стороны специализированных медицинский служб – только 0,6% пациентов в послеродовом периоде наблюдаются у психиатра, а направление к нему не превышает 2% [14, 15].
Особое внимание было уделено эпидемиологии БАР как одного из наиболее труднокурабельных расстройств в перинатальном периоде. Сложности ведения беременных женщин с БАР объясняются повышенным риском развития аномалий плода на фоне приема нормотимиков и высокими показателями рецидивирования при отмене терапии. В исследовании A.Viguera и соавт. (2000 г.) показатели рецидивирования в течение первых 40 нед после отмены приема лития были сопоставимы у беременных и в контрольной группе (52 и 58% соответственно), более чем в 2 раза превышая этот показатель у женщин, находящихся на поддерживающем лечении (21%). Среди испытуемых, остававшихся в стабильном состоянии в течение 40 нед после отмены лития, послеродовое рецидивирование было в 3 раза более частым, чем у небеременных в течение последующих 41–64 нед. Также было показано, что предикторами обострений состояния являлись: быстрая отмена лития и наличие аффективных эпизодов в анамнезе [17].
В свете проблемы регоспитализаций приведены данные, согласно которым на период с 10 по 19-й день после родов приходится наибольшая вероятность развития психических расстройств и регоспитализаций, причем наличие в анамнезе диагноза БАР является сильным предиктором риска повторных госпитализаций в этот период. Наименьший риск регоспитализаций приходится на период беременности, а по прошествии одного и более месяцев после родов он сравним с таковым у небеременных женщин [18, 19].
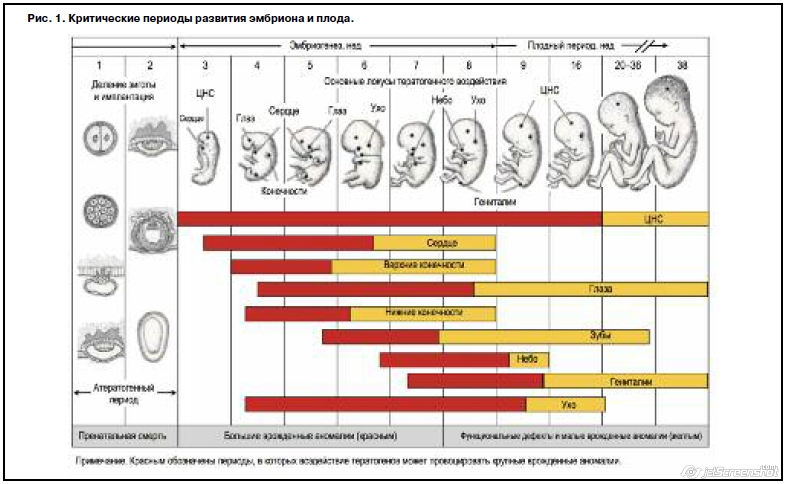
Одним из принципиальных вопросов при назначении медикаментозной терапии в период беременности является оценка потенциального риска ее влияния на развитие плода, в связи с чем важным считается понимание фармакокинетики и фармакодинамики лекарственных средств, а также этапы физиологического развития беременности. Лектором выдвинуты тезисы о том, что все психотропные средства проникают через плацентарный барьер, а степень влияния на плод зависит прежде всего от гестационных сроков. Так, при влиянии на плод неблагоприятных факторов (в том числе нерациональной психофармакотерапии) на ранних сроках беременности (до 12 нед) есть вероятность развития тяжелых структурных аномалий – эмбриопатий (рис. 1).
В срок с 12 нед до момента рождения происходят активная дифференциация органов и тканей, быстрый рост плода. Вредности, оказывающие влияние на плод в этом периоде, приводят к развитию малых структурных и функциональных дефектов в органах, формирование которых не завершено (головной мозг, гениталии, зубы, легкие), а также повышает риск преждевременных родов. В долгосрочной перспективе влияние психотропных препаратов на плод может привести к нарушению нейроразвития и повышенной восприимчивости ребенка к хроническим заболеваниям.
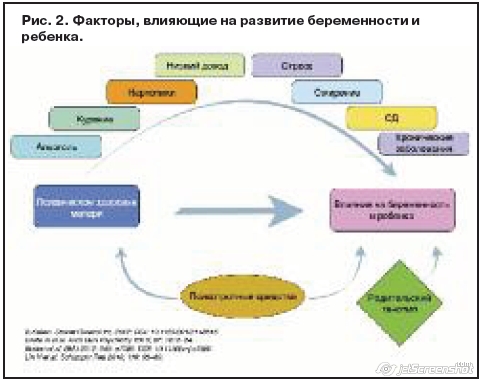
Исследователи, изучая потенциальный вред лекарственных препаратов для ребенка, сталкиваются с рядом трудностей. Во-первых, проведение рандомизированных контролируемых двойных слепых исследований неэтично, а следующим уровнем доказательности являются результаты популяционных и когортных исследований, полученные в ходе учета беременных, а также исследований «случай–контроль». Во-вторых, к размеру выборки, необходимой для проверки врожденных аномалий, предъявляются особые требования. Например, если аномалии встречаются в 0,1% случаев в общей популяции (например, волчья пасть), то для проверки удвоенного риска необходимо почти 11 тыс. случаев [20]. Третья проблема, с которой сталкиваются исследователи, – это разнообразие искажающих факторов, которые сами по себе могут влиять на развитие отклонений от нормы (например, возраст, курение, употребление алкоголя и психоактивных веществ, индекс массы тела, социально-экономическая, расовая/этническая принадлежность, сопутствующие хронические заболевания и лечение препаратами других групп (рис. 2) [21–24].
Существование искажающих факторов и отсутствие последовательного подхода к их анализу вносят неопределенность в результаты исследования. На качество доказательств также оказывают влияние диагностические погрешности, дефицит информации о развитии пороков у детей, чьи матери имели нелеченые психические расстройства, что препятствует сравнению между исследованиями.
Однако, несмотря на имеющиеся трудности, в настоящее время получены ответы на ряд вопросов, касающихся риска развития врожденных аномалий при терапии большинством психотропных средств.
 В своем выступлении A.Wieck подробно осветила вопросы курации перинатальных психических расстройств, выделив три ключевых аспекта, на которые должны быть направлены усилия группы специалистов, занимающихся ведением беременности у женщин с психическими расстройствами:
В своем выступлении A.Wieck подробно осветила вопросы курации перинатальных психических расстройств, выделив три ключевых аспекта, на которые должны быть направлены усилия группы специалистов, занимающихся ведением беременности у женщин с психическими расстройствами:
1) поддержание стабильности психического состояния на протяжении беременности;
2) безопасность ребенка;
3) предотвращение рецидивов в послеродовом периоде.
В рамках реализации перечисленных аспектов ключевым моментом является раннее направление к психиатру (желательно его включение в мультидисциплинарную бригаду на этапе планирования беременности) и осуществление психиатрического сопровождения на протяжении всей беременности и послеродового периода. К обязанностям врача-психиатра помимо диагностики и подбора/коррекции психофармакотерапии относятся: оценка факторов риска послеродовых рецидивов, профилактика риска аномалий развития у плода (например, назначение фолиевой кислоты), психообразование, проведение интервенций, направленных на снижение уровня постнатального стресса, оптимизацию цикла сон–бодрствование, тесное сотрудничество с другими специалистами, участвующими в оказании помощи. Назначая медикаментозное лечение, врач-психиатр должен избегать полипрагмазии, придерживаться принципа абсолютной информированности пациента, а также воздерживаться от назначения препаратов, не имеющих достаточно данных по безопасности или обладающих тератогенным действием.
Раскрывать тему влияния антипсихотиков на терапию беременных профессор А.Wieck начала с общепринятого заблуждения, что типичные антипсихотики (ТА) более безопасны в применении, чем атипичные (АА), в связи с большей изученностью. По данным T.Barnes (2011 г.), среди ТА только флуфеназин и галоперидол упоминаются в литературе больше 200 раз, тогда как остальные препараты этой группы – меньше 100. Лидерами среди АА по количеству упоминаний в научной литературе являются оланзапин (∼200), рисперидон и арипипразол (более 100), менее 100 исследований посвящено кветиапину и клозапину [25–27].
Несмотря на распространенное мнение о большей безопасности ТА, научные данные свидетельствуют о возрастающем использовании АА в купировании различных психопатологических состояний в перинатальном периоде. Так, за период с 2001 по 2007 г. АА назначались в среднем в 2,5 раза чаще, чем ТА, при этом частота использования АА при аффективных расстройствах (депрессия – 63%, БАР – 43%) значительно превышала таковую при шизофрении (13%) [28].
Широкое применение антипсихотических препаратов в период гестации не позволяет в полной мере оценить их репродуктивную безопасность. В метаанализе C.Coughlin и соавт. (2015 г.) выявлена существенная взаимосвязь между применением антипсихотиков и развитием множественных акушерских и неонатальных нежелательных явлений (пороки сердца, преждевременные роды, недоношенность, рекомендуемое прерывание беременности, низкая масса тела) вне зависимости от фармакологической группы (ТА или АА). Авторы признают сложности в интерпретации полученных результатов, ссылаясь на малую выборку включенных исследований и невозможность оценки влияния дополнительных факторов (таких как курение, злоупотребление психоактивными веществами, ожирение, сахарный диабет – СД, социально-экономический статус, медикаментозная терапия сопутствующей патологии) [29]. Исследовательской группой из Дании M.Sørensen и соавт. (2015 г.) было показано, что женщины, принимающие антипсихотики до/во время беременности, имеют высокий риск (34%) спонтанного аборта, а те, что принимали антипсихотики только во время родов, в 2 раза больший риск мертворождений [30]. Однако и это исследование имело свои ограничения. В изучаемой выборке были женщины с ожирением и/или гестационным СД (ГСД), что само по себе может увеличивать вероятность невынашивания, внутриутробных аномалий и других осложнений беременности и родов [31, 32]. С другой стороны, само применение антипсихотиков в 2 раза увеличивает вероятность развития ГСД [33, 34].
Относительно влияния антипсихотиков на здоровье новорожденных F.Habermann и соавт. (2013 г.) установлено, что их применение на поздних сроках беременности приводит к развитию послеродовых расстройств у новорожденного (респираторных, кардиологических, желудочно-кишечного тракта, центральной нервной системы – ЦНС, мультисистемных), как в случае с АА (15,6%), так и ТА (21,6%). При этом для беременных, применяющих ТА, были выявлены положительные корреляции с повышенным риском преждевременных родов и низкой массой тела новорожденного, а в отношении АА – с возникновением крупных пороков развития. Не было выявлено влияния терапии нейролептиками на риск спонтанных абортов, показатели мертворождения и неонатальной смертности [35]. Представляют интерес данные о влиянии приема антипсихотиков в период беременности на нейроразвитие. Результаты исследований новорожденных, матери которых принимали антипсихотики, свидетельствуют о задержке нейроразвития, определяемой низкими результатами по когнитивным, моторным, социально-эмоциональным и адаптационно-поведенческим показателям (шкала Bayley Scales of Infant and Toddler Development, third edition – BSID-III) в первые месяцы после рождения. Вместе с тем все выявленные нарушения нивелировались к первому году жизни ребенка [36–39].
Отдельной проблемой является ГСД, вероятность развития которого на фоне применения антипсихотиков увеличивается в 2 раза. Такое увеличение может быть объяснено не только прямым действием лекарств, но и повышенным индексом массы тела на ранних сроках беременности, а также рядом других причин, которые необходимо учитывать при подборе антипсихотика (наследственность, этническая принадлежность, наличие макросомии и ГСД при предыдущих беременностях) [40].
Таким образом, имеющиеся доказательства не подтверждают гипотезу о существенном тератогенном потенциале антипсихотических препаратов, а увеличение риска развития крупных пороков развития (наиболее частые сердечно-сосудистые дефекты), мертворождения, ассоциации с увеличением риска преждевременных родов и рождения младенцев, маленьких для своего гестационного возраста, объясняется исследователями влиянием дополнительных факторов и/или их сочетанием. Данных относительно каких-либо дефектов развития нервной системы в исследованиях не получено.
В продолжение доклада А.Wieck остановилась на противоэпилептических препаратах, используемых для лечения БАР. Опыт их применения у беременных связан в первую очередь с эпилепсией. Согласно имеющимся данным большинство детей, рожденных от матерей с эпилепсией, которые принимают поддерживающую терапию, не имеют существенной патологии. Вместе с тем известно, что именно эта фармакологическая группа лекарственных средств обладает наибольшим тератогенным потенциалом и риском развития поведенческих нарушений. Согласно ведущей гипотезе тератогенности в процессе метаболизма нормотимиков образуются свободные радикалы, которые приводят к окислительному макромолекулярному повреждению [41]. Частота врожденных пороков развития при использовании нормотимиков колеблется в пределах от 4,5 до 8,6% (моно-/политерапия соответственно) [42].
Наиболее распространенной патологией являются пороки развития сердца (например, дефект межжелудочковой перегородки), ротолицевые дефекты (например, расщелина губ и/или неба), урологические пороки развития (например, гипосподия), аномалии скелета (например, аномальное строение костей верхних конечностей, гипоплазия фаланг пальцев), дефекты нервной трубки (например, spina bifida). Причиной поведенческих нарушений считается вызванный приемом нормотимиков апоптоз нервных клеток. В исследовании на грызунах было показано, что применение клоназепама, диазепама, фенобарбитала, фенитоина, вигабатрина и вальпроевой кислоты приводило к распространенному апоптозу нейронов у новорожденных крыс. Эффект зависел от дозы, наблюдался при терапевтически значимых уровнях препаратов в плазме, относительно кратковременном применении и мог усиливаться за счет синергического действия нескольких препаратов. Подобные апоптотические эффекты не наблюдались при монотерапии в терапевтических дозировках для карбамазепина, леветирацетама, ламотриджина или топирамата. Кроме того, воздействие вальпроатов и вигабатрина может приводить к гиппокампальной и кортикальной дисплазии, вторичной по отношению к нарушенной миграции и гибели нейронов [43].
Монотерапия карбамазепином ассоциирована с возникновением крупного врожденного порока – spina bifida и более высоким риском возникновения таких пороков сердца, как единственный желудочек и дефект атриовентрикулярной перегородки, но эти риски значительно ниже в сравнении с вальпроатами [44]. Для последних характерно значительное увеличение рисков возникновения spina bifida (отношение шансов – ОШ 12,7; 95% доверительный интервал – ДИ от 7,7 до 20,7), дефекта межпредсердной перегородки, расщелины неба, гипоспадии, полидактилии и краниосиностоза [45]. Ламотриджин в сравнении с вальпроатами обладает низкой тератогенностью. Риск всех пороков развития при монотерапии ламотриджином составил от 2,0 до 5,6% по сравнению с базовыми показателями (1,1–3,6%) для детей, чьи матери не получали ламотриджин во время беременности [46]. В исследовании L.Holmes и соавт. (2008 г.) получены следующие результаты: дети, подвергавшиеся в I триместре воздействию ламотриджина, имеют повышенный риск возникновения пороков развития челюстно-лицевой области (7,3/1000): изолированной расщелины неба или хейлосхизиса [47]. Однако эти данные не подтверждаются другими исследованиями, в которых не было обнаружено высокого риска развития челюстно-лицевых аномалиий в сравнении с другими пороками на монотерапии ламотриджином [46, 48, 49].
Помимо врожденных пороков внутриутробного развития лечение нормотимиками в период гестации может приводить к нарушениям когнитивного развития у потомства на ранних этапах жизни, а также повышать риск других серьезных нейропсихиатрических расстройств [50–53]. R.Bromley и соавт. (2013 г.) обнаружили увеличение риска возникновения расстройств нервно-психического развития у детей, матери которых подвергались монотерапии вальпроатом натрия (12,0%, p=0,007), наиболее частым диагнозом было расстройство аутистического спектра [54], абсолютный риск развития которого – 4,42% [55]. Важнейшим фактором, определяющим связь с аутистическими симптомами, является используемая доза вальпроата натрия [56, 57].
Данные относительно приема солей лития неоднозначны. В исследовании M.Weinstein (1980 г.) было показано, что у 8% детей, которые подвергались внутриутробному воздействию лития, фиксировались сердечно-сосудистые аномалии в сравнении с 1% в общей популяции, а 2,7% детей имели аномалию Эбштейна при распространенности в общей популяции 1 на 20 тыс. [58]. Недавнее исследование O.Diav-Citrin и соавт. (2014 г.) показало, что риск развития сердечно-сосудистых аномалий у детей, подвергавшихся воздействию лития в I триместре, составляет 4,1% против 0,6% в контрольной группе. Частота преждевременных родов была выше в группе лития по сравнению с группой контроля (13,7 и 6,0% соответственно) [59]. С другой стороны, в работах A.Ornoy и соавт. (2008 г.) и R.McKnight и соавт. (2012 г.) показано, что накоплено недостаточное количество данных о безопасности применения лития у беременных, а наблюдения, которые ранее расценивались как существенные, являлись переоцененными [60, 61]. А в исследовании M.Schou (1987 г.) опровергается гипотеза повышенного риска развития нейроповеденческих нарушений у детей, чьи матери во время беременности принимали препараты лития [62]. В литературе встречаются единичные сообщения о наличии патологий у плода и новорожденного, таких как аритмия, гипогликемия, несахарный диабет, дисфункция щитовидной железы, зоб, вялость, заторможенность, аномалии развития печени и респираторные нарушения, а также упоминания о материнской и неонатальной токсичности в связи с приемом препаратов лития [63].
Особое внимание лектором было уделено вопросу применения фолиевой кислоты (фолатов) с акцентом на неоднозначности протективной роли этих веществ у женщин, принимающих нормотимики, в период беременности. Известно, что небольшие дозы фолиевой кислоты (0,4 мг в день) предотвращают врожденные аномалии развития в общей популяции, в частности дефекты нервной трубки, а высокие дозировки до 5 мг в день используются для семей с повышенным риском. Сроки профилактического приема разнятся, так, в Великобритании рекомендован прием фолатов за 3 мес до и 3 мес после наступления беременности. Согласно рекомендациям NICE (National Institute of Health and Care Excellence 2004, 2007, 2014) женщинам, находящимся на терапии противоэпилептическими препаратами, следует принимать 5 мг фолиевой кислоты в сутки в период, предшествующий зачатию. Однако в серии исследований последних лет не было выявлено существенного протективного действия фолатов, что ставит под сомнение целесообразность их использования в качестве средства профилактики развития внутриутробных пороков развития [64–66].
В соответствии с приведенными выше данными многими медицинскими организациями разработаны собственные рекомендации по ведению беременности женщин с эпилепсией, БАР и мигренью на фоне приема противоэпилептических препаратов. Согласно официальным рекомендациям Европейского медицинского агентства вальпроаты не следует использовать для лечения эпилепсии, биполярного расстройства и мигрени у женщин, которые беременны или могут забеременеть, за исключением случаев, когда другое лечение неэффективно или плохо переносится. Если препараты вальпроевой кислоты являются единственно возможным вариантом лечения, женщины должны использовать надежные методы контрацепции [67]. Рекомендации NICE (2014 г.) более категоричны и полностью исключают использование вальпроатов у женщин детородного возраста для лечения аффективных расстройств, даже при условии применения надежных методов контрацепции. Таким образом, целесообразным считается избегать назначения вальпроатов и карбамазепина в период беременности, тогда как для оценки безопасности ламотриджина имеющихся данных недостаточно.
Применение лития в I триместре оправдано в случае неэффективности антипсихотической терапии и высокого риска рецидивирования при переходе на более безопасный препарат. В отсутствие данных трудностей целесообразна замена лития на антипсихотические препараты на сроки до начала II триместра или вплоть до родов. Рекомендуется измерение концентрации препарата в плазме с частотой: 1 раз в месяц до 36-й недели беременности, 1 раз в неделю в месяц предполагаемой даты родов с последующей коррекцией дозы лития (NICE, 2014) [68]. Имеются интра- и постнатальные особенности приема. На момент начала родов необходимо отменить препарат и мониторировать показатели лития и водно-электролитного баланса во время родов. В постнатальном периоде, если уровень лития находится в пределах терапевтических рамок, возможно продолжение терапии дозами, принимаемыми до беременности. Контроль содержания лекарства следует проводить после 1-й недели приема с последующей коррекцией в случае необходимости.
Затрагивая тему использования антидепрессантов, доктор А.Wieck привела эпидемиологические данные, согласно которым от 2,8 до 10,2% женщин используют антидепрессанты в период беременности. В исследовании распространенности назначений антидепрессантов группы селективных ингибиторов обратного захвата серотонина (СИОЗС) в странах Европы лидером по этому показателю стала Великобритания [69].
Применение антидепрессантов в I триместре ассоциировано с повышением риска развития пороков сердечно-сосудистой системы у плода. Среди представителей трициклических антидепрессантов (ТЦА) только для кломипрамина есть достоверные данные об ассоциации с небольшим увеличением сердечно-сосудистых дефектов на фоне общего дефицита информации и ее противоречивости для остальных представителей данной группы. Исследований по безопасности применения антидепрессантов из группы СИОЗС значительно больше. В метанализе S.Grigoriadis и соавт. (2013 г.) подтверждается связь приема СИОЗС с незначительным увеличением сердечно-сосудистых мальформаций (абсолютный риск – 1,36) [70]. С другой стороны, в более поздних исследованиях K.Huybrechts и соавт. (2014 г.), K.Furu и соавт. (2015 г.) с учетом вклада в риск сопутствующих факторов не было обнаружено существенного увеличения распространенности врожденных сердечно-сосудистых аномалий у младенцев, которые подвергались воздействию исследуемых лекарственных препаратов в утробе матери [71, 72]. Данные о развитии других пороков менее согласованы для всех представителей антидепрессантов. Различия между препаратами СИОЗС не имеют прочной доказательной основы из-за обилия противоречивых данных. Имеется лишь ограниченное число свидетельств, что пароксетин отличается большим риском развития врожденных аномалий [70].
В отношении безопасности других групп антидепрессантов в I триместре беременности имеется незначительное количество сведений. Так, например, в работах C.Bellantuono и соавт. (2015 г.) и D.Lassen и соавт. (2016 г.) показано, что прием венлафаксина в период гестации относительно безопасен, особенно в отношении крупных пороков развития [73, 74]. В связи с фактическим отсутствием убедительных данных относительно безопасности использования миртазапина, тразодона и дулоксетина доктор А.Wieck предостерегла от их назначения беременным и кормящим для купирования симптомов депрессии.
Использование антидепрессантов во II и III триместрах может приводить к повышению риска преждевременных родов (ОШ 1,53) [75]. В то же время депрессия у матери во время беременности сама по себе связана с увеличением вероятности преждевременных родов (ОШ 1,37) [76].
Прием антидепрессантов также влияет на здоровье ребенка в неонатальном периоде. Воздействие СИОЗС на поздних сроках ассоциировано с развитием персистирующей легочной гипертензии новорожденного – ПЛГН (2,9–3,5 на 1 тыс. детей) [77]. В исследовании K.Huybrechts и соавт. (2015 г.) на большой выборке пациентов показано, что у 322 детей, чьи матери принимали СИОЗС на поздних сроках беременности, развилась ПЛГН (28,3–35,2 на 10 тыс. родов) в сравнении с 7630 детьми, не испытывавшими внутриутробного влияния антидепрессантов (20,4–21,3 на 10 тыс. родов), что подтверждает повышение риска ПЛГН при приеме препаратов СИОЗС во второй половине беременности [78]. Помимо всего прочего все антидепрессанты способны нарушать неонатальную адаптацию (ОШ 5,07), чаще в виде неонатального респираторного дистресса, тремора и гипогликемии (19%) [79]. Симптомы дезадаптации возникают у каждого третьего ребенка, однако отличаются умеренной выраженностью, транзиторностью и не требуют дополнительных медицинских вмешательств [78].
Проблема риска аутистических расстройств у детей, чьи матери принимают антидепрессанты во время беременности, широко обсуждается в научных кругах. Из анализа тематических исследований следует, что риск развития подобных расстройств повышен (абсолютный риск от 1,1 и 1,8) [80, 81]. Однако достоверность связи между внутриутробным воздействием СИОЗС и развитием расстройств аутистического спектра сомнительна по причине невозможности учета вклада других сопутствующих факторов [82, 83]. Применение ТЦА, СИOЗС и венлафаксина не оказывает влияния на развитие нейроповеденческих нарушений в раннем детском возрасте [84, 85]. В исследовании M.Handal и соавт. (2015 г.) отмечена слабая связь воздействия СИОЗС с задержкой двигательного развития (нарушением мелкой моторики) в возрасте 3 лет, но данные не имели клинической значимости [86].
Таким образом, при выборе антидепрессантов из ряда ТЦА, СИОЗС, селективных ингибиторов обратного захвата серотонина и норадреналина для лечения психопатологии у беременных женщин следует учитывать сроки беременности, опыт предыдущей терапии (эффективность и переносимость), информацию по профилю безопасности используемых препаратов. Психотерапия – 1-я линия коррекции нарушений при тревожных и депрессивных расстройствах у беременных, и только в случае предпочтения медикаментозного лечения самой пациенткой или неэффективности психотерапии рассматривается возможность назначения лекарственных препаратов.
Применение бензодиазепинов в I триместре беременности не приводит к формированию крупных пороков развития плода [87, 88]. Вместе с тем, по замечанию лектора, использовать бензодиазепины в период зачатия, во время беременности и после родов необходимо строго по показаниям (тревога, возбуждение) и короткими курсами.
Исследования показывают, что использование гипнотиков (Z-препараты) в перинатальный период не приводит к появлению выраженных врожденных аномалий [88, 89]. Изучение одного из препаратов этой группы (золпидем) позволило сделать вывод о его относительной безопасности. В исследовании L.Wang и соавт. (2010 г.) показано, что прием золпидема во время беременности незначительно увеличивает риск преждевременных родов – 1,49 (95% ДИ 1,28–1,74), рождения ребенка с низкой массой тела – 1,39 (95% ДИ 1,17–1,64), гипотрофии плода (низкая масса для данного гестационного возраста) – 1,34 (95% ДИ 1,20–1,49) и кесарева сечения – 1,74 (95% ДИ 1,59–1,90) [90]. В отношении других препаратов, часто применяемых в купировании симптомов инсомнии (например, тразодон, промазин и т.д.), нет достаточной информации по безопасности, поэтому их применение у беременных не рекомендуется.
Согласно рекомендациям Всемирной организации здравоохранения первые 6 мес после рождения дети должны находиться исключительно на грудном вскармливании. По истечении этого срока для удовлетворения пищевых потребностей младенцам необходимо получать адекватное и безопасное питание пищевыми добавками параллельно с продолжением грудного вскармливания в течение 2 лет и более [91].
Принимая во внимание рекомендации по грудному вскармливанию, актуальным является вопрос о применении психофармакотерапии в период лактации. Для оценки степени влияния препаратов на ребенка используется показатель «относительная младенческая доза» – ОМД (англ. Relative Infant Dose) – это доза, получаемая через грудное молоко ребенком относительно материнской дозы, выражаемая в процентах. ОМД<10% считается «относительно безопасной». Большинство психотропных препаратов имеют показатель ниже 10%, за редким исключением. Так, для ламотриджина и лития этот показатель составляет 9,2–18,3 и 12–30,1% соответственно, основываясь на этих данных, предпочтительно в период лактации использовать препараты вальпроевой кислоты и карбамазепина [92–95].
При назначении ТЦА, СИОЗС или селективных ингибиторов обратного захвата серотонина и норадреналина в период лактации учитывают преимущества грудного вскармливания для женщины и ребенка, оценивают риски, связанные с изменениями ранее эффективного лечения или его отменой. СИОЗС считаются одними из самых изученных препаратов в отношении применения в период лактации. В частности, сертралин, пароксетин и флувоксамин являются препаратами выбора для лечения депрессии у кормящих женщин, так как в меньшей степени выделяются с грудным молоком и практически не вызывают нежелательных явлений у ребенка. Учитывая ОМД, длительный период полувыведения и сообщаемые побочные эффекты у младенцев, использование циталопрама, эсциталопрама и флуоксетина противопоказано во время грудного вскармливания [96].
ТЦА имеют менее благоприятный профиль нежелательных явлений и гораздо более высокий риск смертности при передозировке. Тем не менее их применение относительно безопасно, так как большинство ТЦА имеют низкую секрецию в грудное молоко. ОМД для различных представителей ТЦА находится в пределах 10%: амитриптилин – 1,5%, кломипрамин – 2,8%, дотипин – 4,4%, доксепин – 1,2%, имипрамин – 0,15% и нортриптилин – 1,5%. В большинстве случаев не было обнаружено никаких неблагоприятных эффектов при их воздействии.
Относительно безопасности применения гипнотиков и анксиолитиков в период лактации данных мало, только 16 (57%) из 28 препаратов в настоящий момент изучены. При назначении бензодиазепинов необходимо принимать во внимание разницу в метаболизме бензодиазепинов у новорожденных и взрослых: у первых метаболизм значительнее медленнее, что в итоге ведет к кумуляции препаратов с длительным периодом полувыведения, как следствие – развитию седации и тошноты. С учетом этого следует отдавать предпочтение препаратам с коротким периодом полувыведения и проводить постоянный мониторинг состояния младенца, а при появлении токсических эффектов сразу прекратить грудное вскармливание [97].
Антипсихотики – это класс с наименьшим количеством исследований (изучены 11 из 22 препаратов), касающихся использования во время грудного вскармливания. Хлорпромазин и оланзапин принято считать препаратами первого выбора для лечения психотических расстройств в период лактации, также допустимо использование галоперидола и кветиапина. Нежелательными для применения признаны клозапин и сульпирид. Все антипсихотические препараты имеют относительно длительные периоды полувыведения, поэтому следует наблюдать за развитием летаргии и седации у младенцев.
Если возникает необходимость в назначении психотропных препаратов, то необходимо предоставить полную информацию обоим родителям о последствиях воздействия препаратов на здоровье новорожденных [98]. Педиатр также должен быть осведомлен о потенциальных побочных эффектах воздействия медикаментов и взаимодействиях с другими препаратами, проводить клинический мониторинг состояния младенца (поведение ребенка, сон, питание).
Резюмируя свой доклад, доктор A.Wieck обратила внимание аудитории на необходимость индивидуальной оценки параметров риск/польза при выборе психофармакологического сопровождения в период зачатия, во время беременности и грудного вскармливания; отметила важность междисциплинарного подхода при ведении беременности, осложненной хроническим психическим расстройством, подчеркнула необходимость тесного взаимодействия как с будущей матерью, так и ее близкими. A.Wieck подчеркнула, что проявления психической патологии могут существенно в большей степени нарушать процессы физиологического развития плода и негативно сказываться на состоянии здоровья матери, чем возможные неблагоприятные эффекты от использования психофармакотерапии в период беременности.
Сведения об авторе
Марачев Максим Павлович – канд. мед. наук, ст. науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ «ФМИЦПН им. В.П.Сербского».
Е-mail: marachevm@gmail.com
Статья посвящена проблеме психофармакотерапии в период беременности и лактации, а также нозологическому и клиническому разнообразию психопатологических проявлений у обоих родителей во время гестации и в первый год жизни ребенка.
Ключевые слова: психофармакотерапия, беременность, лактация.
Для цитирования: Марачев М.П. Особенности психофармакотерапии в период беременности и лактации. Психиатрия и психофармакотерапия. 2018; 20 (3–4): 34–42.
Features of psychopharmacotherapy during pregnancy and lactation
M.P.MarachevV.P.Serbsky Federal Medical Research Center of Psychiatry and Narcology of the Ministry of Health of the Russian Federation. 119991, Russian Federation, Moscow, Kropotkinskii per., d. 23marachevm@gmail.com
The article is devoted to the problem of psychopharmacotherapy during pregnancy and lactation, as well as nosological and clinical diversity of psychopathological manifestations in both parents during the gestation period and the first year of the child's life.
Key words: psychopharmacotherapy, pregnancy, lactation.
For citation: Marachev M.P. Features of psychopharmacotherapy during pregnancy and lactation. Psychiatry and Psychopharmacotherapy. 2018; 20 (3–4): 34–42.
Вопросы перинатальной психопатологии вызывают устойчивый интерес среди врачей-психиатров, о чем свидетельствует большое число слушателей симпозиумов и воркшопов, посвященных этой тематике, на европейских психиатрических конгрессах (EPA, ECNP) последних лет. Серия из двух обзорных статей будет посвящена психофармакотерапии в период беременности и лактации, а также нозологическому и клиническому разнообразию психопатологических проявлений у обоих родителей во время гестации и первый год жизни ребенка.
Первым описаниям расстройств, связанных с беременностью, более 2 тыс. лет. В 400 г. до н.э. Гиппократ описал случай «послеродового делирия» с тяжелой бессонницей и беспокойством, развившийся у женщины в течение недели после рождения близнецов [1, 2]. Швейцарский врач F.Plater (XVI в.) описывал бред и гневливость в послеродовом периоде. А в работах немецкого акушера F.Osiander (XVIII в.) встречается подробное описание послеродовой мании с быстрым началом и нарастанием симптоматики в виде дезорганизованности речи, сильного волнения, возбуждения, а также ненормального содержания мыслей по поводу материнства (например, «ребенок все еще в матке», «ребенок – Иисус Христос», «ребенок может летать») [3]. Донозологические гипотезы патогенеза перинатальных расстройств отличались своеобразием. Так, например, итальянский врач T.Ruggier (XI в.) допускал наличие связи между маткой и меланхолией: «Если матка слишком влажная, то мозг заполняется водой и влага подходит к глазам, приводя к невольному плачу» [4]. Французский гинеколог L.Berger (XVIII в.) полагал, что такие симптомы, как головная боль или ступор, в послеродовой период развивались вследствие раздражающего воздействия грудного молока на мозг роженицы. C подавлением или невозможностью лактации связывал развитие психических расстройств и J.Esquirol (XVIII в.) [5].
Первые попытки классифицировать перинатальную психопатологию были сделаны на рубеже XIX и XX вв. Все расстройства были разделены на 3 группы:
1) связанные с беременностью;
2) послеродовые (первые 6 нед после родов);
3) лактационные (начиная с 7-й недели после родов) [6].
Термин «послеродовой психоз» был включен в DSM-II (1968 г.) как диагноз исключения [7]. Однако из DSM-IV-TR нозология была исключена как самостоятельная категория [8]. В современном медицинском сообществе существуют разногласия относительно того, является ли послеродовой психоз независимым психическим расстройством или роды провоцируют психотические эпизоды у женщин, имеющих предрасположенность. Так, D.Sit и соавт. (2006 г.) предположили, что послеродовой психоз является фактически биполярным аффективным расстройством (БАР), вызванным резким изменением уровня гормонов в послеродовом периоде, что соответствует ранее полученным данным, согласно которым 72–88% женщин с психотическими расстройствами после родов имеют биполярное или шизоаффективное расстройство и только 12% – шизофрению [9–11].
Проблемы перинатальной психопатологии можно условно разделить на две основных составляющие. Это, с одной стороны, наличие психических расстройств, чаще хронических (например, БАР, шизофрения, униполярная депрессия и др.), у женщин детородного возраста, планирующих беременность или беременных. С другой – это манифестация психических расстройств или обострение хронических заболеваний в последние 2 нед беременности или после родов. К настоящему моменту нет согласованного мнения исследователей относительно продолжительности послеродового периода оценки состояния, в литературе можно встретить временной интервал в 4 нед, 3 мес (используется чаще всего) и 12 мес [12].
Одной из самых трудных клинических задач является подбор медикаментозной терапии для коррекции сопутствующей психической патологии в период беременности и лактации. Именно этой проблематике был посвящен воркшоп под названием «Медикаментозная коррекция аффективных расстройств и психозов у беременных и кормящих» на минувшем конгрессе Европейской психиатрической ассоциации во Флоренции. Мероприятие проведено под председательством специалиста в области перинатальной психиатрии доктором A.Wieck (отдел клинической психологии Университета Манчестера, Великобритания). В лекции последовательно раскрывались вопросы эпидемиологии основных психических расстройств во время беременности и после родов, безопасность применения психотропных лекарственных средств и принципы терапии основными группами медикаментов (стабилизаторы настроения, антипсихотики, антидепрессанты, гипнотики) во время гестации и лактации.
По данным Всемирной организации здравоохранения, одна из трех женщин в развивающихся странах и одна из десяти в развитых имеют проблемы с психическим здоровьем во время беременности или послеродовом периоде [13]. Наиболее распространенной патологией являются тревожные и депрессивные расстройства как в гестационный период (13 и 12% соответственно), так и после родов (15 и 20%). Среди тревожных расстройств чаще встречаются: паническое, генерализованное тревожное расстройство, обсессивно-компульсивное и посттравматическое расстройства, а также токофобия (патологическая боязнь родов). Распространенность депрессии колеблется в пределах от 3 до 5%. Известно, что психотические эпизоды, особенно в структуре БАР I типа, имеют большую вероятность рецидивирования или манифестации в перинатальный период, чем психозы в рамках шизофрении [14, 15]. В среднем распространенность психозов составляет 1–2 случая на 1 тыс., при этом около 1/2 всех случаев приходится на женщин без психопатологического анамнеза [16].
Доктор A.Wieck привела эпидемиологические данные, согласно которым в период с 2006 по 2008 г. на 100 тыс. родов в Великобритании приходилось 1,27 материнских смертей, связанных с психическими расстройствами, что объясняется недостаточным выявлением и отсутствием адекватной терапии [15]. Другой значимой проблемой является отсутствие контроля со стороны специализированных медицинский служб – только 0,6% пациентов в послеродовом периоде наблюдаются у психиатра, а направление к нему не превышает 2% [14, 15].
Особое внимание было уделено эпидемиологии БАР как одного из наиболее труднокурабельных расстройств в перинатальном периоде. Сложности ведения беременных женщин с БАР объясняются повышенным риском развития аномалий плода на фоне приема нормотимиков и высокими показателями рецидивирования при отмене терапии. В исследовании A.Viguera и соавт. (2000 г.) показатели рецидивирования в течение первых 40 нед после отмены приема лития были сопоставимы у беременных и в контрольной группе (52 и 58% соответственно), более чем в 2 раза превышая этот показатель у женщин, находящихся на поддерживающем лечении (21%). Среди испытуемых, остававшихся в стабильном состоянии в течение 40 нед после отмены лития, послеродовое рецидивирование было в 3 раза более частым, чем у небеременных в течение последующих 41–64 нед. Также было показано, что предикторами обострений состояния являлись: быстрая отмена лития и наличие аффективных эпизодов в анамнезе [17].
В свете проблемы регоспитализаций приведены данные, согласно которым на период с 10 по 19-й день после родов приходится наибольшая вероятность развития психических расстройств и регоспитализаций, причем наличие в анамнезе диагноза БАР является сильным предиктором риска повторных госпитализаций в этот период. Наименьший риск регоспитализаций приходится на период беременности, а по прошествии одного и более месяцев после родов он сравним с таковым у небеременных женщин [18, 19].
Одним из принципиальных вопросов при назначении медикаментозной терапии в период беременности является оценка потенциального риска ее влияния на развитие плода, в связи с чем важным считается понимание фармакокинетики и фармакодинамики лекарственных средств, а также этапы физиологического развития беременности. Лектором выдвинуты тезисы о том, что все психотропные средства проникают через плацентарный барьер, а степень влияния на плод зависит прежде всего от гестационных сроков. Так, при влиянии на плод неблагоприятных факторов (в том числе нерациональной психофармакотерапии) на ранних сроках беременности (до 12 нед) есть вероятность развития тяжелых структурных аномалий – эмбриопатий (рис. 1).
В срок с 12 нед до момента рождения происходят активная дифференциация органов и тканей, быстрый рост плода. Вредности, оказывающие влияние на плод в этом периоде, приводят к развитию малых структурных и функциональных дефектов в органах, формирование которых не завершено (головной мозг, гениталии, зубы, легкие), а также повышает риск преждевременных родов. В долгосрочной перспективе влияние психотропных препаратов на плод может привести к нарушению нейроразвития и повышенной восприимчивости ребенка к хроническим заболеваниям.

Исследователи, изучая потенциальный вред лекарственных препаратов для ребенка, сталкиваются с рядом трудностей. Во-первых, проведение рандомизированных контролируемых двойных слепых исследований неэтично, а следующим уровнем доказательности являются результаты популяционных и когортных исследований, полученные в ходе учета беременных, а также исследований «случай–контроль». Во-вторых, к размеру выборки, необходимой для проверки врожденных аномалий, предъявляются особые требования. Например, если аномалии встречаются в 0,1% случаев в общей популяции (например, волчья пасть), то для проверки удвоенного риска необходимо почти 11 тыс. случаев [20]. Третья проблема, с которой сталкиваются исследователи, – это разнообразие искажающих факторов, которые сами по себе могут влиять на развитие отклонений от нормы (например, возраст, курение, употребление алкоголя и психоактивных веществ, индекс массы тела, социально-экономическая, расовая/этническая принадлежность, сопутствующие хронические заболевания и лечение препаратами других групп (рис. 2) [21–24].
Существование искажающих факторов и отсутствие последовательного подхода к их анализу вносят неопределенность в результаты исследования. На качество доказательств также оказывают влияние диагностические погрешности, дефицит информации о развитии пороков у детей, чьи матери имели нелеченые психические расстройства, что препятствует сравнению между исследованиями.
Однако, несмотря на имеющиеся трудности, в настоящее время получены ответы на ряд вопросов, касающихся риска развития врожденных аномалий при терапии большинством психотропных средств.
 В своем выступлении A.Wieck подробно осветила вопросы курации перинатальных психических расстройств, выделив три ключевых аспекта, на которые должны быть направлены усилия группы специалистов, занимающихся ведением беременности у женщин с психическими расстройствами:
В своем выступлении A.Wieck подробно осветила вопросы курации перинатальных психических расстройств, выделив три ключевых аспекта, на которые должны быть направлены усилия группы специалистов, занимающихся ведением беременности у женщин с психическими расстройствами:1) поддержание стабильности психического состояния на протяжении беременности;
2) безопасность ребенка;
3) предотвращение рецидивов в послеродовом периоде.
В рамках реализации перечисленных аспектов ключевым моментом является раннее направление к психиатру (желательно его включение в мультидисциплинарную бригаду на этапе планирования беременности) и осуществление психиатрического сопровождения на протяжении всей беременности и послеродового периода. К обязанностям врача-психиатра помимо диагностики и подбора/коррекции психофармакотерапии относятся: оценка факторов риска послеродовых рецидивов, профилактика риска аномалий развития у плода (например, назначение фолиевой кислоты), психообразование, проведение интервенций, направленных на снижение уровня постнатального стресса, оптимизацию цикла сон–бодрствование, тесное сотрудничество с другими специалистами, участвующими в оказании помощи. Назначая медикаментозное лечение, врач-психиатр должен избегать полипрагмазии, придерживаться принципа абсолютной информированности пациента, а также воздерживаться от назначения препаратов, не имеющих достаточно данных по безопасности или обладающих тератогенным действием.
Раскрывать тему влияния антипсихотиков на терапию беременных профессор А.Wieck начала с общепринятого заблуждения, что типичные антипсихотики (ТА) более безопасны в применении, чем атипичные (АА), в связи с большей изученностью. По данным T.Barnes (2011 г.), среди ТА только флуфеназин и галоперидол упоминаются в литературе больше 200 раз, тогда как остальные препараты этой группы – меньше 100. Лидерами среди АА по количеству упоминаний в научной литературе являются оланзапин (∼200), рисперидон и арипипразол (более 100), менее 100 исследований посвящено кветиапину и клозапину [25–27].
Несмотря на распространенное мнение о большей безопасности ТА, научные данные свидетельствуют о возрастающем использовании АА в купировании различных психопатологических состояний в перинатальном периоде. Так, за период с 2001 по 2007 г. АА назначались в среднем в 2,5 раза чаще, чем ТА, при этом частота использования АА при аффективных расстройствах (депрессия – 63%, БАР – 43%) значительно превышала таковую при шизофрении (13%) [28].
Широкое применение антипсихотических препаратов в период гестации не позволяет в полной мере оценить их репродуктивную безопасность. В метаанализе C.Coughlin и соавт. (2015 г.) выявлена существенная взаимосвязь между применением антипсихотиков и развитием множественных акушерских и неонатальных нежелательных явлений (пороки сердца, преждевременные роды, недоношенность, рекомендуемое прерывание беременности, низкая масса тела) вне зависимости от фармакологической группы (ТА или АА). Авторы признают сложности в интерпретации полученных результатов, ссылаясь на малую выборку включенных исследований и невозможность оценки влияния дополнительных факторов (таких как курение, злоупотребление психоактивными веществами, ожирение, сахарный диабет – СД, социально-экономический статус, медикаментозная терапия сопутствующей патологии) [29]. Исследовательской группой из Дании M.Sørensen и соавт. (2015 г.) было показано, что женщины, принимающие антипсихотики до/во время беременности, имеют высокий риск (34%) спонтанного аборта, а те, что принимали антипсихотики только во время родов, в 2 раза больший риск мертворождений [30]. Однако и это исследование имело свои ограничения. В изучаемой выборке были женщины с ожирением и/или гестационным СД (ГСД), что само по себе может увеличивать вероятность невынашивания, внутриутробных аномалий и других осложнений беременности и родов [31, 32]. С другой стороны, само применение антипсихотиков в 2 раза увеличивает вероятность развития ГСД [33, 34].
Относительно влияния антипсихотиков на здоровье новорожденных F.Habermann и соавт. (2013 г.) установлено, что их применение на поздних сроках беременности приводит к развитию послеродовых расстройств у новорожденного (респираторных, кардиологических, желудочно-кишечного тракта, центральной нервной системы – ЦНС, мультисистемных), как в случае с АА (15,6%), так и ТА (21,6%). При этом для беременных, применяющих ТА, были выявлены положительные корреляции с повышенным риском преждевременных родов и низкой массой тела новорожденного, а в отношении АА – с возникновением крупных пороков развития. Не было выявлено влияния терапии нейролептиками на риск спонтанных абортов, показатели мертворождения и неонатальной смертности [35]. Представляют интерес данные о влиянии приема антипсихотиков в период беременности на нейроразвитие. Результаты исследований новорожденных, матери которых принимали антипсихотики, свидетельствуют о задержке нейроразвития, определяемой низкими результатами по когнитивным, моторным, социально-эмоциональным и адаптационно-поведенческим показателям (шкала Bayley Scales of Infant and Toddler Development, third edition – BSID-III) в первые месяцы после рождения. Вместе с тем все выявленные нарушения нивелировались к первому году жизни ребенка [36–39].
Отдельной проблемой является ГСД, вероятность развития которого на фоне применения антипсихотиков увеличивается в 2 раза. Такое увеличение может быть объяснено не только прямым действием лекарств, но и повышенным индексом массы тела на ранних сроках беременности, а также рядом других причин, которые необходимо учитывать при подборе антипсихотика (наследственность, этническая принадлежность, наличие макросомии и ГСД при предыдущих беременностях) [40].
Таким образом, имеющиеся доказательства не подтверждают гипотезу о существенном тератогенном потенциале антипсихотических препаратов, а увеличение риска развития крупных пороков развития (наиболее частые сердечно-сосудистые дефекты), мертворождения, ассоциации с увеличением риска преждевременных родов и рождения младенцев, маленьких для своего гестационного возраста, объясняется исследователями влиянием дополнительных факторов и/или их сочетанием. Данных относительно каких-либо дефектов развития нервной системы в исследованиях не получено.
В продолжение доклада А.Wieck остановилась на противоэпилептических препаратах, используемых для лечения БАР. Опыт их применения у беременных связан в первую очередь с эпилепсией. Согласно имеющимся данным большинство детей, рожденных от матерей с эпилепсией, которые принимают поддерживающую терапию, не имеют существенной патологии. Вместе с тем известно, что именно эта фармакологическая группа лекарственных средств обладает наибольшим тератогенным потенциалом и риском развития поведенческих нарушений. Согласно ведущей гипотезе тератогенности в процессе метаболизма нормотимиков образуются свободные радикалы, которые приводят к окислительному макромолекулярному повреждению [41]. Частота врожденных пороков развития при использовании нормотимиков колеблется в пределах от 4,5 до 8,6% (моно-/политерапия соответственно) [42].
Наиболее распространенной патологией являются пороки развития сердца (например, дефект межжелудочковой перегородки), ротолицевые дефекты (например, расщелина губ и/или неба), урологические пороки развития (например, гипосподия), аномалии скелета (например, аномальное строение костей верхних конечностей, гипоплазия фаланг пальцев), дефекты нервной трубки (например, spina bifida). Причиной поведенческих нарушений считается вызванный приемом нормотимиков апоптоз нервных клеток. В исследовании на грызунах было показано, что применение клоназепама, диазепама, фенобарбитала, фенитоина, вигабатрина и вальпроевой кислоты приводило к распространенному апоптозу нейронов у новорожденных крыс. Эффект зависел от дозы, наблюдался при терапевтически значимых уровнях препаратов в плазме, относительно кратковременном применении и мог усиливаться за счет синергического действия нескольких препаратов. Подобные апоптотические эффекты не наблюдались при монотерапии в терапевтических дозировках для карбамазепина, леветирацетама, ламотриджина или топирамата. Кроме того, воздействие вальпроатов и вигабатрина может приводить к гиппокампальной и кортикальной дисплазии, вторичной по отношению к нарушенной миграции и гибели нейронов [43].
Монотерапия карбамазепином ассоциирована с возникновением крупного врожденного порока – spina bifida и более высоким риском возникновения таких пороков сердца, как единственный желудочек и дефект атриовентрикулярной перегородки, но эти риски значительно ниже в сравнении с вальпроатами [44]. Для последних характерно значительное увеличение рисков возникновения spina bifida (отношение шансов – ОШ 12,7; 95% доверительный интервал – ДИ от 7,7 до 20,7), дефекта межпредсердной перегородки, расщелины неба, гипоспадии, полидактилии и краниосиностоза [45]. Ламотриджин в сравнении с вальпроатами обладает низкой тератогенностью. Риск всех пороков развития при монотерапии ламотриджином составил от 2,0 до 5,6% по сравнению с базовыми показателями (1,1–3,6%) для детей, чьи матери не получали ламотриджин во время беременности [46]. В исследовании L.Holmes и соавт. (2008 г.) получены следующие результаты: дети, подвергавшиеся в I триместре воздействию ламотриджина, имеют повышенный риск возникновения пороков развития челюстно-лицевой области (7,3/1000): изолированной расщелины неба или хейлосхизиса [47]. Однако эти данные не подтверждаются другими исследованиями, в которых не было обнаружено высокого риска развития челюстно-лицевых аномалиий в сравнении с другими пороками на монотерапии ламотриджином [46, 48, 49].
Помимо врожденных пороков внутриутробного развития лечение нормотимиками в период гестации может приводить к нарушениям когнитивного развития у потомства на ранних этапах жизни, а также повышать риск других серьезных нейропсихиатрических расстройств [50–53]. R.Bromley и соавт. (2013 г.) обнаружили увеличение риска возникновения расстройств нервно-психического развития у детей, матери которых подвергались монотерапии вальпроатом натрия (12,0%, p=0,007), наиболее частым диагнозом было расстройство аутистического спектра [54], абсолютный риск развития которого – 4,42% [55]. Важнейшим фактором, определяющим связь с аутистическими симптомами, является используемая доза вальпроата натрия [56, 57].
Данные относительно приема солей лития неоднозначны. В исследовании M.Weinstein (1980 г.) было показано, что у 8% детей, которые подвергались внутриутробному воздействию лития, фиксировались сердечно-сосудистые аномалии в сравнении с 1% в общей популяции, а 2,7% детей имели аномалию Эбштейна при распространенности в общей популяции 1 на 20 тыс. [58]. Недавнее исследование O.Diav-Citrin и соавт. (2014 г.) показало, что риск развития сердечно-сосудистых аномалий у детей, подвергавшихся воздействию лития в I триместре, составляет 4,1% против 0,6% в контрольной группе. Частота преждевременных родов была выше в группе лития по сравнению с группой контроля (13,7 и 6,0% соответственно) [59]. С другой стороны, в работах A.Ornoy и соавт. (2008 г.) и R.McKnight и соавт. (2012 г.) показано, что накоплено недостаточное количество данных о безопасности применения лития у беременных, а наблюдения, которые ранее расценивались как существенные, являлись переоцененными [60, 61]. А в исследовании M.Schou (1987 г.) опровергается гипотеза повышенного риска развития нейроповеденческих нарушений у детей, чьи матери во время беременности принимали препараты лития [62]. В литературе встречаются единичные сообщения о наличии патологий у плода и новорожденного, таких как аритмия, гипогликемия, несахарный диабет, дисфункция щитовидной железы, зоб, вялость, заторможенность, аномалии развития печени и респираторные нарушения, а также упоминания о материнской и неонатальной токсичности в связи с приемом препаратов лития [63].
Особое внимание лектором было уделено вопросу применения фолиевой кислоты (фолатов) с акцентом на неоднозначности протективной роли этих веществ у женщин, принимающих нормотимики, в период беременности. Известно, что небольшие дозы фолиевой кислоты (0,4 мг в день) предотвращают врожденные аномалии развития в общей популяции, в частности дефекты нервной трубки, а высокие дозировки до 5 мг в день используются для семей с повышенным риском. Сроки профилактического приема разнятся, так, в Великобритании рекомендован прием фолатов за 3 мес до и 3 мес после наступления беременности. Согласно рекомендациям NICE (National Institute of Health and Care Excellence 2004, 2007, 2014) женщинам, находящимся на терапии противоэпилептическими препаратами, следует принимать 5 мг фолиевой кислоты в сутки в период, предшествующий зачатию. Однако в серии исследований последних лет не было выявлено существенного протективного действия фолатов, что ставит под сомнение целесообразность их использования в качестве средства профилактики развития внутриутробных пороков развития [64–66].
В соответствии с приведенными выше данными многими медицинскими организациями разработаны собственные рекомендации по ведению беременности женщин с эпилепсией, БАР и мигренью на фоне приема противоэпилептических препаратов. Согласно официальным рекомендациям Европейского медицинского агентства вальпроаты не следует использовать для лечения эпилепсии, биполярного расстройства и мигрени у женщин, которые беременны или могут забеременеть, за исключением случаев, когда другое лечение неэффективно или плохо переносится. Если препараты вальпроевой кислоты являются единственно возможным вариантом лечения, женщины должны использовать надежные методы контрацепции [67]. Рекомендации NICE (2014 г.) более категоричны и полностью исключают использование вальпроатов у женщин детородного возраста для лечения аффективных расстройств, даже при условии применения надежных методов контрацепции. Таким образом, целесообразным считается избегать назначения вальпроатов и карбамазепина в период беременности, тогда как для оценки безопасности ламотриджина имеющихся данных недостаточно.
Применение лития в I триместре оправдано в случае неэффективности антипсихотической терапии и высокого риска рецидивирования при переходе на более безопасный препарат. В отсутствие данных трудностей целесообразна замена лития на антипсихотические препараты на сроки до начала II триместра или вплоть до родов. Рекомендуется измерение концентрации препарата в плазме с частотой: 1 раз в месяц до 36-й недели беременности, 1 раз в неделю в месяц предполагаемой даты родов с последующей коррекцией дозы лития (NICE, 2014) [68]. Имеются интра- и постнатальные особенности приема. На момент начала родов необходимо отменить препарат и мониторировать показатели лития и водно-электролитного баланса во время родов. В постнатальном периоде, если уровень лития находится в пределах терапевтических рамок, возможно продолжение терапии дозами, принимаемыми до беременности. Контроль содержания лекарства следует проводить после 1-й недели приема с последующей коррекцией в случае необходимости.
Затрагивая тему использования антидепрессантов, доктор А.Wieck привела эпидемиологические данные, согласно которым от 2,8 до 10,2% женщин используют антидепрессанты в период беременности. В исследовании распространенности назначений антидепрессантов группы селективных ингибиторов обратного захвата серотонина (СИОЗС) в странах Европы лидером по этому показателю стала Великобритания [69].
Применение антидепрессантов в I триместре ассоциировано с повышением риска развития пороков сердечно-сосудистой системы у плода. Среди представителей трициклических антидепрессантов (ТЦА) только для кломипрамина есть достоверные данные об ассоциации с небольшим увеличением сердечно-сосудистых дефектов на фоне общего дефицита информации и ее противоречивости для остальных представителей данной группы. Исследований по безопасности применения антидепрессантов из группы СИОЗС значительно больше. В метанализе S.Grigoriadis и соавт. (2013 г.) подтверждается связь приема СИОЗС с незначительным увеличением сердечно-сосудистых мальформаций (абсолютный риск – 1,36) [70]. С другой стороны, в более поздних исследованиях K.Huybrechts и соавт. (2014 г.), K.Furu и соавт. (2015 г.) с учетом вклада в риск сопутствующих факторов не было обнаружено существенного увеличения распространенности врожденных сердечно-сосудистых аномалий у младенцев, которые подвергались воздействию исследуемых лекарственных препаратов в утробе матери [71, 72]. Данные о развитии других пороков менее согласованы для всех представителей антидепрессантов. Различия между препаратами СИОЗС не имеют прочной доказательной основы из-за обилия противоречивых данных. Имеется лишь ограниченное число свидетельств, что пароксетин отличается большим риском развития врожденных аномалий [70].
В отношении безопасности других групп антидепрессантов в I триместре беременности имеется незначительное количество сведений. Так, например, в работах C.Bellantuono и соавт. (2015 г.) и D.Lassen и соавт. (2016 г.) показано, что прием венлафаксина в период гестации относительно безопасен, особенно в отношении крупных пороков развития [73, 74]. В связи с фактическим отсутствием убедительных данных относительно безопасности использования миртазапина, тразодона и дулоксетина доктор А.Wieck предостерегла от их назначения беременным и кормящим для купирования симптомов депрессии.
Использование антидепрессантов во II и III триместрах может приводить к повышению риска преждевременных родов (ОШ 1,53) [75]. В то же время депрессия у матери во время беременности сама по себе связана с увеличением вероятности преждевременных родов (ОШ 1,37) [76].
Прием антидепрессантов также влияет на здоровье ребенка в неонатальном периоде. Воздействие СИОЗС на поздних сроках ассоциировано с развитием персистирующей легочной гипертензии новорожденного – ПЛГН (2,9–3,5 на 1 тыс. детей) [77]. В исследовании K.Huybrechts и соавт. (2015 г.) на большой выборке пациентов показано, что у 322 детей, чьи матери принимали СИОЗС на поздних сроках беременности, развилась ПЛГН (28,3–35,2 на 10 тыс. родов) в сравнении с 7630 детьми, не испытывавшими внутриутробного влияния антидепрессантов (20,4–21,3 на 10 тыс. родов), что подтверждает повышение риска ПЛГН при приеме препаратов СИОЗС во второй половине беременности [78]. Помимо всего прочего все антидепрессанты способны нарушать неонатальную адаптацию (ОШ 5,07), чаще в виде неонатального респираторного дистресса, тремора и гипогликемии (19%) [79]. Симптомы дезадаптации возникают у каждого третьего ребенка, однако отличаются умеренной выраженностью, транзиторностью и не требуют дополнительных медицинских вмешательств [78].
Проблема риска аутистических расстройств у детей, чьи матери принимают антидепрессанты во время беременности, широко обсуждается в научных кругах. Из анализа тематических исследований следует, что риск развития подобных расстройств повышен (абсолютный риск от 1,1 и 1,8) [80, 81]. Однако достоверность связи между внутриутробным воздействием СИОЗС и развитием расстройств аутистического спектра сомнительна по причине невозможности учета вклада других сопутствующих факторов [82, 83]. Применение ТЦА, СИOЗС и венлафаксина не оказывает влияния на развитие нейроповеденческих нарушений в раннем детском возрасте [84, 85]. В исследовании M.Handal и соавт. (2015 г.) отмечена слабая связь воздействия СИОЗС с задержкой двигательного развития (нарушением мелкой моторики) в возрасте 3 лет, но данные не имели клинической значимости [86].
Таким образом, при выборе антидепрессантов из ряда ТЦА, СИОЗС, селективных ингибиторов обратного захвата серотонина и норадреналина для лечения психопатологии у беременных женщин следует учитывать сроки беременности, опыт предыдущей терапии (эффективность и переносимость), информацию по профилю безопасности используемых препаратов. Психотерапия – 1-я линия коррекции нарушений при тревожных и депрессивных расстройствах у беременных, и только в случае предпочтения медикаментозного лечения самой пациенткой или неэффективности психотерапии рассматривается возможность назначения лекарственных препаратов.
Применение бензодиазепинов в I триместре беременности не приводит к формированию крупных пороков развития плода [87, 88]. Вместе с тем, по замечанию лектора, использовать бензодиазепины в период зачатия, во время беременности и после родов необходимо строго по показаниям (тревога, возбуждение) и короткими курсами.
Исследования показывают, что использование гипнотиков (Z-препараты) в перинатальный период не приводит к появлению выраженных врожденных аномалий [88, 89]. Изучение одного из препаратов этой группы (золпидем) позволило сделать вывод о его относительной безопасности. В исследовании L.Wang и соавт. (2010 г.) показано, что прием золпидема во время беременности незначительно увеличивает риск преждевременных родов – 1,49 (95% ДИ 1,28–1,74), рождения ребенка с низкой массой тела – 1,39 (95% ДИ 1,17–1,64), гипотрофии плода (низкая масса для данного гестационного возраста) – 1,34 (95% ДИ 1,20–1,49) и кесарева сечения – 1,74 (95% ДИ 1,59–1,90) [90]. В отношении других препаратов, часто применяемых в купировании симптомов инсомнии (например, тразодон, промазин и т.д.), нет достаточной информации по безопасности, поэтому их применение у беременных не рекомендуется.
Согласно рекомендациям Всемирной организации здравоохранения первые 6 мес после рождения дети должны находиться исключительно на грудном вскармливании. По истечении этого срока для удовлетворения пищевых потребностей младенцам необходимо получать адекватное и безопасное питание пищевыми добавками параллельно с продолжением грудного вскармливания в течение 2 лет и более [91].
Принимая во внимание рекомендации по грудному вскармливанию, актуальным является вопрос о применении психофармакотерапии в период лактации. Для оценки степени влияния препаратов на ребенка используется показатель «относительная младенческая доза» – ОМД (англ. Relative Infant Dose) – это доза, получаемая через грудное молоко ребенком относительно материнской дозы, выражаемая в процентах. ОМД<10% считается «относительно безопасной». Большинство психотропных препаратов имеют показатель ниже 10%, за редким исключением. Так, для ламотриджина и лития этот показатель составляет 9,2–18,3 и 12–30,1% соответственно, основываясь на этих данных, предпочтительно в период лактации использовать препараты вальпроевой кислоты и карбамазепина [92–95].
При назначении ТЦА, СИОЗС или селективных ингибиторов обратного захвата серотонина и норадреналина в период лактации учитывают преимущества грудного вскармливания для женщины и ребенка, оценивают риски, связанные с изменениями ранее эффективного лечения или его отменой. СИОЗС считаются одними из самых изученных препаратов в отношении применения в период лактации. В частности, сертралин, пароксетин и флувоксамин являются препаратами выбора для лечения депрессии у кормящих женщин, так как в меньшей степени выделяются с грудным молоком и практически не вызывают нежелательных явлений у ребенка. Учитывая ОМД, длительный период полувыведения и сообщаемые побочные эффекты у младенцев, использование циталопрама, эсциталопрама и флуоксетина противопоказано во время грудного вскармливания [96].
ТЦА имеют менее благоприятный профиль нежелательных явлений и гораздо более высокий риск смертности при передозировке. Тем не менее их применение относительно безопасно, так как большинство ТЦА имеют низкую секрецию в грудное молоко. ОМД для различных представителей ТЦА находится в пределах 10%: амитриптилин – 1,5%, кломипрамин – 2,8%, дотипин – 4,4%, доксепин – 1,2%, имипрамин – 0,15% и нортриптилин – 1,5%. В большинстве случаев не было обнаружено никаких неблагоприятных эффектов при их воздействии.
Относительно безопасности применения гипнотиков и анксиолитиков в период лактации данных мало, только 16 (57%) из 28 препаратов в настоящий момент изучены. При назначении бензодиазепинов необходимо принимать во внимание разницу в метаболизме бензодиазепинов у новорожденных и взрослых: у первых метаболизм значительнее медленнее, что в итоге ведет к кумуляции препаратов с длительным периодом полувыведения, как следствие – развитию седации и тошноты. С учетом этого следует отдавать предпочтение препаратам с коротким периодом полувыведения и проводить постоянный мониторинг состояния младенца, а при появлении токсических эффектов сразу прекратить грудное вскармливание [97].
Антипсихотики – это класс с наименьшим количеством исследований (изучены 11 из 22 препаратов), касающихся использования во время грудного вскармливания. Хлорпромазин и оланзапин принято считать препаратами первого выбора для лечения психотических расстройств в период лактации, также допустимо использование галоперидола и кветиапина. Нежелательными для применения признаны клозапин и сульпирид. Все антипсихотические препараты имеют относительно длительные периоды полувыведения, поэтому следует наблюдать за развитием летаргии и седации у младенцев.
Если возникает необходимость в назначении психотропных препаратов, то необходимо предоставить полную информацию обоим родителям о последствиях воздействия препаратов на здоровье новорожденных [98]. Педиатр также должен быть осведомлен о потенциальных побочных эффектах воздействия медикаментов и взаимодействиях с другими препаратами, проводить клинический мониторинг состояния младенца (поведение ребенка, сон, питание).
Резюмируя свой доклад, доктор A.Wieck обратила внимание аудитории на необходимость индивидуальной оценки параметров риск/польза при выборе психофармакологического сопровождения в период зачатия, во время беременности и грудного вскармливания; отметила важность междисциплинарного подхода при ведении беременности, осложненной хроническим психическим расстройством, подчеркнула необходимость тесного взаимодействия как с будущей матерью, так и ее близкими. A.Wieck подчеркнула, что проявления психической патологии могут существенно в большей степени нарушать процессы физиологического развития плода и негативно сказываться на состоянии здоровья матери, чем возможные неблагоприятные эффекты от использования психофармакотерапии в период беременности.
Сведения об авторе
Марачев Максим Павлович – канд. мед. наук, ст. науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ «ФМИЦПН им. В.П.Сербского».
Е-mail: marachevm@gmail.com
Список исп. литературыСкрыть список1. Sit D, Rothschild AJ, Wisner KL. A review of postpartum psychosis.
J Women's Health 2006; 15 (4): 352–68.
2. Spinelli M.G. Psychiatric Disorders During Pregnancy and Postpartum. J Am Med Women’s Ass’n 1998; 53: 165.
3. Brockington I. A historical perspective on the psychiatry of motherhood. Perinatal stress, mood and anxiety disorders. Karger Pub 2005; 173: 1–5.
4. Steiner M, Yonkers KA, Eriksson E (ed.). Mood disorders in women. M.Dunitz, 2000.
5. Esquirol É. Des maladies mentales. 1838.
6. Butts HF. Post-partum psychiatric problems. A review of the literature dealing with etiological theories. J National Med Assoc 1969; 61 (2): 136.
7. American Psychiatric Association et al. DSM-II: Diagnostic and Statistical Manual of Mental Disorders. Am Psychiatric Assoc 1975.
8. Frances A et al. Diagnostic and statistical manual of mental disorders: DSM-IV. American Psychiatric Association, 1994.
9. Sit D, Rothschild AJ, Wisner KL. A review of postpartum psychosis.
J Women's Health 2006; 15 (4): 352–68.
10. Brockington I. Puerperal psychosis: Motherhood and mental health. New York: Oxford University Press, 1996; р. 200.
11. Wisner KL, Peindl KS, Hanusa BH. Psychiatric episodes in women with young children. J Affect Dis 1995; 34 (1): 1–11.
12. O'Hara MW, Wisner KL. Perinatal mental illness: definition, description and aetiology. Best Pract Res Clin Obstet Gynaecol 2014; 28 (1): 3–12.
13. Maternal mental health and child health and development in low and middle income countries. Report of the WHO meeting. Geneva, World Health Organization, 2008.
14. Oates M. Perinatal maternal mental health services. London, England: Royal College of Psychiatrists, 2000.
15. National Collaborating Centre for Mental Health UK et al. Antenatal and postnatal mental health: the NICE guideline on clinical management and service guidance. British Psychological Society, 2007.
16. Valdimarsdóttir U et al. Psychotic illness in first-time mothers with no previous psychiatric hospitalizations: a population-based study. PLoS Med 2009; 6 (2): e1000013.
17. Viguera AC et al. Risk of recurrence of bipolar disorder in pregnant and nonpregnant women after discontinuing lithium maintenance. Am J Psychiatry 2000; 157 (2): 179–84.
18. Munk-Olsen T et al. New parents and mental disorders: a population-based register study. JAMA 2006; 296 (21): 2582–9.
19. Munk-Olsen T et al. Risks and predictors of readmission for a mental disorder during the postpartum period. Arch General Psychiatry 2009; 66 (2):189–95.
20. Dellicour S, ter Kuile FO, Stergachis A. Pregnancy exposure registries for assessing antimalarial drug safety in pregnancy in malaria-endemic countries. PLoS Med 2008; 5 (9): e187.
21. Källén B. The problem of confounding in studies of the effect of maternal drug use on pregnancy outcome. Obstet Gynecol Int 2011; 2012.
22. Grote NK et al. A meta-analysis of depressionduring pregnancy and the risk of preterm birth, low birth weight, and intrauterine growth restriction. Arch General Psychiatry 2010; 67 (10): 1012–24.
23. Bodén R et al. Risks of adverse pregnancy and birth outcomes in women treated or not treated with mood stabilisers for bipolar disorder: population based cohort study. 2012.
24. Lin HC et al. Maternal schizophrenia and pregnancy outcome: does the use of antipsychotics make a difference? Schizophrenia Res 2010; 116 (1): 55–60.
25. Barnes TRE. Schizophrenia Consensus Group of the British Association for Psychopharmacology. Evidence-based guidelines for the pharmacological treatment of schizophrenia: recommendations from the British Association for Psychopharmacology. J Psychopharmacol 2011; 25 (5): 567–620.
26. Ennis ZN, Damkier P. Pregnancy exposure to olanzapine, quetiapine, risperidone, aripiprazole and risk of congenital malformations. A systematic review. Basic Clin Pharmacol Toxicol 2015; 116 (4): 315–20.
27. Bellet F et al. Exposure to aripiprazole during embryogenesis: a prospective multicenter cohort study. Pharmacoepidemiol Drug Saf 2015; 24 (4): 368–80.
28. Toh S et al. Prevalence and trends in the use of antipsychotic medications during pregnancy in the US, 2001–2007: a population-based study of 585,615 deliveries. Arch Women's Mental Health 2013; 16 (2): 149–57.
29. Coughlin CG et al. Obstetric and neonatal outcomes after antipsychotic medication exposure in pregnancy. Obstet Gynecol 2015; 125 (5): 1224–35.
30. Sørensen MJ et al. Risk of Fetal Death after Treatment with Antipsychotic Medications during Pregnancy. PloS One 2015; 10 (7): e0132280.
31. HAPO Study Cooperative Research Group et al. Hyperglycaemia and Adverse Pregnancy Outcome (HAPO) Study: associations with maternal body mass index. BJOG 2010; 117 (5): 575.
32. Wendland EM et al. Gestational diabetes and pregnancy outcomes-a systematic review of the World Health Organization (WHO) and the International Association of Diabetes in Pregnancy Study Groups (IADPSG) diagnostic criteria. BMC 2012; 12 (1): 1.
33. Reis M, Källén B. Maternal use of antipsychotics in early pregnancy and delivery outcome. J Clin Psychopharmacol 2008; 28 (3): 279–88.
34. Bodén R et al. Antipsychotics during pregnancy: relation to fetal and maternal metabolic effects. Arch General Psychiatry 2012; 69 (7): 715–21.
35. Habermann F et al. Atypical antipsychotic drugs and pregnancy outcome: a prospective, cohort study. J Clin Psychopharmacol 2013; 33 (4): 453–62.
36. Peng M et al. Effects of prenatal exposure to atypical antipsychotics on postnatal development and growth of infants: a case-controlled, prospective study. Psychopharmacology 2013; 228 (4): 577–84.
37. Gentile S. Antipsychotic therapy during early and late pregnancy.
A systematic review. Schizophrenia Bulletin 2010; 36 (3): 518–44.
38. Kris EB. Children of mothers maintained on pharmacotherapy during pregnancy and postpartum. Cur Ther Res, Clin Experimental 1965; 7 (12): 785–9.
39. Slone D et al. Antenatal exposure to the phenothiazines in relation to congenital malformations, perinatal mortality rate, birth weight, and intelligence quotient score. Am J Obstet Gynecol 1977; 128 (5): 486–8.
40. Batterham RL. National Institute for Health and Care Excellence (2014), Obesity-Identification, assessment and management of overweight and obesity in children, young people an adults, CG43.
41. Wells PG et al. Oxidative damage in chemical teratogenesis. Mutation Res/Fundamental Molecular Mechanisms Mutagenesis 1997; 396 (1): 65–78.
42. Holmes LB et al. The teratogenicity of anticonvulsant drugs. N Engl
J Med 2001; 344 (15): 1132–8.
43. Meador KJ et al. Pregnancy registries in epilepsy A consensus statement on health out-comes. Neurology 2008; 71 (14): 1109–17.
44. Jentink J et al. Intrauterine exposure to carbamazepine and specific congenital malformations: systematic review and case-control study. BMJ 2010; 341: c6581.
45. Jentink J et al. Valproic acid mono-therapy in pregnancy and major congenital malformations. N Engl J Med 2010; 362 (23): 2185–93.
46. Hunt SJ, Craig JJ, Morrow JI. Increased frequency of isolated cleft palate in infants exposed to lamotrigine during pregnancy. Neurology 2009; 72 (12): 1108–9.
47. Holmes LB et al. Increased frequency of isolated cleft palate in infants exposed to lamotrigine during pregnancy. Neurology 2008; 70 (22). Part 2: 2152–8.
48. Dolk H et al. Does lamotrigine use in pregnancy increase orofacial cleft risk relative to other malformations? Neurology 2008; 71 (10): 714–22.
49. Cunnington MC et al. Final results from 18 years of the International Lamotrigine Pregnancy Registry. Neurology 2011; 76 (21): 1817–23.
50. Bromley RL et al. Early cognitive development in children born to women with epilepsy: a pro-spective report. Epilepsia 2010; 51 (10): 2058–65.
51. Meador KJ et al. Fetal antiepileptic drug exposure and cognitive function at age 3. N Engl J Med 2009; 360: 1597–605.
52. Adab N et al. The long-er term outcome of children born to mothers with epilepsy. J Neurology, Neurosurg Psychiatry 2004; 75 (11): 1575–83.
53. Meador KJ et al. Fetal antiepileptic drug exposure and cognitive out-comes at age 6 years (NEAD study): a prospective observational study. Lancet Neurol 2013; 12 (3): 244–52.
54. Bromley RL et al. The prevalence of neurodevel-opmental disorders in children prenatally exposed to antiepileptic drugs. J Neurol, Neurosurg Psychiatry 2013; 84 (6): 637–43.
55. Christensen J et al. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA 2013; 309 (16): 1696–703.
56. Wood AG et al. Prospective assessment of autism traits in children exposed to antiepileptic drugs during pregnancy. Epilepsia 2015; 56 (7): 1047–55.
57. Perucca P, Camfield P, Camfield C. Does gender influence susceptibility and consequences of acquired epilepsies? Neurobiol Dis 2014; 72: 125–30.
58. Weinstein MR. Lithium treatment of women during pregnancy and in the post-delivery period. Handbook Lithium Ther. Springer Netherlands, 1980; р. 421–30.
59. Diav-Citrin O. et al. Pregnancy outcome following in utero exposure to lithium: a prospective, comparative, observational study. Am J Psychiatry 2014.
60. Ornoy A, Yacobi S. Lithium and pregnancy Response. Israel J Psychiatry Related Sci 2008; 45 (4): 301.
61. McKnight RF et al. Lithium toxicity profile: a systematic review and meta-analysis. Lancet 2012; 379 (9817): 721–8.
62. Schou M. What happened later to the lithium babies? A follow‐up study of children born without malformations. Acta Psychiatr Scand 1976; 54 (3): 193–7.
63. American college of obstetricians and gynecologists 2007, practice bulletin number 87. http://www.ncbi.nlm.nih.gov/pubmed/ 17978143
64. Morrow JI et al. Folic acid use and major congenital malformations in offspring of women with epilepsy: a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol, Neurosurg Psychiatry 2009; 80 (5): 506–11.
65. Jentink J et al. Does folic acid use decrease the risk for spina bifida after in utero exposure to valproic acid? Pharmacoepidemiol Drug Safety 2010; 19 (8): 803–7.
66. Wlodarczyk BJ et al. Antiepileptic drugs and pregnancy outcomes. Am J Med Genetics. Part A 2012; 158 (8): 2071–90.
67. European Medicines Agency (EMA). http:// www.ema.europa.eu /ima/index.jsp?curl=pages/ news_and_events/news/2014/10/ news _detail_002186. jsp&mid=WC0b01ac058004d5c1
68. NICE Clinical Guideline 192. 2014. http://www.nice.org.uk/guidance/cg192. National Institute for Health and Care Excellence.
69. Charlton RA et al. Selective serotonin reuptake inhibitor prescribing before, during and after pregnancy: a population‐based study in six European regions. BJOG 2015; 122 (7): 1010–20.
70. Grigoriadis S et al. The impact of maternal depression during pregnancy on perinatal outcomes: a systematic review and meta-analysis. J Clin Psychiatry 2013; 74 (4): 321–41.
71. Huybrechts KF et al. Antidepressant use in pregnancy and the risk of cardiac defects. N Engl J Med 2014; 370 (25): 2397–407.
72. Furu K et al. Selective serotonin reuptake inhibitors and venlafaxine in early pregnancy and risk of birth defects: population based cohort study and sibling design. BMJ 2015; 350: h1798.
73. Bellantuono C et al. The safety of serotonin-noradrenaline reuptake inhibitors (SNRIs) in pregnancy and breastfeeding: a comprehensive review. Hum Psychopharmacol: Clin Experimental 2015; 30 (3): 143–51.
74. Lassen D, Ennis ZN, Damkier P. First‐Trimester Pregnancy Exposure to Venlafaxine or Duloxetine and Risk of Major Congenital Malformations: A Systematic Review. Basic Clin Pharmacol Toxicol 2016; 118 (1): 32–6.
75. Huybrechts KF et al. Preterm birth and antidepressant medication use during pregnancy: a systematic review and me-ta-analysis. PLoS One 2014; 9 (3): e92778.
76. Grigoriadis S et al. Prenatal exposure to antidepressants and persistent pulmonary hypertension of the newborn: systematic review and meta-analysis. BMJ 2014; 348: f6932.
77. Huybrechts KF et al. Antidepressant use late in preg-nancy and risk of persistent pulmonary hypertension of the newborn. JAMA 2015; 313 (21): 2142–51.
78. Grigoriadis S et al. Antidepressant exposure during pregnancy and congenital malformations: is there an association? A systematic review and meta-analysis of the best evidence. J Clin Psychiatry 2013; 74 (4): e293–e308.
79. Forsberg L et al. Neonatal Adaptation in Infants Prenatally Exposed to Antidepressants-Clinical Monitoring Using Neonatal Abstinence Score. PloS One 2014; 9 (11): e111327.
80. Man KKC et al. Exposure to selective serotonin reuptake inhibitors during pregnancy and risk of autism spectrum disorder in children: A systematic review and meta-analysis of observational studies. Neurosci Biobehavioral Rev 2015; 49: 82–9.
81. Christensen J, Parner ET, Vestergaard M. Antidepressant exposure in pregnancy and risk of autism spectrum disorders. Clin Epidemiol 2013; 5: 449–59.
82. Boukhris T et al. Antidepressant use during pregnancy and the risk of autism spectrum disorder in children. JAMA Pediatr 2015; р. 1–8.
83. Castro VM et al. Absence of evidence for increase in risk for autism or attention-deficit hyperactivity disorder following antidepressant exposure during pregnancy: a replication study. Translational Psychiatry 2016; 6 (1): e708.
84. Nulman I et al. Neurodevelopment of children following prenatal exposure to venlafaxine, selective serotonin reuptake inhibitors, or untreated maternal depression. Am J Psychiatry 2012; 169 (11): 1165–74.
85. Santucci AK et al. Impact of prenatal exposure to serotonin reuptake inhibitors or maternal major depressive disorder on infant developmental outcomes. J Clin Psychiatry 2014; 75 (10): 1088–95.
86. Handal M et al. Motor development in children prenatally exposed to selective serotonin reuptake inhibitors: a large population‐based pregnancy cohort study. BJOG 2016; 123 (12): 1908–17.
87. Rounds M. The fetal safety of benzodiazepines: an updated meta-analysis. J Obstet Gynaecol Can 2011; 33 (1): 46–8.
88. Ban L et al. First trimester exposure to anxiolytic and hypnotic drugs and the risks of major congenital anomalies: a United Kingdom population-based cohort study. PloS One 2014; 9 (6): e100996.
89. Wikner BN, Källén B. Are hypnotic benzodiazepine receptor agonists teratogenic in humans? J Clin Psychopharmacol 2011; 31 (3): 356–9.
90. Wang LH et al. Increased risk of adverse pregnancy out-comes in women receiving zolpidem during pregnancy. Clinl Pharmacol Ther 2010; 88 (3).
91. World health organization. Global strategy for infant and young child feeding. Geneva, 2003.
92. Hale TW, Hilary E. Rowe. Medications and mothers' milk. Pharmasoft Medical Pub., 2004. Lutz UC et al. Aripiprazole in pregnancy and lactation: a case report. J Clin Psychopharmacol 2010; 30 (2): 204–5.
93. Teoh S et al. Estimation of rac-amisulpride transfer into milk and of infant dose via milk during its use in a lactating woman with bipolar disorder and schizophrenia. Breastfeeding Med 2011; 6 (2): 85–8.
94. Dev VJ, Krupp P. Adverse event profile and safety of clozapine. Rev Contemp Pharmacother 1995; 6: 197–208.
95. Tripathi BM, Majumder P. Lactating mother and psychotropic drugs. Mens Sana Monographs 2010; 8 (1): 83.
96. Oystein Berle J, Spigset O. Antidepressant use during breastfeeding. Cur Women's Health Rev 2011; 7 (1): 28–34.
97. Sivertz K, Kostaras X. The use of psychotropic medications in pregnancy and lactation. BC Med J 2005; 47: 135–8.
98. Burt VK et al. The use of psychotropic medications during breast-feeding. Am J Psychiatry 2001; 158 (7): 1001–9.
20 августа 2018
Количество просмотров: 4218

