Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2018
Участие цитокинов (провоспалительных и противовоспалительных интерлейкинов) в развитии депрессивных расстройств №05 2018
Номера страниц в выпуске:9-12
Данный обзор подготовлен по материалам 30-го Конгресса Европейского колледжа нейропсихофармакологии (сентябрь 2017 г., Париж) участником проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании “Сервье”» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»).
В статье изложены материалы, посвященные цитокиновой гипотезе формирования депрессии, в основе которой лежит предположение о том, что аффективные нарушения могут возникать вследствие секреции цитокинов, ассоциированных с активацией иммунной системы, которые были представлены на 30-м Конгрессе Европейского колледжа нейропсихофармакологии в Париже (Франция), 2–5 сентября 2017 г.
Ключевые слова: цитокины, цитокиновая гипотеза, депрессия, депрессивные расстройства.
Для цитирования: Федченко В.Ю. Участие цитокинов (провоспалительных и противовоспалительных интерлейкинов) в развитии депрессивных расстройств. Психиатрия и психофармакотерапия. 2018; 20 (5): 9–12.
В статье изложены материалы, посвященные цитокиновой гипотезе формирования депрессии, в основе которой лежит предположение о том, что аффективные нарушения могут возникать вследствие секреции цитокинов, ассоциированных с активацией иммунной системы, которые были представлены на 30-м Конгрессе Европейского колледжа нейропсихофармакологии в Париже (Франция), 2–5 сентября 2017 г.
Ключевые слова: цитокины, цитокиновая гипотеза, депрессия, депрессивные расстройства.
Для цитирования: Федченко В.Ю. Участие цитокинов (провоспалительных и противовоспалительных интерлейкинов) в развитии депрессивных расстройств. Психиатрия и психофармакотерапия. 2018; 20 (5): 9–12.
Данный обзор подготовлен по материалам 30-го Конгресса Европейского колледжа нейропсихофармакологии (сентябрь 2017 г., Париж) участником проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании “Сервье”» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»).
В статье изложены материалы, посвященные цитокиновой гипотезе формирования депрессии, в основе которой лежит предположение о том, что аффективные нарушения могут возникать вследствие секреции цитокинов, ассоциированных с активацией иммунной системы, которые были представлены на 30-м Конгрессе Европейского колледжа нейропсихофармакологии в Париже (Франция), 2–5 сентября 2017 г.
Ключевые слова: цитокины, цитокиновая гипотеза, депрессия, депрессивные расстройства.
Для цитирования: Федченко В.Ю. Участие цитокинов (провоспалительных и противовоспалительных интерлейкинов) в развитии депрессивных расстройств. Психиатрия и психофармакотерапия. 2018; 20 (5): 9–12.
Institute of Neurology, Psychiatry and Narcology of the National Academy of Medical Sciences of Ukraine. 61068, Ukraine, Kharkov, ul. Akademika Pavlova 46
vfedchenko83@ukr.net
The article presents materials on the cytokine hypothesis of the formation of depression, which is based on the that affective disorders may occur due to the secretion of cytokines associated with the activation of immune system, presented at the 30th Congress of the European College of Neuropsychopharmacology in Paris (France), 2–5 September 2017.
Key words: cytokines, cytokine hypothesis, depression, depressive disorders.
For citation: Fedchenko V.Yu. Participation of cytokines (pro-inflammatory and anti-inflammatory interleukins) in the development. Psychiatry and Psychopharmacotherapy. 2018; 20 (5): 9–12.
Актуальной версией цитокиновой гипотезы формирования депрессии является идея о развитии цитокиновой активации непосредственно в мозге. В соответствии с этой моделью, иммунное воздействие на периферии вызывает синтез или появление цитокинов и их рецепторов в паренхиме мозга, что может приводить к хроническому локальному воспалительному процессу в областях мозга, ответственных за депрессивные симптомы [1 –4].
В то же время преимущественно обсуждается участие монокинов, к которым относятся интерлейкин (ИЛ)-1, ИЛ-6 и фактор некроза опухоли (ФНО)-a, однако имеющиеся данные достаточно противоречивы. В ранних исследованиях авторы указывали на снижение иммунной функции у лиц с депрессией [5]. Согласно более поздним источникам, у этой категории пациентов предполагалась иммунная активация [6].
Как известно, цитокины представляют собой низкомолекулярные информационные растворимые белки, обеспечивающие передачу сигналов между клетками. Синтезированный цитокин выделяется на поверхность клетки и взаимодействует с рецепторами соседних клеток. Активация зоны воспаления проявляется в том, что клетки начинают синтезировать и выделять множество цитокинов, среди которых различают те, которые способствуют (провоспалительные), и те, которые препятствуют развитию воспалительного процесса (противовоспалительные). Соотношение между противовоспалительными и провоспалительными цитокинами – важный момент в регуляции возникновения и развития воспалительного процесса. От этого баланса зависит и течение болезни, и ее исход. При воздействии цитокинов на центральную нервную систему (ЦНС) меняется весь комплекс поведенческих реакций, происходит изменение синтеза большинства гормонов, синтеза белков и состава плазмы. При этом происходящие изменения имеют не случайный характер: они либо необходимы для повышения защитных реакций, либо способствуют переключению энергии организма на борьбу с патогенным воздействием [7–10].
Результаты новейших исследований, представленные в докладе L.Capuron (Франция) «Роль воспаления в нейропсихиатрических исследовательских доменах» в рамках симпозиума «Причины и последствия воспаления при биполярном расстройстве», убедительно демонстрируют, что воспаление вторглось в область психиатрии. Представление о том, что цитокины повышены при различных аффективных и психотических расстройствах, выдвигает на первый план необходимость определения точных Исследовательских критериев доменов (Research Domain Criteria), за которые отвечает воспаление. Эта задача, безусловно, самая передовая в сфере изучения большого депрессивного расстройства (БДР) и позволяет перейти к дименсиональным подходам, интегрирующим нейронауки и психопатологию. Немногочисленные клинические и преклинические исследования показали, что воспаление может вызывать симптомы депрессии, и наоборот, антагонисты цитокинов могут ослаблять симптомы депрессии у пациентов с соматическими и психическими заболеваниями при низком уровне хронического воспаления. Существенные знания были получены в отношении дименсии симптомов, которые стимулируют воспаление, и механизмов действия цитокинов в головном мозге, выдвигая новые цели для исследований и разработок в области лекарственных средств [11, 12].
В течение нескольких последних десятилетий исследования в области, называемой «психонейроиммунология», продемонстрировали сложную сеть реципрокных взаимодействий между иммунной системой и мозгом. Изменения в иммунной функции были обнаружены у пациентов с БДР и включают ранние сообщения об иммунной супрессии (например, снижение активности естественных киллерных клеток и снижение пролиферации лимфоцитов) с последующим доказательством повышенной воспалительной активности, например увеличение циркулирующих уровней воспалительных маркеров (Z.Kronfol и соавт., 1983; Irwin и Gillin, 1987; Maes и соавт., 1993; Anisman и соавт., 1999; Zorilla и соавт., 2001).
Большая часть недавнего интереса к роли иммунной системы в патогенезе депрессии сосредоточена на усилении воспаления, связанного с аффективными нарушениями. Провоспалительные цитокины, включая ИЛ-1, ИЛ-6 и ФНО-a, высвобождаются активированными иммунными клетками во время реакции организма на инвазию патогенов, а также в контексте повреждения тканей и психосоциального стресса. Эти растворимые факторы, по-видимому, представляют собой первичные медиаторы связи между иммунной системой и головным мозгом и не только помогают организовать клеточные реакции на иммунный вызов, но также координируют поведенческие изменения, необходимые для восстановления. Во время иммунного вызова высвобождение провоспалительных цитокинов обычно является промежуточным и регулируется противовоспалительными механизмами. Следовательно, поведенческие эффекты, вызванные активацией воспалительного ответа, развиваются как адаптивная, временная и контролируемая реакция ЦНС на иммунные сигналы. Тем не менее, когда иммунный вызов становится хроническим и/или нерегулируемым, как это наблюдается у пациентов, получающих длительную терапию цитокинами или пациентов с хроническими заболеваниями и/или стрессом, поведенческие эффекты цитокинов и результирующий воспалительный ответ могут способствовать развитию соответствующих клинических поведенческих симптомов и нейропсихиатрических заболеваний, включая БДР.
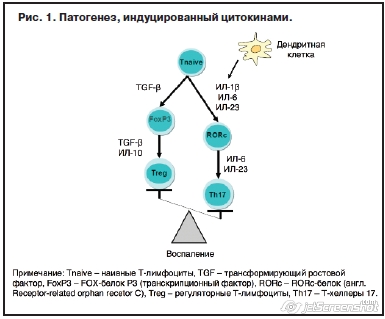 Как только сигналы цитокинов достигают мозга, они могут взаимодействовать практически с каждой патофизиологической областью, относящейся к регуляции настроения (рис. 1). К ним относятся эффекты на нейросхемы, которые регулируют двигательную активность и мотивацию (базальные ганглии), настроение, беспокойство, возбуждение и тревогу (передняя цингулярная кора); воздействие на факторы роста, такие как нейротрофический фактор мозга, нейрогенез и, в конечном счете, синаптическая пластичность; эффекты на метаболизм моноаминовых нейротрансмиттеров, таких как серотонин и допамин, а также возбуждающие аминокислотные нейротрансмиттеры, такие как глутамат; и эффекты на нейроэндокринную функцию, приводящую к глюкокортикоидной резистентности и изменению секреции глюкокортикоида.
Как только сигналы цитокинов достигают мозга, они могут взаимодействовать практически с каждой патофизиологической областью, относящейся к регуляции настроения (рис. 1). К ним относятся эффекты на нейросхемы, которые регулируют двигательную активность и мотивацию (базальные ганглии), настроение, беспокойство, возбуждение и тревогу (передняя цингулярная кора); воздействие на факторы роста, такие как нейротрофический фактор мозга, нейрогенез и, в конечном счете, синаптическая пластичность; эффекты на метаболизм моноаминовых нейротрансмиттеров, таких как серотонин и допамин, а также возбуждающие аминокислотные нейротрансмиттеры, такие как глутамат; и эффекты на нейроэндокринную функцию, приводящую к глюкокортикоидной резистентности и изменению секреции глюкокортикоида.
Две развивающиеся теории патофизиологии депрессии связаны с чрезмерной активацией воспалительных путей и изменениями в метаболизме глутамата [13–15]. Например, повышение воспалительных маркеров достоверно обнаруживается в периферической крови и цереброспинальной жидкости пациентов с униполярной и биполярной депрессиями [13, 16, 17]. Кроме того, было показано, что введение воспалительных стимулов, таких как интерферон a, тифозная вакцинация или эндотоксин, приводит к поведенческим изменениям, которые характеризуют эти расстройства, включая подавленное настроение, ангедонию и психомоторную ретардацию [18–23]. Наконец, обнаружено, что ингибирование воспалительных цитокинов снижало депрессивное настроение у нескольких популяций пациентов [24, 25]. Интересно, что эти два пути могут быть связаны, однако неизвестно, связано ли повышенное воспаление с повышенным глутаматом среди пациентов с БДР.
Для ответа на этот вопрос E.Haroon (2016 г.) было проведено исследование, в котором с помощью магнитно-резонансной спектроскопии измерялись абсолютные концентрации глутамата в базальных ганглиях и дорсальной передней цингулярной коре (dACC) и оценивались воспалительные маркеры плазмы и цереброспинальной жидкости. В исследование были включены 50 лиц в возрасте 21–65 лет с диагнозом БДР или биполярного расстройства в депрессивной фазе на основе использования структурированного клинического интервью для DSM-IV (Structured Clinical Interview for Diagnostic and Statistical Manual-IV-TR) [26].
Установлено, что повышенный C-реактивный белок плазмы (СРБ) был достоверно связан с увеличением глутамата левого базального ганглия, контролирующего возраст, пол, расу, индекс массы тела, статус курения и тяжесть протекания депрессии. В свою очередь, глутамат левых базальных ганглиев ассоциировался с ангедонией и психомоторной ретардацией. Плазменный и цереброспинальный СРБ также были связаны с концентрацией глутамата базальных ганглиев и глиального маркера мио-инозитола. При этом плазменный СРБ не был связан с глутаматом dACC. Эти данные свидетельствуют о том, что усиление воспаления при БДР может приводить к увеличению глутамата в базальных ганглиях в связи с глиальной дисфункцией, и терапевтические стратегии, направленные на глутамат, могут быть преимущественно эффективными у этой категории пациентов.
Предыдущие данные продемонстрировали, что введение воспалительных цитокинов или их индукторов может приводить к нарушению функции базальных ганглиев, связанной, в частности, со снижением психомоторной скорости. Сниженная психомоторная скорость, которую клинически называют психомоторной задержкой или ретардацией, является одним из ключевых симптомом БДР и связана с плохим ответом на антидепрессанты. Поэтому D.Goldsmith (2016 г.) исследовал связь между воспалительными маркерами плазмы и психомоторной скоростью у 93 пациентов в возрасте 21–65 лет с первичным диагнозом БДР, не получавших терапию. Психомоторная скорость оценивалась с помощью ряда нейропсихологических тестов от непосредственно двигательных задач, например, латентности движения и прикосновения пальцев (Finger Tapping Task– FTT), до тех, которые включали двигательную активность с вовлечением когнитивных функций и участия коры (например, трейл-тесты А – Trails A) и цифровая замена символов (Digit Symbol Substitution Task – DSST) [27].
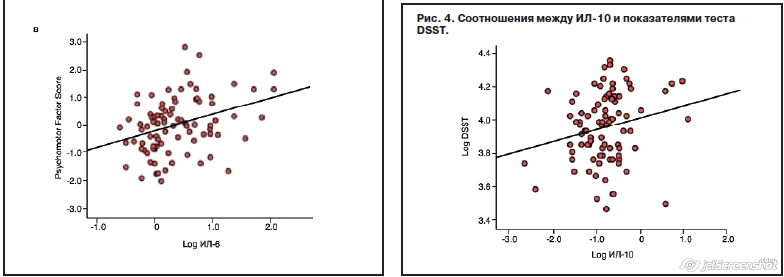
Были проведены линейные регрессионные анализы для определения взаимосвязи показателей воспалительных маркеров и эффективности психомоторных задач, определяющих возраст, расу, пол, образование, индекс массы тела и тяжесть депрессии. У пациентов с БДР наблюдалось снижение психомоторной скорости по всем задачам относительно нормативных стандартов. При помощи Кембриджской автоматизированной батареи нейропсихологических тестов (CANTAB) установлено, что увеличенный ИЛ-6 был связан с уменьшением производительности при простых и сложных двигательных задачах (r=0,25 при p=0,015 и r=0,24 при p=0,026 соответственно), в то время как моноцитарный хемотаксический фактор-1 (MCP-1) был связан с пониженной производительностью при задании касания пальцев и по DSST (r=-0,26 при p=0,015 и r=-0,28 при p=0,006 соответственно); рис. 2, 3. ИЛ-10 был связан с увеличением производительности по DSST (r=0,21 при p=0,046); рис. 4. В аналитическом анализе основных компонентов, включая все психомоторные задачи, ИЛ-6 был связан с фактором психомоторной скорости (r=0,34 при p=0,001); см. рис. 2. Полученные данные демонстрируют, что периферический воспалительный профиль, включающий увеличенные ИЛ-6 и MCP-1, последовательно связан с психомоторной скоростью при БДР.
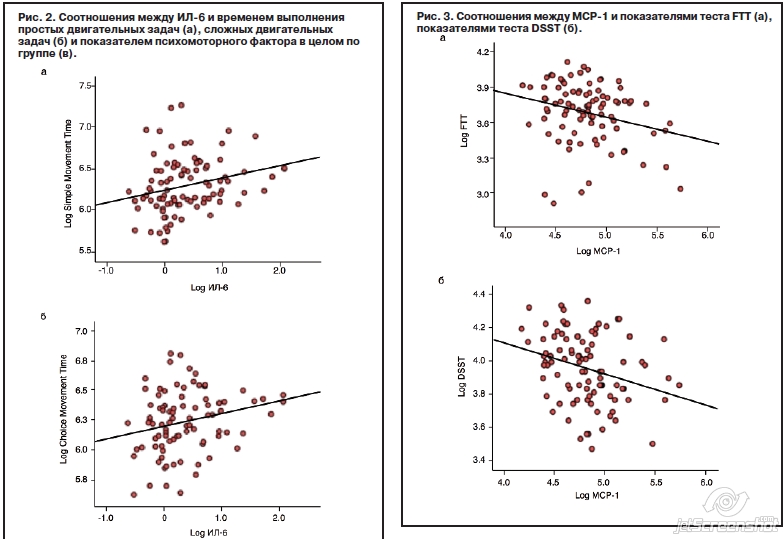
Следовательно, результаты этого исследования предоставляют дополнительные доказательства того, что периферические воспалительные маркеры у пациентов с БДР могут способствовать психомоторной ретардации, которая является первичным симптомом расстройства и связана с отсутствием ответа на терапию, а также согласуются с представлениями о том, что цитокины влияют на базальные ганглии и допаминергические пути, регулирующие двигательную активность. В совокупности эти данные показывают, что психомоторная скорость может служить подходящей переменной для оценки результата последующих исследований, направленных на изучение иммунной системы, особенно ИЛ-6, для лечения нейропсихиатрических расстройств, характеризующихся повышенным воспалением.
Таким образом, основываясь на модели индуцированной воспалением депрессии в клинических и преклинических условиях, идентифицированы различные патофизиологические пути метаболизма нейротрансмиттеров, имеющих особое значение для развития симптомокомплексов, которые являются общими для различных нейропсихиатрических и нейродегенеративных состояний, охватывающих соответственно настроение/когнитивные симптомы и нейровегетативные/мотивационные изменения. Более того, конвергентные данные показывают, что взаимодействие воспалительных процессов (и их влияние на пути нейротрансмиттера) с соответствующими факторами уязвимости, включая особенности личности, стресс, метаболические и нейроэндокринные факторы, в конечном итоге модулируют симптомы нейропсихиатрического воспаления. В целом эти данные делают воспаление ключевым фактором в психопатологии. Соответственно, разработка терапевтических стратегий, направленных на воспаление и специфическое модулирование путей и систем, посредством которых воспалительные процессы избирательно влияют на метаболизм и функцию нейротрансмиттера, будет иметь особое значение для профилактики и лечения специфических доменов нейропсихиатрических симптомов в перспективе разработки персонализированных и прецизионных методов терапии в психиатрии.
Сведения об авторе
Федченко Виктория Юрьевна – ст. науч. сотр. ГУ ИНПН НАМН Украины. E-mail: vfedchenko83@ukr.net
В статье изложены материалы, посвященные цитокиновой гипотезе формирования депрессии, в основе которой лежит предположение о том, что аффективные нарушения могут возникать вследствие секреции цитокинов, ассоциированных с активацией иммунной системы, которые были представлены на 30-м Конгрессе Европейского колледжа нейропсихофармакологии в Париже (Франция), 2–5 сентября 2017 г.
Ключевые слова: цитокины, цитокиновая гипотеза, депрессия, депрессивные расстройства.
Для цитирования: Федченко В.Ю. Участие цитокинов (провоспалительных и противовоспалительных интерлейкинов) в развитии депрессивных расстройств. Психиатрия и психофармакотерапия. 2018; 20 (5): 9–12.
Participation of cytokines (pro-inflammatory and anti-inflammatory interleukins) in the development
V.Yu.FedchenkoInstitute of Neurology, Psychiatry and Narcology of the National Academy of Medical Sciences of Ukraine. 61068, Ukraine, Kharkov, ul. Akademika Pavlova 46
vfedchenko83@ukr.net
The article presents materials on the cytokine hypothesis of the formation of depression, which is based on the that affective disorders may occur due to the secretion of cytokines associated with the activation of immune system, presented at the 30th Congress of the European College of Neuropsychopharmacology in Paris (France), 2–5 September 2017.
Key words: cytokines, cytokine hypothesis, depression, depressive disorders.
For citation: Fedchenko V.Yu. Participation of cytokines (pro-inflammatory and anti-inflammatory interleukins) in the development. Psychiatry and Psychopharmacotherapy. 2018; 20 (5): 9–12.
Актуальной версией цитокиновой гипотезы формирования депрессии является идея о развитии цитокиновой активации непосредственно в мозге. В соответствии с этой моделью, иммунное воздействие на периферии вызывает синтез или появление цитокинов и их рецепторов в паренхиме мозга, что может приводить к хроническому локальному воспалительному процессу в областях мозга, ответственных за депрессивные симптомы [1 –4].
В то же время преимущественно обсуждается участие монокинов, к которым относятся интерлейкин (ИЛ)-1, ИЛ-6 и фактор некроза опухоли (ФНО)-a, однако имеющиеся данные достаточно противоречивы. В ранних исследованиях авторы указывали на снижение иммунной функции у лиц с депрессией [5]. Согласно более поздним источникам, у этой категории пациентов предполагалась иммунная активация [6].
Как известно, цитокины представляют собой низкомолекулярные информационные растворимые белки, обеспечивающие передачу сигналов между клетками. Синтезированный цитокин выделяется на поверхность клетки и взаимодействует с рецепторами соседних клеток. Активация зоны воспаления проявляется в том, что клетки начинают синтезировать и выделять множество цитокинов, среди которых различают те, которые способствуют (провоспалительные), и те, которые препятствуют развитию воспалительного процесса (противовоспалительные). Соотношение между противовоспалительными и провоспалительными цитокинами – важный момент в регуляции возникновения и развития воспалительного процесса. От этого баланса зависит и течение болезни, и ее исход. При воздействии цитокинов на центральную нервную систему (ЦНС) меняется весь комплекс поведенческих реакций, происходит изменение синтеза большинства гормонов, синтеза белков и состава плазмы. При этом происходящие изменения имеют не случайный характер: они либо необходимы для повышения защитных реакций, либо способствуют переключению энергии организма на борьбу с патогенным воздействием [7–10].
Результаты новейших исследований, представленные в докладе L.Capuron (Франция) «Роль воспаления в нейропсихиатрических исследовательских доменах» в рамках симпозиума «Причины и последствия воспаления при биполярном расстройстве», убедительно демонстрируют, что воспаление вторглось в область психиатрии. Представление о том, что цитокины повышены при различных аффективных и психотических расстройствах, выдвигает на первый план необходимость определения точных Исследовательских критериев доменов (Research Domain Criteria), за которые отвечает воспаление. Эта задача, безусловно, самая передовая в сфере изучения большого депрессивного расстройства (БДР) и позволяет перейти к дименсиональным подходам, интегрирующим нейронауки и психопатологию. Немногочисленные клинические и преклинические исследования показали, что воспаление может вызывать симптомы депрессии, и наоборот, антагонисты цитокинов могут ослаблять симптомы депрессии у пациентов с соматическими и психическими заболеваниями при низком уровне хронического воспаления. Существенные знания были получены в отношении дименсии симптомов, которые стимулируют воспаление, и механизмов действия цитокинов в головном мозге, выдвигая новые цели для исследований и разработок в области лекарственных средств [11, 12].
В течение нескольких последних десятилетий исследования в области, называемой «психонейроиммунология», продемонстрировали сложную сеть реципрокных взаимодействий между иммунной системой и мозгом. Изменения в иммунной функции были обнаружены у пациентов с БДР и включают ранние сообщения об иммунной супрессии (например, снижение активности естественных киллерных клеток и снижение пролиферации лимфоцитов) с последующим доказательством повышенной воспалительной активности, например увеличение циркулирующих уровней воспалительных маркеров (Z.Kronfol и соавт., 1983; Irwin и Gillin, 1987; Maes и соавт., 1993; Anisman и соавт., 1999; Zorilla и соавт., 2001).
Большая часть недавнего интереса к роли иммунной системы в патогенезе депрессии сосредоточена на усилении воспаления, связанного с аффективными нарушениями. Провоспалительные цитокины, включая ИЛ-1, ИЛ-6 и ФНО-a, высвобождаются активированными иммунными клетками во время реакции организма на инвазию патогенов, а также в контексте повреждения тканей и психосоциального стресса. Эти растворимые факторы, по-видимому, представляют собой первичные медиаторы связи между иммунной системой и головным мозгом и не только помогают организовать клеточные реакции на иммунный вызов, но также координируют поведенческие изменения, необходимые для восстановления. Во время иммунного вызова высвобождение провоспалительных цитокинов обычно является промежуточным и регулируется противовоспалительными механизмами. Следовательно, поведенческие эффекты, вызванные активацией воспалительного ответа, развиваются как адаптивная, временная и контролируемая реакция ЦНС на иммунные сигналы. Тем не менее, когда иммунный вызов становится хроническим и/или нерегулируемым, как это наблюдается у пациентов, получающих длительную терапию цитокинами или пациентов с хроническими заболеваниями и/или стрессом, поведенческие эффекты цитокинов и результирующий воспалительный ответ могут способствовать развитию соответствующих клинических поведенческих симптомов и нейропсихиатрических заболеваний, включая БДР.
 Как только сигналы цитокинов достигают мозга, они могут взаимодействовать практически с каждой патофизиологической областью, относящейся к регуляции настроения (рис. 1). К ним относятся эффекты на нейросхемы, которые регулируют двигательную активность и мотивацию (базальные ганглии), настроение, беспокойство, возбуждение и тревогу (передняя цингулярная кора); воздействие на факторы роста, такие как нейротрофический фактор мозга, нейрогенез и, в конечном счете, синаптическая пластичность; эффекты на метаболизм моноаминовых нейротрансмиттеров, таких как серотонин и допамин, а также возбуждающие аминокислотные нейротрансмиттеры, такие как глутамат; и эффекты на нейроэндокринную функцию, приводящую к глюкокортикоидной резистентности и изменению секреции глюкокортикоида.
Как только сигналы цитокинов достигают мозга, они могут взаимодействовать практически с каждой патофизиологической областью, относящейся к регуляции настроения (рис. 1). К ним относятся эффекты на нейросхемы, которые регулируют двигательную активность и мотивацию (базальные ганглии), настроение, беспокойство, возбуждение и тревогу (передняя цингулярная кора); воздействие на факторы роста, такие как нейротрофический фактор мозга, нейрогенез и, в конечном счете, синаптическая пластичность; эффекты на метаболизм моноаминовых нейротрансмиттеров, таких как серотонин и допамин, а также возбуждающие аминокислотные нейротрансмиттеры, такие как глутамат; и эффекты на нейроэндокринную функцию, приводящую к глюкокортикоидной резистентности и изменению секреции глюкокортикоида.Две развивающиеся теории патофизиологии депрессии связаны с чрезмерной активацией воспалительных путей и изменениями в метаболизме глутамата [13–15]. Например, повышение воспалительных маркеров достоверно обнаруживается в периферической крови и цереброспинальной жидкости пациентов с униполярной и биполярной депрессиями [13, 16, 17]. Кроме того, было показано, что введение воспалительных стимулов, таких как интерферон a, тифозная вакцинация или эндотоксин, приводит к поведенческим изменениям, которые характеризуют эти расстройства, включая подавленное настроение, ангедонию и психомоторную ретардацию [18–23]. Наконец, обнаружено, что ингибирование воспалительных цитокинов снижало депрессивное настроение у нескольких популяций пациентов [24, 25]. Интересно, что эти два пути могут быть связаны, однако неизвестно, связано ли повышенное воспаление с повышенным глутаматом среди пациентов с БДР.
Для ответа на этот вопрос E.Haroon (2016 г.) было проведено исследование, в котором с помощью магнитно-резонансной спектроскопии измерялись абсолютные концентрации глутамата в базальных ганглиях и дорсальной передней цингулярной коре (dACC) и оценивались воспалительные маркеры плазмы и цереброспинальной жидкости. В исследование были включены 50 лиц в возрасте 21–65 лет с диагнозом БДР или биполярного расстройства в депрессивной фазе на основе использования структурированного клинического интервью для DSM-IV (Structured Clinical Interview for Diagnostic and Statistical Manual-IV-TR) [26].
Установлено, что повышенный C-реактивный белок плазмы (СРБ) был достоверно связан с увеличением глутамата левого базального ганглия, контролирующего возраст, пол, расу, индекс массы тела, статус курения и тяжесть протекания депрессии. В свою очередь, глутамат левых базальных ганглиев ассоциировался с ангедонией и психомоторной ретардацией. Плазменный и цереброспинальный СРБ также были связаны с концентрацией глутамата базальных ганглиев и глиального маркера мио-инозитола. При этом плазменный СРБ не был связан с глутаматом dACC. Эти данные свидетельствуют о том, что усиление воспаления при БДР может приводить к увеличению глутамата в базальных ганглиях в связи с глиальной дисфункцией, и терапевтические стратегии, направленные на глутамат, могут быть преимущественно эффективными у этой категории пациентов.
Предыдущие данные продемонстрировали, что введение воспалительных цитокинов или их индукторов может приводить к нарушению функции базальных ганглиев, связанной, в частности, со снижением психомоторной скорости. Сниженная психомоторная скорость, которую клинически называют психомоторной задержкой или ретардацией, является одним из ключевых симптомом БДР и связана с плохим ответом на антидепрессанты. Поэтому D.Goldsmith (2016 г.) исследовал связь между воспалительными маркерами плазмы и психомоторной скоростью у 93 пациентов в возрасте 21–65 лет с первичным диагнозом БДР, не получавших терапию. Психомоторная скорость оценивалась с помощью ряда нейропсихологических тестов от непосредственно двигательных задач, например, латентности движения и прикосновения пальцев (Finger Tapping Task– FTT), до тех, которые включали двигательную активность с вовлечением когнитивных функций и участия коры (например, трейл-тесты А – Trails A) и цифровая замена символов (Digit Symbol Substitution Task – DSST) [27].
Были проведены линейные регрессионные анализы для определения взаимосвязи показателей воспалительных маркеров и эффективности психомоторных задач, определяющих возраст, расу, пол, образование, индекс массы тела и тяжесть депрессии. У пациентов с БДР наблюдалось снижение психомоторной скорости по всем задачам относительно нормативных стандартов. При помощи Кембриджской автоматизированной батареи нейропсихологических тестов (CANTAB) установлено, что увеличенный ИЛ-6 был связан с уменьшением производительности при простых и сложных двигательных задачах (r=0,25 при p=0,015 и r=0,24 при p=0,026 соответственно), в то время как моноцитарный хемотаксический фактор-1 (MCP-1) был связан с пониженной производительностью при задании касания пальцев и по DSST (r=-0,26 при p=0,015 и r=-0,28 при p=0,006 соответственно); рис. 2, 3. ИЛ-10 был связан с увеличением производительности по DSST (r=0,21 при p=0,046); рис. 4. В аналитическом анализе основных компонентов, включая все психомоторные задачи, ИЛ-6 был связан с фактором психомоторной скорости (r=0,34 при p=0,001); см. рис. 2. Полученные данные демонстрируют, что периферический воспалительный профиль, включающий увеличенные ИЛ-6 и MCP-1, последовательно связан с психомоторной скоростью при БДР.


Следовательно, результаты этого исследования предоставляют дополнительные доказательства того, что периферические воспалительные маркеры у пациентов с БДР могут способствовать психомоторной ретардации, которая является первичным симптомом расстройства и связана с отсутствием ответа на терапию, а также согласуются с представлениями о том, что цитокины влияют на базальные ганглии и допаминергические пути, регулирующие двигательную активность. В совокупности эти данные показывают, что психомоторная скорость может служить подходящей переменной для оценки результата последующих исследований, направленных на изучение иммунной системы, особенно ИЛ-6, для лечения нейропсихиатрических расстройств, характеризующихся повышенным воспалением.
Таким образом, основываясь на модели индуцированной воспалением депрессии в клинических и преклинических условиях, идентифицированы различные патофизиологические пути метаболизма нейротрансмиттеров, имеющих особое значение для развития симптомокомплексов, которые являются общими для различных нейропсихиатрических и нейродегенеративных состояний, охватывающих соответственно настроение/когнитивные симптомы и нейровегетативные/мотивационные изменения. Более того, конвергентные данные показывают, что взаимодействие воспалительных процессов (и их влияние на пути нейротрансмиттера) с соответствующими факторами уязвимости, включая особенности личности, стресс, метаболические и нейроэндокринные факторы, в конечном итоге модулируют симптомы нейропсихиатрического воспаления. В целом эти данные делают воспаление ключевым фактором в психопатологии. Соответственно, разработка терапевтических стратегий, направленных на воспаление и специфическое модулирование путей и систем, посредством которых воспалительные процессы избирательно влияют на метаболизм и функцию нейротрансмиттера, будет иметь особое значение для профилактики и лечения специфических доменов нейропсихиатрических симптомов в перспективе разработки персонализированных и прецизионных методов терапии в психиатрии.
Сведения об авторе
Федченко Виктория Юрьевна – ст. науч. сотр. ГУ ИНПН НАМН Украины. E-mail: vfedchenko83@ukr.net
Список исп. литературыСкрыть список1. Brites D, Fernandes A. Neuroinflammation and Depression: Microglia Activation, Extracellular Microvesicles and microRNA Dysregulation. Front Cell Neurosci 2015; 9: 476. DOI: 10.3389/fncel.2015.00476
2. Dantzer R, O’Connor JC, Freund GG et al. From inflammation to sickness and depression: when the immune system subjugates the brain. Nat Rev Neurosci 2008; 9: 46–56.
3. Eyre H, Baune BT. Neuroplastic changes in depression: a role for the immune system. Psychoneuroendocrinology 2012; 37: 1397–416.
4. Van Heesch F. Inflammation-induced depression. Studying the role of proinflammatory cytokines in anhedonia. In: Depressief door je afweersysteem. De Volkskrant, 2014; p. 18.
5. Weisse CS. Depression and immunocompetence, a review of the literature. Psych Bull 1992; 111: 475–89.
6. Kronfol Z. Immune dysregulation in major depression: a critical review of exesting evidence. Int J Neuropsychopharmacol 2002; 5: 333–43.
7. Jo WK, Zhang Y, Emrich HM, Dietrich DE. Glia in the cytokine-mediated onset of depression: fine tuning the immune response. Front Cell Neurosci 2015; 9: 268.
8. Raison CL, Capuron L, Miller AH. Cytokines sing the blues: inflammation and the pathogenesis of depression. Trends Immunol 2006; 27: 24–31.
9. Song C, Wang H. Cytokines mediated inflammation and decreased neurogenesis in animal models of depression. Prog Neuropsychopharmacol Biol Psychiatry 2011; 35: 760–8.
10. Xanthos DN, Sandkuhler J. Neurogenic neuroinflammation: inflammatory CNS reactions in response to neuronal activity. Nat Rev Neurosci 2014; 15: 43–53.
11. Capuron L, Miller AH, Immune system to brain signaling: neuropsychopharmacological implications. Pharmacol Ther 2011; 130 (2): 226–38. DOI: 10.1016/j.pharmthera.2011.01.014
12. Capuron L, Castanon N, Role of inflammation in the development of neuropsychiatric symptom domains: evidence and mechanisms. Curr Top Behav Neurosci 2017; 31: 31–44. DOI: 10.1007/7854_2016_14
13. Miller AH, Maletic V, Raison CL. Inflammation and its discontents: the role of cytokines in the pathophysiology of major depression. Biol Psychiatry 2009; 65: 732–41.
14. Sanacora G, Banasr M. From pathophysiology to novel antidepressant drugs: glial contributions to the pathology and treatment of mood disorders. Biol Psychiatry 2013; 73: 1172–9.
15. Sanacora G, Treccani G, Popoli M. Towards a glutamate hypothesis of depression: an emerging frontier of neuropsychopharmacology for mood disorders. Neuropharmacology 2012; 62: 63–77.
16. Stertz L, Magalhaes PV, Kapczinski F. Is bipolar disorder an inflammatory condition? The relevance of microglial activation. Curr Opin Psychiatry 2013; 26: 19–26.
17. Herrmann N, Swardfager W, Liu H et al. A meta-analysis of cytokines in major depression. Biol Psychiatry 2010; 67: 446–57.
18. Brydon L, Harrison NA, Walker C et al. Peripheral inflammation is associated with altered substantia nigra activity and psychomotor slowing in humans. Biol Psychiatry 2008; 63: 1022–9.
19. Raison CL, Borisov AS, Woolwine BJ et al. Interferon-alpha effects on diurnal hypothalamic-pituitary-adrenal axis activity: relationship with proinflammatory cytokines and behavior. Mol Psychiatry 2010; 15: 535–47.
20. Eisenberger NI, Berkman ET, Inagaki TK et al. Inflammation-induced anhedonia: endotoxin reduces ventral striatum responses to reward. Biol Psychiatry 2010; 68: 748–54.
21. Harrison NA, Brydon L, Walker C et al. Inflammation causes mood changes through alterations in subgenual cingulate activity and mesolimbic connectivity. Biol Psychiatry 2009; 66: 407–14.
22. Harrison NA, Brydon L, Walker C et al. Neural origins of human sickness in interoceptive responses to inflammation. Biol Psychiatry 2009; 66: 415–22.
23. Raison CL, Rutherford RE, Woolwine BJ et al. A randomized controlled trial of the tumor necrosis factor antagonist infliximab for treatment-resistant depression: the role of baseline inflammatory biomarkers. JAMA Psychiatry 2013; 70: 31–41.
24. Tyring S, Gottlieb A, Papp K et al. Etanercept and clinical outcomes, fatigue, and depression in psoriasis: double-blind placebo-controlled randomised phase III trial. Lancet 2006; 367: 29–35.
25. Monk JP, Phillips G, Waite R et al. Assessment of tumor necrosis factor alpha blockade as an intervention to improve tolerability of dose-intensive chemotherapy in cancer patients. J Clin Oncol 2006; 24: 1852–9.
26. Haroon E, Fleischer CC, Felger JC et al. Conceptual convergence: increased inflammation is associated with increased basal ganglia glutamate in patients with major depression. Molecular Psychiatry 2016; 21: 1351–57.
27. Goldsmith DR, Rapaport MH, Miller BJ. A meta-analysis of blood cytokine network alterations in psychiatric patients: comparisons between schizophrenia, bipolar disorder and depression. Mol Psychiatry 2016 Dec; 21 (12): 1696–709.
13 ноября 2018
Количество просмотров: 1835

