Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2018
Эффективность карипразина в лечении шизофрении, особенно с преобладанием негативной симптоматики №05 2018
Номера страниц в выпуске:27-37
Карипразин – это новейший антипсихотик III поколения (или атипичный антипсихотик II поколения), производное пиперазина. Он близок по химическому строению к ранее одобренным арипипразолу и брекспипразолу и, подобно им, является парциальным агонистом D2- и D3-дофаминовых рецепторов. Однако препарат отличается от них обоих улучшенным рецепторным профилем, преференциальным связыванием с D3-, а не с D2-рецепторами (что дает ему ряд преимуществ в лечении негативной, когнитивной и депрессивной симптоматики шизофрении), еще меньшим по сравнению с ними обоими потенциалом вызывания метаболических побочных эффектов, улучшенной переносимостью и безопасностью. Кроме того, карипразин также имеет меньшую по сравнению с арипипразолом внутреннюю агонистическую активность по отношению к D2-рецептору. Вследствие этого он гораздо реже арипипразола вызывает обострение продуктивной психопатологической симптоматики (бреда, галлюцинаций), возбуждение, тревогу или бессонницу в начале терапии. Еще одним уникальным преимуществом карипразина перед всеми другими присутствующими на рынке антипсихотиками является то, что у него самый большой среди всех пероральных антипсихотиков период полувыведения, что дает ему особые преимущества при применении у больных с пониженным уровнем комплаентности, недостаточной критикой к своему состоянию, забывчивостью в приеме лекарств.
Доказательная база эффективности и безопасности применения карипразина имеется как для острой купирующей, так и для поддерживающей терапии шизофрении. Препарат также является единственным из новых атипичных антипсихотиков, для которого строго методологически корректно доказано превосходство над рисперидоном в устранении негативной и когнитивной симптоматики шизофрении.
Ключевые слова: карипразин, производные пиперазина, арипипразол, брекспипразол, парциальный агонист D2-рецепторов, преференциальный лиганд D3-рецепторов, антипсихотик III поколения, шизофрения, негативная симптоматика.
Для цитирования: Быков Ю.В., Беккер Р.А., Морозов П.В. Эффективность карипразина в лечении шизофрении, особенно с преобладанием негативной симптоматики. Психиатрия и психофармакотерапия. 2018; 5: 27–37.
Доказательная база эффективности и безопасности применения карипразина имеется как для острой купирующей, так и для поддерживающей терапии шизофрении. Препарат также является единственным из новых атипичных антипсихотиков, для которого строго методологически корректно доказано превосходство над рисперидоном в устранении негативной и когнитивной симптоматики шизофрении.
Ключевые слова: карипразин, производные пиперазина, арипипразол, брекспипразол, парциальный агонист D2-рецепторов, преференциальный лиганд D3-рецепторов, антипсихотик III поколения, шизофрения, негативная симптоматика.
Для цитирования: Быков Ю.В., Беккер Р.А., Морозов П.В. Эффективность карипразина в лечении шизофрении, особенно с преобладанием негативной симптоматики. Психиатрия и психофармакотерапия. 2018; 5: 27–37.
Карипразин – это новейший антипсихотик III поколения (или атипичный антипсихотик II поколения), производное пиперазина. Он близок по химическому строению к ранее одобренным арипипразолу и брекспипразолу и, подобно им, является парциальным агонистом D2- и D3-дофаминовых рецепторов. Однако препарат отличается от них обоих улучшенным рецепторным профилем, преференциальным связыванием с D3-, а не с D2-рецепторами (что дает ему ряд преимуществ в лечении негативной, когнитивной и депрессивной симптоматики шизофрении), еще меньшим по сравнению с ними обоими потенциалом вызывания метаболических побочных эффектов, улучшенной переносимостью и безопасностью. Кроме того, карипразин также имеет меньшую по сравнению с арипипразолом внутреннюю агонистическую активность по отношению к D2-рецептору. Вследствие этого он гораздо реже арипипразола вызывает обострение продуктивной психопатологической симптоматики (бреда, галлюцинаций), возбуждение, тревогу или бессонницу в начале терапии. Еще одним уникальным преимуществом карипразина перед всеми другими присутствующими на рынке антипсихотиками является то, что у него самый большой среди всех пероральных антипсихотиков период полувыведения, что дает ему особые преимущества при применении у больных с пониженным уровнем комплаентности, недостаточной критикой к своему состоянию, забывчивостью в приеме лекарств.
Доказательная база эффективности и безопасности применения карипразина имеется как для острой купирующей, так и для поддерживающей терапии шизофрении. Препарат также является единственным из новых атипичных антипсихотиков, для которого строго методологически корректно доказано превосходство над рисперидоном в устранении негативной и когнитивной симптоматики шизофрении.
Ключевые слова: карипразин, производные пиперазина, арипипразол, брекспипразол, парциальный агонист D2-рецепторов, преференциальный лиганд D3-рецепторов, антипсихотик III поколения, шизофрения, негативная симптоматика.
Для цитирования: Быков Ю.В., Беккер Р.А., Морозов П.В. Эффективность карипразина в лечении шизофрении, особенно с преобладанием негативной симптоматики. Психиатрия и психофармакотерапия. 2018; 5: 27–37.
1Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310;
2David Ben-Gurion University in Negev. 8410501, Israel, Be'er-Sheva;
3N.I.Pirogov Russian National Research Medical University of the Ministry of Health of the Russian Federation. 117997, Russian Federation, Moscow, ul. Ostrovitianova, d. 1yubykov@gmail.com
Cariprazine is the newest antipsychotic of the third generation (or, in other words, an atypical antipsychotic of the second generation). Chemically it is a derivative of piperazine. Its chemical structure resembles two other previously approved atypical antipsychotics – aripiprazole and brexpiprazole. Like those two drugs, cariprazine is a partial agonist of D2 and D3 dopamine receptors. However, it differs from both of them by its improved receptor profile, with preferential binding more to D3 than to D2 receptors. This gives cariprazine a number of advantages in treating the negative, cognitive and depressive symptoms of schizophrenia, and also lies in roots of its significant antidepressant activity. Cariprazine also has even lower potential to cause weight gain and metabolic side effects than both aripiprazole and brexpiprazole, which already were associated with lower risk of this undesirable side effect than any other antipsychotic that existed before them. This means that cariprazine has improved tolerability and long-term cardiovascular safety than either aripiprazole or brexpiprazole, let alone other, more weight gain-prone antipsychotics. In addition, cariprazine also has lower intrinsic agonist activity at D2 receptors compared to aripiprazole. As a result, cariprazine is much less prone to cause agitation, anxiety or insomnia or exacerbation of psychosis at the start of therapy, compared to aripiprazole. Another unique advantage of cariprazine over all other antipsychotics present on the market is that it has the greatest half-life among all oral antipsychotics. This gives cariprazine a special advantage when it is used in patients with a low level of compliance, poor insight or forgetfulness to take medications.
The evidence base for the efficacy and safety of the use of cariprazine is available both for the acute and maintenance therapy of schizophrenia. Cariprazine is also the only of new atypical antipsychotics that has scientifically proven better performance over risperidone in the treatment of schizophrenia with prominent or predominant negative and cognitive symptoms.
Key words: cariprazine, piperazine derivatives, aripiprazole, brexpiprazole, D2 receptor partial agonist, D3 receptor preferential ligand, third generation antipsychotic, schizophrenia.
For citation: Bykov Yu.V., Bekker R.A., Morozov P.V. The efficacy of cariprazine in the treatment of schizophrenia, especially with prominent or predominant negative symptoms. Psychiatry and Psychopharmacotherapy. 2018; 5: 27–37.
Однако вскоре после начала широкого применения ТАП в психиатрии выяснилось, что их эффективность в купировании психопатологической симптоматики шизофрении весьма ограничена и наблюдается только в отношении позитивной (продуктивной) симптоматики, такой как бред, галлюцинации, агрессивное поведение, при нулевом или даже отрицательном влиянии на проявления негативной симптоматики, например апато-абулию (так называемый нейролептик-индуцированный дефицитарный синдром – НИДС), когнитивные нарушения (КН), аффективную симптоматику (нейролептические депрессии) [S.Stahl, 2013].
Кроме того, обнаружилось также, что кроме положительного влияния на продуктивную психопатологическую симптоматику ТАП также обладают многочисленными побочными эффектами (ПЭ), такими как выраженный экстрапирамидный синдром (ЭПС) и акатизия, ассоциированный с их применением риск возникновения поздних дискинезий (ПД), ортостатическая гипотензия (ОГ) и другие нежелательные сердечно-сосудистые эффекты, а также гиперпролактинемия (ГП), повышение аппетита, прибавка массы тела вплоть до ожирения, развитие сахарного диабета (СД) 2-го типа, метаболического синдрома – МС (P.Weiden, 2007; S.Stahl, 2013; J.Frankel, T.Schwartz, 2017).
Это связывают с недостаточной селективностью ТАП, т.е. с тем, что они блокируют дофаминовые D2-рецепторы не только в тех областях мозга, где это необходимо для развития антипсихотического эффекта (в мезолимбической системе), но и, например, в мезокортикальной (что приводит к развитию НИДС и КН), нигростриарной (что приводит к развитию ЭПС и акатизии и возникновению риска ПД), тубероинфундибулярной системе (что ведет к развитию ГП), рвотном центре, центрах регуляции аппетита и насыщения (вызывает не только противорвотный эффект, но и повышение аппетита и прибавку массы тела, а затем и развитие метаболических нарушений) [S.Stahl, 2013].
Сопутствующая блокада других типов рецепторов, таких как a1-адренергические, М-холинергические и H1-гистаминовые, добавляла свои ПЭ (соответственно, ОГ, сонливость и седация, запоры и другие М-холинолитические эффекты) и часто ограничивала дозу АП сверху. В ряде случаев это вообще не давало возможности достичь у конкретного больного терапевтически эффективной дозировки (S.Stahl, 2013).
Первым настоящим «неклозапиновым» (т.е. не случайно открытым, а целенаправленно синтезированным) ААП стал синтезированный в начале 1990-х годов рисперидон. Он вызывал меньше ЭПС и акатизии, НИДС, нейролептических депрессий и КН, в основном благодаря своему сильному антагонизму к серотониновым 5-HT2A-рецепторам (более сильному, чем его же антагонизм к дофаминовым D2-рецепторам) [S.Stahl, 2013; J.Frankel, T.Schwartz, 2017]. Было показано, что в основе «атипичности» клинического профиля рисперидона и многих других ААП лежит именно их сильная способность к блокаде 5-HT2A-рецепторов, которая способствует косвенному повышению уровня дофамина в таких областях мозга, как нигростриарная (что потенциально способно уменьшить ЭПС и акатизию и риск возникновения ПД), тубероинфундибулярная система (потенциально снижает степень вызываемой ААП ГП), префронтальная кора (сокращает риск возникновения НИДС, нейролептик-индуцированных КН и нейролептических депрессий при применении ААП) [S.Stahl, 2013; J.Frankel, T.Schwartz, 2017].
Широкое применение в психиатрии ААП, начавшееся с внедрения в психиатрическую практику рисперидона, способствовало переориентации мышления как самих психиатров, так и пациентов и их родственников, изменению целей, которые ставились отныне перед терапией АП, от цели «подавления продуктивной симптоматики любой ценой, в том числе ценой ЭПС, ГП и других осложнений» к более гуманному и индивидуализированному, комплексному подходу, в котором ставилась цель подавления не только и даже не столько продуктивной, сколько негативной, когнитивной и аффективной симптоматики шизофрении, в большей мере определяющей долгосрочные функциональные исходы, социализацию и трудоспособность больных (S.Stahl, 2013).
Это также привело к тому, что главной целью стало не само по себе подавление той или иной симптоматики, а восстановление психосоциального, семейно-бытового и профессионального функционирования, улучшение общего качества жизни пациентов при одновременной минимизации ПЭ (S.Stahl, 2013; M.Solmi и соавт., 2017).
За истекшие десятилетия строго доказано, что ААП демонстрируют гораздо лучший профиль безопасности и переносимости по сравнению с ТАП при сопоставимой с последними эффективности в отношении продуктивной психопатологической симптоматики, но лучшей эффективности в отношении когнитивной, негативной и аффективной симптоматики (S.Stahl, 2013; M.Solmi и соавт., 2017).
ААП реже и меньше, по сравнению с ТАП, вызывают ЭПС и акатизию, ГП, реже и меньше вызывают НИДС, КН, нейролептические депрессии и могут даже сами обладать антидепрессивной, антинегативной и прокогнитивной активностью (S.Stahl, 2013; M.Solmi и соавт., 2017).
Таким образом, важнейшим преимуществом ААП перед ТАП является то, что при сопоставимой с ТАП эффективности в отношении продуктивной симптоматики они дают меньше таких ПЭ, как ЭПС и акатизия, ГП, НИДС, и имеют более широкий спектр активности в отношении других доменов симптоматики шизофрении – негативной, когнитивной и аффективной. Это транслируется в улучшение общего качества жизни больных шизофренией, их социализации, семейно-бытового и профессионального функционирования, а также в более высокую комплаентность по отношению к лечению ААП, чем к терапии ТАП (S.Stahl, 2013).
Все это привело к тому, что ААП постепенно вытеснили ТАП в качестве препаратов 1-й линии для лечения шизофрении и других психозов во многих алгоритмах, отодвинув использование ТАП во 2-ю и даже 3-ю линию терапии или оставив применение ТАП в 1-й линии только для ситуаций острого психомоторного возбуждения и агрессивности (S.Stahl, 2013).
Однако создание и широкое применение ААП I поколения, таких как рисперидон, оланзапин, кветиапин, обозначило новую проблему. Прежде всего оказалось, что добиться высокой селективности блокады тем или иным новым препаратом 5-HT2A-рецепторов, не затрагивая сходные по строению 5-HT2C-рецепторы, крайне сложно. Между тем неизбирательная блокада 5-HT2C-рецепторов, несмотря на то что она имеет полезное антидепрессивное и прокогнитивное действие за счет вызываемого ею реципрокного повышения уровней норадреналина и дофамина в префронтальной коре, также вызывает резкое повышение аппетита (в связи с блокадой «серотонинергического тормоза» в центрах регуляции аппетита и насыщения), особенно в сочетании с блокадой H1-гистаминовых и/или M3-холинергических рецепторов, которой такие первые ААП также не были лишены (S.Stahl, 2013).
Это привело к тому, что первые ААП (особенно оланзапин) вызывают еще большую прибавку массы тела и еще более выраженные метаболические нарушения (СД 2-го типа, МС), чем ТАП (S.Stahl, 2013). Это вызвало необходимость в разработке новых ААП с улучшенными рецепторными свойствами и пониженной вероятностью развития метаболических ПЭ (S.Stahl, 2013).
Кроме того, обнаружилось также, что даже такой более низкий по сравнению с ТАП уровень полной блокады
D2-рецепторов, который свойственен первым ААП рисперидону и оланзапину, хотя и снижает, но неполностью исключает риск развития ЭПС, КН, нейролептических депрессий и/или НИДС и возникновения в дальнейшем ПД при лечении ими. Кветиапин же, имеющий самый низкий среди ААП (кроме клозапина) уровень оккупации D2-рецепторов в терапевтических дозах и потому обычно не ассоциирующийся с развитием компенсаторной гиперчувствительности D2-рецепторов и феномена ПД при длительной терапии им, оказался достаточно слабым АП, не всегда надежно устраняющим продуктивную симптоматику (S.Stahl, 2013).
Стало понятно, что сам принцип полной функциональной D2-блокады при любом ее уровне и при любой степени ее компенсации другими рецепторными свойствами, такими как 5-HT2A-блокада, имеет принципиальные ограничения по эффективности и что в некоторых областях мозга, например в префронтальной коре, где дофаминергическая нейротрансмиссия при шизофрении ослаблена (с чем связывают негативную и когнитивную симптоматику), D2-рецепторы желательно стимулировать, а в некоторых других, таких как мезолимбическая система, где дофаминергическая нейротрансмиссия при психозах избыточно усилена, D2-рецепторы желательно блокировать, по возможности также соблюдая относительную «нейтральность» в отношении регулирования дофаминергической нейротрансмиссии в тех зонах мозга, где она интактна – в нигростриарной и тубероинфундибулярной системе (S.Stahl, 2013).
Это понимание привело к зарождению концепции парциального D2-агонизма как основы антипсихотического действия нового, III поколения АП (или II поколения ААП), вместо полной D2-блокады, свойственной как I, так и II поколению АП (т.е. свойственной как ТАП, так и ААП I поколения, но у последних D2-блокада уравновешивается другими рецепторными свойствами) [S.Stahl, 2013; J.Frankel, T.Schwartz, 2017].
Парциальный D2-агонизм как раз и предоставляет возможность создавать функциональную D2-блокаду в тех зонах мозга, где дофаминергическая активность избыточно усилена, и одновременно обеспечивать мягкую, умеренную, тоническую D2-стимуляцию в тех зонах мозга, где дофаминергическая активность патологически снижена (S.Stahl, 2013; J.Frankel, T.Schwartz, 2017).
Задачи, которые ставились при синтезе арипипразола, – добиться создания ААП с очень низким потенциалом вызывания повышения аппетита, прибавки массы тела и метаболических нарушений (СД 2-го типа, МС), а также с нормализующим, а не повышающим влиянием на пролактин, низким риском вызывания ЭПС и НИДС, ПД и выраженным антинегативным и антидепрессивным действием – были во многом решены (S.Stahl, 2013; J.Frankel, T.Schwartz, 2017).
Прежде всего оказалось, что для многих больных шизофренией арипипразол – «слишком D2-агонистичен» и из-за этого довольно часто вызывает, особенно в начале терапии, обострение продуктивной психотической симптоматики (бреда и галлюцинаций), психомоторное возбуждение, тревогу, бессонницу, вегетативную неустойчивость, тошноту и даже рвоту. Для других же пациентов арипипразол – по-прежнему «недостаточно D2-агонистичен» и вызывает ЭПС, акатизию или недостаточно хорошо устраняет негативную, когнитивную и депрессивную симптоматику шизофрении (S.Stahl, 2013, 2015, 2017).
Это привело к необходимости синтезировать новые парциальные D2-агонисты, находящиеся на разных концах агонист-антагонистического спектра и удовлетворяющие потребности этих столь разных подгрупп больных шизофренией: либо «более D2-антагонистические», чем арипипразол, «более классические в этом отношении, более близкие к I и II поколению АП» (таковы появившийся в 2015 г. в США брекспипразол и новейший, получивший разрешение FDA также в 2015 г., карипразин, который является темой данной статьи), либо, напротив, «более
D2-агонистические», чем арипипразол, «более близкие к прамипексолу», такие как не получивший одобрения FDA в 2007 г. бифепрунокс и некоторые другие новые, разрабатываемые сейчас, молекулы АП (S.Stahl, 2013, 2015, 2017).
Кроме того, важно также и то, что все имеющиеся на сегодняшний день на рынке ТАП и ААП, включая как уже упоминавшиеся арипипразол и брекспипразол, так и новейший карипразин, помимо своего сродства к D2-рецепторам, которым, как полагают, в основном и обусловлена их антипсихотическая активность (M.Nord, L.Farde, 2011), имеют также различные – и у разных препаратов значительно различающиеся – степени сродства к дополнительным рецепторам, имеющимся в центральной нервной системе и периферических тканях (S.Leucht и соавт., 2013; S.Stahl, 2013).
Это, а также различия в особенностях печеночного метаболизма разных препаратов, объясняет индивидуальные различия данных препаратов в отношении их эффективности, переносимости и профилей ПЭ у разных пациентов (S.Leucht и соавт., 2013; S.Stahl, 2013).
Поэтому создание новых ААП с улучшенными и отличающимися друг от друга рецепторными профилями, улучшенной переносимостью и устойчивой эффективностью в отношении широкого спектра симптомов шизофрении, а не только продуктивной симптоматики – весьма важно и предоставляет возможность более тонкого подбора и индивидуализации терапии, минимизации ПЭ, улучшения качества жизни и долгосрочных функциональных исходов пациентов (S.Leucht и соавт., 2013; S.Stahl, 2013).
Именно в свете этого карипразин – это не просто «еще один новый АП III поколения», а весьма важное расширение терапевтического арсенала психиатров (J.Frankel, T.Schwartz, 2017).
Карипразин был одобрен FDA в 2015 г. и затем European Medicines Agency (EMA) в 2017 г. для лечения шизофрении в дозировке 1,5–6 мг/сут (L.Citrome, 2016; S.Durgam и соавт., 2017).
Ведущей на сегодняшний день гипотезой относительно патофизиологии шизофрении является гипотеза генетически обусловленной дисфункции NMDA-рецепторов парвальбуминсодержащих ГАМКергических интернейронов коры (прежде всего ее префронтальных областей), получающих входящую глутаматергическую нейротрансмиссию от пирамидных нейронов вышележащих слоев коры. Эта дисфункция NMDA-рецепторов ГАМК-интернейронов приводит к нарушению нормальных процессов синаптогенеза и синаптической пластичности (укрепления «нужных» синаптических связей) и синаптического прунинга (удаления, элиминации «ненужных» синаптических связей) [S.Stahl, 2013; P.Ruiz, 2017].
Это, в свою очередь, приводит к тому, что у пациентов с шизофренией после завершения периода полового созревания, в течение которого под влиянием половых стероидов в норме происходит наиболее активный синаптический прунинг, сохраняется большое количество «слабых», неэффективных глутаматергических синапсов, которые в норме должны были бы быть элиминированы в процессе прунинга.
Дисфункция NMDA-рецепторов ГАМКергических интернейронов коры также приводит к патологическому усилению активности глутаматергических нейронов вышележащих слоев коры (так как они не получают достаточного тормозного ГАМК-сигнала) и к постепенной их гибели вследствие NMDA-опосредованной эксайтотоксичности, что, видимо, и является причиной «кумулятивной токсичности» перенесенных шизофренических психозов, нарастания с течением времени проявлений шизофренического дефекта (негативной симптоматики) и КН (S.Stahl, 2013; P.Ruiz, 2017).
Кроме того, дисфункция NMDA-рецепторов парвальбуминсодержащих ГАМКергических интернейронов коры ведет к развитию вторичной дисфункции самих этих нейронов, в частности, к снижению в них активности ГАМК-трансаминазы и содержания ГАМК. А это, в свою очередь, оказывает неблагоприятное влияние на модуляцию активности множества нейронных цепей, в которых участвуют эти интернейроны – и в особенности дофаминергических и серотонинергических нейронных цепей (S.Stahl, 2013).
Таким образом, «глутаматергическая» теория вовсе не отменяет прежние теории шизофрении – «дофаминовую» и «дофамин-серотонинового дисбаланса», а объясняет нарушения, наблюдаемые при шизофрении в дофаминергических и серотонинергических нейронных цепях, как вторичные по отношению к глутаматергической и ГАМКергической дисфункциям (S.Stahl, 2013; P.Ruiz, 2017).
Разберем механизм возникновения этих вторичных дофаминергических нарушений при шизофрении чуть подробнее. Дофаминергические проводящие пути в мезолимбической системе (от вентральной области покрышки – Ventral Tegmental Area, VTA – к прилежащему ядру – Nucleus Accumbens, NAcc) регулируются нисходящими глутаматергическими влияниями от пирамидных нейронов коры непосредственно – без участия вставочных ГАМКергических нейронов. Поэтому упомянутая нами гиперактивность глутаматергических пирамидных нейронов коры приводит к стимуляции дофаминергических нейронов NAcc и VTA, развитию дофаминергической гиперактивности в мезолимбической системе, и в конечном счете – к развитию продуктивной симптоматики шизофрении (бреда, галлюцинаций, специфических нарушений мышления) [S.Stahl, 2013; P.Ruiz, 2017].
В то же время дофаминергические проводящие пути в мезокортикальной системе (иннервирующей, в частности, префронтальную кору) регулируются нисходящими глутаматергическими влияниями пирамидных нейронов коры через посредство тех самых ослабленных и дисфункциональных вставочных ГАМК-нейронов. Поэтому гиперактивность глутаматергических пирамидных нейронов коры ведет к угнетению дофаминергической нейротрансмиссии в мезокортикальной системе, снижению выделения дофамина в префронтальной коре, и в конечном счете – к развитию негативной, депрессивной и когнитивной симптоматики шизофрении (S.Stahl, 2013; P.Ruiz, 2017).
Таким образом, получается, что для эффективного устранения всей симптоматики шизофрении (не только продуктивной, но и негативной, когнитивной и аффективной) необходим такой препарат, который был бы способен в одних областях мозга (в мезолимбической системе, где дофамина изначально слишком много) дофаминергическую активность снижать, а в других (в мезокортикальной системе, где дофамина изначально слишком мало), наоборот, повышать (S.Stahl, 2013; P.Ruiz, 2017).
Теоретически существует два способа обеспечить повышение дофаминергической активности в мезокортикальной системе (т.е. устранение негативной, когнитивной и аффективной симптоматики) без снижения степени дофаминергической блокады в мезолимбической системе (и без соответствующего снижения эффективности в отношении продуктивной симптоматики).
Один способ заключается в использовании косвенного механизма повышения дофаминергической активности в префронтальной коре при помощи блокады серотонинергических 5-HT2A-рецепторов или парциального агонизма к 5-HT1A-рецепторам. Этот способ используют все «обычные» ААП (АП II поколения), такие как рисперидон, оланзапин, кветиапин.
Другой же способ заключается в применении для лечения шизофрении парциальных дофаминергических агонистов, которые сами собой, встроенным в сам принцип их действия образом, т.е. напрямую (а не косвенным механизмом) проявляют дофамин-подобные свойства в тех областях мозга, в которых дофамина изначально мало, и одновременно конкурируют с последним и снижают его активность в тех областях мозга, в которых дофамина изначально слишком много (S.Stahl, 2013; Ruiz P, 2017).
Однако общим принципом фармакологии, и в частности психофармакологии, является то, что, чем ближе механизм действия лекарства к самому ядру патогенеза заболевания, тем потенциально выше его эффективность в устранении всей симптоматики заболевания и что прямые механизмы воздействия на ключевые звенья патогенеза болезни всегда эффективнее косвенных. Поэтому было заранее предсказано, что парциальные дофаминергические агонисты (АП III поколения) должны быть эффективнее «смешанных 5-HT2A/D2-антагонистов» (АП II поколения) в устранении негативной, когнитивной и аффективной симптоматики шизофрении. Это в целом подтвердилось клинически (S.Stahl, 2013; P.Ruiz, 2017).
В перспективе возможен синтез АП, работающих на совершенно новых принципах, лежащих еще ближе к ядру патогенеза шизофрении, в частности, влияющих на лежащие в основе всего болезненного процесса глутаматергическую и ГАМКергическую дисфункции. Потенциально они могут быть еще эффективнее в отношении негативной симптоматики шизофрении. Пока такие попытки (в частности, попытки разработки агонистов метаботропных глутаматных рецепторов 2 и 3-го подтипов – mGluR2/3) не увенчались успехом. Однако с использованием современных методов компьютеризированного поиска и моделирования подходящих соединений это положение может измениться, и такие лекарства, несомненно, будут найдены и внедрены.
Пока же в ожидании этого самыми эффективными средствами устранения негативной и когнитивной симптоматики шизофрении остаются именно парциальные дофаминергические агонисты (S.Stahl, 2013; P.Ruiz, 2017).
Завершив описание современной теории патофизиологии шизофрении (по необходимости краткое, в силу ограничений объема журнальной статьи), перейдем к рассмотрению свойств карипразина – новейшего члена семейства парциальных дофаминергических агонистов – и доказательной базы для его применения при лечении шизофрении.
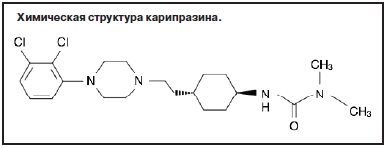 Карипразин является производным пиперазина, который был разработан «Gedeon Richter» в Венгрии (R.Roberts и соавт., 2016). Первоначально ученые разрабатывали в качестве потенциального нового ААП несколько другое вещество, а то, которое мы сегодня знаем как карипразин – транс-N-(4-(2-(4-(2,3-дихлорфенил)пиперазин-1-ил)этил)циклогексил)-N',N'-диметиламид, было получено попутно в процессе его синтеза (см. рисунок) [É.Ágai-Csongor и соавт., 2012].
Карипразин является производным пиперазина, который был разработан «Gedeon Richter» в Венгрии (R.Roberts и соавт., 2016). Первоначально ученые разрабатывали в качестве потенциального нового ААП несколько другое вещество, а то, которое мы сегодня знаем как карипразин – транс-N-(4-(2-(4-(2,3-дихлорфенил)пиперазин-1-ил)этил)циклогексил)-N',N'-диметиламид, было получено попутно в процессе его синтеза (см. рисунок) [É.Ágai-Csongor и соавт., 2012].
Однако последующие эксперименты показали, что именно это «попутное» вещество, которое теперь известно как карипразин, – клинически более перспективное, чем то вещество, над которым изначально работали ученые (É.Ágai-Csongor и соавт., 2012). Этот препарат первоначально был синтезирован в лабораториях компании «Gedeon Richter Ltd.» и затем разрабатывался и испытывался в кооперации с компаниями «Forest Laboratories Inc.» и «Mitsubishi Tanabe Pharma Corp.».
Химически он относится к производным пиперазина (как и уже упоминаемые арипипразол и брекспипразол, к которым он близок по строению) [S.Stahl, 2013, 2015, 2017; А.Б.Шмуклер, 2014].
На ранних этапах разработки препарат имел кодовое название RGH-188, а затем был переименован в карипразин и клинически исследован для применения при шизофрении и других психозах. В США он имеет торговое название Vraylar®, а в Европе – Reagila® (R.Roberts и соавт., 2016).
Карипразин обладает самым длительным среди всех представленных сегодня на рынке пероральных АП периодом полувыведения (T1/2) – он составляет от 2 до 6 сут (G.Mészáros и соавт., 2007; M.Kapás и соавт., 2008). Это дает препарату уникальные терапевтические преимущества при его применении у больных с пониженной комплаентностью терапии АП и отказом от пролонгированных инъекционных форм АП либо с их непереносимостью, а также у пациентов с пониженным уровнем критичности к своему состоянию или с выраженными КН, обусловливающими забывчивость в приеме лекарств (S.Stahl, 2015, 2017).
Стабильная концентрация карипразина в плазме крови (Css) при его постоянном приеме (Tss) достигается через
5 T1/2, т.е. в сроки от 1 нед до 1 мес (F.Werner, R.Coveñas, 2015).
Длительный период до стабилизации концентрации карипразина в крови означает, что при применении карипразина в еще большей мере, чем при использовании также обладающих довольно большими (но меньшими, чем у карипразина) T1/2 и Tss арипипразола и брекспипразола, необходимо терпение и что при применении нельзя преждевременно делать выводы о его неэффективности у конкретного больного в первые недели терапии (F.Werner, R.Coveñas, 2015; S.Stahl, 2015, 2017).
Как и большинство других липофильных АП, карипразин выводится из организма в основном за счет метаболизма в печени и последующего выведения метаболитов с мочой и в меньшей мере – с калом. У препарата имеются два активных деметилированных метаболита – N-дезметилкарипразин (норкарипразин) и N-дидезметилкарипразин (диноркарипразин). Оба активных метаболита имеют еще более длительный T1/2, чем родительское соединение (карипразин), что продлевает время до прекращения функциональной блокады D2-рецепторов до 1 мес и более.
Это дает карипразину уникальные преимущества при лечении больных с пониженной комплаентностью терапии АП, низким уровнем критики к своему состоянию, выраженными КН или забывчивостью в приеме лекарств (G.Pásztor Mészáros и соавт., 2008; F.Werner, R.Coveñas, 2015).
Метаболизм карипразина в печени происходит при участии ферментов системы микросомальных смешанных оксидаз – изоферментов цитохрома P450 (CYP450), в основном изофермента CYP450 3A4 и в меньшей степени также изофермента CYP450 2D6 (N.Kirschner и соавт., 2008). Образовавшиеся метаболиты затем подвергаются глюкуронизации и выводятся в основном с мочой. После отмены карипразина при длительном приеме снижение уровня его в плазме на 50% наблюдается через 1 нед (N.Kirschner и соавт., 2008).
D3-рецепторами. Однако если арипипразол и брекспипразол являются по отношению к D3-рецептору скорее антагонистами, то карипразин, в отличие от них, – парциальным агонистом также и по отношению к D3-рецепторам. Кроме того, карипразин, в отличие от арипипразола и брекспипразола, обладает значительно более высокой аффинностью к D3-, чем к D2-дофаминовым рецепторам. Поэтому он предпочтительно связывается с D3-рецепторами (B.Kiss и соавт., 2010; П.В.Морозов, В.Э.Медведев, 2014; А.Б.Шмуклер, 2014; S.Durgam и соавт., 2017).
Среди всех представленных на рынке ААП (исключая клозапин) именно карипразин имеет наиболее высокое соотношение аффинности к D3-рецепторам и его же аффинности к D2-рецепторам. Его аффинность к D3-рецепторам, измеренная на клонированных рецепторах человека in vitro, превышает его же аффинность к клонированным человеческим D2-рецепторам in vitro, по данным разных исследователей, в 6–10 раз (B.Kiss и соавт., 2010; P.McCormick и соавт., 2010; L.Citrome, 2013; F.Werner, R.Coveñas, 2015).
Это преференциальное воздействие карипразина именно на D3-, а не на D2-рецепторы в сочетании с его парциальным агонизмом, а не полным антагонизмом по отношению к D3-рецептору может обусловливать уникальное сильное положительное влияние карипразина на негативную, когнитивную и аффективную (депрессивную) симптоматику шизофрении (J.Joyce, M.Millan, 2005; B.Kiss и соавт., 2008; R.Zimnisky и соавт., 2013).
Дело в том, что именно D3-, а не D2-рецепторы играют особенно важную роль в регуляции настроения, чувства удовольствия, а также когнитивных функций. Дисфункция этих рецепторов сопряжена с депрессией, ангедонией, развитием КН, а также влечения к психоактивным веществам (G.Gross, K.Drescher, 2012).
Карипразин специально разрабатывался именно исходя из предположения о том, что соединение, проявляющее более высокую аффинность связывания с D3-, чем с D2-дофаминовыми рецепторами, и являющееся парциальным агонистом по отношению к обоим подтипам дофаминовых рецепторов (а не только к D2 подтипу, одновременно антагонизируя D3 подтип), может оказаться особенно полезным в лечении негативной, когнитивной и депрессивной симптоматики шизофрении, а также в уменьшении нередко сопутствующего этому тяжелому психическому заболеванию влечения к психоактивным веществам. Это предположение нашло свое подтверждение в клинической практике при применении карипразина (J.Joyce, M.Millan, 2005; B.Kiss и соавт., 2008; R.Zimnisky и соавт., 2013; S.Stahl, 2013, 2015, 2017).
Такая особенность рецепторного профиля карипразина приводит к тому, что препарат более сбалансированно связывается с D2- и D3-дофаминовыми рецепторами in vivo как в экспериментальных моделях на животных (I.Gyertyán и соавт., 2011; É.Ágai-Csongor и соавт., 2012), так и у пациентов с шизофренией, а также у здоровых добровольцев (R.Girgis и соавт., 2016).
Это отличает карипразин от всех других ААП, кроме клозапина, которые in vivo преимущественно связываются с D2-, а не с D3-дофаминовыми рецепторами, и сближает его с клозапином в этом отношении (A.Graff-Guerrero и соавт., 2009; P.McCormick и соавт., 2010).
Кроме того, было также показано, что карипразин уникален среди всех других неклозапиновых ААП (и, в частности, отличается в этом от своего ближайшего родственника арипипразола) в том, что он при длительном приеме способен повышать экспрессию (вызывать апрегуляцию) D3-рецепторов в ряде областей мозга. Между тем экспрессия D3-рецепторов в противоположность экспрессии D2-рецепторов у нелеченых больных шизофренией обычно исходно снижена, а не повышена, и ее апрегуляция является полезным эффектом (Y.Choi и соавт., 2014).
Применение карипразина также косвенным механизмом приводит к апрегуляции (повышению количества и плотности) и увеличению фосфорилирования (а значит, и функциональной активности) NMDA-рецепторов, чего не наблюдается при применении других неклозапиновых ААП (Y.Choi и соавт., 2014).
Между тем именно гипофункция NMDA-рецепторов, как принято считать сегодня, лежит в основе патогенеза шизофрении и вторично обусловливает наблюдаемые при ней нарушения в работе дофаминергической и серотонинергической системы мозга (S.Stahl, 2013).
Как мы уже упоминали, парциальные агонисты D2-рецепторов, к которым относится и карипразин, имеют более низкий риск развития ЭПС, акатизии, НИДС, нейролептических депрессий и нейролептикассоциированных КН, ПД, а также ГП и ассоциированных с нею метаболических и сексуальных нарушений, чем полные антагонисты
D2-рецепторов (S.Stahl, 2013, 2015, 2017; J.Scarff, 2016).
Тот факт, что карипразин является слабым парциальным агонистом, а не полным антагонистом D2- и D3-дофаминовых рецепторов, обеспечивает возможность достижения при лечении его терапевтическими дозами очень высокого процента занятости D2- и D3-дофаминовых рецепторов (приближающегося к 90–100%) без развития выраженных ЭПС – процента, который при лечении полными антагонистами D2-рецепторов, будь то ТАП или ААП I поколения, был бы недостижим без развития полной акинезии (N.Seneca и соавт., 2011; S.Stahl, 2013). Это обеспечивает карипразину возможность добиться терапевтического успеха в ряде случаев резистентной шизофрении, при которой обеспечиваемая ТАП и ААП I поколения 60–80% степень занятости D2-рецепторов оказывается недостаточной для получения терапевтического эффекта (N.Seneca и соавт., 2011; S.Stahl, 2013).
Так, уже при дозах, эквивалентных 2–3 мг/сут карипразина для человека, процент оккупации D2- и D3-рецепторов у экспериментальных приматов достигает 85% (N.Seneca и соавт., 2011). У пациентов с шизофренией уже при дозе 1,5 мг/сут процент оккупации D2- и D3-рецепторов превышает 69–75% (S.Potkin и соавт., 2009). У здоровых добровольцев уже при дозировке всего 1 мг/сут достигается 65% занятость D2- и D3-рецепторов (I.Laszlovsky и соавт., 2007).
Процент же занятости 5-HT1A серотониновых рецепторов в терапевтических дозах in vivo, несмотря на высокое сродство карипразина к этим рецепторам, не превышает 20–30%, что сопоставимо с аналогичными показателями у арипипразола и буспирона, но меньше, чем у новейших мультимодальных антидепрессантов вилазодона и вортиоксетина, у которых он приближается к 50% (N.Seneca и соавт., 2011; S.Stahl, 2013, 2015, 2017).
Карипразин преимущественно подавляет чрезмерную спонтанную активность мезолимбических дофаминергических нейронов (с чем и связывают его антипсихотический, антибредовый, антигаллюцинаторный эффект), практически не оказывая влияния на дофаминергические нейроны нигростриарной (с чем ассоциируют низкий риск возникновения при лечении им ЭПС, акатизии, ПД) и тубероинфундибулярной системы (с чем связывают низкий риск возникновения при терапии им ГП и связанных с ней метаболических и сексуальных нарушений) [S.Caccia и соавт., 2013; S.Stahl, 2013, 2015, 2017].
Парциальный агонизм карипразина к D2- и D3-дофаминовым рецепторам в основном реализуется в стриатуме (антипсихотический эффект) и префронтальной коре (антинегативный и прокогнитивный эффекты) [F.Werner, R.Coveñas, 2015].
Кроме своего высокого сродства к D3- и D2-дофаминовым рецепторам карипразин, подобно арипипразолу, также имеет in vitro и in vivo достаточно высокое сродство к 5-HT1A-серотониновым рецепторам, для которых он также является парциальным агонистом (Ki=0,085, 0,5 и 3,0 nM соответственно) [N.Seneca и соавт., 2011; L.Citrome, 2013; А.Б.Шмуклер, 2014].
Парциальный агонизм карипразина к 5-HT1A-серотониновым рецепторам приводит к реципрокному повышению уровней дофамина и норадреналина в префронтальной коре, увеличению уровня дофамина в нигростриарной и тубероинфундибулярной системе (по аналогии с буспироном, арипипразолом). Это дополнительно снижает вероятность возникновения при лечении карипразином ЭПС, НИДС, КН, ГП, нейролептических депрессий, сексуальных нарушений, а также способствует его антидепрессивной, анксиолитической и прокогнитивной активности (S.Stahl, 2013, 2015, 2017).
Карипразин по своему рецепторному профилю больше похож не на брекспипразол, а на арипипразол, который тоже сочетает парциальный агонизм к D2- и антагонизм к D3-дофаминовым рецепторам с сильным парциальным агонизмом к 5-HT1A-серотониновым рецепторам (B.Kiss и соавт., 2010; É.Ágai-Csongor и соавт., 2012).
Карипразин также является сильным антагонистом 5-HT2B, умеренным антагонистом 5-HT2A и слабым антагонистом 5-HT2C-серотониновых рецепторов (Ki=0,58, 19 и 134 nM соответственно) [B.Kiss и соавт., 2010; L.Citrome, 2013; P.De Deurwaerdère, 2016]. Эти его рецепторные свойства также способствуют повышению уровней дофамина и норадреналина в префронтальной коре, уровня дофамина в нигростриарном и тубероинфундибулярном трактах и дополнительно уменьшают вероятность ЭПС, НИДС, ГП, нейролептических депрессий и сексуальных нарушений при терапии им, вносят вклад в его общую антидепрессивную, анксиолитическую и прокогнитивную активность (L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
В то же время то, что карипразин имеет достаточно слабый антагонизм к 5-HT2C-подтипу серотониновых рецепторов (всего 134 nM), уменьшает вероятность возникновения при терапии им метаболических нарушений (повышения аппетита, прибавки массы тела, развития СД 2-го типа и МС) [L.Citrome, 2013; S.Stahl, 2013, 2015, 2017].
Карипразин также считается слабым антагонистом 5-HT7-серотониновых рецепторов с Ki=111 nM и слабым антагонистом s1-рецепторов (B.Kiss и соавт., 2010; L.Citrome, 2013). Эти рецепторные свойства потенциально могут придавать ему способность положительно влиять на циркадные ритмы сна и бодрствования, а также привносить вклад в его общую антидепрессивную и анксиолитическую, прокогнитивную, просоциальную активность (L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
Карипразин является умеренным антагонистом H1-гистаминовых рецепторов с Ki=23 nM. Это наряду с меньшей, по сравнению с арипипразолом, внутренней агонистической активностью карипразина по отношению к дофаминовым D2-рецепторам частично объясняет то, что в клинической практике карипразин реже, чем арипипразол, вызывает в начале терапии обострение тревоги, бессонницы или возбуждения (B.Kiss и соавт., 2010; L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
В то же время умеренность сродства карипразина к H1-гистаминовым рецепторам, по сравнению с такими ААП, как оланзапин, кветиапин или зипрасидон, наряду с его низким сродством к 5-HT2C-серотониновым рецепторам приводит к тому, что при длительной терапии карипразин не оказывает нежелательного седативного действия, не ассоциируется с повышением аппетита, прибавкой массы тела, развитием метаболических нарушений (СД 2-го типа, МС) [B.Kiss и соавт., 2010; L.Citrome, 2013; S.Stahl, 2013, 2015, 2017].
Карипразин также не связывается с M-холинергическими, a-адренергическими, ГАМКергическими, бензодиазепиновыми, опиоидными или какими-либо другими рецепторами, кроме упомянутых выше, и не имеет ассоциированных с этим ПЭ, таких как ОГ, тахикардия, чрезмерная седация, запоры, задержка мочи и др. (W.Kroeze и соавт., 2003; E.Richelson и соавт., 2010; B.Kiss и соавт., 2010; J.Leung и соавт., 2010; G.Reynolds, 2012; L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
Результаты клинического изучения
Так, в одном двойном слепом 6-недельном плацебо-контролируемом сравнительном РКИ 2013 г., посвященном изучению эффективности и безопасности карипразина в сравнении с арипипразолом и плацебо при острой купирующей терапии шизофрении, приняли участие 617 пациентов с острыми шизофреническими психозами. Все они были рандомизированы к получению либо низкой дозировки карипразина (3 мг/сут), либо высокой дозы карипразина (6 мг/сут), либо арипипразола 10 мг/сут, либо плацебо в течение всех 6 нед исследования (L.Citrome, 2013). При этом оценка по шкале PANSS по подшкалам как продуктивной (позитивной), так и негативной симптоматики шизофрении к сроку 4 и 6 нед терапии статистически достоверно значительно улучшилась в обеих группах карипразина (L.Citrome, 2013).
В данном исследовании эффективность низкой дозы карипразина (3 мг/сут) оказалась статистически достоверно значительно превышающей эффективность плацебо и сопоставимой с эффективностью арипипразола 10 мг/сут при более низком, чем у арипипразола, уровне ПЭ. Более высокая дозировка карипразина (6 мг/сут) также статистически достоверно улучшала состояние пациентов, уменьшая выраженность симптомов по шкале PANSS, по сравнению с плацебо. Уровень ПЭ был низким в обеих группах карипразина (L.Citrome, 2013).
В другом двойном слепом 6-недельном плацебо-контролируемом сравнительном РКИ 2015 г., в котором также изучали эффективность и безопасность применения карипразина в краткосрочной купирующей терапии шизофрении, участвовали 732 пациента с острым шизофреническим психозом. Все они были рандомизированы в одну из 5 подгрупп: карипразин 1,5, 3, 4,5 мг/сут, плацебо или ААП сравнения – рисперидон – в дозе 4 мг/сут – в течение всех 6 нед исследования. Пациенты из всех подгрупп активного лечения показали статистически достоверное значительное улучшение по сравнению с плацебо. При этом карипразин оказался сопоставим с рисперидоном по общей эффективности, но ассоциировался с меньшим уровнем ПЭ (в частности, ЭПС, ГП, акатизии) и более низким уровнем отказов от продолжения лечения по сравнению с рисперидоном (S.Durgam и соавт., 2015).
В еще одном двойном слепом 6-недельном плацебо-контролируемом РКИ 2015 г. по эффективности и безопасности карипразина при краткосрочной купирующей терапии шизофрении приняли участие 446 пациентов с острыми шизофреническими психозами. Все они были рандомизированы в 3 подгруппы: карипразин 3–6 мг/сут (151 человек), карипразин 6–9 мг/сут (148 участников) либо плацебо (147 человек) [J.Kane и соавт., 2015].
В обеих группах активного лечения, в которых больные получали карипразин, было достигнуто статистически достоверное значительное улучшение по сравнению с плацебо по подшкалам продуктивной и негативной симптоматики PANSS (J.Kane и соавт., 2015).
В 2016 г. был опубликован метаанализ, посвященный изучению эффективности и безопасности карипразина в терапии агрессивного поведения у больных шизофренией. В этот метаанализ вошли 3 двойных слепых плацебо-контролируемых РКИ по применению карипразина в краткосрочной купирующей терапии шизофрении (L.Citrome и соавт., 2016).
Авторы данного метаанализа пришли к выводу, что лечение карипразином ассоциируется со статистически достоверным значительным уменьшением агрессивности у больных шизофренией по сравнению с плацебо. Согласно их заключению препарат эффективен и безопасен и хорошо переносится при лечении агрессивного поведения у больных шизофренией (L.Citrome и соавт., 2016).
В более свежий метаанализ 2017 г., посвященный изучению эффективности и безопасности карипразина при купирующей терапии шизофрении, вошли 4 двойных слепых плацебо-контролируемых РКИ (W.Earley и соавт., 2017). Авторы этого метаанализа пришли к выводу, что частота ПЭ, наблюдавшихся при применении карипразина, пропорциональна его дозе в диапазоне используемых в данных РКИ дозировок (от 1,5 до 12 мг/сут). Они также заключили, что в пределах того диапазона дозировок карипразина, который одобрен FDA (от 1,5 до 6 мг/сут), препарат эффективен и безопасен и хорошо переносится при краткосрочной купирующей терапии у больных шизофренией (W.Earley и соавт., 2017).
Совсем недавно, в 2018 г., был опубликован метаанализ, в который вошли 4 двойных слепых плацебо-контролируемых сравнительных РКИ по применению карипразина в купирующей терапии шизофрении с общим числом участников 1843. Авторы этого метаанализа сделали вывод о том, что меньшее число пациентов, получавших карипразин, прекращали лечение по любой причине (например, из-за неэффективности терапии или ПЭ) по сравнению с плацебо. Кроме того, было показано, что статистически достоверно значительно меньшее число пациентов, получавших карипразин, испытывали серьезные ПЭ в отличие от АП сравнения, а также по сравнению с историческими данными об уровне ПЭ из РКИ по другим АП (M.Zhao и соавт., 2018).
Таким образом, авторы этого метаанализа пришли к заключению о том, что карипразин является эффективным и безопасным препаратом для купирующей терапии шизофрении, ассоциируется с более низким уровнем ПЭ, чем другие АП, и что его дальнейшее исследование при этой патологии является перспективным (M.Zhao и соавт., 2018).
В данном РКИ была показана высокая противорецидивная эффективность карипразина: время до наступления рецидива оказалось значительно дольше в подгруппе карипразина, чем в подгруппе плацебо (p=0,001). Рецидив за время наблюдения (72 нед) случился у 24,8% пациентов, получавших карипразин, и у 47,5% получавших плацебо. Таким образом, лечение карипразином более чем вдвое снижало вероятность рецидива за время наблюдения. Уровень ПЭ был низким. Во время предварительной открытой фазы исследования наиболее частыми из наблюдавшихся ПЭ карипразина были акатизия (у 19,2% пациентов), бессонница (14,4%) и головная боль (12%). Во время фазы поддерживающей терапии не было зарегистрировано каких-либо ПЭ с частотой, превышающей 10%. Авторы сделали вывод, что карипразин эффективен и безопасен при долгосрочной поддерживающей терапии шизофрении на протяжении по крайней мере 72 нед и очень хорошо переносится. Профиль долгосрочной безопасности карипразина в данном РКИ оказался сходным с тем, который был обнаружен в предыдущих, более краткосрочных, клинических исследованиях данного препарата (S.Durgam и соавт., 2016).
В другом долгосрочном РКИ от 2017 г. изучались как эффективность и безопасность карипразина при длительной противорецидивной терапии шизофрении, так и отдельно его эффективность в устранении негативной, когнитивной и аффективной симптоматики, а также влияние на общее качество жизни больных хронической шизофренией с преобладанием негативной симптоматики в сопоставлении с рисперидоном. Описанию результатов данного РКИ посвящена одна публикация, а изучению и сравнению изменений общего качества жизни больных шизофренией (QoL) при терапии карипразином и рисперидоном – другая (B.Németh и соавт., 2017 a, b).
В данном РКИ было выявлено статистически достоверное преимущество карипразина по сравнению с рисперидоном как в отношении эффективности влияния на негативную, когнитивную и аффективную симптоматику шизофрении, так и в отношении переносимости, уровня ПЭ и общего качества жизни больных (B.Németh и соавт., 2017 a, b).
В еще одном клиническом исследовании от 2017 г., имевшем открытый дизайн, изучали в первую очередь долгосрочную безопасность и переносимость карипразина при поддерживающем противорецидивном лечении шизофрении у взрослых. Однако кроме вопросов переносимости и безопасности карипразина при длительной терапии в данном исследовании оценке подвергалось также его влияние на общий балл по шкале PANSS (S.Durgam и соавт., 2017).
В этом исследовании приняли участие 93 человека. Около 1/2 пациентов (46 из 93) завершили это исследование. Наиболее частыми зарегистрированными в данном исследовании ПЭ карипразина были акатизия (у 14% пациентов), бессонница (14%), незначительное увеличение массы тела (12%). Авторы работы сделали вывод, что длительное поддерживающее лечение карипразином шизофрении в дозах от 1,5 до 4,5 мг/сут является безопасным по крайней мере в течение 48 нед, эффективно и хорошо переносится и не ассоциируется с возникновением каких-либо новых ПЭ или проблем безопасности при длительной терапии по сравнению с теми ПЭ, которые уже известны из краткосрочных исследований карипразина в острой фазе шизофрении (S.Durgam и соавт., 2017).
В еще одном более позднем (опубликованном в 2018 г.) исследовании, также с открытым дизайном и тоже посвященном изучению долгосрочной безопасности и эффективности карипразина при длительной поддерживающей терапии шизофрении у взрослых, приняли участие 586 человек. Карипразин назначался в гибких дозах от 3 до 9 мг/сут. Подбор дозировки и оценка безопасности и уровня ПЭ проводились в первые 4 нед. Затем больные получали подобранную дозу карипразина в течение еще 48 нед. Наиболее частыми зарегистрированными в этом исследовании ПЭ карипразина были акатизия (16%), головная боль (13%), бессонница (13%) и незначительное повышение массы тела (10%). При этом уровень отказов от лечения из-за выраженных ПЭ был низким – по этой причине прекратили терапию карипразином лишь 73 (12,5% от общего числа) пациента. Объективно расценены как серьезные ПЭ лишь у 59 (10,1%) человек. Авторы данного исследования сделали вывод, что долгосрочная поддерживающая терапия шизофрении карипразином в дозировках до
9 мг/сут эффективна, безопасна и хорошо переносится больными (A.Cutler и соавт., 2018).
В одном метаанализе, опубликованном в 2017 г., изучали долгосрочную эффективность и безопасность применения карипразина в поддерживающей противорецидивной терапии шизофрении. В него вошли результаты 2 двойных слепых 48-недельных РКИ с общим числом участников 679. Согласно данным этого метаанализа такие ПЭ, как акатизия, тремор, беспокойство, внутреннее напряжение, ЭПС, отмечались при длительной терапии менее чем в 5% случаев. Авторы данного метаанализа сделали вывод, что длительное поддерживающее противорецидивное лечение карипразином при шизофрении в рекомендованном FDA диапазоне терапевтических доз (1,5–6 мг/сут) эффективно, безопасно и хорошо переносится (H.Nasrallah и соавт., 2017).
В 2018 г. также опубликован интересный метаанализ, в котором сравнивалась эффективность разных ААП в лечении шизофрении с выраженной негативной симптоматикой либо с преимущественно негативной симптоматикой и выраженными КН.
Авторы этого метаанализа, обобщив данные 21 РКИ, сделали вывод, что из всех неклозапиновых ААП на сегодняшний день только для карипразина убедительно, методологически корректно доказано преимущество перед каким-либо другим ААП (а именно – рисперидоном) в устранении негативной и когнитивной симптоматики шизофрении. Для всех остальных неклозапиновых ААП, например для оланзапина, продемонстрировано лишь преимущество их в этом отношении над ТАП (галоперидолом), что на сегодняшний день является общим местом, не вызывающим особых сомнений (M.Krause и соавт., 2018).
Попарные же сравнения других неклозапиновых ААП между собой дают противоречивые результаты, или же использованные в исследованиях выборки пациентов слишком малы для того, чтобы делать какие-либо выводы (M.Krause и соавт., 2018).
Низкий уровень метаболических ПЭ при применении препарата связывают с отсутствием у него антагонизма к M3-холинергическим рецепторам, а также с его низкой аффинностью к гистаминовым H1 и серотониновым
5-HT2C-рецепторам (S.Durgam и соавт., 2015).
Кроме того, карипразин не обладает кардиотоксичностью, не влияет на скорость проведения импульсов в сердечной мышце и не вызывает клинически значимых изменений на электрокардиограмме. Уровень пролактина при лечении карипразином обычно снижается, а не повышается, как при лечении другими АП (L.Citrome, 2013).
Наиболее частые ПЭ при применении карипразина бывают либо центральными, либо желудочно-кишечными.
Среди первых, в порядке уменьшения частоты, наиболее часто регистрируются бессонница, легкие ЭПС, акатизия, седация, головная боль, головокружение, тревожность.
Среди желудочно-кишечных ПЭ наиболее часто отмечались, в порядке убывания, тошнота, запоры, рвота (S.Durgam и соавт., 2015).
Из опыта применения арипипразола было известно, что в связи с особенностями своего механизма действия он чаще других ААП вызывает акатизию. Поэтому вопрос о способности карипразина вызывать последнюю подвергся особенно тщательному исследованию. При этом было показано, что повышение вероятности возникновения акатизии при применении карипразина невелико по сравнению с применением плацебо и что оно меньше, чем у арипипразола. Было также отмечено, что вызванная карипразином акатизия по шкале Барни обычно не бывает тяжелой (S.Durgam и соавт., 2015).
Зарегистрированные в большинстве РКИ ПЭ карипразина, по-видимому, чаще всего не зависели от дозировки препарата (L.Citrome, 2013; S.Durgam и соавт., 2015).
Карипразин не обладает гепатотоксичностью, не вызывает повышения печеночных трансаминаз или иных лабораторных изменений функции печени. Он также не блокирует и не индуцирует изоферменты цитохрома P450 печени и имеет низкий риск межлекарственных взаимодействий (R.Roberts и соавт., 2016).
Вместе с тем из-за большого T1/2 как самого карипразина, так и его активных метаболитов и длительного времени, необходимого для установления его стационарной концентрации в крови, FDA добавила в официальную инструкцию к препарату предупреждение о том, что при лечении карипразином переносимость его можно оценивать только спустя несколько недель и что при терапии им возможны поздние ПЭ, возникающие в эти сроки (R.Roberts и соавт., 2016).
Как и любой другой препарат, карипразин противопоказан пациентам с известной непереносимостью или гиперчувствительностью (аллергией) к нему. Осторожность требуется также при применении препарата у больных, имеющих документированную гиперчувствительность к другим производным пиперазина (это не только арипипразол и брекспипразол, но и некоторые антигистаминные средства и др.) [J.Scarff, 2016].
Как и любой другой АП, карипразин потенциально способен повышать риск преждевременной смерти и сердечно-сосудистых осложнений у пожилых пациентов, особенно с дементными состояниями и психозами на их фоне. В силу этого поздний возраст, наличие деменции являются относительными (но не абсолютными) противопоказаниями к применению карипразина (J.Scarff, 2016).
Как и любой другой АП, карипразин потенциально способен вызвать злокачественный нейролептический синдром, хотя риск этого низкий. Как и любой другой АП, данный препарат также может снижать судорожный порог, что потенциально может привести к развитию судорог у предрасположенных лиц. Изредка отмечавшиеся острые дистонические реакции потенциально способны распространиться на глотательные мышцы, что может привести к развитию дисфагии и быть опасным для жизни. Иногда также фиксировалось снижение уровня лейкоцитов в крови, но не отмечалось развития опасных агранулоцитозов [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015].
Безопасность применения карипразина у беременных пока не установлена, и категория его безопасности для данного контингента еще не назначена. Однако известно, что новорожденные, подвергшиеся воздействию карипразина в III триместре беременности, имеют риск развития ЭПС и/или синдрома отмены, как и при применении других АП [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015].
Данные о безопасности использования карипразина у кормящих матерей также пока отсутствуют. В связи с этим производитель рекомендует учитывать и сопоставлять, с одной стороны, преимущества продолжения грудного вскармливания, с другой – объективную потребность матери в лечении ее психического заболевания именно карипразином, риск потенциально неблагоприятного воздействия на ребенка попавшего в молоко карипразина и риск такого же воздействия на него нелеченого психического заболевания матери [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015].
Прием карипразина следует начинать с 1,5 мг в течение 1 дня, а затем титровать дозу с шагом 1,5 или 3 мг до достижения целевой дозы (J.Scarff, 2016). У пациентов, которые уже принимают карипразин и которым начали давать тот или иной ингибитор цитохрома CYP3A4, следует уменьшить дозировку карипразина в 2 раза (при приеме 6 мг/сут – уменьшить до 3 мг/сут; 4,5 мг – сократить до 1,5 или 3 мг/сут; 1,5 мг/сут – принимать 1,5 мг/сут через день) [EMA Public Assessment Report on Reagila, 2017].
У пациентов, которые до начала терапии карипразином уже получают стабильную дозу ингибитора CYP3A4, лечение препаратом следует начинать с меньших, чем обычно, доз (1,5 мг через день), а максимальная дозировка не должна превышать 3 мг/сут (Scarff JR, 2016; EMA Public Assessment Report on Reagila, 2017).
При легкой или умеренной печеночной или почечной недостаточности корректировка дозы карипразина не требуется. При тяжелых степенях печеночной или почечной недостаточности безопасность применения препарата не установлена, и использование его в этих обстоятельствах производителем не рекомендуется [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015]. Также не рекомендуется одновременный прием карипразина с индукторами изофермента CYP3A4, поскольку это может привести к снижению эффективности терапии (EMA Public Assessment Report on Reagila, 2017).
Очень важно то, что, как показывают данные опубликованного в 2018 г. метаанализа, карипразин в настоящее время остается единственным неклозапиновым ААП, для которого строго методологически корректно доказано превосходство над рисперидоном в устранении негативной и когнитивной симптоматики шизофрении.
Резюмируя, мы можем сказать, что карипразин является весьма важным расширением терапевтического арсенала психиатра при лечении шизофрении, особенно с преобладанием негативной и/или когнитивной симптоматики.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Морозов Петр Викторович – д-р мед. наук, проф. каф. психиатрии ФУВ ФГБОУ ВО «РНИМУ им. Н.И.Пирогова»
Доказательная база эффективности и безопасности применения карипразина имеется как для острой купирующей, так и для поддерживающей терапии шизофрении. Препарат также является единственным из новых атипичных антипсихотиков, для которого строго методологически корректно доказано превосходство над рисперидоном в устранении негативной и когнитивной симптоматики шизофрении.
Ключевые слова: карипразин, производные пиперазина, арипипразол, брекспипразол, парциальный агонист D2-рецепторов, преференциальный лиганд D3-рецепторов, антипсихотик III поколения, шизофрения, негативная симптоматика.
Для цитирования: Быков Ю.В., Беккер Р.А., Морозов П.В. Эффективность карипразина в лечении шизофрении, особенно с преобладанием негативной симптоматики. Психиатрия и психофармакотерапия. 2018; 5: 27–37.
The efficacy of cariprazine in the treatment of schizophrenia, especially with prominent or predominant negative symptoms
Yu.V.Bykov1, R.A.Bekker2, P.V.Morozov31Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310;
2David Ben-Gurion University in Negev. 8410501, Israel, Be'er-Sheva;
3N.I.Pirogov Russian National Research Medical University of the Ministry of Health of the Russian Federation. 117997, Russian Federation, Moscow, ul. Ostrovitianova, d. 1yubykov@gmail.com
Cariprazine is the newest antipsychotic of the third generation (or, in other words, an atypical antipsychotic of the second generation). Chemically it is a derivative of piperazine. Its chemical structure resembles two other previously approved atypical antipsychotics – aripiprazole and brexpiprazole. Like those two drugs, cariprazine is a partial agonist of D2 and D3 dopamine receptors. However, it differs from both of them by its improved receptor profile, with preferential binding more to D3 than to D2 receptors. This gives cariprazine a number of advantages in treating the negative, cognitive and depressive symptoms of schizophrenia, and also lies in roots of its significant antidepressant activity. Cariprazine also has even lower potential to cause weight gain and metabolic side effects than both aripiprazole and brexpiprazole, which already were associated with lower risk of this undesirable side effect than any other antipsychotic that existed before them. This means that cariprazine has improved tolerability and long-term cardiovascular safety than either aripiprazole or brexpiprazole, let alone other, more weight gain-prone antipsychotics. In addition, cariprazine also has lower intrinsic agonist activity at D2 receptors compared to aripiprazole. As a result, cariprazine is much less prone to cause agitation, anxiety or insomnia or exacerbation of psychosis at the start of therapy, compared to aripiprazole. Another unique advantage of cariprazine over all other antipsychotics present on the market is that it has the greatest half-life among all oral antipsychotics. This gives cariprazine a special advantage when it is used in patients with a low level of compliance, poor insight or forgetfulness to take medications.
The evidence base for the efficacy and safety of the use of cariprazine is available both for the acute and maintenance therapy of schizophrenia. Cariprazine is also the only of new atypical antipsychotics that has scientifically proven better performance over risperidone in the treatment of schizophrenia with prominent or predominant negative and cognitive symptoms.
Key words: cariprazine, piperazine derivatives, aripiprazole, brexpiprazole, D2 receptor partial agonist, D3 receptor preferential ligand, third generation antipsychotic, schizophrenia.
For citation: Bykov Yu.V., Bekker R.A., Morozov P.V. The efficacy of cariprazine in the treatment of schizophrenia, especially with prominent or predominant negative symptoms. Psychiatry and Psychopharmacotherapy. 2018; 5: 27–37.
Введение (общие исторические сведения)
С момента открытия хлорпромазина в 1952 г. антипсихотики (АП) I поколения, или типичные АП (ТАП), произвели революцию в психиатрии. Это открытие привело к зарождению новой отрасли науки – психофармакологии и широкому применению ее достижений – психофармакотерапии в психиатрии. В свою очередь, достижения психофармакологии привели к значительному сокращению продолжительности пребывания психически больных в стационаре, уменьшению частоты рецидивов и госпитализаций и как следствие – к предоставлению возможности большому числу ранее на длительные сроки или пожизненно институционализированных пациентов с тяжелыми психическими заболеваниями жить вне стен специализированных учреждений, заново адаптироваться в обществе и во многих случаях даже вернуться к работе или иной общественно полезной деятельности (M.Solmi и соавт., 2017).Однако вскоре после начала широкого применения ТАП в психиатрии выяснилось, что их эффективность в купировании психопатологической симптоматики шизофрении весьма ограничена и наблюдается только в отношении позитивной (продуктивной) симптоматики, такой как бред, галлюцинации, агрессивное поведение, при нулевом или даже отрицательном влиянии на проявления негативной симптоматики, например апато-абулию (так называемый нейролептик-индуцированный дефицитарный синдром – НИДС), когнитивные нарушения (КН), аффективную симптоматику (нейролептические депрессии) [S.Stahl, 2013].
Кроме того, обнаружилось также, что кроме положительного влияния на продуктивную психопатологическую симптоматику ТАП также обладают многочисленными побочными эффектами (ПЭ), такими как выраженный экстрапирамидный синдром (ЭПС) и акатизия, ассоциированный с их применением риск возникновения поздних дискинезий (ПД), ортостатическая гипотензия (ОГ) и другие нежелательные сердечно-сосудистые эффекты, а также гиперпролактинемия (ГП), повышение аппетита, прибавка массы тела вплоть до ожирения, развитие сахарного диабета (СД) 2-го типа, метаболического синдрома – МС (P.Weiden, 2007; S.Stahl, 2013; J.Frankel, T.Schwartz, 2017).
Это связывают с недостаточной селективностью ТАП, т.е. с тем, что они блокируют дофаминовые D2-рецепторы не только в тех областях мозга, где это необходимо для развития антипсихотического эффекта (в мезолимбической системе), но и, например, в мезокортикальной (что приводит к развитию НИДС и КН), нигростриарной (что приводит к развитию ЭПС и акатизии и возникновению риска ПД), тубероинфундибулярной системе (что ведет к развитию ГП), рвотном центре, центрах регуляции аппетита и насыщения (вызывает не только противорвотный эффект, но и повышение аппетита и прибавку массы тела, а затем и развитие метаболических нарушений) [S.Stahl, 2013].
Сопутствующая блокада других типов рецепторов, таких как a1-адренергические, М-холинергические и H1-гистаминовые, добавляла свои ПЭ (соответственно, ОГ, сонливость и седация, запоры и другие М-холинолитические эффекты) и часто ограничивала дозу АП сверху. В ряде случаев это вообще не давало возможности достичь у конкретного больного терапевтически эффективной дозировки (S.Stahl, 2013).
От I поколения АП ко II поколению
Чтобы преодолеть упомянутые принципиальные ограничения эффективности ТАП в отношении негативной, когнитивной и аффективной симптоматики шизофрении, а также улучшить переносимость АП и уменьшить их ПЭ, были синтезированы новые более селективные так называемые атипичные АП (ААП), или АП II поколения.Первым настоящим «неклозапиновым» (т.е. не случайно открытым, а целенаправленно синтезированным) ААП стал синтезированный в начале 1990-х годов рисперидон. Он вызывал меньше ЭПС и акатизии, НИДС, нейролептических депрессий и КН, в основном благодаря своему сильному антагонизму к серотониновым 5-HT2A-рецепторам (более сильному, чем его же антагонизм к дофаминовым D2-рецепторам) [S.Stahl, 2013; J.Frankel, T.Schwartz, 2017]. Было показано, что в основе «атипичности» клинического профиля рисперидона и многих других ААП лежит именно их сильная способность к блокаде 5-HT2A-рецепторов, которая способствует косвенному повышению уровня дофамина в таких областях мозга, как нигростриарная (что потенциально способно уменьшить ЭПС и акатизию и риск возникновения ПД), тубероинфундибулярная система (потенциально снижает степень вызываемой ААП ГП), префронтальная кора (сокращает риск возникновения НИДС, нейролептик-индуцированных КН и нейролептических депрессий при применении ААП) [S.Stahl, 2013; J.Frankel, T.Schwartz, 2017].
Широкое применение в психиатрии ААП, начавшееся с внедрения в психиатрическую практику рисперидона, способствовало переориентации мышления как самих психиатров, так и пациентов и их родственников, изменению целей, которые ставились отныне перед терапией АП, от цели «подавления продуктивной симптоматики любой ценой, в том числе ценой ЭПС, ГП и других осложнений» к более гуманному и индивидуализированному, комплексному подходу, в котором ставилась цель подавления не только и даже не столько продуктивной, сколько негативной, когнитивной и аффективной симптоматики шизофрении, в большей мере определяющей долгосрочные функциональные исходы, социализацию и трудоспособность больных (S.Stahl, 2013).
Это также привело к тому, что главной целью стало не само по себе подавление той или иной симптоматики, а восстановление психосоциального, семейно-бытового и профессионального функционирования, улучшение общего качества жизни пациентов при одновременной минимизации ПЭ (S.Stahl, 2013; M.Solmi и соавт., 2017).
За истекшие десятилетия строго доказано, что ААП демонстрируют гораздо лучший профиль безопасности и переносимости по сравнению с ТАП при сопоставимой с последними эффективности в отношении продуктивной психопатологической симптоматики, но лучшей эффективности в отношении когнитивной, негативной и аффективной симптоматики (S.Stahl, 2013; M.Solmi и соавт., 2017).
ААП реже и меньше, по сравнению с ТАП, вызывают ЭПС и акатизию, ГП, реже и меньше вызывают НИДС, КН, нейролептические депрессии и могут даже сами обладать антидепрессивной, антинегативной и прокогнитивной активностью (S.Stahl, 2013; M.Solmi и соавт., 2017).
Таким образом, важнейшим преимуществом ААП перед ТАП является то, что при сопоставимой с ТАП эффективности в отношении продуктивной симптоматики они дают меньше таких ПЭ, как ЭПС и акатизия, ГП, НИДС, и имеют более широкий спектр активности в отношении других доменов симптоматики шизофрении – негативной, когнитивной и аффективной. Это транслируется в улучшение общего качества жизни больных шизофренией, их социализации, семейно-бытового и профессионального функционирования, а также в более высокую комплаентность по отношению к лечению ААП, чем к терапии ТАП (S.Stahl, 2013).
Все это привело к тому, что ААП постепенно вытеснили ТАП в качестве препаратов 1-й линии для лечения шизофрении и других психозов во многих алгоритмах, отодвинув использование ТАП во 2-ю и даже 3-ю линию терапии или оставив применение ТАП в 1-й линии только для ситуаций острого психомоторного возбуждения и агрессивности (S.Stahl, 2013).
Однако создание и широкое применение ААП I поколения, таких как рисперидон, оланзапин, кветиапин, обозначило новую проблему. Прежде всего оказалось, что добиться высокой селективности блокады тем или иным новым препаратом 5-HT2A-рецепторов, не затрагивая сходные по строению 5-HT2C-рецепторы, крайне сложно. Между тем неизбирательная блокада 5-HT2C-рецепторов, несмотря на то что она имеет полезное антидепрессивное и прокогнитивное действие за счет вызываемого ею реципрокного повышения уровней норадреналина и дофамина в префронтальной коре, также вызывает резкое повышение аппетита (в связи с блокадой «серотонинергического тормоза» в центрах регуляции аппетита и насыщения), особенно в сочетании с блокадой H1-гистаминовых и/или M3-холинергических рецепторов, которой такие первые ААП также не были лишены (S.Stahl, 2013).
Это привело к тому, что первые ААП (особенно оланзапин) вызывают еще большую прибавку массы тела и еще более выраженные метаболические нарушения (СД 2-го типа, МС), чем ТАП (S.Stahl, 2013). Это вызвало необходимость в разработке новых ААП с улучшенными рецепторными свойствами и пониженной вероятностью развития метаболических ПЭ (S.Stahl, 2013).
Кроме того, обнаружилось также, что даже такой более низкий по сравнению с ТАП уровень полной блокады
D2-рецепторов, который свойственен первым ААП рисперидону и оланзапину, хотя и снижает, но неполностью исключает риск развития ЭПС, КН, нейролептических депрессий и/или НИДС и возникновения в дальнейшем ПД при лечении ими. Кветиапин же, имеющий самый низкий среди ААП (кроме клозапина) уровень оккупации D2-рецепторов в терапевтических дозах и потому обычно не ассоциирующийся с развитием компенсаторной гиперчувствительности D2-рецепторов и феномена ПД при длительной терапии им, оказался достаточно слабым АП, не всегда надежно устраняющим продуктивную симптоматику (S.Stahl, 2013).
Стало понятно, что сам принцип полной функциональной D2-блокады при любом ее уровне и при любой степени ее компенсации другими рецепторными свойствами, такими как 5-HT2A-блокада, имеет принципиальные ограничения по эффективности и что в некоторых областях мозга, например в префронтальной коре, где дофаминергическая нейротрансмиссия при шизофрении ослаблена (с чем связывают негативную и когнитивную симптоматику), D2-рецепторы желательно стимулировать, а в некоторых других, таких как мезолимбическая система, где дофаминергическая нейротрансмиссия при психозах избыточно усилена, D2-рецепторы желательно блокировать, по возможности также соблюдая относительную «нейтральность» в отношении регулирования дофаминергической нейротрансмиссии в тех зонах мозга, где она интактна – в нигростриарной и тубероинфундибулярной системе (S.Stahl, 2013).
Это понимание привело к зарождению концепции парциального D2-агонизма как основы антипсихотического действия нового, III поколения АП (или II поколения ААП), вместо полной D2-блокады, свойственной как I, так и II поколению АП (т.е. свойственной как ТАП, так и ААП I поколения, но у последних D2-блокада уравновешивается другими рецепторными свойствами) [S.Stahl, 2013; J.Frankel, T.Schwartz, 2017].
Парциальный D2-агонизм как раз и предоставляет возможность создавать функциональную D2-блокаду в тех зонах мозга, где дофаминергическая активность избыточно усилена, и одновременно обеспечивать мягкую, умеренную, тоническую D2-стимуляцию в тех зонах мозга, где дофаминергическая активность патологически снижена (S.Stahl, 2013; J.Frankel, T.Schwartz, 2017).
От II поколения АП к III поколению
Именно на основе упомянутого принципа парциального D2-агонизма 10 лет спустя после появления первого ААП рисперидона был синтезирован первый АП III поколения, или ААП II поколения – арипипразол. Он получил разрешение Управления по контролю пищевых продуктов и лекарств в США (Food and Drug Administration – FDA) и поступил в продажу в 2002 г. (S.Stahl, 2013; J.Frankel, T.Schwartz, 2017).Задачи, которые ставились при синтезе арипипразола, – добиться создания ААП с очень низким потенциалом вызывания повышения аппетита, прибавки массы тела и метаболических нарушений (СД 2-го типа, МС), а также с нормализующим, а не повышающим влиянием на пролактин, низким риском вызывания ЭПС и НИДС, ПД и выраженным антинегативным и антидепрессивным действием – были во многом решены (S.Stahl, 2013; J.Frankel, T.Schwartz, 2017).
От III поколения АП к карипразину и индивидуализированной терапии
До 2015 г. арипипразол оставался не только первым, но и единственным в классе АП препаратом III поколения с упомянутым уникальным механизмом парциального D2-агонистического действия (S.Stahl, 2013; J.Frankel, T.Schwartz, 2017). Однако с его применением тоже ассоциировался ряд новых проблем, не свойственных предыдущим поколениям АП.Прежде всего оказалось, что для многих больных шизофренией арипипразол – «слишком D2-агонистичен» и из-за этого довольно часто вызывает, особенно в начале терапии, обострение продуктивной психотической симптоматики (бреда и галлюцинаций), психомоторное возбуждение, тревогу, бессонницу, вегетативную неустойчивость, тошноту и даже рвоту. Для других же пациентов арипипразол – по-прежнему «недостаточно D2-агонистичен» и вызывает ЭПС, акатизию или недостаточно хорошо устраняет негативную, когнитивную и депрессивную симптоматику шизофрении (S.Stahl, 2013, 2015, 2017).
Это привело к необходимости синтезировать новые парциальные D2-агонисты, находящиеся на разных концах агонист-антагонистического спектра и удовлетворяющие потребности этих столь разных подгрупп больных шизофренией: либо «более D2-антагонистические», чем арипипразол, «более классические в этом отношении, более близкие к I и II поколению АП» (таковы появившийся в 2015 г. в США брекспипразол и новейший, получивший разрешение FDA также в 2015 г., карипразин, который является темой данной статьи), либо, напротив, «более
D2-агонистические», чем арипипразол, «более близкие к прамипексолу», такие как не получивший одобрения FDA в 2007 г. бифепрунокс и некоторые другие новые, разрабатываемые сейчас, молекулы АП (S.Stahl, 2013, 2015, 2017).
Кроме того, важно также и то, что все имеющиеся на сегодняшний день на рынке ТАП и ААП, включая как уже упоминавшиеся арипипразол и брекспипразол, так и новейший карипразин, помимо своего сродства к D2-рецепторам, которым, как полагают, в основном и обусловлена их антипсихотическая активность (M.Nord, L.Farde, 2011), имеют также различные – и у разных препаратов значительно различающиеся – степени сродства к дополнительным рецепторам, имеющимся в центральной нервной системе и периферических тканях (S.Leucht и соавт., 2013; S.Stahl, 2013).
Это, а также различия в особенностях печеночного метаболизма разных препаратов, объясняет индивидуальные различия данных препаратов в отношении их эффективности, переносимости и профилей ПЭ у разных пациентов (S.Leucht и соавт., 2013; S.Stahl, 2013).
Поэтому создание новых ААП с улучшенными и отличающимися друг от друга рецепторными профилями, улучшенной переносимостью и устойчивой эффективностью в отношении широкого спектра симптомов шизофрении, а не только продуктивной симптоматики – весьма важно и предоставляет возможность более тонкого подбора и индивидуализации терапии, минимизации ПЭ, улучшения качества жизни и долгосрочных функциональных исходов пациентов (S.Leucht и соавт., 2013; S.Stahl, 2013).
Именно в свете этого карипразин – это не просто «еще один новый АП III поколения», а весьма важное расширение терапевтического арсенала психиатров (J.Frankel, T.Schwartz, 2017).
Карипразин был одобрен FDA в 2015 г. и затем European Medicines Agency (EMA) в 2017 г. для лечения шизофрении в дозировке 1,5–6 мг/сут (L.Citrome, 2016; S.Durgam и соавт., 2017).
Краткое введение в патофизиологию шизофрении
Для лучшего понимания того, почему для АП III поколения (парциальных дофаминергических агонистов) и, в частности, карипразина, с теоретической точки зрения была предсказана более высокая эффективность в устранении негативной, когнитивной и депрессивной симптоматики шизофрении по сравнению с АП II поколения («обычными» ААП – «смешанными D2/5-HT2-антагонистами», такими как рисперидон, оланзапин, кветиапин), а у АП II поколения эффективность в отношении этих доменов симптоматики шизофрении была предсказана более высокой, чем у ТАП (и эти предсказания впоследствии подтвердились клинически), необходим краткий экскурс в патофизиологию шизофрении.Ведущей на сегодняшний день гипотезой относительно патофизиологии шизофрении является гипотеза генетически обусловленной дисфункции NMDA-рецепторов парвальбуминсодержащих ГАМКергических интернейронов коры (прежде всего ее префронтальных областей), получающих входящую глутаматергическую нейротрансмиссию от пирамидных нейронов вышележащих слоев коры. Эта дисфункция NMDA-рецепторов ГАМК-интернейронов приводит к нарушению нормальных процессов синаптогенеза и синаптической пластичности (укрепления «нужных» синаптических связей) и синаптического прунинга (удаления, элиминации «ненужных» синаптических связей) [S.Stahl, 2013; P.Ruiz, 2017].
Это, в свою очередь, приводит к тому, что у пациентов с шизофренией после завершения периода полового созревания, в течение которого под влиянием половых стероидов в норме происходит наиболее активный синаптический прунинг, сохраняется большое количество «слабых», неэффективных глутаматергических синапсов, которые в норме должны были бы быть элиминированы в процессе прунинга.
Дисфункция NMDA-рецепторов ГАМКергических интернейронов коры также приводит к патологическому усилению активности глутаматергических нейронов вышележащих слоев коры (так как они не получают достаточного тормозного ГАМК-сигнала) и к постепенной их гибели вследствие NMDA-опосредованной эксайтотоксичности, что, видимо, и является причиной «кумулятивной токсичности» перенесенных шизофренических психозов, нарастания с течением времени проявлений шизофренического дефекта (негативной симптоматики) и КН (S.Stahl, 2013; P.Ruiz, 2017).
Кроме того, дисфункция NMDA-рецепторов парвальбуминсодержащих ГАМКергических интернейронов коры ведет к развитию вторичной дисфункции самих этих нейронов, в частности, к снижению в них активности ГАМК-трансаминазы и содержания ГАМК. А это, в свою очередь, оказывает неблагоприятное влияние на модуляцию активности множества нейронных цепей, в которых участвуют эти интернейроны – и в особенности дофаминергических и серотонинергических нейронных цепей (S.Stahl, 2013).
Таким образом, «глутаматергическая» теория вовсе не отменяет прежние теории шизофрении – «дофаминовую» и «дофамин-серотонинового дисбаланса», а объясняет нарушения, наблюдаемые при шизофрении в дофаминергических и серотонинергических нейронных цепях, как вторичные по отношению к глутаматергической и ГАМКергической дисфункциям (S.Stahl, 2013; P.Ruiz, 2017).
Разберем механизм возникновения этих вторичных дофаминергических нарушений при шизофрении чуть подробнее. Дофаминергические проводящие пути в мезолимбической системе (от вентральной области покрышки – Ventral Tegmental Area, VTA – к прилежащему ядру – Nucleus Accumbens, NAcc) регулируются нисходящими глутаматергическими влияниями от пирамидных нейронов коры непосредственно – без участия вставочных ГАМКергических нейронов. Поэтому упомянутая нами гиперактивность глутаматергических пирамидных нейронов коры приводит к стимуляции дофаминергических нейронов NAcc и VTA, развитию дофаминергической гиперактивности в мезолимбической системе, и в конечном счете – к развитию продуктивной симптоматики шизофрении (бреда, галлюцинаций, специфических нарушений мышления) [S.Stahl, 2013; P.Ruiz, 2017].
В то же время дофаминергические проводящие пути в мезокортикальной системе (иннервирующей, в частности, префронтальную кору) регулируются нисходящими глутаматергическими влияниями пирамидных нейронов коры через посредство тех самых ослабленных и дисфункциональных вставочных ГАМК-нейронов. Поэтому гиперактивность глутаматергических пирамидных нейронов коры ведет к угнетению дофаминергической нейротрансмиссии в мезокортикальной системе, снижению выделения дофамина в префронтальной коре, и в конечном счете – к развитию негативной, депрессивной и когнитивной симптоматики шизофрении (S.Stahl, 2013; P.Ruiz, 2017).
Таким образом, получается, что для эффективного устранения всей симптоматики шизофрении (не только продуктивной, но и негативной, когнитивной и аффективной) необходим такой препарат, который был бы способен в одних областях мозга (в мезолимбической системе, где дофамина изначально слишком много) дофаминергическую активность снижать, а в других (в мезокортикальной системе, где дофамина изначально слишком мало), наоборот, повышать (S.Stahl, 2013; P.Ruiz, 2017).
Теоретически существует два способа обеспечить повышение дофаминергической активности в мезокортикальной системе (т.е. устранение негативной, когнитивной и аффективной симптоматики) без снижения степени дофаминергической блокады в мезолимбической системе (и без соответствующего снижения эффективности в отношении продуктивной симптоматики).
Один способ заключается в использовании косвенного механизма повышения дофаминергической активности в префронтальной коре при помощи блокады серотонинергических 5-HT2A-рецепторов или парциального агонизма к 5-HT1A-рецепторам. Этот способ используют все «обычные» ААП (АП II поколения), такие как рисперидон, оланзапин, кветиапин.
Другой же способ заключается в применении для лечения шизофрении парциальных дофаминергических агонистов, которые сами собой, встроенным в сам принцип их действия образом, т.е. напрямую (а не косвенным механизмом) проявляют дофамин-подобные свойства в тех областях мозга, в которых дофамина изначально мало, и одновременно конкурируют с последним и снижают его активность в тех областях мозга, в которых дофамина изначально слишком много (S.Stahl, 2013; Ruiz P, 2017).
Однако общим принципом фармакологии, и в частности психофармакологии, является то, что, чем ближе механизм действия лекарства к самому ядру патогенеза заболевания, тем потенциально выше его эффективность в устранении всей симптоматики заболевания и что прямые механизмы воздействия на ключевые звенья патогенеза болезни всегда эффективнее косвенных. Поэтому было заранее предсказано, что парциальные дофаминергические агонисты (АП III поколения) должны быть эффективнее «смешанных 5-HT2A/D2-антагонистов» (АП II поколения) в устранении негативной, когнитивной и аффективной симптоматики шизофрении. Это в целом подтвердилось клинически (S.Stahl, 2013; P.Ruiz, 2017).
В перспективе возможен синтез АП, работающих на совершенно новых принципах, лежащих еще ближе к ядру патогенеза шизофрении, в частности, влияющих на лежащие в основе всего болезненного процесса глутаматергическую и ГАМКергическую дисфункции. Потенциально они могут быть еще эффективнее в отношении негативной симптоматики шизофрении. Пока такие попытки (в частности, попытки разработки агонистов метаботропных глутаматных рецепторов 2 и 3-го подтипов – mGluR2/3) не увенчались успехом. Однако с использованием современных методов компьютеризированного поиска и моделирования подходящих соединений это положение может измениться, и такие лекарства, несомненно, будут найдены и внедрены.
Пока же в ожидании этого самыми эффективными средствами устранения негативной и когнитивной симптоматики шизофрении остаются именно парциальные дофаминергические агонисты (S.Stahl, 2013; P.Ruiz, 2017).
Завершив описание современной теории патофизиологии шизофрении (по необходимости краткое, в силу ограничений объема журнальной статьи), перейдем к рассмотрению свойств карипразина – новейшего члена семейства парциальных дофаминергических агонистов – и доказательной базы для его применения при лечении шизофрении.
Химическое строение карипразина
 Карипразин является производным пиперазина, который был разработан «Gedeon Richter» в Венгрии (R.Roberts и соавт., 2016). Первоначально ученые разрабатывали в качестве потенциального нового ААП несколько другое вещество, а то, которое мы сегодня знаем как карипразин – транс-N-(4-(2-(4-(2,3-дихлорфенил)пиперазин-1-ил)этил)циклогексил)-N',N'-диметиламид, было получено попутно в процессе его синтеза (см. рисунок) [É.Ágai-Csongor и соавт., 2012].
Карипразин является производным пиперазина, который был разработан «Gedeon Richter» в Венгрии (R.Roberts и соавт., 2016). Первоначально ученые разрабатывали в качестве потенциального нового ААП несколько другое вещество, а то, которое мы сегодня знаем как карипразин – транс-N-(4-(2-(4-(2,3-дихлорфенил)пиперазин-1-ил)этил)циклогексил)-N',N'-диметиламид, было получено попутно в процессе его синтеза (см. рисунок) [É.Ágai-Csongor и соавт., 2012].Однако последующие эксперименты показали, что именно это «попутное» вещество, которое теперь известно как карипразин, – клинически более перспективное, чем то вещество, над которым изначально работали ученые (É.Ágai-Csongor и соавт., 2012). Этот препарат первоначально был синтезирован в лабораториях компании «Gedeon Richter Ltd.» и затем разрабатывался и испытывался в кооперации с компаниями «Forest Laboratories Inc.» и «Mitsubishi Tanabe Pharma Corp.».
Химически он относится к производным пиперазина (как и уже упоминаемые арипипразол и брекспипразол, к которым он близок по строению) [S.Stahl, 2013, 2015, 2017; А.Б.Шмуклер, 2014].
На ранних этапах разработки препарат имел кодовое название RGH-188, а затем был переименован в карипразин и клинически исследован для применения при шизофрении и других психозах. В США он имеет торговое название Vraylar®, а в Европе – Reagila® (R.Roberts и соавт., 2016).
Фармакокинетика
Карипразин быстро и практически полностью (общая абсорбция 95–98%) всасывается в желудочно-кишечном тракте и быстро распределяется в организме после перорального приема (F.Werner, R.Coveñas, 2015). Пиковая концентрация в плазме крови (Cmax) карипразина достигается через 3–4 ч после перорального приема. Время достижения Cmax карипразина не зависит от одновременного приема пищи или приема препарата натощак (G.Moszáros и соавт., 2007; M.Kapás и соавт., 2008). Карипразин обладает высокой липофильностью и хорошо проходит гематоэнцефалический барьер (G.Pásztor Mészáros и соавт., 2008; F.Werner, R.Coveñas, 2015).Карипразин обладает самым длительным среди всех представленных сегодня на рынке пероральных АП периодом полувыведения (T1/2) – он составляет от 2 до 6 сут (G.Mészáros и соавт., 2007; M.Kapás и соавт., 2008). Это дает препарату уникальные терапевтические преимущества при его применении у больных с пониженной комплаентностью терапии АП и отказом от пролонгированных инъекционных форм АП либо с их непереносимостью, а также у пациентов с пониженным уровнем критичности к своему состоянию или с выраженными КН, обусловливающими забывчивость в приеме лекарств (S.Stahl, 2015, 2017).
Стабильная концентрация карипразина в плазме крови (Css) при его постоянном приеме (Tss) достигается через
5 T1/2, т.е. в сроки от 1 нед до 1 мес (F.Werner, R.Coveñas, 2015).
Длительный период до стабилизации концентрации карипразина в крови означает, что при применении карипразина в еще большей мере, чем при использовании также обладающих довольно большими (но меньшими, чем у карипразина) T1/2 и Tss арипипразола и брекспипразола, необходимо терпение и что при применении нельзя преждевременно делать выводы о его неэффективности у конкретного больного в первые недели терапии (F.Werner, R.Coveñas, 2015; S.Stahl, 2015, 2017).
Как и большинство других липофильных АП, карипразин выводится из организма в основном за счет метаболизма в печени и последующего выведения метаболитов с мочой и в меньшей мере – с калом. У препарата имеются два активных деметилированных метаболита – N-дезметилкарипразин (норкарипразин) и N-дидезметилкарипразин (диноркарипразин). Оба активных метаболита имеют еще более длительный T1/2, чем родительское соединение (карипразин), что продлевает время до прекращения функциональной блокады D2-рецепторов до 1 мес и более.
Это дает карипразину уникальные преимущества при лечении больных с пониженной комплаентностью терапии АП, низким уровнем критики к своему состоянию, выраженными КН или забывчивостью в приеме лекарств (G.Pásztor Mészáros и соавт., 2008; F.Werner, R.Coveñas, 2015).
Метаболизм карипразина в печени происходит при участии ферментов системы микросомальных смешанных оксидаз – изоферментов цитохрома P450 (CYP450), в основном изофермента CYP450 3A4 и в меньшей степени также изофермента CYP450 2D6 (N.Kirschner и соавт., 2008). Образовавшиеся метаболиты затем подвергаются глюкуронизации и выводятся в основном с мочой. После отмены карипразина при длительном приеме снижение уровня его в плазме на 50% наблюдается через 1 нед (N.Kirschner и соавт., 2008).
Фармакодинамика
Карипразин, подобно арипипразолу и брекспипразолу, является парциальным агонистом D2-дофаминовых рецепторов. Кроме того, подобно указанным препаратам, карипразин также активно связывается с дофаминовымиD3-рецепторами. Однако если арипипразол и брекспипразол являются по отношению к D3-рецептору скорее антагонистами, то карипразин, в отличие от них, – парциальным агонистом также и по отношению к D3-рецепторам. Кроме того, карипразин, в отличие от арипипразола и брекспипразола, обладает значительно более высокой аффинностью к D3-, чем к D2-дофаминовым рецепторам. Поэтому он предпочтительно связывается с D3-рецепторами (B.Kiss и соавт., 2010; П.В.Морозов, В.Э.Медведев, 2014; А.Б.Шмуклер, 2014; S.Durgam и соавт., 2017).
Среди всех представленных на рынке ААП (исключая клозапин) именно карипразин имеет наиболее высокое соотношение аффинности к D3-рецепторам и его же аффинности к D2-рецепторам. Его аффинность к D3-рецепторам, измеренная на клонированных рецепторах человека in vitro, превышает его же аффинность к клонированным человеческим D2-рецепторам in vitro, по данным разных исследователей, в 6–10 раз (B.Kiss и соавт., 2010; P.McCormick и соавт., 2010; L.Citrome, 2013; F.Werner, R.Coveñas, 2015).
Это преференциальное воздействие карипразина именно на D3-, а не на D2-рецепторы в сочетании с его парциальным агонизмом, а не полным антагонизмом по отношению к D3-рецептору может обусловливать уникальное сильное положительное влияние карипразина на негативную, когнитивную и аффективную (депрессивную) симптоматику шизофрении (J.Joyce, M.Millan, 2005; B.Kiss и соавт., 2008; R.Zimnisky и соавт., 2013).
Дело в том, что именно D3-, а не D2-рецепторы играют особенно важную роль в регуляции настроения, чувства удовольствия, а также когнитивных функций. Дисфункция этих рецепторов сопряжена с депрессией, ангедонией, развитием КН, а также влечения к психоактивным веществам (G.Gross, K.Drescher, 2012).
Карипразин специально разрабатывался именно исходя из предположения о том, что соединение, проявляющее более высокую аффинность связывания с D3-, чем с D2-дофаминовыми рецепторами, и являющееся парциальным агонистом по отношению к обоим подтипам дофаминовых рецепторов (а не только к D2 подтипу, одновременно антагонизируя D3 подтип), может оказаться особенно полезным в лечении негативной, когнитивной и депрессивной симптоматики шизофрении, а также в уменьшении нередко сопутствующего этому тяжелому психическому заболеванию влечения к психоактивным веществам. Это предположение нашло свое подтверждение в клинической практике при применении карипразина (J.Joyce, M.Millan, 2005; B.Kiss и соавт., 2008; R.Zimnisky и соавт., 2013; S.Stahl, 2013, 2015, 2017).
Такая особенность рецепторного профиля карипразина приводит к тому, что препарат более сбалансированно связывается с D2- и D3-дофаминовыми рецепторами in vivo как в экспериментальных моделях на животных (I.Gyertyán и соавт., 2011; É.Ágai-Csongor и соавт., 2012), так и у пациентов с шизофренией, а также у здоровых добровольцев (R.Girgis и соавт., 2016).
Это отличает карипразин от всех других ААП, кроме клозапина, которые in vivo преимущественно связываются с D2-, а не с D3-дофаминовыми рецепторами, и сближает его с клозапином в этом отношении (A.Graff-Guerrero и соавт., 2009; P.McCormick и соавт., 2010).
Кроме того, было также показано, что карипразин уникален среди всех других неклозапиновых ААП (и, в частности, отличается в этом от своего ближайшего родственника арипипразола) в том, что он при длительном приеме способен повышать экспрессию (вызывать апрегуляцию) D3-рецепторов в ряде областей мозга. Между тем экспрессия D3-рецепторов в противоположность экспрессии D2-рецепторов у нелеченых больных шизофренией обычно исходно снижена, а не повышена, и ее апрегуляция является полезным эффектом (Y.Choi и соавт., 2014).
Применение карипразина также косвенным механизмом приводит к апрегуляции (повышению количества и плотности) и увеличению фосфорилирования (а значит, и функциональной активности) NMDA-рецепторов, чего не наблюдается при применении других неклозапиновых ААП (Y.Choi и соавт., 2014).
Между тем именно гипофункция NMDA-рецепторов, как принято считать сегодня, лежит в основе патогенеза шизофрении и вторично обусловливает наблюдаемые при ней нарушения в работе дофаминергической и серотонинергической системы мозга (S.Stahl, 2013).
Как мы уже упоминали, парциальные агонисты D2-рецепторов, к которым относится и карипразин, имеют более низкий риск развития ЭПС, акатизии, НИДС, нейролептических депрессий и нейролептикассоциированных КН, ПД, а также ГП и ассоциированных с нею метаболических и сексуальных нарушений, чем полные антагонисты
D2-рецепторов (S.Stahl, 2013, 2015, 2017; J.Scarff, 2016).
Тот факт, что карипразин является слабым парциальным агонистом, а не полным антагонистом D2- и D3-дофаминовых рецепторов, обеспечивает возможность достижения при лечении его терапевтическими дозами очень высокого процента занятости D2- и D3-дофаминовых рецепторов (приближающегося к 90–100%) без развития выраженных ЭПС – процента, который при лечении полными антагонистами D2-рецепторов, будь то ТАП или ААП I поколения, был бы недостижим без развития полной акинезии (N.Seneca и соавт., 2011; S.Stahl, 2013). Это обеспечивает карипразину возможность добиться терапевтического успеха в ряде случаев резистентной шизофрении, при которой обеспечиваемая ТАП и ААП I поколения 60–80% степень занятости D2-рецепторов оказывается недостаточной для получения терапевтического эффекта (N.Seneca и соавт., 2011; S.Stahl, 2013).
Так, уже при дозах, эквивалентных 2–3 мг/сут карипразина для человека, процент оккупации D2- и D3-рецепторов у экспериментальных приматов достигает 85% (N.Seneca и соавт., 2011). У пациентов с шизофренией уже при дозе 1,5 мг/сут процент оккупации D2- и D3-рецепторов превышает 69–75% (S.Potkin и соавт., 2009). У здоровых добровольцев уже при дозировке всего 1 мг/сут достигается 65% занятость D2- и D3-рецепторов (I.Laszlovsky и соавт., 2007).
Процент же занятости 5-HT1A серотониновых рецепторов в терапевтических дозах in vivo, несмотря на высокое сродство карипразина к этим рецепторам, не превышает 20–30%, что сопоставимо с аналогичными показателями у арипипразола и буспирона, но меньше, чем у новейших мультимодальных антидепрессантов вилазодона и вортиоксетина, у которых он приближается к 50% (N.Seneca и соавт., 2011; S.Stahl, 2013, 2015, 2017).
Карипразин преимущественно подавляет чрезмерную спонтанную активность мезолимбических дофаминергических нейронов (с чем и связывают его антипсихотический, антибредовый, антигаллюцинаторный эффект), практически не оказывая влияния на дофаминергические нейроны нигростриарной (с чем ассоциируют низкий риск возникновения при лечении им ЭПС, акатизии, ПД) и тубероинфундибулярной системы (с чем связывают низкий риск возникновения при терапии им ГП и связанных с ней метаболических и сексуальных нарушений) [S.Caccia и соавт., 2013; S.Stahl, 2013, 2015, 2017].
Парциальный агонизм карипразина к D2- и D3-дофаминовым рецепторам в основном реализуется в стриатуме (антипсихотический эффект) и префронтальной коре (антинегативный и прокогнитивный эффекты) [F.Werner, R.Coveñas, 2015].
Кроме своего высокого сродства к D3- и D2-дофаминовым рецепторам карипразин, подобно арипипразолу, также имеет in vitro и in vivo достаточно высокое сродство к 5-HT1A-серотониновым рецепторам, для которых он также является парциальным агонистом (Ki=0,085, 0,5 и 3,0 nM соответственно) [N.Seneca и соавт., 2011; L.Citrome, 2013; А.Б.Шмуклер, 2014].
Парциальный агонизм карипразина к 5-HT1A-серотониновым рецепторам приводит к реципрокному повышению уровней дофамина и норадреналина в префронтальной коре, увеличению уровня дофамина в нигростриарной и тубероинфундибулярной системе (по аналогии с буспироном, арипипразолом). Это дополнительно снижает вероятность возникновения при лечении карипразином ЭПС, НИДС, КН, ГП, нейролептических депрессий, сексуальных нарушений, а также способствует его антидепрессивной, анксиолитической и прокогнитивной активности (S.Stahl, 2013, 2015, 2017).
Карипразин по своему рецепторному профилю больше похож не на брекспипразол, а на арипипразол, который тоже сочетает парциальный агонизм к D2- и антагонизм к D3-дофаминовым рецепторам с сильным парциальным агонизмом к 5-HT1A-серотониновым рецепторам (B.Kiss и соавт., 2010; É.Ágai-Csongor и соавт., 2012).
Карипразин также является сильным антагонистом 5-HT2B, умеренным антагонистом 5-HT2A и слабым антагонистом 5-HT2C-серотониновых рецепторов (Ki=0,58, 19 и 134 nM соответственно) [B.Kiss и соавт., 2010; L.Citrome, 2013; P.De Deurwaerdère, 2016]. Эти его рецепторные свойства также способствуют повышению уровней дофамина и норадреналина в префронтальной коре, уровня дофамина в нигростриарном и тубероинфундибулярном трактах и дополнительно уменьшают вероятность ЭПС, НИДС, ГП, нейролептических депрессий и сексуальных нарушений при терапии им, вносят вклад в его общую антидепрессивную, анксиолитическую и прокогнитивную активность (L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
В то же время то, что карипразин имеет достаточно слабый антагонизм к 5-HT2C-подтипу серотониновых рецепторов (всего 134 nM), уменьшает вероятность возникновения при терапии им метаболических нарушений (повышения аппетита, прибавки массы тела, развития СД 2-го типа и МС) [L.Citrome, 2013; S.Stahl, 2013, 2015, 2017].
Карипразин также считается слабым антагонистом 5-HT7-серотониновых рецепторов с Ki=111 nM и слабым антагонистом s1-рецепторов (B.Kiss и соавт., 2010; L.Citrome, 2013). Эти рецепторные свойства потенциально могут придавать ему способность положительно влиять на циркадные ритмы сна и бодрствования, а также привносить вклад в его общую антидепрессивную и анксиолитическую, прокогнитивную, просоциальную активность (L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
Карипразин является умеренным антагонистом H1-гистаминовых рецепторов с Ki=23 nM. Это наряду с меньшей, по сравнению с арипипразолом, внутренней агонистической активностью карипразина по отношению к дофаминовым D2-рецепторам частично объясняет то, что в клинической практике карипразин реже, чем арипипразол, вызывает в начале терапии обострение тревоги, бессонницы или возбуждения (B.Kiss и соавт., 2010; L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
В то же время умеренность сродства карипразина к H1-гистаминовым рецепторам, по сравнению с такими ААП, как оланзапин, кветиапин или зипрасидон, наряду с его низким сродством к 5-HT2C-серотониновым рецепторам приводит к тому, что при длительной терапии карипразин не оказывает нежелательного седативного действия, не ассоциируется с повышением аппетита, прибавкой массы тела, развитием метаболических нарушений (СД 2-го типа, МС) [B.Kiss и соавт., 2010; L.Citrome, 2013; S.Stahl, 2013, 2015, 2017].
Карипразин также не связывается с M-холинергическими, a-адренергическими, ГАМКергическими, бензодиазепиновыми, опиоидными или какими-либо другими рецепторами, кроме упомянутых выше, и не имеет ассоциированных с этим ПЭ, таких как ОГ, тахикардия, чрезмерная седация, запоры, задержка мочи и др. (W.Kroeze и соавт., 2003; E.Richelson и соавт., 2010; B.Kiss и соавт., 2010; J.Leung и соавт., 2010; G.Reynolds, 2012; L.Citrome, 2013; S.Stahl, 2013, 2015, 2017).
Результаты клинического изучения
Влияние на симптоматику и течение шизофрении Купирующая терапия/эффекты на позитивную симптоматику/эффекты на галлюцинаторные и бредовые проявления
Как и любой новый АП, в первую очередь карипразин изучался при купирующей терапии продуктивной симптоматики шизофрении. Его терапевтическая эффективность в этом отношении была убедительно доказана в нескольких крупных 6-недельных двойных слепых плацебо-контролируемых рандомизированных клинических исследованиях (РКИ) [S.Durgam и соавт., 2014; S.Durgam и соавт., 2015 (b); J.Kane и соавт., 2015].Так, в одном двойном слепом 6-недельном плацебо-контролируемом сравнительном РКИ 2013 г., посвященном изучению эффективности и безопасности карипразина в сравнении с арипипразолом и плацебо при острой купирующей терапии шизофрении, приняли участие 617 пациентов с острыми шизофреническими психозами. Все они были рандомизированы к получению либо низкой дозировки карипразина (3 мг/сут), либо высокой дозы карипразина (6 мг/сут), либо арипипразола 10 мг/сут, либо плацебо в течение всех 6 нед исследования (L.Citrome, 2013). При этом оценка по шкале PANSS по подшкалам как продуктивной (позитивной), так и негативной симптоматики шизофрении к сроку 4 и 6 нед терапии статистически достоверно значительно улучшилась в обеих группах карипразина (L.Citrome, 2013).
В данном исследовании эффективность низкой дозы карипразина (3 мг/сут) оказалась статистически достоверно значительно превышающей эффективность плацебо и сопоставимой с эффективностью арипипразола 10 мг/сут при более низком, чем у арипипразола, уровне ПЭ. Более высокая дозировка карипразина (6 мг/сут) также статистически достоверно улучшала состояние пациентов, уменьшая выраженность симптомов по шкале PANSS, по сравнению с плацебо. Уровень ПЭ был низким в обеих группах карипразина (L.Citrome, 2013).
В другом двойном слепом 6-недельном плацебо-контролируемом сравнительном РКИ 2015 г., в котором также изучали эффективность и безопасность применения карипразина в краткосрочной купирующей терапии шизофрении, участвовали 732 пациента с острым шизофреническим психозом. Все они были рандомизированы в одну из 5 подгрупп: карипразин 1,5, 3, 4,5 мг/сут, плацебо или ААП сравнения – рисперидон – в дозе 4 мг/сут – в течение всех 6 нед исследования. Пациенты из всех подгрупп активного лечения показали статистически достоверное значительное улучшение по сравнению с плацебо. При этом карипразин оказался сопоставим с рисперидоном по общей эффективности, но ассоциировался с меньшим уровнем ПЭ (в частности, ЭПС, ГП, акатизии) и более низким уровнем отказов от продолжения лечения по сравнению с рисперидоном (S.Durgam и соавт., 2015).
В еще одном двойном слепом 6-недельном плацебо-контролируемом РКИ 2015 г. по эффективности и безопасности карипразина при краткосрочной купирующей терапии шизофрении приняли участие 446 пациентов с острыми шизофреническими психозами. Все они были рандомизированы в 3 подгруппы: карипразин 3–6 мг/сут (151 человек), карипразин 6–9 мг/сут (148 участников) либо плацебо (147 человек) [J.Kane и соавт., 2015].
В обеих группах активного лечения, в которых больные получали карипразин, было достигнуто статистически достоверное значительное улучшение по сравнению с плацебо по подшкалам продуктивной и негативной симптоматики PANSS (J.Kane и соавт., 2015).
В 2016 г. был опубликован метаанализ, посвященный изучению эффективности и безопасности карипразина в терапии агрессивного поведения у больных шизофренией. В этот метаанализ вошли 3 двойных слепых плацебо-контролируемых РКИ по применению карипразина в краткосрочной купирующей терапии шизофрении (L.Citrome и соавт., 2016).
Авторы данного метаанализа пришли к выводу, что лечение карипразином ассоциируется со статистически достоверным значительным уменьшением агрессивности у больных шизофренией по сравнению с плацебо. Согласно их заключению препарат эффективен и безопасен и хорошо переносится при лечении агрессивного поведения у больных шизофренией (L.Citrome и соавт., 2016).
В более свежий метаанализ 2017 г., посвященный изучению эффективности и безопасности карипразина при купирующей терапии шизофрении, вошли 4 двойных слепых плацебо-контролируемых РКИ (W.Earley и соавт., 2017). Авторы этого метаанализа пришли к выводу, что частота ПЭ, наблюдавшихся при применении карипразина, пропорциональна его дозе в диапазоне используемых в данных РКИ дозировок (от 1,5 до 12 мг/сут). Они также заключили, что в пределах того диапазона дозировок карипразина, который одобрен FDA (от 1,5 до 6 мг/сут), препарат эффективен и безопасен и хорошо переносится при краткосрочной купирующей терапии у больных шизофренией (W.Earley и соавт., 2017).
Совсем недавно, в 2018 г., был опубликован метаанализ, в который вошли 4 двойных слепых плацебо-контролируемых сравнительных РКИ по применению карипразина в купирующей терапии шизофрении с общим числом участников 1843. Авторы этого метаанализа сделали вывод о том, что меньшее число пациентов, получавших карипразин, прекращали лечение по любой причине (например, из-за неэффективности терапии или ПЭ) по сравнению с плацебо. Кроме того, было показано, что статистически достоверно значительно меньшее число пациентов, получавших карипразин, испытывали серьезные ПЭ в отличие от АП сравнения, а также по сравнению с историческими данными об уровне ПЭ из РКИ по другим АП (M.Zhao и соавт., 2018).
Таким образом, авторы этого метаанализа пришли к заключению о том, что карипразин является эффективным и безопасным препаратом для купирующей терапии шизофрении, ассоциируется с более низким уровнем ПЭ, чем другие АП, и что его дальнейшее исследование при этой патологии является перспективным (M.Zhao и соавт., 2018).
Долгосрочная терапия/противорецидивное действие, в том числе на негативную и когнитивную симптоматику, ресоциализацию и «социальную когницию»
Результаты одного из первых многоцентровых двойных слепых плацебо-контролируемых РКИ, посвященных изучению эффективности, безопасности и переносимости карипразина при долгосрочной поддерживающей (противорецидивной) терапии шизофрении у взрослых, были опубликованы в 2016 г. В предварительной открытой фазе исследования все участники исследования были стабилизированы на карипразине в течение 20 нед с подбором гибкой дозы в первые 8 нед и последующей стабилизацией в течение 12 нед. Затем все достигшие стабилизации пациенты (200 человек) были рандомизированы к дальнейшему получению либо карипразина в ранее подобранной дозе (от 3 до 9 мг/сут – 101 человек), либо плацебо (99 человек) на срок до 72 нед (S.Durgam и соавт., 2016).В данном РКИ была показана высокая противорецидивная эффективность карипразина: время до наступления рецидива оказалось значительно дольше в подгруппе карипразина, чем в подгруппе плацебо (p=0,001). Рецидив за время наблюдения (72 нед) случился у 24,8% пациентов, получавших карипразин, и у 47,5% получавших плацебо. Таким образом, лечение карипразином более чем вдвое снижало вероятность рецидива за время наблюдения. Уровень ПЭ был низким. Во время предварительной открытой фазы исследования наиболее частыми из наблюдавшихся ПЭ карипразина были акатизия (у 19,2% пациентов), бессонница (14,4%) и головная боль (12%). Во время фазы поддерживающей терапии не было зарегистрировано каких-либо ПЭ с частотой, превышающей 10%. Авторы сделали вывод, что карипразин эффективен и безопасен при долгосрочной поддерживающей терапии шизофрении на протяжении по крайней мере 72 нед и очень хорошо переносится. Профиль долгосрочной безопасности карипразина в данном РКИ оказался сходным с тем, который был обнаружен в предыдущих, более краткосрочных, клинических исследованиях данного препарата (S.Durgam и соавт., 2016).
В другом долгосрочном РКИ от 2017 г. изучались как эффективность и безопасность карипразина при длительной противорецидивной терапии шизофрении, так и отдельно его эффективность в устранении негативной, когнитивной и аффективной симптоматики, а также влияние на общее качество жизни больных хронической шизофренией с преобладанием негативной симптоматики в сопоставлении с рисперидоном. Описанию результатов данного РКИ посвящена одна публикация, а изучению и сравнению изменений общего качества жизни больных шизофренией (QoL) при терапии карипразином и рисперидоном – другая (B.Németh и соавт., 2017 a, b).
В данном РКИ было выявлено статистически достоверное преимущество карипразина по сравнению с рисперидоном как в отношении эффективности влияния на негативную, когнитивную и аффективную симптоматику шизофрении, так и в отношении переносимости, уровня ПЭ и общего качества жизни больных (B.Németh и соавт., 2017 a, b).
В еще одном клиническом исследовании от 2017 г., имевшем открытый дизайн, изучали в первую очередь долгосрочную безопасность и переносимость карипразина при поддерживающем противорецидивном лечении шизофрении у взрослых. Однако кроме вопросов переносимости и безопасности карипразина при длительной терапии в данном исследовании оценке подвергалось также его влияние на общий балл по шкале PANSS (S.Durgam и соавт., 2017).
В этом исследовании приняли участие 93 человека. Около 1/2 пациентов (46 из 93) завершили это исследование. Наиболее частыми зарегистрированными в данном исследовании ПЭ карипразина были акатизия (у 14% пациентов), бессонница (14%), незначительное увеличение массы тела (12%). Авторы работы сделали вывод, что длительное поддерживающее лечение карипразином шизофрении в дозах от 1,5 до 4,5 мг/сут является безопасным по крайней мере в течение 48 нед, эффективно и хорошо переносится и не ассоциируется с возникновением каких-либо новых ПЭ или проблем безопасности при длительной терапии по сравнению с теми ПЭ, которые уже известны из краткосрочных исследований карипразина в острой фазе шизофрении (S.Durgam и соавт., 2017).
В еще одном более позднем (опубликованном в 2018 г.) исследовании, также с открытым дизайном и тоже посвященном изучению долгосрочной безопасности и эффективности карипразина при длительной поддерживающей терапии шизофрении у взрослых, приняли участие 586 человек. Карипразин назначался в гибких дозах от 3 до 9 мг/сут. Подбор дозировки и оценка безопасности и уровня ПЭ проводились в первые 4 нед. Затем больные получали подобранную дозу карипразина в течение еще 48 нед. Наиболее частыми зарегистрированными в этом исследовании ПЭ карипразина были акатизия (16%), головная боль (13%), бессонница (13%) и незначительное повышение массы тела (10%). При этом уровень отказов от лечения из-за выраженных ПЭ был низким – по этой причине прекратили терапию карипразином лишь 73 (12,5% от общего числа) пациента. Объективно расценены как серьезные ПЭ лишь у 59 (10,1%) человек. Авторы данного исследования сделали вывод, что долгосрочная поддерживающая терапия шизофрении карипразином в дозировках до
9 мг/сут эффективна, безопасна и хорошо переносится больными (A.Cutler и соавт., 2018).
В одном метаанализе, опубликованном в 2017 г., изучали долгосрочную эффективность и безопасность применения карипразина в поддерживающей противорецидивной терапии шизофрении. В него вошли результаты 2 двойных слепых 48-недельных РКИ с общим числом участников 679. Согласно данным этого метаанализа такие ПЭ, как акатизия, тремор, беспокойство, внутреннее напряжение, ЭПС, отмечались при длительной терапии менее чем в 5% случаев. Авторы данного метаанализа сделали вывод, что длительное поддерживающее противорецидивное лечение карипразином при шизофрении в рекомендованном FDA диапазоне терапевтических доз (1,5–6 мг/сут) эффективно, безопасно и хорошо переносится (H.Nasrallah и соавт., 2017).
В 2018 г. также опубликован интересный метаанализ, в котором сравнивалась эффективность разных ААП в лечении шизофрении с выраженной негативной симптоматикой либо с преимущественно негативной симптоматикой и выраженными КН.
Авторы этого метаанализа, обобщив данные 21 РКИ, сделали вывод, что из всех неклозапиновых ААП на сегодняшний день только для карипразина убедительно, методологически корректно доказано преимущество перед каким-либо другим ААП (а именно – рисперидоном) в устранении негативной и когнитивной симптоматики шизофрении. Для всех остальных неклозапиновых ААП, например для оланзапина, продемонстрировано лишь преимущество их в этом отношении над ТАП (галоперидолом), что на сегодняшний день является общим местом, не вызывающим особых сомнений (M.Krause и соавт., 2018).
Попарные же сравнения других неклозапиновых ААП между собой дают противоречивые результаты, или же использованные в исследованиях выборки пациентов слишком малы для того, чтобы делать какие-либо выводы (M.Krause и соавт., 2018).
Вопросы переносимости карипразина
По данным РКИ, карипразин имеет в среднем менее выраженные по сравнению с другими недавно одобренными FDA ААП II поколения (такими как азенапин, луразидон, илоперидон и даже его ближайший родственник брекспипразол), а также по сравнению с более старыми ААП (включая его ближайший родственник арипипразол) метаболические ПЭ. В частности, по сравнению с ними он менее склонен вызывать прибавку массы тела, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию или гипергликемию, реже вызывает развитие СД 2-го типа или МС. Уровень метаболических ПЭ при применении карипразина статистически достоверно не отличается от плацебо (L.Citrome, 2013; J.Kane и соавт., 2015; S.Durgam и соавт., 2015).Низкий уровень метаболических ПЭ при применении препарата связывают с отсутствием у него антагонизма к M3-холинергическим рецепторам, а также с его низкой аффинностью к гистаминовым H1 и серотониновым
5-HT2C-рецепторам (S.Durgam и соавт., 2015).
Кроме того, карипразин не обладает кардиотоксичностью, не влияет на скорость проведения импульсов в сердечной мышце и не вызывает клинически значимых изменений на электрокардиограмме. Уровень пролактина при лечении карипразином обычно снижается, а не повышается, как при лечении другими АП (L.Citrome, 2013).
Наиболее частые ПЭ при применении карипразина бывают либо центральными, либо желудочно-кишечными.
Среди первых, в порядке уменьшения частоты, наиболее часто регистрируются бессонница, легкие ЭПС, акатизия, седация, головная боль, головокружение, тревожность.
Среди желудочно-кишечных ПЭ наиболее часто отмечались, в порядке убывания, тошнота, запоры, рвота (S.Durgam и соавт., 2015).
Из опыта применения арипипразола было известно, что в связи с особенностями своего механизма действия он чаще других ААП вызывает акатизию. Поэтому вопрос о способности карипразина вызывать последнюю подвергся особенно тщательному исследованию. При этом было показано, что повышение вероятности возникновения акатизии при применении карипразина невелико по сравнению с применением плацебо и что оно меньше, чем у арипипразола. Было также отмечено, что вызванная карипразином акатизия по шкале Барни обычно не бывает тяжелой (S.Durgam и соавт., 2015).
Зарегистрированные в большинстве РКИ ПЭ карипразина, по-видимому, чаще всего не зависели от дозировки препарата (L.Citrome, 2013; S.Durgam и соавт., 2015).
Карипразин не обладает гепатотоксичностью, не вызывает повышения печеночных трансаминаз или иных лабораторных изменений функции печени. Он также не блокирует и не индуцирует изоферменты цитохрома P450 печени и имеет низкий риск межлекарственных взаимодействий (R.Roberts и соавт., 2016).
Вместе с тем из-за большого T1/2 как самого карипразина, так и его активных метаболитов и длительного времени, необходимого для установления его стационарной концентрации в крови, FDA добавила в официальную инструкцию к препарату предупреждение о том, что при лечении карипразином переносимость его можно оценивать только спустя несколько недель и что при терапии им возможны поздние ПЭ, возникающие в эти сроки (R.Roberts и соавт., 2016).
Как и любой другой препарат, карипразин противопоказан пациентам с известной непереносимостью или гиперчувствительностью (аллергией) к нему. Осторожность требуется также при применении препарата у больных, имеющих документированную гиперчувствительность к другим производным пиперазина (это не только арипипразол и брекспипразол, но и некоторые антигистаминные средства и др.) [J.Scarff, 2016].
Как и любой другой АП, карипразин потенциально способен повышать риск преждевременной смерти и сердечно-сосудистых осложнений у пожилых пациентов, особенно с дементными состояниями и психозами на их фоне. В силу этого поздний возраст, наличие деменции являются относительными (но не абсолютными) противопоказаниями к применению карипразина (J.Scarff, 2016).
Как и любой другой АП, карипразин потенциально способен вызвать злокачественный нейролептический синдром, хотя риск этого низкий. Как и любой другой АП, данный препарат также может снижать судорожный порог, что потенциально может привести к развитию судорог у предрасположенных лиц. Изредка отмечавшиеся острые дистонические реакции потенциально способны распространиться на глотательные мышцы, что может привести к развитию дисфагии и быть опасным для жизни. Иногда также фиксировалось снижение уровня лейкоцитов в крови, но не отмечалось развития опасных агранулоцитозов [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015].
Безопасность применения карипразина у беременных пока не установлена, и категория его безопасности для данного контингента еще не назначена. Однако известно, что новорожденные, подвергшиеся воздействию карипразина в III триместре беременности, имеют риск развития ЭПС и/или синдрома отмены, как и при применении других АП [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015].
Данные о безопасности использования карипразина у кормящих матерей также пока отсутствуют. В связи с этим производитель рекомендует учитывать и сопоставлять, с одной стороны, преимущества продолжения грудного вскармливания, с другой – объективную потребность матери в лечении ее психического заболевания именно карипразином, риск потенциально неблагоприятного воздействия на ребенка попавшего в молоко карипразина и риск такого же воздействия на него нелеченого психического заболевания матери [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015].
Режим дозирования карипразина
Карипразин выпускается в капсулах по 1,5, 3, 4,5 и 6 мг. Его следует принимать 1 раз в сутки независимо от приема пищи [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015]. Рекомендованные как FDA, так и EMA дозировки для больных шизофренией составляют от 1,5 до 6 мг/сут (J.Scarff, 2016; EMA Public Assessment Report on Reagila, 2017).Прием карипразина следует начинать с 1,5 мг в течение 1 дня, а затем титровать дозу с шагом 1,5 или 3 мг до достижения целевой дозы (J.Scarff, 2016). У пациентов, которые уже принимают карипразин и которым начали давать тот или иной ингибитор цитохрома CYP3A4, следует уменьшить дозировку карипразина в 2 раза (при приеме 6 мг/сут – уменьшить до 3 мг/сут; 4,5 мг – сократить до 1,5 или 3 мг/сут; 1,5 мг/сут – принимать 1,5 мг/сут через день) [EMA Public Assessment Report on Reagila, 2017].
У пациентов, которые до начала терапии карипразином уже получают стабильную дозу ингибитора CYP3A4, лечение препаратом следует начинать с меньших, чем обычно, доз (1,5 мг через день), а максимальная дозировка не должна превышать 3 мг/сут (Scarff JR, 2016; EMA Public Assessment Report on Reagila, 2017).
При легкой или умеренной печеночной или почечной недостаточности корректировка дозы карипразина не требуется. При тяжелых степенях печеночной или почечной недостаточности безопасность применения препарата не установлена, и использование его в этих обстоятельствах производителем не рекомендуется [Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015]. Также не рекомендуется одновременный прием карипразина с индукторами изофермента CYP3A4, поскольку это может привести к снижению эффективности терапии (EMA Public Assessment Report on Reagila, 2017).
Заключение
Как видно из приведенных нами данных литературы, карипразин – это не просто «еще один новый ААП», а представитель III поколения АП (поколения, к которому относятся также арипипразол и брекспипразол), но с улучшенным по сравнению как с ними, так и с другими присутствующими сегодня на рынке ААП профилем безопасности и переносимости, низким уровнем ПЭ (в частности, даже более низким уровнем метаболических ПЭ, чем у арипипразола, у которого этот уровень был самым низким в группе ААП до появления карипразина) и одновременно высокой эффективностью в отношении всех доменов симптоматики шизофрении – как продуктивной, так и негативной, когнитивной и аффективной.Очень важно то, что, как показывают данные опубликованного в 2018 г. метаанализа, карипразин в настоящее время остается единственным неклозапиновым ААП, для которого строго методологически корректно доказано превосходство над рисперидоном в устранении негативной и когнитивной симптоматики шизофрении.
Резюмируя, мы можем сказать, что карипразин является весьма важным расширением терапевтического арсенала психиатра при лечении шизофрении, особенно с преобладанием негативной и/или когнитивной симптоматики.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Морозов Петр Викторович – д-р мед. наук, проф. каф. психиатрии ФУВ ФГБОУ ВО «РНИМУ им. Н.И.Пирогова»
Список исп. литературыСкрыть список1. Морозов П.В., Медведев В.Э. Карипразин – новый антипсихотик для лечения эндогенных психических расстройств. Психиатрия и психофармакотерапия им. П.Б.Ганнушкина. 2014; 1: 9–14. / Morozov P.V., Medvedev V.E. Cariprazin – new antipsychotic for the treatment of endogenous mental disorders. Psychiatry and Psychopharmacotherapy. [in Russian]
2. Шмуклер А.Б. Карипразин – антипсихотик с новыми уникальными потенциальными возможностями для лечения шизофрении и аффективных расстройств. Соц. и клин. психиатрия. 2014; 24 (2): 72–5. / Shmukler A.B. Kariprazin – antipsikhotik s novymi unikal'nymi potentsial'nymi vozmozhnostiami dlia lecheniia shizofrenii i affektivnykh rasstroistv. Sots. i klin. psikhiatriia. 2014; 24 (2): 72–5. [in Russian]
3. Agai-Csongor E, Domány G, Nógrádi K et al. Discovery of cariprazine (RGH-188): a novel antipsychotic acting on dopamine D3/D2 receptors. Bioorg Med Chem Lett 2012; 22 (10): 3437–40.
4. Caccia S, Invernizzi RW, Nobili A, Pasina L. A new generation of antipsychotics: pharmacology and clinical utility of cariprazine in schizophrenia. Ther Clin Risk Manag 2013; 9: 319–28.
5. Choi YK, Adham N, Kiss B et al. Long-term effects of cariprazine exposure on dopamine receptor subtypes. CNS Spectr 2014; 19 (3): 268–77.
6. Citrome L, Durgam S, Lu K et al. The effect of cariprazine on hostility associated with schizophrenia: post hoc analyses from 3 randomized controlled trials. J Clin Psychiatry 2016; 77 (1): 109–15.
7. Citrome L. Cariprazine: chemistry, pharmacodynamics, pharmacokinetics, and metabolism, clinical efficacy, safety, and tolerability. Expert Opin Drug Metab Toxicol 2013; 9 (2): 193–206.
8. Citrome L. Cariprazine for the Treatment of Schizophrenia: A Review of this Dopamine D3-Preferring D3/D2 Receptor Partial Agonist. Clin Schizophr Relat Psychoses 2016; 10 (2): 109–19.
9. Corponi F, Serretti A, Montgomery S, Fabbri C. Cariprazine specificity profile in the treatment of acute schizophrenia: a meta-analysis and meta-regression of randomized-controlled trials. Int Clin Psychopharmacol 2017; 32 (6): 309–18.
10. Cutler AJ, Durgam S, Wang Y et al. Evaluation of the long-term safety and tolerability of cariprazine in patients with schizophrenia: results from a 1-year open-label study. CNS Spectr 2018; 23 (1): 39–50.
11. De Deurwaerdère P. Cariprazine: New dopamine biased agonist for neuropsychiatric disorders. Drugs Today (Barc) 2016; 52 (2): 97–110.
12. Durgam S, Cutler AJ, Lu K et al. Cariprazine in acute exacerbation of schizophrenia: a fixed-dose, phase 3, randomized, double-blind, placebo- and active-controlled trial. J Clin Psychiatry 2015; 76: e1574–e1582.
13. Durgam S, Starace A, Li D et al. An evaluation of the safety and efficacy of cariprazine in patients with acute exacerbation of schizophrenia: a phase II, randomized clinical trial. Schiz Res 2014; 152: 450–7.
14. Durgam S, Earley W, Li R et al. Long-term cariprazine treatment for the prevention of relapse in patients with schizophrenia: A randomized, double-blind, placebo-controlled trial. Schizophr Res 2016; 176 (2–3): 264–71.
15. Durgam S, Earley W, Lu K et al. Global improvement with cariprazine in the treatment of bipolar I disorder and schizophrenia: A pooled post hoc analysis. Int J Clin Pract 2017; 71 (12).
16. Durgam S, Greenberg WM, Li D et al. Safety and tolerability of cariprazine in the long-term treatment of schizophrenia: results from a 48-week, single-arm, open-label extension study. Psychopharmacology (Berl) 2017; 234 (2): 199–209.
17. Earley W, Durgam S, Lu K et al. Safety and tolerability of cariprazine in patients with acute exacerbation of schizophrenia: a pooled analysis of four phase II/III randomized, double-blind, placebo-controlled studies. Int Clin Psychopharmacol 2017; 32 (6): 319–28.
18. EMA. EMA Public Assessment Report on Reagila. 2017. Available at: https: //www.ema.europa.eu/documents/assessment-report/reagila-epar-public-assessment-report_en.pdf
19. Frankel JS, Schwartz TL. Brexpiprazole and cariprazine: distinguishing two new atypical antipsychotics from the original dopamine stabilizer aripiprazole. Ther Adv Psychopharmacol 2017; 7 (1): 29–41.
20. Girgis RR, Slifstein M, D’Souza D et al. Preferential binding to dopamine D3 over D2 receptors by cariprazine in patients with schizophrenia using PET with the D3/D2 receptor ligand [ (11)C]- (+)-PHNO. Psychopharmacology (Berl) 2016; 233 (19–20): 3503–12.
21. Graff-Guerrero A, Mizrahi R, Agid O et al. The dopamine D2 receptors in high-affinity state and D3 receptors in schizophrenia: a clinical [11C]- (+)-PHNO PET study. Neuropsychopharmacology 2009; 34 (4): 1078–86.
22. Gross G, Drescher K. The role of dopamine D3 receptors in antipsychotic activity and cognitive functions. Handb Exp Pharmacol 2012; 213: 167–210.
23. Gyertyán I, Kiss B, Sághy K et al. Cariprazine (RGH-188), a potent D3/D2 dopamine receptor partial agonist, binds to dopamine D3 receptors in vivo and shows antipsychotic-like and procognitive effects in rodents. Neurochem Int 2011; 59 (6): 925–35.
24. Joyce JN, Millan MJ. Dopamine D3 receptor antagonists as therapeutic agents. Drug Discov Today 2005; 10 (13): 917–25.
25. Kane JM, Zukin S, Wang Y, et al. Efficacy and safety of cariprazine in acute exacerbation of schizophrenia: results from an International, phase III clinical trial. J Clin Psychopharmacol 2015; 35 (4): 367–73.
26. Kapás M, Mészáros GP, Yu B et al. (P.3.c.051) Comparison of the pharmacokinetic behaviour of RGH-188 in schizophrenic patients and healthy volunteers. Eur Neuropsychopharmacol 2008; 18 (Suppl. 4): S433.
27. Kirschner N, Gémesi LI, Vastag M et al. In vitro metabolism of RGH-188; Presented at the 10th European International Society of the Study of Xenobiotics (ISSX), Meeting; May 18–21, 2008.
28. Kiss B, Horvath A, Nemethy Z et al. Cariprazine (RGH-188), a dopamine D3 receptor-preferring, D3/D2 dopamine receptor antagonist-partial agonist antipsychotic candidate: in vitro and neurochemical profile. J Pharmacol Exp Ther 2010; 333 (1): 328–40.
29. Kiss B, Laszlovszky I, Horváth A et al. Subnanomolar dopamine D3 receptor antagonism coupled to moderate D2 affinity results in favourable antipsychotic-like activity in rodent models: I. neurochemical characterisation of RG-15. Naunyn Schmiedebergs Arch Pharmacol 2008; 378 (5): 515–28.
30. Krause M, Zhu Y, Huhn M et al. Antipsychotic drugs for patients with schizophrenia and predominant or prominent negative symptoms: a systematic review and meta-analysis. Eur Arch Psychiatry Clin Neurosci 2018.
31. Kroeze WK, Hufeisen SJ, Popadak BA et al. H1-histamine receptor affinity predicts short-term weight gain for typical and atypical antipsychotic drugs. Neuropsychopharmacology 2003; 28 (3): 519–26.
32. Laszlovsky I, Németh G, Mészáros P et al. Dopamine D2/D3 receptor occupancy of RGH-188, a D3/D2 antagonist/partial agonist antipsychotic, in healthy volunteers. Eur Neuropsychopharmacol 2007; 17 (Suppl. 4): S455.
33. Leucht S, Cipriani A, Spineli L et al. Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet 2013; 382 (9896): 951–62.
34. Leung JY, Barr AM, Procyshyn RM et al. Cardiovascular side-effects of antipsychotic drugs: the role of the autonomic nervous system. Pharmacol Ther 2012; 135 (2): 113–22.
35. McCormick PN, Kapur S, Graff-Guerrero A et al. The antipsychotics olanzapine, risperidone, clozapine, and haloperidol are D2-selective ex vivo but not in vitro. Neuropsychopharmacology 2010; 35 (8): 1826–35.
36. Mészáros GP, Kapás M, Borsos M et al. (P.3.c.047) Pharmacokinetics of RGH-188, a new dopamine D3/D2 antagonist/partial agonist atypical antipsychotic, in healthy subjects. Eur Neuropsychopharmacol 2007; 17 (Suppl. 4): S451–S452.
37. Nasrallah HA, Earley W, Cutler AJ et al. The safety and tolerability of cariprazine in long-term treatment of schizophrenia: a post hoc pooled analysis. BMC Psychiatry 2017; 17 (1): 305.
38. Németh G, Laszlovszky I, Czobor P et al. Cariprazine versus risperidone monotherapy for treatment of predominant negative symptoms in patients with schizophrenia: a randomised, double-blind, controlled trial. Lancet 2017; 389 (10074): 1103–13.
39. Németh B, Molnár A, Akehurst R et al. Quality-adjusted life year difference in patients with predominant negative symptoms of schizophrenia treated with cariprazine and risperidone. J Comp Eff Res 2017; 6 (8): 639–48.
40. Nord M, Farde L. Antipsychotic occupancy of dopamine receptors in schizophrenia. CNS Neurosci Ther 2011; 17 (2): 97–103.
41. Pásztor Mészáros G, Agai-Csongor E, Kapaś M. Sensitive LC-MS/MS methods for the quantification of RGH-188 and its active metabolites, desmethyl- and didesmethyl-cariprazine in human plasma and urine.
J Pharm Biomed Anal 2008; 48 (2): 388–97.
42. Potkin S, Keator D, Mukherjee J et al. Dopamine D3 and D2 receptor occupancy of cariprazine in schizophrenic patients. Eur Neuropsychopharmacol 2009; 19 (Suppl. 3): S316.
43. Reynolds GP. Histamine and antipsychotic drug-induced weight gain.
J Psychopharmacol 2012; 26 (12): 1608–9.
44. Richelson E. New antipsychotic drugs: how do their receptor-binding profiles compare? J Clin Psychiatry 2010; 71 (9): 1243–4.
45. Roberts RJ, Findlay LJ, El-Mallakh PL, El-Mallakh RS. Upd ate on schizophrenia and bipolar disorder: focus on cariprazine. Neuropsychiatr Dis Treat 2016; 12: 1837–42.
46. Ruiz P. Comprehensive textbook of psychiatry 2017.
47. Scarff JR. Cariprazine for Schizophrenia and Bipolar Disorder. Innov Clin Neurosci 2016; 13 (9–10): 49–52.
48. Scarff JR. The prospects of cariprazine in the treatment of schizophrenia. Ther Adv Psychopharmacol 2017; 7 (11): 237–9.
49. Seneca N, Finnema SJ, Laszlovszky I et al. Occupancy of dopamine D2 and D3 and serotonin 5-HT1A receptors by the novel antipsychotic drug candidate, cariprazine (RGH-188), in monkey brain measured using positron emission tomography. Psychopharmacology (Berl) 2011; 218 (3): 579–87.
50. Solmi M, Murru A, Pacchiarotti I et al. Safety, tolerability, and risks associated with first- and second-generation antipsychotics: a state-of-the-art clinical review. Ther Clin Risk Manag 2017; 13: 757–77.
51. Stahl SM. Case Studies: Stahl's Essential Psychopharmacology. Cambridge University Press. 1st Ed. 2015.
52. Stahl SM. Case Studies: Stahl's Essential Psychopharmacology: Volume 2. Cambridge University Press. 1st Ed. 2017.
53. Stahl SM. Prescriber's Guide: Stahl's Essential Psychopharmacology. Cambridge University Press. 6th Ed. 2016.
54. Stahl's Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. Cambridge University Press. 4rd Ed. 2013.
55. Vraylar (cariprazine) package insert. Parsippany, New Jersey: Sep, 2015.
56. Weiden PJ. EPS profiles: the atypical antipsychotics are not all the same.
Psychiatr Pract 2007; 13 (1): 13–24.
57. Werner FM, Coveñas R. New developments in the management of schizophrenia and bipolar disorder: potential use of cariprazine. Ther Clin Risk Manag 2015; 11: 1657–61.
58. Zhao MJ, Qin B, Wang JB et al. Efficacy and Acceptability of Cariprazine in Acute Exacerbation of Schizophrenia: Meta-Analysis of Randomized Placebo-Controlled Trials. J Clin Psychopharmacol 2018; 38 (1): 55–9.
59. Zimnisky R, Chang G, Gyertyán I, Kiss B et al. Cariprazine, a dopamine D3-receptor-preferring partial agonist, blocks phencyclidine-induced impairments of working memory, attention se t-shifting, and recognition memory in the mouse. Psychopharmacology (Berl) 2013; 226 (1): 91–100.
13 ноября 2018
Количество просмотров: 5154

