Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2019
Ассоциации полиморфных вариантов генов DRD2, DRD3, HTR2A, BDNF с нарушением когнитивных функций у пациентов с терапевтически резистентной шизофренией №01 2019
Номера страниц в выпуске:4-10
По разным данным, до 1/2 всех пациентов с шизофрений имеют терапевтически резистентный тип течения. Считается, что они обладают сниженными когнитивными навыками по сравнению с пациентами без резистентности к антипсихотической терапии. Когнитивные способности являются признаком с высокой степенью наследуемости, таким образом, изучение генетических механизмов регуляции этих процессов остается достаточно актуальным. В своей работе мы провели сравнительный анализ отличий когнитивных нарушений у пациентов с терапевтической резистентностью и хорошим ответом на антипсихотическую терапию для установления их возможной предиктивной роли в развитии терапевтической резистентности. Всего в исследование были включены 130 пациентов с диагнозом «шизофрения» (F20 по Международной классификации болезней 10-го пересмотра). В работе использованы следующие шкалы: PANSS (Positive and Negative Syndrome Scale), CGI-S (Clinical Global Impression Scale), GAF (Global Assessment of Functioning Scale), BAC-S (Brief Assessment of Cognition in Schizophrenia). Все пациенты были генотипированы по: DRD2 (Taq1A), DRD3 (Ser9Gly), BDNF (rs6265) HTR2A (T102C).
Больные с терапевтической резистентностью показали худшие результаты при выполнении тестов «Вербальная память» и «Словесная и семантическая беглость» батареи BAC-S. Также пациенты с терапевтически резистентной шизофренией имели более выраженные позитивные и негативные симптомы шизофрении и достоверно более низкий уровень адаптации в социуме и повседневной жизни. Носительство полиморфных вариантов генов BDNF, DRD2, HTR2A ассоциировалось с отклонениями при выполнении когнитивных тестов. Не было показано ассоциации данных полиморфных вариантов с терапевтической резистентностью. Это направление является актуальным и перспективным. Проведение более масштабных исследований с широкими генетическими панелями позволит приблизиться к пониманию проблемы терапевтической резистентности.
Ключевые слова: терапевтически резистентная шизофрения, когнитивные нарушения, антипсихотики, биомаркеры, полиморфные варианты генов.
Для цитирования: Сосин Д.Н., Иващенко Д.В., Отмахов А.П. и др. Ассоциации полиморфных вариантов генов DRD2, DRD3, HTR2A, BDNF с нарушением когнитивных функций у пациентов с терапевтически резистентной шизофренией. Психиатрия и психофармакотерапия. 2019; 21 (1): 4–10.
Больные с терапевтической резистентностью показали худшие результаты при выполнении тестов «Вербальная память» и «Словесная и семантическая беглость» батареи BAC-S. Также пациенты с терапевтически резистентной шизофренией имели более выраженные позитивные и негативные симптомы шизофрении и достоверно более низкий уровень адаптации в социуме и повседневной жизни. Носительство полиморфных вариантов генов BDNF, DRD2, HTR2A ассоциировалось с отклонениями при выполнении когнитивных тестов. Не было показано ассоциации данных полиморфных вариантов с терапевтической резистентностью. Это направление является актуальным и перспективным. Проведение более масштабных исследований с широкими генетическими панелями позволит приблизиться к пониманию проблемы терапевтической резистентности.
Ключевые слова: терапевтически резистентная шизофрения, когнитивные нарушения, антипсихотики, биомаркеры, полиморфные варианты генов.
Для цитирования: Сосин Д.Н., Иващенко Д.В., Отмахов А.П. и др. Ассоциации полиморфных вариантов генов DRD2, DRD3, HTR2A, BDNF с нарушением когнитивных функций у пациентов с терапевтически резистентной шизофренией. Психиатрия и психофармакотерапия. 2019; 21 (1): 4–10.
По разным данным, до 1/2 всех пациентов с шизофрений имеют терапевтически резистентный тип течения. Считается, что они обладают сниженными когнитивными навыками по сравнению с пациентами без резистентности к антипсихотической терапии. Когнитивные способности являются признаком с высокой степенью наследуемости, таким образом, изучение генетических механизмов регуляции этих процессов остается достаточно актуальным. В своей работе мы провели сравнительный анализ отличий когнитивных нарушений у пациентов с терапевтической резистентностью и хорошим ответом на антипсихотическую терапию для установления их возможной предиктивной роли в развитии терапевтической резистентности. Всего в исследование были включены 130 пациентов с диагнозом «шизофрения» (F20 по Международной классификации болезней 10-го пересмотра). В работе использованы следующие шкалы: PANSS (Positive and Negative Syndrome Scale), CGI-S (Clinical Global Impression Scale), GAF (Global Assessment of Functioning Scale), BAC-S (Brief Assessment of Cognition in Schizophrenia). Все пациенты были генотипированы по: DRD2 (Taq1A), DRD3 (Ser9Gly), BDNF (rs6265) HTR2A (T102C).
Больные с терапевтической резистентностью показали худшие результаты при выполнении тестов «Вербальная память» и «Словесная и семантическая беглость» батареи BAC-S. Также пациенты с терапевтически резистентной шизофренией имели более выраженные позитивные и негативные симптомы шизофрении и достоверно более низкий уровень адаптации в социуме и повседневной жизни. Носительство полиморфных вариантов генов BDNF, DRD2, HTR2A ассоциировалось с отклонениями при выполнении когнитивных тестов. Не было показано ассоциации данных полиморфных вариантов с терапевтической резистентностью. Это направление является актуальным и перспективным. Проведение более масштабных исследований с широкими генетическими панелями позволит приблизиться к пониманию проблемы терапевтической резистентности.
Ключевые слова: терапевтически резистентная шизофрения, когнитивные нарушения, антипсихотики, биомаркеры, полиморфные варианты генов.
Для цитирования: Сосин Д.Н., Иващенко Д.В., Отмахов А.П. и др. Ассоциации полиморфных вариантов генов DRD2, DRD3, HTR2A, BDNF с нарушением когнитивных функций у пациентов с терапевтически резистентной шизофренией. Психиатрия и психофармакотерапия. 2019; 21 (1): 4–10.
1V.M.Bekhterev Saint Petersburg Research Institute. 192019, Russian Federation, Saint Petersburg, ul. Bekhtereva, d. 3;
2Russian Medical Academy of Continuous Professional Education of the Ministry of Health of the Russian Federation. 125993, Russian Federation, Moscow, ul. Barrikadnaia, d. 2/1;
3Kashcenko Mental Hospital №1. 188357, Russian Federation, Leningradskaya obl., s. Nikol'skoye, ul. Men'kovskaya, d. 10
sosin.dmitriy@gmail.com
According to various data, up to half of all patients with schizophrenia have a treatment resistant type of course. It is believed that such patients have reduced cognitive functions compared with patients without treatment resistant. Cognitive functions are a feature with a high degree of heritability, thus, the study of the genetic mechanisms of regulation of these processes is quite relevant. In our research, we attempted to conduct a comparative analysis of the differences in cognitive impairment in patients with treatment resistant and a good response of antipsychotic therapy in order to establish their possible predictive role in the development of treatment resistant. A total of 130 patients were diagnosed with schizophrenia (F20 according to ICD 10). The following scales were used: PANSS (Positive and Negative Syndrome Scale), CGI-S (Clinical Global Impression Scale), GAF (Global Assessment of Functioning Scale), BAC-S (Brief Assessment of Cognition in Schizophrenia). All patients were genotyped according to: DRD2 (Taq1A), DRD3 (Ser9Gly), BDNF (rs6265) HTR2A (T102C).
Patients with treatment resistant showed the worst results when performing tests "Verbal memory" and "Verbal and semantic fluency" of the BAC-S battery. Also, patients with treatment resistant schizophrenia had more pronounced positive and negative symptoms of schizophrenia and significantly lower levels of adaptation in society and in everyday life. The carriage of polymorphic variants of the genes BDNF, DRD2, HTR2A was associated with abnormalities in the performance of cognitive tests. Associations of these polymorphic variants with treatment resistant schizophrenia have not been shown. This direction is relevant and promising. Conducting more extensive research with broad genetic panels will allow you to get closer to understanding the problem of treatment resistant schizophrenia.
Key words: treatment resistant schizophrenia, cognitive impairment, antypsychotics, biomarkers, polymorphic gene variants.
For citation: Sosin D.N., Ivashchenko D.V., Otmakhov A.P. et al. Associations of DRD2, DRD3, HTR2A and BDNF genes’ polymorphisms with cognitive impairment in treatment resistant schizophrenia. Psychiatry and Psychopharmacotherapy. 2019; 21 (1): 4–10.
Одной из основных клинических характеристик шизофрении являются когнитивные нарушения [6]. Они наблюдаются более чем у 80% пациентов с шизофренией [7]. Считается, что больные с ТРШ имеют сниженные когнитивные навыки по сравнению с пациентами с более благоприятным типом течения шизофрении. Однако, по мнению некоторых авторов, в настоящее время на эту тему проведено ограниченное число доказательных исследований [8]. На сегодняшний день существует не так много работ, подтверждающих, что пациенты с ТРШ имеют более низкие показатели при выполнении когнитивных тестов [9]. Причины данного явления также требуют внимания. Наиболее вероятные факторы риска: выраженность продуктивной и негативной симптоматики шизофрении, массивная психофармакотерапия, а также индивидуальные биомаркеры – в первую очередь генетические [10].
Есть данные, что антипсихотики I поколения значительно ухудшают когнитивные функции [11], а препараты II генерации влияют на них положительным образом [12]. Однако, согласно результатам, полученным D.Kontis и соавт. (2010 г.), полипрагмазия не влияет на когнитивные функции пациентов с шизофренией [13]. Также есть данные о том, что отказ от приема антипсихотической терапии в последующем приводит к существенному улучшению показателей когнитивной сферы [10].
Учитывая тот факт, что когнитивные способности являются признаком с высокой степенью наследуемости [14], изучение генетических механизмов регуляции этих процессов остается достаточно перспективной областью исследований [15]. Международный консорциум по психиатрической генетике (Psychiatric Genomics Consortium) подтвердил наличие как минимум 108 локусов, значимых как факторы риска развития шизофрении, а учитывая тот факт, что когнитивные нарушения определяются у большей части пациентов с шизофренией, каждый из этих генов может влиять и на когнитивные функции [16].
В 2014 г. R.Kroken и соавт. предложили ставить улучшение когнитивных функций в приоритет при лечении шизофрении [17]. Ввиду этого разделение пациентов на группы по наличию/отсутствию ТРШ и выделение особенностей когнитивных нарушений в данной группе больных является наиболее актуальным, это, безусловно, должно облегчить понимание данной проблемы.
Цель – провести сравнительный анализ отличий когнитивных нарушений у пациентов с ТРШ и хорошим ответом на антипсихотическую терапию для установления их возможной предиктивной роли в развитии терапевтической резистентности.
СПб ГБУЗ «ПНД №2». Длительность психического расстройства каждого на момент включения в исследование составляла не менее 24 мес. Включение больных в исследование осуществлялось после подписания добровольного информированного согласия. В анализ не включались пациенты, психическое состояние которых не позволяло провести оценку когнитивных функций, также пациенты с коморбидными психическими расстройствами и/или соматическими и инфекционными заболеваниями в стадии декомпенсации.
Всего были включены 130 пациентов с диагнозом «шизофрения» (F20 по Международной классификации болезней 10-го пересмотра). Из них 85 (65,4%) – мужчины, 45 (34,6%) – женщины.
Участники были разделены на 2 группы: 1-я – с ТРШ, 2-я – респондеры (от англ. responder – пациент, отвечающий на терапию). Выделение пациентов в группу с ТРШ осуществлялось согласно следующим критериям [18]:
• После 2 курсов антипсихотической терапии (один из которых должен быть проведен антипсихотиком II поколения) в адекватной дозировке продолжительностью 4–6 нед без должного ответа, в особенности при сохранении психотической симптоматики.
• Стойкая психотическая симптоматика, оказывающая влияние на поведение и функционирование пациента.
• Наличие суицидных тенденций, насильственных действий или коморбидного злоупотребления психоактивными веществами.
Психическое состояние пациентов было оценено посредством шкалы PANSS (Positive and Negative Syndrome Scale) [19] и шкалы общего клинического впечатления CGI-S (Clinical Global Impression Scale) [20]. Общие баллы по данным шкалам положительно коррелируют с выраженностью психотического состояния. Оценка качества социального и профессионального функционирования проводилась с помощью шкалы GAF (Global Assessment
of Functioning Scale) [21]. Оценка когнитивных функций осуществлялась с помощью батареи тестов BAC-S (Brief Assessment of Cognition in Schizophrenia) [22]. Общий балл при выполнении тестов данной батареи положительно коррелирует с когнитивными функциями, т.е. чем больше балл, тем лучше когнитивные функции.
Лабораторная часть исследования выполнялась в НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО (Москва). Из образцов крови была выделена ДНК сорбционным методом при помощи наборов «Амплипрайм» (производитель ООО «Синтол»). Метод проведения генотипирования: полимеразная цепная реакция в реальном времени (real-time PCR) на амплификаторе Biorad CFX-96. Для амплификации полиморфных вариантов DRD2 (Taq1A), DRD3 (Ser9Gly), BDNF (rs6265) HTR2A (T102C) применялись коммерческие наборы (производитель ООО «Синтол»).
Статистическая обработка результатов проводилась в программе SPSS Statistics 21.0. Использовался метод c2 Пирсона для сравнения категориальных переменных, сравнение количественных переменных выполнялось методом Манна–Уитни ввиду ненормального распределения значений.
Не было установлено статистически значимой разницы по возрасту между пациентами с ТРШ и респондерами (р=0,357).
Пациенты с ТРШ при выполнении теста «Вербальная память» батареи BAC-S показали более низкие результаты по сравнению с респондерами. Данная группа пациентов также хуже справлялась с заданиями на словесную и семантическую беглость батареи тестов BAC-S.
При оценке психического состояния при помощи шкалы PANSS больные с ТРШ имели более выраженные позитивные и негативные симптомы шизофрении.
По данным шкалы GAF пациенты с ТРШ имели достоверно более низкий уровень адаптации в социуме или повседневной жизни (р=0,0001); табл. 1.
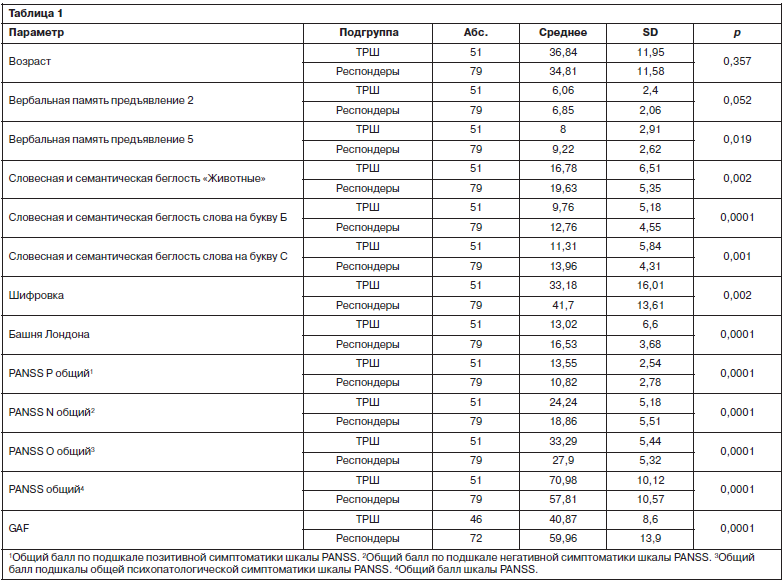
Пациенты с установленной формой ТРШ отличались менее благоприятным течением заболевания: худшим ответом на терапию, что отражено меньшей длительностью ремиссии, отношением эффективных курсов антипсихотической терапии к их общему количеству (табл. 2).
Описание ассоциаций носительства значимых генетических полиморфизмов генов с когнитивными функциями и психическим состоянием пациентов в зависимости от наличия ТРШ
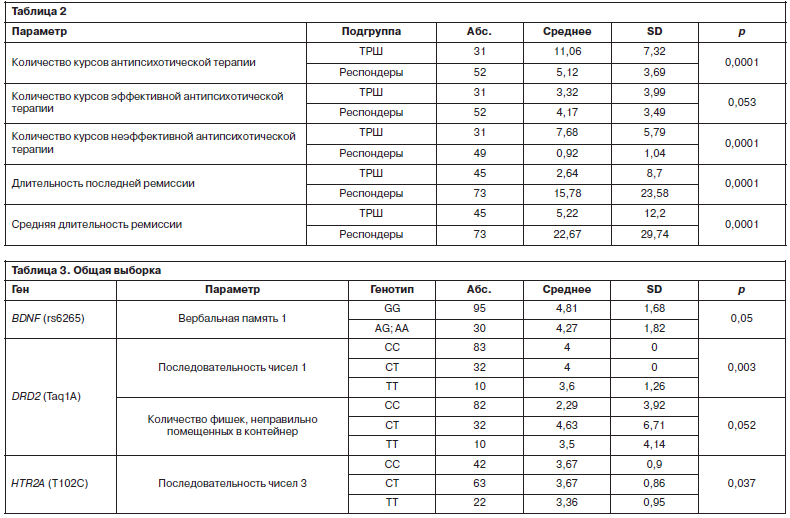
Носительство полиморфных вариантов генов BDNF, DRD2, HTR2A ассоциировалось с отклонениями при выполнении когнитивных тестов. В частности, проблемы были выявлены при следующих тестах BAC-S: «Вербальная память» (BDNF rs6265), «Двигательный тест с фишками» (DRD2 Taq1A), «Последовательность чисел» (DRD2 Taq1A, HTR2A T102C); табл. 3.
Пациенты с ТРШ
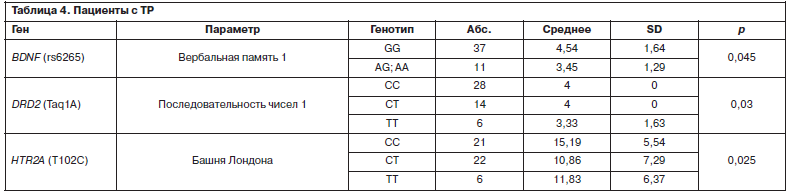
Пациенты данной группы – носители исследуемых полиморфных вариантов генов BDNF, DRD2 и HTR2A – показали более низкие результаты отдельных тестов BAC-S.
В частности, «Вербальная память» (BDNF rs6265), «Башня Лондона» (HTR2A T102C), «Последовательность чисел» (DRD2 Taq1A); табл. 4.
Группа респондеров
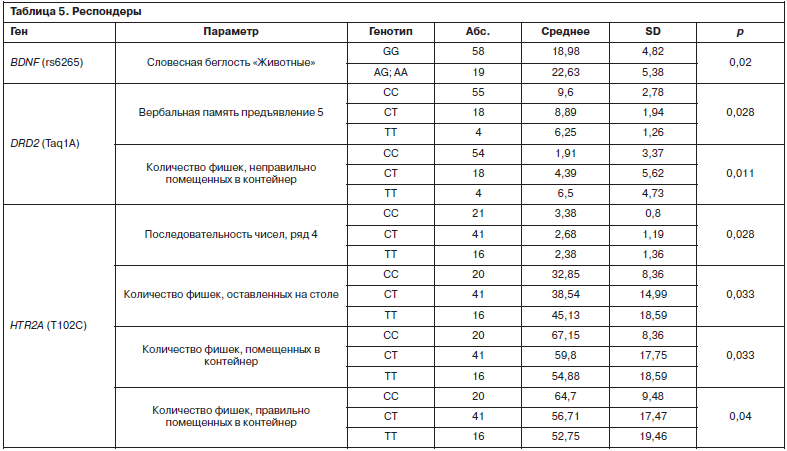
В данной группе также отмечена ассоциация носительства полиморфных вариантов генов BDNF, DRD2 и HTR2A с результатами выполнения батареи тестов BAC-S. Как показано в табл. 3, значимые различия выявлены для тестов «Словесная и семантическая беглость (животные)» (BDNF rs6265), «Вербальная память» (DRD2 Taq1A), «Двигательный тест с фишками» (DRD2 Taq1A, HTR2A T102C), «Последовательность чисел» (HTR2A T102C); табл. 5.
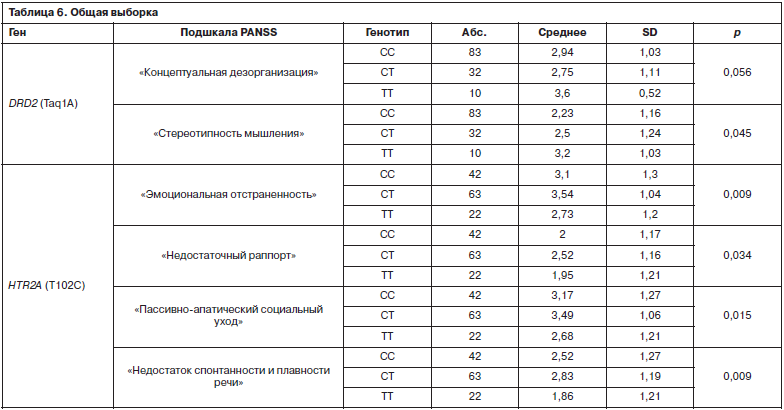
Психическое состояние, измеренное на момент включения пациентов в исследование в общей группе больных, показало взаимосвязь с носительством полиморфизмов генов DRD2 и HTR2A. В частности, выявлена ассоциация носительства Taq1A DRD2 с более высоким баллом по пунктам шкалы PANSS «Концептуальная дезорганизация мышления», «Стереотипность мышления». Носительство полиморфизма HTR2A T102C ассоциировалось с большей выраженностью «Эмоциональной отстраненности», «Социального ухода», «Недостатка спонтанности и плавности речи» и «Недостаточного раппорта» (табл. 6).
Пациенты с ТРШ
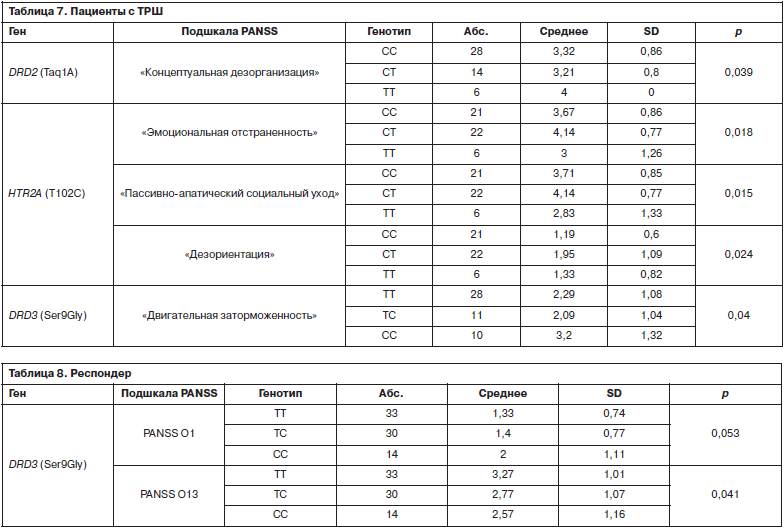
В группе пациентов с ТРШ также отмечалась ассоциация степени тяжести психического состояния с носительством изучаемых полиморфных вариантов генов DRD2, HTR2A и DRD3. В частности, полиморфный вариант DRD2 Taq1A с пунктом «Концептуальная дезорганизация мышления», полиморфный вариант T102C HTR2A c пунктами «Эмоциональная отстраненность», «Социальный уход» и «Дезориентация», а полиморфный вариант Ser9Gly DRD3 с пунктом «Двигательная заторможенность» (табл. 7).
Группа респондеров
В данной группе пациентов была показана ассоциация полиморфного варианта Ser9Gly гена DRD3 c пунктами «Озабоченность соматическими нарушениями» и «Волевые нарушения» шкалы PANSS (табл. 8).
Мы рассмотрели только наиболее значимые фармакодинамические гены, связанные с психическим состоянием и когнитивными функциями [16]. Помимо них большую роль играют также фармакокинетические, которые, в свою очередь, влияют на метаболизм лекарственных средств и, следовательно, на эффективность и безопасность проводимой антипсихотической терапии. Исследования по изучению роли данных генов также необходимы.
В рамках этого исследования мы не принимали во внимание влияние фармакотерапии. В дальнейшем планируется провести анализ сочетанного влияния внешних и внутренних факторов на когнитивные функции у пациентов с ТРШ. Тема влияния психофармакотерапии на исходы психических расстройств является довольно обширной и требует рассмотрения в рамках отдельной статьи.
В настоящей работе не было найдено ассоциации носительства полиморфных вариантов генов и ТРШ. Возможно, это связано с тем, что проблема ТРШ является наиболее комплексной, и механизмы, участвующие в ее формировании, достаточно разнообразны. Ограниченная генетическая панель в полной мере не позволяет оценить данную проблему.
Наряду с тем, что кросс-секционный дизайн нашего исследования позволяет сократить временные затраты, он приводит к некоторым ограничениям. Оценка психического состояния в одной точке не позволяет детально изучить эффективность, а также в полной мере охватить параметры безопасности проводимой антипсихотической терапии. Дополнительные трудности вносит сбор сведений о прошлых курсах терапии, течении самого психического расстройства и т.д. Необходимо стремиться к проведению более трудоемких и масштабных проспективных исследований.
Учитывая немалое количество сложностей, возникающих при лечении ТРШ, данная тема является наиболее интересной и перспективной. Расширение панели полиморфных вариантов генов, проведение более масштабных проспективных исследований с большим числом пациентов, несмотря на их высокую стоимость, то, к чему необходимо стремиться. Раннее прогнозирование ТРШ позволит начать противорецидивную терапию на более ранних сроках, что, в свою очередь, может предупредить социальное снижение и инвалидизацию.
Коллектив авторов выражает благодарность: Ж.А.Созаевой – лаборанту кафедры клинической фармакологии и терапии ФГБОУ ДПО РМАНПО, К.А.Рыжиковой – научному сотруднику отдела молекулярной медицины НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО, Р.А.Шейдокову – заведующему отделения СПб ГБУЗ «Больница №1 им. П.П.Кащенко», В.С.Фадеевой – врачу-психиатру СПб ГБУЗ «ПНД №2», В.М.Чомской – заведующей отделением, СПб ГБУЗ «ПНД №3» за помощь в проведении данного исследования.
Сведения об авторах
Сосин Дмитрий Николаевич – мл. науч. сотр. отд-ния биологической терапии психически больных ФГБУ «НМИЦ ПН им. В.М.Бехтерева». E-mail: sosin.dmitriy@gmail.com
Иващенко Дмитрий Владимирович – канд. мед. наук, науч. сотр. отд. персонализированной медицины НИИ молекулярной и персонализированной медицины, ассистент каф. детской психиатрии и психотерапии ФГБОУ ДПО РМАНПО. E-mail: dvi1991@yandex.ru
Отмахов Андрей Павлович – врач-психиатр, зам. глав. врача СПб ГБУЗ «Больница №1 им. П.П.Кащенко». E-mail: otmakhov@kaschenko-spb.ru
Янушко Мария Григорьевна – вед. науч. сотр. отд-ния биологической терапии психически больных ФГБУ «НМИЦ ПН им. В.М.Бехтерева». E-mail: yanushko@list.ru
Гришина Елена Анатольевна – канд. биол. наук, доц., зам. дир. НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО. E-mail: gelana2010@yandex.ru
Сычев Дмитрий Алексеевич – чл.-кор. РАН, д-р мед. наук, проф., проректор по развитию и инновациям, зав. каф. клинической фармакологии и терапии ФГБОУ ДПО РМАНПО. E-mail: dmitry.alex.sychev@gmail.com
Иванов Михаил Владимирович – д-р мед. наук, проф., рук. отд-ния биологической терапии психически больных ФГБУ «НМИЦ ПН им. В.М.Бехтерева». E-mail: profmikhailivanov@gmail.com
Больные с терапевтической резистентностью показали худшие результаты при выполнении тестов «Вербальная память» и «Словесная и семантическая беглость» батареи BAC-S. Также пациенты с терапевтически резистентной шизофренией имели более выраженные позитивные и негативные симптомы шизофрении и достоверно более низкий уровень адаптации в социуме и повседневной жизни. Носительство полиморфных вариантов генов BDNF, DRD2, HTR2A ассоциировалось с отклонениями при выполнении когнитивных тестов. Не было показано ассоциации данных полиморфных вариантов с терапевтической резистентностью. Это направление является актуальным и перспективным. Проведение более масштабных исследований с широкими генетическими панелями позволит приблизиться к пониманию проблемы терапевтической резистентности.
Ключевые слова: терапевтически резистентная шизофрения, когнитивные нарушения, антипсихотики, биомаркеры, полиморфные варианты генов.
Для цитирования: Сосин Д.Н., Иващенко Д.В., Отмахов А.П. и др. Ассоциации полиморфных вариантов генов DRD2, DRD3, HTR2A, BDNF с нарушением когнитивных функций у пациентов с терапевтически резистентной шизофренией. Психиатрия и психофармакотерапия. 2019; 21 (1): 4–10.
Associations of DRD2, DRD3, HTR2A and BDNF genes’ polymorphisms with cognitive impairment in treatment resistant schizophrenia
D.N.Sosin1, D.V.Ivashchenko2, A.P.Otmakhov3, M.G.Yanushko1, Е.А.Grishina2, D.A.Sychev2, M.V.Ivanov11V.M.Bekhterev Saint Petersburg Research Institute. 192019, Russian Federation, Saint Petersburg, ul. Bekhtereva, d. 3;
2Russian Medical Academy of Continuous Professional Education of the Ministry of Health of the Russian Federation. 125993, Russian Federation, Moscow, ul. Barrikadnaia, d. 2/1;
3Kashcenko Mental Hospital №1. 188357, Russian Federation, Leningradskaya obl., s. Nikol'skoye, ul. Men'kovskaya, d. 10
sosin.dmitriy@gmail.com
According to various data, up to half of all patients with schizophrenia have a treatment resistant type of course. It is believed that such patients have reduced cognitive functions compared with patients without treatment resistant. Cognitive functions are a feature with a high degree of heritability, thus, the study of the genetic mechanisms of regulation of these processes is quite relevant. In our research, we attempted to conduct a comparative analysis of the differences in cognitive impairment in patients with treatment resistant and a good response of antipsychotic therapy in order to establish their possible predictive role in the development of treatment resistant. A total of 130 patients were diagnosed with schizophrenia (F20 according to ICD 10). The following scales were used: PANSS (Positive and Negative Syndrome Scale), CGI-S (Clinical Global Impression Scale), GAF (Global Assessment of Functioning Scale), BAC-S (Brief Assessment of Cognition in Schizophrenia). All patients were genotyped according to: DRD2 (Taq1A), DRD3 (Ser9Gly), BDNF (rs6265) HTR2A (T102C).
Patients with treatment resistant showed the worst results when performing tests "Verbal memory" and "Verbal and semantic fluency" of the BAC-S battery. Also, patients with treatment resistant schizophrenia had more pronounced positive and negative symptoms of schizophrenia and significantly lower levels of adaptation in society and in everyday life. The carriage of polymorphic variants of the genes BDNF, DRD2, HTR2A was associated with abnormalities in the performance of cognitive tests. Associations of these polymorphic variants with treatment resistant schizophrenia have not been shown. This direction is relevant and promising. Conducting more extensive research with broad genetic panels will allow you to get closer to understanding the problem of treatment resistant schizophrenia.
Key words: treatment resistant schizophrenia, cognitive impairment, antypsychotics, biomarkers, polymorphic gene variants.
For citation: Sosin D.N., Ivashchenko D.V., Otmakhov A.P. et al. Associations of DRD2, DRD3, HTR2A and BDNF genes’ polymorphisms with cognitive impairment in treatment resistant schizophrenia. Psychiatry and Psychopharmacotherapy. 2019; 21 (1): 4–10.
Введение
Одной из самых актуальных проблем в современной психиатрии является терапевтически резистентная шизофрения (ТРШ). Под терапевтической резистентностью понимают отсутствие ответа на антипсихотическую терапию [1]. По разным данным, от 25 до 50% всех пациентов с шизофрений имеют терапевтически резистентное течение [2]. Такая форма течения, в свою очередь, приводит к высокой частоте инвалидизации и, соответственно, несет в себе неблагоприятный прогноз [3]. Даже не принимая во внимание экономические затраты, можно сказать, что хотя бы частичное решение данной проблемы принесет значительную пользу [4]. Дополнительные сложности вносит само определение терапевтической резистентности, а точнее – отсутствие общепринятых критериев данной формы течения шизофрении [5].Одной из основных клинических характеристик шизофрении являются когнитивные нарушения [6]. Они наблюдаются более чем у 80% пациентов с шизофренией [7]. Считается, что больные с ТРШ имеют сниженные когнитивные навыки по сравнению с пациентами с более благоприятным типом течения шизофрении. Однако, по мнению некоторых авторов, в настоящее время на эту тему проведено ограниченное число доказательных исследований [8]. На сегодняшний день существует не так много работ, подтверждающих, что пациенты с ТРШ имеют более низкие показатели при выполнении когнитивных тестов [9]. Причины данного явления также требуют внимания. Наиболее вероятные факторы риска: выраженность продуктивной и негативной симптоматики шизофрении, массивная психофармакотерапия, а также индивидуальные биомаркеры – в первую очередь генетические [10].
Есть данные, что антипсихотики I поколения значительно ухудшают когнитивные функции [11], а препараты II генерации влияют на них положительным образом [12]. Однако, согласно результатам, полученным D.Kontis и соавт. (2010 г.), полипрагмазия не влияет на когнитивные функции пациентов с шизофренией [13]. Также есть данные о том, что отказ от приема антипсихотической терапии в последующем приводит к существенному улучшению показателей когнитивной сферы [10].
Учитывая тот факт, что когнитивные способности являются признаком с высокой степенью наследуемости [14], изучение генетических механизмов регуляции этих процессов остается достаточно перспективной областью исследований [15]. Международный консорциум по психиатрической генетике (Psychiatric Genomics Consortium) подтвердил наличие как минимум 108 локусов, значимых как факторы риска развития шизофрении, а учитывая тот факт, что когнитивные нарушения определяются у большей части пациентов с шизофренией, каждый из этих генов может влиять и на когнитивные функции [16].
В 2014 г. R.Kroken и соавт. предложили ставить улучшение когнитивных функций в приоритет при лечении шизофрении [17]. Ввиду этого разделение пациентов на группы по наличию/отсутствию ТРШ и выделение особенностей когнитивных нарушений в данной группе больных является наиболее актуальным, это, безусловно, должно облегчить понимание данной проблемы.
Цель – провести сравнительный анализ отличий когнитивных нарушений у пациентов с ТРШ и хорошим ответом на антипсихотическую терапию для установления их возможной предиктивной роли в развитии терапевтической резистентности.
Материалы и методы
В исследование включались пациенты, получающие лечение в ФГБУ НМИЦ ПН им. В.М.Бехтерева, СПб ГБУЗ «Больница №1 им. П.П.Кащенко», СПб ГБУЗ «ПНД №3»,СПб ГБУЗ «ПНД №2». Длительность психического расстройства каждого на момент включения в исследование составляла не менее 24 мес. Включение больных в исследование осуществлялось после подписания добровольного информированного согласия. В анализ не включались пациенты, психическое состояние которых не позволяло провести оценку когнитивных функций, также пациенты с коморбидными психическими расстройствами и/или соматическими и инфекционными заболеваниями в стадии декомпенсации.
Всего были включены 130 пациентов с диагнозом «шизофрения» (F20 по Международной классификации болезней 10-го пересмотра). Из них 85 (65,4%) – мужчины, 45 (34,6%) – женщины.
Участники были разделены на 2 группы: 1-я – с ТРШ, 2-я – респондеры (от англ. responder – пациент, отвечающий на терапию). Выделение пациентов в группу с ТРШ осуществлялось согласно следующим критериям [18]:
• После 2 курсов антипсихотической терапии (один из которых должен быть проведен антипсихотиком II поколения) в адекватной дозировке продолжительностью 4–6 нед без должного ответа, в особенности при сохранении психотической симптоматики.
• Стойкая психотическая симптоматика, оказывающая влияние на поведение и функционирование пациента.
• Наличие суицидных тенденций, насильственных действий или коморбидного злоупотребления психоактивными веществами.
Психическое состояние пациентов было оценено посредством шкалы PANSS (Positive and Negative Syndrome Scale) [19] и шкалы общего клинического впечатления CGI-S (Clinical Global Impression Scale) [20]. Общие баллы по данным шкалам положительно коррелируют с выраженностью психотического состояния. Оценка качества социального и профессионального функционирования проводилась с помощью шкалы GAF (Global Assessment
of Functioning Scale) [21]. Оценка когнитивных функций осуществлялась с помощью батареи тестов BAC-S (Brief Assessment of Cognition in Schizophrenia) [22]. Общий балл при выполнении тестов данной батареи положительно коррелирует с когнитивными функциями, т.е. чем больше балл, тем лучше когнитивные функции.
Лабораторная часть исследования выполнялась в НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО (Москва). Из образцов крови была выделена ДНК сорбционным методом при помощи наборов «Амплипрайм» (производитель ООО «Синтол»). Метод проведения генотипирования: полимеразная цепная реакция в реальном времени (real-time PCR) на амплификаторе Biorad CFX-96. Для амплификации полиморфных вариантов DRD2 (Taq1A), DRD3 (Ser9Gly), BDNF (rs6265) HTR2A (T102C) применялись коммерческие наборы (производитель ООО «Синтол»).
Статистическая обработка результатов проводилась в программе SPSS Statistics 21.0. Использовался метод c2 Пирсона для сравнения категориальных переменных, сравнение количественных переменных выполнялось методом Манна–Уитни ввиду ненормального распределения значений.
Результаты и обсуждение
Сравнение групп пациентов с ТРШ и респондеровНе было установлено статистически значимой разницы по возрасту между пациентами с ТРШ и респондерами (р=0,357).
Пациенты с ТРШ при выполнении теста «Вербальная память» батареи BAC-S показали более низкие результаты по сравнению с респондерами. Данная группа пациентов также хуже справлялась с заданиями на словесную и семантическую беглость батареи тестов BAC-S.
При оценке психического состояния при помощи шкалы PANSS больные с ТРШ имели более выраженные позитивные и негативные симптомы шизофрении.
По данным шкалы GAF пациенты с ТРШ имели достоверно более низкий уровень адаптации в социуме или повседневной жизни (р=0,0001); табл. 1.

Клинико-анамнестические данные участников исследования
Между группами ТРШ и респондеровПациенты с установленной формой ТРШ отличались менее благоприятным течением заболевания: худшим ответом на терапию, что отражено меньшей длительностью ремиссии, отношением эффективных курсов антипсихотической терапии к их общему количеству (табл. 2).
Описание ассоциаций носительства значимых генетических полиморфизмов генов с когнитивными функциями и психическим состоянием пациентов в зависимости от наличия ТРШ
Когнитивные функции
Общая выборка пациентовНосительство полиморфных вариантов генов BDNF, DRD2, HTR2A ассоциировалось с отклонениями при выполнении когнитивных тестов. В частности, проблемы были выявлены при следующих тестах BAC-S: «Вербальная память» (BDNF rs6265), «Двигательный тест с фишками» (DRD2 Taq1A), «Последовательность чисел» (DRD2 Taq1A, HTR2A T102C); табл. 3.

Пациенты с ТРШ
Пациенты данной группы – носители исследуемых полиморфных вариантов генов BDNF, DRD2 и HTR2A – показали более низкие результаты отдельных тестов BAC-S.
В частности, «Вербальная память» (BDNF rs6265), «Башня Лондона» (HTR2A T102C), «Последовательность чисел» (DRD2 Taq1A); табл. 4.

Группа респондеров
В данной группе также отмечена ассоциация носительства полиморфных вариантов генов BDNF, DRD2 и HTR2A с результатами выполнения батареи тестов BAC-S. Как показано в табл. 3, значимые различия выявлены для тестов «Словесная и семантическая беглость (животные)» (BDNF rs6265), «Вербальная память» (DRD2 Taq1A), «Двигательный тест с фишками» (DRD2 Taq1A, HTR2A T102C), «Последовательность чисел» (HTR2A T102C); табл. 5.

Психическое состояние
Общая выборкаПсихическое состояние, измеренное на момент включения пациентов в исследование в общей группе больных, показало взаимосвязь с носительством полиморфизмов генов DRD2 и HTR2A. В частности, выявлена ассоциация носительства Taq1A DRD2 с более высоким баллом по пунктам шкалы PANSS «Концептуальная дезорганизация мышления», «Стереотипность мышления». Носительство полиморфизма HTR2A T102C ассоциировалось с большей выраженностью «Эмоциональной отстраненности», «Социального ухода», «Недостатка спонтанности и плавности речи» и «Недостаточного раппорта» (табл. 6).

Пациенты с ТРШ
В группе пациентов с ТРШ также отмечалась ассоциация степени тяжести психического состояния с носительством изучаемых полиморфных вариантов генов DRD2, HTR2A и DRD3. В частности, полиморфный вариант DRD2 Taq1A с пунктом «Концептуальная дезорганизация мышления», полиморфный вариант T102C HTR2A c пунктами «Эмоциональная отстраненность», «Социальный уход» и «Дезориентация», а полиморфный вариант Ser9Gly DRD3 с пунктом «Двигательная заторможенность» (табл. 7).
Группа респондеров
В данной группе пациентов была показана ассоциация полиморфного варианта Ser9Gly гена DRD3 c пунктами «Озабоченность соматическими нарушениями» и «Волевые нарушения» шкалы PANSS (табл. 8).

Выводы
Традиционно принято считать, что пациенты с ТРШ хуже справляются с когнитивными тестами, а также имеют более выраженную психотическую симптоматику [23]. Причинами ухудшения данных параметров может быть как более «злокачественное» течение самого психического расстройства, так и причины, напрямую с ним не связанные, как внешние, так и внутренние. Среди внутренних причин на первом месте стоят генетические особенности, в частности, носительство полиморфных вариантов определенных генов [15, 16]. К внешним причинам помимо более выраженной позитивной и негативной симптоматики относится фармакотерапия. Учитывая отсутствие эффекта от антипсихотической терапии, большинство практикующих психиатров пойдет по пути аугментации, что означает сочетание нескольких психотропных препаратов. Широко известно, что полипрагмазия приводит к различным межлекарственным взаимодействиям, что, в свою очередь, увеличивает риск развития нежелательных побочных реакций, которые могут отрицательно влиять на когнитивное функционирование, психическое состояние, снижать комплаенс, приводить к смене терапии и в конце концов усугублять терапевтическую резистентность [24].Мы рассмотрели только наиболее значимые фармакодинамические гены, связанные с психическим состоянием и когнитивными функциями [16]. Помимо них большую роль играют также фармакокинетические, которые, в свою очередь, влияют на метаболизм лекарственных средств и, следовательно, на эффективность и безопасность проводимой антипсихотической терапии. Исследования по изучению роли данных генов также необходимы.
В рамках этого исследования мы не принимали во внимание влияние фармакотерапии. В дальнейшем планируется провести анализ сочетанного влияния внешних и внутренних факторов на когнитивные функции у пациентов с ТРШ. Тема влияния психофармакотерапии на исходы психических расстройств является довольно обширной и требует рассмотрения в рамках отдельной статьи.
В настоящей работе не было найдено ассоциации носительства полиморфных вариантов генов и ТРШ. Возможно, это связано с тем, что проблема ТРШ является наиболее комплексной, и механизмы, участвующие в ее формировании, достаточно разнообразны. Ограниченная генетическая панель в полной мере не позволяет оценить данную проблему.
Наряду с тем, что кросс-секционный дизайн нашего исследования позволяет сократить временные затраты, он приводит к некоторым ограничениям. Оценка психического состояния в одной точке не позволяет детально изучить эффективность, а также в полной мере охватить параметры безопасности проводимой антипсихотической терапии. Дополнительные трудности вносит сбор сведений о прошлых курсах терапии, течении самого психического расстройства и т.д. Необходимо стремиться к проведению более трудоемких и масштабных проспективных исследований.
Учитывая немалое количество сложностей, возникающих при лечении ТРШ, данная тема является наиболее интересной и перспективной. Расширение панели полиморфных вариантов генов, проведение более масштабных проспективных исследований с большим числом пациентов, несмотря на их высокую стоимость, то, к чему необходимо стремиться. Раннее прогнозирование ТРШ позволит начать противорецидивную терапию на более ранних сроках, что, в свою очередь, может предупредить социальное снижение и инвалидизацию.
Коллектив авторов выражает благодарность: Ж.А.Созаевой – лаборанту кафедры клинической фармакологии и терапии ФГБОУ ДПО РМАНПО, К.А.Рыжиковой – научному сотруднику отдела молекулярной медицины НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО, Р.А.Шейдокову – заведующему отделения СПб ГБУЗ «Больница №1 им. П.П.Кащенко», В.С.Фадеевой – врачу-психиатру СПб ГБУЗ «ПНД №2», В.М.Чомской – заведующей отделением, СПб ГБУЗ «ПНД №3» за помощь в проведении данного исследования.
Сведения об авторах
Сосин Дмитрий Николаевич – мл. науч. сотр. отд-ния биологической терапии психически больных ФГБУ «НМИЦ ПН им. В.М.Бехтерева». E-mail: sosin.dmitriy@gmail.com
Иващенко Дмитрий Владимирович – канд. мед. наук, науч. сотр. отд. персонализированной медицины НИИ молекулярной и персонализированной медицины, ассистент каф. детской психиатрии и психотерапии ФГБОУ ДПО РМАНПО. E-mail: dvi1991@yandex.ru
Отмахов Андрей Павлович – врач-психиатр, зам. глав. врача СПб ГБУЗ «Больница №1 им. П.П.Кащенко». E-mail: otmakhov@kaschenko-spb.ru
Янушко Мария Григорьевна – вед. науч. сотр. отд-ния биологической терапии психически больных ФГБУ «НМИЦ ПН им. В.М.Бехтерева». E-mail: yanushko@list.ru
Гришина Елена Анатольевна – канд. биол. наук, доц., зам. дир. НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО. E-mail: gelana2010@yandex.ru
Сычев Дмитрий Алексеевич – чл.-кор. РАН, д-р мед. наук, проф., проректор по развитию и инновациям, зав. каф. клинической фармакологии и терапии ФГБОУ ДПО РМАНПО. E-mail: dmitry.alex.sychev@gmail.com
Иванов Михаил Владимирович – д-р мед. наук, проф., рук. отд-ния биологической терапии психически больных ФГБУ «НМИЦ ПН им. В.М.Бехтерева». E-mail: profmikhailivanov@gmail.com
Список исп. литературыСкрыть список1. Iasevoli F, Avagliano C, Altavilla B et al. Evaluation of a few discrete clinical markers may predict categorization of actively symptomatic non-acute schizophrenia patients as treatment resistant or responders: A study by ROC curve analysis and multivariate analyses. Psychiatry Res 2018; 269: 481–93. DOI: 10.1016/j. psychres.2018.08.109
2. Lally J, MacCabe JH. Antipsychotic medication in schizophrenia: a review. Br Med Bull 2015; 114 (1): 169–79. DOI: 10.1093/ bmb/ldv017
3. Iasevoli F, Giordano S, Balletta R et al. Treatment resistant schizophrenia is associated with the worst community functioning among severely-ill highly-disabling psychiatric conditions and is the most relevant predictor of poorer achievements in functional milestones. Prog Neuropsychopharmacol Biol Psychiatry 2016; 65: 34–48. DOI: 10.1016/j.pnpbp.2015.08.010
4. Kennedy JL, Altar CA, Taylor DL et al. The social and economic burden of treatment-resistant schizophrenia: a systematic literature review. Int Clin Psychopharmacol 2014; 29 (2): 63–76. DOI: 10.1097/YIC.0b013e32836508e6
5. Мазо Г.Э., Горобец Л.Н. Замена антипсихотика как метод предотвращения формирования резистентности при шизофрении. Обозрение психиатрии и мед. психологии. 2017; 3: 74–80. / Mazo G.E., Gorobets L.N. Zamena antipsikhotika kak metod predotvrashcheniia formirovaniia rezistentnosti pri shizofrenii. Obozrenie psikhiatrii i med. psikhologii. 2017; 3: 74–80. [in Russian]
6. Янушко М.Г., Иванов М.В., Сорокина А.В. Когнитивные нарушения при эндогенных психозах: современные представления в свете дименсионального подхода. Соц. и клин. психиатрия. 2014; 24 (1): 90–5. / Ianushko M.G., Ivanov M.V., Sorokina A.V. Kognitivnye narusheniia pri endogennykh psikhozakh: sovremennye predstavleniia v svete dimensional'nogo podkhoda. Sots. i klin. psikhiatriia. 2014; 24 (1): 90–5. [in Russian]
7. Keefe RS, Fenton WS. How should DSM-V criteria for schizophrenia include cognitive impairment? Schizophr Bull 2007; 33 (4): 912–20.
8. Woodward N, Meltzer H. Neuropsychologyoftreatment-resistantschizophrenia In: Elkis H, Meltzer H, editors. Therapy-resistant schizophrenia. Basel (Switzerland): Karger, 2010; p. 33–51.
9. Anderson VM, McIlwain ME, Kydd RR, Russell BR. Does cognitive impairment in treatment-resistant and ultra-treatment-resistant schizophrenia differ from that in treatment responders? Psychiatry Res 2015; 230 (3): 811–8. DOI: 10.1016/j.psychres.2015.10.036
10. Albert N, Randers L, Allott K et al. Cognitive functioning following discontinuation of antipsychotic medication. A naturalistic sub-group analysis from the OPUS II trial. Psychol Med 2018: 1–10. DOI: 10.1017/S0033291718001836
11. Medalia A, Gold J, Merriam A. The effects of neuroleptics on neuropsychological test results of schizophrenia. Arch Clin Neuropsychol 1988; 3 (3): 249–71.
12. Clissold M, Crowe SF. Comparing the effect of the subcategories of atypical antipsychotic medications on cognition in schizophrenia using a meta-analytic approach. J Clin Exp Neuropsychol 2018: 1–17. DOI: 10.1080/13803395.2018.1488952
13. Kontis D, Theochari E, Kleisas S et al. Doubtful association of antipsychotic polypharmacy and high dosage with cognition in chronic schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2010; 34 (7): 1333–41. DOI: 10.1016/j.pnpbp.2010.07.029
14. Blokland GAM, Mesholam-Gately RI, Toulopoulou T et al. Heritability of neuropsychological measures in schizophrenia and nonpsychiatric populations: a systematic review and meta-analysis. Schizophr Bull 2017; 43 (4): 788–800. DOI: 10.1093/schbul/sbw146
15. Янушко М.Г., Сосин Д.Н., Шаманина М.В., Иванов М.В. Генетические корреляты когнитивных нарушений при шизофрении (обзор литературы). Сиб. вестн. психиатрии и наркологии. 2018; 2 (99): 98–103. DOI: 10.26617/1810-3111-2018-2 (99)-98-103 / Ianushko M.G., Sosin D.N., Shamanina M.V., Ivanov M.V. Geneticheskie korreliaty kognitivnykh narushenii pri shizofrenii (obzor literatury). Sib. vestn. psikhiatrii i narkologii. 2018; 2 (99): 98–103. DOI: 10.26617/1810-3111-2018-2 (99)-98-103 [in Russian]
16. Schizophrenia Working Group of the Psychiatric Genomics Consortium. Biological insights from 108 schizophrenia-associated genetic loci. Nature 2014; 511: 421–7.
17. Kroken RA, Loberg EM, Dronen T et al. A critical review of pro-cognitive drug targets in psychosis: convergence on myelination and inflammation. Front Psychiatry 2014; 5: 11. DOI: 10.3389/ fpsyt.2014.00011
18. Stahl SM, Morrissette DA, Citrome L et al. "Meta-guidelines" for the management of patients with schizophrenia. CNS Spectr 2013; 18 (3): 150–62. DOI: 10.1017/S109285291300014X
19. Kay SR, Fiszbein A, Opler LA. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull 1987; 13 (2): 261–76.
20. Busner J, Targum SD. The Clinical Global Impressions Scale. Psychiatry (Edgmont) 2007; 4 (7): 28–37.
21. Endicott J, Spitzer RL, Fleiss JL, Cohen J. The global assessment scale: A procedure for measuring overall severity of psychiatric disturbance. Arch Gen Psychiatry 1976; 33: 766–71.
22. Keefe RS, Fox KH, Davis VG et al. The Brief Assessment of Cognition In Affective Disorders (BAC-A): Performance of patients with bipolar depression and healthy controls. J Affect Dis 2014; 166: 86–92. DOI: 10.1016/j.jad.2014.05.002
23. De Bartolomeis A, Balletta R, Giordano S et al. Differential cognitive performances between schizophrenic responders and non-responders to antipsychotics: correlation with course of the illness, psychopathology, attitude to the treatment and antipsychotics doses. Psychiatry Res 2013; 210 (2): 387–95. DOI: 10.1016/j. psychres.2013.06.042
24. Cheng CM, Chang WH, Chiu YC et al. Association of Polypharmacy With Mild Cognitive Impairment and Cognitive Ability: A Nationwide Survey in Taiwan. J Clin Psychiatry 2018; 79 (6); pii: 17m12043. DOI: 10.4088/JCP.17m12043
1 марта 2019
Количество просмотров: 2014

