Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2019
Эффективность и безопасность антипсихотика III поколения луразидона (Латуда) при шизофрении и биполярных депрессиях (обзор литературы с комментариями) №04 2019
Аннотация
Несмотря на все усилия Российского общества психиатров и Министерства здравоохранения Российской Федерации по повышению квалификации психиатров и улучшению качества диагностики психических заболеваний, проблема гипердиагностики шизофрении и других расстройств шизофренического спектра и в то же время – неадекватно низкой выявляемости аффективных и тревожных расстройств, а также расстройств обсессивно-компульсивного спектра, продолжает оставаться одной из острейших проблем современной российской психиатрии. С этим тесно связана и проблема неадекватного лечения, в частности чрезмерного увлечения антипсихотиками (АП) при самых разных психических заболеваниях. В свете этого особое значение приобретает наличие в арсенале психиатров универсальных препаратов, способных оказать положительное действие и на психотическую, и на аффективную, тревожную и обсессивно-компульсивную симптоматику и эффективных как при расстройствах шизофренического спектра, так и при аффективных и тревожных расстройствах. Одним из таких универсальных препаратов как раз и является рассматриваемый в данной статье препарат Латуда (луразидон). Особый рецепторный профиль луразидона, в частности его самое сильное среди всех имеющихся на рынке АП II и III поколений 5-HT7-блокирующее действие, обусловливает такие особенности его клинического профиля, как выраженное антинегативное, прокогнитивное и антидепрессивное действие, специфическое нормализующее действие на фазовую структуру сна и циркадные ритмы, а также сильный анксиолитический эффект. Стоит особо отметить, что из всех присутствующих на рынке АП и комбинаций АП и антидепрессантов в одной таблетке только у трех препаратов на данный момент имеется официальная регистрация Управления по контролю пищевых продуктов и лекарств в США для применения при биполярной депрессии: у кветиапина (в монотерапии), у препарата Симбиакс – комбинации оланзапина и флуоксетина (но не у монотерапии оланзапином!) и у героя нашего нынешнего обзора – препарата Латуда (луразидон), причем как в монотерапии, так и в комбинации с литием или вальпроатами. Ни у одного другого АП официальных показаний для потенцирования ими нормотимиков не имеется. Это отражает высокий нормотимический, антидепрессивный и анксиолитический потенциал луразидона как в монотерапии, так и в комбинации с литием или вальпроатом. К важным преимуществам луразидона перед другими присутствующими на рынке АП относятся также его хорошая переносимость и безопасность, связанная с его улучшенным рецепторным профилем. В частности, для луразидона характерна низкая склонность вызывать экстрапирамидные побочные явления и акатизию, повышение аппетита, прибавку массы тела и метаболические нарушения, ортостатическую гипотензию и тахикардию. В свете этого можно сказать, что луразидон является не просто «еще одним новым АП», а весьма важным расширением терапевтического арсенала психиатрии.
Ключевые слова: шизофрения, шизоаффективное расстройство, биполярное аффективное расстройство, депрессивные расстройства, единый психоз, эндофенотип, ангедония, мультидименсиональная модель, антипсихотик III поколения, луразидон, Латуда.
Для цитирования: Беккер Р.А., Быков Ю.В. Эффективность и безопасность антипсихотика III поколения луразидона (Латуда) при шизофрении и биполярных депрессиях (обзор литературы с комментариями). Психиатрия и психофармакотерапия. 2019; 4:
Аннотация
Несмотря на все усилия Российского общества психиатров и Министерства здравоохранения Российской Федерации по повышению квалификации психиатров и улучшению качества диагностики психических заболеваний, проблема гипердиагностики шизофрении и других расстройств шизофренического спектра и в то же время – неадекватно низкой выявляемости аффективных и тревожных расстройств, а также расстройств обсессивно-компульсивного спектра, продолжает оставаться одной из острейших проблем современной российской психиатрии. С этим тесно связана и проблема неадекватного лечения, в частности чрезмерного увлечения антипсихотиками (АП) при самых разных психических заболеваниях. В свете этого особое значение приобретает наличие в арсенале психиатров универсальных препаратов, способных оказать положительное действие и на психотическую, и на аффективную, тревожную и обсессивно-компульсивную симптоматику и эффективных как при расстройствах шизофренического спектра, так и при аффективных и тревожных расстройствах. Одним из таких универсальных препаратов как раз и является рассматриваемый в данной статье препарат Латуда (луразидон). Особый рецепторный профиль луразидона, в частности его самое сильное среди всех имеющихся на рынке АП II и III поколений 5-HT7-блокирующее действие, обусловливает такие особенности его клинического профиля, как выраженное антинегативное, прокогнитивное и антидепрессивное действие, специфическое нормализующее действие на фазовую структуру сна и циркадные ритмы, а также сильный анксиолитический эффект. Стоит особо отметить, что из всех присутствующих на рынке АП и комбинаций АП и антидепрессантов в одной таблетке только у трех препаратов на данный момент имеется официальная регистрация Управления по контролю пищевых продуктов и лекарств в США для применения при биполярной депрессии: у кветиапина (в монотерапии), у препарата Симбиакс – комбинации оланзапина и флуоксетина (но не у монотерапии оланзапином!) и у героя нашего нынешнего обзора – препарата Латуда (луразидон), причем как в монотерапии, так и в комбинации с литием или вальпроатами. Ни у одного другого АП официальных показаний для потенцирования ими нормотимиков не имеется. Это отражает высокий нормотимический, антидепрессивный и анксиолитический потенциал луразидона как в монотерапии, так и в комбинации с литием или вальпроатом. К важным преимуществам луразидона перед другими присутствующими на рынке АП относятся также его хорошая переносимость и безопасность, связанная с его улучшенным рецепторным профилем. В частности, для луразидона характерна низкая склонность вызывать экстрапирамидные побочные явления и акатизию, повышение аппетита, прибавку массы тела и метаболические нарушения, ортостатическую гипотензию и тахикардию. В свете этого можно сказать, что луразидон является не просто «еще одним новым АП», а весьма важным расширением терапевтического арсенала психиатрии.
Ключевые слова: шизофрения, шизоаффективное расстройство, биполярное аффективное расстройство, депрессивные расстройства, единый психоз, эндофенотип, ангедония, мультидименсиональная модель, антипсихотик III поколения, луразидон, Латуда.
Для цитирования: Беккер Р.А., Быков Ю.В. Эффективность и безопасность антипсихотика III поколения луразидона (Латуда) при шизофрении и биполярных депрессиях (обзор литературы с комментариями). Психиатрия и психофармакотерапия. 2019; 4:
On the safety and efficacy of a III generation antipsychotic lurasidone (Latuda) in schizophrenia and bipolar depression (a literature review with authors’ comments)
R.A. Bekker1, Yu.V. Bykov2
1David Ben-Gurion University in Negev, Be’er-Sheva, Israel;
2Stavropol State Medical University, Stavropol, Russia yubykov@gmail.com
Abstract
Despite all the efforts of the Russian Society of Psychiatrists and the Ministry of Health of the Russian Federation to improve the psychiatrists’ knowledge and to improve the quality of diagnosis of mental diseases, the problem of overdiagnosis of schizophrenia and other schizophrenia spectrum disorders, and at the same time the problem of inadequately low detection of affective and anxiety disorders, as well as of obsessive-compulsive spectrum disorders, continues to be one of the most acute problems of modern Russian psychiatry. Closely related to this is the problem of inadequate treatment, in particular, overuse of antipsychotics in a wide variety of mental illnesses. In light of this, the presence in the arsenal of psychiatrists of fairly universal drugs which can have a positive effect on both psychotic, affective, anxious, and obsessive-compulsive symptoms, and which have proven efficacy in both schizophrenia spectrum and affective spectrum disorders, is of particular importance. One of these universal drugs is reviewed in this article. It is a new III generation antipsychotic named Latuda (lurasidone). The unique receptor profile of lurasidone, in particular, its very strong 5-HT7 blocking action, which is the strongest among all the second and III generation antipsychotics currently marketed, determines some distinctive features of its clinical profile, such as its pronounced anti-negative, pro-cognitive and antidepressant effect, its specific normalizing effect on the sleep phase structure and circadian rhythms, as well as its strong anxiolytic effect. It is worth noting that of all antipsychotics and antipsychotic/antidepressant combinations currently on the market, only three drugs and drug combinations have and official FDA approval for use in bipolar depression: quetiapine (in monotherapy), Symbyax – olanzapine/fluoxetine combination (but not olanzapine monotherapy!), and lurasidone (Latuda), both as monotherapy and in combination with lithium or valproate. No other antipsychotic currently marketed has official FDA indications for use in augmentation of mood stabilizers. This fact reflects the high mood-stabilizing, antidepressant and anxiolytic potential of lurasidone, both as monotherapy and in combination with lithium or valproate. An important advantage of lurasidone over other antipsychotics on the market is its good tolerability and safety due to its improved receptor profile. In particular, it has a low propensity to cause extrapyramidal side effects and akathisia, to increase appetite, to promote weight gain and metabolic disturbances, to give orthostatic hypotension and tachycardia. In light of this, we can say that lurasidone is not just «another new antipsychotic», but a very important expansion of the therapeutic arsenal of psychiatry.
Key words: schizophrenia, schizoaffective disorder, bipolar affective disorder, major depressive disorder, single psychosis theory, endophenotype, anhedonia, multidimensional model, III generation antipsychotic, lurasidone, Latuda.
For citation: Bekker R.A., Bykov Yu.V. On the safety and efficacy of a III generation antipsychotic lurasidone (Latuda) in schizophrenia and bipolar depression (a literature review with authors’ comments). Psychiatry and Psychopharmacotherapy. 2019; 21 (4):
Введение. Общие исторические сведения
Психические заболевания известны человечеству с глубокой древности. Так, исторически первые описания «меланхолии» и «мании», сохранившие актуальность до наших дней, сделаны еще Гиппократом II (W. Sneader, 2005).
Позднее Карлом Кальбаумом были выделены и охарактеризованы отдельные клинические синдромы, такие как кататонический, параноидный, депрессивный, маниакальный синдром и др. (Р.А. Беккер и соавт., 2019).
Еще позже Эмиль Крепелин, изучая характер течения различных психических заболеваний на протяжении длительного времени, впервые ввел знаменитую «крепелинскую дихотомию», проведя четкую грань между «ранним слабоумием», или «деменцией прекокс» (заболеванием, которое мы сегодня знаем как шизофрению) и «маниакально-депрессивным безумием» (заболеванием, которое мы сегодня знаем как биполярное аффективное расстройство – БАР); Р.А. Беккер и соавт., 2019.
Стоит отметить, что существования каких бы то ни было промежуточных форм, например состояния, которое мы сегодня называем «шизоаффективным расстройством» (ШАР), Э. Крепелин не признавал и видел свою дихотомию как жесткую, не допускающую разночтений (Р.А. Беккер и соавт., 2019).
Позже, в 1908 г., О. Блейлер предложил реконцептуализацию заболевания, впервые описанного Э. Крепелиным под названием «деменция прекокс», и ввел для нее новое название – «шизофрения», соответствующее предложенной им новой концепции. Его сын Манфред, развивая идеи и концепции своего отца, показал, что между шизофренией и БАР на самом деле не существует четкой границы и впервые выделил и описал ШАР (Р.А. Беккер и соавт., 2019).
Шизофрения и аффективные расстройства: дихотомия или непрерывный спектр?
Это привело к возрождению на новом, более современном, уровне «концепции единого психоза», казалось бы, навсегда похороненной с введением Э. Крепелиным его знаменитой дихотомии. В современной психиатрии утвердилось понимание, что шизофрения, ШАР и БАР представляют собой непрерывный спектр, или, скорее, даже многомерный континуум состояний, на одном полюсе которого – «чистая» шизофрения с минимальными признаками аффективного расстройства или вообще без таковых, на другом полюсе – «чистое» БАР с минимальными признаками психоза или вообще без таковых, а между ними – разные варианты ШАР (Р.А. Беккер и соавт., 2019).
Интересно отметить, что, несмотря на общепринятое сегодня понимание природы этих состояний как непрерывного спектра, по сей день в мировой психиатрии, по словам известного психофармаколога Стивена М. Шталя, борются две точки зрения – «шизофреноцентричная» и «аффектоцентричная». Для одних специалистов шизофрения, протекающая даже с минимальными признаками аффективной патологии, – это как минимум ШАР, если не «неверно диагностированный БАР». Для других же, наоборот, БАР, протекающий даже с минимальными признаками психоза или чего-то «около-негативного», такого, например, как потеря работы или снижение социального статуса – это как минимум ШАР, если не «неверно диагностированная шизофрения» (S. Stahl, 2013, 2015).
Различия в концептуализациях между дихотомической моделью шизофрении, ШАР и БАР, и моделью непрерывного спектра представлены ниже на рис. 1, 2. Рис. 1 иллюстрирует дихотомический подход, в то время как рис. 2 иллюстрирует концепцию непрерывного спектра. Современные научные данные заставляют предполагать, что концепция непрерывного спектра лучше отражает клиническую реальность (S. Stahl, 2013, 2015).
- Психоз обязателен - Психоз обязателен - Психоз обязателен, но может наблюдаться на высоте аффективных фаз любого знака - Хроническое течение - Также обязательны выраженные аффективные нарушения любого знака - Обязательно наличие в картине болезни маниакальных, гипоманиакальных или смешанных эпизодов - В целом неблагоприятный прогноз - Прогноз промежуточный между шизофренией и БАР, сильно зависит от типа течения болезни - Эпизодическое (фазное) или циклическое течение- Шизофреноцентрическая модель предполагает, что даже небольшой «запах шизофрении» позволяет врачу поставить пациенту диагноз шизофрении или как минимум ШАР или другого РШС - Несмотря на наличие ШАР в официальных диагностических классификациях, существование ШАР как отдельной самостоятельной группы заболеваний, отличной и от шизофрении, и от БАР, до сих пор признается не всеми специалистами - В среднем более благоприятный прогноз - Аффектоцентрическая модель предполагает, что даже небольшой «запах аффективного расстройства» позволяет врачу поставить пациенту диагноз аффективного расстройства (БАР, РДР) или как минимум ШАР
Рис. 1. Дихотомическая модель шизофрении, ШАР и БАР.
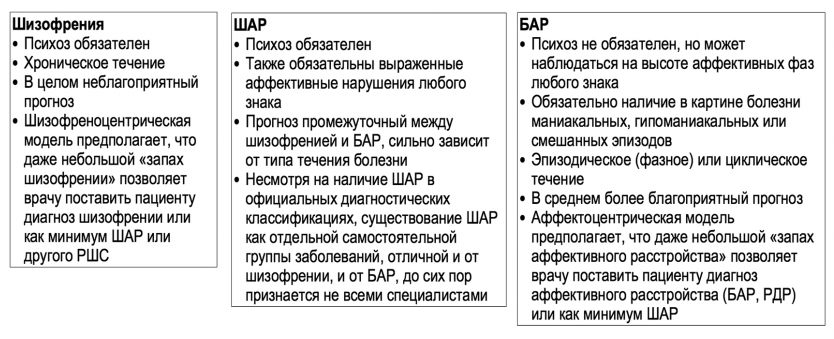
Рис. 2. Концепция шизоаффективного спектра.
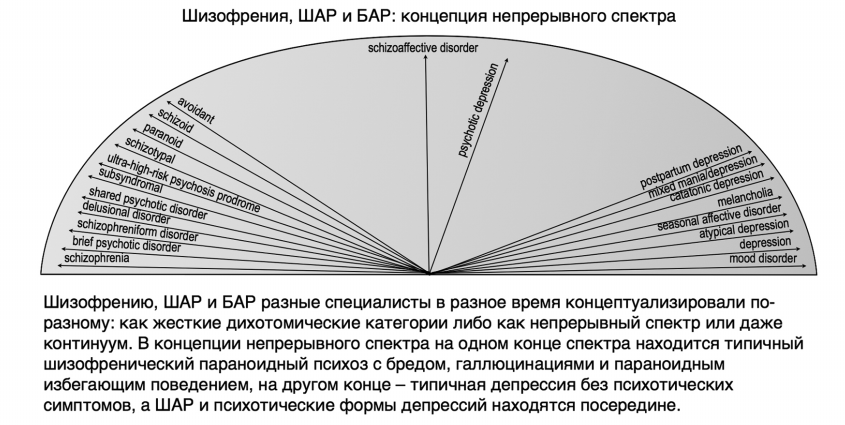
Шизофрения, ШАР и БАР: концепция непрерывного спектра
В частности, выделяют форму ШАР с биполярным течением: с чередованием маниакальных или гипоманиакальных фаз с депрессивными, как при БАР, но с наличием также продуктивной симптоматики, свойственной шизофрении; чередование при этом часто бывает неправильным, менее регулярным во времени, чем при «чистом» БАР (S. Stahl, 2013).
Эта форма течения ШАР, так называемое «шизо-биполярное расстройство» («циркулярная шизофрения», или «биполярная шизофрения» в терминологиях О. Блейлера и А.А. Снежневского), иллюстрируется на рис. 3. Этот тип течения ШАР не является единственно возможным (S. Stahl, 2013, 2015).
Рис. 3. Один из видов ШАР с нерегулярным во времени биполярным течением (так называемое «шизо-биполярное» расстройство).
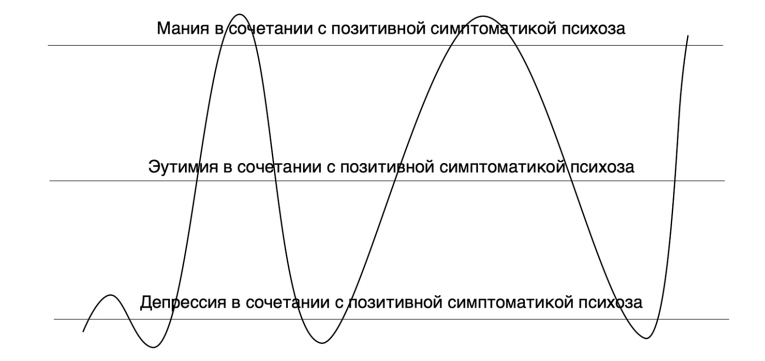
Существуют и другие типы течения ШАР, например, только с униполярными депрессивными фазами, но с наличием также продуктивной симптоматики, свойственной шизофрении – «периодическая или приступообразная депрессивно-параноидная или депрессивно-ипохондрическая шизофрения» (S. Stahl, 2013, 2015).
Иллюстрируя диагностические сложности, возникающие при дифференциальной диагностике шизофрении, ШАР и БАР на практике, S. Stahl в другой своей книге – «Case Studies» – описывает 35-летнюю женщину, у которой за 15 лет болезни диагноз циклически менялся между ШАР, БАР и шизофренией 15 (!) раз, причем в части случаев один и тот же психиатр ставил этой больной разные диагнозы в разные фазы ее болезни (S. Stahl, 2015).
Роль аффективной, тревожной, когнитивной и негативной симптоматики в общей картине шизофрении
С другой же стороны, разложение всего комплекса симптомов шизофрении на кластеры или субдомены, предпринятое современными исследователями с помощью многопараметрического компьютерного анализа, показало, что, наряду с традиционно выделяемыми кластерами или субдоменами «продуктивной» («позитивной») и «негативной» симптоматики, интегральной частью общей картины шизофрении является также субдомен аффективной симптоматики и субдомен когнитивной симптоматики (P. Ruiz, 2017).
Более того, при дальнейшем разложении этих основных субдоменов симптоматики шизофрении удалось выявить, что субдомен аффективной симптоматики в действительности распадается на субдомены депрессивной и тревожной симптоматики, а субдомен продуктивной симптоматики распадается на субдомен «классической» продуктивной симптоматики (бред, галлюцинации) и субдомен дезорганизации (возбуждение, нарушения поведения, речи, кататония); P. Ruiz, 2017.
Таким образом, депрессия, тревога и когнитивные нарушения являются интегральной частью общей картины шизофрении, и игнорировать их недопустимо. Лечение больных шизофренией не должно быть сосредоточено только лишь на устранении продуктивной и/или негативной симптоматики, но включать в себя и нормализацию когнитивного функционирования, и устранение депрессии, и устранение тревожности (P. Ruiz, 2017).
Интересно также отметить, что, когда Самуэль Гершон и руководимый им авторский коллектив попытались обнаружить «эндофенотип», лежащий в основе БАР, т.е. «ядерный» симптом или симптомокомплекс, лежащий ближе всего к предполагаемым генетическим или эпигенетическим основам болезни и предположительно порождающий все остальные наблюдаемые симптомы, то они обнаружили, что лучше всего на роль эндофенотипа биполярной депрессии подходит такой симптом, как ангедония (S. Gershon, J. Soares, 2000).
Однако, пытаясь выяснить, является ли выделенный ими эндофенотип, ставящий на первое место ангедонию, специфичным для БАР, эти ученые обнаружили, что ангедония является столь же частым симптомом и при шизофрении. Более того, ангедония является ключевым, ядерным симптомом как в субдомене депрессивной симптоматики шизофрении, так и в субдомене ее негативной симптоматики. В частности, именно ангедонией можно объяснить как «притупление эмоций», «уплощение аффекта», так и снижение энергии, воли, мотивации, побуждений, инициативы – «зачем что-то делать, если это не приносит удовольствия?» (S. Gershon, J. Soares, 2000).
Из всего этого видно, насколько большую роль в действительности играет депрессивная и тревожная симптоматика в общей картине шизофрении и насколько важно ее устранение для более благоприятного долгосрочного функционального исхода болезни (S. Gershon, J. Soares, 2000).
БАР vs униполярное рекуррентное депрессивное расстройство: дихотомия или непрерывный спектр?
К обсуждавшемуся выше вопросу о том, являются ли шизофрения, ШАР и БАР тремя категориально различными заболеваниями или же они являются непрерывным спектром состояний со множеством переходных форм, тесно примыкает также другой сходный вопрос: являются ли БАР и униполярное рекуррентное депрессивное расстройство (РДР) двумя дихотомически, категориально различными состояниями или же это тоже непрерывный спектр, даже многомерный континуум состояний (S. Gershon, J. Soares, 2000; S. Stahl, 2013)?
Между тем это не отвлеченный, абстрактно-теоретический вопрос. Это вопрос, напрямую влияющий на всю психиатрическую диагностику, а также на стратегию и тактику лечения пациентов с «псевдоуниполярными» депрессивными состояниями, подозрительными на принадлежность к расстройствам биполярного спектра. В частности, это касается вопроса о целесообразности как можно более раннего применения при таких депрессиях в первую очередь не только и не столько антидепрессантов (АД), сколько нормотимиков (НТ) и/или антипсихотиков (АП) II и III поколений (АП-2П и АП-3П) с антидепрессивными и нормотимическими свойствами, в частности таких, как луразидон (S. Stahl, 2013).
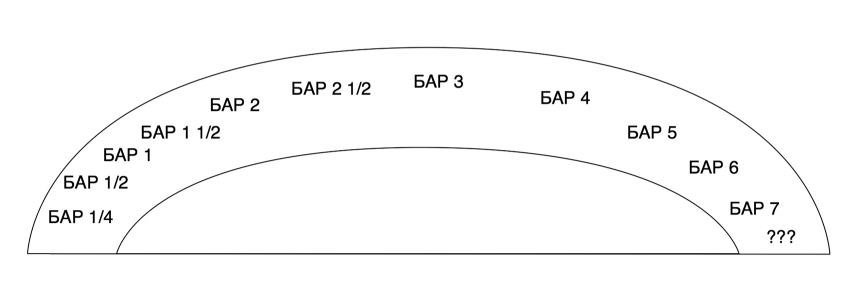
В последние десятилетия накапливается все больше научных данных в пользу того, что концепция «биполярного спектра» ближе к клинической реальности, чем концепция биполярно-униполярной дихотомии, и что БАР и РДР представляют собой «две противоположные крайности» спектра расстройств биполярного спектра. В частности, известный специалист по аффективной патологии Хагоп Акискал выделил наряду с описанными в DSM-IV-TR категориями БАР 1-го типа, БАР 2-го типа и циклотимии еще несколько «промежуточных» типов БАР, например подтип БАР 1/4, проявляющийся нестабильной реакцией на АД, быстрой потерей их эффективности – pop-out (S. Stahl, 2013).
Недостаточное внимание к выявлению так называемых «малых признаков биполярности», таких как: молодой или очень молодой возраст начала болезни, семейный анамнез по БАР или циклотимии, острое начало и/или быстрое развертывание депрессии, столь же быстрое ее окончание или быстрая ее обратная динамика, сразу большая тяжесть депрессий (с первых же депрессивных эпизодов и/или с первых дней текущего эпизода), выраженная суицидальность, атипичные (инвертированные) соматовегетативные знаки (повышение аппетита, прибавка массы тела и/или гиперсомния вместо снижения аппетита, исхудания и бессонницы), выраженная раздражительность, агрессивность или дисфоричность в картине депрессии, выраженная тревога или ажитация, психотический характер депрессии, наличие в картине депрессии синдрома деперсонализации-дереализации, наличие в анамнезе хотя бы коротких и стертых гипоманий (в том числе индуцированных приемом АД) – может привести к неверному диагнозу униполярного РДР и к неправильному лечению, в частности к монотерапии АД и к неназначению НТ и/или АП-2П/АП-3П с нормотимическими свойствами там, где они на самом деле показаны. Это, в свою очередь, может привести к потере времени, неблагоприятным для пациента социальным последствиям (потеря работы, прекращение учебы, разрушение отношений с семьей и друзьями) и даже к суицидальным попыткам и завершенным суицидам (S. Stahl, 2013).
Концепция биполярного спектра изображена на рис. 4 (S. Stahl, 2013).
Рис. 4. Биполярный спектр.
Ниже мы дадим пояснения к этому рисунку с кратким описанием выделенных Х. Акискалом подтипов БАР. Мы не будем глубоко входить в детали этого описания, обсуждать правомерность выделения тех или иных подтипов БАР, разногласия между аффектологами по этому вопросу, особенности диагностики и лечения разных подтипов БАР, поскольку это выходит за рамки данной статьи. За более подробными разъяснениями следует обращаться к первоисточнику (S. Stahl, 2013).
БАР 1/4. Подтипом БАР 1/4 Х. Акискал обозначил псевдоуниполярные депрессии с выраженной нестабильностью эффекта, получаемого от АД, с нередко быстрым ответом на терапию, но таким же быстрым «сползанием» или потерей их эффективности – pop-out (S. Stahl, 2013).
БАР 1/2 или, иначе говоря, ШАР. Подтипом БАР 1/2 Х. Акискал обозначил ШАР. Выбор именно такого цифрового обозначения для ШАР обусловлен тем, что, как мы уже писали выше, в модели шизоаффективного спектра ШАР представляет собой не отдельную диагностическую категорию, а часть спектра, расположенную между «чистой» шизофренией и «чистым БАР», т.е. как бы «на 1/2 БАР и на 1/2 шизофрению» (S. Stahl, 2013).
БАР 1 и БАР 2 Х. Акискал определяет так же, как эти широко известные подтипы БАР определяются в DSM-IV-TR (S. Stahl, 2013).
БАР 1 1/2. Текущие версии диагностических классификаций ни в случае DSM, ни в случае Международной классификации болезней не позволяют поставить диагноз БАР (даже 2-го типа) или хотя бы циклотимии пациенту, у которого на момент постановки диагноза наблюдаются только гипомании без депрессивных эпизодов, хотя бы циклотимического или дистимического (субдепрессивного) уровня. Однако Х. Акискал обоснованно указывает, что эти пациенты тоже принадлежат к биполярному спектру, и что у них впоследствии, при более длительном наблюдении, часто развиваются депрессивные или субдепрессивные состояния, которые плохо поддаются монотерапии АД и требуют добавления НТ и/или АП-2П/АП-3П с нормотимическими свойствами. Он обозначил эту подкатегорию как БАР 1 1/2 (S. Stahl, 2013).
БАР 2 1/2. Подтипом БАР 2 1/2 Х. Акискал обозначил нередкую клиническую ситуацию, в которой большие депрессивные эпизоды накладываются либо на хроническую дистимию или «гипотимный характер» (так называемая «двойная депрессия»), либо на циклотимию или на «циклоидный характер». Такая ситуация тоже формально никак не предусмотрена действующими диагностическими классификациями (не выделяется в них). При этом Х. Акискал указал, что пациенты с дистимией или циклотимией редко обращаются к врачам до развития у них «полномасштабных» депрессивных эпизодов и что при недостаточно внимательном расспросе выраженная циклоидность или циклотимия, дистимия или гипотимный характер до развития депрессии часто оказываются «пропущены». Между тем эти пациенты тоже явно принадлежат к биполярному спектру и тоже часто дают плохую, недостаточную или «неправильную» (индукция нестабильности настроения, суицидальности и т.п.) реакцию на монотерапию АД без добавления НТ и/или АП-2П/АП-3П с нормотимическими свойствами (S. Stahl, 2013).
БАР 3. Подтипом БАР 3 Х. Акискал обозначил пациентов, у которых (пока) не зарегистрировано было спонтанного развития маний, гипоманий или смешанных состояний, однако имеется предыстория индукции подобных состояний при попытках лечения депрессии монотерапией АД. Текущие формальные диагностические классификации не позволяют поставить такому пациенту диагноз БАР (вместо этого полагается ставить «аффективное расстройство, вызванное употреблением химических веществ»). Однако такие пациенты, бесспорно, тоже принадлежат к биполярному спектру и являются плохими кандидатами на монотерапию АД без добавления НТ и/или АП-2П/АП-3П с нормотимическими свойствами (S. Stahl, 2013).
БАР 3 1/2. Особый подвариант БАР 3, когда злоупотребление алкоголем или психоактивными веществами приводит к индукции маний, гипоманий или смешанных состояний или маскирует симптомы лежащей в его основе аффективной патологии и затрудняет диагностику БАР, Х. Акискал предложил называть БАР 3 1/2 (на рис. 4 не показан); S. Stahl, 2013.
БАР 4. Подтипом БАР 4 Х. Акискал обозначил пациентов, у которых депрессивные эпизоды развиваются на фоне предсуществующего гипертимного темперамента. Так же, как и выше упоминавшиеся пациенты с «двойной депрессией» (большой депрессией на фоне дистимии или «гипотимного темперамента») или пациенты с большой депрессией на фоне циклотимии или циклоидного темперамента, эти пациенты часто оказываются плохими кандидатами на монотерапию АД без добавления НТ и/или АП-2П/АП-3П с нормотимическими свойствами (S. Stahl, 2013).
БАР 5. Подтипом БАР 5 Х. Акискал обозначил пациентов с депрессиями, которые, согласно DSM-IV-TR (до принятия DSM-5 и введения возможности использования квалификатора with mixed features – «со смешанными признаками» – как для биполярных эпизодов обоего знака, так и для униполярных депрессий) не могли быть диагностированы как страдающие тем или иным подтипом БАР или как страдающие от «смешанной депрессии», несмотря на то, что в клинической картине их депрессии одновременно присутствуют один или несколько признаков гипомании. Дело в том, что диагностические критерии DSM-IV-TR требовали для возможности постановки диагноза «смешанного состояния» (mixed state) одновременного присутствия полных синдромальных критериев как депрессии, так и мании (даже не гипомании); S. Stahl, 2013.
Между тем таких «полносиндромных» пациентов меньшинство среди пациентов со смешанными аффективными состояниями. В то же время пациенты со смешанными депрессиями, «не дотягивающими» до формальных диагностических критериев «смешанного эпизода» по DSM-IV-TR, явно тоже относятся к биполярному спектру и являются плохими кандидатами на монотерапию АД без добавления НТ и/или АП-2П/АП-3П с нормотимическими свойствами (S. Stahl, 2013).
БАР 6. Подтипом БАР 6 Х. Акискал обозначил клиническую ситуацию, при которой БАР или другое расстройство биполярного спектра впервые развивается (манифестирует) или протекает коморбидно на фоне деменции того или иного типа (например, сосудистой, мультиинфарктной, деменции Альцгеймера, Пика, болезни Паркинсона, лобно-височной деменции и т.п.) или на фоне энцефалопатии (например, посттравматической). При этом Х. Акискал указывает, что у части таких пациентов БАР или другое расстройство биполярного спектра имелось и ранее, но аффективные эпизоды могли протекать менее заметно. Поэтому до развития дементного состояния или энцефалопатии такой пациент просто не попадал в поле зрения врачей или не был своевременно диагностирован (S. Stahl, 2013).
У части же пациентов действительно может отмечаться поздняя манифестация БАР, поскольку распределение пациентов с БАР по возрасту манифестации подчиняется нормальному закону. И хотя наиболее часты манифестации БАР в подростковом, юношеском или молодом возрасте, но манифест этого заболевания, хотя и редко, может наблюдаться и в пожилом возрасте (S. Stahl, 2013).
Важно, что у таких пациентов симптомы БАР могут быть «пропущены», не замечены лечащим врачом на фоне выступающей на первый план деменции или энцефалопатии или могут быть некорректно списаны на поведенческие симптомы самой деменции или энцефалопатии. Между тем лечение коморбидного аффективного расстройства у таких пациентов с помощью НТ и/или АП-2П/АП-3П с нормотимическими свойствами приводит к выраженному улучшению (S. Stahl, 2013).
БАР 7. Подтипом БАР 7 Х. Акискал обозначил клиническую ситуацию, при которой БАР или другое расстройство биполярного спектра развивается или протекает коморбидно на фоне синдрома дефицита внимания с гиперактивностью (СДВГ) и/или расстройства аутистического спектра (РАС). Такая коморбидность на самом деле встречается часто, чаще, чем это можно было бы ожидать от простого совпадения. Ряд симптомов СДВГ, таких как гиперактивность, импульсивность, раздражительность вплоть до агрессивности, нарушения концентрации внимания, нарушения сна, сходны с симптомами, наблюдаемыми при маниакальных, гипоманиакальных и смешанных состояниях в рамках БАР. Это может затруднять диагностику и приводить к неправильному лечению – только психостимуляторами или атомоксетином, без НТ и/или АП-2П/АП-3П с нормотимическими свойствами (S. Stahl, 2013).
С другой же стороны, нарушения социального взаимодействия и неконтактность, а порой и полное отсутствие речи, свойственные пациентам с РАС, тоже осложняют для врача диагностику коморбидных состояний, в том числе и БАР. Х. Акискал особо подчеркивает, что такая ситуация встречается не только в детской и подростковой практике и что у взрослых наличие коморбидного СДВГ и/или РАС тоже может осложнять диагностику БАР (S. Stahl, 2013).
Далее Х. Акискал пишет, что подтипов расстройств биполярного спектра, по-видимому, на самом деле существует гораздо больше, чем описал он сам в этой своей предварительной классификации. Так, например, некоторые специалисты считают, что пограничное расстройство личности (ПРЛ) является на самом деле не истинным расстройством личности, а своеобразным «атипичным вариантом БАР», или же что могут существовать две внешне сходные формы ПРЛ – ПРЛ как истинное расстройство личности и ПРЛ как атипичный вариант течения БАР. В доказательство этого они приводят статистику о высокой коморбидности БАР и ПРЛ, не объяснимой просто случайным совпадением, а также то, что у многих пациентов с ПРЛ АД (особенно трициклики) усиливают импульсивность и тенденции к самоповреждению, в то время как НТ и/или АП-2П/АП-3П с нормотимическим компонентом действия приводят к выраженному улучшению состояния (S. Stahl, 2013).
Проблема гипердиагностики расстройств шизофренического спектра и недостаточной диагностики аффективных и тревожных расстройств в постсоветских странах
Согласно обнародованной совсем недавно, в 2016 г., статистике за 2013 г., диагноз БАР в России ставится в 0,008% всех случаев обращения за психиатрической помощью (Б.А. Казаковцев, 2016).
Между тем общемировая статистика свидетельствует о том, что БАР встречается в популяции с частотой около 1,2% (A. Clemente, 2015). Таким образом, расхождение между российской статистикой заболеваемости БАР и общемировой составляет ни много ни мало 150 (сто пятьдесят!) раз.
Аналогичным образом, российские статистические данные за 2010 г. свидетельствуют о том, что диагнозы из группы униполярных депрессивных расстройств непсихотического уровня (большой депрессивный эпизод без психотических симптомов, дистимия, РДР) в России выставляются лишь у 0,078% обратившихся за психиатрической помощью (Н.К. Демчева, 2012).
Общемировая же статистика дает для распространенности униполярных депрессий непсихотического уровня цифру около 4,7% в среднем, причем в Восточной Европе распространенность выше – 5,1% (A. Ferrari, 2013). Таким образом, расхождение между российской статистикой заболеваемости униполярными депрессиями и общемировой составляет 60 (шестьдесят!) раз.
Детальной статистики по разным подгруппам тревожных расстройств в России не ведется вообще. Однако из статистики за 2013 г. известно, что вся подгруппа F4x.xx – подгруппа «тревожных, невротических и связанных со стрессом расстройств» – составляла лишь 0,3% от общего числа обратившихся за психиатрической помощью (Б.А. Казаковцев, 2016).
В то же время общемировая статистика дает для распространенности всех тревожных расстройств, вместе взятых, оценку около 6,7% (Z. Steel, 2014). Таким образом, расхождение здесь составляет более 60 раз!
Для такой гиподиагностики аффективных и тревожных расстройств в России есть множество причин. Одной из них является как раз гипердиагностика шизофрении (F20.xx), ШАР (F25.xx), шизотипического расстройства (F21.xx) и других расстройств шизофренического спектра (РШС, F2x.xx). Она связана с целым рядом причин, например, с социальными причинами (диагноз из группы F2x.xx позволяет получить инвалидность легче, чем большинство других психиатрических диагнозов), с традициями психиатрического образования в России и др.
Очень часто диагнозы из этой категории выставляются, в частности, как раз пациентам с БАР, реже – с униполярными депрессиями (особенно осложнившимися синдромом деперсонализации-дереализации), обсессивно-компульсивным расстройством, некоторыми другими тревожными расстройствами, например социальным тревожным расстройством.
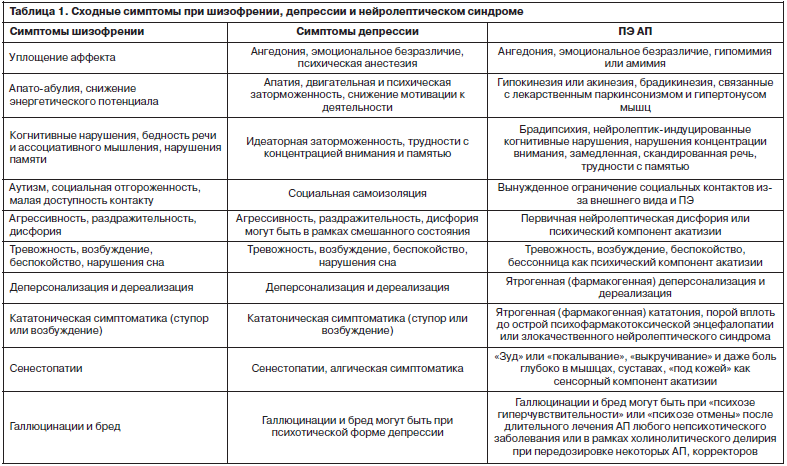
Проблема гипердиагностики шизофрении и РШС и недостаточной диагностики аффективных и тревожных расстройств в России и странах СНГ связана также и с объективными трудностями в дифференциальной диагностике шизофрении и аффективных расстройств (особенно их психотических форм), а также с тем, что побочные эффекты (ПЭ), возникающие при применении АП, вносят свой вклад в затушевывание общей картины и затруднение диагностики. Эти трудности иллюстрируются табл. 1.
Краткая история эволюции антипсихотической терапии: от I поколения АП к III поколению
Мы уже неоднократно и весьма подробно касались темы истории эволюции АП в ряде предыдущих наших статей, посвященных самым современным АП. Поэтому здесь мы не будем подробно касаться этого вопроса, чтобы не повторяться. Здесь мы лишь кратко напомним читателю о том, что АП I поколения (АП-1П), такие как галоперидол, трифлуоперазин (блокаторы преимущественно дофаминовых D2-рецепторов), эффективны в основном в отношении продуктивной (позитивной) симптоматики шизофрении и имеют весьма ограниченную эффективность в лечении негативной, когнитивной и аффективной симптоматики этой болезни. Более того, АП-1П сами могут вызывать нейролептические депрессии, вторичные нейролептик-индуцированные когнитивные нарушения, вторичную негативную симптоматику, нейролептик-индуцированный дефицитарный синдром (J. Lieberman, 1993).
Кроме того, АП-1П также плохо переносятся и часто вызывают развитие экстрапирамидного синдрома (ЭПС), в частности лекарственного паркинсонизма, острых дистоний, акатизии, поздних дискинезий, а также развитие гиперпролактинемии (D. Casey, 1996).
Именно осознание этих принципиальных ограничений терапии АП-1П побудило ученых-фармакологов к созданию и выводу на рынок АП-2П, первым из которых был рисперидон. Препараты этого класса обладают свойствами более сильных блокаторов серотониновых 5-HT2A-рецепторов, чем дофаминовых D2-рецепторов. Благодаря этому АП-2П способны одновременно понижать дофаминовую нейропередачу в мезолимбической системе, где она при шизофрении патологически усилена, и увеличивать ее в мезокортикальной системе, где она при шизофрении патологически снижена (S. Stahl, 2013, 2015, 2017).
Это клинически транслируется в то, что АП-2П имеют сопоставимую с АП-1П эффективность в купировании продуктивной (позитивной) симптоматики шизофрении и при этом значительно большую, по сравнению с АП-1П, эффективность в купировании негативной симптоматики. Кроме того, АП-2П также имеют более благоприятный профиль переносимости и значительно меньший риск вызывания ЭПС и нейролептик-индуцированного дефицитарного синдрома (H. Meltzer и соавт., 2003; S. Leucht и соавт., 2009).
Однако создание АП-2П тоже не смогло решить все проблемы, которые ставит перед врачами-практиками лечение шизофрении. Прежде всего АП-2П, такие как рисперидон, имея более высокую по сравнению с АП-1П эффективность в отношении негативной симптоматики шизофрении, все еще недостаточно эффективны в отношении трех других «проблемных» доменов – когнитивной, тревожной и депрессивной симптоматики. Показано, что для выраженного эффекта на когнитивную, тревожную и депрессивную симптоматику шизофрении необходимо наличие у препарата сильных 5-HT7-блокирующих свойств (P. Harvey и соавт., 2004; S. Stahl, 2013, 2015, 2017).
Кроме того, многие АП-2П, такие как оланзапин, кветиапин, рисперидон, обладают нежелательными H1-гистаминоблокирующими и 5-HT2C-блокирующими свойствами, которые обусловливают повышение аппетита, прибавку массы тела и метаболические нарушения (P. Haddad, 2005). Наличие у многих АП-2П выраженных H1-гистаминоблокирующих, и/или М-холиноблокирующих, и/или a1-адреноблокирующих свойств обусловливает такие их нежелательные ПЭ, как ортостатическая гипотензия и тахикардия, вегетативные нарушения, сонливость и седация, ухудшение когнитивных функций, памяти и концентрации внимания (W. Kroeze и соавт., 2003).
Все это вызвало потребность в разработке новых АП с улучшенным рецепторным профилем, в частности с сильной не только 5-HT2A-, но и 5-HT7-блокирующей активностью, и с уменьшенными нежелательными рецепторными свойствами, к которым можно отнести H1-гистаминоблокирующие, М-холиноблокирующие и a1-адреноблокирующие свойства, с улучшенным профилем эффективности и безопасности, меньшей склонностью вызывать вышеперечисленные ПЭ и с более выраженным положительным влиянием на когнитивную и аффективную сферу пациентов (W. Kroeze и соавт., 2003).
Препараты, отвечающие этим критериям, принято называть АП-3П. Одним из самых ярких представителей класса АП-3П как раз и является герой данной статьи – препарат Латуда (луразидон); S. Stahl, 2013, 2015, 2017.
Общая характеристика луразидона
Луразидон – это один из новейших представителей класса АП-3П. Изначально он был разработан японской фармацевтической компанией Dainippon Sumitomo Pharma в сотрудничестве с Merck Laboratories, Inc. (H. Zhang и соавт., 2012; M. Pompili и соавт., 2017).
В 2010 г. луразидон в таблетках с немедленным высвобождением под торговой маркой Latuda, в дозировках 20, 40, 60, 80 и 120 мг в одной таблетке, получил регистрацию Управления по контролю за продуктами и лекарствами США (FDA) для лечения шизофрении у взрослых (начиная с 18 лет). Позже этот препарат получил одобрение контролирующих органов по данному показанию также в Канаде, странах Европейского Союза, Швейцарии и Австралии (A. Loebel, L. Citrome, 2015).
С 2012 г. луразидон одобрен в нескольких странах, включая США и Канаду, также для лечения биполярной депрессии в рамках БАР 1-го типа у взрослых (начиная с 18 лет), причем как в монотерапии, так и в комбинации с литием или вальпроатом (A. Loebel, L. Citrome, 2015; P. Ruiz, 2017).
Стоит особо отметить, что луразидон стал вторым после кветиапина атипичным АП, для которого строго доказана – и утверждена в официальной инструкции FDA – эффективность именно в монотерапии при биполярной депрессии в рамках БАР 1-го типа, а также единственным атипичным АП, для которого строго доказана – и утверждена в официальной инструкции FDA – способность потенцировать НТ (литий или вальпроат) при лечении биполярной депрессии в рамках БАР 1-го типа (P. Ruiz, 2017).
Для всех остальных атипичных АП, кроме луразидона и кветиапина, например для оланзапина, на данный момент доказана лишь способность потенцировать АД (например, флуоксетин) при биполярной депрессии в рамках БАР 1-го типа, но не эффективность и возможность применения по данному показанию в монотерапии (P. Ruiz, 2017). Это отражает высокую нормотимическую, антидепрессивную и анксиолитическую активность луразидона.
Кроме того, недавно луразидон одобрен FDA также для лечения шизофрении у подростков от 13 до 17 лет включительно и для лечения биполярной депрессии в рамках БАР 1-го типа (как в монотерапии, так и в комбинациях с литием или вальпроатом) у детей и подростков от 10 до 17 лет включительно (I. Osborne и соавт., 2018).
Однако в России луразидон пока одобрен только для пациентов старше 18 лет, как при шизофрении, так и при биполярной депрессии (Регистр лекарственных средств России – РЛС, Луразидон, 2019).
Химическая структура луразидона и ее связь с рецепторным профилем
С химической точки зрения луразидон представляет собой производное бензизотиазола (T. Ishibashi и соавт., 2010). Луразидон сходен по химическому строению с такими производными бензизоксазола, как рисперидон и палиперидон, и с таким пиперидинил-бензизоксазоловым производным, как илоперидон. Однако их рецепторные профили достаточно сильно отличаются. Рецепторный профиль луразидона значительно благоприятнее рецепторного профиля всех трех упомянутых выше препаратов с точки зрения риска возникновения целого ряда ПЭ, в частности ЭПС, акатизии, повышения аппетита и прибавки массы тела, ортостатической гипотензии и тахикардии, нежелательной сонливости и седации (M. Mauri и соавт., 2014).
Определенное химическое сходство луразидон имеет также с такими производными бензил-изотиазолил-пиперазина, как зипрасидон, и с такими производными азапирона, как пероспирон, буспирон, тандоспирон. Некоторое сходство имеется и в их рецепторных профилях. В частности, все упомянутые препараты являются сильными парциальными агонистами 5-HT1A-подтипа серотониновых рецепторов. Это вносит свой вклад как в уменьшение вероятности возникновения ЭПС и акатизии при применении луразидона, так и в его антидепрессивную, анксиолитическую и прокогнитивную активность (M. Mauri и соавт., 2014).
S. Stahl сгруппировал луразидон, зипрасидон, рисперидон, палиперидон и илоперидон в подгруппу «донов», в противоположность «пинам», таким как клозапин, клотиапин, кветиапин, оланзапин, азенапин (S. Stahl, 2013, 2015, 2017).
Фармакодинамика
Подобно другим «донам», луразидон обладает высоким сродством к D2-подтипу дофаминовых рецепторов (Ki=0,994 nM). При этом луразидон обладает очень высокой селективностью именно к D2-подтипу дофаминовых рецепторов по сравнению с подтипами D1, D3 и D4 (T. Ishibashi и соавт., 2010; L. Citrome, 2011).
Считается, что низкое связывание луразидона с D1 и D4-подтипами дофаминовых рецепторов, блокада которых в префронтальной коре нежелательна и приводит к ухудшению когнитивного функционирования, лежит в основе прокогнитивного эффекта луразидона, особенно выраженного у пациентов с шизофренией. В то же время высокая селективность и высокий аффинитет луразидона к D2-подтипу дофаминовых рецепторов обусловливают его мощный антипсихотический эффект (T. Murai и соавт., 2014).
Интересно, что, несмотря на мощное D2-блокирующее действие in vivo, луразидон обладает весьма низкой способностью вызывать ЭПС и акатизию – одной из самых низких среди всех АП-2П и АП-3П, меньшей, чем у зипрасидона, оланзапина, азенапина и тем более рисперидона, и сопоставимой с «наименее экстрапирамидными» атипичными АП – илоперидоном, кветиапином (H. Zhang и соавт., 2012; S. Stahl, 2013, 2015, 2017).
Это обусловлено рядом других его рецепторных свойств. Так, в частности, луразидон обладает высоким сродством к серотониновым 5-HT2A-рецепторам (Ki=0,47 nM), 5-HT1A-рецепторам (Ki=6,38 nM) и 5-HT7-рецепторам (Ki=0,495 nM). Каждое из этих рецепторных свойств по отдельности способно уменьшать ЭПС и акатизию (T. Ishibashi и соавт., 2010; H. Zhang и соавт., 2012; S. Caccia и соавт., 2012; S. Stahl, 2013, 2015, 2017).
Среди всех АП-2П и АП-3П, известных сегодня, луразидон обладает наибольшей аффинностью к 5-HT7-подтипу серотониновых рецепторов (Ki=0,495 nM). Предполагается, что блокада этого подтипа рецепторов наряду с уменьшением ЭПС и акатизии вносит вклад также в основное антипсихотическое действие луразидона (S. Caccia и соавт., 2012; V. Risbood и соавт., 2012).
Кроме того, известно также, что блокада 5-HT7-подтипа серотониновых рецепторов ассоциируется с улучшением сна и нормализацией циркадных ритмов, улучшением памяти и когнитивного функционирования, а также с антидепрессивным, анальгетическим и анксиолитическим эффектом. Все эти эффекты действительно наблюдаются при клиническом применении луразидона (A. Meneses, 2004; M. Guscott и соавт., 2005; A. Terry и соавт., 2008; R. McIntyre и соавт., 2012; M. Mauri и соавт., 2014).
Серотониновые рецепторы подтипа 5-HT7 широко распространены в центральной нервной системе. В частности, в большом количестве они имеются в таламической и гипоталамической областях, где они участвуют в регуляции сна, циркадных ритмов и болевой чувствительности. В большом количестве они экспрессируются также в различных областях коры больших полушарий, гиппокампе и лимбической системе, ядрах шва. Там они принимают участие в процессах памяти, регуляции когнитивных функций и концентрации внимания, настроения, эмоционального состояния, уровня тревожности (A. Meneses, 2004; M. Guscott и соавт., 2005).
Кроме того, высокое сродство луразидона к 5-HT1A-подтипу серотониновых рецепторов (Ki=6,38 nM), для которых он является парциальным агонистом, также вносит свой вклад в его антидепрессивную, анксиолитическую, прокогнитивную и анти-амнестическую активность (M. Cruz, 2011).
Серотониновые рецепторы подтипа 5-HT1A также весьма широко распространены в центральной нервной системе, в частности в префронтальной коре. Сегодня известно, что парциальный агонизм к этому подтипу серотониновых рецепторов (как у луразидона или, например, арипипразола, зипрасидона), наряду с 5-HT2A-антагонизмом, способствует улучшению функции префронтальной коры у больных шизофренией, улучшению их когнитивного функционирования, уменьшению негативной симптоматики. Связано это с тем, что 5-HT1A-парциальный агонизм в мезокортикальной системе, как и 5-HT2A-антагонизм, приводит к косвенному повышению уровней дофамина и норадреналина в префронтальной коре (S. Stahl, 2013, 2015, 2017; M. Mauri и соавт., 2014).
Кроме того, парциальный агонизм к 5-HT1A и антагонизм к 5-HT2A-серотониновым рецепторам в нигростриарном и тубероинфундибулярном путях и в лимбической системе также приводит к косвенному повышению уровней дофамина в них и уменьшает ПЭ, вызванные блокадой D2-рецепторов, такие как ЭПС, акатизия, поздняя дискинезия, гиперпролактинемия, нейролептические депрессии, ангедония (S. Stahl, 2013, 2015, 2017; M. Mauri и соавт., 2014).
Среди других полезных для когнитивной функции рецепторных свойств луразидона следует отметить его высокую аффинность и антагонизм к a2С-подтипу адренорецепторов (Ki=10,8 nM) при среднем или низком аффинитете к a2A (Ki=40,7 nM) и a2B-подтипам, которые обусловливают ненужную сонливость, седацию и гипотензивный эффект при применении клонидина по сравнению с более селективным гуанфацином. Между тем клонидин и гуанфацин улучшают концентрацию внимания и уменьшают импульсивность, неусидчивость (и ради этого применяются при синдроме дефицита внимания) именно благодаря своему агонистическому взаимодействию с a2С-подтипом адренорецепторов префронтальной коры (H. Zhang и соавт., 2012; S. Caccia и соавт., 2012).
С другой же стороны, антагонизм луразидона к пресинаптическим ауторегуляторным и гетерорегуляторным a2С-адренорецепторам в условиях достаточно высокой концентрации норадреналина в синапсе де-факто означает функциональный антагонизм к ним и снимает «пресинаптический норадренергический тормоз». Это вызывает увеличение высвобождения нейромедиаторов в синапс, подобно тому, как это происходит при воздействии таких антагонистов a2С-адренорецепторов, как миртазапин, миансерин. Это тоже привносит свой вклад в общее антидепрессивное действие луразидона (H. Zhang и соавт., 2012; S. Caccia и соавт., 2012).
В то же время луразидон имеет низкое или очень низкое связывание с такими «нежелательными» рецепторными мишенями, как H1-гистаминовые рецепторы, 5-HT2C-серотониновые рецепторы, М-холинергические и a1-адренорецепторы. Это транслируется в низкую вероятность развития при лечении им таких ПЭ, как чрезмерная сонливость и седация, ортостатическая гипотензия и тахикардия, повышение аппетита, прибавка массы тела, метаболические нарушения, М-холинергические ПЭ: парез аккомодации глаз, запоры, задержка мочи, сухость во рту, нарушения памяти и когнитивных функций (T. Ishibashi и соавт., 2010; S. Caccia и соавт., 2012; H. Zhang и соавт., 2012; R. McIntyre и соавт., 2012; M. Mauri и соавт., 2014).
Такой рецепторный профиль луразидона заставил ряд авторов предположить, что луразидон может быть особенно эффективным в устранении когнитивной симптоматики шизофрении по сравнению с другими АП-2П и АП-3П. К таким выводам авторов подтолкнуло сочетание нескольких фактов, а именно (T. Ishibashi и соавт., 2010):
1. В отличие от большинства других АП-2П и АП-3П, луразидон не обладает клинически значимой антагонистической активностью в отношении H1-гистаминовых, М-холинергических или a1-адренорецепторов, блокада которых негативно влияет на память, концентрацию внимания и обучаемость, и вызывает ненужную седацию и сонливость, ортостатическую гипотензию и ухудшение кровоснабжения центральной нервной системы.
2. Луразидон обладает самым высоким среди всех АП-2П и АП-3П сродством к 5-HT7-серотониновым рецепторам (блокада которых прокогнитивна), а также высоким сродством к ряду других рецепторов, блокада или парциальный агонизм к которым улучшают когнитивную функцию, концентрацию внимания, память и обучаемость, а именно – 5-HT1A, 5-HT2A, a2C.
3. Благодаря очень низкому (сопоставимому с «наименее экстрапирамидными» среди всех АП-2П и АП-3П илоперидоном, кветиапином) потенциалу вызывания ЭПС и акатизии, луразидон обычно не нуждается в одновременном назначении антихолинергических корректоров типа тригексифенидила или биперидена, которые негативно влияют на когнитивную функцию.
Фармакокинетика
Луразидон быстро всасывается из желудочно-кишечного тракта (ЖКТ) после приема внутрь. Время достижения его пиковой концентрации в плазме крови (Cmax) варьирует от 1 до 3 ч [Latuda (lurasidone HCl), 2010; R. McIntyre и соавт., 2012].
Так же, как и в случае близкого по химическому строению зипрасидона, всасывание луразидона в ЖКТ улучшается при одновременном его приеме с пищей, особенно – с пищей, богатой жирами. Поэтому инструкция по применению луразидона предписывает обязательный одновременный прием его с порцией пищи, содержащей не менее 350 ккал [Latuda (lurasidone HCl), 2010; L. Citrome, 2011; McIntyre RS и соавт., 2012; V. Risbood и соавт., 2012].
Показано, что при одновременном приеме луразидона с пищей суммарная экспозиция луразидона (площадь под кривой его концентрации в плазме – AUC) увеличивается почти в 2 раза, а Cmax увеличивается в 3 раза. В то же время достижение Cmax при приеме луразидона с пищей замедляется – время достижения Cmax отсрочивается на 0,5–1,5 ч (L. Citrome, 2011).
Всасывание луразидона в ЖКТ дозозависимо. Однако во всем диапазоне его официально утвержденных для клинического применения доз (от 20 до 160 мг/сут) оно подчиняется линейному закону. Как суммарная экспозиция луразидона (AUC), так и Cmax в этом диапазоне доз линейно увеличиваются пропорционально увеличению суточной дозы [Latuda (lurasidone HCl), 2010].
Луразидон имеет достаточно большой период полувыведения (T1/2). Это позволяет принимать его один раз в сутки, что повышает удобство терапии и комплаентность больных, снижает риск случайных забываний и пропусков в приеме препарата. В связи с его выраженными 5-HT7-блокирующими свойствами, обеспечивающими улучшение сна и нормализацию циркадных ритмов, обычно рекомендуется принимать его вечером, во время ужина (S. Stahl, 2013, 2015, 2017).
У здоровых добровольцев начальное значение T1/2 при однократном приеме 120 мг/сут луразидона составляет от 12,2 до 18,3 ч. После 9 дней постоянного приема средний конечный T1/2 луразидона у здоровых добровольцев удлинился до 36 ч. Средний T1/2 луразидона у пациентов с шизофренией при разовых дозах от 120 до 160 мг/сут, типичных для острой фазы этого заболевания, составляет от 28,8 до 37,4 ч (J. Meyer и соавт., 2009).
Как и для любого другого препарата с линейной фармакокинетикой, для луразидона справедливо правило «пяти T1/2» – равновесная стационарная концентрация луразидона в плазме крови достигается примерно через 5 его конечных T1/2, т.е. примерно через 7 сут постоянного приема препарата [Latuda (lurasidone HCl), 2010].
После всасывания из ЖКТ луразидон быстро распределяется в тканях. Благодаря своей высокой липофильности луразидон легко преодолевает гематоэнцефалический барьер (S. Caccia и соавт., 2012).
Луразидон сильно связывается с белками плазмы крови (99,8%), в первую очередь с альбумином и с кислым a1-гликопротеином (J. Meyer и соавт., 2009; L. Citrome, 2011).
Исследования с меченым луразидоном показывают дозозависимое увеличение процента занятости D2-дофаминовых рецепторов в дозах до 60 мг/сут у здоровых добровольцев (до 77,4–84,3%). Однако при дозах 80 мг/сут и выше у здоровых добровольцев дальнейшего увеличения процента занятости дофаминовых D2-рецепторов не происходит. В то же время у больных шизофренией в остром психотическом состоянии при дозах луразидона вплоть до 160 мг/сут отмечается дальнейшее увеличение процента занятости D2-дофаминовых рецепторов. Это и обусловило выбор диапазона доз луразидона для клинического применения (L. Citrome, 2011).
Луразидон метаболизируется в печени главным образом при участии изофермента P450 CYP3A4. При этом образуется три активных и два неактивных метаболита. Основной активный метаболит луразидона ID-14283 (8-гидрокси-луразидон) быстро обнаруживается в плазме крови после приема луразидона. При этом его Cmax составляет в среднем 26% от введенной дозы луразидона. Этот метаболит имеет сходный с родительским соединением (луразидоном) рецепторный и клинико-фармакологический профиль, но более короткий T1/2 (от 7,4 до 10 ч), чем сам луразидон. Предполагается, что ID-14283 вносит существенный вклад в общее действие луразидона (V. Risbood и соавт., 2012).
Другие два активных метаболита луразидона – так называемые ID-14326 и ID-11614 – присутствуют в плазме крови в крайне низких концентрациях – в среднем 3% и 1% от введенной дозы луразидона соответственно. Поэтому они вряд ли могут вносить какой-либо клинически значимый вклад в общее действие луразидона (J. Meyer и соавт., 2009).
Благодаря своей высокой липофильности луразидон легко преодолевает маточно-плацентарный барьер, а также легко проникает в грудное молоко кормящих матерей (FDA, 2010).
После приема внутрь меченного радиоактивным изотопом луразидона около 67% всей введенной дозы луразидона выводится через кишечник с калом и около 19% – почками с мочой, главным образом в виде метаболитов. Почечная экскреция исходного соединения минимальна (РЛС, Луразидон, 2019).
Взаимодействие с другими препаратами
Поскольку луразидон метаболизируется при участии изофермента цитохрома P450 CYP3A4, то его применение совместно с сильными ингибиторами изофермента P450 CYP3A4 (например, с боцепревиром, кларитромицином, эритромицином, дилтиаземом, кобицистатом, индинавиром, итраконазолом, кетоконазолом, нефазодоном, нелфинавиром, позаконазолом, ритонавиром, саквинавиром, телапревиром, телитромицином, вориконазолом), согласно инструкции, строго противопоказано (J. Meyer и соавт., 2009; S. Caccia и соавт., 2012; РЛС, Луразидон, 2019).
Показано, что мощные ингибиторы CYP3A4, такие как дилтиазем, кетоконазол или эритромицин, у здоровых добровольцев весьма значительно увеличивают Cmax и AUC луразидона и его основного активного метаболита ID-14283. Это может привести к усилению ПЭ луразидона и даже к проявлениям токсичности, поэтому такие сочетания строго противопоказаны (S. Caccia и соавт., 2012; РЛС, Луразидон, 2019).
В то же время мощные индукторы CYP3A4, такие как карбамазепин, фенобарбитал, фенитоин, рифампицин, препараты зверобоя продырявленного, значительно снижают Cmax луразидона в плазме крови и его AUC. Это может привести к снижению и даже утрате его лечебного эффекта. Так, одновременный прием 40 мг/сут луразидона и 600 мг/сут рифампицина приводит к снижению Cmax и AUC луразидона в среднем на 85% у здоровых добровольцев по сравнению с не принимающими рифампицин. Поэтому совместное применение луразидона с мощными индукторами изофермента CYP3A4, согласно инструкции, также противопоказано (S. Caccia и соавт., 2012; РЛС, Луразидон, 2019).
Поскольку луразидон метаболизируется без участия изофермента P450 CYP2D6, то совместное применение луразидона с сильными ингибиторами CYP2D6, такими как флуоксетин, пароксетин или хинидин, достаточно безопасно и не требует коррекции дозы луразидона [Latuda (lurasidone HCl), 2010].
Луразидон является субстратом P-гликопротеина (белка P-gp) и BCRP (белка резистентности рака молочной железы) in vitro. Однако клиническая значимость этого его свойства in vivo не установлена. Одновременное применение луразидона с мощными ингибиторами P-gp или BCRP, такими как верапамил, циклоспорин, пероральные контрацептивы, мидазолам, омепразол или литий, потенциально может увеличивать экспозицию луразидона (его AUC); РЛС, Луразидон, 2019.
Можно применять луразидон в комбинации с дигоксином (субстратом P-gp с узким терапевтическим диапазоном), так как при одновременном их применении экспозиция дигоксина (его AUC) не увеличивалась, и только незначительно (в 1,3 раза) увеличивалась Cmax дигоксина (РЛС, Луразидон, 2019).
Луразидон in vitro является ингибитором эффлюксного транспортера P-gp. Поэтому нельзя исключить клиническую значимость ингибирования луразидоном P-gp в кишечнике. Одновременное с луразидоном применение субстрата P-gp дабигатрана этексилата может привести к повышению концентрации дабигатрана в крови (РЛС, Луразидон, 2019).
Поскольку луразидон сильно связывается с белками плазмы крови (на 99,8%), особенно с альбумином и кислым a1-гликопротеином, следует с осторожностью применять его у пациентов с гипопротеинемией или гипоальбуминемией, например у пожилых пациентов, пациентов с белковым недоеданием, ожоговых больных, больных с циррозом печени и др. Следует также учитывать возможность вытеснения луразидоном из связей с белками плазмы крови других сильно связывающихся с белками препаратов, таких как варфарин, ацетилсалициловая кислота и др., особенно при гипопротеинемии или гипоальбуминемии [Latuda (lurasidone HCl), 2010; J. Meyer и соавт., 2009].
Режим дозирования
У взрослых пациентов с шизофренией рекомендуемая начальная доза луразидона составляет 40 мг/сут однократно внутрь, с приемом пищи, содержащим не менее 350 ккал (обычно с ужином, поскольку луразидон благодаря своим 5-HT7-блокирующим свойствам улучшает сон и способствует нормализации циркадных ритмов, хотя и не вызывает чрезмерной сонливости); M. Cruz, 2011; S. Stahl, 2013, 2015, 2017.
Поскольку луразидон обычно хорошо переносится и не обладает способностью вызывать такие проблематичные ПЭ первых дней, как избыточная сонливость и седация, ортостатическая гипотензия и тахикардия, то наращивание его дозы, начиная с субтерапевтической или с минимальной терапевтической (как, например, у кветиапина или у илоперидона), обычно не требуется. Любая из разрешенных к применению терапевтических доз луразидона (40, 60, 80, 120 и даже 160 мг/сут) при необходимости и на усмотрение врача может быть назначена с первых дней лечения. Это является важным преимуществом луразидона при лечении острых состояний, в случаях, когда не требуется инъекционное введение АП (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
Как и для любого другого АП, оценка эффективности терапии луразидоном и достаточности его дозы должна производиться не ранее 4–6–8 нед терапии. Наиболее распространенная дозировка луразидона, по опыту его клинического применения в США и странах Европейского Союза, составляет 80 или 120 мг/сут при острой шизофрении (в некоторых случаях – до 160 мг/сут) и от 20 до 60 мг/сут при биполярной депрессии (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
У пациентов с почечной недостаточностью умеренной или тяжелой степени (с клиренсом креатинина от 10 до 50 мл/мин) и у пациентов с печеночной недостаточностью умеренной или тяжелой степени не рекомендуется превышать дозу луразидона 40 мг/сут (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
Пациентам пожилого и старческого возраста с сохранной функцией печени и почек корректировка дозы луразидона вниз обычно не требуется (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
Противопоказания и меры предосторожности
Луразидон нельзя использовать у пациентов с аллергией или индивидуальной повышенной чувствительностью к нему. С осторожностью следует использовать луразидон у пациентов с известной аллергией к другим «донам» (рисперидон, палиперидон, илоперидон, зипрасидон) или к азапиронам (буспирон, пероспирон, тандоспирон и др.), поскольку аллергия может быть перекрестной на все бензизотиазолы и бензизоксазолы, азапироны или даже на все «доны» сходного химического строения (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
Нельзя использовать луразидон у пациентов, получающих сильные ингибиторы CYP3A4 (боцепревир, кларитромицин, эритромицин, дилтиазем, кобицистат, индинавир, итраконазол, кетоконазол, нефазодон, нелфинавир, позаконазол, ритонавир, саквинавир, телапревир, телитромицин, вориконазол и др.) или сильные индукторы CYP3A4 (карбамазепин, фенобарбитал, фенитоин, рифампицин, препараты зверобоя продырявленного). Подобно всем другим АП, луразидон следует с осторожностью использовать у пожилых пациентов с деменцией и с психозом или поведенческими нарушениями на фоне деменции, так как луразидон, подобно всем другим АП, сокращает ожидаемую продолжительность жизни и повышает риск преждевременной смертности в этой категории больных (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
Несмотря на то, что, по данным исследований, луразидон имеет низкий риск развития ЭПС и акатизии, его, как и большинство других АП, следует с осторожностью применять у пациентов с болезнью Паркинсона или с деменцией телец Леви и с психозом на фоне этих заболеваний. У пациентов с этими заболеваниями повышена чувствительность к экстрапирамидным ПЭ при применении АП и повышен риск усиления симптомов паркинсонизма, вплоть до развития акинетического криза или злокачественного нейролептического синдрома на фоне применения АП. Поэтому препарат Латуда (луразидон) можно применять у пациентов с болезнью Паркинсона или деменцией телец Леви и с психозом на фоне этих заболеваний только в тех случаях, когда потенциальная польза от его применения превышает возможный риск для пациента (РЛС, Луразидон, 2019).
Несмотря на то, что луразидон обладает достаточно слабыми a1-адреноблокирующими свойствами и редко вызывает ортостатическую гипотензию, следует мониторить и профилактировать состояния, способные вызвать или предрасположить пациентов к ней (например, обезвоживание, гипонатриемию, гипокалиемию). Это особенно важно у пожилых пациентов, и особенно – у пожилых пациентов с деменцией, у которых прием пищи и воды часто неадекватен по количеству и качеству (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
ПЭ и переносимость
Луразидон, как АП-3П, специально синтезированный в расчете на лучшую переносимость, связанную с его улучшенным рецепторным профилем, обычно хорошо переносится и имеет мало ПЭ, особенно по сравнению с АП-1П и АП-2П (M. Cruz, 2011; S. Stahl, 2013, 2015, 2017).
Наиболее частыми ПЭ, зарегистрированными в период клинических испытаний луразидона, были сонливость и седация (частота сопоставима с таковой у зипрасидона и ниже, чем у рисперидона, оланзапина и кветиапина), акатизия и лекарственный паркинсонизм (частота сопоставима с таковой у илоперидона и кветиапина и значительно ниже, чем у рисперидона, ниже, чем у оланзапина), тошнота, ажитация (вероятно, связанная с акатизией); M. Cruz, 2011.
В отличие от некоторых других АП-2П и АП-3П, луразидон не вызывает клинически значимых изменений интервала QT на электрокардиограмме. Так, например, сопоставление кардиологической безопасности луразидона с оланзапином и плацебо, проведенное в 2011 г. H. Meltzer и соавт., показало, что среднее удлинение интервала QT при приеме луразидона в дозах 40 и 80 мг/сут составляет +4,5 мс и +5,1 мс соответственно. Это сопоставимо со средним удлинением интервала QT при приеме плацебо (+3,8 мс) или 10 мг/сут оланзапина (+4,4 мс); H. Meltzer и соавт., 2011.
Высокая степень кардиологической безопасности луразидона подтверждена также в долгосрочных клинических исследованиях. Не было сообщений о каких-либо клинически значимых изменениях на электрокардиограмме или о клинически значимом удлинении интервала QT при длительном, многолетнем приеме луразидона (L. Citrome и соавт., 2012; A. Loebel и соавт., 2013).
Луразидон, как и другие АП, благодаря своему основному дофаминергическому действию имеет потенциал для повышения уровня пролактина в крови. Однако этот потенциал для вызывания выраженной гиперпролактинемии намного ниже, чем у АП-1П (например, галоперидола) или у такого АП-2П, как рисперидон (J. Cucchiaro и соавт., 2010; M. Ehret и соавт., 2010; S. Caccia и соавт., 2012).
Предсказанный заранее на основании рецепторного профиля луразидона его благоприятный профиль метаболического действия подтвердился клинически. Так, ни в долгосрочных, ни в краткосрочных клинических исследованиях не было обнаружено повышения общего уровня холестерина, «плохого» холестерина (холестерина липопротеидов низкой плотности), атерогенного индекса или уровня триглицеридов в плазме крови (J. Cucchiaro и соавт., 2010; L. Samalin и соавт., 2011).
Более того, луразидон, по-видимому, даже более благоприятно влияет на липидный профиль крови, чем близкий по химическому строению зипрасидон, считавшийся одним из наиболее метаболически безопасных среди АП-2П до появления луразидона. Так, в исследовании S. Potkin и соавт. от 2011 г. было показано, что лечение луразидоном приводит к снижению уровня триглицеридов в плазме крови в среднем на -2,6 мг/дл, в то время как лечение зипрасидоном привело, напротив, к повышению уровня триглицеридов в плазме в среднем на +22,4 мг/дл (S. Potkin и соавт., 2011).
Благоприятный рецепторный и метаболический профиль луразидона транслируется также в то, что он оказывает минимальное воздействие на массу тела у пациентов с шизофренией (сопоставимое или даже лучшее по сравнению с такими «метаболически благоприятными» препаратами, как арипипразол, зипрасидон). Так, в краткосрочных рандомизированных клинических исследованиях (РКИ) сообщалось о том, что среднее увеличение массы тела у пациентов, получавших луразидон, составило всего +0,75 кг по сравнению с +0,26 кг в среднем у пациентов, получавших плацебо (L. Samalin и соавт., 2011; S. Caccia и соавт., 2012).
S. Stahl предлагает рассматривать перевод на луразидон в качестве одного из наиболее предпочтительных вариантов у пациентов, дающих выраженную прибавку массы тела или метаболические нарушения при приеме других АП (S. Stahl, 2013, 2015, 2017).
Мы уже упоминали о том, что луразидон обладает одним из самых низких среди всех АП-2П и АП-3П экстрапирамидным потенциалом, сопоставимым с таковым у наилучших по этому параметру илоперидона, кветиапина, и лучшим, чем, например, у оланзапина, азенапина, зипрасидона, не говоря уже о рисперидоне и АП-1П. Тем не менее экстрапирамидная симптоматика при назначении луразидона регистрируется достоверно чаще, чем при назначении плацебо – 14,7% в группе луразидона против 5,1% в группе плацебо (L. Samalin и соавт., 2011).
Так, в частности, акатизия достоверно чаще регистрировалась в группе луразидона (15%) по сравнению с группой плацебо (3,3%). Но эта частота все равно ниже, чем частота регистрации акатизии у ряда других АП-2П и АП-3П, например у арипипразола, рисперидона, брекспипразола (L. Samalin и соавт., 2011).
В связи с низким экстрапирамидным потенциалом луразидона S. Stahl предлагает рассматривать его как одну из предпочтительных опций у пациентов с плохой переносимостью экстрапирамидных ПЭ при приеме других АП (S. Stahl, 2013, 2015, 2017).
Доказательная база для применения луразидона в психиатрии Шизофрения
Острая (купирующая) терапия. Как и любой другой АП, луразидон изначально исследовался в первую очередь в качестве средства для лечения шизофрении. Основанием для его регистрации FDA в качестве препарата для купирующего лечения шизофрении стали результаты пяти двойных слепых плацебо-контролируемых РКИ, каждое длительностью 6 нед. Во всех этих РКИ были показаны высокая эффективность и безопасность применения луразидона в дозах от 40 до 160 мг/сут в качестве средства купирующей терапии шизофрении (M. Nakamura и соавт., 2009; H. Meltzer и соавт., 2011; M. Ogasa и соавт., 2013; H. Nasrallah и соавт., 2013; A. Loebel и соавт., 2013).
Как уже упоминалось нами ранее, наиболее типичными средними дозами луразидона при острой шизофрении являются 80 или 120 мг/сут (иногда до 160 мг/сут). Поскольку луразидон хорошо переносится и не требует титрования начальной дозы, то рекомендуется начинать лечение острой шизофрении сразу со средних доз (80 или 120 мг/сут). Оценку клинической эффективности назначенной дозы, как и в случае любых других АП, рекомендуется проводить не ранее 4–6–8 нед. При необходимости быстрого увеличения дозы (например, у островозбужденных, агрессивных пациентов) целесообразно это делать с шагом 40 мг/сут еженедельно с еженедельной оценкой эффективности очередного повышения и достаточности дозы луразидона. В некоторых наиболее острых случаях допустимо начинать лечение сразу с дозы 160 мг/сут (S. Stahl, 2013, 2015, 2017).
В 6-недельном двойном слепом плацебо-контролируемом РКИ по изучению эффективности и безопасности луразидона (в дозах 40, 80 и 120 мг/сут) при острой купирующей терапии шизофрении у взрослых, проведенном в 2013 г., показано, что применение луразидона приводит к быстрому и эффективному купированию как продуктивной, так и негативной симптоматики шизофрении (H. Nasrallah и соавт., 2013).
В 2015 году та же группа авторов опубликовали анализ комбинированного пула данных из 4 РКИ, в котором показала, что луразидон эффективен также в уменьшении депрессивной симптоматики при острой шизофрении, измеренной по шкале MADRS (H. Nasrallah и соавт., 2015).
Луразидон также эффективен и безопасен при краткосрочном купирующем лечении шизофрении у подростков от 13 до 17 лет включительно. Так, в двойном слепом плацебо-контролируемом РКИ от 2017 г. луразидон в дозах 40 и 80 мг/сут показал статистически достоверное и клинически значимое улучшение как позитивной (продуктивной), так и негативной, когнитивной и аффективной симптоматики шизофрении по шкале PANSS по сравнению с плацебо у подростков данной возрастной категории (R. Goldman и соавт., 2017).
Луразидон в целом хорошо переносится и имеет минимальное или малое влияние на аппетит, массу тела и метаболические параметры. Это особенно важно при лечении подростков в связи с их эндокринной неустойчивостью и особой повышенной чувствительностью к метаболическим ПЭ при применении различных АП (R. Goldman и соавт., 2017).
Поддерживающая (противорецидивная) терапия. Долгосрочная противорецидивная эффективность луразидона при шизофрении, а также его долгосрочная безопасность у этих пациентов при приеме на протяжении по крайней мере 28 нед поддерживающей терапии были надежно установлены в крупном двойном слепом плацебо-контролируемом РКИ, результаты которого были опубликованы в 2016 г. (R. Tandon и соавт., 2016).
В это исследование вошли 285 пациентов, которые были предварительно стабилизированы на луразидоне в течение по крайней мере 12 нед. Из них 144 пациента были рандомизированы к получению луразидона в качестве поддерживающей терапии и 141 пациент – к получению плацебо на протяжении еще 28 нед. При этом было показано, что поддерживающая терапия луразидоном значительно (на 33,7%) снижает риск рецидива шизофрении (p=0,041) по сравнению с плацебо (R. Tandon и соавт., 2016).
Важно, что в период как острой, так и поддерживающей терапии луразидоном авторы отметили минимальное его влияние на аппетит, массу тела, липидный и гликемический профиль, уровень пролактина в крови у пациентов (R. Tandon и соавт., 2016).
В другом двойном слепом сравнительном РКИ от 2013 г. по изучению эффективности и безопасности луразидона в длительной поддерживающей терапии шизофрении его противорецидивную активность (в дозах от 40 до 160 мг/сут) сравнивали с таковой у пролонгированной формы кветиапина (в дозах от 200 до 800 мг/сут) на протяжении 12 мес (A. Loebel и соавт., 2013).
Авторами этого РКИ было показано статистически достоверное (p=0,049) преимущество луразидона над кветиапином по такому параметру, как вероятность госпитализации с обострением или рецидивом шизофрении за время исследования (9,8% в группе луразидона против 23,1% в группе кветиапина, т.е. уменьшение риска госпитализации на 56,7% по сравнению с кветиапином). Кроме того, в группе кветиапина обострения или рецидивы симптоматики не только встречались чаще, но и протекали тяжелее. Общая вероятность рецидива на протяжении 12 мес составила 23,7% в группе луразидона и 33,6% в группе кветиапина. Это привело авторов к выводу, что в свете высокой стоимости госпитализаций при шизофрении применение луразидона может привести к значительному положительному экономическому эффекту в сравнении с применением кветиапина (A. Loebel и соавт., 2013).
Кроме того, в группе луразидона ремиссии отмечались чаще и были более качественными, чем в группе кветиапина (61,9% против 46,3%, p=0,043). Это, в частности, выразилось в значительно большей редукции как общего балла шкалы PANSS, так и баллов по ее подшкале позитивной симптоматики в группе луразидона по сравнению с кветиапином (A. Loebel и соавт., 2013).
Луразидон также оказался значительно эффективнее кветиапина в купировании депрессивной симптоматики шизофрении, что выразилось в более существенной редукции среднего балла по шкале MADRS в группе луразидона по сравнению с группой кветиапина – -6,0 в группе луразидона против -3,8 в группе кветиапина; p<0,05 (A. Loebel и соавт., 2013).
При терапии луразидоном чаще отмечались легкие ЭПС, акатизия, головная боль, бессонница, ажитация, в то время как при терапии кветиапином чаще отмечались сонливость и седация, ортостатическая гипотензия и тахикардия, повышение аппетита, прибавка массы тела, ухудшение метаболических показателей, приступы головокружения. Общая переносимость и частота ПЭ и отказов от лечения у обоих препаратов была сопоставима (A. Loebel и соавт., 2013).
В еще одном двойном слепом сравнительном РКИ от 2012 г. изучали в основном вопросы переносимости и безопасности луразидона (40–120 мг/сут, 427 пациентов) в сопоставлении с рисперидоном (2–6 мг/сут, 202 пациента) при длительной, 12-месячной, поддерживающей терапии шизофрении. Вопросы противорецидивной эффективности для этого РКИ были второстепенными. Тем не менее в этом РКИ было показано, что луразидон обладает сопоставимой с рисперидоном эффективностью; процент рецидивов и обострений в обеих группах был низким. Также были показаны хорошая безопасность и переносимость луразидона при длительной поддерживающей терапии шизофрении. Так, в частности, в группе рисперидона статистически достоверно чаще, чем в группе луразидона, отмечалась прибавка массы тела более 7% от исходной (14% в группе рисперидона против 7% в группе луразидона). Среднее увеличение уровня пролактина в крови также было значительно больше в группе рисперидона по сравнению с луразидоном; p<0,001 (L. Citrome и соавт., 2012).
Биполярные депрессии в рамках БАР 1-го типа
Острая купирующая терапия. В 2014 г. были опубликованы результаты 6-недельного двойного слепого плацебо-контролируемого РКИ по изучению эффективности и безопасности применения луразидона в монотерапии в лечении острой биполярной депрессии. В этом РКИ приняли участие 505 пациентов с диагнозом БАР 1-го типа и текущим депрессивным эпизодом. Все они были рандомизированы к получению либо низких доз луразидона, от 20 до 60 мг/сут (166 человек), либо высоких доз луразидона, от 80 до 120 мг/сут (169 человек), либо плацебо (170 человек) на протяжении 6 нед (A. Loebel и соавт., 2014, a).
При этом было показано, что в обоих дозовых режимах (как в низких дозах, так и в высоких) луразидон гораздо эффективнее плацебо в купирующем лечении острой биполярной депрессии в рамках БАР 1-го типа. В обоих дозовых режимах луразидон показал себя как безопасный и хорошо переносимый препарат. Важно, что применение луразидона привело не только к быстрому (начиная со 2-й недели, с усилением эффекта к сроку 4–6 нед) купированию собственно депрессивной симптоматики по шкале MADRS у пациентов с БАР, но и к глубокой редукции коморбидной тревоги по шкале HAM-A, к значительному улучшению когнитивного функционирования депрессивных больных и к улучшению их общего качества жизни и удовлетворенности терапией (A. Loebel и соавт., 2014, a).
В другом, также 6-недельном двойном слепом плацебо-контролируемом РКИ от 2014 г., проведенном этим же авторским коллективом, изучали эффективность и безопасность луразидона в купирующем лечении острой биполярной депрессии в рамках БАР 1-го типа не в монотерапии, а при добавлении к НТ (литию или вальпроату). При этом авторами было показано, что добавление луразидона к НТ гораздо эффективнее добавления плацебо к НТ при купирующем лечении острой биполярной депрессии в рамках БАР 1-го типа. Опять-таки, применение луразидона и в этом РКИ ассоциировалось не только с быстрым снижением выраженности депрессивной симптоматики по шкале MADRS, начиная со 2-й недели терапии, развертывавшимся к 4–6-й неделям терапии, но и с быстрой и глубокой редукцией сопутствующей тревоги по шкале HAM-A, с улучшением когнитивного функционирования, повышением общего качества жизни пациентов и их удовлетворенности лечением (A. Loebel и соавт., 2014, b).
В этом РКИ также было показано, что добавление луразидона к любому из двух НТ (литию или вальпроату) безопасно и хорошо переносится при купирующем лечении острой биполярной депрессии. Авторы особо отметили минимальное влияние луразидона на аппетит и массу тела, липидный профиль крови и гликемические показатели (A. Loebel и соавт., 2014, b).
Важно отметить, что уровень инверсии знака фазы в манию, гипоманию или в смешанное состояние был низким, сопоставимым с таковым у плацебо, в обоих дозовых режимах луразидона, как при монотерапии (в группе луразидона 20–60 мг/сут – 3,7%, в группах луразидона 80–120 мг/сут и плацебо – по 1,9%), так и в сочетании с литием или вальпроатами (1,1% в группе луразидона, 1,2% в группе плацебо);A. Loebel и соавт., 2014,a, b.
Это позволяет говорить о том, что луразидон значительно безопаснее АД при лечении биполярных депрессий, так как риск инверсии фазы ассоциируется с риском долгосрочного ухудшения течения БАР (S. Stahl, 2013).
Описана также эффективность луразидона в комбинации с НТ, обладающими собственным антидепрессивным действием (ламотриджин и/или литий) и/или с АД при лечении терапевтически резистентных форм биполярных депрессий (C. Schaffer и соавт., 2016).
Профилактическое противорецидивное лечение. В нескольких двойных слепых плацебо-контролируемых РКИ было убедительно доказано, что луразидон обладает не только острой купирующей (антидепрессивной), но и профилактической противорецидивной (нормотимической) активностью в отношении депрессивных фаз при БАР 1-го типа, и что он безопасен и хорошо переносится при длительном поддерживающем лечении БАР 1-го типа, причем как в монотерапии, так и в комбинациях с НТ – литием или вальпроатом (A. Pikalov и соавт., 2017).
Так, в одном двойном слепом плацебо-контролируемом РКИ, результаты которого были опубликованы в 2017 г., изучали эффективность и безопасность длительного (в течение 2 лет) профилактического лечения луразидоном в дозах от 20 до 120 мг/сут при БАР 1-го типа. Авторами этого РКИ было показано, что применение луразидона при БАР 1-го типа ассоциируется со снижением частоты рецидивов депрессии, а также с улучшением общего клинического впечатления по шкале CGI (A. Pikalov и соавт., 2017).
Важно, что, несмотря на длительность лечения (в данном исследовании – 2 года), луразидон у этой категории пациентов хорошо переносился. В частности, он оказывал минимальное влияние на аппетит, массу тела и метаболические показатели пациентов (A. Pikalov и соавт., 2017).
Особый интерес вызывает изучение вопроса об эффективности, безопасности и переносимости длительной поддерживающей терапии луразидоном у пациентов с БАР пожилого и старческого возраста. В 2018 г. был опубликован ретроспективный анализ, в котором было показано, что 6-месячное поддерживающее лечение луразидоном после 6-недельного острого купирующего лечения биполярной депрессии у пациентов пожилого и старческого возраста не только эффективно снижает частоту рецидивов эпизодов БАР обоих знаков, но также безопасно и хорошо переносится. Луразидон у пациентов пожилого и старческого возраста тоже ассоциировался с минимальным влиянием на аппетит, массу тела и метаболические параметры (B. Forester и соавт., 2018).
Униполярные депрессии
Многие АП обладают доказанной способностью потенцировать действие АД и применяются в этих целях при униполярных терапевтически резистентных депрессиях. У некоторых АП, например кветиапина, оланзапина, арипипразола, даже имеется регистрация FDA по этому показанию (S. Stahl, 2013, 2015, 2017).
Однако до недавнего времени только у кветиапина имелась доказательная база для его применения в монотерапии при униполярных депрессиях (для всех остальных АП – только в качестве потенцирующих агентов к АД); S. Stahl, 2013, 2015, 2017.
Луразидон пока широко не изучался при «чистой» униполярной депрессии (ни в монотерапии, ни в качестве потенцирующего агента к АД). Однако существует достаточно много исследований, посвященных изучению эффективности луразидона при «смешанных депрессиях» (major depressive disorder with mixed features, в терминах DSM-5). Это, например, депрессии, протекающие с выраженной раздражительностью, ажитацией, тревогой, бессонницей или со «скачкой идей» вместо идеаторной заторможенности (S. Stahl, 2013).
Как мы уже указывали выше, таким пациентам формально нельзя поставить БАР 2-го типа даже по DSM-5 (где критерии БАР 2-го типа были расширены и смягчены по сравнению с DSM-IV-TR), если у них не бывает гипоманий. Однако Х. Акискал, как мы уже упоминали, относит таких пациентов к биполярному спектру и называет этот подтип БАР 5 (S. Stahl, 2013).
В частности, одним из таких исследований, посвященных изучению эффективности луразидона при униполярных «смешанных депрессиях» и при депрессиях с выраженной тревогой, является опубликованный в 2017 г. post-hoc-анализ результатов 6-недельного двойного слепого плацебо-контролируемого РКИ от 2017 г. В нем изучались эффективность и безопасность применения низких доз луразидона (от 20 до 60 мг/сут) в качестве монотерапии при данных разновидностях депрессий (J. Tsai и соавт., 2017).
В данном РКИ приняли участие 209 пациентов. Из них 109 человек были рандомизированы в группу луразидона, а 100 пациентов получали плацебо. Авторы этого РКИ сумели показать, что луразидон в монотерапии в дозах от 20 до 60 мг/сут гораздо эффективнее плацебо при лечении «смешанных депрессий» и депрессий с выраженной тревогой и при этом безопасен и хорошо переносится. Применение луразидона для лечения этих разновидностей депрессии ассоциировалось с выраженным снижением среднего балла не только депрессии (по шкале MADRS), но и тревоги (по шкале HAM-A); J. Tsai и соавт., 2017.
В том же 2017 г. описан клинический случай, в котором луразидон оказался эффективным в лечении униполярной терапевтически резистентной депрессии (N. Nuñez, G. Gobbi, 2017).
Аналогичные результаты, подтверждающие высокую эффективность луразидона в лечении «смешанных депрессий» (major depressive disorder with mixed features), получили T. Suppes и соавт. в двойном слепом плацебо-контролируемом РКИ от 2016 г. Стоит заметить, что в этом РКИ, в отличие от РКИ J. Tsai и соавт. от 2017 г., участвовали только пациенты, у которых было зафиксировано одновременно с наличием депрессии не менее 2–3 маниакальных или гипоманиакальных симптомов. Одного лишь наличия выраженной тревожности в структуре депрессии было недостаточно для включения в исследование (T. Gobbi и соавт., 2016).
Сравнение с другими препаратами, влияние смены терапии на луразидон
В метаобзоре от 2018 г. было показано, что луразидон обладает сопоставимой с брекспипразолом клинической эффективностью при лечении шизофрении и при этом дает еще меньше прибавки массы тела и метаболических ПЭ, чем брекспипразол (который, надо сказать, является одним из наиболее метаболически благоприятных АП); D. Ng-Mak и соавт., 2018.
В другом обзоре показано, что пациенты с шизофренией, которых перевели на луразидон, имели меньшую частоту повторных госпитализаций и более низкий процент отказов от лечения, чем пациенты, которые получали кветиапин или были переведены на него (J. Newcomer и соавт., 2018).
Мы уже ранее указывали, что рецепторный профиль луразидона, в частности его сильные 5-HT7-блокирующие свойства, заставляет предполагать наличие у него выраженной прокогнитивной активности (способности улучшать когнитивные функции больных). Действительно, опубликованный в 2017 г. ретроспективный анализ показал, что применение луразидона в дозах от 40 до 160 мг/сут значительно улучшает когнитивное функционирование пациентов с шизофренией, получающих длительную поддерживающую терапию, по сравнению с применением пролонгированной формы кветиапина в дозах от 200 до 800 мг/сут (P. Harvey и соавт., 2017).
Немаловажен и экономический аспект терапии. Показано, что, несмотря на высокую стоимость нового препарата, затраты на него окупаются меньшим количеством госпитализаций, более частым возвращением трудоспособности пациентов с шизофренией за счет выраженного положительного влияния луразидона на когнитивное функционирование, негативную и депрессивную симптоматику шизофрении. Луразидон оказался более экономически выгоден по соотношению «затраты–полезность», чем арипипразол и палиперидон (Y. Jiang, W. Ni, 2015; K. Rajagopalan и соавт., 2016).
Заключение
Как видно из проведенного нами обзора литературы, как проблема гипердиагностики шизофрении, шизотипического расстройства и других РШС, так и проблема недостаточной выявляемости аффективных и тревожных расстройств, а также расстройств обсессивно-компульсивного спектра, продолжают оставаться весьма острыми проблемами современной российской психиатрии. С гипердиагностикой РШС и недостаточной выявляемостью других психических расстройств тесно связана и проблема неадекватного, неправильного лечения, не соответствующего истинному диагнозу пациента. Часто это – лечение различными АП.
Такое положение дел сохраняется, несмотря на значительные усилия, предпринимаемые в последние десятилетия Российским обществом психиатров и Минздравом России в области повышения квалификации психиатров и улучшения диагностики и дифференциальной диагностики психических заболеваний.
Кроме того, не всегда дифференциальный диагноз между шизофренией, ШАР и БАР достаточно прост или вообще возможен, что и иллюстрирует описанный S. Stahl клинический случай.
В свете этого особое значение приобретает наличие в арсенале современной психиатрии и психофармакологии достаточно универсальных препаратов, способных дать нужный лечебный эффект в отношении как психотической, так и депрессивной, тревожной, обсессивно-компульсивной симптоматики независимо от (истинного) диагноза пациента и/или склонности лечащего врача к гипердиагностике в сторону БАР или же в сторону шизофрении. Одним из таких достаточно универсальных препаратов является рассматриваемый в данном обзоре АП-3П – Латуда (луразидон).
Обзор имеющейся доказательной базы по применению луразидона показывает, что он высокоэффективен и безопасен как в остром купирующем лечении шизофрении, так и в длительной поддерживающей противорецидивной терапии. При этом луразидон, благодаря своим мощным 5-HT7-блокирующим свойствам (самым мощным среди всех имеющихся на рынке АП-2П и АП-3П), оказывает особенно сильное положительное влияние на когнитивное функционирование больных шизофренией, а также на негативную, депрессивную и тревожную симптоматику шизофрении. Эти же сильные 5-HT7 блокирующие свойства обусловливают уникальное положительное влияние луразидона на фазовую структуру сна и циркадные ритмы.
Кроме того, луразидон также высокоэффективен и безопасен в лечении острой биполярной депрессии (депрессивной фазы БАР 1-го типа) как в монотерапии, так и в комбинациях с НТ (литием или вальпроатом).
Особо следует подчеркнуть, что антидепрессивный потенциал луразидона, по-видимому, превышает таковой у большинства других АП-2П и АП-3П. Это проявляется в частности в том, что из всех АП-2П и АП-3П только для луразидона и для кветиапина в настоящее время имеются убедительная доказательная база по их применению в монотерапии для лечения острой биполярной депрессии в рамках БАР 1-го типа (т.е. не в комбинациях с НТ) и регистрация FDA по этому показанию в монотерапии.
К дополнительным важным преимуществам луразидона относятся его хорошая переносимость, низкий потенциал вызывания ЭПС и акатизии (сопоставимый с илоперидоном, кветиапином), благоприятный метаболический профиль, малая склонность вызывать прибавку массы тела и метаболические нарушения (сопоставимо или лучше, чем у зипрасидона, арипипразола), низкая склонность вызывать ортостатическую гипотензию и тахикардию.
Резюмируя, можно сказать, что луразидон, безусловно, является не просто «еще одним новым АП», а весьма важным и своевременным расширением терапевтического арсенала психиатра – и особенно полезным, благодаря своей универсальности, в условиях России, с ее тенденцией к гипердиагностике шизофрении, шизотипического расстройства и других РШС и к лечению любых психических заболеваний с помощью АП. Важно также то, что луразидон обладает предсказуемой эффективностью как при шизофрении, так и при биполярной депрессии в рамках БАР 1-го типа.
Отдельно следует заметить также, что клиническое применение луразидона только начинается, поэтому нам пока не удалось найти достаточно данных об его эффективности за пределами шизофрении и биполярных депрессий при БАР 1-го типа. Между тем из рецепторного профиля луразидона можно предположить, что он, подобно некоторым другим АП-2П и АП-3П, может принести потенциальную пользу и при резистентных формах тревожных расстройств, и при расстройствах обсессивно-компульсивного спектра. Надо полагать, что такие данные могут появиться в будущем.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Список исп. литературыСкрыть список1. Беккер Р.А., Быков Ю.В., Морозов П.В. Выдающиеся психиатры XX века. М.: Городец, 2019. / Bekker R.A., Bykov Iu.V., Morozov P.V. Vydaiushchiesia psikhiatry XX veka. M.: Gorodets, 2019. [in Russian]
2. Демчева Н.К., Творогова Н.А. Психиатрическая помощь населению в 2012 году. Аналитический обзор. Под ред. З.И.Кекелидзе, Б.А.Казаковцева. М.: ФГБУ «ГНЦССП им. В.П.Сербского» МЗ РФ, 2012. / Demcheva N.K., Tvorogova N.A. Psikhiatricheskaia pomoshch' naseleniiu v 2012 godu. Analiticheskii obzor. Pod red. Z.I.Kekelidze, B.A.Kazakovtseva. M.: FGBU "GNTsSSP im. V.P.Serbskogo' MZ RF, 2012. [in Russian]
3. Казаковцев Б.А., Демчева Н.К., Сидорюк О.В. и др. Состояние психиатрических служб и распространенность психических расстройств в Российской Федерации в 2013–2015 годах. Психическое здоровье. 2016; 14 (7): 3–22. / Kazakovtsev B.A., Demcheva N.K., Sidoriuk O.V. i dr. Sostoianie psikhiatricheskikh sluzhb i rasprostranennost' psikhicheskikh rasstroistv v Rossiiskoi Federatsii v 2013–2015 godakh. Psikhicheskoe zdorov'e. 2016; 14 (7): 3–22. [in Russian]
4. Caccia S, Pasina L, Nobili A. Critical appraisal of lurasidone in the management of schizophrenia. Neuropsychiatr Dis Treat 2012; 8: 155–68.
5. Casey DE. Extrapyramidal syndromes and new antipsychotic drugs: findings in patients and non-human primate models. Br J Psychiatry (Suppl.) 1996; 29: 32–9.
6. Citrome L, Cucchiaro J, Sarma K et al. Long-term safety and tolerability of lurasidone in schizophrenia: a 12-month, double-blind, active-controlled study. Int Clin Psychopharmacol 2012; 27 (3): 165–76.
7. Citrome L, Weiden PJ, McEvoy JP et al. Effectiveness of lurasidone in schizophrenia or schizoaffective patients switched from other antipsychotics: a 6-month, open-label, extension study. CNS Spectr 2013; 16: 1–10.
8. Citrome L. Lurasidone for schizophrenia: A brief review of a new second-generation antipsychotic. Clin Schizophr Relat Psychoses 2011; 4 (4): 251–7.
9. Citrome L. Lurasidone for schizophrenia: a review of the efficacy and safety profile for this newly approved second-generation antipsychotic. Int J Clin Pract 2011; 65 (2): 189–210.
10. Clemente AS, Diniz BS, Nicolato R et al. Bipolar disorder prevalence: a systematic review and meta-analysis of the literature. Braz J Psychiatry 2015; 37 (2): 155–61.
11. Cruz MP. Lurasidone HCl (Latuda), an Oral, Once-Daily Atypical Antipsychotic Agent for the Treatment of Patients with Schizophrenia. P T 2011; 36 (8): 489–92.
12. Cucchiaro J, Pikalov A, Ogasa M. Safety of lurasidone: pooled analysis of five placebo-controlled trials in patients with schizophrenia. Int J Neuropsychopharmacol 2010; 13 (Suppl. 1): 217.
13. Ehret MJ, Sopko M, Lemieux T. Focus on lurasidone: a new atypical antipsychotic for the treatment of schizophrenia. Formulary 2010; 45 (10): 313–7.
14. Ferrari AJ, Charlson FJ, Norman RE et al. Burden of depressive disorders by country, sex, age, and year: findings from the global burden of disease study 2010. PLoS Med 2013; 10 (11): e1001547.
15. Food and Drug Administration Drug approval package Latuda (lurasidone hydrochloride) tablets. http://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/200603Orig1s000TOC.cfm
16. Forester BP, Sajatovic M, Tsai J et al. Safety and Effectiveness of Long-Term Treatment with Lurasidone in Older Adults with Bipolar Depression: Post-Hoc Analysis of a 6-Month, Open-Label Study. Am J Geriatr Psychiatry 2018; 26 (2): 150–9.
17. Gershon S, Soares JC. Bipolar disorders: basic mechanisms and therapeutic implications. CRC Press, 2000.
18. Goldman R, Loebel A, Cucchiaro J et al. Efficacy and Safety of Lurasidone in Adolescents with Schizophrenia: A 6-Week, Randomized Placebo-Controlled Study. J Child Adolesc Psychopharmacol 2017; 27 (6): 516–25.
19. Guscott M, Bristow LJ, Hadingham K et al. Genetic knockout and pharmacological blockade studies of the 5-HT7 receptor suggest therapeutic potential in depression. Neuropharmacology 2005; 48 (4): 492–502.
20. Haddad P. Weight change with atypical antipsychotics in the treatment of schizophrenia. J Psychopharmacol 2005; 19 (Suppl. 6): 16–27.
21. Harvey PD, Siu CO, Hsu J et al. Effect of lurasidone on neurocognitive performance in patients with schizophrenia: a short-term placebo- and active-controlled study followed by a 6-month double-blind extension. Eur Neuropsychopharmacol 2013; 23: 1373–82.
22. Harvey PD, Siu CO, Loebel AD. Insight and Treatment Outcomes in Schizophrenia: Post-hoc Analysis of a Long-term, Double-blind Study Comparing Lurasidone and Quetiapine XR. Innov Clin Neurosci 2017; 14 (11–12): 23–9.
23. Ishibashi T, Horisawa T, Tokuda K et al. Pharmacological profile of lurasidone, a novel antipsychotic agent with potent 5-hydroxytryptamine 7 (5-HT7) and 5-HT1A receptor activity. J Pharmacol Exp Ther 2010; 334 (1): 171–81.
24. Jiang Y, Ni W. Health Care Utilization and Treatment Persistence Associated with Oral Paliperidone and Lurasidone in Schizophrenia Treatment. J Manag Care Spec Pharm 2015; 21 (9): 780–92.
25. Kroeze WK, Hufeisen SJ, Popadak BA et al. H1-histamine receptor affinity predicts short-term weight gain for typical and atypical antipsychotic drugs. Neuropsychopharmacology 2003; 28 (3): 519–26.
26. Latuda (lurasidone HCl) tablets prescribing information. http://www.latuda.com/LatudaPrescribingInformation.pdf
27. Leucht S, Corves C, Arbter D et al. Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet 2009; 373 (9657): 31–41.
28. Lieberman JA. Understanding the mechanisms of action of atypical antipsychotic drugs: a review of compounds in use and development. Br J Psychiatry (Suppl.) 1993; 22: 7–18.
29. Loebel A, Citrome L. Lurasidone: a novel antipsychotic agent for the treatment of schizophrenia and bipolar depression. BJ Psych Bull 2015; 39 (5): 237–41.
30. Loebel A, Cucchiaro J, Sarma K et al. Efficacy and safety of lurasidone 80 mg/day and 160 mg/day in the treatment of schizophrenia: a randomized, double-blind, placebo- and active-controlled trial. Schizophr Res 2013; 145: 101–9.
31. Loebel A, Cucchiaro J, Silva R et al. Lurasidone monotherapy in the treatment of bipolar I depression: a randomized, double-blind, placebo-controlled study. Am J Psychiatry 2014; 171 (2): 160–8.
32. Loebel A, Cucchiaro J, Xu J et al. Effectiveness of lurasidone vs quetiapine XR for relapse prevention in schizophrenia: a 12-month, double-blind, non-inferiority study. Schizophr Res 2013; 147 (1): 95–102.
33. Mauri MC, Paletta S, Maffini M et al. Clinical pharmacology of atypical antipsychotics: an update. EXCLI J 2014; 13: 1163–91.
34. McIntyre RS, Cha DS, Alsuwaidan M et al. A review of published evidence reporting on the efficacy and pharmacology of lurasidone. Expert Opin Pharmacother 2012; 13 (11): 1653–9.
35. Meltzer HY, Cucchiaro J, Silva R et al. Lurasidone in the treatment of schizophrenia: a randomized, double-blind, placebo- and olanzapine-controlled study. Am J Psychiatry 2011; 168: 957–67.
36. Meltzer HY, Li Z, Kaneda Y, Ichikawa J. Serotonin receptors: their key role in drugs to treat schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2003; 27 (7): 1159–72.
37. Meneses A. Effects of the 5-HT7 receptor antagonists SB-269970 and DR 4004 in autoshaping Pavlovian/instrumental learning task. Behav Brain Res 2004; 155 (2): 275–82.
38. Meyer JM, Loebel AD, Schweizer E. Lurasidone: A new drug in development for schizophrenia. Expert Opin Investig Drugs 2009; 18 (11): 1715–26.
39. Murai T, Nakako T, Ikeda K et al. Lack of dopamine D4 receptor affinity contributes to the procognitive effect of lurasidone. Behav Brain Res 2014; 261: 26–30.
40. Nakamura M, Ogasa M, Guarino J et al. Lurasidone in the treatment of acute schizophrenia: a double-blind, placebo-controlled trial. J Clin Psychiatry 2009; 70: 829–36.
41. Nasrallah HA, Cucchiaro JB, Mao Y et al. Lurasidone for the treatment of depressive symptoms in schizophrenia: analysis of 4 pooled, 6-week, placebo-controlled studies. CNS Spectr 2015; 20 (2): 140–7.
42. Nasrallah HA, Silva R, Phillips D et al. Lurasidone for the treatment of acutely psychotic patients with schizophrenia: a 6-week, randomized, placebo-controlled study. J Psychiatr Res 2013; 47: 670–7.
43. Newcomer JW, Ng-Mak D, Rajagopalan K, Loebel A. Hospitalization outcomes in patients with schizophrenia after switching to lurasidone or quetiapine: a US claims database analysis. BMC Health Serv Res 2018; 18 (1): 243.
44. Ng-Mak D, Tongbram V, Ndirangu K et al. Efficacy and metabolic effects of lurasidone versus brexpiprazole in schizophrenia: a network meta-analysis. J Comp Eff Res 2018. DOI: 10.2217/cer-2018-0016
45. Nuñez NA, Gobbi G. Lurasidone and Mood Stabilizers in Treatment-Resistant Unipolar Depression: A Case Report. J Clin Psychopharmacol 2017; 37 (2): 263–4.
46. Ogasa M, Kimura T, Nakamura M, Guarino J. Lurasidone in the treatment of schizophrenia: a 6-week, placebo-controlled study. Psychopharmacology (Berl) 2013; 225: 519–30.
47. Osborne IJ, Mace S, Taylor D. A prospective year-long follow-up of lurasidone use in clinical practice: factors predicting treatment persistence. Ther Adv Psychopharmacol 2018; 8 (4): 117–25.
48. Pikalov A, Tsai J, Mao Y et al. Long-term use of lurasidone in patients with bipolar disorder: safety and effectiveness over 2 years of treatment. Int J Bipolar Disord 2017; 5 (1): 9.
49. Pompili M, Verzura C, Trovini G et al. Lurasidone: efficacy and safety in the treatment of psychotic and mood disorders. Expert Opin Drug Saf 2018; 17 (2): 197–205.
50. Potkin SG, Ogasa M, Cucchiaro J, Loebel A. Double-blind comparison of the safety and efficacy of lurasidone and ziprasidone in clinically stable outpatients with schizophrenia or schizoaffective disorder. Schizophr Res 2011; 132 (2–3): 101–7.
51. Rajagopalan K, Trueman D, Crowe L et al. Cost-Utility Analysis of Lurasidone Versus Aripiprazole in Adults with Schizophrenia. Pharmacoeconomics 2016; 34 (7): 709–21.
52. Risbood V, Lee JR, Roche-Desilets J, Fuller MA. Lurasidone: an atypical antipsychotic for schizophrenia. Ann Pharmacother 2012; 46 (7–8): 1033–46.
53. Ruiz P. Comprehensive textbook of psychiatry. 2017.
54. Samalin L, Garnier M, Llorca PM. Clinical potential of lurasidone in the management of schizophrenia. Ther Clin Risk Manag 2011; 7: 239–50.
55. Schaffer CB, Schaffer LC, Nordahl TE et al. An Open Trial of Lurasidone as an Acute and Maintenance Adjunctive Treatment for Outpatients With Treatment-Resistant Bipolar Disorder. J Clin Psychopharmacol 2016; 36 (1): 88–9.
56. Sneader W. Drug discovery: a history. John Wiley & Sons, 2005.
57. Stahl SM. Stahl’s Essential Psychopharmacology: Case studies. Volume 2. Cambridge university press, 2015.
58. Stahl SM. Stahl’s Essential Psychopharmacology: Prescriber’s Guide. Cambridge university press, 2017.
59. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. Cambridge University Press. 4rd Ed. 2013.
60. Steel Z, Marnane C, Iranpour С et al. The global prevalence of common mental disorders: a systematic review and meta-analysis 1980–2013. Int J Epidemiol 2014; 43 (2): 476–93.
61. Suppes T, Silva R, Cucchiaro J et al. Lurasidone for the Treatment of Major Depressive Disorder With Mixed Features: A Randomized, Double-Blind, Placebo-Controlled Study. Am J Psychiatry 2016; 173 (4): 400–7.
62. Tandon R, Cucchiaro J, Phillips D et al. A double-blind, placebo-controlled, randomized withdrawal study of lurasidone for the maintenance of efficacy in patients with schizophrenia. J Psychopharmacol 2016; 30 (1): 69–77.
63. Terry AV, Jr, Buccafusco JJ, Wilson C. Cognitive dysfunction in neuropsychiatric disorders: Selected serotonin receptor subtypes as therapeutic targets. Behav Brain Res 2008; 195 (1): 30–8.
64. Tsai J, Thase ME, Mao Y et al. Lurasidone for major depressive disorder with mixed features and anxiety: a post-hoc analysis of a randomized, placebo-controlled study. CNS Spectr 2017; 22 (2): 236–45.
65. Zhang H, Wang H, Zhu X et al. Lurasidone hydrochloride. Acta Crystallogr Sect E Struct Rep Online 2012; 68 (Pt 5): o1357.


