Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2019
Применение ницерголина (препарат Сермион®) в комбинированной терапии болезни Альцгеймера №04 2019
Номера страниц в выпуске:34-39
Аннотация
Болезнь Альцгеймера (БА) обладает многофакторной этиологией, которая включает различные патофизиологические процессы, влияющие на пути передачи сигналов нескольких нейротрансмиттеров. С учетом понимания сложной этиологии этого заболевания становится все более очевидным, что необходим комплексный подход к терапии БА с использованием препаратов, готовых к применению в таких комбинациях. Одним из таких препаратов является ницерголин (Сермион®). Ницерголин оказывает положительное влияние на когнитивные функции и поведенческие симптомы у пожилых пациентов с легкими или умеренными когнитивными нарушениями и деменциями различного клинического происхождения. В отделении по изучению когнитивных расстройств и деменции ФГБНУ «Научный центр психического здоровья» была проведена оценка накопленного опыта длительного применения ницерголина (Сермион®) при лечении больных БА. Для проведения сравнительного анализа комплексной терапии были сформированы две группы пациентов с умеренной и тяжелой БА от 63 до 85 лет: 1-я группа (n=28) получала мемантин в стабильной дозе 20 мг/сут и ницерголин в стабильной дозе 30 мг/сут в течение 12 мес, 2-я группа (n=24) – только мемантин в дозе 20 мг/сут. Анализ показал большую эффективность комбинированной терапии БА по сравнению с монотерапией мемантином. Комплексная терапия мемантина и ницерголина (препарат Сермион®) позволяет стабилизировать на протяжении 12 мес когнитивное функционирование, оцененное по ADAS-Сog-шкале, у пациентов с выраженной БА. При использовании монотерапии мемантином через 12 мес состояние когнитивных функций статистически значимо ухудшается по сравнению с комплексной терапией. Кроме того, при сочетанной терапии ницерголином и мемантином отмечалась выраженная и стойкая редукция таких симптомов, как тревога, апатия, аберрантное моторное поведение и раздражительность, по сравнению с монотерапией мемантином. Таким образом, результаты проведенного анализа применения ницерголина (Сермион®) в комбинированной терапии БА свидетельствуют об эффективности и безопасности данного подхода к лечению нейродегенеративных заболеваний позднего возраста.
Ключевые слова: деменция, болезнь Альцгеймера, терапия, ницерголин.
Для цитирования: Колыхалов И.В. Применение ницерголина (препарат Сермион®) в комбинированной терапии болезни Альцгеймера. Психиатрия и психофармакотерапия. 2019; 21 (4): 34–39.
Болезнь Альцгеймера (БА) обладает многофакторной этиологией, которая включает различные патофизиологические процессы, влияющие на пути передачи сигналов нескольких нейротрансмиттеров. С учетом понимания сложной этиологии этого заболевания становится все более очевидным, что необходим комплексный подход к терапии БА с использованием препаратов, готовых к применению в таких комбинациях. Одним из таких препаратов является ницерголин (Сермион®). Ницерголин оказывает положительное влияние на когнитивные функции и поведенческие симптомы у пожилых пациентов с легкими или умеренными когнитивными нарушениями и деменциями различного клинического происхождения. В отделении по изучению когнитивных расстройств и деменции ФГБНУ «Научный центр психического здоровья» была проведена оценка накопленного опыта длительного применения ницерголина (Сермион®) при лечении больных БА. Для проведения сравнительного анализа комплексной терапии были сформированы две группы пациентов с умеренной и тяжелой БА от 63 до 85 лет: 1-я группа (n=28) получала мемантин в стабильной дозе 20 мг/сут и ницерголин в стабильной дозе 30 мг/сут в течение 12 мес, 2-я группа (n=24) – только мемантин в дозе 20 мг/сут. Анализ показал большую эффективность комбинированной терапии БА по сравнению с монотерапией мемантином. Комплексная терапия мемантина и ницерголина (препарат Сермион®) позволяет стабилизировать на протяжении 12 мес когнитивное функционирование, оцененное по ADAS-Сog-шкале, у пациентов с выраженной БА. При использовании монотерапии мемантином через 12 мес состояние когнитивных функций статистически значимо ухудшается по сравнению с комплексной терапией. Кроме того, при сочетанной терапии ницерголином и мемантином отмечалась выраженная и стойкая редукция таких симптомов, как тревога, апатия, аберрантное моторное поведение и раздражительность, по сравнению с монотерапией мемантином. Таким образом, результаты проведенного анализа применения ницерголина (Сермион®) в комбинированной терапии БА свидетельствуют об эффективности и безопасности данного подхода к лечению нейродегенеративных заболеваний позднего возраста.
Ключевые слова: деменция, болезнь Альцгеймера, терапия, ницерголин.
Для цитирования: Колыхалов И.В. Применение ницерголина (препарат Сермион®) в комбинированной терапии болезни Альцгеймера. Психиатрия и психофармакотерапия. 2019; 21 (4): 34–39.
Аннотация
Болезнь Альцгеймера (БА) обладает многофакторной этиологией, которая включает различные патофизиологические процессы, влияющие на пути передачи сигналов нескольких нейротрансмиттеров. С учетом понимания сложной этиологии этого заболевания становится все более очевидным, что необходим комплексный подход к терапии БА с использованием препаратов, готовых к применению в таких комбинациях. Одним из таких препаратов является ницерголин (Сермион®). Ницерголин оказывает положительное влияние на когнитивные функции и поведенческие симптомы у пожилых пациентов с легкими или умеренными когнитивными нарушениями и деменциями различного клинического происхождения. В отделении по изучению когнитивных расстройств и деменции ФГБНУ «Научный центр психического здоровья» была проведена оценка накопленного опыта длительного применения ницерголина (Сермион®) при лечении больных БА. Для проведения сравнительного анализа комплексной терапии были сформированы две группы пациентов с умеренной и тяжелой БА от 63 до 85 лет: 1-я группа (n=28) получала мемантин в стабильной дозе 20 мг/сут и ницерголин в стабильной дозе 30 мг/сут в течение 12 мес, 2-я группа (n=24) – только мемантин в дозе 20 мг/сут. Анализ показал большую эффективность комбинированной терапии БА по сравнению с монотерапией мемантином. Комплексная терапия мемантина и ницерголина (препарат Сермион®) позволяет стабилизировать на протяжении 12 мес когнитивное функционирование, оцененное по ADAS-Сog-шкале, у пациентов с выраженной БА. При использовании монотерапии мемантином через 12 мес состояние когнитивных функций статистически значимо ухудшается по сравнению с комплексной терапией. Кроме того, при сочетанной терапии ницерголином и мемантином отмечалась выраженная и стойкая редукция таких симптомов, как тревога, апатия, аберрантное моторное поведение и раздражительность, по сравнению с монотерапией мемантином. Таким образом, результаты проведенного анализа применения ницерголина (Сермион®) в комбинированной терапии БА свидетельствуют об эффективности и безопасности данного подхода к лечению нейродегенеративных заболеваний позднего возраста.
Ключевые слова: деменция, болезнь Альцгеймера, терапия, ницерголин.
Для цитирования: Колыхалов И.В. Применение ницерголина (препарат Сермион®) в комбинированной терапии болезни Альцгеймера. Психиатрия и психофармакотерапия. 2019; 21 (4): 34–39.
Mental Health Research Center, Moscow, Russia *ikolykhalov@yandex.ru
Abstract
Alzheimer's disease (AD) has a multifactorial etiology, which includes various pathophysiological processes that affect the signal pathways of several neurotransmitters. With regard to the complex etiology of disease the need of a comprehensive approach to AD therapy is becoming obvious with administration of drugs that may used in combined therapy of AD. One of these drugs is nicergoline (Sermion®). Nicergoline has a positive effect on cognitive functions and behavioral symptoms in elderly patients with mild or moderate cognitive impairment and dementia of various geneses. In the Department for the study of cognitive disorders and dementia of Mental Health Research Center the accumulated experience of long-term use of nicergoline (Sermion®) in the treatment of AD patients was evaluated. To conduct a comparative analysis of complex therapy two groups of patients with moderate and severe AD from 63 to 85 years were formed. The 1st group (n=28) received memantine at a stable dose of 20 mg/day and nicergoline at a stable dose 30 mg/day for 12 months. The 2nd group (n=24) received only memantine at a dose of 20 mg/day. The analysis showed greater effectiveness of combined AD therapy compared to monotherapy with memantine. Combined therapy with memantine and nicergoline (Sermion®) allows to stabilize cognitive functioning, assessed on a scale ADAS-Cog, in patients with moderate/severe AD for 12 months. In comparison to the 1st group, patients receiving monotherapy for 12 months showed statistically significant cognitive decline. In addition compared with memantine monotherapy, combined therapy with nicergoline and memantine, leaded to pronounced and persistent reduction anxiety, apathy, aberrant motor behavior and irritability. Thus, obtained results of the analysis of the use of nicergoline (Sermion®) in combined AD therapy indicate the effectiveness and safety of this approach to the treatment of neurodegenerative diseases in elderly.
Key words: dementia, Alzheimer's disease, therapy, nicergoline.
For citation: Kolykhalov I.V. The use of nicergoline (Sermion®) in combined therapy of Alzheimer's disease. Psychiatry and Psychopharmacotherapy. 2019; 21 (4): 34–39.
В настоящее время менее чем 1/2 пациентов с БА устанавливается диагноз, а примерно 25% лечатся антидементными препаратами [1]. За последние десятилетия миллиарды долларов были потрачены на исследования БА, но не было достигнуто прогресса в поиске эффективной терапии этого заболевания. Многочисленные фармакологические исследования, потерпев неудачу, заставляют переосмыслить подходы к терапии БА.
БА обладает многофакторной этиологией, которая включает различные патофизиологические процессы, такие как аномальная агрегация белка, дегенерация нейронов и синапсов, нейровоспаление, повреждение митохондрий, окислительный стресс и эксайтотоксичность, которые влияют на пути передачи сигналов нескольких нейротрансмиттеров [2]. Так, J. Weinstein [3] выделяет 4 основных патологических процесса, влияющих на развитие БА: 1) сосудистая гипоперфузия головного мозга с сопутствующей митохондриальной дисфункцией; 2) деструктивные белковые отложения, повреждающие нейроны; 3) неконтролируемый окислительный стресс; 4) провоспалительные иммунные процессы, вторичные по отношению к микроглиальной и астроцитарной дисфункции головного мозга.
Все больше данных подтверждают теорию о том, что окислительный стресс, в основном из-за активных форм кислорода, приводит к повреждению митохондрий, которое первично возникает в результате хронической гипоперфузии. Патологический процесс, вызывающий митохондриальную дисфункцию и лежащий в основе патогенеза заболевания, вероятно, ассоциируется с возрастом. Потенциал митохондриальной мембраны, показатели контроля дыхания и клеточное потребление кислорода снижаются с возрастом и коррелируют с увеличением выработки активных форм кислорода. Длительная гипоперфузия и окислительный стресс в тканях мозга могут стимулировать экспрессию синтеза оксида азота, что, вероятно, увеличивает накопление продуктов окислительного стресса и способствует разрушению гематоэнцефалического барьера и повреждению паренхиматозных клеток головного мозга [4].
Два основных признака характеризуют БА: внеклеточное накопление амилоидного b-пептида (Ab) и интранейрональная агрегация тау-белка, образующего нейрофибриллярные клубки [5]. Помимо бляшек Ab и нейрофибриллярных клубков, более 50% пациентов с БА обнаруживают сопутствующую патологию a-синуклеина [6]. a-Cинуклеин представляет собой 140-аминокислотный белок, широко экспрессируемый в нейрональных пресинаптических терминалах. Различные исследования показывают, что a-синуклеин может быть вовлечен в развитие БА с самых ранних стадий формирования патологии Ab [7].
Одним из признанных патологических признаков БА является нейровоспаление [8]. В нормальном мозге микроглия не продуцирует провоспалительные молекулы, но при БА отложения Ab вызывают активацию астроцитов и микроглии с усиленным высвобождением провоспалительных молекул [9]. При БА отмечаются повышенные концентрации в мозге воспалительных цитокинов, таких как интерлейкин (ИЛ)-1a, ИЛ-b, ИЛ-6 и фактор некроза опухоли a [10].
Другой очень распространенной особенностью пациентов с БА является сосудистая дисфункция [11]. Состояние церебрально-сосудистой системы рассматривается как ключевой модулирующий фактор в механизмах распространения, отложения и токсичности таких прионоподобных белков, как Ab и тау-белок. Сосудистая дисфункция при БА оказывает значительное влияние на метаболизм мозга, гомеостаз, проницаемость гематоэнцефалического барьера, а также на клиренс b-амилоида и других токсических метаболитов. Последние данные указывают на то, что дисфункция гематоэнцефалического барьера связана с накоплением нескольких васкулотоксичных и нейротоксичных молекул в паренхиме головного мозга, снижением мозгового кровотока и гипоксией. Уменьшение мозгового кровотока приводит к снижению клиренса Ab из мозга, способствуя дегенерации нейронов и развитию БА [12, 13]. Сосудистое заболевание и нейродегенерация не только сосуществуют, но взаимодействуют. Вклад поражения мелких сосудов (артериолосклероз и амилоидная ангиопатия) в деменцию может повышать риск БА. Считается возможным воздействие сосудистого фактора на когнитивный резерв не только при деменции, но и при мягком когнитивном снижении амнестического типа [14].
В настоящее время в клинической практике используются лекарственные средства, направленные на преодоление холинергического дефицита, а также на стимуляцию и коррекцию глутаматергической системы головного мозга. Однако все используемые препараты не способны изменять или замедлять развитие БА, поэтому профилактика и терапия БА остается неразработанной, а с учетом растущего понимания сложной этиологии этого заболевания становится все более очевидным, что необходим комбинированный подход к терапии БА. Поэтому существует большой интерес к изучению новых направлений лекарственной терапии БА, которые должны быть направлены против различных причин и основываться на комбинированной терапии. Уже сейчас существуют препараты, готовые к применению в таких комбинациях, которые доступны и используются клинически для других целей, но не имеют прямого показания для лечения БА.
Одним из таких препаратов является ницерголин – это производное спорыньи, которое в настоящее время используется в более чем 50 странах на протяжении более трех десятилетий для лечения когнитивных, аффективных и поведенческих расстройств у пожилых людей. Первоначально ницерголин рассматривался как вазоактивный препарат, исходя из его действия в качестве антагониста a1-адренорецепторов, приводящего к расширению кровеносных сосудов, уменьшению сопротивления сосудов и усилению притока крови, в связи с чем он назначался при цереброваскулярных расстройствах [15]. Более поздние результаты исследований выявили другие особенности действия ницерголина, которые обеспечили его обоснованное использование для лечения разных форм деменции. Было показано, что ницерголин увеличивает доступность ацетилхолина за счет повышенного высвобождения его из холинергических терминалов и селективного ингибирования ацетилхолинэстеразы [16]. Ницерголин положительно влияет на систему трансдукции нейронального сигнала, стимулирующую фосфоинозитидный путь, который специфически нарушается при БА. Другие полезные действия ницерголина при деменции – это увеличение транслокации протеинкиназы С, которая помогает бороться с отложением Ab и замедляет уменьшение продукции фактора роста нервов, что может помочь предотвратить потерю холинергических нейронов [17].
Ницерголин оказывает положительное влияние на когнитивные функции, поведение и общее клиническое улучшение при лечении пожилых пациентов с легкими или умеренными когнитивными и поведенческими нарушениями различного клинического происхождения, включая хронические цереброваскулярные заболевания и БА [18].
Лечение ницерголином улучило перфузию лобной и теменной областей у пациентов с ранним началом БА. Предполагают, что повышение гемоперфузии в верхней лобной извилине может быть связано с механизмами, которые задерживают или предотвращают прогрессирующее ухудшение когнитивных функций при БА [19].
Терапевтический эффект ницерголина был показан при лечении деменции различной этиологии, причем почти у 89% пациентов наблюдалось улучшение познавательной деятельности и поведения. Даже после краткосрочного лечения в течение 2 мес наблюдается очевидное улучшения по сравнению с плацебо, а у большинства пациентов улучшение сохраняется или наблюдается стабилизация состояния через 12 мес [17]. Ницерголин исследовался при мягкой и умеренной БА в двойном слепом плацебо-контролируемом рандомизированном исследовании, в котором участвовали 346 пациентов из стран Западной Европы. По окончании 6-месячного курса терапии у пациентов c БА, лечившихся ницерголином, отмечались хорошая переносимость препарата и значимое положительное воздействие на когнитивное функционирование, которое оценивалось по ADAS-Cog-шкале (Alzheimer’s Disease Assessment Scale, ADAS-Cog) [20].
Ницерголин не является в настоящее время препаратом для базисной терапии БА, и точный механизм его действия при лечении деменции пока до конца не выяснен, но многие качества данного препарата могут действовать одновременно для улучшения различных симптомов, наблюдаемых при деменции, и в частности при БА. В связи с вышесказанным было решено оценить накопленный опыт длительного применения ницерголина (препарат Сермион®) в комплексной терапии пациентов с БА, наблюдавшихся за 5-летний период (с 2014 по 2018 г.) в отделении по изучению когнитивных расстройств и деменции отдела гериатрической психиатрии ФГБНУ НЦПЗ.
Диагноз БА устанавливался с использованием диагностических критериев Международной классификации болезней 10-го пересмотра и NINCDS–ADRDA. Для подтверждения диагноза использовались данные нейровизуализации (магнитно-резонансная томография или компьютерная томография головного мозга). Стадия деменции определялась по шкале тяжести деменции – Clinical Dementia Rating scale (CDR).
Большинство пациентов страдали хроническими соматическими заболеваниями. Так, у 16 больных в 1-й группе и у 13 человек во 2-й группе отмечалась гипертоническая болезнь, у 8 – в каждой группе выявлена ишемическая болезнь сердца, у 5 человек в 1-й группе и у 3 больных во 2-й группе – хронический пиелонефрит. Сахарным диабетом страдали 2 пациента из 1-й группы и 3 – из 2-й группы. Соматическое состояние всех больных к началу терапии оценивалось как компенсированное.
Распределение больных по терапевтическим группам представлено в табл. 1. Значимых различий между двумя терапевтическими группами выявлено не было ни по одному из представленных параметров. В обеих группах преобладали пациенты с поздним началом БА и с умеренной стадией деменции.
Оценка эффектов терапии в обеих группах производилась до начала терапии, по окончании 6 и 12 мес лечения. Для оценки терапевтической динамики когнитивного функционирования использовались краткая шкала оценки психического статуса – Mini Mental State Examination (MMSE) и шкала оценки когнитивных нарушений при БА ADAS-Cog.
Статистический анализ данных проводился с применением пакета прикладных программ Statistica 6. Для описания выборочного распределения количественных признаков использовалась медиана (Ме) и верхний (Q1) и нижний квартили (Q3) – интерквартильный размах. Группы сравнивали с использованием непараметрического U-критерия Манна–Уитни (для сравнения показателей между двумя независимыми группами). Различия считали достоверными при р<0,05.
К моменту окончания 6 мес лечения в обеих группах больных отмечалось статистически значимое улучшение когнитивного функционирования по сравнению с исходным уровнем как по шкале MMSE, так и по шкале ADAS-Cog (табл. 2). Через 12 мес терапии по шкале MMSE в обеих группах больных отмечалось статистически значимое снижение оценки в среднем на 1 балл. Однако при оценке когнитивных нарушений по шкале ADAS-Cog в группе пациентов, получавших комбинированную терапию (мемантин и ницерголин), не произошло ухудшения когнитивных функций за 12 мес терапии, тогда как в группе больных, получавших монотерапию мемантином, за 1 год произошло статистически значимое ухудшение когнитивного функционирования (см. табл. 2).
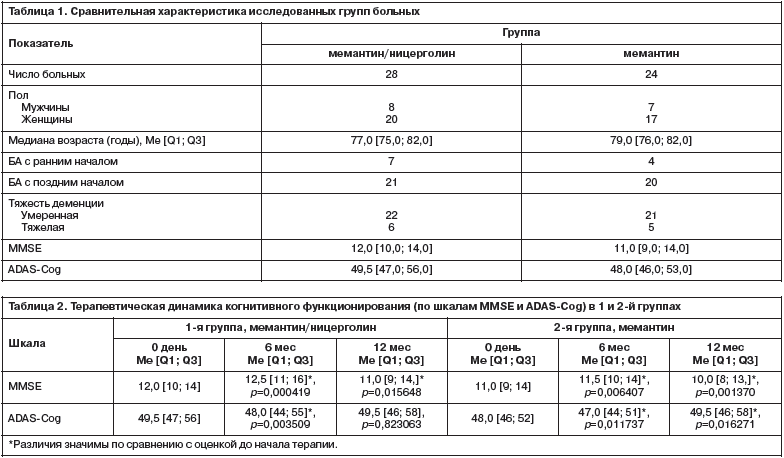
 Сравнительная динамика оценки когнитивных функций по шкале MMSE не выявила значимых различий между исследуемыми группами ни к окончанию 6 мес лечения, ни к 12 мес терапии (рис. 1). Однако анализ когнитивного функционирования по шкале ADAS-Сog показал различия в оценках между двумя терапевтическими группами на 12-м месяце терапии. Так, в группе больных, получавших комбинированную терапию, нарушения когнитивных функций на протяжении 1 года остались стабильными, а в группе пациентов, получавших монотерапию мемантином, произошло значимое ухудшение по сравнению с 1-й группой больных (см. рис. 1).
Сравнительная динамика оценки когнитивных функций по шкале MMSE не выявила значимых различий между исследуемыми группами ни к окончанию 6 мес лечения, ни к 12 мес терапии (рис. 1). Однако анализ когнитивного функционирования по шкале ADAS-Сog показал различия в оценках между двумя терапевтическими группами на 12-м месяце терапии. Так, в группе больных, получавших комбинированную терапию, нарушения когнитивных функций на протяжении 1 года остались стабильными, а в группе пациентов, получавших монотерапию мемантином, произошло значимое ухудшение по сравнению с 1-й группой больных (см. рис. 1).
Помимо когнитивных расстройств в данной работе были проанализированы различные некогнитивные симптомы, которые наблюдались в обеих группах больных. Следует подчеркнуть, что изначально в данную работу не включались пациенты, которые дополнительно нуждались в назначении антипсихотических препаратов или антидепрессантов, т.е. больные с выраженными депрессивными симптомами, психотическими расстройствами и агрессивным поведением. Однако отдельные поведенческие и аффективные симптомы наблюдались в обеих группах больных. Так, до начала терапии некогнитивные психические расстройства, оцениваемые по NPI-шкале, распределились в 1-й группе больных, получавших комбинированную терапию, следующим образом: аберрантное моторное поведение – у 64,3,0%, раздражительность – у 57,1%,
тревога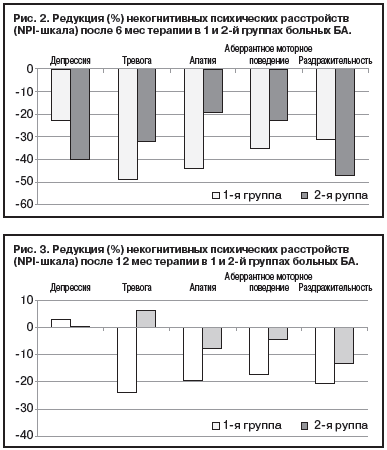 – у 46,4%, депрессия и апатия были установлены у 35,7% больных. Во 2-й группе больных, получавших монотерапию, аберрантное моторное поведение – у 66,7,0%, раздражительность – 62,5%, тревога – 54,2%, депрессия – 45,8% и апатия – 37,5% больных.
– у 46,4%, депрессия и апатия были установлены у 35,7% больных. Во 2-й группе больных, получавших монотерапию, аберрантное моторное поведение – у 66,7,0%, раздражительность – 62,5%, тревога – 54,2%, депрессия – 45,8% и апатия – 37,5% больных.
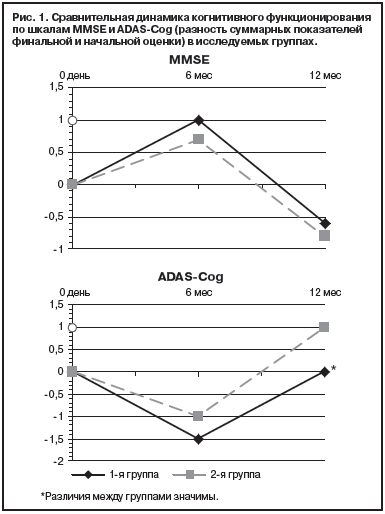
Анализ отдельных симптомов, представленных в NPI-шкале, показал, что к окончанию 6 мес терапии положительная динамика была отмечена по всему оцениваемому спектру некогнитивных психических расстройств. Их редукция по отношению к оценке на начало терапии была выше 20,0% как при комбинированном лечении, так и при монотерапии (рис. 2). В 1-й группе больных такие показатели, как тревога, апатия, аберрантное моторное поведение, редуцировались в диапазоне от 35 до 49%, а во 2-й группе подобная редукция (40–47%) отмечалась в отношении депрессии и раздражительности.
К окончанию 12 мес терапии уменьшение симптомов тревоги, апатии, аберрантного моторного поведения и раздражительности в 1-й группе больных БА составило около 20,0% по сравнению с оценкой до начала лечения, и только депрессивные симптомы незначительно (на 3,0%) усилились (рис. 3). Во 2-й группе больных через 1 год после начала лечения редукция аберрантного моторного поведения, апатии и раздражительности оказалась менее выраженной по сравнению с 1-й группой и колебалась от 4 до 13%, а депрессивные и особенно тревожные расстройства несколько усилились по сравнению с первоначальной оценкой (см. рис. 3).
Проведенный нами анализ показал большую эффективность применения комбинированной терапии при умеренной и тяжелой БА по сравнению с монотерапией мемантином. Особенно интересны результаты долгосрочной терапии ницерголином (препарат Сермион®) в сочетании с мемантином, поскольку данная комплексная терапия позволяет в первые полгода статистически значимо улучшать, а затем и стабилизировать на протяжении 12 мес когнитивное функционирование, оцененное по шкале ADAS-Cog, у пациентов с БА с выраженной деменцией. При использовании монотерапии мемантином через 12 мес состояние когнитивных функций больных статистически значимо ухудшается по сравнению с сочетанной терапией.
Ранее проведенные исследования показали, что ницерголин эффективен при лечении большинства пациентов с деменцией. В зависимости от длительности лечения ницерголином и типа деменции улучшение в разных терапевтических группах наблюдалось у 66,7–89,1% по сравнению с 26,9–50,0% в группах, принимавших плацебо [17]. Однако указанные исследования посвящены оценке монотерапии ницерголином по сравнению с плацебо.
Исследования, оценивавшие применение ницерголина в комплексной терапии деменций и более легких когнитивных нарушений в позднем возрасте, немногочисленны. Так, M. Hao и соавт. [21] установили, что ницерголин в сочетании с донепезилом обладает большей терапевтической эффективностью при лечении когнитивных нарушений по сравнению с монотерапией донепезилом, при этом в группе сочетанной терапии значимое улучшение отмечалось не только в отношении когнитивных функций, но и повседневного функционирования пролеченных больных.
В исследовании Е.В. Пономаревой [22], которая оценивала комплексную терапию ницерголином при БА, смешанной и сосудистой деменции, было показано, что 3-месячный курс комплексной терапии ницерголином в сочетании с ингибиторами холинэстеразы и/или мемантином улучшает когнитивное функционирование больных, редуцирует психопатологические и поведенческие симптомы, а также состояния спутанности.
Длительные эффекты от приема ницерголина были показаны с помощью двойного слепого многоцентрового исследования с участием 108 пациентов с деменцией (от легкой до умеренной) при БА, мультиинфарктной и смешанной деменции [23]. Лечение ницерголином оказалось более эффективно по сравнению с плацебо: через 12 мес терапии общий балл по SCAG-шкале показал статистически значимое улучшение в группе, получавшей ницерголин, по сравнению с пациентами, получавшими плацебо. Когнитивные функции, оцениваемые по шкале MMSE, оставались стабильными на протяжении всего периода лечения ницерголином.
Полученные нами результаты подтвердили данные ранее проведенных исследований о том, что применение ницерголина положительно влияет не только на когнитивные функции, но и на некогнитивные психические расстройства, такие как апатия и аффективные нарушения [24]. При длительной комбинированной терапии ницерголином и мемантином отмечена выраженная и стойкая редукция таких симптомов, как тревога, апатия, аберрантное моторное поведение и раздражительность, по сравнению с монотерапией мемантином.
Стабилизация когнитивного функционирования на разных этапах деменции является очень важным показателем целесообразности применения ницерголина при лечении БА, но также открывает возможности его использования для вторичной профилактики деменции у лиц с додементными когнитивными расстройствами.
В настоящее время поиск новых подходов в разработке превентивных стратегий терапии БА становится одним из приоритетных направлений научных исследований. Наиболее ранним проявлением деменции считают синдром мягкого когнитивного снижения (Mild Cognitive Impairment, MCI). Этот синдром представляет собой состояние, переходное между физиологическим снижением познавательных функций, обусловленных старением, и начальной (доклинической) стадией деменции [25]. Данные по переходу предементных состояний в деменцию очень вариативны, частота перехода от MCI к деменции колеблется от 5 до 17% в год [26]. Начало терапии на додементном этапе – оптимальная стратегия не только потому, что уровень функционирования пациента будет сохранен в течение более длительного периода, но также и потому, что пациенты, живущие в домашних условиях, требуют меньших социальных затрат по сравнению с больными, нуждающимися в долгосрочной институционализации.
Сведения об авторе
Колыхалов Игорь Владимирович – д-р мед. наук, гл. науч. сотр. отд. гериатрической психиатрии ФГБНУ НЦПЗ. E-mail: ikolykhalov@yandex.ru
Болезнь Альцгеймера (БА) обладает многофакторной этиологией, которая включает различные патофизиологические процессы, влияющие на пути передачи сигналов нескольких нейротрансмиттеров. С учетом понимания сложной этиологии этого заболевания становится все более очевидным, что необходим комплексный подход к терапии БА с использованием препаратов, готовых к применению в таких комбинациях. Одним из таких препаратов является ницерголин (Сермион®). Ницерголин оказывает положительное влияние на когнитивные функции и поведенческие симптомы у пожилых пациентов с легкими или умеренными когнитивными нарушениями и деменциями различного клинического происхождения. В отделении по изучению когнитивных расстройств и деменции ФГБНУ «Научный центр психического здоровья» была проведена оценка накопленного опыта длительного применения ницерголина (Сермион®) при лечении больных БА. Для проведения сравнительного анализа комплексной терапии были сформированы две группы пациентов с умеренной и тяжелой БА от 63 до 85 лет: 1-я группа (n=28) получала мемантин в стабильной дозе 20 мг/сут и ницерголин в стабильной дозе 30 мг/сут в течение 12 мес, 2-я группа (n=24) – только мемантин в дозе 20 мг/сут. Анализ показал большую эффективность комбинированной терапии БА по сравнению с монотерапией мемантином. Комплексная терапия мемантина и ницерголина (препарат Сермион®) позволяет стабилизировать на протяжении 12 мес когнитивное функционирование, оцененное по ADAS-Сog-шкале, у пациентов с выраженной БА. При использовании монотерапии мемантином через 12 мес состояние когнитивных функций статистически значимо ухудшается по сравнению с комплексной терапией. Кроме того, при сочетанной терапии ницерголином и мемантином отмечалась выраженная и стойкая редукция таких симптомов, как тревога, апатия, аберрантное моторное поведение и раздражительность, по сравнению с монотерапией мемантином. Таким образом, результаты проведенного анализа применения ницерголина (Сермион®) в комбинированной терапии БА свидетельствуют об эффективности и безопасности данного подхода к лечению нейродегенеративных заболеваний позднего возраста.
Ключевые слова: деменция, болезнь Альцгеймера, терапия, ницерголин.
Для цитирования: Колыхалов И.В. Применение ницерголина (препарат Сермион®) в комбинированной терапии болезни Альцгеймера. Психиатрия и психофармакотерапия. 2019; 21 (4): 34–39.
The use of nicergoline (Sermion®) in combined therapy of Alzheimer's disease
I.V. Kolykhalov*Mental Health Research Center, Moscow, Russia *ikolykhalov@yandex.ru
Abstract
Alzheimer's disease (AD) has a multifactorial etiology, which includes various pathophysiological processes that affect the signal pathways of several neurotransmitters. With regard to the complex etiology of disease the need of a comprehensive approach to AD therapy is becoming obvious with administration of drugs that may used in combined therapy of AD. One of these drugs is nicergoline (Sermion®). Nicergoline has a positive effect on cognitive functions and behavioral symptoms in elderly patients with mild or moderate cognitive impairment and dementia of various geneses. In the Department for the study of cognitive disorders and dementia of Mental Health Research Center the accumulated experience of long-term use of nicergoline (Sermion®) in the treatment of AD patients was evaluated. To conduct a comparative analysis of complex therapy two groups of patients with moderate and severe AD from 63 to 85 years were formed. The 1st group (n=28) received memantine at a stable dose of 20 mg/day and nicergoline at a stable dose 30 mg/day for 12 months. The 2nd group (n=24) received only memantine at a dose of 20 mg/day. The analysis showed greater effectiveness of combined AD therapy compared to monotherapy with memantine. Combined therapy with memantine and nicergoline (Sermion®) allows to stabilize cognitive functioning, assessed on a scale ADAS-Cog, in patients with moderate/severe AD for 12 months. In comparison to the 1st group, patients receiving monotherapy for 12 months showed statistically significant cognitive decline. In addition compared with memantine monotherapy, combined therapy with nicergoline and memantine, leaded to pronounced and persistent reduction anxiety, apathy, aberrant motor behavior and irritability. Thus, obtained results of the analysis of the use of nicergoline (Sermion®) in combined AD therapy indicate the effectiveness and safety of this approach to the treatment of neurodegenerative diseases in elderly.
Key words: dementia, Alzheimer's disease, therapy, nicergoline.
For citation: Kolykhalov I.V. The use of nicergoline (Sermion®) in combined therapy of Alzheimer's disease. Psychiatry and Psychopharmacotherapy. 2019; 21 (4): 34–39.
Введение
Болезнь Альцгеймера (БА) – первичное нейродегенеративное заболевание, которое является наиболее распространенной причиной деменции в пожилом и старческом возрасте. Ежегодная заболеваемость БА оценивается в 4,6 млн человек, что является эквивалентом одного нового случая каждые 7 с. Бремя инвалидности, связанное с деменцией, у пожилых людей выше, чем при инсульте, заболеваниях скелетно-мышечной системы, болезнях сердца и раке. Поскольку численность людей преклонного возраста в мире увеличивается, деменция становится одной из важнейших социальных, экономических и медицинских проблем. Так, в декларации Саммита G20 от 29 июня 2019 г. деменция была выделена в качестве одного из глобальных приоритетов в области здравоохранении.В настоящее время менее чем 1/2 пациентов с БА устанавливается диагноз, а примерно 25% лечатся антидементными препаратами [1]. За последние десятилетия миллиарды долларов были потрачены на исследования БА, но не было достигнуто прогресса в поиске эффективной терапии этого заболевания. Многочисленные фармакологические исследования, потерпев неудачу, заставляют переосмыслить подходы к терапии БА.
БА обладает многофакторной этиологией, которая включает различные патофизиологические процессы, такие как аномальная агрегация белка, дегенерация нейронов и синапсов, нейровоспаление, повреждение митохондрий, окислительный стресс и эксайтотоксичность, которые влияют на пути передачи сигналов нескольких нейротрансмиттеров [2]. Так, J. Weinstein [3] выделяет 4 основных патологических процесса, влияющих на развитие БА: 1) сосудистая гипоперфузия головного мозга с сопутствующей митохондриальной дисфункцией; 2) деструктивные белковые отложения, повреждающие нейроны; 3) неконтролируемый окислительный стресс; 4) провоспалительные иммунные процессы, вторичные по отношению к микроглиальной и астроцитарной дисфункции головного мозга.
Все больше данных подтверждают теорию о том, что окислительный стресс, в основном из-за активных форм кислорода, приводит к повреждению митохондрий, которое первично возникает в результате хронической гипоперфузии. Патологический процесс, вызывающий митохондриальную дисфункцию и лежащий в основе патогенеза заболевания, вероятно, ассоциируется с возрастом. Потенциал митохондриальной мембраны, показатели контроля дыхания и клеточное потребление кислорода снижаются с возрастом и коррелируют с увеличением выработки активных форм кислорода. Длительная гипоперфузия и окислительный стресс в тканях мозга могут стимулировать экспрессию синтеза оксида азота, что, вероятно, увеличивает накопление продуктов окислительного стресса и способствует разрушению гематоэнцефалического барьера и повреждению паренхиматозных клеток головного мозга [4].
Два основных признака характеризуют БА: внеклеточное накопление амилоидного b-пептида (Ab) и интранейрональная агрегация тау-белка, образующего нейрофибриллярные клубки [5]. Помимо бляшек Ab и нейрофибриллярных клубков, более 50% пациентов с БА обнаруживают сопутствующую патологию a-синуклеина [6]. a-Cинуклеин представляет собой 140-аминокислотный белок, широко экспрессируемый в нейрональных пресинаптических терминалах. Различные исследования показывают, что a-синуклеин может быть вовлечен в развитие БА с самых ранних стадий формирования патологии Ab [7].
Одним из признанных патологических признаков БА является нейровоспаление [8]. В нормальном мозге микроглия не продуцирует провоспалительные молекулы, но при БА отложения Ab вызывают активацию астроцитов и микроглии с усиленным высвобождением провоспалительных молекул [9]. При БА отмечаются повышенные концентрации в мозге воспалительных цитокинов, таких как интерлейкин (ИЛ)-1a, ИЛ-b, ИЛ-6 и фактор некроза опухоли a [10].
Другой очень распространенной особенностью пациентов с БА является сосудистая дисфункция [11]. Состояние церебрально-сосудистой системы рассматривается как ключевой модулирующий фактор в механизмах распространения, отложения и токсичности таких прионоподобных белков, как Ab и тау-белок. Сосудистая дисфункция при БА оказывает значительное влияние на метаболизм мозга, гомеостаз, проницаемость гематоэнцефалического барьера, а также на клиренс b-амилоида и других токсических метаболитов. Последние данные указывают на то, что дисфункция гематоэнцефалического барьера связана с накоплением нескольких васкулотоксичных и нейротоксичных молекул в паренхиме головного мозга, снижением мозгового кровотока и гипоксией. Уменьшение мозгового кровотока приводит к снижению клиренса Ab из мозга, способствуя дегенерации нейронов и развитию БА [12, 13]. Сосудистое заболевание и нейродегенерация не только сосуществуют, но взаимодействуют. Вклад поражения мелких сосудов (артериолосклероз и амилоидная ангиопатия) в деменцию может повышать риск БА. Считается возможным воздействие сосудистого фактора на когнитивный резерв не только при деменции, но и при мягком когнитивном снижении амнестического типа [14].
В настоящее время в клинической практике используются лекарственные средства, направленные на преодоление холинергического дефицита, а также на стимуляцию и коррекцию глутаматергической системы головного мозга. Однако все используемые препараты не способны изменять или замедлять развитие БА, поэтому профилактика и терапия БА остается неразработанной, а с учетом растущего понимания сложной этиологии этого заболевания становится все более очевидным, что необходим комбинированный подход к терапии БА. Поэтому существует большой интерес к изучению новых направлений лекарственной терапии БА, которые должны быть направлены против различных причин и основываться на комбинированной терапии. Уже сейчас существуют препараты, готовые к применению в таких комбинациях, которые доступны и используются клинически для других целей, но не имеют прямого показания для лечения БА.
Одним из таких препаратов является ницерголин – это производное спорыньи, которое в настоящее время используется в более чем 50 странах на протяжении более трех десятилетий для лечения когнитивных, аффективных и поведенческих расстройств у пожилых людей. Первоначально ницерголин рассматривался как вазоактивный препарат, исходя из его действия в качестве антагониста a1-адренорецепторов, приводящего к расширению кровеносных сосудов, уменьшению сопротивления сосудов и усилению притока крови, в связи с чем он назначался при цереброваскулярных расстройствах [15]. Более поздние результаты исследований выявили другие особенности действия ницерголина, которые обеспечили его обоснованное использование для лечения разных форм деменции. Было показано, что ницерголин увеличивает доступность ацетилхолина за счет повышенного высвобождения его из холинергических терминалов и селективного ингибирования ацетилхолинэстеразы [16]. Ницерголин положительно влияет на систему трансдукции нейронального сигнала, стимулирующую фосфоинозитидный путь, который специфически нарушается при БА. Другие полезные действия ницерголина при деменции – это увеличение транслокации протеинкиназы С, которая помогает бороться с отложением Ab и замедляет уменьшение продукции фактора роста нервов, что может помочь предотвратить потерю холинергических нейронов [17].
Ницерголин оказывает положительное влияние на когнитивные функции, поведение и общее клиническое улучшение при лечении пожилых пациентов с легкими или умеренными когнитивными и поведенческими нарушениями различного клинического происхождения, включая хронические цереброваскулярные заболевания и БА [18].
Лечение ницерголином улучило перфузию лобной и теменной областей у пациентов с ранним началом БА. Предполагают, что повышение гемоперфузии в верхней лобной извилине может быть связано с механизмами, которые задерживают или предотвращают прогрессирующее ухудшение когнитивных функций при БА [19].
Терапевтический эффект ницерголина был показан при лечении деменции различной этиологии, причем почти у 89% пациентов наблюдалось улучшение познавательной деятельности и поведения. Даже после краткосрочного лечения в течение 2 мес наблюдается очевидное улучшения по сравнению с плацебо, а у большинства пациентов улучшение сохраняется или наблюдается стабилизация состояния через 12 мес [17]. Ницерголин исследовался при мягкой и умеренной БА в двойном слепом плацебо-контролируемом рандомизированном исследовании, в котором участвовали 346 пациентов из стран Западной Европы. По окончании 6-месячного курса терапии у пациентов c БА, лечившихся ницерголином, отмечались хорошая переносимость препарата и значимое положительное воздействие на когнитивное функционирование, которое оценивалось по ADAS-Cog-шкале (Alzheimer’s Disease Assessment Scale, ADAS-Cog) [20].
Ницерголин не является в настоящее время препаратом для базисной терапии БА, и точный механизм его действия при лечении деменции пока до конца не выяснен, но многие качества данного препарата могут действовать одновременно для улучшения различных симптомов, наблюдаемых при деменции, и в частности при БА. В связи с вышесказанным было решено оценить накопленный опыт длительного применения ницерголина (препарат Сермион®) в комплексной терапии пациентов с БА, наблюдавшихся за 5-летний период (с 2014 по 2018 г.) в отделении по изучению когнитивных расстройств и деменции отдела гериатрической психиатрии ФГБНУ НЦПЗ.
Результаты
Для проведения сравнительного анализа комплексной терапии были сформированы 2 группы: 1-я группа состояла из 28 пациентов с умеренной и тяжелой БА, которые на протяжении 12 мес получали мемантин в стабильной дозе 20 мг/сут и ницерголин (препарат Сермион®) 30 мг/сут, и 2-я группа – из 24 пациентов с умеренной и тяжелой БА, которые на протяжении того же периода принимали только мемантин в дозе 20 мг/сут. Возраст больных был от 63 до 85 лет.Диагноз БА устанавливался с использованием диагностических критериев Международной классификации болезней 10-го пересмотра и NINCDS–ADRDA. Для подтверждения диагноза использовались данные нейровизуализации (магнитно-резонансная томография или компьютерная томография головного мозга). Стадия деменции определялась по шкале тяжести деменции – Clinical Dementia Rating scale (CDR).
Большинство пациентов страдали хроническими соматическими заболеваниями. Так, у 16 больных в 1-й группе и у 13 человек во 2-й группе отмечалась гипертоническая болезнь, у 8 – в каждой группе выявлена ишемическая болезнь сердца, у 5 человек в 1-й группе и у 3 больных во 2-й группе – хронический пиелонефрит. Сахарным диабетом страдали 2 пациента из 1-й группы и 3 – из 2-й группы. Соматическое состояние всех больных к началу терапии оценивалось как компенсированное.
Распределение больных по терапевтическим группам представлено в табл. 1. Значимых различий между двумя терапевтическими группами выявлено не было ни по одному из представленных параметров. В обеих группах преобладали пациенты с поздним началом БА и с умеренной стадией деменции.
Оценка эффектов терапии в обеих группах производилась до начала терапии, по окончании 6 и 12 мес лечения. Для оценки терапевтической динамики когнитивного функционирования использовались краткая шкала оценки психического статуса – Mini Mental State Examination (MMSE) и шкала оценки когнитивных нарушений при БА ADAS-Cog.
Статистический анализ данных проводился с применением пакета прикладных программ Statistica 6. Для описания выборочного распределения количественных признаков использовалась медиана (Ме) и верхний (Q1) и нижний квартили (Q3) – интерквартильный размах. Группы сравнивали с использованием непараметрического U-критерия Манна–Уитни (для сравнения показателей между двумя независимыми группами). Различия считали достоверными при р<0,05.
К моменту окончания 6 мес лечения в обеих группах больных отмечалось статистически значимое улучшение когнитивного функционирования по сравнению с исходным уровнем как по шкале MMSE, так и по шкале ADAS-Cog (табл. 2). Через 12 мес терапии по шкале MMSE в обеих группах больных отмечалось статистически значимое снижение оценки в среднем на 1 балл. Однако при оценке когнитивных нарушений по шкале ADAS-Cog в группе пациентов, получавших комбинированную терапию (мемантин и ницерголин), не произошло ухудшения когнитивных функций за 12 мес терапии, тогда как в группе больных, получавших монотерапию мемантином, за 1 год произошло статистически значимое ухудшение когнитивного функционирования (см. табл. 2).

 Сравнительная динамика оценки когнитивных функций по шкале MMSE не выявила значимых различий между исследуемыми группами ни к окончанию 6 мес лечения, ни к 12 мес терапии (рис. 1). Однако анализ когнитивного функционирования по шкале ADAS-Сog показал различия в оценках между двумя терапевтическими группами на 12-м месяце терапии. Так, в группе больных, получавших комбинированную терапию, нарушения когнитивных функций на протяжении 1 года остались стабильными, а в группе пациентов, получавших монотерапию мемантином, произошло значимое ухудшение по сравнению с 1-й группой больных (см. рис. 1).
Сравнительная динамика оценки когнитивных функций по шкале MMSE не выявила значимых различий между исследуемыми группами ни к окончанию 6 мес лечения, ни к 12 мес терапии (рис. 1). Однако анализ когнитивного функционирования по шкале ADAS-Сog показал различия в оценках между двумя терапевтическими группами на 12-м месяце терапии. Так, в группе больных, получавших комбинированную терапию, нарушения когнитивных функций на протяжении 1 года остались стабильными, а в группе пациентов, получавших монотерапию мемантином, произошло значимое ухудшение по сравнению с 1-й группой больных (см. рис. 1). Помимо когнитивных расстройств в данной работе были проанализированы различные некогнитивные симптомы, которые наблюдались в обеих группах больных. Следует подчеркнуть, что изначально в данную работу не включались пациенты, которые дополнительно нуждались в назначении антипсихотических препаратов или антидепрессантов, т.е. больные с выраженными депрессивными симптомами, психотическими расстройствами и агрессивным поведением. Однако отдельные поведенческие и аффективные симптомы наблюдались в обеих группах больных. Так, до начала терапии некогнитивные психические расстройства, оцениваемые по NPI-шкале, распределились в 1-й группе больных, получавших комбинированную терапию, следующим образом: аберрантное моторное поведение – у 64,3,0%, раздражительность – у 57,1%,
тревога
 – у 46,4%, депрессия и апатия были установлены у 35,7% больных. Во 2-й группе больных, получавших монотерапию, аберрантное моторное поведение – у 66,7,0%, раздражительность – 62,5%, тревога – 54,2%, депрессия – 45,8% и апатия – 37,5% больных.
– у 46,4%, депрессия и апатия были установлены у 35,7% больных. Во 2-й группе больных, получавших монотерапию, аберрантное моторное поведение – у 66,7,0%, раздражительность – 62,5%, тревога – 54,2%, депрессия – 45,8% и апатия – 37,5% больных.Анализ отдельных симптомов, представленных в NPI-шкале, показал, что к окончанию 6 мес терапии положительная динамика была отмечена по всему оцениваемому спектру некогнитивных психических расстройств. Их редукция по отношению к оценке на начало терапии была выше 20,0% как при комбинированном лечении, так и при монотерапии (рис. 2). В 1-й группе больных такие показатели, как тревога, апатия, аберрантное моторное поведение, редуцировались в диапазоне от 35 до 49%, а во 2-й группе подобная редукция (40–47%) отмечалась в отношении депрессии и раздражительности.
К окончанию 12 мес терапии уменьшение симптомов тревоги, апатии, аберрантного моторного поведения и раздражительности в 1-й группе больных БА составило около 20,0% по сравнению с оценкой до начала лечения, и только депрессивные симптомы незначительно (на 3,0%) усилились (рис. 3). Во 2-й группе больных через 1 год после начала лечения редукция аберрантного моторного поведения, апатии и раздражительности оказалась менее выраженной по сравнению с 1-й группой и колебалась от 4 до 13%, а депрессивные и особенно тревожные расстройства несколько усилились по сравнению с первоначальной оценкой (см. рис. 3).
Обсуждение
Долгосрочная эффективность ницерголина и безопасность его применения лучше всего исследованы (по сравнению с плацебо) для лечения деменции, независимо от этиологии заболевания (сосудистая деменция или БА). При лечении деменции преимущества применения ницерголина (в дозе 30 мг/сут) сохраняются в течение длительного периода, в то время как улучшение, наблюдающееся после применения плацебо, нивелируется по прошествии нескольких месяцев [17].Проведенный нами анализ показал большую эффективность применения комбинированной терапии при умеренной и тяжелой БА по сравнению с монотерапией мемантином. Особенно интересны результаты долгосрочной терапии ницерголином (препарат Сермион®) в сочетании с мемантином, поскольку данная комплексная терапия позволяет в первые полгода статистически значимо улучшать, а затем и стабилизировать на протяжении 12 мес когнитивное функционирование, оцененное по шкале ADAS-Cog, у пациентов с БА с выраженной деменцией. При использовании монотерапии мемантином через 12 мес состояние когнитивных функций больных статистически значимо ухудшается по сравнению с сочетанной терапией.
Ранее проведенные исследования показали, что ницерголин эффективен при лечении большинства пациентов с деменцией. В зависимости от длительности лечения ницерголином и типа деменции улучшение в разных терапевтических группах наблюдалось у 66,7–89,1% по сравнению с 26,9–50,0% в группах, принимавших плацебо [17]. Однако указанные исследования посвящены оценке монотерапии ницерголином по сравнению с плацебо.
Исследования, оценивавшие применение ницерголина в комплексной терапии деменций и более легких когнитивных нарушений в позднем возрасте, немногочисленны. Так, M. Hao и соавт. [21] установили, что ницерголин в сочетании с донепезилом обладает большей терапевтической эффективностью при лечении когнитивных нарушений по сравнению с монотерапией донепезилом, при этом в группе сочетанной терапии значимое улучшение отмечалось не только в отношении когнитивных функций, но и повседневного функционирования пролеченных больных.
В исследовании Е.В. Пономаревой [22], которая оценивала комплексную терапию ницерголином при БА, смешанной и сосудистой деменции, было показано, что 3-месячный курс комплексной терапии ницерголином в сочетании с ингибиторами холинэстеразы и/или мемантином улучшает когнитивное функционирование больных, редуцирует психопатологические и поведенческие симптомы, а также состояния спутанности.
Длительные эффекты от приема ницерголина были показаны с помощью двойного слепого многоцентрового исследования с участием 108 пациентов с деменцией (от легкой до умеренной) при БА, мультиинфарктной и смешанной деменции [23]. Лечение ницерголином оказалось более эффективно по сравнению с плацебо: через 12 мес терапии общий балл по SCAG-шкале показал статистически значимое улучшение в группе, получавшей ницерголин, по сравнению с пациентами, получавшими плацебо. Когнитивные функции, оцениваемые по шкале MMSE, оставались стабильными на протяжении всего периода лечения ницерголином.
Полученные нами результаты подтвердили данные ранее проведенных исследований о том, что применение ницерголина положительно влияет не только на когнитивные функции, но и на некогнитивные психические расстройства, такие как апатия и аффективные нарушения [24]. При длительной комбинированной терапии ницерголином и мемантином отмечена выраженная и стойкая редукция таких симптомов, как тревога, апатия, аберрантное моторное поведение и раздражительность, по сравнению с монотерапией мемантином.
Стабилизация когнитивного функционирования на разных этапах деменции является очень важным показателем целесообразности применения ницерголина при лечении БА, но также открывает возможности его использования для вторичной профилактики деменции у лиц с додементными когнитивными расстройствами.
В настоящее время поиск новых подходов в разработке превентивных стратегий терапии БА становится одним из приоритетных направлений научных исследований. Наиболее ранним проявлением деменции считают синдром мягкого когнитивного снижения (Mild Cognitive Impairment, MCI). Этот синдром представляет собой состояние, переходное между физиологическим снижением познавательных функций, обусловленных старением, и начальной (доклинической) стадией деменции [25]. Данные по переходу предементных состояний в деменцию очень вариативны, частота перехода от MCI к деменции колеблется от 5 до 17% в год [26]. Начало терапии на додементном этапе – оптимальная стратегия не только потому, что уровень функционирования пациента будет сохранен в течение более длительного периода, но также и потому, что пациенты, живущие в домашних условиях, требуют меньших социальных затрат по сравнению с больными, нуждающимися в долгосрочной институционализации.
Заключение
Результаты проведенного анализа использования ницерголина (препарат Сермион®) в комбинированной терапии БА свидетельствуют об эффективности и безопасности данного подхода к лечению нейродегенеративных заболеваний позднего возраста. Поскольку существующие теории патогенеза БА оказались несостоятельными при разработке болезньмодифицирующих фармацевтических подходов к лечению и профилактике из-за мультимодального и глобального характера молекулярных, патофизиологических и анатомических мозговых изменений при БА, становится все более очевидным, что будущий терапевтический дизайн у больных БА должен быть сосредоточен на разработке комбинаторных подходов, ориентированных на разные механизмы патогенеза заболевания. Лечение сосудистой дисфункции на ранней стадии патогенеза БА или даже у пожилых лиц на додементном этапе развития БА может значительно улучшить как краткосрочные, так и долгосрочные результаты терапии.Сведения об авторе
Колыхалов Игорь Владимирович – д-р мед. наук, гл. науч. сотр. отд. гериатрической психиатрии ФГБНУ НЦПЗ. E-mail: ikolykhalov@yandex.ru
Список исп. литературыСкрыть список1. Solomon PR, Murphy CA. Should we screen for Alzheimer's disease? A review of the evidence for and against screening Alzheimer's disease in primary care practice. Geriatrics 2005; 60 (11): 26–31.
2. Behl C, Ziegler C. Beyond amyloid – widening the view on Alzheimer’s disease. J Neurochem 2017; 143: 394–5. DOI: 10.1111/jnc.14137
3. Weinstein JD. A new direction for Alzheimer's research. Neural Regen Res 2018; 13 (2): 190–3. DOI: 10.4103/1673-5374.226381
4. Aliev G, Palacios HH, Gasimov E et al. Oxidative stress induced mitochondrial failure and vascular hypoperfusion as a key initiator for the development of Alzheimer disease. Pharmaceuticals (Basel) 2010; 3 (1): 158–87. DOI: 10.3390/ph3010158
5. Calderon-Garcidueñas AL, Duyckaerts C. Alzheimer disease. Handb Clin Neurol 2017; 145: 325–37. DOI: 10.1016/B978-0-12-802395-2.00023-7
6. Twohig D, Rodriguez-Vieitez E, Sando SB et al. The relevance of cerebrospinal fluid α-synuclein levels to sporadic and familial Alzheimer’s disease. Acta Neuropathol Commun 2018; 6: 130. DOI: 10.1186/s40478-018-0624-z
7. Vergallo A, Bun RS, Toschi N et al.; INSIGHT-preAD study group; Alzheimer Precision Medicine Initiative (APMI). Association of cerebrospinal fluid α-synuclein with total and phospho-tau. Alzheimers Dement 2018; 14: 1623–31. DOI: 10.1016/j.jalz.2018.06.3053
8. González-Reyes RE, Nava-Mesa MO, Vargas-Sánchez K et al. Involvement of astrocytes in Alzheimer’s disease from a neuroinflammatory and oxidative stress perspective. Front Mol Neurosci 2017; 10: 427. DOI: 10.3389/fnmol.2017.00427
9. Yucesoy B, Peila R, White LR et al. Association of interleukin-1 gene polymorphisms with dementia in a community-based sample: the Honolulu-Asia aging Study. Neurobiol Aging 2006; 27: 211–7. DOI: 10.1016/j.neurobiolaging.2005.01.013
10. Zilka N, Ferencik M, Hulin I. Neuroinflammation in Alzheimer’s disease: protector or promoter? Bratisl Lek Listy 2006; 107: 374–83.
11. Iadecola C. Rescuing troubled vessels in Alzheimer disease. Nat Med 2005; 11: 923–4. DOI: 10.1038/nm0905-923
12. Zlokovic B.V. Neurovascular pathways to neurodegeneration in Alzheimer’s disease and other disorders. Nat Rev Neurosci 2011; 12: 723–38. DOI: 10.1038/nrn3114
13. Govindpani K, McNamara LG, Smith NR et al. Vascular Dysfunction in Alzheimer’s Disease: A Prelude to the Pathological Process or a Consequence of It? J Clin Med 2019; 8: 651. DOI: 10.3390/jcm8050651
14. Bennett DA. Mixed pathologies and neural reserve: Implications of complexity for Alzheimer disease drug discovery. PLoS Med 2017; 14 (3): 1–4 e1002256. DOI: 10.1371/journal.pmed.1002256
15. Alvarez-Guerra M, Bertholom N, Garay RP. Selective blockade by nicergoline of vascular responses elicited by stimulation of alphaiA-adrenoceptor subtype in the rat. Fundam Clin Pharmacol 1999; 13 (1): 50–8.
16. Carfagna N, Di Clemente A, Cavanus S et al. Modulation of hippocampal ACh release by chronic nicergoline treatment in freely moving young and aged rats. Neurosci Lett 1995; 197: 195–8.
17. Winblad B, Fioravanti M, Dolezal T et al. Therapeutic use of nicergoline. Clin Drug Investig 2008; 28 (9): 533–52.
18. Fioravanti M, Flicker L. Efficacy of nicergoline in dementia and other age associated forms of cognitive impairment. Cochrane Database Syst Rev 2001; 4: CD003159.
19. Im JJ, Jeong HS, Park JS et al. Changes in Regional Cerebral Perfusion after Nicergoline Treatment in Early Alzheimer's Disease: A Pilot Study. Dement Neurocogn Disord 2017; 16 (4): 104–9. DOI: 10.12779/dnd.2017.16.4.104
20. Winblad B, Bonura ML, Rossini BM, Battaglia A. Nicergoline in the treatment of mild-to-moderate Alzheimer’s disease: a European multicentre trial. Clin Drug Invest 2001; 21 (9): 621–32.
21. Hao M, Ren X, Guo S et al. A Meta-analysis on nicergoline in the treatment of cognitive impairment. J of Shanxi Medical University 2017; 5: 479–84.
22. Пономарева Е.В. Применение ницерголина (Cермиона) в комплексной терапии деменций позднего возраста в амбулаторной практике. Психиатрия. 2017; 73 (1): 49–59. / Ponomareva E.V. Primenenie nitsergolina (Cermiona) v kompleksnoi terapii dementsii pozdnego vozrasta v ambulatornoi praktike. Psikhiatriia. 2017; 73 (1): 49–59. [in Russian]
23. Nappi G, Bono G, Merlo P et al. Long-Term Nicergoline Treatment of Mild to Moderate Senile Dementia: Results of a Multicentre, Double-Blind, Placebo-Controlled Study. Clin Drug Investig 1997; 13 (6): 308–16. DOI: 10.2165/00044011-199713060-00003
24. Fioravanti M, Nakashima T, Xu J, Garg A. A systematic review and meta-analysis assessing adverse event profile and tolerability of nicergoline. BMJ Open 2014; 4 (7): e005090. DOI: 10.1136/bmjopen-2014-005090
25. Bachurin SO, Gavrilova SI, Samsonova A et al. Mild cognitive impairment due to Alzheimer disease: Contemporary approaches to diagnostics and pharmacological intervention. Pharmacol Res 2018; 129: 216–26. DOI: 10.1016/j.phrs.2017.11.021
26. Jongsiriyanyong S, Limpawattana P. Mild Cognitive Impairment in Clinical Practice: A Review Article. Am J Alzheimers Dis Other Demen 2018; 33 (8): 500–7. DOI: 10.1177/1533317518791401
22 августа 2019
Количество просмотров: 4681


