Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Резюме
Со времени появления в конце 2019-го года инфекционной болезни, вызванной новым коронавирусом SARS-CoV-2, и по настоящее время (июнь 2022 года) — в мире переболели этой болезнью, получившей название COVID-19, уже более 537 миллионов человек. На сегодняшний день, помимо острого COVID-19 на первый план для системы мирового здравоохранения всё в большей мере начинает выходить борьба с отдалёнными последствиями перенесённого COVID-19 — то есть с так называемым постковидным синдромом.
Актуальность этой проблемы обусловлена тем, что у очень большого процента переболевших COVID-19 (по разным данным — от 50% до 80% от общего их числа) на протяжении многих недель, многих месяцев и даже нескольких лет после выздоровления от острой фазы болезни — наблюдаются многообразные как нейропсихиатрические, так и общесоматические симптомы, и жалобы, которые служат для этих пациентов причиной повторных обращений за медицинской помощью.
В данной статье мы рассматриваем обзор литературы, касающиеся терапии постковидного синдрома, а также новые данные, касающиеся действия препарата флувоксамин в отношении Сигма-1 рецепторов. Описываются механизмы развития воспалительных постковидных нейро-психиатрических и соматических осложнений, а также механизмы активации Сигма-1 рецепторов и их влияние на снижение продукции цитокинов и сосудистого воспаления, как основы развития постковидных осложнений. Мы также представляем клинический случай из нашей собственной практики, иллюстрирующий данный тезис.
Ключевые слова: COVID-19, SARS-CoV-2, коронавирус, постковидный синдром, нейровоспаление, депрессия, тревога, инсомния, флувоксамин, сигма-1 рецептор.
Для цитирования: П.В. Морозов, Ю.В. Быков, Р.А. Беккер. Постковидный синдром и его лечение: новая роль Сигма-1 рецепторов и флувоксамина
(Обзор литературы и описание клинического случая). Психиатрия и психофармакотерапия. 2022; 3: 33–47.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2023
Постковидный синдром и его лечение: новая роль Сигма-1 рецепторов и флувоксамина №03 2023
Резюме
Со времени появления в конце 2019-го года инфекционной болезни, вызванной новым коронавирусом SARS-CoV-2, и по настоящее время (июнь 2022 года) — в мире переболели этой болезнью, получившей название COVID-19, уже более 537 миллионов человек. На сегодняшний день, помимо острого COVID-19 на первый план для системы мирового здравоохранения всё в большей мере начинает выходить борьба с отдалёнными последствиями перенесённого COVID-19 — то есть с так называемым постковидным синдромом.
Актуальность этой проблемы обусловлена тем, что у очень большого процента переболевших COVID-19 (по разным данным — от 50% до 80% от общего их числа) на протяжении многих недель, многих месяцев и даже нескольких лет после выздоровления от острой фазы болезни — наблюдаются многообразные как нейропсихиатрические, так и общесоматические симптомы, и жалобы, которые служат для этих пациентов причиной повторных обращений за медицинской помощью.
В данной статье мы рассматриваем обзор литературы, касающиеся терапии постковидного синдрома, а также новые данные, касающиеся действия препарата флувоксамин в отношении Сигма-1 рецепторов. Описываются механизмы развития воспалительных постковидных нейро-психиатрических и соматических осложнений, а также механизмы активации Сигма-1 рецепторов и их влияние на снижение продукции цитокинов и сосудистого воспаления, как основы развития постковидных осложнений. Мы также представляем клинический случай из нашей собственной практики, иллюстрирующий данный тезис.
Ключевые слова: COVID-19, SARS-CoV-2, коронавирус, постковидный синдром, нейровоспаление, депрессия, тревога, инсомния, флувоксамин, сигма-1 рецептор.
Для цитирования: П.В. Морозов, Ю.В. Быков, Р.А. Беккер. Постковидный синдром и его лечение: новая роль Сигма-1 рецепторов и флувоксамина
(Обзор литературы и описание клинического случая). Психиатрия и психофармакотерапия. 2022; 3: 33–47.
Abstract
Since the first appearance at the end of 2019 new infectious disease, which was caused by the new SARS-CoV-2 coronavirus, and to the present time (June 2022) — more than 537 million people worldwide have been diagnosed with this new disease. Nowadays, the fight against the long-term consequences of the COVID-19, that is, of the so-called long COVID, or post-COVID syndrome, is increasingly beginning to be one of the priorities for the global healthcare system. The actuality of this problem lies in the fact that a very large percentage of patients who have successfully recovered from acute phase of COVID-19 disease (according to various sources — from 50% to 80% of their total number) continue to suffer from diverse, both neuropsychiatric and somatic symptoms and complaints for weeks, months or, in some cases, even several years after initial recovery. Those symptoms and complaints then serve as a reason for these patients to repeatedly seek for more medical help.
In this article, we review the literature concerning the treatment of post-COVID syndrome, and new role of Sigma-1 receptors and fluvoxamine. We review the mechanisms of long COVID inflammation and neuropsychiatric and somatic complications, as well as the mechanisms of activation of Sigma-1 receptors and their effect on the reduction of cytokine production and vascular inflammation, as the basis for the development of post-COVID complications. We also present a clinical case from our own practice illustrating this thesis.
Keywords: COVID-19, SARS-CoV-2, coronavirus, long COVID, neuroinflammation, depression, anxiety, insomnia, fluvoxamine, sigma-1 receptor.
For citation: P.V. Morozov, Yu.V. Bykov, R.A. Bekker. Long COVID and its treatment: new role of Sigma-1 receptors and fluvoxamine (A Literature Review and a Clinical Case). Psychiatry and psychopharmacotherapy. 2022; 3: 33–47.
Введение
(Обоснование актуальности)
Со времени появления в конце 2019-го года первых тревожных сообщений, которые исходили из китайской провинции Ухань, об эпизодах новой, ранее неизвестной человечеству, инфекционной болезни, вызванной новым коронавирусом SARS-CoV-2, и по настоящее время (июнь 2022 года) – в мире переболели этой болезнью, получившей название COVID-19, уже более 537 миллионов человек. С тех пор мир пережил три основных волны пандемии COVID-19 [Wiersinga WJ et al, 2020; Torres I et al, 2020; Беккер РА, Быков ЮВ, 2021; Our World In Data, 2022].
Усилия мировых правительств по обеспечению вакцинации против SARS-CoV-2, а также по введению жёстких карантинных мер – позволили в значительной мере погасить пандемию. Однако более медленный, в целом уже не носящий эпидемического характера, рост количества заболевших COVID-19 продолжается и по сей день [Wiersinga WJ et al, 2020; Torres I et al, 2020; Беккер РА, Быков ЮВ, 2021; Our World In Data, 2022].
Вместе с тем, по мере угасания собственно пандемии COVID-19, на первый план для системы мирового здравоохранения всё в большей мере начинает выходить борьба с отдалёнными последствиями перенесённого COVID-19 – то есть с так называемым постковидным синдромом [Wiersinga WJ et al, 2020; Torres I et al, 2020; Беккер РА, Быков ЮВ, 2021; Our World In Data, 2022].
Актуальность этой проблемы обусловлена тем, что у очень большого процента переболевших COVID-19 (по разным данным – от 50% до 80% от общего их числа) на протяжении многих недель, многих месяцев и даже нескольких лет после выздоровления от острой фазы болезни – наблюдаются многообразные как нейропсихиатрические, так и общесоматические симптомы и жалобы, которые служат для этих пациентов причиной повторных обращений за медицинской помощью [Wiersinga WJ et al, 2020; Беккер РА, Быков ЮВ, 2021].
Принято считать, что если симптомы сохраняются в течение более чем 3 недель после выздоровления от острой фазы болезни, то у данного пациента можно диагностировать постковидный синдром [Amenta EM et al, 2020].
Клиническая симптоматика постковидного синдрома
Детальное описание всех тех многообразных симптомов, которые могут наблюдаться у разных пациентов в рамках постковидного синдрома, уже было дано в одной из наших предыдущих статей, посвящённых этому же синдрому, поэтому здесь мы не будем повторяться и дадим лишь краткое их описание [Беккер РА, Быков ЮВ, 2021].
Постковидный синдром (диагноз, внесённый в МКБ-10 под кодом U09.9 как «Состояние после COVID-19 неуточнённое») – это клинически гетерогенная группа состояний разной степени тяжести и разной продолжительности. Она включает в себя постинфекционный синдром хронической усталости (СХУ), постреанимационный синдром, психологические последствия длительной и тяжёлой госпитализации и/или пребывания в отделении реанимации и интенсивной терапии, а также постковидные дисфункции в самых разных системах организма, включая центральную нервную систему (ЦНС), периферическую нервную систему (ПНС), особенно её вегетативный отдел, или вегетативную нервную систему (ВНС), сердечно-сосудистую систему (ССС), желудочно-кишечный тракт (ЖКТ), систему органов дыхания, опорно-двигательную систему, эндокринную систему и другие [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Показано, что от 10% до 65% пациентов, перенёсших острую фазу COVID-19 в лёгкой или средней тяжести формах, проявляют те или иные симптомы постковидного синдрома спустя 12 и более недель после выздоровления от острой фазы заболевания. Среди пациентов, переболевших COVID-19 в тяжёлой или очень тяжёлой форме, этот процент ещё выше [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Наиболее распространёнными и стойкими проявлениями постковидного синдрома спустя 6 месяцев после выздоровления от острой фазы COVID-19 оказались такие симптомы, как быстрая утомляемость, физическая слабость, раздражительность, одышка, тревожность, депрессия, нарушения концентрации внимания, нарушения сна и когнитивных функций, особенно памяти, синусовая тахикардия, экстрасистолы, а также головные боли или «летучие» боли во всём теле – в животе, в мышцах и/или суставах. Пациенты, страдающие постковидным синдромом, предъявляют в среднем около 14 различных жалоб [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Значительное место среди жалоб, предъявляемых пациентами, страдающими постковидным синдромом – занимают жалобы именно на психические и неврологические нарушения [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Воспалительная гипотеза этиопатогенеза постковидного синдрома
За два с половиной года, прошедшие с момента первого описания новой коронавирусной болезни COVID-19 и обнаружения вскоре того факта, что эта болезнь нередко оставляет после себя те или иные долгосрочные последствия – было выдвинуто множество гипотез об этиопатогенезе постковидного синдрома [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Мы кратко осветим лишь одну из них, которая в настоящее время является наиболее общепринятой из всего множества таких гипотез, и одновременно – представляет интерес именно в контексте данной статьи [Беккер РА, Быков ЮВ, 2021].
Эта гипотеза связывает проявления постковидного синдрома с длительной персистенцией воспалительных иммунопатологических сдвигов, первоначально вызванных инфицированием вирусом SARS-CoV-2, с патологической гиперреактивностью иммунной системы, с неконтролируемым, длительным, продолжающимся уже в отсутствие самого вируса, воспалением и повреждением тканей и/или с запуском вирусом неких аутоиммунных процессов [Mehta P et al, 2019; Asif M et al, 2020; Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Эта гипотеза опирается, среди прочего, на тот факт, что повреждения лёгких и других органов, наблюдаемые во время острой фазы COVID-19 – тоже в большей мере связаны с гиперергической реакцией иммунной системы организма, с чрезмерной активацией воспаления и с цитокиновым штормом, чем с собственно повреждающим действием самого вируса на клетки различных органов и тканей [Mehta P et al, 2019; Asif M et al, 2020; Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Принято считать, что геморрагические, гипоксические, метаболические и воспалительные повреждения ЦНС, которые могут возникать как в результате нарушения функций ССС, системы внешнего дыхания, печени и почек, так и вследствие прямого нейроинвазивного и нейротоксического действия вируса SARS-CoV-2, обладающего способностью проникать в ЦНС через обонятельный тракт и/или через нарушенный вследствие системного воспаления и цитокинового шторма гематоэнцефалический барьер (ГЭБ) – являются одними из основных причин развития постковидного синдрома. Научные данные по этому поводу накапливаются быстрыми темпами [Tang SW et al, 2022].
В мировой научной литературе, посвящённой COVID-19 и постковидному синдрому, отмечается всплеск интереса к изучению эффективности и безопасности в их лечении различных психотропных препаратов, активирующих Сигма-1 рецепторы, и прежде всего – наиболее высокопотентного их агониста, антидепрессанта (АД) из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) – флувоксамина. Множатся литературные сообщения о защитных, противовоспалительных и иммуномодулирующих эффектах флувоксамина как в острой фазе COVID-19, так и при постковидном синдроме [Tang SW et al, 2022].
Данная гипотеза даёт основания предполагать, что в лечении постковидного синдрома применение иммуномодулирующих и/или противовоспалительных препаратов, и в частности флувоксамина – будет иметь такое же значение, как и в лечении острой фазы заболевания COVID-19 [Mehta P et al, 2019; Asif M et al, 2020; Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Краткий обзор мировых рекомендаций
и протоколов по лечению постковидного синдрома
Поскольку постковидный синдром является мультисиндромным заболеванием, которое может проявляться симптомами очень многообразных нарушений со стороны самых разных органов и систем организма (вовсе не только психическими и неврологическими симптомами, такими, как депрессия, тревожность, диссомнические нарушения) – то мы решили привести здесь краткие выдержки из протоколов и рекомендаций по лечению постковидного синдрома, выпущенных несколькими наиболее авторитетными в мире медицинскими организациями.
Мы надеемся, что это поможет практикующим психиатрам и врачам других специальностей лучше ориентироваться как в общих подходах к ведению пациентов с постковидным синдромом, так и в лечении сопутствующих нарушений в работе различных органов и систем у этих пациентов, а не только в специфической психотропной терапии по поводу постковидной депрессии, постковидной астении или тревоги, постковидных диссомнических нарушений.
Так, в Британии авторитетный Национальный Институт Здравоохранения и Передового опыта (National Institute for Health and Care Excellence, NICE) в самом последнем (от 2021 года) пересмотре рекомендаций NG 188 по лечению постковидного синдрома – содержит много указаний относительно обследования пациентов с этим синдромом, но почти не содержит каких-либо конкретных указаний относительно их фармакологического лечения. Рекомендации NG 188 содержат лишь общие указания на то, что «программы реабилитации для пациентов с постковидным синдромом должны быть индивидуальными и адаптированными к потребностям каждого конкретного пациента» [NICE guideline NG188, 2021; Venkatesan P, 2021].
Далее в тексте рекомендаций NG 188 указывается, что, «поскольку не было представлено достаточных доказательств эффективности и безопасности того или иного лекарственного средства или метода реабилитации пациентов с постковидным синдромом, чтобы можно было рекомендовать конкретные критерии для отбора и направления пациентов на то или иное лечение или реабилитацию, то рабочая группа согласилась с тем, что правильный и необходимый в каждом конкретном случае уровень и объём медицинского вмешательства должен быть согласован между врачом и пациентом путём совместного принятия решения, после комплексной оценки врачом клинического состояния пациента, а также сравнительных рисков и преимуществ различных вариантов доступных при этом заболевании медицинских вмешательств» [NICE guideline NG188, 2021; Venkatesan P, 2021].
А в США не менее авторитетная правительственная медицинская организация – Центр по Контролю и Профилактике Заболеваний (Center for Disease Control and Prevention, CDC) – также в целом рекомендует индивидуализированный подход к лечению каждого конкретного пациента с постковидным синдромом. Рекомендации CDC, как и рекомендации NICE, не предписывают применение для лечения пациентов с постковидным синдромом каких-либо конкретных лекарственных средств, но призывают дозировать и контролировать физические нагрузки в соответствии с индивидуальными возможностями и потребностями каждого конкретного пациента [CDC guideline, 2021].
Ниже мы приводим некоторые выдержки из обновлённых рекомендаций CDC от 2021 года по лечению постковидного синдрома.
«Для большинства пациентов с постковидным синдромом целью их лечения является оптимизация их биологического, социального, семейно-бытового и профессионального функционирования и их общего качества жизни. В идеале врач общей практики, проконсультировавшись с соответствующими специалистами, должен разработать комплексный индивидуализированный план лечения для такого пациента, который будет основан на имеющихся у этого конкретного пациента симптомах и жалобах в рамках постковидного синдрома, на имеющихся у него тех или иных сопутствующих (коморбидных или преморбидных) психических и соматических заболеваниях, на особенностях личной истории, семейной, трудовой и социальной ситуации конкретного пациента, и на тех целях, которых пациент надеется достичь в результате лечения. Постановка реалистичных и достижимых терапевтических целей при помощи совместного принятия решения после обсуждения между врачом и пациентом может быть очень полезной» [CDC guideline, 2021].
Далее рекомендации CDC указывают, что: «Для обеспечения адекватности процесса постановки терапевтических целей и последующего процесса принятия диагностических и терапевтических решений – очень важна прозрачность в общении между врачом и пациентом. Врач должен проинформировать пациента о том, что ни природа, причинные факторы и механизмы развития, ни методы лечения и реабилитации постковидных состояний ещё не изучены в достаточной мере, и заверить пациента в том, что по мере появления новой научной информации пациент будет продолжать получать наилучшую возможную в каждый конкретный момент времени медицинскую и психологическую помощь. Врач также должен в процессе лечения продолжать периодически обсуждать с пациентом достигнутый прогресс в лечении, характер и степень тяжести сохраняющихся у пациента проблем и жалоб, и при необходимости в сотрудничестве с пациентом оперативно корректировать цели, стратегию и тактику лечения» [CDC guideline, 2021].
Рекомендации CDC также указывают, что «У пациентов с постковидным синдромом нередко наблюдаются различные симптомы, природу, причины и механизмы возникновения которых у данного пациента нельзя объяснить объективными данными медицинских обследований, либо тяжесть которых несоразмерна масштабам нарушений, выявленных у этого пациента при объективном медицинском обследовании. Тем не менее, наличие и степень тяжести у пациента этих симптомов и испытываемые им страдания от их наличия не следует игнорировать, недооценивать или всецело приписывать наличию у пациента таких психических расстройств, как конверсионное, соматоформное или ипохондрическое расстройства, даже в тех случаях, когда у нас ещё нет полного понимания природы, причин и механизмов развития этих симптомов (их этиологии и патогенеза) или их прогноза (их ожидаемой продолжительности)» [CDC guideline, 2021].
Далее рекомендации CDC констатируют, что «Многие проявления постковидного синдрома можно уменьшить или даже полностью устранить с помощью тех подходов, которые ранее уже были разработаны для лечения аналогичных симптомов, возникающих в рамках других заболеваний (например, дыхательные упражнения для уменьшения симптомов одышки). Для некоторых пациентов с постковидным синдромом может быть очень полезным создание комплексного плана их реабилитации. Такой комплексный план реабилитации постковидного пациента может включать в себя такие компоненты, как физическая терапия (дозированные физические нагрузки), трудотерапия (постепенное возвращение к посильной трудовой деятельности), логопедическая и/или лингвистическая терапия (при проблемах с речью и/или с владением языком), консультирование по профориентации (подбор более подходящей работы или области деятельности), неврологическая и/или нейрокогнитивная реабилитация (при неврологических нарушениях в чувствительной и/или двигательной сферах и/или при наличии нейрокогнитивных симптомов), психоэмоциональная реабилитация и психотерапия, индивидуально подобранная фармакотерапия. Некоторым пациентам с постковидным синдромом, испытывающим значительное недомогание после физической нагрузки, может быть показан более консервативный план физической реабилитации. Таким пациентам может быть полезна консультация со специалистом по физической терапии и/или со специалистом по спортивной медицине для разработки индивидуализированного плана осторожного начала физических упражнений с учётом их переносимости и с учётом рекомендаций специалиста в плане ритма занятий и дозирования величины нагрузки. Тем не менее, постепенное, плавное возвращение к дозированным физическим упражнениям с учётом их индивидуальной переносимости и физических возможностей конкретного пациента – может быть полезным большинству пациентов с постковидным синдромом» [CDC guideline, 2021].
Рекомендации CDC также указывают, что: «Оптимальный план лечения постковидного синдрома и сопутствующих (коморбидных или преморбидных) заболеваний может также включать, при необходимости, консультации по таким компонентам здорового образа жизни, как правильное питание, налаживание режима дня, режима сна и отдыха, снижение уровня стресса (например, с помощью медитации)» [CDC guideline, 2021].
Далее пишется, что: «Ведение календаря или дневника пациента может быть очень полезным для документирования динамики изменений в состоянии здоровья и в степени тяжести проявлений постковидного синдрома у данного конкретного пациента в процессе его лечения, а также для выявления потенциальных триггеров для ухудшения его состояния, таких, как физическая, когнитивная или психоэмоциональная нагрузка, стресс, недосыпание, употребление определённых продуктов питания, алкоголя, определённых психоактивных веществ или лекарств, или дни менструации. Кроме того, такие дневники и календари также могут дать медицинским работникам более глубокое и более детализированное представление об испытываемых данным конкретным пациентом симптомах болезни в динамике, о его привычках и образе жизни, об его общем жизненном опыте и о его опыте внутреннего переживания или преломления болезни. Медицинские работники должны поощрять пациентов с постковидным синдромом сообщать врачу о появлении любых новых симптомов или об изменении прежде имевшихся у них симптомов в любую сторону, а также поощрять пациентов обсуждать с врачом любые изменения, как положительные, так и отрицательные, которые произошли в жизнедеятельности, в социальном, семейно-бытовом, академическом или профессионально-трудовом функционировании или в распорядке дня пациента» [CDC guideline, 2021].
Далее указывается, что: «У пациентов с постковидным синдромом могут наблюдаться общие симптомы, сходные с теми, которые наблюдаются у пациентов, страдающих миалгическим энцефаломиелитом или СХУ, фибромиалгией (ФМА), хронической ортостатической гипотензией (ОГ), синдромом активации тучных клеток (САТК), синдромом после болезни Лайма. Те подходы к лечению, которые оказались полезными для уменьшения выраженности симптомов при вышеуказанных расстройствах (например, управление физической активностью при недомогании после физической нагрузки, применение АД при симптомах ФМА, применение ингибиторов активации тучных клеток при симптомах САТК, применение мидодрина или флудрокортизона при симптомах ОГ и др.), возможно, могут также принести пользу некоторым пациентам с постковидным синдромом, испытывающим аналогичные симптомы» [CDC guideline, 2021].
По поводу же фармакологического лечения постковидного синдрома рекомендации CDC звучат достаточно неконкретно: «Некоторые рецептурные или отпускаемые без рецепта лекарства, а также некоторые витаминные, минеральные или аминокислотные добавки, возможно, могут оказаться полезными при определённых симптомах в рамках постковидного синдрома (например, таких, как головная боль, бессонница или беспокойство) или при наличии документированных дефицитов определённых витаминов, минералов или аминокислот, после тщательного взвешивания преимуществ и рисков от каждого конкретного вида фармакологического вмешательства» [CDC guideline, 2021].
Помимо официальных рекомендаций по лечению постковидного синдрома от правительственных организаций, таких, как американская CDC и британская NICE, существуют рекомендации по лечению постковидного синдрома и от независимых, неправительственных исследовательских групп. Например, в США создан и работает исследовательский альянс Front Line COVID-19 Critical Care Alliance (FLCCC), который ставит своей первоочередной задачей изучение эффективности и безопасности репозиционирования тех или иных уже существующих на рынке лекарств для профилактики заражения вирусом SARS-CoV-2 или для профилактики развития симптоматики заболевания COVID-19 у бессимптомных вирусоносителей SARS-CoV-2, для амбулаторного и стационарного лечения пациентов в острой фазе заболевания COVID-19, для лечения постковидного синдрома и поствакцинальных осложнений, а также разработку соответствующих протоколов [Alek Korab, 2021; FLCCC Protocol, 2022].
Интересующий нас в контексте данной статьи протокол лечения именно постковидного синдрома, предложенный альянсом FLCCC, называется I-RECOVER. Он регулярно пересматривается и обновляется исследователями из этого альянса. На момент написания данной статьи протокол I-RECOVER рекомендует в качестве первой линии терапии постковидного синдрома противовоспалительные препараты, в частности, короткий (до 2-3 недель) курс лечения преднизоном в дозе 10-15 мг/сут, с последующим плавным снижением и отменой преднизона. В качестве альтернативных или дополнительных (адъювантных) к терапии преднизоном препаратов данный протокол рекомендует либо упоминает целый ряд других препаратов с известными противовирусными (в отношении вируса SARS-CoV-2), противовоспалительными и/или иммуномодулирующими свойствами, в частности, омега-3 полиненасыщенные жирные кислоты (омега-3 ПНЖК), витамин D, витамин С, витамин K2, низкодозированный налтрексон (Low-Dose Naltrexone – LDN), ивермектин, гидроксихлорохин, мелатонин, куркумин, пробиотики и др. [Alek Korab, 2021; FLCCC Protocol, 2022].
Ко второй линии терапии постковидного синдрома авторы вышеупомянутого протокола I-RECOVER отнесли комбинацию флувоксамина 25 мг 1 раз в сутки с гипохолестеринемическим препаратом из группы статинов – аторвастатином 20-40 мг один раз в сутки. Эту комбинацию они рекомендуют применять в том случае, если на терапию преднизоном и/или одним из упомянутых выше альтернативных преднизону либо адъювантных к преднизону препаратов не было получено достаточного положительного клинического ответа к сроку 1-2 недели [Alek Korab, 2021; FLCCC Protocol, 2022].
К третьей линии терапии постковидного синдрома авторы протокола I-RECOVER отнесли применение маравирока (первоначально – антиретровирусного препарата, предназначенного для лечения и профилактики ВИЧ-инфекции, но обладающего также иммуномодулирующими свойствами; среди антиретровирусных препаратов маравирок классифицируется как ингибитор проникновения ВИЧ в клетки) в дозе 300 мг 2 раза в сутки [Alek Korab, 2021; FLCCC Protocol, 2022].
К маравироку, как третьей линии терапии постковидного синдрома, авторы протокола I-RECOVER рекомендуют прибегать в том случае, если предшествующая терапия
2-й линии (флувоксамин 25 мг/сут плюс аторвастатин
20-40 мг/сут) не дала достаточного эффекта к сроку 6-8 недель лечения [Alek Korab, 2021; FLCCC Protocol, 2022].
Детальное рассмотрение теоретических обоснований и клинической доказательной базы (или же отсутствия таковой доказательной базы) для применения каждого из упомянутых в протоколе I-RECOVER средств и методов лечения постковидного синдрома – выходит далеко за рамки данной статьи, и заняло бы слишком много места в ней.
Однако отметим, что препараты группы статинов (в частности, упомянутый в протоколе I-RECOVER аторвастатин, который в нём предлагается комбинировать с флувоксамином в качестве второй линии терапии постковидного синдрома) – обладают иммуномодулирующими и противовоспалительными свойствами. В частности, статины блокируют цитокиновые пути активации хемотаксиса и адгезии иммунокомпетентных клеток. Флувоксамин, являясь мощным агонистом сигма-1 рецепторов, также проявляет иммуномодулирующие и противовоспалительные свойства и снижает продукцию воспалительных цитокинов [Alek Korab, 2021; FLCCC Protocol, 2022].
А предложенный в протоколе I-RECOVER в качестве третьей линии терапии постковидного синдрома антиретровирусный препарат маравирок, являясь блокатором рецептора хемокинов CCR5, предотвращает активацию хемокинами иммунокомпетентных клеток, последующее перемещение активированных иммунокомпетентных клеток в зону воспаления (их хемотаксис), а затем – их адгезию к эндотелию сосудов зоны воспаления и их инфильтрацию в сам очаг воспаления (их экстравазацию) [Alek Korab, 2021; FLCCC Protocol, 2022].
Актуальность проблемы нейропсихиатрических проявлений постковидного синдрома
Поскольку данная наша статья является статьёй по психиатрии, то вполне логично, что среди многочисленных проявлений постковидного синдрома нас более всего интересуют именно нейропсихиатрические, а не какие-либо другие возможные его проявления.
Показано, что как сама пандемия COVID-19, так и её многообразные негативные социально-экономические, политические и психологические последствия привели к резкому росту распространённости в популяции депрессивных, тревожных и связанных со стрессом расстройств [Петрова НН с соавт, 2020; Морозов ПВ с соавт, 2021].
Особенно подверженными риску развития данных групп психических расстройств оказались такие подгруппы населения, как пожилые люди, пациенты с предсуществовавшими хроническими соматическими и/или психическими заболеваниями, а также медицинские работники [Петрова НН с соавт, 2020; Морозов ПВ с соавт, 2021].
Так, в частности, распространённость именно депрессивных расстройств в общей популяции за период пандемии COVID-19 значительно выросла. Она составляет, по разным данным, от 20,9% до 27,8% [Ettman CK et al, 2020; Kim SW et al, 2021].
Ещё чаще наблюдаются депрессивные расстройства среди пациентов, перенёсших COVID-19. Так, по данным М. Дженнаро с соавторами, опубликованным в 2021 году, клинически значимая депрессивная симптоматика на протяжении 3 месяцев после выздоровления от острой фазы COVID-19, наблюдалась у 35,8% респондентов [Gennaro MM et al, 2021].
При этом М. Дженнаро с соавторами отметили, что симптомы депрессии у этих пациентов сохранялись на протяжении длительного времени, в отличие от симптомов тревожности, нарушений сна и симптомов посттравматического стрессового расстройства (ПТСР), которые имели тенденцию к медленному спонтанному улучшению с течением времени [Gennaro MM et al, 2021].
Кроме того, М. Дженнаро с соавторами отметили также тенденцию к усилению или рецидиву депрессивной симптоматики у людей с психическими расстройствами в анамнезе после перенесения ими COVID-19, более высокую подверженность женщин развитию этого осложнения после COVID-19, и связь между остротой и тяжестью инфекции и выраженностью нейрокогнитивных и неврологических расстройств после выздоровления от острой фазы болезни. В частности, те или иные нарушения координации движений, исполнительная дисфункция, нарушения памяти – наблюдались у 78% респондентов в течение 3 месяцев после выздоровления от острой фазы COVID-19 [Gennaro MM et al, 2021].
Другая группа авторов отмечает, что различные постковидные психические расстройства, включая постковидную депрессию, постковидную тревогу и постковидную астению или СХУ – очень распространены среди реконвалесцентов острой фазы COVID-19, и что подобная симптоматика может, по разным оценкам, поражать от 26% до 40% пациентов, перенёсших острую фазу COVID-19, и сохраняться в течение 6 месяцев и более после выздоровления от острой фазы болезни [Huang C et al, 2021].
Распространённость симптомов тревоги в общей популяции также выросла на фоне пандемии COVID-19 и составила, по данным одной из исследовательских групп, 27,3%. Однако среди пациентов, выздоровевших от острой фазы COVID-19, распространённость симптомов тревоги оказалась ещё выше и составила 42% [Pashazadeh Kan F et al, 2021].
Из всей предшествующей истории человечества известно, что тревожная симптоматика часто впервые возникает или рецидивирует у людей именно в периоды эпидемий и пандемий, и что она может затем сохраняться в течение длительного времени и после их завершения [Bendau A et al, 2021].
Причиной резкого повышения общего уровня тревожности в популяции в период пандемии COVID-19, как и в периоды предшествующих эпидемий и пандемий, называют в первую очередь страх перед возможными последствиями пандемии – как перед возможными её последствиями для своего здоровья или для здоровья близких, так и перед её возможными социальными, экономическими и/или политическими последствиями [Bendau A et al, 2021].
Показано, что факторами риска, повышающими вероятность развития de novo, усиления или рецидива симптомов тревоги или тревожного расстройства в период пандемии COVID-19 – являются чрезмерное внимание к потреблению средств массовой информации (СМИ), принадлежность к женскому полу, работа в медицинском контексте или наличие медицинского образования, наличие предсуществовавших психических расстройств, а также более тесный контакт с вирусом, с заболевшими людьми или же перенесённое самим человеком заболевание COVID-19 [Bendau A et al, 2021].
Особая роль системного воспаления и нейровоспаления в этиопатогенезе именно постковидных депрессивных и тревожных расстройств
Давно и хорошо известно, что депрессивные и тревожные расстройства, независимо от своей изначальной причины, очень часто сопровождаются гиперактивацией иммунной системы и воспалительным ответом как на периферии (системным воспалительным ответом), так и в ЦНС (нейровоспалением) [Miller AH, 2010; Blume J et al, 2011].
В частности, при депрессивных и тревожных расстройствах часто наблюдается повышение в плазме крови и в ликворе маркеров оксидативного и нитрозативного стресса, маркеров перекисного окисления липидов, а также снижение активности антиоксидантных ферментов, и как следствие этого – повышение образования свободных радикалов (активных форм кислорода и азота) [Czarny P et al, 2018].
Также часто при депрессивных и тревожных расстройствах обнаруживаются повышенные уровни провоспалительных цитокинов и сниженные уровни противовоспалительных цитокинов в плазме крови и в ликворе, признаки воспалительной гиперактивации «стрессовой» оси ГГН, повышенные уровни в плазме крови белков острой фазы воспаления, включая С-реактивный белок (СРБ), гепсидин, гаптоглобин, α1-антитрипсин (А1АТ), кислый α1-гликопротеин (АГП). При этом никакого системного или местного воспалительного процесса известной этиологии у этих пациентов обнаружить не удаётся [Dowlati Y et al, 2010].
Верно, однако, и обратное – многие воспалительные, инфекционные, аутоиммунные заболевания, независимо от своей природы – сопровождаются повышенным риском развития депрессии и/или тревоги [Stahl SM, 2013; Ruiz P, 2017].
Существуют достаточно веские основания полагать, что вышеописанные, обнаруживаемые у значительной части пациентов с депрессивными и тревожными расстройствами, воспалительные сдвиги в плазме крови и в ликворе – являются не просто «спутниками», маркерами или следствиями депрессивного или тревожного состояния – но, напротив, сами играют важную, если не одну из ключевых, ролей в патогенезе депрессивных и тревожных состояний [Stahl SM, 2013; Ruiz P, 2017].
Целый ряд сходящихся в одной точке данных заставляет думать именно так. Например, тот факт, что в экспериментах на животных состояние, очень напоминающее депрессию у человека, можно вызвать введением бактериального липополисахарида (ЛПС), или что лечение интерферонами или интерлейкинами 1 либо 2 (важными воспалительными цитокинами) – часто вызывает у пациентов развитие ятрогенной депрессии или ятрогенного тревожного состояния. Или, например, тот факт, что воспалительные цитокины интерферон-альфа (ИФН-α) и фактор некроза опухолей-альфа (ФНО-α) оба способны активировать фермент индол-2,3-диоксигеназу (ИДО), осуществляющий катаболизм L-триптофана по так называемому кинурениновому пути с образованием нейротоксичной кинуреновой кислоты, и заодно попутно снижать биосинтез из L-триптофана таких важных для функционирования ЦНС метаболитов, как серотонин, мелатонин, никотинамид. Кроме того, воспалительные цитокины как непосредственно, так и через активацию ими оси ГГН угнетают биосинтез факторов роста нервных клеток, таких, как BDNF и NGF [Stahl SM, 2013; Ruiz P, 2017].
Эта гипотеза получила название «воспалительной гипотезы депрессий». На сегодняшний день она рассматривается как одна из основных гипотез этиопатогенеза депрессивных состояний [Stahl SM, 2013; Miller AH, Raison CL, 2016; Benedetti F et al, 2016; Ruiz P, 2017].
В свете всех этих данных, неудивительно, что связь между интенсивностью воспаления (оцениваемой по уровням ряда воспалительных маркеров и маркеров оксидативного стресса в плазме крови) – и выраженностью депрессивных, тревожных и нейрокогнитивных расстройств была обнаружена и у пациентов с постковидным синдромом, и что эта корреляция сохранялась и спустя 3 месяца после окончания острой фазы болезни и выписки из больницы [Gennaro MM et al, 2021].
Ряд исследований показывает, что не только непосредственно сам гипериммунный ответ организма на инфицирование вирусом SARS-CoV-2, но и вызываемая психологическими стрессорами, связанными с пандемией, гиперактивность «стрессовой» оси ГГН – могут вызывать или активизировать хронические воспалительные процессы в организме, и приводить к повышению маркеров воспаления, оксидативного и нитрозативного стресса в плазме крови и в ликворе. А это, в свою очередь, может способствовать усилению процессов нейровоспаления, нейроповреждения и нейродегенерации, усилению апоптоза нейронов и клеток нейроглии, ослаблению процессов нейрогенеза и нейропластичности, процессов аксоно-, дендрито- и синаптогенеза, и, как следствие – может способствовать возникновению различных психиатрических и неврологических осложнений перенесённого COVID-19, то есть – способствовать развитию нейропсихиатрических симптомов постковидного синдрома [Bektas A et al, 2020; Gennaro MM et al, 2021].
 Например, в исследовании Koumpa (2020) было показано, что у реконвалесцентов острой фазы COVID-19 спустя 1-3 месяца после выписки из стационара всё ещё обнаруживаются повышенные уровни интерлейкина-4 (ИЛ-4) в плазме крови и в ликворе, и что этот показатель хорошо коррелирует у данной категории пациентов с показателями депрессии и тревоги по Госпитальной шкале (HADS). Это может указывать как на продолжающееся, длительно персистирующее нейровоспаление и системное воспаление у пациентов, перенёсших острую фазу COVID-19, так и на роль системного воспаления и нейровоспаления в патогенезе именно постковидной депрессии и постковидной тревоги [Koumpa FS et al, 2020].
Например, в исследовании Koumpa (2020) было показано, что у реконвалесцентов острой фазы COVID-19 спустя 1-3 месяца после выписки из стационара всё ещё обнаруживаются повышенные уровни интерлейкина-4 (ИЛ-4) в плазме крови и в ликворе, и что этот показатель хорошо коррелирует у данной категории пациентов с показателями депрессии и тревоги по Госпитальной шкале (HADS). Это может указывать как на продолжающееся, длительно персистирующее нейровоспаление и системное воспаление у пациентов, перенёсших острую фазу COVID-19, так и на роль системного воспаления и нейровоспаления в патогенезе именно постковидной депрессии и постковидной тревоги [Koumpa FS et al, 2020].
В канву этой гипотезы хорошо ложится также тот статистический факт, что у тех пациентов, у которых заболевание COVID-19 протекало тяжело, с выраженными респираторными симптомами, высокой лихорадкой, гипоксией, нарушениями сознания, выраженной интоксикацией, проявлениями цитокинового шторма или органной недостаточности, или у пациентов, у которых течение болезни потребовало госпитализации в отделение реанимации и/или в отделение интенсивной терапии, применения высоких доз ГК, антицитокиновых препаратов, кислородной поддержки или искусственной вентиляции лёгких (ИВЛ) – с большей вероятностью отмечаются после выздоровления длительные и/или тяжёлые нейропсихиатрические последствия перенесённого COVID-19, например, длительная и/или тяжёлая депрессия, длительная и/или тяжёлая тревожность, манифестация de novo или рецидив обсессивно-компульсивного расстройства (ОКР) – вероятно, по механизму, сходному с механизмом манифестации или рецидива ОКР после стрептококковых и некоторых вирусных инфекций (так называемый PANDAS синдром), и даже – необычно раннее начало болезни Паркинсона (БП) или болезни Альцгеймера (БА) после перенесения COVID-19 [Ortelli P et al, 2021].
Одна из причин этого явления заключается в высокой нейротропности, нейроинвазивности и нейротоксичности самого вируса SARS-CoV-2 (более высокой, чем даже у его ближайшего родственника – вируса SARS-CoV) [Ortelli P et al, 2021].
Другая же причина заключается в том, что повышение в периферической крови воспалительных цитокинов и других медиаторов воспаления – например, простагландинов и лейкотриенов, усиление оксидативного и нитрозативного стресса на периферии – потенциально способно нарушить целостность ГЭБ [Ortelli P et al, 2021].
Проникая через ГЭБ, эти вещества запускают каскад нейровоспаления, нейроповреждения и нейродегенерации уже в самой ЦНС. А это приводит к многообразным вторичным неблагоприятным изменениям в синаптической нейропередаче, включая такие важные нейромедиаторные системы, как глутаматергическая система, система γ-аминомасляной кислоты (ГАМКергическая), все три моноаминергические и холинергическая системы [Ortelli P et al, 2021].
Вирус SARS-CoV-2 имеет свойство реплицироваться в промежуточном компартменте между эндоплазматическим ретикулумом (ЭПР) и комплексом Гольджи. Это приводит к стрессу ЭПР, митохондриальному окислительному стрессу, митохондриальной дисфункции и к гиперпродукции повреждённой клеткой различных сигнальных молекул, в частности, воспалительных цитокинов. Эти воспалительные цитокины, в свою очередь, запускают в ближайших и отдалённых от места повреждения клетках каскад чрезмерной, гиперергической воспалительной реакции [Hashimoto K, 2021].
А изучение механизмов взаимодействия между вирусом SARS-CoV-2 и клетками организма хозяина, в том числе – взаимодействия, опосредованного активацией ренин-ангиотензин-альдостероновой системы (РААС), системы эндотелина-1, сигма-1 рецепторов (S1R), каскадов воспалительных цитокинов, и аналогичных изменений в тех же системах, которые происходят при развитии ПТСР любого генеза – позволило одной исследовательской группе сформулировать гипотезу о ПТСР (причём не только о постковидном ПТСР, а вообще о ПТСР как таковом), как о системном воспалительном заболевании, повреждающем, в первую очередь, эндотелий сосудов, и о том, что агонисты сигма-1 рецепторов (S1R агонисты), такие, как флувоксамин – могут быть особенно полезными в лечении ПТСР, в силу своего противовоспалительного, иммуномодулирующего и ангиопротективного (эндотелиопротективного) действия [Sfera A et al, 2021].
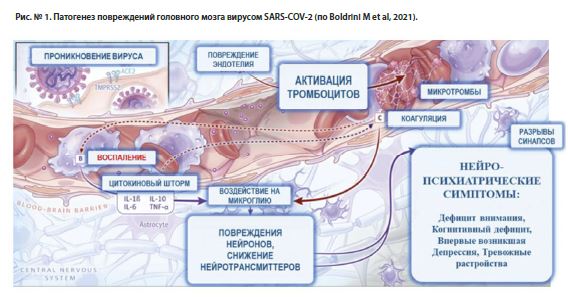
Один из основных механизмов развития постковидного синдрома связывают с воспалением эндотелия сосудов, вызванным вирусной нагрузкой. Было показано, что значительное количество активированных моноцитов содержат спайк-белок (белок S1) и другие уже не способные к размножению частицы коронавируса SARS-CoV-2 даже спустя 15 месяцев после первичного заражения. Активированные моноциты разносят белки вируса SARS-CoV-2 по всему телу, связываются с эндотелием кровеносных сосудов и вызывают его воспаление. Это, в свою очередь, приводит к патологическому повышению проницаемости стенок кровеносных сосудов и развитию локального отёка, а также к повышению вероятности запуска каскада локальных микротромбозов как реакций на повреждение эндотелия сосудов, с соответствующими последствиями для тех участков живых тканей (в том числе для ткани мозга), которые в результате тромбоза остаются без кровоснабжения [Boldrini M et al, 2021; Patterson BK et al, 2022].
Кроме того, активированные моноциты, нагруженные фрагментами белков вируса SARS-CoV-2, могут проникать через повреждённый эндотелиальным воспалением ГЭБ, и запускать в мозгу каскад нейровоспаления (воспалительную реакцию микроглии). Это приводит к снижению в мозгу уровней моноаминов и трофических факторов, к утрате синапсов, к развитию оксидативного и нитрозативного стресса, свободнорадикального повреждения нервных и глиальных клеток, к повышению внеклеточных концентраций глутамата и N-метил-D-аспартата (NMDA) и к развитию эксайтотоксичности, и в конечном итоге – к апоптотической гибели нервных и глиальных клеток мозга (см. рис. № 1) [Boldrini M et al, 2021].
Сигма-1 рецепторы и их роль в терапии постковидных нарушений
Сигма-1 рецепторы – это важные сигнальные и рецепторные белки, которые расположены в эндоплазматическом ретикулуме (ER). Они являются мощными ингибиторами продукции воспалительных цитокинов и свободных радикалов (активных форм кислорода и азота). Кроме того, они также играют важную роль в модуляции внутриклеточной передачи сигналов и взаимодействуют со множеством цитоплазматических и мембранных рецепторов, ионных каналов, киназ и других ферментов, а также липидов клетки [Rosen DA, 2019].
Изменения в функциях и уровне экспрессии сигма-1 рецепторов, как сейчас полагают, могут играть важную роль в этиопатогенезе многих психических и неврологических расстройств, в том числе – аффективных и когнитивных расстройств, шизофрении, хронических болевых синдромов, нейродегенеративных заболеваний, ряда химических зависимостей (например, кокаиновой и метамфетаминовой) [Gris G et al, 2015; Ruscher K, Wieloch T, 2015; Hong WC et al, 2017; Ruiz-Cantero MC et al, 2021; Sałaciak K, Pytka K, 2022].
При любом внутриклеточном стрессе (таком, как вирусное повреждение, воздействие на клетку экзогенных или эндогенных токсинов, ионизирующей радиации, свободных радикалов, оксидативный или нитрозативный стресс, осмотический или температурный стресс, эксайтотоксичность в результате перевозбуждения клетки, гипоксия и др.), или при стимуляции лигандами сигма-1 рецепторы перемещаются с мембран митохондрий в направлении эндоплазматической ретикулярной сети, а также в направлении внутренней стороны плазматической мембраны клетки с целью оказания регулирующих влияний на активность целого ряда важных функциональных белков клетки, таких, как ионные каналы, рецепторы, киназы и другие внутриклеточные ферменты [Su TP et al, 2010; 2016].
Таким образом, сигма-1 рецепторы служат регуляторами, модуляторами и координаторами внутриклеточной передачи сигналов между органеллами клетки, как локально – между митохондриями и эндоплазматическим ретикулумом, так и глобально и удалённо – между клеткой и внешней средой (через модуляцию активности рецепторов, ионных каналов, киназ и других ферментов, расположенных на внешней стороне плазматической мембраны клетки) [Su TP et al, 2010; 2016].
В ЦНС активность сигма-1 рецепторов косвенно регулирует работу целого ряда нейромедиаторных систем, в том числе таких важных, как NMDA-опосредованная глутаматергическая, ГАМКергическая, серотонинергическая, норадренергическая и дофаминергическая системы, система мозгового нейротрофического фактора (BDNF) [Skuza G, 2012],
Кроме того, активность сигма-1 рецепторов играет роль в таких важных физиологических процессах в ЦНС, как модуляция восприятия боли, процессы нейровоспаления и нейродегенерации, синаптической дегенерации, апоптоза нервных клеток и, наоборот, процессы нейрогенеза, нейропластичности, синаптогенеза и синаптической пластичности, процессы нейрорепарации и нейрорегенерации или, как их ещё называют, процессы нейроремонта (восстановления ЦНС после тех или иных повреждений) [Kourrich S et al, 2012; Sanchez EL, Lagunoff M, 2015; Ruscher K, Wieloch T, 2015; Jia J et al, 2018; Jerčić L et al, 2019; Lisak RP et al, 2020].
В свете того, что COVID-19 и постковидный синдром являются мультиорганными и мультисистемными заболеваниями, поражающими многие различные органы и системы нашего организма, важно отметить, что сигма-1 рецепторы обильно экспрессируются, помимо ЦНС, также в ткани лёгких, в печени, в надпочечниках, в яичках у мужчин и в яичниках у женщин, в почках, в сердечной мышце и в эндотелии сосудов [Hashimoto K, 2013; 2021; Vela JM, 2020; Dalwadi DA et al, 2021].
Также следует отметить, что агонисты сигма-1 рецепторов, такие, как флувоксамин, значительно повышают уровень мозгового нейротрофического фактора (BDNF) в ЦНС, и поэтому они могут быть полезны при лечении постковидного синдрома и различных повреждений ЦНС (нейродегенеративных заболеваний, последствий черепно-мозговых травм, инсультов и др.), вне зависимости от их угнетающего влияния на процессы нейровоспаления [Hashimoto K, 2013; 2021; Dalwadi DA et al, 2021].
На сегодняшний день агонисты сигма-1 рецепторов активно разрабатываются в качестве перспективных терапевтических агентов, способных, с одной стороны, стимулировать процессы нейрогенеза, нейропластичности и нейрорепарации (нейровосстановления, нейроремонта), а с другой – угнетать процессы нейровоспаления, нейроповреждения и нейродегенерации. Оба этих свойства агонистов сигма-1 рецепторов – весьма важны для эффективного лечения постковидных осложнений [Brimson JM et al, 2020; Vela JM, 2020; Hashimoto K, 2021].
Флувоксамин как перспективный препарат для лечения COVID-19 и постковидного синдрома
Краткая общая характеристика флувоксамина
Флувоксамин – это АД из группы СИОЗС, который широко применяется в мире начиная с 1990-х годов [Ishima T et al, 2014; Hashimoto K, 2015; Cobos EJ et al, 2020].
Специфической особенностью фармакодинамики флувоксамина, резко отличающей его от всех остальных АД и в том числе – от всех прочих препаратов класса СИОЗС, является его сильный и высокоаффинный агонизм по отношению к сигма-1 рецепторам (S1R; флувоксамин, вообще, является самым высокоаффинным из всех ныне клинически применяемых агонистов S1R, причём он является таковым вовсе не только среди АД, но и среди всех лекарств; более высокоаффинные S1R агонисты либо пока находятся на ранних стадиях разработки для клинического применения, либо вообще имеют сугубо экспериментальное применение, без перспектив когда-либо «войти в клиническую практику») [Ishima T et al, 2014; Hashimoto K, 2015; Cobos EJ et al, 2020].
Эта особенность фармакодинамики флувоксамина предопределяет и ряд особенностей его клинического профиля как АД. В частности, с сильным S1R агонизмом флувоксамина – связывают сильное и быстро наступающее (нередко уже с первых дней терапии) анксиолитическое действие флувоксамина. Также стоит упомянуть влияние флувоксамина на повышение концентрации мелатонина, и связываемую с этим, его способность быстро, нередко уже с первой недели терапии, нормализовать нарушенные сон и циркадные ритмы [Беккер РА, Быков ЮВ, 2019 (a), (b)].
С сильным S1R агонизмом флувоксамина связывают также его прокогнитивные и антиамнестические свойства, выгодно отличающие его от других СИОЗС (способность флувоксамина улучшать нарушенные при депрессиях и тревожных состояниях когнитивные функции и память, что, кстати, немаловажно при постковидных депрессиях с учётом высокой частоты нейрокогнитивных нарушений при них) [Беккер РА, Быков ЮВ, 2019 (a), (b)].
С косвенным нормализующим действием флувоксамина на работу дофаминергической системы мозга, также реализующимся через его сильный S1R агонизм, связывают как его специфическое анти-ангедоническое действие (его способность эффективно устранять ангедонию, как один из ключевых симптомов депрессии, чего не наблюдается при применении других СИОЗС, в целом склонных давать некоторое «притупление эмоций»), так и его своеобразное антипсихотическое действие – его эффективность в монотерапии (без добавления антипсихотика – АП) при психотических формах депрессий. Более того, показано даже, что флувоксамин в монотерапии, без добавления АП, может быть эффективен при делириозных состояниях, например, у послеоперационных пациентов или у пациентов с БА [Furuse T, Hashimoto K, 2010; Беккер РА, Быков ЮВ, 2019 (a), (b)].
С наличием у флувоксамина сильной S1R агонистической активности связывают также его анальгетические свойства (которых, опять-таки, не наблюдается у других СИОЗС, в отличие от трициклических АД – ТЦА – или селективных ингибиторов обратного захвата серотонина и норадреналина – СИОЗСиН; последние два класса АД, впрочем, переносятся в среднем хуже, чем флувоксамин). Стоит отметить, что анальгетическая активность флувоксамина тоже может оказаться весьма полезной именно в контексте лечения постковидного синдрома, учитывая нередкую представленность в его картине различных болевых синдромов (головных болей, болей в животе, летучих болей в мышцах и/или суставах по типу фибромиалгии) [Беккер РА, Быков ЮВ, 2019 (a), (b)].
Однако ещё более интересно в данном контексте то, что сильная S1R агонистическая активность флувоксамина, по-видимому, обуславливает не только описанный нами выше ряд особенностей спектра его психотропной активности, но и ряд ценных для лечения постковидных пациентов его соматотропных свойств. В частности, задолго до пандемии COVID-19 было показано сильное обезболивающее, иммуномодулирующее, противовоспалительное и артро- (хондро-) протективное действие флувоксамина при артритах разного генеза, включая постинфекционные реактивные артриты (а ведь они нередко развиваются и у постковидных пациентов) [Riesner HJ et al, 2008].
В другой серии исследований – и тоже задолго до пандемии COVID-19 – было показано, что флувоксамин, благодаря своему S1R агонизму, обладает кардио- и ангиопротективными свойствами в самых разных контекстах, включая хроническую ишемию миокарда (ХИМ), хроническую сердечную недостаточность (ХСН) и др. Опять-таки, и это тоже может оказаться важным при лечении постковидных пациентов, учитывая, сколь часто у этой когорты пациентов встречаются симптомы со стороны ССС [Tagashira H, Fukunaga K, 2012; Bhuiyan S et al, 2013].
А ещё в одной серии исследований было показано, что флувоксамин, именно благодаря своему S1R агонизму, обладает сильными нейропротективными, противовоспалительными и иммуномодулирующими свойствами при самых разных органических поражениях ЦНС, например, после ЧМТ или ОНМК, или при развивающейся БА или БП, или в экспериментальной модели рассеянного склероза (РС). Флувоксамин уменьшал апоптотическую гибель клеток, накопление β-амилоида, улучшал выживаемость и размножение нервных стволовых клеток (нейрогенез), понижал секрецию таких воспалительных цитокинов, как интерферон-гамма (ИФН-γ) и повышал секрецию противовоспалительного цитокина интерлейкин-4 (ИЛ-4) [Ghareghani M et al, 2017; Shi M et al, 2022; Bogár F et al, 2022].
Опять-таки, и это свойство флувоксамина может оказаться важным в контексте лечения постковидных пациентов, учитывая данные о высокой нейроинвазивности и нейротоксичности вируса SARS-CoV-2, а также о провокации этим вирусом процессов нейровоспаления, нейроповреждения и нейродегенерации, вплоть до раннего манифеста БА, БП или развития de novo РС после перенесённого COVID-19 [Ghareghani M et al, 2017; Shi M et al, 2022; Bogár F et al, 2022].
По этому поводу стоит отметить, что флувоксамин сейчас рассматривается как перспективный терапевтический агент для репозиционирования в качестве средства лечения различных нейродегенеративных заболеваний, в том числе БА и БП. Параллельно ряд фирм ведёт разработки таких экспериментальных S1R агонистов, как AF710B (ANAVEX 3–71), для тех же целей [Bogár F et al, 2022].
Флувоксамин сравнительно недорог, хорошо переносится, прост в использовании, широко доступен во всём мире и обладает высокой степенью липофильности, что обеспечивает лёгкость его проникновения в клетки различных органов и тканей, включая такие часто поражаемые при COVID-19 и постковидном синдроме ткани, как эпителий лёгких, кардиомиоциты, клетки эндотелия сосудов, нервные и глиальные клетки и др. [Hallifax D, Houston JB, 2007].
Перейдём, однако, к рассмотрению механизмов противовоспалительного и иммуномодулирующего действия флувоксамина именно в контексте заболевания COVID-19.
Механизмы противовоспалительного и иммуномодулирующего действия флувоксамина при COVID-19
В конце 2020 года Гордон с соавторами установили, что выключение (нокаут) гена SIGMAR1, который кодирует белок S1R, вызывает существенное торможение репликации вируса SARS-CoV-2 как в культуре генетически модифицированных клеток, так и у нокаутных экспериментальных животных [Gordon DE et al, 2020 (a), (b)].
Между тем, белок S1R уже давно привлекал внимание исследователей из самых разных областей медицины, как влияющий на патофизиологию огромного множества самых различных заболеваний – психических, неврологических, аутоиммунных, сердечно-сосудистых, злокачественных и др. [Hayashi T, Su TP, 2008; Albayrak Y, Hashimoto K, 2017].
Чтобы понять, почему это так – нужно хорошо представлять себе, что вообще такое белок S1R, и какова его роль в клетке. Белок S1R – это многофункциональный белок-шаперон, один из белков теплового шока (БТШ), расположенный в ЭПР. Он опосредует перекрёстные взаимодействия сигналов между митохондриями и ядром клетки [Mahdi M et al, 2022].
Будучи белком-шапероном, белок S1R способствует правильному пространственному свёртыванию вновь синтезированных рибосомами белков, а также предотвращает внутриклеточное накопление неправильно свернувшихся белков [Hayashi T, Su TP, 2007; Rosen DA et al, 2019].
Кроме того, будучи одним из важнейших БТШ, белок S1R играет большую роль в механизмах неспецифической защиты клетки от воздействия самых разных стрессоров – будь то повышенная температура окружающей среды («тепловой шок», откуда и название всего этого семейства защитных белков – БТШ), или, наоборот, пониженная температура окружающей среды («криогенный шок»), или воздействие на клетку ионизирующей радиации, свободных радикалов (активных форм кислорода и азота – «оксидативный и/или нитрозативный стресс»), или осмотический стресс, нападение на клетку вирусов, гипоксия клетки и др. [Hayashi T, Su TP, 2007; Rosen DA et al, 2019].
Усиление экспрессии белка S1R – это один из универсальных ответов живых клеток на воздействие любого стрессора. Оно способствует повышению выживаемости клеток. То есть, можно сказать, что белок S1R обладает мощными цитопротективными и антиоксидантными свойствами. Один из механизмов цитопротекции, обеспечиваемой белком S1R, заключается в модуляции входящего тока ионов кальция (Ca2+) из ЭПР в митохондрии, особенно в моменты клеточного и/или митохондриального стресса [Hayashi T, Su TP, 2007; Rosen DA et al, 2019].
При вирусной инфекции, как и при любой другой форме клеточного стресса, гиперэкспрессия S1R играет защитную роль, уменьшая оксидативный и нитрозативный стресс митохондрий, а также стресс ЭПР от большого количества чужеродных (вирусных) или неправильно свёрнутых белков. Кроме того, гиперэкспрессия S1R индуцирует целый каскад цитопротективных, анти-апоптотических, направленных на обеспечение выживания клетки в стрессовых условиях, механизмов, и одновременно тормозит экспрессию про-апоптотических, летальных для клетки, сигналов и механизмов [Rosen DA et al, 2019].
Вышеупомянутые данные Гордона с соавторами о торможении репликации вируса SARS-CoV-2 при выключении гена SIGMAR1, наряду с более ранними исследованиями, которые указывали на наличие у лигандов S1R мощных противовоспалительных и иммуномодулирующих свойств, на их способность угнетать гиперпродукцию воспалительных цитокинов и повышать продукцию противовоспалительных цитокинов, снижать смертность экспериментальных животных от сепсиса – закономерно вызвали интерес к изучению потенциала использования уже существующих лигандов S1R в качестве средств лечения ранних этапов инфекции SARS-CoV-2 для предотвращения более тяжёлого течения этой инфекции и развития цитокинового шторма, поскольку уже было известно, что именно гиперергическая воспалительная реакция и цитокиновый шторм, а не сам вирус SARS-CoV-2 при заболевании COVID-19 представляют основную опасность для жизни и здоровья пациента [Rosen DA et al, 2019].
Между тем, ещё в 2014 году, задолго до пандемии COVID-19, Ишима с соавторами показали, что флувоксамин является самым высокоаффинным агонистом S1R среди всех клинически применяемых АД. Позднее было показано, что флувоксамин является самым высокоаффинным агонистом S1R среди всех зарегистрированных на сегодня лекарств вообще [Ishima T et al, 2014; Rosen DA et al, 2019].
Учитывая давно известную ключевую роль белка S1R в смягчении внутриклеточного стресса при вирусных инфекциях, различные лиганды S1R уже давно изучались в качестве потенциальных средств для лечения других вирусных инфекций (не для лечения инфекции SARS-CoV-2). Так, например, в контексте инфицирования вирусом гепатита С (Hepatitis С Virus – HCV) было показано, что белок S1R в гепатоцитах ко-локализуется вместе с не-структурными белками клетки, связывающимися с комплексом вирусной репликазы HCV, и что индукция экспрессии белка S1R способствует ускорению обезвреживания и элиминации из клетки как готовых частиц HCV, так и отдельных вирусных белков [Friesland M et al, 2013].
А совсем недавно было обнаружено, что белок nsp6 вируса SARS-CoV-2 – связывается с белком S1R и отключает многие из активируемых S1R внутриклеточных защитных, анти-апоптотических сигнальных каскадов. Кроме того, белок nsp6 вируса SARS-CoV-2 также перехватывает, опять-таки благодаря взаимодействию с белком S1R, управление трансляцией белков в рибосомах клетки, и направляет все ресурсы внутриклеточных рибосом на трансляцию вирусных белков, а не нужных самой клетке белков [Gordon DE et al, 2020 (a), (b)].
Большинство исследователей считают, что основным механизмом положительного воздействия флувоксамина на клиническое течение COVID-19 является его противовоспалительное и иммуномодулирующее действие, реализующееся через его высокопотентный S1R агонизм и активацию каскада S1R-IRE [Rosen DA et al, 2019; Facente SN et al, 2021].
Механизмы противовоспалительного действия флувоксамина в доклинических моделях
Предпосылкой для появления интереса к исследованию эффективности и безопасности применения флувоксамина для лечения COVID-19 стало получение некоторых интересных результатов сначала в исследованиях in vitro (в культурах клеток), а затем и in vivo (на экспериментальных животных) [Chen Y, Brandizzi F, 2013; Rosen DA et al, 2019].
Ещё в 2013-м году, задолго до пандемии COVID-19, в опытах in vitro было показано, что активация сигма-1 рецепторов угнетает выработку воспалительных цитокинов в макрофагах, причём этот эффект реализуется через угнетение ими активности так называемого IRE1 (инозитол-требующего фермента), который также образно называют датчиком стресса и исполнителем судьбы клетки (за влияние IRE1 на про-апоптотические и анти-апоптотические каскады в клетке) [Chen Y, Brandizzi F, 2013].
В 2019-м году Д. Розен с соавторами провели эксперимент по сопоставлению защитного действия агониста сигма-1 рецепторов флувоксамина и цефалоспоринового антибиотика 3-го поколения в модели грамотрицательного сепсиса у мышей. Сеттинг этого эксперимента состоял в том, что подопытным мышам вводили внутрибрюшинно сначала заведомо летальную в отсутствие лечения дозу мышиных фекалий, которые всегда содержат грамотрицательные бактерии (2 г/кг массы тела), а затем – флувоксамин и/или цефтриаксон [Rosen DA et al, 2019].
Авторы вышеупомянутого эксперимента сумели показать, что флувоксамин не уступал по эффективности цефтриаксону по влиянию на повышение выживаемости подопытных мышей после получения ими летальной дозы инфекционного материала. При совместном же применении действие флувоксамина и цефтриаксона в отношении защиты животных от грамотрицательного сепсиса суммировалось. Это говорит о том, что в защитном действии у флувоксамина и у цефтриаксона в экспериментальной модели грамотрицательного сепсиса у мышей – имеются разные и взаимно дополняющие друг друга (комплементарные) механизмы [Rosen DA et al, 2019].
Авторы данного исследования предположили, что основной механизм защитного действия флувоксамина в экспериментальной модели грамотрицательного сепсиса у животных, по всей вероятности, связан с агонистическим воздействием флувоксамина на сигма-1 рецепторы и с ингибированием через них активности IRE1. Основания для такого предположения им дало то, что в той же модели грамотрицательного сепсиса у нокаутных мышей с генетически выключенным сигма-1 рецептором летальность животных от септического шока была значительно выше, а защитное действие флувоксамина – практически не проявлялось [Rosen DA et al, 2019].
Кроме того, Розен с соавторами также показали, что активация сигма-1 рецепторов (S1R) и угнетение активности IRE1 играют защитную роль в экспериментальных моделях воспаления и сепсиса на животных. Введение флувоксамина улучшало биохимические показатели крови и клиническое состояние животных, снижало температуру их тела, уровни воспалительных цитокинов и маркеров воспаления и оксидативного стресса в крови и повышало выживаемость животных не только при их заражении экспериментальным грамотрицательным сепсисом, но и при введении им очищенных бактериальных липополисахаридов (ЛПС) (p<0,01) [Rosen DA et al, 2019].
Получив эти результаты, Розен с соавторами затем продемонстрировали, что противовоспалительное и иммуномодулирующее действие флувоксамина проявляется также на клетках человека in vitro. Флувоксамин в концентрации 20 мкМ значительно снижал in vitro воспалительный ответ лимфоцитов и макрофагов здоровых доноров на их стимуляцию бактериальным ЛПС, в частности, секрецию ими интерлейкина-1-бета (ИЛ-1β) (p<0,05), интерлейкина-6 (ИЛ-6) (р<0,01) и изоформы p40 интерлейкина-12 (ИЛ-12 p40) (p<0,01) [Rosen DA et al, 2019].
При этом очень важно отметить, что противовоспалительное и иммуномодулирующее действие флувоксамина ограничивается влиянием его на секрецию строго определённых воспалительных цитокинов, а не является результатом глубокого общего угнетения их продукции, как это имеет место быть при применении высоких доз глюкокортикоидов (ГК), или традиционных иммуносупрессоров и цитостатиков [Rosen DA et al, 2019].
Доказательная база по применению флувоксамина для лечения COVID-19
Первое пилотное исследование, посвящённое изучению эффективности и безопасности применения флувоксамина для лечения COVID-19, было предпринято E. Lenze с соавторами ещё летом 2020 года, во время первой волны пандемии. Это исследование имело формат небольшого, краткосрочного (15 суток) двойного слепого плацебо-контролируемого рандомизированного клинического испытания (РКИ) [Lenze EJ et al, 2020].
Все участники данного РКИ, страдающие подтверждённым лабораторно COVID-19 в лёгкой форме, были рандомизированы к получению либо флувоксамина (доза которого быстро, в течение нескольких дней, наращивалась с 50 мг 1 раз в сутки до 100 мг 3 раза в сутки = 300 мг/сут, если позволяла переносимость), либо плацебо. При этом ни та, ни другая группа пациентов не должны были, согласно дизайну исследования, получать каких-либо иных противовирусных, противовоспалительных или иммуномодулирующих препаратов [Lenze EJ et al, 2020].
Заранее определённой перед началом данного РКИ первичной конечной точкой исследования (primary endpoint) было клиническое ухудшение. Принятое авторами исследования определение того, что есть такое «клиническое ухудшение» в течении заболевания COVID-19 звучало так: «снижение насыщения артериальной крови кислородом (SaO2) ниже 92% при дыхании атмосферным воздухом, либо появление одышки при дыхании атмосферным воздухом, или же появление потребности в кислородной поддержке или ИВЛ» [Lenze EJ et al, 2020].
Авторы данного исследования сумели показать, что ни один из пациентов в группе активного лечения, получавшей флувоксамин, не достиг первичной конечной точки (то есть не испытал клинического ухудшения в течении болезни на протяжении 15 суток исследования). В то же время у 6 из 72 пациентов, которые получали плацебо, было зарегистрировано клиническое ухудшение – либо появление одышки при дыхании атмосферным воздухом, либо снижение SaO2 ниже 92% при дыхании атмосферным воздухом, либо появление потребности в кислородной поддержке [Lenze EJ et al, 2020].
На основании первых многообещающих результатов вышеописанного пилотного РКИ, чуть позднее – в ноябре-декабре 2020 года, во время второй волны COVID-19, другая группа авторов – провела открытое проспективное когортное исследование эффективности и безопасности применения флувоксамина в лечении острой фазы COVID-19 у пациентов с лёгкой (амбулаторной) формой заболевания [Seftel D, Boulware DR, 2021].
В этом исследовании доза флувоксамина была несколько ниже, чем в первом пилотном РКИ (100 мг/сут = 2 раза в сутки по 50 мг на протяжении 14 суток, тогда как в выше процитированном РКИ флувоксамин доводили до
300 мг/сут = 3 раза в сутки по 100 мг на протяжении 15 суток, если позволяла переносимость) [Seftel D, Boulware DR, 2021].
В общей сложности 65 пациентов согласились принимать флувоксамин, в то время как 48 пациентов выбрали режим «только наблюдение», без какого-либо конкретного лечения. Результаты этого исследования также показали значительное преимущество флувоксамина перед отсутствием лечения. Ни один из 65 пациентов, принимавших флувоксамин (0%), за 14 суток исследования не стал нуждаться в госпитализации, в отличие от 6 из 48 пациентов (12,5%) в группе «только наблюдения» (p=0,005) [Seftel D, Boulware DR, 2021].
Более того, несмотря на то, что группа пациентов, получавших флувоксамин, изначально была несколько более тяжёлой и испытывала в среднем бóльшее количество начальных симптомов заболевания – к сроку 14 суток ни у одного из 65 пациентов, получавших флувоксамин (0%), уже не было никаких симптомов болезни. В то же время у 29 из 48 пациентов, которые выбрали режим «только наблюдение» (то есть у 60% от общего их числа) – к сроку 14 суток всё ещё сохранялись те или иные симптомы заболевания COVID-19 (p<0,001) [Seftel D, Boulware DR, 2021].
Самое же крупномасштабное РКИ, названное TOGETHER и посвящённое изучению эффективности и безопасности применения флувоксамина в сопоставлении как с плацебо, так и с другими противовирусными и/или противовоспалительными и иммуномодулирующими препаратами, для амбулаторного лечения COVID-19 – было проведено уже в этом, 2022 году, в Бразилии, Гилмаром Рейсом с соавторами [Reis G et al, 2022].
По своему дизайну это было многоцентровое двойное слепое плацебо-контролируемое сравнительное РКИ.
В нём амбулаторные пациенты с лёгкой формой лабораторно подтверждённого COVID-19 были рандомизированы к получению либо флувоксамина (в дозе 200 мг/сут = 100 мг 2 раза в сутки), либо плацебо, либо других противовирусных, противовоспалительных или иммуномодулирующих лекарств по выбору врача (гидроксихлорохин, комбинация лопинавир/ритонавир, метформин, аторвастатин, ивермектин, доксазозин или интерферон-гамма) на протяжении 10 суток [Reis G et al, 2022].
В общей сложности 741 участник данного исследования получал флувоксамин, а 756 – получали плацебо. При этом в группе флувоксамина клиническое ухудшение на протяжении 10 дней наблюдения было зарегистрировано только у 79 из 741 участника (всего у 11%), в то время как в группе плацебо за этот же срок клиническое ухудшение наблюдалось у 119 из 756 пациентов, или у 16% от общего их числа (p<0,001) [Reis G et al, 2022].
Кроме того, пациентам из группы плацебо значительно чаще, чем пациентам из группы, получавшей флувоксамин, при развитии клинического ухудшения требовалась госпитализация, кислородная поддержка, ИВЛ или введение больших доз ГК и/или антицитокиновых препаратов [Reis G et al, 2022].
Пациенты из группы плацебо также проводили в среднем больше времени, по сравнению с пациентами из группы флувоксамина, в стационаре как таковом, и в отделениях реанимации и интенсивной терапии – в частности [Reis G et al, 2022].
Среди всех пациентов, получавших флувоксамин (то есть при intention-to-treat анализе), было зарегистрировано лишь 17 смертей из 741 принявших участие в исследовании, тогда как среди пациентов, получавших плацебо, было зарегистрировано 25 смертных случаев из 756 участников исследования [Reis G et al, 2022].
Стоит отметить, что в исследовании TOGETHER часть пациентов отказались от продолжения лечения тем или иным назначенным им препаратом из-за его плохой переносимости. Встречались отказы от продолжения лечения и в группе флувоксамина. При этом среди тех пациентов, которые завершили хотя бы 80% от курса лечения рекомендованной продолжительности (флувоксамин – 548 пациентов, плацебо – 618 пациентов) – в группе флувоксамина был зарегистрирован только 1 смертный случай, тогда как в группе плацебо было зарегистрировано 12 смертных случаев (р = 0,022) [Reis G et al, 2022].
Доверие к результатам исследования Рейса с соавторами повышается не только в связи с крупным размером выборки этого исследования (более 8 000 пациентов), но и тем, что полученные Рейсом с коллегами данные хорошо согласуются с теми данными, которые были получены во многих других, более ранних исследованиях. Так, например, в исследовании TOGETHER, так же как и в целом ряде других, более ранних исследований, ни метформин, ни ивермектин, ни комбинация лопинавир/ритонавир не показали достоверных отличий по эффективности от плацебо. В то же время в этом исследовании, так же как и в упоминавшихся нами выше исследованиях STOP COVID 1 и 2, флувоксамин показал статистически достоверные отличия по эффективности от плацебо [Reis G et al, 2022].
Будучи первым в истории крупным многоцентровым двойным слепым плацебо-контролируемым РКИ по применению флувоксамина в лечении COVID-19, исследование TOGETHER представило первые строгие (уровень доказательности А) доказательства эффективности и безопасности использования флувоксамина на ранних стадиях заболевания COVID-19, для предотвращения его более тяжёлого течения [Reis G et al, 2022].
Позднее в 2022-м году Кристина Гуо с соавторами опубликовали мета-анализ всех РКИ, посвящённых изучению эффективности и безопасности применения флувоксамина в лечении острой фазы заболевания COVID-19 и в профилактике его тяжёлого течения. В этот мета-анализ вошли, в частности, исследования STOP COVID 1 и STOP COVID 2 (первое пилотное РКИ и последующее follow-up исследование), а также выше процитированное нами исследование TOGETHER. Аналогичный мета-анализ был независимо проведён также группой Тодда Ли с соавторами [Guo CM et al, 2022; Lee TC et al, 2022].
Авторы обоих мета-анализов подтвердили высокое методологическое качество исследования TOGETHER, а также поддержали его выводы об эффективности и безопасности применения флувоксамина в лечении острой фазы заболевания COVID-19 и в профилактике его тяжёлого течения [Guo CM et al, 2022; Lee TC et al, 2022].
Признание большой практической ценности научных результатов, полученных в исследовании TOGETHER, и высочайшего методологического качества этой работы – очевидно из того факта, что Сообщество клинических исследований (SCS) признало исследование TOGETHER – лучшим научным исследованием 2021 года, а авторитетнейший журнал Nature включил исследование TOGETHER в ежегодно составляемый им ТОП-10 исследований, которые определили направления развития медицины и науки в 2022-м году.
На основании этих данных, Американский Институт клинического и экономического анализа (ICER) – независимая некоммерческая исследовательская организация в США, которая оценивает доказательную базу для применения тех или иных медицинских вмешательств, а затем выдаёт рекомендации для частных американских компаний медицинского страхования по включению или невключению тех или иных препаратов или медицинских услуг в «страховую корзину» для оплаты – в июне 2022 года выпустил рекомендации включить флувоксамин и паксловид в «страховую корзину» для оплаты лечения COVID-19 страховыми компаниями США [ICER Assessment, 2022; FDA News, 2022].
Одновременно ICER дал рекомендацию отклонить включение в «страховую корзину» лечения COVID-19 препарата молнуправир, ввиду недостаточной, по мнению ICER, убедительности доказательной базы по его эффективности и безопасности в лечении COVID-19 (в отличие от флувоксамина и паксловида) [ICER Assessment, 2022; FDA News, 2022].
Литературных данных, специфически посвящённых изучению эффективности и безопасности применения флувоксамина при постковидном синдроме и, в частности, при лечении постковидных депрессий и постковидной тревоги – в отличие от данных по применению флувоксамина при лечении COVID-19 для профилактики его тяжёлого течения – пока не существует.
Однако это не является большой проблемой. Во-первых, таких данных пока не существует и по многим другим препаратам, упомянутым в эмпирическом протоколе лечения постковидного синдрома, предложенном FLCCC. На фоне отсутствия таких данных врачу предлагается рассуждать по аналогии. А именно – если то или иное иммуномодулирующее или противовоспалительное лекарство оказалось эффективным и безопасным в острой фазе COVID-19, и если длительно персистирующее воспаление и иммунологические нарушения – играют существенную роль в этиопатогенезе постковидного синдрома – то логично предположить, что эти же лекарства могут оказаться эффективными и в лечении постковидного синдрома [FLCCC Protocol, 2022].
Во-вторых же, флувоксамин достоверно эффективен при широком спектре депрессивных, тревожных и диссомнических расстройств, включая депрессивные, тревожные и диссомнические расстройства на фоне разнообразных соматических патологий, известных задолго до пандемии COVID-19 (например, постинсультные, постинфарктные, посттравматические, постинфекционные депрессивные, тревожные и диссомнические расстройства) [Stahl SM, 2013; Ruiz P, 2017].
Представление клинического случая эффективности флувоксамина при постковидном синдроме
Клинический случай. Постковидный синдром с депрессией средней тяжести, тревогой, диссомническими нарушениями и САТК.
Мужчина Г. С., 1998 года рождения (24 года на момент обращения за консультацией к одному из авторов настоящей статьи). Холост, живёт один. Начитан, хорошо образован, имеет философский склад мышления, знает три европейских языка (помимо английского – также немецкий и итальянский). По образованию – программист. До болезни – сотрудник крупной международной IT компании. Психическими расстройствами ранее не страдал, к врачам по этому поводу не обращался. Наличие психических расстройств у родственников отрицает.
В феврале 2022 года данный пациент перенёс амбулаторно COVID-19 в лёгкой форме. На протяжении всего периода болезни (около месяца с момента первого положительного теста на COVID-19 до момента, когда тест стал стойко отрицательным) пациент оставался на режиме домашней изоляции.
Несмотря на сравнительно лёгкое течение самой болезни, после выздоровления от неё данный пациент стал предъявлять жалобы на сильную утомляемость, разбитость, физическую слабость, неспособность сосредоточиться на работе, вялость, апатию, выраженную тревогу, катастрофические мысли о будущем, тоску, подавленность, ночные кошмары апокалиптического содержания («снится Третья Мировая война»), пробуждения около 4-5 часов утра с сильной тревогой, тахикардией, чувством оцепенения и грядущей неминуемой катастрофы. Пациент был вынужден уволиться с работы.
Помимо этого, пациент также стал испытывать периодические, внешне ничем не спровоцированные (не связанные с воздействием какого-либо очевидного аллергена) приступы нестерпимого кожного зуда, сопровождавшиеся тошнотой и слабостью. Первым лечащим врачом данного пациента это состояние было расценено как «психогенный кожный зуд».
После первого обращения к психиатру в марте 2022 года данный пациент получил назначение пароксетина (10 мг утром, затем 20 мг утром) и гидроксизина (25 мг на ночь). Однако первый же приём пароксетина в дозе 10 мг вызвал у этого пациента приступ рвоты. После этого пациент отказался от продолжения лечения, и вплоть до начала мая 2022 года к врачам не обращался, попыток лечения не предпринимал.
В начале мая 2022 года данный пациент, продолжая испытывать всё тот же набор симптомов, обратился за консультацией к одному из соавторов данной статьи. На момент обращения показатель шкалы депрессии Бека у него составлял 24 балла (умеренная депрессия или депрессия средней тяжести), показатель шкалы тревоги Шихана – 68 баллов (значительно выраженная тревожность).
В общем анализе крови (ОАК) пациента внимание автора привлекла эозинофилия (16%). При этом никаких очевидных причин для эозинофильного сдвига в лейкоцитарной формуле у пациента не было: анализ на яйца глистов, предпринятый после обнаружения эозинофилии в крови, оказался отрицательным, уровни антител к распространённым паразитам в крови – близкими к нулевым. Зато в стандартном биохимическом (БХ) анализе крови был обнаружен повышенный уровень СРБ (20 мг/л), при этом очевидных воспалительных или ревматических заболеваний у пациента также обнаружено не было.
После консультации с иммунологом-аллергологом было выдвинуто предположение о том, что как эозинофилия в периферической крови, так и приступы нестерпимого кожного зуда с тошнотой, слабостью и гипотензией – могут объясняться развитием САТК, который, как известно, может манифестировать в рамках постковидного синдрома после перенесённого COVID-19. Повышенный же СРБ в рамках нашей гипотезы объясняется перенесённым сравнительно недавно COVID-19 и наличием депрессии с тревогой.
С учётом данных о той большой патогенетической роли, которую играют воспаление и иммунологические нарушения в патогенезе именно постковидных депрессий и постковидной тревоги, а также с учётом специфики клинической картины депрессии у данного пациента (в которой присутствовали выраженная тревожность и диссомнические нарушения) и наличия у флувоксамина противовоспалительного и иммуномодулирующего действия (связанного с его сигма-1 рецепторной активностью) и выраженных анксиолитических свойств и способности нормализовывать сон и циркадные ритмы – мы сочли, что именно флувоксамин будет наилучшим выбором АД для данного пациента.
Начальная доза флувоксамина составила 50 мг на ночь. В последующем с интервалами 4 дня доза была доведена до 200 мг/сут (100 мг 2 раза в сутки), с хорошей переносимостью.
С учётом наличия у пациента также постковидного САТК, после консультации с иммунологом-аллергологом, данному пациенту был назначен короткий курс преднизолона (15 мг утром в один приём на протяжении 14 сут, 10 мг утром последующие 4 дня, 5 мг утром ещё 4 дня, 0), и 250 мг хлорохин на ночь, после ужина. Позднее хлорохин был заменен на кетотифен 1 мг на ночь.
Данная терапия привела к становлению у пациента полной клинической ремиссии к сроку 4 недели терапии, причём как по линии депрессии, тревоги и диссомнических нарушений, так и по линии САТК.
Пациент восстановил трудоспособность. Имея хорошую репутацию на прежнем месте работы, он легко вернулся на прежнюю должность, где и работает сейчас.
Заключение
Как видно из приведённых нами в этой статье данных литературы, флувоксамин, благодаря уникальному сочетанию своих фармакологических свойств, которое включает, наряду с «основным» для всякого АД действием – антидепрессивным и противотревожным – также мощные противовоспалительные, иммуномодулирующие, нейро-, хондро- и кардиопротективные свойства, анальгетическую активность – может оказаться перспективным и предпочтительным средством лечения постковидного синдрома, причём не только его нейропсихиатрических проявлений, таких, как депрессия, тревожность или диссомнические нарушения, но и общесоматических проявлений.
Эти особенности флувоксамина, выгодно отличающие его от других АД именно в контексте лечения постковидного синдрома, и делающие его препаратом выбора при данной патологии – связаны с тем, что флувоксамин является самым мощным среди всех клинически применяемых АД агонистом сигма-1 рецепторов.
Клинический случай, представленный в данной статье, на наш взгляд, ярко и убедительно иллюстрирует этот тези
Since the first appearance at the end of 2019 new infectious disease, which was caused by the new SARS-CoV-2 coronavirus, and to the present time (June 2022) — more than 537 million people worldwide have been diagnosed with this new disease. Nowadays, the fight against the long-term consequences of the COVID-19, that is, of the so-called long COVID, or post-COVID syndrome, is increasingly beginning to be one of the priorities for the global healthcare system. The actuality of this problem lies in the fact that a very large percentage of patients who have successfully recovered from acute phase of COVID-19 disease (according to various sources — from 50% to 80% of their total number) continue to suffer from diverse, both neuropsychiatric and somatic symptoms and complaints for weeks, months or, in some cases, even several years after initial recovery. Those symptoms and complaints then serve as a reason for these patients to repeatedly seek for more medical help.
In this article, we review the literature concerning the treatment of post-COVID syndrome, and new role of Sigma-1 receptors and fluvoxamine. We review the mechanisms of long COVID inflammation and neuropsychiatric and somatic complications, as well as the mechanisms of activation of Sigma-1 receptors and their effect on the reduction of cytokine production and vascular inflammation, as the basis for the development of post-COVID complications. We also present a clinical case from our own practice illustrating this thesis.
Keywords: COVID-19, SARS-CoV-2, coronavirus, long COVID, neuroinflammation, depression, anxiety, insomnia, fluvoxamine, sigma-1 receptor.
For citation: P.V. Morozov, Yu.V. Bykov, R.A. Bekker. Long COVID and its treatment: new role of Sigma-1 receptors and fluvoxamine (A Literature Review and a Clinical Case). Psychiatry and psychopharmacotherapy. 2022; 3: 33–47.
Введение
(Обоснование актуальности)
Со времени появления в конце 2019-го года первых тревожных сообщений, которые исходили из китайской провинции Ухань, об эпизодах новой, ранее неизвестной человечеству, инфекционной болезни, вызванной новым коронавирусом SARS-CoV-2, и по настоящее время (июнь 2022 года) – в мире переболели этой болезнью, получившей название COVID-19, уже более 537 миллионов человек. С тех пор мир пережил три основных волны пандемии COVID-19 [Wiersinga WJ et al, 2020; Torres I et al, 2020; Беккер РА, Быков ЮВ, 2021; Our World In Data, 2022].
Усилия мировых правительств по обеспечению вакцинации против SARS-CoV-2, а также по введению жёстких карантинных мер – позволили в значительной мере погасить пандемию. Однако более медленный, в целом уже не носящий эпидемического характера, рост количества заболевших COVID-19 продолжается и по сей день [Wiersinga WJ et al, 2020; Torres I et al, 2020; Беккер РА, Быков ЮВ, 2021; Our World In Data, 2022].
Вместе с тем, по мере угасания собственно пандемии COVID-19, на первый план для системы мирового здравоохранения всё в большей мере начинает выходить борьба с отдалёнными последствиями перенесённого COVID-19 – то есть с так называемым постковидным синдромом [Wiersinga WJ et al, 2020; Torres I et al, 2020; Беккер РА, Быков ЮВ, 2021; Our World In Data, 2022].
Актуальность этой проблемы обусловлена тем, что у очень большого процента переболевших COVID-19 (по разным данным – от 50% до 80% от общего их числа) на протяжении многих недель, многих месяцев и даже нескольких лет после выздоровления от острой фазы болезни – наблюдаются многообразные как нейропсихиатрические, так и общесоматические симптомы и жалобы, которые служат для этих пациентов причиной повторных обращений за медицинской помощью [Wiersinga WJ et al, 2020; Беккер РА, Быков ЮВ, 2021].
Принято считать, что если симптомы сохраняются в течение более чем 3 недель после выздоровления от острой фазы болезни, то у данного пациента можно диагностировать постковидный синдром [Amenta EM et al, 2020].
Клиническая симптоматика постковидного синдрома
Детальное описание всех тех многообразных симптомов, которые могут наблюдаться у разных пациентов в рамках постковидного синдрома, уже было дано в одной из наших предыдущих статей, посвящённых этому же синдрому, поэтому здесь мы не будем повторяться и дадим лишь краткое их описание [Беккер РА, Быков ЮВ, 2021].
Постковидный синдром (диагноз, внесённый в МКБ-10 под кодом U09.9 как «Состояние после COVID-19 неуточнённое») – это клинически гетерогенная группа состояний разной степени тяжести и разной продолжительности. Она включает в себя постинфекционный синдром хронической усталости (СХУ), постреанимационный синдром, психологические последствия длительной и тяжёлой госпитализации и/или пребывания в отделении реанимации и интенсивной терапии, а также постковидные дисфункции в самых разных системах организма, включая центральную нервную систему (ЦНС), периферическую нервную систему (ПНС), особенно её вегетативный отдел, или вегетативную нервную систему (ВНС), сердечно-сосудистую систему (ССС), желудочно-кишечный тракт (ЖКТ), систему органов дыхания, опорно-двигательную систему, эндокринную систему и другие [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Показано, что от 10% до 65% пациентов, перенёсших острую фазу COVID-19 в лёгкой или средней тяжести формах, проявляют те или иные симптомы постковидного синдрома спустя 12 и более недель после выздоровления от острой фазы заболевания. Среди пациентов, переболевших COVID-19 в тяжёлой или очень тяжёлой форме, этот процент ещё выше [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Наиболее распространёнными и стойкими проявлениями постковидного синдрома спустя 6 месяцев после выздоровления от острой фазы COVID-19 оказались такие симптомы, как быстрая утомляемость, физическая слабость, раздражительность, одышка, тревожность, депрессия, нарушения концентрации внимания, нарушения сна и когнитивных функций, особенно памяти, синусовая тахикардия, экстрасистолы, а также головные боли или «летучие» боли во всём теле – в животе, в мышцах и/или суставах. Пациенты, страдающие постковидным синдромом, предъявляют в среднем около 14 различных жалоб [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Значительное место среди жалоб, предъявляемых пациентами, страдающими постковидным синдромом – занимают жалобы именно на психические и неврологические нарушения [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Воспалительная гипотеза этиопатогенеза постковидного синдрома
За два с половиной года, прошедшие с момента первого описания новой коронавирусной болезни COVID-19 и обнаружения вскоре того факта, что эта болезнь нередко оставляет после себя те или иные долгосрочные последствия – было выдвинуто множество гипотез об этиопатогенезе постковидного синдрома [Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Мы кратко осветим лишь одну из них, которая в настоящее время является наиболее общепринятой из всего множества таких гипотез, и одновременно – представляет интерес именно в контексте данной статьи [Беккер РА, Быков ЮВ, 2021].
Эта гипотеза связывает проявления постковидного синдрома с длительной персистенцией воспалительных иммунопатологических сдвигов, первоначально вызванных инфицированием вирусом SARS-CoV-2, с патологической гиперреактивностью иммунной системы, с неконтролируемым, длительным, продолжающимся уже в отсутствие самого вируса, воспалением и повреждением тканей и/или с запуском вирусом неких аутоиммунных процессов [Mehta P et al, 2019; Asif M et al, 2020; Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Эта гипотеза опирается, среди прочего, на тот факт, что повреждения лёгких и других органов, наблюдаемые во время острой фазы COVID-19 – тоже в большей мере связаны с гиперергической реакцией иммунной системы организма, с чрезмерной активацией воспаления и с цитокиновым штормом, чем с собственно повреждающим действием самого вируса на клетки различных органов и тканей [Mehta P et al, 2019; Asif M et al, 2020; Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Принято считать, что геморрагические, гипоксические, метаболические и воспалительные повреждения ЦНС, которые могут возникать как в результате нарушения функций ССС, системы внешнего дыхания, печени и почек, так и вследствие прямого нейроинвазивного и нейротоксического действия вируса SARS-CoV-2, обладающего способностью проникать в ЦНС через обонятельный тракт и/или через нарушенный вследствие системного воспаления и цитокинового шторма гематоэнцефалический барьер (ГЭБ) – являются одними из основных причин развития постковидного синдрома. Научные данные по этому поводу накапливаются быстрыми темпами [Tang SW et al, 2022].
В мировой научной литературе, посвящённой COVID-19 и постковидному синдрому, отмечается всплеск интереса к изучению эффективности и безопасности в их лечении различных психотропных препаратов, активирующих Сигма-1 рецепторы, и прежде всего – наиболее высокопотентного их агониста, антидепрессанта (АД) из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) – флувоксамина. Множатся литературные сообщения о защитных, противовоспалительных и иммуномодулирующих эффектах флувоксамина как в острой фазе COVID-19, так и при постковидном синдроме [Tang SW et al, 2022].
Данная гипотеза даёт основания предполагать, что в лечении постковидного синдрома применение иммуномодулирующих и/или противовоспалительных препаратов, и в частности флувоксамина – будет иметь такое же значение, как и в лечении острой фазы заболевания COVID-19 [Mehta P et al, 2019; Asif M et al, 2020; Carod-Artal FJ, 2021; Беккер РА, Быков ЮВ, 2021].
Краткий обзор мировых рекомендаций
и протоколов по лечению постковидного синдрома
Поскольку постковидный синдром является мультисиндромным заболеванием, которое может проявляться симптомами очень многообразных нарушений со стороны самых разных органов и систем организма (вовсе не только психическими и неврологическими симптомами, такими, как депрессия, тревожность, диссомнические нарушения) – то мы решили привести здесь краткие выдержки из протоколов и рекомендаций по лечению постковидного синдрома, выпущенных несколькими наиболее авторитетными в мире медицинскими организациями.
Мы надеемся, что это поможет практикующим психиатрам и врачам других специальностей лучше ориентироваться как в общих подходах к ведению пациентов с постковидным синдромом, так и в лечении сопутствующих нарушений в работе различных органов и систем у этих пациентов, а не только в специфической психотропной терапии по поводу постковидной депрессии, постковидной астении или тревоги, постковидных диссомнических нарушений.
Так, в Британии авторитетный Национальный Институт Здравоохранения и Передового опыта (National Institute for Health and Care Excellence, NICE) в самом последнем (от 2021 года) пересмотре рекомендаций NG 188 по лечению постковидного синдрома – содержит много указаний относительно обследования пациентов с этим синдромом, но почти не содержит каких-либо конкретных указаний относительно их фармакологического лечения. Рекомендации NG 188 содержат лишь общие указания на то, что «программы реабилитации для пациентов с постковидным синдромом должны быть индивидуальными и адаптированными к потребностям каждого конкретного пациента» [NICE guideline NG188, 2021; Venkatesan P, 2021].
Далее в тексте рекомендаций NG 188 указывается, что, «поскольку не было представлено достаточных доказательств эффективности и безопасности того или иного лекарственного средства или метода реабилитации пациентов с постковидным синдромом, чтобы можно было рекомендовать конкретные критерии для отбора и направления пациентов на то или иное лечение или реабилитацию, то рабочая группа согласилась с тем, что правильный и необходимый в каждом конкретном случае уровень и объём медицинского вмешательства должен быть согласован между врачом и пациентом путём совместного принятия решения, после комплексной оценки врачом клинического состояния пациента, а также сравнительных рисков и преимуществ различных вариантов доступных при этом заболевании медицинских вмешательств» [NICE guideline NG188, 2021; Venkatesan P, 2021].
А в США не менее авторитетная правительственная медицинская организация – Центр по Контролю и Профилактике Заболеваний (Center for Disease Control and Prevention, CDC) – также в целом рекомендует индивидуализированный подход к лечению каждого конкретного пациента с постковидным синдромом. Рекомендации CDC, как и рекомендации NICE, не предписывают применение для лечения пациентов с постковидным синдромом каких-либо конкретных лекарственных средств, но призывают дозировать и контролировать физические нагрузки в соответствии с индивидуальными возможностями и потребностями каждого конкретного пациента [CDC guideline, 2021].
Ниже мы приводим некоторые выдержки из обновлённых рекомендаций CDC от 2021 года по лечению постковидного синдрома.
«Для большинства пациентов с постковидным синдромом целью их лечения является оптимизация их биологического, социального, семейно-бытового и профессионального функционирования и их общего качества жизни. В идеале врач общей практики, проконсультировавшись с соответствующими специалистами, должен разработать комплексный индивидуализированный план лечения для такого пациента, который будет основан на имеющихся у этого конкретного пациента симптомах и жалобах в рамках постковидного синдрома, на имеющихся у него тех или иных сопутствующих (коморбидных или преморбидных) психических и соматических заболеваниях, на особенностях личной истории, семейной, трудовой и социальной ситуации конкретного пациента, и на тех целях, которых пациент надеется достичь в результате лечения. Постановка реалистичных и достижимых терапевтических целей при помощи совместного принятия решения после обсуждения между врачом и пациентом может быть очень полезной» [CDC guideline, 2021].
Далее рекомендации CDC указывают, что: «Для обеспечения адекватности процесса постановки терапевтических целей и последующего процесса принятия диагностических и терапевтических решений – очень важна прозрачность в общении между врачом и пациентом. Врач должен проинформировать пациента о том, что ни природа, причинные факторы и механизмы развития, ни методы лечения и реабилитации постковидных состояний ещё не изучены в достаточной мере, и заверить пациента в том, что по мере появления новой научной информации пациент будет продолжать получать наилучшую возможную в каждый конкретный момент времени медицинскую и психологическую помощь. Врач также должен в процессе лечения продолжать периодически обсуждать с пациентом достигнутый прогресс в лечении, характер и степень тяжести сохраняющихся у пациента проблем и жалоб, и при необходимости в сотрудничестве с пациентом оперативно корректировать цели, стратегию и тактику лечения» [CDC guideline, 2021].
Рекомендации CDC также указывают, что «У пациентов с постковидным синдромом нередко наблюдаются различные симптомы, природу, причины и механизмы возникновения которых у данного пациента нельзя объяснить объективными данными медицинских обследований, либо тяжесть которых несоразмерна масштабам нарушений, выявленных у этого пациента при объективном медицинском обследовании. Тем не менее, наличие и степень тяжести у пациента этих симптомов и испытываемые им страдания от их наличия не следует игнорировать, недооценивать или всецело приписывать наличию у пациента таких психических расстройств, как конверсионное, соматоформное или ипохондрическое расстройства, даже в тех случаях, когда у нас ещё нет полного понимания природы, причин и механизмов развития этих симптомов (их этиологии и патогенеза) или их прогноза (их ожидаемой продолжительности)» [CDC guideline, 2021].
Далее рекомендации CDC констатируют, что «Многие проявления постковидного синдрома можно уменьшить или даже полностью устранить с помощью тех подходов, которые ранее уже были разработаны для лечения аналогичных симптомов, возникающих в рамках других заболеваний (например, дыхательные упражнения для уменьшения симптомов одышки). Для некоторых пациентов с постковидным синдромом может быть очень полезным создание комплексного плана их реабилитации. Такой комплексный план реабилитации постковидного пациента может включать в себя такие компоненты, как физическая терапия (дозированные физические нагрузки), трудотерапия (постепенное возвращение к посильной трудовой деятельности), логопедическая и/или лингвистическая терапия (при проблемах с речью и/или с владением языком), консультирование по профориентации (подбор более подходящей работы или области деятельности), неврологическая и/или нейрокогнитивная реабилитация (при неврологических нарушениях в чувствительной и/или двигательной сферах и/или при наличии нейрокогнитивных симптомов), психоэмоциональная реабилитация и психотерапия, индивидуально подобранная фармакотерапия. Некоторым пациентам с постковидным синдромом, испытывающим значительное недомогание после физической нагрузки, может быть показан более консервативный план физической реабилитации. Таким пациентам может быть полезна консультация со специалистом по физической терапии и/или со специалистом по спортивной медицине для разработки индивидуализированного плана осторожного начала физических упражнений с учётом их переносимости и с учётом рекомендаций специалиста в плане ритма занятий и дозирования величины нагрузки. Тем не менее, постепенное, плавное возвращение к дозированным физическим упражнениям с учётом их индивидуальной переносимости и физических возможностей конкретного пациента – может быть полезным большинству пациентов с постковидным синдромом» [CDC guideline, 2021].
Рекомендации CDC также указывают, что: «Оптимальный план лечения постковидного синдрома и сопутствующих (коморбидных или преморбидных) заболеваний может также включать, при необходимости, консультации по таким компонентам здорового образа жизни, как правильное питание, налаживание режима дня, режима сна и отдыха, снижение уровня стресса (например, с помощью медитации)» [CDC guideline, 2021].
Далее пишется, что: «Ведение календаря или дневника пациента может быть очень полезным для документирования динамики изменений в состоянии здоровья и в степени тяжести проявлений постковидного синдрома у данного конкретного пациента в процессе его лечения, а также для выявления потенциальных триггеров для ухудшения его состояния, таких, как физическая, когнитивная или психоэмоциональная нагрузка, стресс, недосыпание, употребление определённых продуктов питания, алкоголя, определённых психоактивных веществ или лекарств, или дни менструации. Кроме того, такие дневники и календари также могут дать медицинским работникам более глубокое и более детализированное представление об испытываемых данным конкретным пациентом симптомах болезни в динамике, о его привычках и образе жизни, об его общем жизненном опыте и о его опыте внутреннего переживания или преломления болезни. Медицинские работники должны поощрять пациентов с постковидным синдромом сообщать врачу о появлении любых новых симптомов или об изменении прежде имевшихся у них симптомов в любую сторону, а также поощрять пациентов обсуждать с врачом любые изменения, как положительные, так и отрицательные, которые произошли в жизнедеятельности, в социальном, семейно-бытовом, академическом или профессионально-трудовом функционировании или в распорядке дня пациента» [CDC guideline, 2021].
Далее указывается, что: «У пациентов с постковидным синдромом могут наблюдаться общие симптомы, сходные с теми, которые наблюдаются у пациентов, страдающих миалгическим энцефаломиелитом или СХУ, фибромиалгией (ФМА), хронической ортостатической гипотензией (ОГ), синдромом активации тучных клеток (САТК), синдромом после болезни Лайма. Те подходы к лечению, которые оказались полезными для уменьшения выраженности симптомов при вышеуказанных расстройствах (например, управление физической активностью при недомогании после физической нагрузки, применение АД при симптомах ФМА, применение ингибиторов активации тучных клеток при симптомах САТК, применение мидодрина или флудрокортизона при симптомах ОГ и др.), возможно, могут также принести пользу некоторым пациентам с постковидным синдромом, испытывающим аналогичные симптомы» [CDC guideline, 2021].
По поводу же фармакологического лечения постковидного синдрома рекомендации CDC звучат достаточно неконкретно: «Некоторые рецептурные или отпускаемые без рецепта лекарства, а также некоторые витаминные, минеральные или аминокислотные добавки, возможно, могут оказаться полезными при определённых симптомах в рамках постковидного синдрома (например, таких, как головная боль, бессонница или беспокойство) или при наличии документированных дефицитов определённых витаминов, минералов или аминокислот, после тщательного взвешивания преимуществ и рисков от каждого конкретного вида фармакологического вмешательства» [CDC guideline, 2021].
Помимо официальных рекомендаций по лечению постковидного синдрома от правительственных организаций, таких, как американская CDC и британская NICE, существуют рекомендации по лечению постковидного синдрома и от независимых, неправительственных исследовательских групп. Например, в США создан и работает исследовательский альянс Front Line COVID-19 Critical Care Alliance (FLCCC), который ставит своей первоочередной задачей изучение эффективности и безопасности репозиционирования тех или иных уже существующих на рынке лекарств для профилактики заражения вирусом SARS-CoV-2 или для профилактики развития симптоматики заболевания COVID-19 у бессимптомных вирусоносителей SARS-CoV-2, для амбулаторного и стационарного лечения пациентов в острой фазе заболевания COVID-19, для лечения постковидного синдрома и поствакцинальных осложнений, а также разработку соответствующих протоколов [Alek Korab, 2021; FLCCC Protocol, 2022].
Интересующий нас в контексте данной статьи протокол лечения именно постковидного синдрома, предложенный альянсом FLCCC, называется I-RECOVER. Он регулярно пересматривается и обновляется исследователями из этого альянса. На момент написания данной статьи протокол I-RECOVER рекомендует в качестве первой линии терапии постковидного синдрома противовоспалительные препараты, в частности, короткий (до 2-3 недель) курс лечения преднизоном в дозе 10-15 мг/сут, с последующим плавным снижением и отменой преднизона. В качестве альтернативных или дополнительных (адъювантных) к терапии преднизоном препаратов данный протокол рекомендует либо упоминает целый ряд других препаратов с известными противовирусными (в отношении вируса SARS-CoV-2), противовоспалительными и/или иммуномодулирующими свойствами, в частности, омега-3 полиненасыщенные жирные кислоты (омега-3 ПНЖК), витамин D, витамин С, витамин K2, низкодозированный налтрексон (Low-Dose Naltrexone – LDN), ивермектин, гидроксихлорохин, мелатонин, куркумин, пробиотики и др. [Alek Korab, 2021; FLCCC Protocol, 2022].
Ко второй линии терапии постковидного синдрома авторы вышеупомянутого протокола I-RECOVER отнесли комбинацию флувоксамина 25 мг 1 раз в сутки с гипохолестеринемическим препаратом из группы статинов – аторвастатином 20-40 мг один раз в сутки. Эту комбинацию они рекомендуют применять в том случае, если на терапию преднизоном и/или одним из упомянутых выше альтернативных преднизону либо адъювантных к преднизону препаратов не было получено достаточного положительного клинического ответа к сроку 1-2 недели [Alek Korab, 2021; FLCCC Protocol, 2022].
К третьей линии терапии постковидного синдрома авторы протокола I-RECOVER отнесли применение маравирока (первоначально – антиретровирусного препарата, предназначенного для лечения и профилактики ВИЧ-инфекции, но обладающего также иммуномодулирующими свойствами; среди антиретровирусных препаратов маравирок классифицируется как ингибитор проникновения ВИЧ в клетки) в дозе 300 мг 2 раза в сутки [Alek Korab, 2021; FLCCC Protocol, 2022].
К маравироку, как третьей линии терапии постковидного синдрома, авторы протокола I-RECOVER рекомендуют прибегать в том случае, если предшествующая терапия
2-й линии (флувоксамин 25 мг/сут плюс аторвастатин
20-40 мг/сут) не дала достаточного эффекта к сроку 6-8 недель лечения [Alek Korab, 2021; FLCCC Protocol, 2022].
Детальное рассмотрение теоретических обоснований и клинической доказательной базы (или же отсутствия таковой доказательной базы) для применения каждого из упомянутых в протоколе I-RECOVER средств и методов лечения постковидного синдрома – выходит далеко за рамки данной статьи, и заняло бы слишком много места в ней.
Однако отметим, что препараты группы статинов (в частности, упомянутый в протоколе I-RECOVER аторвастатин, который в нём предлагается комбинировать с флувоксамином в качестве второй линии терапии постковидного синдрома) – обладают иммуномодулирующими и противовоспалительными свойствами. В частности, статины блокируют цитокиновые пути активации хемотаксиса и адгезии иммунокомпетентных клеток. Флувоксамин, являясь мощным агонистом сигма-1 рецепторов, также проявляет иммуномодулирующие и противовоспалительные свойства и снижает продукцию воспалительных цитокинов [Alek Korab, 2021; FLCCC Protocol, 2022].
А предложенный в протоколе I-RECOVER в качестве третьей линии терапии постковидного синдрома антиретровирусный препарат маравирок, являясь блокатором рецептора хемокинов CCR5, предотвращает активацию хемокинами иммунокомпетентных клеток, последующее перемещение активированных иммунокомпетентных клеток в зону воспаления (их хемотаксис), а затем – их адгезию к эндотелию сосудов зоны воспаления и их инфильтрацию в сам очаг воспаления (их экстравазацию) [Alek Korab, 2021; FLCCC Protocol, 2022].
Актуальность проблемы нейропсихиатрических проявлений постковидного синдрома
Поскольку данная наша статья является статьёй по психиатрии, то вполне логично, что среди многочисленных проявлений постковидного синдрома нас более всего интересуют именно нейропсихиатрические, а не какие-либо другие возможные его проявления.
Показано, что как сама пандемия COVID-19, так и её многообразные негативные социально-экономические, политические и психологические последствия привели к резкому росту распространённости в популяции депрессивных, тревожных и связанных со стрессом расстройств [Петрова НН с соавт, 2020; Морозов ПВ с соавт, 2021].
Особенно подверженными риску развития данных групп психических расстройств оказались такие подгруппы населения, как пожилые люди, пациенты с предсуществовавшими хроническими соматическими и/или психическими заболеваниями, а также медицинские работники [Петрова НН с соавт, 2020; Морозов ПВ с соавт, 2021].
Так, в частности, распространённость именно депрессивных расстройств в общей популяции за период пандемии COVID-19 значительно выросла. Она составляет, по разным данным, от 20,9% до 27,8% [Ettman CK et al, 2020; Kim SW et al, 2021].
Ещё чаще наблюдаются депрессивные расстройства среди пациентов, перенёсших COVID-19. Так, по данным М. Дженнаро с соавторами, опубликованным в 2021 году, клинически значимая депрессивная симптоматика на протяжении 3 месяцев после выздоровления от острой фазы COVID-19, наблюдалась у 35,8% респондентов [Gennaro MM et al, 2021].
При этом М. Дженнаро с соавторами отметили, что симптомы депрессии у этих пациентов сохранялись на протяжении длительного времени, в отличие от симптомов тревожности, нарушений сна и симптомов посттравматического стрессового расстройства (ПТСР), которые имели тенденцию к медленному спонтанному улучшению с течением времени [Gennaro MM et al, 2021].
Кроме того, М. Дженнаро с соавторами отметили также тенденцию к усилению или рецидиву депрессивной симптоматики у людей с психическими расстройствами в анамнезе после перенесения ими COVID-19, более высокую подверженность женщин развитию этого осложнения после COVID-19, и связь между остротой и тяжестью инфекции и выраженностью нейрокогнитивных и неврологических расстройств после выздоровления от острой фазы болезни. В частности, те или иные нарушения координации движений, исполнительная дисфункция, нарушения памяти – наблюдались у 78% респондентов в течение 3 месяцев после выздоровления от острой фазы COVID-19 [Gennaro MM et al, 2021].
Другая группа авторов отмечает, что различные постковидные психические расстройства, включая постковидную депрессию, постковидную тревогу и постковидную астению или СХУ – очень распространены среди реконвалесцентов острой фазы COVID-19, и что подобная симптоматика может, по разным оценкам, поражать от 26% до 40% пациентов, перенёсших острую фазу COVID-19, и сохраняться в течение 6 месяцев и более после выздоровления от острой фазы болезни [Huang C et al, 2021].
Распространённость симптомов тревоги в общей популяции также выросла на фоне пандемии COVID-19 и составила, по данным одной из исследовательских групп, 27,3%. Однако среди пациентов, выздоровевших от острой фазы COVID-19, распространённость симптомов тревоги оказалась ещё выше и составила 42% [Pashazadeh Kan F et al, 2021].
Из всей предшествующей истории человечества известно, что тревожная симптоматика часто впервые возникает или рецидивирует у людей именно в периоды эпидемий и пандемий, и что она может затем сохраняться в течение длительного времени и после их завершения [Bendau A et al, 2021].
Причиной резкого повышения общего уровня тревожности в популяции в период пандемии COVID-19, как и в периоды предшествующих эпидемий и пандемий, называют в первую очередь страх перед возможными последствиями пандемии – как перед возможными её последствиями для своего здоровья или для здоровья близких, так и перед её возможными социальными, экономическими и/или политическими последствиями [Bendau A et al, 2021].
Показано, что факторами риска, повышающими вероятность развития de novo, усиления или рецидива симптомов тревоги или тревожного расстройства в период пандемии COVID-19 – являются чрезмерное внимание к потреблению средств массовой информации (СМИ), принадлежность к женскому полу, работа в медицинском контексте или наличие медицинского образования, наличие предсуществовавших психических расстройств, а также более тесный контакт с вирусом, с заболевшими людьми или же перенесённое самим человеком заболевание COVID-19 [Bendau A et al, 2021].
Особая роль системного воспаления и нейровоспаления в этиопатогенезе именно постковидных депрессивных и тревожных расстройств
Давно и хорошо известно, что депрессивные и тревожные расстройства, независимо от своей изначальной причины, очень часто сопровождаются гиперактивацией иммунной системы и воспалительным ответом как на периферии (системным воспалительным ответом), так и в ЦНС (нейровоспалением) [Miller AH, 2010; Blume J et al, 2011].
В частности, при депрессивных и тревожных расстройствах часто наблюдается повышение в плазме крови и в ликворе маркеров оксидативного и нитрозативного стресса, маркеров перекисного окисления липидов, а также снижение активности антиоксидантных ферментов, и как следствие этого – повышение образования свободных радикалов (активных форм кислорода и азота) [Czarny P et al, 2018].
Также часто при депрессивных и тревожных расстройствах обнаруживаются повышенные уровни провоспалительных цитокинов и сниженные уровни противовоспалительных цитокинов в плазме крови и в ликворе, признаки воспалительной гиперактивации «стрессовой» оси ГГН, повышенные уровни в плазме крови белков острой фазы воспаления, включая С-реактивный белок (СРБ), гепсидин, гаптоглобин, α1-антитрипсин (А1АТ), кислый α1-гликопротеин (АГП). При этом никакого системного или местного воспалительного процесса известной этиологии у этих пациентов обнаружить не удаётся [Dowlati Y et al, 2010].
Верно, однако, и обратное – многие воспалительные, инфекционные, аутоиммунные заболевания, независимо от своей природы – сопровождаются повышенным риском развития депрессии и/или тревоги [Stahl SM, 2013; Ruiz P, 2017].
Существуют достаточно веские основания полагать, что вышеописанные, обнаруживаемые у значительной части пациентов с депрессивными и тревожными расстройствами, воспалительные сдвиги в плазме крови и в ликворе – являются не просто «спутниками», маркерами или следствиями депрессивного или тревожного состояния – но, напротив, сами играют важную, если не одну из ключевых, ролей в патогенезе депрессивных и тревожных состояний [Stahl SM, 2013; Ruiz P, 2017].
Целый ряд сходящихся в одной точке данных заставляет думать именно так. Например, тот факт, что в экспериментах на животных состояние, очень напоминающее депрессию у человека, можно вызвать введением бактериального липополисахарида (ЛПС), или что лечение интерферонами или интерлейкинами 1 либо 2 (важными воспалительными цитокинами) – часто вызывает у пациентов развитие ятрогенной депрессии или ятрогенного тревожного состояния. Или, например, тот факт, что воспалительные цитокины интерферон-альфа (ИФН-α) и фактор некроза опухолей-альфа (ФНО-α) оба способны активировать фермент индол-2,3-диоксигеназу (ИДО), осуществляющий катаболизм L-триптофана по так называемому кинурениновому пути с образованием нейротоксичной кинуреновой кислоты, и заодно попутно снижать биосинтез из L-триптофана таких важных для функционирования ЦНС метаболитов, как серотонин, мелатонин, никотинамид. Кроме того, воспалительные цитокины как непосредственно, так и через активацию ими оси ГГН угнетают биосинтез факторов роста нервных клеток, таких, как BDNF и NGF [Stahl SM, 2013; Ruiz P, 2017].
Эта гипотеза получила название «воспалительной гипотезы депрессий». На сегодняшний день она рассматривается как одна из основных гипотез этиопатогенеза депрессивных состояний [Stahl SM, 2013; Miller AH, Raison CL, 2016; Benedetti F et al, 2016; Ruiz P, 2017].
В свете всех этих данных, неудивительно, что связь между интенсивностью воспаления (оцениваемой по уровням ряда воспалительных маркеров и маркеров оксидативного стресса в плазме крови) – и выраженностью депрессивных, тревожных и нейрокогнитивных расстройств была обнаружена и у пациентов с постковидным синдромом, и что эта корреляция сохранялась и спустя 3 месяца после окончания острой фазы болезни и выписки из больницы [Gennaro MM et al, 2021].
Ряд исследований показывает, что не только непосредственно сам гипериммунный ответ организма на инфицирование вирусом SARS-CoV-2, но и вызываемая психологическими стрессорами, связанными с пандемией, гиперактивность «стрессовой» оси ГГН – могут вызывать или активизировать хронические воспалительные процессы в организме, и приводить к повышению маркеров воспаления, оксидативного и нитрозативного стресса в плазме крови и в ликворе. А это, в свою очередь, может способствовать усилению процессов нейровоспаления, нейроповреждения и нейродегенерации, усилению апоптоза нейронов и клеток нейроглии, ослаблению процессов нейрогенеза и нейропластичности, процессов аксоно-, дендрито- и синаптогенеза, и, как следствие – может способствовать возникновению различных психиатрических и неврологических осложнений перенесённого COVID-19, то есть – способствовать развитию нейропсихиатрических симптомов постковидного синдрома [Bektas A et al, 2020; Gennaro MM et al, 2021].
В канву этой гипотезы хорошо ложится также тот статистический факт, что у тех пациентов, у которых заболевание COVID-19 протекало тяжело, с выраженными респираторными симптомами, высокой лихорадкой, гипоксией, нарушениями сознания, выраженной интоксикацией, проявлениями цитокинового шторма или органной недостаточности, или у пациентов, у которых течение болезни потребовало госпитализации в отделение реанимации и/или в отделение интенсивной терапии, применения высоких доз ГК, антицитокиновых препаратов, кислородной поддержки или искусственной вентиляции лёгких (ИВЛ) – с большей вероятностью отмечаются после выздоровления длительные и/или тяжёлые нейропсихиатрические последствия перенесённого COVID-19, например, длительная и/или тяжёлая депрессия, длительная и/или тяжёлая тревожность, манифестация de novo или рецидив обсессивно-компульсивного расстройства (ОКР) – вероятно, по механизму, сходному с механизмом манифестации или рецидива ОКР после стрептококковых и некоторых вирусных инфекций (так называемый PANDAS синдром), и даже – необычно раннее начало болезни Паркинсона (БП) или болезни Альцгеймера (БА) после перенесения COVID-19 [Ortelli P et al, 2021].
Одна из причин этого явления заключается в высокой нейротропности, нейроинвазивности и нейротоксичности самого вируса SARS-CoV-2 (более высокой, чем даже у его ближайшего родственника – вируса SARS-CoV) [Ortelli P et al, 2021].
Другая же причина заключается в том, что повышение в периферической крови воспалительных цитокинов и других медиаторов воспаления – например, простагландинов и лейкотриенов, усиление оксидативного и нитрозативного стресса на периферии – потенциально способно нарушить целостность ГЭБ [Ortelli P et al, 2021].
Проникая через ГЭБ, эти вещества запускают каскад нейровоспаления, нейроповреждения и нейродегенерации уже в самой ЦНС. А это приводит к многообразным вторичным неблагоприятным изменениям в синаптической нейропередаче, включая такие важные нейромедиаторные системы, как глутаматергическая система, система γ-аминомасляной кислоты (ГАМКергическая), все три моноаминергические и холинергическая системы [Ortelli P et al, 2021].
Вирус SARS-CoV-2 имеет свойство реплицироваться в промежуточном компартменте между эндоплазматическим ретикулумом (ЭПР) и комплексом Гольджи. Это приводит к стрессу ЭПР, митохондриальному окислительному стрессу, митохондриальной дисфункции и к гиперпродукции повреждённой клеткой различных сигнальных молекул, в частности, воспалительных цитокинов. Эти воспалительные цитокины, в свою очередь, запускают в ближайших и отдалённых от места повреждения клетках каскад чрезмерной, гиперергической воспалительной реакции [Hashimoto K, 2021].
А изучение механизмов взаимодействия между вирусом SARS-CoV-2 и клетками организма хозяина, в том числе – взаимодействия, опосредованного активацией ренин-ангиотензин-альдостероновой системы (РААС), системы эндотелина-1, сигма-1 рецепторов (S1R), каскадов воспалительных цитокинов, и аналогичных изменений в тех же системах, которые происходят при развитии ПТСР любого генеза – позволило одной исследовательской группе сформулировать гипотезу о ПТСР (причём не только о постковидном ПТСР, а вообще о ПТСР как таковом), как о системном воспалительном заболевании, повреждающем, в первую очередь, эндотелий сосудов, и о том, что агонисты сигма-1 рецепторов (S1R агонисты), такие, как флувоксамин – могут быть особенно полезными в лечении ПТСР, в силу своего противовоспалительного, иммуномодулирующего и ангиопротективного (эндотелиопротективного) действия [Sfera A et al, 2021].
Один из основных механизмов развития постковидного синдрома связывают с воспалением эндотелия сосудов, вызванным вирусной нагрузкой. Было показано, что значительное количество активированных моноцитов содержат спайк-белок (белок S1) и другие уже не способные к размножению частицы коронавируса SARS-CoV-2 даже спустя 15 месяцев после первичного заражения. Активированные моноциты разносят белки вируса SARS-CoV-2 по всему телу, связываются с эндотелием кровеносных сосудов и вызывают его воспаление. Это, в свою очередь, приводит к патологическому повышению проницаемости стенок кровеносных сосудов и развитию локального отёка, а также к повышению вероятности запуска каскада локальных микротромбозов как реакций на повреждение эндотелия сосудов, с соответствующими последствиями для тех участков живых тканей (в том числе для ткани мозга), которые в результате тромбоза остаются без кровоснабжения [Boldrini M et al, 2021; Patterson BK et al, 2022].
Кроме того, активированные моноциты, нагруженные фрагментами белков вируса SARS-CoV-2, могут проникать через повреждённый эндотелиальным воспалением ГЭБ, и запускать в мозгу каскад нейровоспаления (воспалительную реакцию микроглии). Это приводит к снижению в мозгу уровней моноаминов и трофических факторов, к утрате синапсов, к развитию оксидативного и нитрозативного стресса, свободнорадикального повреждения нервных и глиальных клеток, к повышению внеклеточных концентраций глутамата и N-метил-D-аспартата (NMDA) и к развитию эксайтотоксичности, и в конечном итоге – к апоптотической гибели нервных и глиальных клеток мозга (см. рис. № 1) [Boldrini M et al, 2021].
Сигма-1 рецепторы и их роль в терапии постковидных нарушений
Сигма-1 рецепторы – это важные сигнальные и рецепторные белки, которые расположены в эндоплазматическом ретикулуме (ER). Они являются мощными ингибиторами продукции воспалительных цитокинов и свободных радикалов (активных форм кислорода и азота). Кроме того, они также играют важную роль в модуляции внутриклеточной передачи сигналов и взаимодействуют со множеством цитоплазматических и мембранных рецепторов, ионных каналов, киназ и других ферментов, а также липидов клетки [Rosen DA, 2019].
Изменения в функциях и уровне экспрессии сигма-1 рецепторов, как сейчас полагают, могут играть важную роль в этиопатогенезе многих психических и неврологических расстройств, в том числе – аффективных и когнитивных расстройств, шизофрении, хронических болевых синдромов, нейродегенеративных заболеваний, ряда химических зависимостей (например, кокаиновой и метамфетаминовой) [Gris G et al, 2015; Ruscher K, Wieloch T, 2015; Hong WC et al, 2017; Ruiz-Cantero MC et al, 2021; Sałaciak K, Pytka K, 2022].
При любом внутриклеточном стрессе (таком, как вирусное повреждение, воздействие на клетку экзогенных или эндогенных токсинов, ионизирующей радиации, свободных радикалов, оксидативный или нитрозативный стресс, осмотический или температурный стресс, эксайтотоксичность в результате перевозбуждения клетки, гипоксия и др.), или при стимуляции лигандами сигма-1 рецепторы перемещаются с мембран митохондрий в направлении эндоплазматической ретикулярной сети, а также в направлении внутренней стороны плазматической мембраны клетки с целью оказания регулирующих влияний на активность целого ряда важных функциональных белков клетки, таких, как ионные каналы, рецепторы, киназы и другие внутриклеточные ферменты [Su TP et al, 2010; 2016].
Таким образом, сигма-1 рецепторы служат регуляторами, модуляторами и координаторами внутриклеточной передачи сигналов между органеллами клетки, как локально – между митохондриями и эндоплазматическим ретикулумом, так и глобально и удалённо – между клеткой и внешней средой (через модуляцию активности рецепторов, ионных каналов, киназ и других ферментов, расположенных на внешней стороне плазматической мембраны клетки) [Su TP et al, 2010; 2016].
В ЦНС активность сигма-1 рецепторов косвенно регулирует работу целого ряда нейромедиаторных систем, в том числе таких важных, как NMDA-опосредованная глутаматергическая, ГАМКергическая, серотонинергическая, норадренергическая и дофаминергическая системы, система мозгового нейротрофического фактора (BDNF) [Skuza G, 2012],
Кроме того, активность сигма-1 рецепторов играет роль в таких важных физиологических процессах в ЦНС, как модуляция восприятия боли, процессы нейровоспаления и нейродегенерации, синаптической дегенерации, апоптоза нервных клеток и, наоборот, процессы нейрогенеза, нейропластичности, синаптогенеза и синаптической пластичности, процессы нейрорепарации и нейрорегенерации или, как их ещё называют, процессы нейроремонта (восстановления ЦНС после тех или иных повреждений) [Kourrich S et al, 2012; Sanchez EL, Lagunoff M, 2015; Ruscher K, Wieloch T, 2015; Jia J et al, 2018; Jerčić L et al, 2019; Lisak RP et al, 2020].
В свете того, что COVID-19 и постковидный синдром являются мультиорганными и мультисистемными заболеваниями, поражающими многие различные органы и системы нашего организма, важно отметить, что сигма-1 рецепторы обильно экспрессируются, помимо ЦНС, также в ткани лёгких, в печени, в надпочечниках, в яичках у мужчин и в яичниках у женщин, в почках, в сердечной мышце и в эндотелии сосудов [Hashimoto K, 2013; 2021; Vela JM, 2020; Dalwadi DA et al, 2021].
Также следует отметить, что агонисты сигма-1 рецепторов, такие, как флувоксамин, значительно повышают уровень мозгового нейротрофического фактора (BDNF) в ЦНС, и поэтому они могут быть полезны при лечении постковидного синдрома и различных повреждений ЦНС (нейродегенеративных заболеваний, последствий черепно-мозговых травм, инсультов и др.), вне зависимости от их угнетающего влияния на процессы нейровоспаления [Hashimoto K, 2013; 2021; Dalwadi DA et al, 2021].
На сегодняшний день агонисты сигма-1 рецепторов активно разрабатываются в качестве перспективных терапевтических агентов, способных, с одной стороны, стимулировать процессы нейрогенеза, нейропластичности и нейрорепарации (нейровосстановления, нейроремонта), а с другой – угнетать процессы нейровоспаления, нейроповреждения и нейродегенерации. Оба этих свойства агонистов сигма-1 рецепторов – весьма важны для эффективного лечения постковидных осложнений [Brimson JM et al, 2020; Vela JM, 2020; Hashimoto K, 2021].
Флувоксамин как перспективный препарат для лечения COVID-19 и постковидного синдрома
Краткая общая характеристика флувоксамина
Флувоксамин – это АД из группы СИОЗС, который широко применяется в мире начиная с 1990-х годов [Ishima T et al, 2014; Hashimoto K, 2015; Cobos EJ et al, 2020].
Специфической особенностью фармакодинамики флувоксамина, резко отличающей его от всех остальных АД и в том числе – от всех прочих препаратов класса СИОЗС, является его сильный и высокоаффинный агонизм по отношению к сигма-1 рецепторам (S1R; флувоксамин, вообще, является самым высокоаффинным из всех ныне клинически применяемых агонистов S1R, причём он является таковым вовсе не только среди АД, но и среди всех лекарств; более высокоаффинные S1R агонисты либо пока находятся на ранних стадиях разработки для клинического применения, либо вообще имеют сугубо экспериментальное применение, без перспектив когда-либо «войти в клиническую практику») [Ishima T et al, 2014; Hashimoto K, 2015; Cobos EJ et al, 2020].
Эта особенность фармакодинамики флувоксамина предопределяет и ряд особенностей его клинического профиля как АД. В частности, с сильным S1R агонизмом флувоксамина – связывают сильное и быстро наступающее (нередко уже с первых дней терапии) анксиолитическое действие флувоксамина. Также стоит упомянуть влияние флувоксамина на повышение концентрации мелатонина, и связываемую с этим, его способность быстро, нередко уже с первой недели терапии, нормализовать нарушенные сон и циркадные ритмы [Беккер РА, Быков ЮВ, 2019 (a), (b)].
С сильным S1R агонизмом флувоксамина связывают также его прокогнитивные и антиамнестические свойства, выгодно отличающие его от других СИОЗС (способность флувоксамина улучшать нарушенные при депрессиях и тревожных состояниях когнитивные функции и память, что, кстати, немаловажно при постковидных депрессиях с учётом высокой частоты нейрокогнитивных нарушений при них) [Беккер РА, Быков ЮВ, 2019 (a), (b)].
С косвенным нормализующим действием флувоксамина на работу дофаминергической системы мозга, также реализующимся через его сильный S1R агонизм, связывают как его специфическое анти-ангедоническое действие (его способность эффективно устранять ангедонию, как один из ключевых симптомов депрессии, чего не наблюдается при применении других СИОЗС, в целом склонных давать некоторое «притупление эмоций»), так и его своеобразное антипсихотическое действие – его эффективность в монотерапии (без добавления антипсихотика – АП) при психотических формах депрессий. Более того, показано даже, что флувоксамин в монотерапии, без добавления АП, может быть эффективен при делириозных состояниях, например, у послеоперационных пациентов или у пациентов с БА [Furuse T, Hashimoto K, 2010; Беккер РА, Быков ЮВ, 2019 (a), (b)].
С наличием у флувоксамина сильной S1R агонистической активности связывают также его анальгетические свойства (которых, опять-таки, не наблюдается у других СИОЗС, в отличие от трициклических АД – ТЦА – или селективных ингибиторов обратного захвата серотонина и норадреналина – СИОЗСиН; последние два класса АД, впрочем, переносятся в среднем хуже, чем флувоксамин). Стоит отметить, что анальгетическая активность флувоксамина тоже может оказаться весьма полезной именно в контексте лечения постковидного синдрома, учитывая нередкую представленность в его картине различных болевых синдромов (головных болей, болей в животе, летучих болей в мышцах и/или суставах по типу фибромиалгии) [Беккер РА, Быков ЮВ, 2019 (a), (b)].
Однако ещё более интересно в данном контексте то, что сильная S1R агонистическая активность флувоксамина, по-видимому, обуславливает не только описанный нами выше ряд особенностей спектра его психотропной активности, но и ряд ценных для лечения постковидных пациентов его соматотропных свойств. В частности, задолго до пандемии COVID-19 было показано сильное обезболивающее, иммуномодулирующее, противовоспалительное и артро- (хондро-) протективное действие флувоксамина при артритах разного генеза, включая постинфекционные реактивные артриты (а ведь они нередко развиваются и у постковидных пациентов) [Riesner HJ et al, 2008].
В другой серии исследований – и тоже задолго до пандемии COVID-19 – было показано, что флувоксамин, благодаря своему S1R агонизму, обладает кардио- и ангиопротективными свойствами в самых разных контекстах, включая хроническую ишемию миокарда (ХИМ), хроническую сердечную недостаточность (ХСН) и др. Опять-таки, и это тоже может оказаться важным при лечении постковидных пациентов, учитывая, сколь часто у этой когорты пациентов встречаются симптомы со стороны ССС [Tagashira H, Fukunaga K, 2012; Bhuiyan S et al, 2013].
А ещё в одной серии исследований было показано, что флувоксамин, именно благодаря своему S1R агонизму, обладает сильными нейропротективными, противовоспалительными и иммуномодулирующими свойствами при самых разных органических поражениях ЦНС, например, после ЧМТ или ОНМК, или при развивающейся БА или БП, или в экспериментальной модели рассеянного склероза (РС). Флувоксамин уменьшал апоптотическую гибель клеток, накопление β-амилоида, улучшал выживаемость и размножение нервных стволовых клеток (нейрогенез), понижал секрецию таких воспалительных цитокинов, как интерферон-гамма (ИФН-γ) и повышал секрецию противовоспалительного цитокина интерлейкин-4 (ИЛ-4) [Ghareghani M et al, 2017; Shi M et al, 2022; Bogár F et al, 2022].
Опять-таки, и это свойство флувоксамина может оказаться важным в контексте лечения постковидных пациентов, учитывая данные о высокой нейроинвазивности и нейротоксичности вируса SARS-CoV-2, а также о провокации этим вирусом процессов нейровоспаления, нейроповреждения и нейродегенерации, вплоть до раннего манифеста БА, БП или развития de novo РС после перенесённого COVID-19 [Ghareghani M et al, 2017; Shi M et al, 2022; Bogár F et al, 2022].
По этому поводу стоит отметить, что флувоксамин сейчас рассматривается как перспективный терапевтический агент для репозиционирования в качестве средства лечения различных нейродегенеративных заболеваний, в том числе БА и БП. Параллельно ряд фирм ведёт разработки таких экспериментальных S1R агонистов, как AF710B (ANAVEX 3–71), для тех же целей [Bogár F et al, 2022].
Флувоксамин сравнительно недорог, хорошо переносится, прост в использовании, широко доступен во всём мире и обладает высокой степенью липофильности, что обеспечивает лёгкость его проникновения в клетки различных органов и тканей, включая такие часто поражаемые при COVID-19 и постковидном синдроме ткани, как эпителий лёгких, кардиомиоциты, клетки эндотелия сосудов, нервные и глиальные клетки и др. [Hallifax D, Houston JB, 2007].
Перейдём, однако, к рассмотрению механизмов противовоспалительного и иммуномодулирующего действия флувоксамина именно в контексте заболевания COVID-19.
Механизмы противовоспалительного и иммуномодулирующего действия флувоксамина при COVID-19
В конце 2020 года Гордон с соавторами установили, что выключение (нокаут) гена SIGMAR1, который кодирует белок S1R, вызывает существенное торможение репликации вируса SARS-CoV-2 как в культуре генетически модифицированных клеток, так и у нокаутных экспериментальных животных [Gordon DE et al, 2020 (a), (b)].
Между тем, белок S1R уже давно привлекал внимание исследователей из самых разных областей медицины, как влияющий на патофизиологию огромного множества самых различных заболеваний – психических, неврологических, аутоиммунных, сердечно-сосудистых, злокачественных и др. [Hayashi T, Su TP, 2008; Albayrak Y, Hashimoto K, 2017].
Чтобы понять, почему это так – нужно хорошо представлять себе, что вообще такое белок S1R, и какова его роль в клетке. Белок S1R – это многофункциональный белок-шаперон, один из белков теплового шока (БТШ), расположенный в ЭПР. Он опосредует перекрёстные взаимодействия сигналов между митохондриями и ядром клетки [Mahdi M et al, 2022].
Будучи белком-шапероном, белок S1R способствует правильному пространственному свёртыванию вновь синтезированных рибосомами белков, а также предотвращает внутриклеточное накопление неправильно свернувшихся белков [Hayashi T, Su TP, 2007; Rosen DA et al, 2019].
Кроме того, будучи одним из важнейших БТШ, белок S1R играет большую роль в механизмах неспецифической защиты клетки от воздействия самых разных стрессоров – будь то повышенная температура окружающей среды («тепловой шок», откуда и название всего этого семейства защитных белков – БТШ), или, наоборот, пониженная температура окружающей среды («криогенный шок»), или воздействие на клетку ионизирующей радиации, свободных радикалов (активных форм кислорода и азота – «оксидативный и/или нитрозативный стресс»), или осмотический стресс, нападение на клетку вирусов, гипоксия клетки и др. [Hayashi T, Su TP, 2007; Rosen DA et al, 2019].
Усиление экспрессии белка S1R – это один из универсальных ответов живых клеток на воздействие любого стрессора. Оно способствует повышению выживаемости клеток. То есть, можно сказать, что белок S1R обладает мощными цитопротективными и антиоксидантными свойствами. Один из механизмов цитопротекции, обеспечиваемой белком S1R, заключается в модуляции входящего тока ионов кальция (Ca2+) из ЭПР в митохондрии, особенно в моменты клеточного и/или митохондриального стресса [Hayashi T, Su TP, 2007; Rosen DA et al, 2019].
При вирусной инфекции, как и при любой другой форме клеточного стресса, гиперэкспрессия S1R играет защитную роль, уменьшая оксидативный и нитрозативный стресс митохондрий, а также стресс ЭПР от большого количества чужеродных (вирусных) или неправильно свёрнутых белков. Кроме того, гиперэкспрессия S1R индуцирует целый каскад цитопротективных, анти-апоптотических, направленных на обеспечение выживания клетки в стрессовых условиях, механизмов, и одновременно тормозит экспрессию про-апоптотических, летальных для клетки, сигналов и механизмов [Rosen DA et al, 2019].
Вышеупомянутые данные Гордона с соавторами о торможении репликации вируса SARS-CoV-2 при выключении гена SIGMAR1, наряду с более ранними исследованиями, которые указывали на наличие у лигандов S1R мощных противовоспалительных и иммуномодулирующих свойств, на их способность угнетать гиперпродукцию воспалительных цитокинов и повышать продукцию противовоспалительных цитокинов, снижать смертность экспериментальных животных от сепсиса – закономерно вызвали интерес к изучению потенциала использования уже существующих лигандов S1R в качестве средств лечения ранних этапов инфекции SARS-CoV-2 для предотвращения более тяжёлого течения этой инфекции и развития цитокинового шторма, поскольку уже было известно, что именно гиперергическая воспалительная реакция и цитокиновый шторм, а не сам вирус SARS-CoV-2 при заболевании COVID-19 представляют основную опасность для жизни и здоровья пациента [Rosen DA et al, 2019].
Между тем, ещё в 2014 году, задолго до пандемии COVID-19, Ишима с соавторами показали, что флувоксамин является самым высокоаффинным агонистом S1R среди всех клинически применяемых АД. Позднее было показано, что флувоксамин является самым высокоаффинным агонистом S1R среди всех зарегистрированных на сегодня лекарств вообще [Ishima T et al, 2014; Rosen DA et al, 2019].
Учитывая давно известную ключевую роль белка S1R в смягчении внутриклеточного стресса при вирусных инфекциях, различные лиганды S1R уже давно изучались в качестве потенциальных средств для лечения других вирусных инфекций (не для лечения инфекции SARS-CoV-2). Так, например, в контексте инфицирования вирусом гепатита С (Hepatitis С Virus – HCV) было показано, что белок S1R в гепатоцитах ко-локализуется вместе с не-структурными белками клетки, связывающимися с комплексом вирусной репликазы HCV, и что индукция экспрессии белка S1R способствует ускорению обезвреживания и элиминации из клетки как готовых частиц HCV, так и отдельных вирусных белков [Friesland M et al, 2013].
А совсем недавно было обнаружено, что белок nsp6 вируса SARS-CoV-2 – связывается с белком S1R и отключает многие из активируемых S1R внутриклеточных защитных, анти-апоптотических сигнальных каскадов. Кроме того, белок nsp6 вируса SARS-CoV-2 также перехватывает, опять-таки благодаря взаимодействию с белком S1R, управление трансляцией белков в рибосомах клетки, и направляет все ресурсы внутриклеточных рибосом на трансляцию вирусных белков, а не нужных самой клетке белков [Gordon DE et al, 2020 (a), (b)].
Большинство исследователей считают, что основным механизмом положительного воздействия флувоксамина на клиническое течение COVID-19 является его противовоспалительное и иммуномодулирующее действие, реализующееся через его высокопотентный S1R агонизм и активацию каскада S1R-IRE [Rosen DA et al, 2019; Facente SN et al, 2021].
Механизмы противовоспалительного действия флувоксамина в доклинических моделях
Предпосылкой для появления интереса к исследованию эффективности и безопасности применения флувоксамина для лечения COVID-19 стало получение некоторых интересных результатов сначала в исследованиях in vitro (в культурах клеток), а затем и in vivo (на экспериментальных животных) [Chen Y, Brandizzi F, 2013; Rosen DA et al, 2019].
Ещё в 2013-м году, задолго до пандемии COVID-19, в опытах in vitro было показано, что активация сигма-1 рецепторов угнетает выработку воспалительных цитокинов в макрофагах, причём этот эффект реализуется через угнетение ими активности так называемого IRE1 (инозитол-требующего фермента), который также образно называют датчиком стресса и исполнителем судьбы клетки (за влияние IRE1 на про-апоптотические и анти-апоптотические каскады в клетке) [Chen Y, Brandizzi F, 2013].
В 2019-м году Д. Розен с соавторами провели эксперимент по сопоставлению защитного действия агониста сигма-1 рецепторов флувоксамина и цефалоспоринового антибиотика 3-го поколения в модели грамотрицательного сепсиса у мышей. Сеттинг этого эксперимента состоял в том, что подопытным мышам вводили внутрибрюшинно сначала заведомо летальную в отсутствие лечения дозу мышиных фекалий, которые всегда содержат грамотрицательные бактерии (2 г/кг массы тела), а затем – флувоксамин и/или цефтриаксон [Rosen DA et al, 2019].
Авторы вышеупомянутого эксперимента сумели показать, что флувоксамин не уступал по эффективности цефтриаксону по влиянию на повышение выживаемости подопытных мышей после получения ими летальной дозы инфекционного материала. При совместном же применении действие флувоксамина и цефтриаксона в отношении защиты животных от грамотрицательного сепсиса суммировалось. Это говорит о том, что в защитном действии у флувоксамина и у цефтриаксона в экспериментальной модели грамотрицательного сепсиса у мышей – имеются разные и взаимно дополняющие друг друга (комплементарные) механизмы [Rosen DA et al, 2019].
Авторы данного исследования предположили, что основной механизм защитного действия флувоксамина в экспериментальной модели грамотрицательного сепсиса у животных, по всей вероятности, связан с агонистическим воздействием флувоксамина на сигма-1 рецепторы и с ингибированием через них активности IRE1. Основания для такого предположения им дало то, что в той же модели грамотрицательного сепсиса у нокаутных мышей с генетически выключенным сигма-1 рецептором летальность животных от септического шока была значительно выше, а защитное действие флувоксамина – практически не проявлялось [Rosen DA et al, 2019].
Кроме того, Розен с соавторами также показали, что активация сигма-1 рецепторов (S1R) и угнетение активности IRE1 играют защитную роль в экспериментальных моделях воспаления и сепсиса на животных. Введение флувоксамина улучшало биохимические показатели крови и клиническое состояние животных, снижало температуру их тела, уровни воспалительных цитокинов и маркеров воспаления и оксидативного стресса в крови и повышало выживаемость животных не только при их заражении экспериментальным грамотрицательным сепсисом, но и при введении им очищенных бактериальных липополисахаридов (ЛПС) (p<0,01) [Rosen DA et al, 2019].
Получив эти результаты, Розен с соавторами затем продемонстрировали, что противовоспалительное и иммуномодулирующее действие флувоксамина проявляется также на клетках человека in vitro. Флувоксамин в концентрации 20 мкМ значительно снижал in vitro воспалительный ответ лимфоцитов и макрофагов здоровых доноров на их стимуляцию бактериальным ЛПС, в частности, секрецию ими интерлейкина-1-бета (ИЛ-1β) (p<0,05), интерлейкина-6 (ИЛ-6) (р<0,01) и изоформы p40 интерлейкина-12 (ИЛ-12 p40) (p<0,01) [Rosen DA et al, 2019].
При этом очень важно отметить, что противовоспалительное и иммуномодулирующее действие флувоксамина ограничивается влиянием его на секрецию строго определённых воспалительных цитокинов, а не является результатом глубокого общего угнетения их продукции, как это имеет место быть при применении высоких доз глюкокортикоидов (ГК), или традиционных иммуносупрессоров и цитостатиков [Rosen DA et al, 2019].
Доказательная база по применению флувоксамина для лечения COVID-19
Первое пилотное исследование, посвящённое изучению эффективности и безопасности применения флувоксамина для лечения COVID-19, было предпринято E. Lenze с соавторами ещё летом 2020 года, во время первой волны пандемии. Это исследование имело формат небольшого, краткосрочного (15 суток) двойного слепого плацебо-контролируемого рандомизированного клинического испытания (РКИ) [Lenze EJ et al, 2020].
Все участники данного РКИ, страдающие подтверждённым лабораторно COVID-19 в лёгкой форме, были рандомизированы к получению либо флувоксамина (доза которого быстро, в течение нескольких дней, наращивалась с 50 мг 1 раз в сутки до 100 мг 3 раза в сутки = 300 мг/сут, если позволяла переносимость), либо плацебо. При этом ни та, ни другая группа пациентов не должны были, согласно дизайну исследования, получать каких-либо иных противовирусных, противовоспалительных или иммуномодулирующих препаратов [Lenze EJ et al, 2020].
Заранее определённой перед началом данного РКИ первичной конечной точкой исследования (primary endpoint) было клиническое ухудшение. Принятое авторами исследования определение того, что есть такое «клиническое ухудшение» в течении заболевания COVID-19 звучало так: «снижение насыщения артериальной крови кислородом (SaO2) ниже 92% при дыхании атмосферным воздухом, либо появление одышки при дыхании атмосферным воздухом, или же появление потребности в кислородной поддержке или ИВЛ» [Lenze EJ et al, 2020].
Авторы данного исследования сумели показать, что ни один из пациентов в группе активного лечения, получавшей флувоксамин, не достиг первичной конечной точки (то есть не испытал клинического ухудшения в течении болезни на протяжении 15 суток исследования). В то же время у 6 из 72 пациентов, которые получали плацебо, было зарегистрировано клиническое ухудшение – либо появление одышки при дыхании атмосферным воздухом, либо снижение SaO2 ниже 92% при дыхании атмосферным воздухом, либо появление потребности в кислородной поддержке [Lenze EJ et al, 2020].
На основании первых многообещающих результатов вышеописанного пилотного РКИ, чуть позднее – в ноябре-декабре 2020 года, во время второй волны COVID-19, другая группа авторов – провела открытое проспективное когортное исследование эффективности и безопасности применения флувоксамина в лечении острой фазы COVID-19 у пациентов с лёгкой (амбулаторной) формой заболевания [Seftel D, Boulware DR, 2021].
В этом исследовании доза флувоксамина была несколько ниже, чем в первом пилотном РКИ (100 мг/сут = 2 раза в сутки по 50 мг на протяжении 14 суток, тогда как в выше процитированном РКИ флувоксамин доводили до
300 мг/сут = 3 раза в сутки по 100 мг на протяжении 15 суток, если позволяла переносимость) [Seftel D, Boulware DR, 2021].
В общей сложности 65 пациентов согласились принимать флувоксамин, в то время как 48 пациентов выбрали режим «только наблюдение», без какого-либо конкретного лечения. Результаты этого исследования также показали значительное преимущество флувоксамина перед отсутствием лечения. Ни один из 65 пациентов, принимавших флувоксамин (0%), за 14 суток исследования не стал нуждаться в госпитализации, в отличие от 6 из 48 пациентов (12,5%) в группе «только наблюдения» (p=0,005) [Seftel D, Boulware DR, 2021].
Более того, несмотря на то, что группа пациентов, получавших флувоксамин, изначально была несколько более тяжёлой и испытывала в среднем бóльшее количество начальных симптомов заболевания – к сроку 14 суток ни у одного из 65 пациентов, получавших флувоксамин (0%), уже не было никаких симптомов болезни. В то же время у 29 из 48 пациентов, которые выбрали режим «только наблюдение» (то есть у 60% от общего их числа) – к сроку 14 суток всё ещё сохранялись те или иные симптомы заболевания COVID-19 (p<0,001) [Seftel D, Boulware DR, 2021].
Самое же крупномасштабное РКИ, названное TOGETHER и посвящённое изучению эффективности и безопасности применения флувоксамина в сопоставлении как с плацебо, так и с другими противовирусными и/или противовоспалительными и иммуномодулирующими препаратами, для амбулаторного лечения COVID-19 – было проведено уже в этом, 2022 году, в Бразилии, Гилмаром Рейсом с соавторами [Reis G et al, 2022].
По своему дизайну это было многоцентровое двойное слепое плацебо-контролируемое сравнительное РКИ.
В нём амбулаторные пациенты с лёгкой формой лабораторно подтверждённого COVID-19 были рандомизированы к получению либо флувоксамина (в дозе 200 мг/сут = 100 мг 2 раза в сутки), либо плацебо, либо других противовирусных, противовоспалительных или иммуномодулирующих лекарств по выбору врача (гидроксихлорохин, комбинация лопинавир/ритонавир, метформин, аторвастатин, ивермектин, доксазозин или интерферон-гамма) на протяжении 10 суток [Reis G et al, 2022].
В общей сложности 741 участник данного исследования получал флувоксамин, а 756 – получали плацебо. При этом в группе флувоксамина клиническое ухудшение на протяжении 10 дней наблюдения было зарегистрировано только у 79 из 741 участника (всего у 11%), в то время как в группе плацебо за этот же срок клиническое ухудшение наблюдалось у 119 из 756 пациентов, или у 16% от общего их числа (p<0,001) [Reis G et al, 2022].
Кроме того, пациентам из группы плацебо значительно чаще, чем пациентам из группы, получавшей флувоксамин, при развитии клинического ухудшения требовалась госпитализация, кислородная поддержка, ИВЛ или введение больших доз ГК и/или антицитокиновых препаратов [Reis G et al, 2022].
Пациенты из группы плацебо также проводили в среднем больше времени, по сравнению с пациентами из группы флувоксамина, в стационаре как таковом, и в отделениях реанимации и интенсивной терапии – в частности [Reis G et al, 2022].
Среди всех пациентов, получавших флувоксамин (то есть при intention-to-treat анализе), было зарегистрировано лишь 17 смертей из 741 принявших участие в исследовании, тогда как среди пациентов, получавших плацебо, было зарегистрировано 25 смертных случаев из 756 участников исследования [Reis G et al, 2022].
Стоит отметить, что в исследовании TOGETHER часть пациентов отказались от продолжения лечения тем или иным назначенным им препаратом из-за его плохой переносимости. Встречались отказы от продолжения лечения и в группе флувоксамина. При этом среди тех пациентов, которые завершили хотя бы 80% от курса лечения рекомендованной продолжительности (флувоксамин – 548 пациентов, плацебо – 618 пациентов) – в группе флувоксамина был зарегистрирован только 1 смертный случай, тогда как в группе плацебо было зарегистрировано 12 смертных случаев (р = 0,022) [Reis G et al, 2022].
Доверие к результатам исследования Рейса с соавторами повышается не только в связи с крупным размером выборки этого исследования (более 8 000 пациентов), но и тем, что полученные Рейсом с коллегами данные хорошо согласуются с теми данными, которые были получены во многих других, более ранних исследованиях. Так, например, в исследовании TOGETHER, так же как и в целом ряде других, более ранних исследований, ни метформин, ни ивермектин, ни комбинация лопинавир/ритонавир не показали достоверных отличий по эффективности от плацебо. В то же время в этом исследовании, так же как и в упоминавшихся нами выше исследованиях STOP COVID 1 и 2, флувоксамин показал статистически достоверные отличия по эффективности от плацебо [Reis G et al, 2022].
Будучи первым в истории крупным многоцентровым двойным слепым плацебо-контролируемым РКИ по применению флувоксамина в лечении COVID-19, исследование TOGETHER представило первые строгие (уровень доказательности А) доказательства эффективности и безопасности использования флувоксамина на ранних стадиях заболевания COVID-19, для предотвращения его более тяжёлого течения [Reis G et al, 2022].
Позднее в 2022-м году Кристина Гуо с соавторами опубликовали мета-анализ всех РКИ, посвящённых изучению эффективности и безопасности применения флувоксамина в лечении острой фазы заболевания COVID-19 и в профилактике его тяжёлого течения. В этот мета-анализ вошли, в частности, исследования STOP COVID 1 и STOP COVID 2 (первое пилотное РКИ и последующее follow-up исследование), а также выше процитированное нами исследование TOGETHER. Аналогичный мета-анализ был независимо проведён также группой Тодда Ли с соавторами [Guo CM et al, 2022; Lee TC et al, 2022].
Авторы обоих мета-анализов подтвердили высокое методологическое качество исследования TOGETHER, а также поддержали его выводы об эффективности и безопасности применения флувоксамина в лечении острой фазы заболевания COVID-19 и в профилактике его тяжёлого течения [Guo CM et al, 2022; Lee TC et al, 2022].
Признание большой практической ценности научных результатов, полученных в исследовании TOGETHER, и высочайшего методологического качества этой работы – очевидно из того факта, что Сообщество клинических исследований (SCS) признало исследование TOGETHER – лучшим научным исследованием 2021 года, а авторитетнейший журнал Nature включил исследование TOGETHER в ежегодно составляемый им ТОП-10 исследований, которые определили направления развития медицины и науки в 2022-м году.
На основании этих данных, Американский Институт клинического и экономического анализа (ICER) – независимая некоммерческая исследовательская организация в США, которая оценивает доказательную базу для применения тех или иных медицинских вмешательств, а затем выдаёт рекомендации для частных американских компаний медицинского страхования по включению или невключению тех или иных препаратов или медицинских услуг в «страховую корзину» для оплаты – в июне 2022 года выпустил рекомендации включить флувоксамин и паксловид в «страховую корзину» для оплаты лечения COVID-19 страховыми компаниями США [ICER Assessment, 2022; FDA News, 2022].
Одновременно ICER дал рекомендацию отклонить включение в «страховую корзину» лечения COVID-19 препарата молнуправир, ввиду недостаточной, по мнению ICER, убедительности доказательной базы по его эффективности и безопасности в лечении COVID-19 (в отличие от флувоксамина и паксловида) [ICER Assessment, 2022; FDA News, 2022].
Литературных данных, специфически посвящённых изучению эффективности и безопасности применения флувоксамина при постковидном синдроме и, в частности, при лечении постковидных депрессий и постковидной тревоги – в отличие от данных по применению флувоксамина при лечении COVID-19 для профилактики его тяжёлого течения – пока не существует.
Однако это не является большой проблемой. Во-первых, таких данных пока не существует и по многим другим препаратам, упомянутым в эмпирическом протоколе лечения постковидного синдрома, предложенном FLCCC. На фоне отсутствия таких данных врачу предлагается рассуждать по аналогии. А именно – если то или иное иммуномодулирующее или противовоспалительное лекарство оказалось эффективным и безопасным в острой фазе COVID-19, и если длительно персистирующее воспаление и иммунологические нарушения – играют существенную роль в этиопатогенезе постковидного синдрома – то логично предположить, что эти же лекарства могут оказаться эффективными и в лечении постковидного синдрома [FLCCC Protocol, 2022].
Во-вторых же, флувоксамин достоверно эффективен при широком спектре депрессивных, тревожных и диссомнических расстройств, включая депрессивные, тревожные и диссомнические расстройства на фоне разнообразных соматических патологий, известных задолго до пандемии COVID-19 (например, постинсультные, постинфарктные, посттравматические, постинфекционные депрессивные, тревожные и диссомнические расстройства) [Stahl SM, 2013; Ruiz P, 2017].
Представление клинического случая эффективности флувоксамина при постковидном синдроме
Клинический случай. Постковидный синдром с депрессией средней тяжести, тревогой, диссомническими нарушениями и САТК.
Мужчина Г. С., 1998 года рождения (24 года на момент обращения за консультацией к одному из авторов настоящей статьи). Холост, живёт один. Начитан, хорошо образован, имеет философский склад мышления, знает три европейских языка (помимо английского – также немецкий и итальянский). По образованию – программист. До болезни – сотрудник крупной международной IT компании. Психическими расстройствами ранее не страдал, к врачам по этому поводу не обращался. Наличие психических расстройств у родственников отрицает.
В феврале 2022 года данный пациент перенёс амбулаторно COVID-19 в лёгкой форме. На протяжении всего периода болезни (около месяца с момента первого положительного теста на COVID-19 до момента, когда тест стал стойко отрицательным) пациент оставался на режиме домашней изоляции.
Несмотря на сравнительно лёгкое течение самой болезни, после выздоровления от неё данный пациент стал предъявлять жалобы на сильную утомляемость, разбитость, физическую слабость, неспособность сосредоточиться на работе, вялость, апатию, выраженную тревогу, катастрофические мысли о будущем, тоску, подавленность, ночные кошмары апокалиптического содержания («снится Третья Мировая война»), пробуждения около 4-5 часов утра с сильной тревогой, тахикардией, чувством оцепенения и грядущей неминуемой катастрофы. Пациент был вынужден уволиться с работы.
Помимо этого, пациент также стал испытывать периодические, внешне ничем не спровоцированные (не связанные с воздействием какого-либо очевидного аллергена) приступы нестерпимого кожного зуда, сопровождавшиеся тошнотой и слабостью. Первым лечащим врачом данного пациента это состояние было расценено как «психогенный кожный зуд».
После первого обращения к психиатру в марте 2022 года данный пациент получил назначение пароксетина (10 мг утром, затем 20 мг утром) и гидроксизина (25 мг на ночь). Однако первый же приём пароксетина в дозе 10 мг вызвал у этого пациента приступ рвоты. После этого пациент отказался от продолжения лечения, и вплоть до начала мая 2022 года к врачам не обращался, попыток лечения не предпринимал.
В начале мая 2022 года данный пациент, продолжая испытывать всё тот же набор симптомов, обратился за консультацией к одному из соавторов данной статьи. На момент обращения показатель шкалы депрессии Бека у него составлял 24 балла (умеренная депрессия или депрессия средней тяжести), показатель шкалы тревоги Шихана – 68 баллов (значительно выраженная тревожность).
В общем анализе крови (ОАК) пациента внимание автора привлекла эозинофилия (16%). При этом никаких очевидных причин для эозинофильного сдвига в лейкоцитарной формуле у пациента не было: анализ на яйца глистов, предпринятый после обнаружения эозинофилии в крови, оказался отрицательным, уровни антител к распространённым паразитам в крови – близкими к нулевым. Зато в стандартном биохимическом (БХ) анализе крови был обнаружен повышенный уровень СРБ (20 мг/л), при этом очевидных воспалительных или ревматических заболеваний у пациента также обнаружено не было.
После консультации с иммунологом-аллергологом было выдвинуто предположение о том, что как эозинофилия в периферической крови, так и приступы нестерпимого кожного зуда с тошнотой, слабостью и гипотензией – могут объясняться развитием САТК, который, как известно, может манифестировать в рамках постковидного синдрома после перенесённого COVID-19. Повышенный же СРБ в рамках нашей гипотезы объясняется перенесённым сравнительно недавно COVID-19 и наличием депрессии с тревогой.
С учётом данных о той большой патогенетической роли, которую играют воспаление и иммунологические нарушения в патогенезе именно постковидных депрессий и постковидной тревоги, а также с учётом специфики клинической картины депрессии у данного пациента (в которой присутствовали выраженная тревожность и диссомнические нарушения) и наличия у флувоксамина противовоспалительного и иммуномодулирующего действия (связанного с его сигма-1 рецепторной активностью) и выраженных анксиолитических свойств и способности нормализовывать сон и циркадные ритмы – мы сочли, что именно флувоксамин будет наилучшим выбором АД для данного пациента.
Начальная доза флувоксамина составила 50 мг на ночь. В последующем с интервалами 4 дня доза была доведена до 200 мг/сут (100 мг 2 раза в сутки), с хорошей переносимостью.
С учётом наличия у пациента также постковидного САТК, после консультации с иммунологом-аллергологом, данному пациенту был назначен короткий курс преднизолона (15 мг утром в один приём на протяжении 14 сут, 10 мг утром последующие 4 дня, 5 мг утром ещё 4 дня, 0), и 250 мг хлорохин на ночь, после ужина. Позднее хлорохин был заменен на кетотифен 1 мг на ночь.
Данная терапия привела к становлению у пациента полной клинической ремиссии к сроку 4 недели терапии, причём как по линии депрессии, тревоги и диссомнических нарушений, так и по линии САТК.
Пациент восстановил трудоспособность. Имея хорошую репутацию на прежнем месте работы, он легко вернулся на прежнюю должность, где и работает сейчас.
Заключение
Как видно из приведённых нами в этой статье данных литературы, флувоксамин, благодаря уникальному сочетанию своих фармакологических свойств, которое включает, наряду с «основным» для всякого АД действием – антидепрессивным и противотревожным – также мощные противовоспалительные, иммуномодулирующие, нейро-, хондро- и кардиопротективные свойства, анальгетическую активность – может оказаться перспективным и предпочтительным средством лечения постковидного синдрома, причём не только его нейропсихиатрических проявлений, таких, как депрессия, тревожность или диссомнические нарушения, но и общесоматических проявлений.
Эти особенности флувоксамина, выгодно отличающие его от других АД именно в контексте лечения постковидного синдрома, и делающие его препаратом выбора при данной патологии – связаны с тем, что флувоксамин является самым мощным среди всех клинически применяемых АД агонистом сигма-1 рецепторов.
Клинический случай, представленный в данной статье, на наш взгляд, ярко и убедительно иллюстрирует этот тези


