Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2019
Ангедония в психиатрии и современные возможности ее психофармакологической коррекции с помощью препарата Вальдоксан® (агомелатин) №05 2019
Ангедония является одним из ключевых, ядерных симптомов депрессии. Между тем результаты лечения депрессии часто бывают неудовлетворительными, а достигнутые при этом ремиссии – неполными. Среди прочих остаточных симптомов депрессии часто встречается резидуальная ангедония. Патофизиологические механизмы развития ангедонии включают в себя нарушения в работе дофаминергической и норадренергической систем мозга, а также нейровоспаление и/или системное воспаление в организме и вызываемые им вторичные изменения, такие как оксидативный и нитрозативный стресс, гиперактивация оси «гипоталамус–гипофиз–надпочечники», воспалительно-дистрофические изменения в центральной нервной системе, апоптоз нейронов лимбики и гиппокампа и постепенная атрофия этих мозговых структур и др. Ангедония теснее прочих симптомов депрессии связана с нейровоспалением и/или системным воспалением и с вызываемыми им упомянутыми вторичными изменениями. Препарат Вальдоксан® (агомелатин), обладая одновременно свойствами агониста мелатониновых MT1- и MT2-рецепторов, обусловливающими его сильную противовоспалительную, иммуномодулирующую, антиоксидантную и нейропротективную активность, и свойствами антагониста серотониновых рецепторов подтипов 5-HT2C и 5-HT2B, обусловливающими его косвенное норадренергическое и дофаминергическое действие, является эффективным и безопасным средством устранения ангедонии при депрессивных синдромах различного генеза, в том числе резидуальной ангедонии, сохраняющейся после лечения другими антидепрессантами.
Ключевые слова: ангедония, депрессия, биполярное аффективное расстройство, шизофрения, эндофенотип, нейровоспаление, агомелатин, Вальдоксан.
Для цитирования: Беккер Р.А., Быков Ю.В. Ангедония в психиатрии и современные возможности ее психофармакологической коррекции с помощью препарата Вальдоксан® (агомелатин). Психиатрия и психофармакотерапия. 2019; 21 (5): 22–29.
Ангедония является одним из ключевых, ядерных симптомов депрессии. Между тем результаты лечения депрессии часто бывают неудовлетворительными, а достигнутые при этом ремиссии – неполными. Среди прочих остаточных симптомов депрессии часто встречается резидуальная ангедония. Патофизиологические механизмы развития ангедонии включают в себя нарушения в работе дофаминергической и норадренергической систем мозга, а также нейровоспаление и/или системное воспаление в организме и вызываемые им вторичные изменения, такие как оксидативный и нитрозативный стресс, гиперактивация оси «гипоталамус–гипофиз–надпочечники», воспалительно-дистрофические изменения в центральной нервной системе, апоптоз нейронов лимбики и гиппокампа и постепенная атрофия этих мозговых структур и др. Ангедония теснее прочих симптомов депрессии связана с нейровоспалением и/или системным воспалением и с вызываемыми им упомянутыми вторичными изменениями. Препарат Вальдоксан® (агомелатин), обладая одновременно свойствами агониста мелатониновых MT1- и MT2-рецепторов, обусловливающими его сильную противовоспалительную, иммуномодулирующую, антиоксидантную и нейропротективную активность, и свойствами антагониста серотониновых рецепторов подтипов 5-HT2C и 5-HT2B, обусловливающими его косвенное норадренергическое и дофаминергическое действие, является эффективным и безопасным средством устранения ангедонии при депрессивных синдромах различного генеза, в том числе резидуальной ангедонии, сохраняющейся после лечения другими антидепрессантами.
Ключевые слова: ангедония, депрессия, биполярное аффективное расстройство, шизофрения, эндофенотип, нейровоспаление, агомелатин, Вальдоксан.
Для цитирования: Беккер Р.А., Быков Ю.В. Ангедония в психиатрии и современные возможности ее психофармакологической коррекции с помощью препарата Вальдоксан® (агомелатин). Психиатрия и психофармакотерапия. 2019; 21 (5): 22–29.
Anhedonia in psychiatry and modern opportunities of its psychopharmacologic treatment with Valdoxan® (agomelatine)
R.A. Bekker1, Yu.V. Bykov*2
1David Ben-Gurion University in Negev, Be’er-Sheva, Israel;
2Stavropol State Medical University, Stavropol, Russia
*yubykov@gmail.com
Abstract
Anhedonia is one of the key symptoms of depression. Meanwhile, the results of treatment for depression are often unsatisfactory, and the remissions achieved with it are often incomplete. Among other residual symptoms of depression, residual anhedonia is common. The pathophysiological mechanisms of the development of anhedonia include disturbances in the functioning of the dopaminergic and noradrenergic systems of the brain, as well as neuroinflammation and/or systemic inflammation in the body and the secondary changes caused by it, such as oxidative and nitrosative stress, hyperactivation of the hypothalamic-pituitary-adrenal axis, inflammatory and dystrophic changes in the central nervous system, apoptosis of limbic and hippocampal neurons and gradual atrophy of these brain structures, etc. Anhedonia is more closely related to neuroinflammation and/or systemic inflammation than any other symptoms of depression. Agomelatine (Valdoxan®), possessing both the properties of an agonist of melatonin MT1 and MT2 receptors, which determine its strong anti-inflammatory, immunomodulating, antioxidant and neuroprotective activity, and the properties of a selective antagonist of serotonin receptors of subtypes 5-HT2C and 5-HT2B, which determine its indirect dopaminergic and noradrenergic activity, is an effective and safe means of eliminating anhedonia in depression, including residual anhedonia which sustained after treatment with other antidepressants.
Key words: anhedonia, major depression, bipolar disorder, schizophrenia, endophenotype, neuroinflammation, agomelatine, Valdoxan.
For citation: Bekker R.A., Bykov Yu.V. Anhedonia in psychiatry and modern opportunities of its psychopharmacologic treatment with Valdoxan® (agomelatine). Psychiatry and Psychopharmacotherapy. 2019; 21 (5): 22–29.
Введение (Актуальность проблемы ангедонии в психиатрии)
В одной из предыдущих наших статей мы уже упоминали о том, что среди всех симптомов, входящих в определение «большого депрессивного эпизода» по Международной классификации болезней 10-го пересмотра (т.е. в определение депрессивного синдрома, будь он в рамках большого депрессивного расстройства, в рамках униполярного рекуррентного депрессивного расстройства или в рамках депрессивной фазы биполярного аффективного расстройства), именно ангедония (снижение или полная утрата способности испытывать радость и удовольствие от жизни в целом и от тех видов активности, которые раньше приносили радость и удовольствие) в наибольшей степени подходит для выделения в качестве ключевого, ядерного признака данного синдрома, признака, отличающего депрессивный синдром от «просто плохого настроения» или от так называемой «бытовой хандры» (S. Gershon, J. Soares, 2000; Р.А. Беккер, Ю.В. Быков, 2019).
Там же мы упоминали и о том, что, по данным международной исследовательской группы, возглавляемой Самуэлем Гершоном, именно ангедония в наибольшей степени подходит на роль одного из основных компонентов так называемого эндофенотипа депрессивного синдрома. Эндофенотип определяется как симптом или симптомокомплекс, лежащий ближе всего к предполагаемым нейробиологическим (например, нейрохимическим, нейрофизиологическим, генетическим или эпигенетическим) основам того или иного заболевания (в данном случае – депрессии) и предположительно порождающий все остальные симптомы этого заболевания (S. Gershon, J. Soares, 2000; Р.А. Беккер, Ю.В. Быков, 2019).
В то же время данной исследовательской группе удалось также показать, что ангедония является достаточно неспецифическим симптомом, и что она часто наблюдается также при шизофрении, шизоаффективном расстройстве, шизотипическом расстройстве и других расстройствах шизофренического спектра (РШС) [S. Gershon, J. Soares, 2000; Р.А. Беккер, Ю.В. Быков, 2019].
Более того, при многопараметрическом компьютерном анализе выяснилось, что именно ангедония является ключевым, ядерным, «эндофенотипическим» симптомом как в субдомене депрессивной симптоматики РШС, так и в субдомене негативной симптоматики. В частности, именно ангедонией можно объяснить как «притупление эмоций», «уплощение аффекта», так и снижение энергии, воли, мотивации, побуждений, инициативы – «зачем что-то делать, если это не приносит удовольствия?» (S. Gershon, J. Soares, 2000; Р.А. Беккер, Ю.В. Быков, 2019).
Проблема терапевтической резистентности депрессивных синдромов и резидуальной ангедонии
 С другой же стороны, современные исследования показывают, что, несмотря на появление множества новых антидепрессантов (АД), эффективность лечения депрессивного синдрома, будь он в рамках биполярного аффективного расстройства, униполярного рекуррентного депрессивного расстройства или какого-либо РШС, все еще оставляет желать лучшего. Лишь около 30% пациентов достигают ремиссии на первом же назначенном АД. Еще у 20–30% пациентов при первой попытке лечения АД наблюдается частичное улучшение, и еще у 30% – при первой попытке лечения АД не наблюдается вообще никакого положительного терапевтического эффекта (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
С другой же стороны, современные исследования показывают, что, несмотря на появление множества новых антидепрессантов (АД), эффективность лечения депрессивного синдрома, будь он в рамках биполярного аффективного расстройства, униполярного рекуррентного депрессивного расстройства или какого-либо РШС, все еще оставляет желать лучшего. Лишь около 30% пациентов достигают ремиссии на первом же назначенном АД. Еще у 20–30% пациентов при первой попытке лечения АД наблюдается частичное улучшение, и еще у 30% – при первой попытке лечения АД не наблюдается вообще никакого положительного терапевтического эффекта (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Две последние группы депрессий называются терапевтически резистентными депрессиями (ТРД) с различной степенью резистентности. Например, как мы уже писали, первая степень резистентности (полное отсутствие эффекта или недостаточный, неполный эффект от первого испробованного АД без достижения ремиссии) встречается в 50–70% всех случаев депрессии (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Большой процент пациентов с ТРД различных степеней среди всех депрессивных пациентов вынуждает специалистов, занимающихся лечением депрессий, столкнувшись с ТРД, пытаться использовать различные стратегии достижения терапевтического успеха или ремиссии. Например, замену первого испробованного АД на другой, комбинирование АД из разных фармакологических классов, потенцирование (аугментацию) АД другими терапевтическими агентами, применение различных нефармакологических методов лечения и т.п. (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Одним из наиболее часто наблюдаемых резидуальных (остаточных) симптомов депрессии, т.е. симптомов, которые нередко сохраняются у пациента и после достижения ремиссии или частичного терапевтического эффекта, является как раз ангедония. Это может выглядеть по-разному. Например, это может выглядеть так, что уровень энергии, активности пациента под влиянием АД нормализуется, его настроение также выглядит внешне нормальным, не сниженным. Однако его способность испытывать радость и удовольствие от жизни в целом и от прежде приносивших приятные эмоции занятий в частности по-прежнему снижена по сравнению с доболезненным уровнем (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Между тем показано, что у пациентов, у которых в состоянии ремиссии сохраняется хотя бы один резидуальный депрессивный симптом (в том числе, например, резидуальная ангедония), в 3 раза повышен риск развития рецидива или повторного эпизода депрессии в ближайшие полгода по сравнению с пациентами, достигшими действительно полной ремиссии, без каких-либо резидуальных симптомов депрессии (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Кроме того, пациенты с резидуальной депрессивной симптоматикой, сохраняющейся в состоянии ремиссии (в том числе с резидуальной ангедонией), также имеют худшие показатели общего качества жизни, худшие показатели восстановления работоспособности или академической успеваемости, семейно-бытового, социального и когнитивного функционирования (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Все это, вместе взятое, убедительно доказывает важность полного устранения всей резидуальной депрессивной симптоматики, в том числе важность устранения резидуальной ангедонии, важность добиваться действительно полной ремиссии как для профилактики ближайших и отдаленных рецидивов, так и для достижения оптимальных результатов лечения с точки зрения качества жизни пациента, восстановления его работоспособности и/или способности к учебе (академической успеваемости), его социальной, профессиональной и когнитивной реабилитации (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Дифференцированный подход к выбору антидепрессивной терапии в зависимости от клинической симптоматики депрессии
В случаях ТРД существование четких стандартных алгоритмов последовательного перебора монотерапий АД из разных классов, затем комбинаций АД и затем методов их потенцирования (аугментации), описанных в соответствующих авторитетных руководствах и рекомендациях, безусловно, облегчает практическому врачу принятие решения о том, что делать на каждом следующем шаге алгоритма, т.е. при регистрации у пациента каждой следующей, более высокой, степени терапевтической резистентности (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Однако подобный алгоритмизированный перебор вариантов лечения депрессии стоит очень дорого как в терминах непосредственного экономического ущерба от временной нетрудоспособности пациента или от снижения производительности его труда и от многократных безуспешных попыток его лечения, так и в терминах потери времени при затягивании лечения, риска хронификации депрессии и нарастания ее резистентности, риска разочарования пациента в возможностях лечения депрессии и снижения его комплаентности к лечению, риска неблагоприятных социальных последствий затяжной депрессии для пациента, его семьи и близких, таких как потеря работы или переход на менее квалифицированную и хуже оплачиваемую работу, прекращение учебы, конфликты в семье, развод, потеря контакта с друзьями и близкими и т.п. (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Поэтому у практикующих врачей давно сформировался запрос на разработку методов, позволяющих сэкономить время на таком переборе и по возможности быстрее попасть в цель, т.е. подобрать лекарства или методы лечения, способные принести долгожданный терапевтический успех именно данному конкретному депрессивному пациенту (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013).
Одним из наиболее перспективных методов, позволяющих этого добиться, является дифференцированный индивидуальный подход к выбору антидепрессивной терапии, учитывающий как клиническую симптоматику или форму депрессии у данного конкретного пациента и предполагаемые патофизиологические механизмы, лежащие в основе развития того или иного специфического депрессивного симптома, так и специфические особенности нейрохимического профиля действия того или иного АД, в частности особенности его влияния на разные моноаминергические системы мозга (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013; S. Stahl, 2013).
Клиническая эффективность этого подхода основана, с одной стороны, на том, что ряд специфических депрессивных симптомов, как показывают исследования, имеет более тесную патофизиологическую связь с нарушениями в какой-либо одной моноаминергической системе мозга, чем с нарушениями в двух других основных моноаминергических системах. С другой же стороны, эффективность этого подхода связана с тем, что сегодня существует большой выбор различных АД, многие из которых достаточно селективно влияют на активность какой-либо одной моноаминергической системы мозга, сравнительно мало влияя на остальные две (вернее, оказывая на них лишь косвенное влияние) [Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013; S. Stahl, 2013].
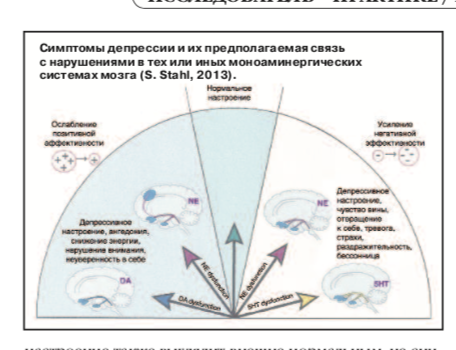 Все симптомы депрессии можно условно разделить на две большие, но отчасти пересекающиеся подгруппы – симптомы, связанные с недостатком позитивной аффективности (ангедония, сниженный фон настроения, вялость, апатия, абулия, нарушения концентрации внимания, памяти, снижение энергии, активности и др.), и симптомы, связанные с избытком негативной аффективности (сниженный фон настроения, чувство вины или стыда, отвращение к себе, тревога, страхи, беспокойство, внутреннее напряжение, раздражительность, гневливость, враждебность, бессонница, суицидальные идеи) [Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013; S. Stahl, 2013].
Все симптомы депрессии можно условно разделить на две большие, но отчасти пересекающиеся подгруппы – симптомы, связанные с недостатком позитивной аффективности (ангедония, сниженный фон настроения, вялость, апатия, абулия, нарушения концентрации внимания, памяти, снижение энергии, активности и др.), и симптомы, связанные с избытком негативной аффективности (сниженный фон настроения, чувство вины или стыда, отвращение к себе, тревога, страхи, беспокойство, внутреннее напряжение, раздражительность, гневливость, враждебность, бессонница, суицидальные идеи) [Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013; S. Stahl, 2013].
Предполагаемую связь этих двух подгрупп симптомов депрессии с нарушениями в тех или иных моноаминергических системах мозга иллюстрирует рисунок.
Предполагаемые патофизиологические механизмы развития ангедонии
Как мы уже писали ранее, использование предложенного дифференцированного подхода к выбору АД в зависимости от клинической симптоматики депрессий предполагает, что у нас имеются некие гипотезы относительно патофизиологических механизмов, лежащих в основе развития тех или иных симптомов депрессии, и что у нас также имеется возможность подобрать АД, более или менее специфически воздействующий именно на эти патофизиологические механизмы и, таким образом, способствующий особенно эффективному устранению именно этих симптомов депрессии (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013; S. Stahl, 2013).
Поскольку наша статья посвящена именно ангедонии, то мы остановимся на предполагаемых патофизиологических механизмах ее развития чуть подробнее.
С одной стороны, как показано на рисунке, развитие ангедонии связывают в большей мере с дисфункцией дофаминергических и отчасти норадренергических систем мозга, чем с дисфункцией серотонинергических систем (Г.Э. Мазо, Н.Г. Незнанов, 2012; Ю.В. Быков и соавт., 2013; S. Stahl, 2013).
С другой же стороны, ангедонию считают тесно связанной с нейровоспалением и/или с системным воспалением в организме, т.е. с повышенной воспалительной активностью нейроглии, изменениями в цитокиновом профиле крови и вторичной, вызванной воспалением, гиперактивностью оси «гипоталамус–гипофиз–надпочечники» (ГГН), вторичным, также вызванным именно воспалением, усилением оксидативного и нитрозативного стресса, с вторичными воспалительно-дистрофическими изменениями в центральной нервной системе (ЦНС), в частности снижением секреции BDNF, постепенной атрофией гиппокампа и эмоциональных центров лимбической системы (X. Fang и соавт., 2019; E. Dempsey и соавт., 2019; M. Moieni и соавт., 2019).
Ангедонию считают более тесно связанной с нейровоспалением и/или с системным воспалением в организме, чем любой другой отдельно взятый симптом депрессии.
В пользу этого свидетельствует, в частности, тот факт, что такие вызывающие системный и мозговой воспалительный ответ воздействия, как, например, введение бактериальных липополисахаридов или вызывание экспериментального колита, экспериментальной нейропатической боли, вызывают у экспериментальных животных в первую очередь развитие ангедонии (в частности, снижение потребления 5% раствора сахарозы) и только затем, причем не всегда и не у всех животных, развитие остальных симптомов депрессии и тревоги (X. Fang и соавт., 2019; E. Dempsey и соавт., 2019; M. Moieni и соавт., 2019).
Другими важными доказательствами тесной связи именно ангедонии с нейровоспалением и/или с системным воспалением в организме являются такие факты, как доказанная эффективность антицитокиновых агентов (например, инфликсимаба, этанерцепта), а также иммуномодуляторов и противовоспалительных препаратов (например, целекоксиба, миноциклина, тофацитиниба) не только и не столько в лечении депрессии в целом, сколько в устранении именно ангедонии, или тот факт, что у депрессивных пациентов с резидуальной ангедонией, сохраняющейся в состоянии ремиссии, сохраняются также и воспалительные сдвиги в цитокиновом профиле крови (Y. Lee и соавт., 2018; G. Wittenberg и соавт., 2019; L. Yin и соавт., 2019).
На данный момент уже существует синтетическая нейробиологическая гипотеза, тесно увязывающая и соединяющая две вышеописанные гипотезы о патофизиологических механизмах развития ангедонии – «дофаминовую» и «воспалительную». Эта гипотеза показывает, каким образом нейровоспаление и/или системное воспаление в организме может приводить к нарушениям в работе именно дофаминергических систем мозга и, в частности, в работе «дофаминового пути удовольствия» (dopamine pleasure pathway), связывающего вентральную область покрышки (Ventral Tegmental Area) и прилежащее ядро (Nucleus Accumbens). Это, в свою очередь, приводит к развитию ангедонии, снижению мотивации и энергии, развитию апатии и абулии, а также к когнитивным нарушениям (нарушениям рабочей памяти, исполнительных функций и концентрации внимания) за счет нарушения функции вентромедиальной префронтальной коры (Ventro-Medial Prefrontal Cortex), получающей обильную дофаминергическую иннервацию (J. Felger, M. Treadway, 2017; L. Yin и соавт., 2019).
Теоретические предпосылки для использования Вальдоксана (агомелатина) для коррекции ангедонии
Препарат Вальдоксан® (агомелатин) является теоретически перспективным средством для коррекции ангедонии сразу по двум причинам. Первая причина состоит в том, что агомелатин, благодаря своей способности блокировать
5-HT2C- и 5-HT2B-серотониновые рецепторы (Ki=631 nM и 660 nM соответственно), обладает косвенным норадренергическим и продофаминергическим действием. За счет своего 5-HT2C- и 5-HT2B- блокирующего действия агомелатин косвенным механизмом повышает содержание дофамина и норадреналина в префронтальной коре, а также в прилежащем ядре и в других структурах лимбической системы, вовлеченных в регуляцию эмоций, в том числе и чувства удовольствия (M. Millan и соавт., 2003; D. Dridi и соавт., 2013; S. Stahl, 2013).
Таким образом, агомелатин воздействует именно на те нейромедиаторные системы мозга, которые, как мы уже указывали, в наибольшей степени вовлечены в патогенез ангедонии, – дофаминовую и норадреналиновую (M. Millan и соавт., 2003; D. Dridi и соавт., 2013; S. Stahl, 2013).
В то же время большинство современных АД воздействуют либо преимущественно на серотониновую систему мозга (как селективные ингибиторы обратного захвата серотонина – СИОЗС), либо на серотониновую и норадреналиновую системы (как селективные ингибиторы обратного захвата серотонина и норадреналина – СИОЗСиН, трициклические антидепрессанты или некоторые атипичные АД) и практически не затрагивают напрямую дофаминергические системы мозга (S. Stahl, 2013; J. Nadar и соавт., 2018; Y. Santana и соавт., 2019).
Это приводит к недостаточной эффективности упомянутых АД в устранении именно тех симптомов депрессии, которые связывают с дисфункцией дофаминергической и норадренергической систем мозга, – ангедонии, амотивации, апатии, абулии, когнитивных нарушений. Более того, некоторые современные АД, в частности препараты группы СИОЗС, даже способны реципрокно понижать дофаминергическую и отчасти норадренергическую активность в ЦНС. Это может приводить к развитию синдрома, известного как «СИОЗС-апатия», к снижению энергии, активности, мотивации, либидо, сексуальной дисфункции, повышенной сонливости и вялости, развитию когнитивных нарушений и опять-таки к ангедонии или «уплощению эмоций и аффекта» (S. Stahl, 2013; J. Nadar и соавт., 2018; Y. Santana и соавт., 2019).
В свете того, сколь ограничены наши сегодняшние возможности прямого влияния на активность дофаминергических систем мозга при депрессиях, косвенная продофаминергическая активность агомелатина заслуживает особого внимания (S. Stahl, 2013; P. Belujon, A. Grace, 2017).
С другой же стороны, агомелатин является перспективным препаратом для коррекции ангедонии еще и потому, что, благодаря имеющимся у него свойствам агониста мелатониновых MT1- и MT2-рецепторов, он, подобно эндогенному мелатонину, является мощным иммуномодулятором и противовоспалительным агентом, а также мощным нейропротектором и антиоксидантом (H. Kalkman,
D. Feuerbach, 2016; K. Gupta и соавт., 2017; A. Rossetti и соавт., 2018).
Между тем, как мы уже указывали, ангедония теснее всех прочих симптомов депрессии связана с нейровоспалением и/или с системным воспалением в организме и с вызываемыми воспалением вторичными изменениями, такими как оксидативный и нитрозативный стресс, апоптоз нейронов лимбики и гиппокампа и постепенная атрофия этих структур мозга, гиперактивация оси ГГН. И напротив, противовоспалительные агенты, иммуномодуляторы и антицитокиновые препараты являются перспективными средствами устранения ангедонии при депрессиях (Y. Lee и соавт., 2018; G. Wittenberg и соавт., 2019; L. Yin и соавт., 2019).
В связи с этим наличие у Вальдоксана (агомелатина) сильного противовоспалительного, иммуномодулирующего, антиоксидантного и нейропротективного действия позволяет предположить, что и он может быть весьма эффективным средством устранения ангедонии при депрессивных синдромах различного происхождения (S. Stahl, 2013).
Это теоретическое предположение подтвердилось клинической практикой (S. Stahl, 2013). Ниже мы представим доказательную базу для применения агомелатина в качестве корректора ангедонии при различных депрессивных синдромах.
Доказательная база для применения Вальдоксана (агомелатина) как корректора ангедонии
Теоретические предположения о возможной специфической эффективности агомелатина в устранении именно ангедонии, основанные на знании механизмов его нейрохимического действия и предполагаемых патофизиологических механизмов развития ангедонии, сначала подверглись экспериментальной, доклинической проверке на животных. При этом было показано, что агомелатин эффективнее, чем «эталонный» АД флуоксетин, восстанавливает потребление экспериментальными животными 5% раствора сахарозы (количественное мерило испытываемой животными ангедонии). Кроме того, агомелатин в экспериментах на животных оказался эффективнее флуоксетина в предотвращении апоптоза нейронов гиппокампа и развития гиппокампальной атрофии (которая является нейроанатомическим субстратом ангедонии и когнитивных нарушений) [G. Dagytė и соавт., 2011; M. El Yacoubi и соавт., 2011].
Первые сообщения о клинической эффективности агомелатина в качестве средства коррекции ангедонии (в том числе резидуальной ангедонии, оставшейся после неуспешного или частично успешного лечения другими АД) относятся к 2011 г. В этом году группа итальянских авторов, основываясь на уже известных продофаминергических и норадренергических свойствах агомелатина и на достоверно установленной роли нарушений в работе дофаминергических и норадренергических систем мозга в патогенезе ангедонии, предприняла 8-недельное открытое пилотное исследование эффективности агомелатина как в лечении большого депрессивного эпизода в целом, так и в устранении ангедонии, а также нарушений сна и циркадианных ритмов (M. Di Giannantonio и соавт., 2011).
В упомянутом исследовании приняли участие 30 пациентов с большим депрессивным эпизодом. Часть из них уже ранее получали другие АД без какого-либо эффекта или с недостаточным, неполным эффектом. Всем им назначалась монотерапия агомелатином в дозе 25 или 50 мг перорально на ночь на протяжении 8 нед. Из 30 принявших участие в исследовании пациентов 24 (80%) завершили это исследование (дошли до 8-й недели) [M. Di Giannantonio и соавт., 2011].
Эффект агомелатина в отношении депрессивной симптоматики в данном исследовании оценивался по шкале Гамильтона для оценки депрессии (HAM-D), эффект в отношении тревожной симптоматики – по шкале Гамильтона для оценки тревоги (HAM-A), специфический эффект агомелатина в отношении ангедонии – по шкале Снейта-Гамильтона (Snaith Hamilton Rating Scale, SHAPS), а специфический эффект в отношении нормализации сна и циркадианных ритмов – по опроснику Лидса для оценки качества сна (Leeds Sleep Evaluation Questionnaire, LSEQ) [M. Di Giannantonio и соавт., 2011].
Авторам данного исследования удалось показать, что применение агомелатина ассоциируется с быстрым, уже начиная с 1-й недели терапии, улучшением не только показателей депрессии и тревоги по шкалам HAM-D (p<0,05) и HAM-A (p<0,01), качества сна и циркадианных ритмов по опроснику LSEQ (p<0,05), но и ангедонии по шкале SHAPS (p<0,05). Уже к концу 1-й недели 9 (30%) пациентов положительно отреагировали на лечение, а 5 (17%) пациентов достигли полной клинической ремиссии (M. Di Giannantonio и соавт., 2011).
Улучшение продолжало развертываться в течение всех 8 нед исследования. К сроку 8 нед, т.е. к концу исследования, полной клинической ремиссии (включая устранение резидуальной ангедонии или резидуальной бессонницы, сохранявшейся после лечения другими АД) достигли 18 (60%) пациентов (M. Di Giannantonio и соавт., 2011).
Позднее, в 2012 г., другая группа итальянских исследователей предприняла небольшое пилотное двойное слепое рандомизированное клиническое исследование (РКИ), посвященное изучению сравнительной эффективности и безопасности агомелатина (Вальдоксан®) и пролонгированного венлафаксина (Effexor® XR) в устранении ангедонии при депрессивных состояниях (G. Martinotti и соавт., 2012).
В этом РКИ приняли участие 60 пациентов. Из них 30 были рандомизированы в группу агомелатина (25–50 мг/сут на ночь) и 30 – в группу пролонгированного венлафаксина (75–150 мг/сут) на протяжении 8 нед.
Авторами этого РКИ показано, что при сопоставимой общей антидепрессивной и анксиолитической активности (сопоставимой степени редукции общего балла по шкалам HAM-D и HAM-A) агомелатин значительно эффективнее венлафаксина устраняет именно ангедонию. Применение агомелатина ассоциировалось в этом РКИ с более выраженным снижением общего балла ангедонии по шкале SHAPS, а также с более значительным улучшением по шкале общего клинического впечатления CGI для депрессии, тревоги, ангедонии и бессонницы (G. Martinotti и соавт., 2012).
Проведя более подробный статистический анализ по подгруппам, авторы этого РКИ также сумели показать, что агомелатин был особенно эффективен в подгруппе пациентов с исходно более выраженной ангедонией (т.е. в подгруппе пациентов с так называемыми «ангедоническими депрессиями») и в подгруппе пациентов с исходно более выраженной тревожностью или бессонницей (т.е. в подгруппе тревожных и диссомнических депрессий) [G. Martinotti и соавт., 2012].
В том же 2012 г. Р. Лэм опубликовал подробный систематический обзор и метаанализ всех РКИ, посвященных изучению и сравнению эффективности и безопасности различных АД, результаты которых были опубликованы в период между 2006 и 2012 г. Особенно интересовали автора этого обзора вопросы о том, терапевтический эффект каких именно АД имеет тенденцию наступать быстрее, чем у прочих АД, какова типичная динамика или траектория улучшения при применении разных АД (т.е. какие именно симптомы депрессии имеют тенденцию проходить раньше остальных при применении того или иного АД), и о том, какие именно признаки могут служить потенциальными маркерами или предикторами терапевтического эффекта или достижения ремиссии при применении того или иного АД (R. Lam, 2012).
В результате проведения этого метаанализа Р. Лэм пришел к выводу, что некоторые АД, в частности агомелатин, ассоциируются с более ранним (уже на 1–2-й неделе, против 2–3–4 нед у большинства АД) началом антидепрессивного и анксиолитического эффекта. Кроме того, он установил, что агомелатин ассоциируется с более ранним и более выраженным улучшением таких ключевых, ядерных симптомов депрессии, как ангедония, нарушения сна и циркадианных ритмов, когнитивные нарушения, меланхолическая симптоматика (психомоторная заторможенность, загрудинные боли) [R. Lam, 2012].
Р. Лэм также показал в своем метаанализе, что маркером или предиктором стойкого терапевтического эффекта и последующего достижения ремиссии при применении любого АД, в том числе и агомелатина, является как раз наличие раннего (на 1–2-й неделе терапии) ответа на лечение именно этим АД в отношении ключевых симптомов депрессии, таких как ангедония, а также наличие типичной и предсказуемой последовательной динамики редукции депрессивного синдрома при продолжении лечения этим АД (R. Lam, 2012).
Также в 2012 г. М. Ди Джаннантонио и Г. Мартинотти опубликовали первый обобщающий метаобзор по вопросу о потенциальной эффективности агомелатина в устранении ангедонии. В этот обзор они включили как результаты уже упоминавшегося открытого пилотного исследования эффективности и безопасности агомелатина в устранении ангедонии, так и результаты упомянутого двойного слепого РКИ, в котором сравнивали по этому параметру агомелатин и пролонгированный венлафаксин (M. Di Giannantonio, G. Martinotti, 2012).
Авторы этого метаобзора заключили, что агомелатин является весьма перспективным, высокоэффективным и безопасным средством устранения ангедонии при депрессиях, в том числе резидуальной ангедонии, остающейся после применения других АД. Они также призвали к дальнейшему изучению эффективности агомелатина в этом отношении (M. Di Giannantonio, G. Martinotti, 2012).
В 2014 г. М. Миллан в другом систематическом обзоре показал, что стратегия комбинирования АД из разных классов, а также препаратов, формально не относящихся к АД, но задействующих разные рецепторные или нейрохимические системы, и в том числе стратегия комбинирования АД из других классов с агомелатином и/или с противовоспалительными, иммуномодулирующими и антицитокиновыми препаратами, может являться эффективной стратегией преодоления терапевтической резистентности при депрессиях, а также эффективной стратегией устранения резидуальной симптоматики депрессий, в том числе – резидуальной ангедонии (M. Millan, 2014).
В 2015 г. опубликована статья, авторы которой показали, что агомелатин, благодаря своему непрямому продофаминергическому и норадренергическому действию, а также благодаря своим сильным противовоспалительным, иммуномодулирующим и нейропротективным свойствам, является эффективным и безопасным средством коррекции ангедонии, апатии и абулии при самых разных патологических состояниях, в частности при депрессиях, шизофрении, состояниях после инсульта, черепно-мозговых травм, облучения ЦНС, при рассеянном склерозе и т.п. (J. Thome, P. Foley, 2015).
В том же 2015 г. М. Вальдингер указал, что быстрая нормализация сна под влиянием агомелатина, отсутствие у агомелатина способности вызывать снижение либидо и сексуальные дисфункции (наоборот, он обычно улучшает либидо и сексуальную функцию), а также отсутствие у агомелатина способности давать тошноту и снижение аппетита (что свойственно многим другим АД, в частности препаратам группы СИОЗС и СИОЗС и норадреналина, кломипрамину) – являются важной частью его специфической антиангедонической активности. В самом деле сон, еда и секс являются наиболее простыми и доступными, но очень важными жизненными удовольствиями для всякого человека, и для эффективного АД крайне нежелательна способность вызывать нарушения в этих сферах жизни (M. Waldinger, 2015).
В 2016–2018 гг. опубликована серия статей, в которых показано, что развитие ангедонии ассоциируется с нейровоспалением, системным воспалением и снижением содержания BDNF в плазме крови, а также с дисфункцией дофаминергических нейронных цепей, участвующих в реализации чувства удовольствия и в формировании самооценки. Было также показано, что лечение агомелатином приводит к снижению уровня С-реактивного белка, нормализации цитокинового профиля крови, повышению содержания BDNF в плазме крови и активации дофаминергических нейронных цепей, иннервирующих дорсолатеральную префронтальную кору, по данным функциональной магнитно-резонансной томографии. Эти положительные изменения теснее коррелируют с уменьшением выраженности ангедонии, чем с уменьшением общей выраженности депрессивной симптоматики (A. Rossetti и соавт., 2016; G. Martinotti и соавт., 2016; P. Delaveau и соавт., 2016; D. De Berardis и соавт., 2017;
J. Tchekalarova и соавт., 2018).
Также в 2016 г. опубликованы результаты крупного (257 пациентов) многоцентрового 8-недельного открытого натуралистического исследования эффективности агомелатина в устранении ангедонии у амбулаторных пациентов с депрессивными, тревожными и диссомническими состояниями в условиях реальной клинической практики. Это исследование подтвердило высокую эффективность агомелатина не только в устранении депрессивной, тревожной и диссомнической симптоматики в целом, но и в специфическом устранении именно ангедонии (P. Gargoloff и соавт., 2016).
В 2017 г. опубликованы статистические данные о том, что ангедония у депрессивных и тревожных пациентов, наблюдающихся у врачей общей практики, теснее коррелирует с нарушением психосоциального функционирования (потерей или отсутствием работы, академической неуспеваемостью или исключением из учебного заведения, одиночеством, потерей друзей или сужением круга общения, разводом или конфликтами в семье), чем любой другой симптом депрессии. Это довольно легко психологически объяснимо. В самом деле, если работа, учеба, общение с друзьями или семьей, выполнение супружеских обязанностей или сексуальная активность не приносят пациенту радости и удовольствия, то это автоматически снижает у него мотивацию заниматься всем этим (F. Vinckier и соавт., 2017).
Та же статистика показывает, что применение агомелатина при лечении депрессивных и тревожных пациентов врачами общей практики ассоциируется не только с уменьшением общей тяжести депрессивной и тревожной симптоматики, но и со значительным уменьшением выраженности именно ангедонии, а также с улучшением психосоциального функционирования пациентов, в частности с восстановлением трудоспособности, круга интересов и общения, улучшением отношений в семье, улучшением академической успеваемости учащихся или студентов (F. Vinckier и соавт., 2017).
Наконец, в нескольких самых свежих, от 2019 г., систематических обзорах и метаанализах, посвященных современным возможностям психофармакологической коррекции именно ангедонии или же современным возможностям лечения депрессивных и тревожных состояний в целом, констатируется, что агомелатин является одним из наиболее перспективных средств для психофармакологической коррекции ангедонии (M. Di Giannantonio и соавт., 2019; B. Cao и соавт., 2019; T. Norman, J. Olver, 2019).
Высокую эффективность препарата Вальдоксан® (агомелатин) как в лечении депрессивных, тревожных и диссомнических состояний в целом, так и в специфической коррекции именно ангедонии (в том числе резидуальной ангедонии, сохраняющейся после неуспешного или частично успешного лечения другими АД; в том числе у пожилых пациентов, пациентов с шизофренией, постпсихотическими депрессиями, депрессиями на фоне соматических и неврологических заболеваний) систематически подтверждают и российские исследователи (G. Panteleeva и соавт., 2015; Y. Kalyn и соавт., 2015; F. Shagiakhmetov и соавт., 2017; Y. Sivolap, 2018).
Заключение
Как показывают приведенные нами литературные данные, ангедония является не просто «одним из симптомов, входящих в определение депрессивного синдрома», но ключевым, ядерным его симптомом, отличающим депрессивный синдром от «просто плохого настроения» или от так называемой «бытовой хандры».
Кроме того, ангедония также является «эндофенотипическим симптомом», т.е. она входит в эндофенотип депрессии и лежит ближе других ее симптомов к предполагаемым нейробиологическим (нейрохимическим, нейрофизиологическим, генетическим или эпигенетическим) основам этого заболевания.
С другой же стороны, результаты лечения депрессии часто бывают неудовлетворительными, а достигнутые при этом ремиссии – неполными. При этом среди прочих остаточных симптомов депрессии часто встречается резидуальная ангедония.
Патофизиологические механизмы развития ангедонии включают в себя нарушения в работе дофаминергической и норадренергической систем мозга, а также нейровоспаление и/или системное воспаление в организме и вызываемые им вторичные изменения, такие как оксидативный и нитрозативный стресс, гиперактивация оси ГГН, воспалительно-дистрофические изменения в ЦНС, апоптоз нейронов лимбики и гиппокампа и постепенная атрофия этих мозговых структур и др. Важно отметить, что ангедония теснее прочих симптомов депрессии связана с нейровоспалением и/или системным воспалением и с вызываемыми им упомянутыми вторичными изменениями.
Препарат Вальдоксан® (агомелатин), обладая одновременно свойствами агониста мелатониновых MT1- и MT2-рецепторов, обусловливающими его сильную противовоспалительную, иммуномодулирующую, антиоксидантную и нейропротективную активность, и свойствами антагониста серотониновых рецепторов подтипов 5-HT2C и 5-HT2B, обусловливающими его косвенное норадренергическое и дофаминергическое действие, является эффективным и безопасным средством устранения ангедонии при депрессивных синдромах различного генеза, в том числе резидуальной ангедонии, сохраняющейся после лечения другими АД.
Следует особо отметить, что, по данным РКИ, терапевтический эффект Вальдоксана как в отношении симптомов депрессии и тревоги в целом, так и в отношении конкретно ангедонии, а также в отношении нарушений сна и циркадианных ритмов, когнитивных нарушений и меланхолии, наступает быстро – клиническое улучшение при его применении фиксируется уже начиная с 1–2-й недели. Учитывая, сколь большое значение имеет быстрое облегчение состояния пациентов с депрессиями, и для повышения их комплаентности к терапии, и для предотвращения суицидальных тенденций, и для предотвращения неблагоприятных социальных и экономических последствий депрессии – быстрота наступления терапевтического эффекта при применении Вальдоксана является очень важным его преимуществом.
Препарат Вальдоксан® также можно комбинировать с другими АД с целью усиления (потенцирования) их действия, преодоления терапевтической резистентности и устранения резидуальной депрессивной симптоматики, в том числе резидуальной ангедонии.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com


