Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2019
Тревикта – первый сверхпролонгированный антипсихотик III поколения: эффективность, безопасность и практические аспекты применения №06 2019
Препарат Тревикта – это первый на мировом рынке сверхпролонгированный антипсихотик III поколения, позволяющий обходиться всего 4 инъекциями в год. В данной статье мы подробно рассматриваем доказательную базу по его эффективности и безопасности, а также практические аспекты его применения.
Ключевые слова: шизофрения, рецидив, когнитивная токсичность, эмоционально-волевой дефект, противорецидивная терапия, комплаентность, пролонгированные антипсихотики, палиперидон, Тревикта.
Для цитирования: Быков Ю.В., Беккер Р.А. Тревикта – первый сверхпролонгированный антипсихотик III поколения: эффективность, безопасность и практические аспекты применения. Психиатрия и психофармакотерапия. 2019; 21 (6): 11–23.
Препарат Тревикта – это первый на мировом рынке сверхпролонгированный антипсихотик III поколения, позволяющий обходиться всего 4 инъекциями в год. В данной статье мы подробно рассматриваем доказательную базу по его эффективности и безопасности, а также практические аспекты его применения.
Ключевые слова: шизофрения, рецидив, когнитивная токсичность, эмоционально-волевой дефект, противорецидивная терапия, комплаентность, пролонгированные антипсихотики, палиперидон, Тревикта.
Для цитирования: Быков Ю.В., Беккер Р.А. Тревикта – первый сверхпролонгированный антипсихотик III поколения: эффективность, безопасность и практические аспекты применения. Психиатрия и психофармакотерапия. 2019; 21 (6): 11–23.
Trevicta – a first ultra-long-acting antipsychotic of third generation: its efficacy, safety and practical aspects of its clinical use
Yu.V. Bykov*1, R.A. Bekker2
1Stavropol State Medical University, Stavropol, Russia;
2David Ben-Gurion University in Negev, Be’er-Sheva, Israel
*yubykov@gmail.com
Abstract
Trevicta is the first ultra-long-acting antipsychotic of third generation on the world market. It allows to manage maintenance therapy of schizophrenia with just four injections per year. In this article, we thoroughly examine the existing evidence base for its effectiveness and safety, and describe practical aspects of its use.
Key words: schizophrenia, relapse, cognitive toxicity, emotional-volitional defect, maintenance therapy, compliance, prolonged antipsychotics, paliperidone, Trevicta.
For citation: Bykov Yu.V., Bekker R.A. Trevicta – a first ultra-long-acting antipsychotic of third generation: its efficacy, safety and practical aspects of its clinical use. Psychiatry and Psychopharmacotherapy. 2019; 21 (6): 11–23.
Введение
Физические и химические свойства
Препарат Тревикта представляет собой нанокристаллы палиперидона пальмитата (т.е. сложного эфира палиперидона и пальмитиновой кислоты). Он предназначен для внутримышечного введения 1 раз в 3 мес. Активным ингредиентом препарата Тревикта является палиперидон
(9-гидрокси-рисперидон), медленно высвобождающийся в месте инъекции при гидролизе палиперидона пальмитата эстеразами мышечной ткани (E. Gilday, H. Nasrallah, 2012).
При гидролизе палиперидона пальмитата эстеразами мышечной ткани в месте инъекции в зависимости от введенной дозы препарата Тревикта высвобождается суммарно 175, 263, 350 или 525 мг палиперидона основания. Высвобождаемая доза палиперидона основания (т.е. миллиграмм-эквивалент – мг-экв) и обозначена как дозировка препарата Тревикта в миллиграммах на его упаковке и на маркировке ампул с ним (P. Ravenstijn и соавт., 2016).
Будучи высоко липофильным препаратом, палиперидона пальмитат практически нерастворим в воде (образует в ней мелкокристаллическую суспензию), очень мало растворим в полярных органических растворителях, таких как этанол и метанол, слабо растворим в этилацетате, но хорошо растворим в жирах, что и обеспечивает возможность его гидролиза в богатой липидами мышечной ткани (Инструкция по медицинскому применению препарата – ИМП Тревикта, 2017).
Рецептура препарата Тревикта такая же, как и рецептура препарата Ксеплион (палиперидона пальмитат для введения 1 раз в месяц), но с увеличенным размером частиц по сравнению с Ксеплионом. Именно это и обеспечивает более замедленное и более длительное (в течение 3 мес, а не 1 мес) высвобождение палиперидона после однократной инъекции препарата Тревикта (P. Ravenstijn и соавт., 2016).
Фармакокинетика
После внутримышечной инъекции суспензии Тревикты содержащиеся в ней нанокристаллы палиперидона пальмитата медленно растворяются в липидах мышечной ткани. Затем они медленно гидролизуются присутствующими в мышечной ткани эстеразами до свободного палиперидона и пальмитиновой кислоты. Пальмитиновая кислота утилизируется мышечными клетками в месте инъекции для своих энергетических и пластических нужд. Свободный же палиперидон медленно поступает в кровеносное русло (ИМП Тревикта, 2017).
Высвобождение палиперидона из нанокристаллов суспензии Тревикты начинается уже в первые сутки после инъекции. Палиперидон продолжает обнаруживаться в плазме крови до 18 мес после однократной инъекции суспензии Тревикты, однако терапевтический уровень палиперидона в плазме сохраняется лишь приблизительно в первые 3 мес после инъекции (ИМП Тревикта, 2017).
Остаточная концентрация (Cend) палиперидона в плазме крови, обнаруживаемая через 18 мес после введения последней дозы Тревикты, при максимальной разрешенной инструкцией дозе 819 мг-экв, составляет всего 3% от стационарной средней концентрации (Css) при введении суспензии препарата в дельтовидную мышцу и 7% от Css при его введении в ягодичную мышцу (B. Carpiniello, F. Pinna, 2016).
Согласно официальной инструкции производителя к препарату Тревикта после однократной инъекции суспензии Тревикты концентрация палиперидона в плазме крови в 1-й месяц после инъекции постепенно повышается. Время достижения максимальной концентрации в плазме крови (Tmax) при этом составляет примерно 30–33 сут (ИМП Тревикта, 2017).
По данным рандомизированных клинических исследований (РКИ), средний T1/2 Тревикты при диапазоне доз от 272 до 819 мг-экв составляет от 84 до 139 дней (B. Carpiniello, F. Pinna, 2016; Е.Б. Любов, 2017).
Данные, собранные в ходе РКИ по эффективности и безопасности препарата Тревикта при поддерживающем лечении шизофрении, позволили установить фармакокинетически эквивалентные (по Css палиперидона в плазме крови) дозы Ксеплиона и Тревикты. Согласно этим данным, 50 мг-экв Ксеплиона фармакокинетически эквивалентны 175 мг-экв Тревикты, 75 мг-экв Ксеплиона соответствуют 263 мг-экв Тревикты, 100 мг-экв Ксеплиона соответствуют 350 мг-экв Тревикты, а 150 мг-экв Ксеплиона соответствуют 525 мг-экв Тревикты (J. Berwaerts и соавт., 2015).
Во всем остальном (связывание с белками плазмы, распределение в организме, проникновение через гематоэнцефалический барьер – ГЭБ, метаболизм и выведение) фармакокинетика Тревикты идентична таковой у перорального палиперидона (препарат Инвега), за исключением отсутствия эффекта «первого прохождения через печень», свойственного пероральным препаратам. Так, в частности, связывание с белками плазмы (в основном с альбумином) у палиперидона составляет в среднем 74% (B. Carpiniello, F. Pinna, 2016).
Около 59% всей введенной дозы палиперидона выводится из организма в неизмененном виде с мочой и еще около 11% – также в неизмененном виде с калом. Таким образом, палиперидон, в отличие от рисперидона, в гораздо меньшей степени подвергается биотрансформации в печени. Поэтому его фармакокинетика гораздо меньше зависит от индивидуальных генетических особенностей цитохромов P450 печени конкретного пациента, чем фармакокинетика рисперидона (S. Stahl, 2013; P. Ravenstijn и соавт., 2016; B. Carpiniello, F. Pinna, 2016).
Фармакодинамика
Поскольку действующим веществом Тревикты, как и Ксеплиона, является медленно высвобождаемый после инъекции препарата путем гидролиза эстеразами мышечной ткани палиперидон, то сведения о фармакодинамических механизмах действия перорального палиперидона (препарат Инвега) в равной степени применимы и к Ксеплиону, и к Тревикте (S. Stahl, 2013).
Как и для любых других антипсихотиков (АП), окончательно и во всей полноте механизм действия палиперидона пока не выяснен (S. Stahl, 2013; N. Daghistani, J. Rey, 2016). Тем не менее современные данные позволяют предположить, что воздействие палиперидона на продуктивную симптоматику шизофрении опосредуется селективной блокадой дофаминовых рецепторов подтипа D2, в меньшей мере – подтипов D3 и D4 в мезолимбической системе (Ki=4,0 nM, 7,5 nM и 30,0 nM соответственно). Относительно низкая степень D2-блокады в мезокортикальной и нигростриарной системах, наблюдаемая при антипсихотических дозах палиперидона, т.е. его относительная селективность к D2-рецепторам мезолимбики, что вообще свойственно всем АП II (АП-2П) и III поколений (АП-3П), объясняет более низкий по сравнению с АП I поколения (АП-1П) и с рисперидоном уровень экстрапирамидного синдрома (ЭПС) и акатизии и более низкую по сравнению с АП-1П и с рисперидоном склонность палиперидона вызывать когнитивные нарушения, нейролептическую депрессию, нейролептик-индуцированный дефицитарный синдром («вторичную негативную симптоматику»)
[A. Schotte и соавт., 1996; S. Stahl, 2013; P. Ravenstijn и соавт., 2016; P. Chue, J. Chue, 2016].
Одновременно сильная блокада палиперидоном серотониновых 5-HT2A-рецепторов (Ki=0,25 nM) приводит к реципрокному повышению уровней дофамина в префронтальной коре, стриатуме и тубероинфундибулярной системе. Блокада 5-HT2C-рецепторов (Ki=47,0 nM) приводит к дополнительному повышению уровней не только дофамина, но и норадреналина в указанных областях мозга. Это не только дополнительно уменьшает вероятность развития ЭПС, акатизии, нейролептик-индуцированного дефицитарного синдрома, нейролептических депрессий и когнитивных нарушений, а также гиперпролактинемии по сравнению с АП-1П и с рисперидоном, но и обусловливает более высокую эффективность палиперидона по сравнению с АП-1П и с рисперидоном в устранении негативной, когнитивной и депрессивной симптоматики шизофрении, при сопоставимой степени D2-блокады в мезолимбической системе и сопоставимой эффективности в отношении позитивной симптоматики (A. Schotte и соавт., 1996;
S. Stahl, 2013; P. Ravenstijn и соавт., 2016; P. Chue, J. Chue, 2016).
Кроме того, палиперидон также является сильным блокатором 5-HT7-подтипа серотониновых рецепторов (более сильным, чем рисперидон; Ki=1,30 nM). Это не только привносит дополнительный вклад в общий антипсихотический эффект палиперидона, но и обеспечивает ему сильное положительное влияние на когнитивные функции больных шизофренией, а также на депрессивную симптоматику в рамках шизофрении, на циркадные ритмы и фазовую структуру сна, нередко нарушенные у больных шизофренией (S. Stahl, 2013; C. Álamo, F. López-Muñoz, 2013; M. Corena-McLeod, 2015).
Некоторую роль в общей антидепрессивной, антинегативной и прокогнитивной активности палиперидона при шизофрении, а также в уменьшении ЭПС, акатизии и гиперпролактинемии по сравнению с рисперидоном может играть также слабый или умеренный, но все же клинически значимый (Ki=380,0 nM) парциальный агонизм палиперидона к 5-HT1A-подтипу серотониновых рецепторов (A. Schotte и соавт., 1996).
Подобно рисперидону, палиперидон также является антагонистом a1-адренергических и H1-гистаминовых рецепторов (Ki=4,0 nM и 32,0 nM соответственно), но эти свойства у него выражены слабее, чем у рисперидона (A. Schotte и соавт., 1996). Эти рецепторные свойства палиперидона, с одной стороны, могут дополнительно уменьшать вероятность возникновения ЭПС и акатизии при терапии им (по аналогии с сильными a1-блокирующими свойствами илоперидона, которые приводят к реципрокному повышению уровня дофамина в стриатуме, чем объясняют очень низкую вероятность ЭПС при терапии илоперидоном) [S. Stahl, 2013].
С другой стороны, эти же рецепторные свойства могут обусловливать такие нежелательные побочные эффекты (ПЭ) палиперидона, как ортостатическая гипотензия и тахикардия, заложенность носа (из-за a1-адреноблокады), сонливость и седация (из-за H1-гистаминовой блокады). Сочетание блокады H1-гистаминовых и 5-HT2C-серотониновых рецепторов может способствовать повышению аппетита, прибавке массы тела и развитию метаболических нарушений. Вместе с тем эти свойства у палиперидона выражены меньше, чем у рисперидона, оланзапина и кветиапина. Это уменьшает вероятность возникновения вышеупомянутых ПЭ и дает основание, ввиду усовершенствованного рецепторного профиля, причислять палиперидон именно к АП-3П, а не к АП-2П (S. Stahl, 2013).
Палиперидон также обладает сильными антагонистическими свойствами по отношению к центральным a2-адренорецепторам (более сильными, чем у рисперидона; Ki=17,0 nM). Это приводит к усилению выделения всех трех моноаминов в синаптическую щель и может, по аналогии с миртазапином и миансерином, обусловливать антидепрессивный эффект палиперидона. Этим свойством палиперидона может объясняться его более высокая по сравнению с рисперидоном эффективность в отношении депрессивной симптоматики шизофрении (S. Stahl, 2013).
Как и рисперидон, палиперидон не обладает клинически значимыми М-холиноблокирующими свойствами, и не вызывает соответствующих ПЭ. Он также не блокирует b-адренергические, ГАМКергические, опиоидные, NMDA-глутаматергические или какие-либо иные рецепторы, кроме упомянутых выше (S. Stahl, 2013; ИМП Тревикта, 2017).
Относительно недавно обнаружен интересный факт: профили экспрессии и фосфорилирования белков митохондриальной цепи электронного транспорта (а конкретно, белков комплексов I и V) в префронтальной коре под влиянием рисперидона и палиперидона значительно различаются. При этом профили экспрессии и фосфорилирования белков, вызываемые палиперидоном, частично сходны с таковыми у лития и вальпроата. Это может указывать на наличие у палиперидона антидепрессивных и/или нормотимических свойств, отличающих его от рисперидона (P. Chue, J. Chue, 2016).
Различия во влиянии рисперидона и палиперидона на митохондриальное дыхание, двигательную активность и размножение митохондрий, паттерны экспрессии и фосфорилирования белков (в частности, белков комплексов I и V митохондриальной цепи электронного транспорта) и активность ряда внутриклеточных сигнальных путей частично объясняются наличием в молекуле палиперидона гидроксильной группы, что приводит к более высокой гидрофильности палиперидона по сравнению с рисперидоном (W. Clarke и соавт., 2013).
Межлекарственные взаимодействия
В настоящее время пока еще нет данных исследований, специально посвященных изучению межлекарственных взаимодействий конкретно препарата Тревикта как особой формы выпуска пролонгированного палиперидона. Поэтому выводы о возможных межлекарственных взаимодействиях препарата Тревикта делаются из исследований, посвященных таковым взаимодействиям у перорального палиперидона (препарат Инвега) или у появившегося на рынке раньше препарата Ксеплион (P. Ravenstijn и соавт., 2016; B. Carpiniello, F. Pinna, 2016).
Имеющиеся данные фармакокинетических исследований in vivo по межлекарственным взаимодействиям перорального палиперидона (препарат Инвега) и препарата Ксеплион свидетельствуют о том, что ингибиторы или индукторы CYP2D6 и/или CYP3A4, как правило, не влияют сколько-нибудь существенно на уровень палиперидона в плазме крови. Вместе с тем возможность или вероятность такого взаимодействия все же следует принимать во внимание (P. Ravenstijn и соавт., 2016; B. Carpiniello, F. Pinna, 2016).
С другой же стороны, сам палиперидон также не является сколько-нибудь значимым индуктором или ингибитором ни для одного из изоферментов системы цитохрома P450 печени (т.е. нейтрален по отношению к ним) [P. Ravenstijn и соавт., 2016; B. Carpiniello, F. Pinna, 2016].
Другие авторы также указывают, что, поскольку палиперидона пальмитат является неактивным пролекарством, которое в организме гидролизуется до активного палиперидона, то при использовании препаратов Тревикта и Ксеплион следует принимать во внимание те межлекарственные взаимодействия, которые были ранее отмечены в исследованиях или в опубликованных клинических случаях для перорального палиперидона (препарат Инвега), а не только те, которые упоминаются непосредственно в инструкциях к данным пролонгированным препаратам (E. Gilday, H. Nasrallah, 2012).
Клинически значимые межлекарственные взаимодействия, которые могут иметь место при назначении любых форм палиперидона (препараты Инвега, Ксеплион, Тревикта), включают в себя возможные нежелательные взаимодействия с гипотензивными лекарственными средствами или с другими лекарствами, способными вызвать ортостатическую гипотензию и тахикардию, с алкоголем и другими средствами, оказывающими угнетающее воздействие на центральную нервную систему (ЦНС), с сильными индукторами или сильными ингибиторами активности изофермента цитохрома P450 печени CYP3A4, сильными индукторами или сильными ингибиторами активности «насосного» белка ГЭБ P-гликопротеина (P-gp), а также с другими D2-антагонистами или, напротив, дофаминергическими препаратами (N. Daghistani, J. Rey, 2016).
Поскольку палиперидон является достаточно сильным a1-адреноблокатором (хотя и более слабым, чем рисперидон), то он потенциально способен вызывать ортостатическую гипотензию и тахикардию (хотя он вызывает ее реже, чем рисперидон). Поэтому при сочетании палиперидона с гипотензивными лекарствами или с другими средствами, способными вызывать ортостатическую гипотензию и тахикардию, может произойти суммирование этих эффектов и повышение риска развития ортостатической гипотензии и тахикардии (E. Gilday, H. Nasrallah, 2012).
Сочетание палиперидона с алкоголем или другими веществами, оказывающими угнетающее действие на ЦНС (как с лекарствами, так и с психоактивными веществами – ПАВ), может привести к взаимному усилению седативного действия и степени угнетения ЦНС, иногда вплоть до развития коматозных состояний (E. Gilday, H. Nasrallah, 2012).
Сочетание палиперидона с сильными ингибиторами активности изофермента CYP3A4, такими как эритромицин, кетоконазол, флувоксамин, может привести к значительному повышению концентрации палиперидона в плазме крови. Сочетание же палиперидона с сильными ингибиторами насосной функции белка P-gp, такими как верапамил, дилтиазем, циклоспорин, может привести к усилению проникновения палиперидона через ГЭБ и к повышению его концентрации в ткани мозга и в ликворе. В обоих случаях может наблюдаться усиление действия палиперидона с проявлением его ПЭ или даже признаков токсического действия. Поэтому подобных сочетаний следует по возможности избегать (E. Gilday, H. Nasrallah, 2012).
И наоборот, сочетание палиперидона с сильными индукторами изофермента CYP3A4, такими как фенобарбитал, фенитоин, карбамазепин, рифампицин, может значительно снизить уровень палиперидона в плазме крови. Это может привести к ослаблению его антипсихотического действия или даже к рецидиву психоза. Поэтому подобных сочетаний также следует по возможности избегать (E. Gilday, H. Nasrallah, 2012).
Сочетание палиперидона с другими антагонистами D2-рецепторов (другие АП, метоклопрамид, циннаризин, прокаинамид, прометазин) или с литием может привести к усилению проявлений ЭПС и/или акатизии и к повышению риска развития злокачественного нейролептического синдрома. И, напротив, сочетание палиперидона с леводопой или с D2-агонистами, такими как бромокриптин, прамипексол и другие, может привести к ослаблению как антипсихотического действия палиперидона, так и антипаркинсонического, гипопролактинемического и других эффектов упомянутых препаратов. Подобные сочетания не рекомендуются к применению. В тех же случаях, когда их применение необходимо, следует осуществлять тщательный мониторинг эффективности терапии обоими препаратами и выраженности ПЭ (E. Gilday, H. Nasrallah, 2012).
Применение препарата Тревикта в особых подгруппах населения
При беременности
Инструкция производителя не рекомендует применение препарата Тревикта (как и других форм палиперидона, включая пероральную) при беременности. Исследования показали, что палиперидон продолжает обнаруживаться в плазме крови в следовых количествах спустя 18 мес после однократного введения препарата Тревикта. Однако клиническое значение этого факта для женщин детородного возраста, получающих терапию препаратом Тревикта, пока не известно (ИМП Тревикта, 2017).
Пока не существует адекватных и хорошо контролируемых РКИ, подтверждающих эффективность и безопасность применения палиперидона в любых его формах выпуска (включая препараты Инвега, Ксеплион, Тревикта) у беременных (N. Daghistani, J. Rey, 2016). Более того, проведение подобных РКИ невозможно по этическим причинам (S. Stahl, 2013; 2017).
Тем не менее исследования палиперидона на животных (как в пероральной форме, так и в форме палиперидона пальмитата) не обнаружили какой-либо тератогенности, мутагенности, эмбриотоксичности или фетотоксичности препарата. У экспериментальных животных при введении палиперидона не наблюдалось какого-либо увеличения частоты пороков развития, патологий плода или повышения частоты выкидышей и преждевременных родов (E. Gilday, H. Nasrallah, 2012).
Опубликовано некоторое количество клинических случаев, документирующих эффективность и безопасность применения палиперидона пальмитата (в формах Ксеплион или Тревикта) у беременных. Так, в 2015 г. турецкими авторами описан случай 28-летней женщины с шизофренией, получавшей Ксеплион на протяжении всей беременности, и на 39-й неделе родившей здорового мальчика весом 3000 г (A. Özdemir и соавт., 2015).
В 2017 г. бразильскими авторами описан другой клинический случай, в котором 34-летняя женщина с шизоаффективным расстройством получала Тревикту на протяжении всей беременности с хорошим эффектом и тоже родила на 38-й неделе здорового ребенка без каких-либо патологий (F. Zamora Rodríguez и соавт., 2017).
Свежий (от 2018 г.) систематический обзор безопасности применения различных АП-2П и АП-3П у беременных указывает, что в литературных данных, доступных авторам, не сообщается о сколько-нибудь клинически значимом повышении риска врожденных пороков развития или уродств у плода при применении рисперидона или палиперидона (включая их пролонгированные формы) на фоне беременности. Вместе с тем данных о безопасности их применения у беременных пока недостаточно, и вряд ли когда-либо будет достаточно в свете невозможности проведения РКИ по этому вопросу из-за этических соображений (P. Damkier, P. Videbech, 2018).
В свете этого авторы вышеупомянутого систематического обзора заключили, что применение рисперидона и палиперидона, включая их пролонгированные формы (Рисполепт Конста, Ксеплион, Тревикта), у беременных потенциально возможно и является оправданным в тех случаях, когда ожидаемая терапевтическая польза для матери превышает потенциальный риск для плода, даже несмотря на то, что такое их использование не рекомендуется инструкцией производителя (P. Damkier, P. Videbech, 2018).
При кормлении грудью
Инструкция производителя не рекомендует применение препарата Тревикта (как и любых других форм выпуска палиперидона) у кормящих матерей. В случае же необходимости применения Тревикты (или других форм выпуска палиперидона) у кормящей матери инструкция производителя рекомендует рассмотреть вопрос о целесообразности прекращения лактации и перевода ребенка с грудного на искусственное вскармливание (ИМП Тревикта, 2017).
Пока не существует адекватных и хорошо контролируемых РКИ, подтверждающих эффективность и безопасность применения палиперидона в любых его формах выпуска (включая препараты Инвега, Ксеплион, Тревикта) у кормящих матерей (N. Daghistani, J. Rey, 2016). Более того, проведение подобных РКИ невозможно по этическим причинам (S. Stahl, 2013; 2017).
Вместе с тем опубликованные данные исследований говорят о том, что рисперидон и палиперидон лишь в умеренной степени проникают в материнское молоко – в большей мере, чем это делают оланзапин и кветиапин, но в гораздо меньшей мере, чем амисульприд и многие из
АП-1П (K. Ilett и соавт., 2004; T. Parikh и соавт., 2014; F. Uguz, 2016).
Не сообщалось о развитии каких-либо ПЭ рисперидона или палиперидона у младенцев, находящихся на грудном вскармливании, чьи матери получали рисперидон или палиперидон (включая их пролонгированные формы – Рисполепт Конста, Ксеплион, Тревикта) и продолжали кормить грудью в период лечения. Уровни рисперидона и палиперидона в крови младенцев в большинстве описанных случаев были ниже порога обнаружения, либо были очень низкими и не имеющими существенного клинического значения (T. Parikh и соавт., 2014; F. Uguz, 2016).
В свете этого ряд авторов считают, что терапия рисперидоном или палиперидоном (включая их пролонгированные формы – Рисполепт Конста, Ксеплион, Тревикта) на фоне кормления грудью является достаточно безопасной для ребенка. Они указывают, что вопрос о необходимости и целесообразности прекращения лактации или, наоборот, ее продолжения на фоне лечения этими препаратами должен в каждом случае решаться индивидуально, с учетом соотношения ожидаемой пользы для ребенка от грудного вскармливания и ожидаемого риска от воздействия на него лекарства, а также ожидаемой пользы от лечения для матери (T. Parikh и соавт., 2014; F. Uguz, 2016).
У детей и подростков
Эффективность и безопасность применения препарата Тревикта в длительной поддерживающей терапии шизофрении у детей и подростков пока прицельно не изучалась. Производителем препарата применение его в данной возрастной категории не рекомендуется (ИМП Тревикта, 2017).
Стоит особо отметить, что никакой из пролонгированных АП (ПАП), включая самые старые ПАП I поколения (ПАП-1П), до сих пор официально не одобрен Управлением по контролю пищевых продуктов и лекарств в США (Food and Drug Administration – FDA) для поддерживающего лечения шизофрении именно у детей и подростков. Между тем именно у подростков низкая комплаентность поддерживающей терапии АП представляет особенно серьезную проблему. Кроме того, раннее начало шизофрении ассоциируется с более тяжелым ее течением, более частыми рецидивами, более быстрым прогрессированием эмоционально-волевого и когнитивного дефицита. Все это вынуждает практикующих врачей прибегать к off-label применению ПАП у подростков, несмотря на отсутствие официального одобрения FDA для такой практики (S. Lytle и соавт., 2017; D. Petrić и соавт., 2019).
Экстраполяция имеющихся данных по эффективности и безопасности применения препарата Ксеплион для поддерживающей терапии шизофрении у подростков на Тревикту позволяет предположить, что и препарат Тревикта также может быть эффективным и безопасным в данной возрастной категории (12–17 лет). Более редкие инъекции могут быть особым преимуществом Тревикты у подростков в связи с тем, что многие подростки боятся внутримышечных инъекций (S. Lytle и соавт., 2017; D. Petrić и соавт., 2019).
В литературе описаны как минимум 2 случая успешного off-label применения новейшего препарата Тревикта для поддерживающей терапии шизофрении именно у подростков. Учитывая, что этот препарат появился на рынке совсем недавно, можно полагать, что со временем таких случаев станет больше (M. Fàbrega и соавт., 2015).
У лиц пожилого и старческого возраста
В РКИ по применению препарата Тревикта для поддерживающего лечения шизофрении участвовало слишком мало пациентов пожилого и старческого возраста с этим заболеванием, для того чтобы можно было сделать окончательные выводы об эффективности и безопасности
Тревикты в данной возрастной категории больных шизофренией (M. Vermeir и соавт., 2008).
Однако, экстраполируя имеющиеся данные об эффективности и безопасности применения перорального палиперидона (препарат Инвега) и 1-месячных инъекций палиперидона пальмитата (препарат Ксеплион) у пациентов пожилого и старческого возраста, можно предположить, что и Тревикта при соблюдении надлежащих мер предосторожности может быть эффективной и безопасной в данной возрастной категории (S. Madhusoodanan, D. Zaveri, 2010; M. Krause и соавт., 2018).
Вместе с тем у пациентов пожилого и старческого возраста может замедляться метаболизм многих лекарств (в том числе палиперидона) в печени, а также их выведение через почки (M. Vermeir и соавт., 2008; E. Gilday, H. Nasrallah, 2012). Это может привести к изменению фармакокинетики препарата Тревикта, повышению концентрации палиперидона в крови и увеличению продолжительности действия однократной инъекции препарата. Это, в свою очередь, может привести к плохой переносимости препарата, развитию выраженных ПЭ и даже признаков
токсичности палиперидона (M. Vermeir и соавт., 2008; E. Gilday, H. Nasrallah, 2012).
В свете этого у пациентов пожилого и старческого возраста рекомендуется осторожность и умеренность в дозировании препарата Тревикта (как и многих других лекарственных препаратов), при необходимости – коррекция дозы Тревикты в сторону снижения, а также тщательный мониторинг функции печени и почек (N. Daghistani, J. Rey, 2016).Некоторые авторы, с учетом медленного выведения Тревикты и того факта, что при ее применении равновесная стабильная концентрация палиперидона в плазме крови может быть достигнута только через 1 год и более, и с учетом возможных выраженных изменений фармакокинетики Тревикты в пожилом и старческом возрасте, рекомендуют обязательно проводить у этой возрастной категории больных терапевтический лекарственный мониторинг – регулярное измерение концентрации палиперидона в плазме крови (G. Schoretsanitis и соавт., 2018).
У пациентов с почечной или печеночной недостаточностью
Поскольку палиперидон в значительном проценте выводится в неизмененном виде почками, то его выведение у пациентов с почечной недостаточностью может быть замедленным. Это может привести к повышению концентрации палиперидона в плазме крови, развитию выраженных ПЭ и даже признаков токсичности палиперидона
(S. Stahl, 2013; 2017).
В свете этого инструкция производителя не рекомендует применение препарата Тревикта у пациентов с почечной недостаточностью умеренной или тяжелой степени.
В то же время применение Тревикты у пациентов с легкими степенями почечной недостаточности вполне возможно и должно основываться на пересчете ранее подобранной для этих пациентов дозы Ксеплиона в эквивалентную дозу Тревикты. На этапе подбора дозы Ксеплиона пациентам с легкой степенью почечной недостаточности могут оказаться необходимыми меньшие его дозы, чем пациентам с нормальной функцией почек (ИМП Тревикта, 2017).
Палиперидон частично метаболизируется в печени (в основном с участием изофермента CYP3A4) до неактивных метаболитов. Поэтому нарушения обезвреживающей функции печени теоретически могут приводить к замедлению элиминации палиперидона, повышению его концентрации в плазме крови и развитию выраженных ПЭ или даже признаков токсичности палиперидона (S. Stahl, 2013; 2017).
Безопасность применения препарата Тревикта у пациентов с выраженными нарушениями функции печени пока прицельно не изучалась. Однако, экстраполируя данные, полученные в исследованиях перорального палиперидона (препарат Инвега) и 1-месячных инъекций палиперидона пальмитата (препарат Ксеплион) на Тревикту, можно предположить, что коррекция дозы Тревикты в сторону снижения не требуется у пациентов с легкими или умеренными степенями печеночной недостаточности (E. Gilday, H. Nasrallah, 2012).
В то же время применение препарата Тревикта у пациентов с тяжелой степенью печеночной недостаточности не рекомендуется инструкцией производителя (ИМП Тревикта, 2017).
Влияние курения, гендерных и возрастных различий и массы тела
На концентрации многих АП в плазме крови (например, оланзапина, клозапина) значительно влияет факт курения больного (снижение в 2 и более раза) [S. Stahl, 2013; 2017]. В свете этого важно отметить, что на концентрацию палиперидона в плазме крови курение значимо не влияет, в том числе и при применении препарата Тревикта (B. Carpiniello, F. Pinna, 2016).
Ряд АП характеризуется значительными гендерными или возрастными различиями в скорости метаболизма, всасывания, распределения и в других фармакокинетических параметрах. В свете этого интересно отметить, что у женщин, получавших пероральный палиперидон (препарат Инвега) отмечалась более низкая его биодоступность и более низкие уровни палиперидона в плазме по сравнению с мужчинами, вероятно, вследствие эффекта «первого прохождения через печень» (B. Carpiniello, F. Pinna, 2016).
В то же время применение инъекционного палиперидона пролонгированного действия (препараты Ксеплион или Тревикта) не сопровождалось какими-либо различиями между полами во всасывании, биодоступности или в уровне палиперидона в плазме (B. Carpiniello, F. Pinna, 2016).
Уровни палиперидона в плазме крови при применении инъекционных форм пролонгированного действия (препараты Ксеплион или Тревикта) также мало зависят от возраста пациента (кроме случаев развития с возрастом почечной или печеночной недостаточности, о чем говорилось выше) [B. Carpiniello, F. Pinna, 2016].
Как стабильные (Css), так и максимальные (Cmax) уровни многих АП оказываются более низкими у пациентов с избыточной массой тела или ожирением. Справедливо это и для перорального палиперидона (препарат Инвега). В то же время при применении пролонгированных инъекционных форм палиперидона (препараты Ксеплион или Тревикта) каких-либо различий в фармакокинетике палиперидона между пациентами с нормальной и с избыточной массой тела или ожирением зафиксировано не было (B. Carpiniello, F. Pinna, 2016).
Резюмируя все сказанное, можно заключить, что применение пролонгированных инъекционных форм палиперидона (препараты Ксеплион или Тревикта) создает более стабильные и предсказуемые уровни палиперидона в плазме крови, чем применение перорального палиперидона (препарат Инвега), и в меньшей степени, чем пероральная терапия, зависит от пола, возраста, массы тела больного, а также от факта курения (B. Carpiniello, F. Pinna, 2016).
Противопоказания и особые меры предосторожности
Палиперидон во всех его формах выпуска, как и все другие АП, включая препарат Тревикта, ассоциируется с повышенным риском преждевременной смертности от любых причин и с повышенным риском сердечно-сосудистой смертности у пожилых пациентов с различными формами деменции, а также с развитием у них беспомощного состояния. Как и для всех остальных АП американские инструкции по применению палиперидона во всех формах выпуска (Invega, Invega Sustenna, Invega Trinza), по настоянию FDA, содержат специальное выделенное черной рамкой предупреждение об этом (S. Stahl, 2013; 2015; 2017).
Тем не менее применение палиперидона у пожилых пациентов, например с деменцией Альцгеймера, для контроля поведения или для уменьшения симптомов психоза может быть оправданным в тех случаях, когда ожидаемая терапевтическая польза превышает ожидаемый риск (S. Stahl, 2013; 2015; 2017).
Нельзя применять палиперидон в любых его формах выпуска (включая препарат Тревикта) для лечения психозов или для контроля поведения у пациентов с болезнью Паркинсона (БП) или с деменцией с тельцами Леви – ДТЛ (хотя при других формах деменции, не сопровождающихся выраженными ЭПС, осторожное применение палиперидона возможно). Единственными разрешенными FDA препаратами из группы АП для лечения психозов или для контроля поведения у больных с БП или с ДТЛ являются низкие дозы клозапина или кветиапина как АП, обладающих самым низким потенциалом вызывания или усугубления ЭПС (S. Stahl, 2013; 2015; 2017).
Это противопоказание обосновывается тем, что пациенты с БП или ДТЛ имеют резко повышенную чувствительность к ПЭ от любых АП или вообще D2-блокаторов, в том числе палиперидона. При попытке применения палиперидона или других мощных АП у таких больных может наблюдаться резкое ухудшение течения болезни, резкое усиление ЭПС вплоть до полной акинезии (акинетического криза), развитие спутанности сознания, беспомощности, ступорозных состояний, резкое усиление когнитивных нарушений (порой вплоть до делирия), нарушения глотания (дисфагия) или провокация развития злокачественного нейролептического синдрома (S. Stahl, 2013; 2015; 2017; N. Daghistani, J. Rey, 2016).
Практические вопросы дозирования Тревикты и перевода с Ксеплиона на Тревикту
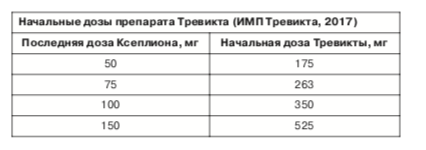 Как показывают данные фармакокинетических исследований, перевод с Ксеплиона на Тревикту целесообразен и допустим только после предварительного подбора дозы Ксеплиона и последующей стабилизации состояния пациента на нем в течение не менее 4 мес, с констатацией хорошего или удовлетворительного терапевтического эффекта от применения Ксеплиона, а также хорошей или удовлетворительной переносимости лечения Ксеплионом. Доза Тревикты при таком переводе должна быть приблизительно в 3,5 раза больше ранее подобранной дозы Ксеплиона; см. таблицу (S. Gopal и соавт., 2015; B. Carpiniello, F. Pinna, 2016; ИМП Тревикта, 2017; R. Emsley, S. Kilian, 2018).
Как показывают данные фармакокинетических исследований, перевод с Ксеплиона на Тревикту целесообразен и допустим только после предварительного подбора дозы Ксеплиона и последующей стабилизации состояния пациента на нем в течение не менее 4 мес, с констатацией хорошего или удовлетворительного терапевтического эффекта от применения Ксеплиона, а также хорошей или удовлетворительной переносимости лечения Ксеплионом. Доза Тревикты при таком переводе должна быть приблизительно в 3,5 раза больше ранее подобранной дозы Ксеплиона; см. таблицу (S. Gopal и соавт., 2015; B. Carpiniello, F. Pinna, 2016; ИМП Тревикта, 2017; R. Emsley, S. Kilian, 2018).
Понятия «ранее подобранная стабильная доза Ксеплиона» и «пациент должен быть предварительно стабилизирован на Ксеплионе перед переводом на Тревикту» инструкция производителя интерпретирует следующим образом: доза Ксеплиона не должна меняться ни в большую, ни в меньшую сторону в течение, по крайней мере, последних 2 мес перед планируемым переводом на Тревикту. То есть как минимум последние 2 инъекции Ксеплиона перед началом введения Тревикты должны быть в одной и той же дозе. При этом пациент должен быть клинически стабилен (т.е. его состояние не должно значимо изменяться в худшую сторону за время наблюдения) или находиться в частичной или полной ремиссии на этой подобранной дозе Ксеплиона (ИМП Тревикта, 2017; R. Emsley, S. Kilian, 2018).
При переводе с Ксеплиона на Тревикту рекомендуется в тот день, когда по графику должно было бы состояться введение очередной ежемесячной дозы Ксеплиона, вместо нее ввести пациенту фармакокинетически эквивалентную, согласно таблице пересчета, первую дозу Тревикты. Однако допускаются небольшие отклонения от этого графика. Согласно инструкции производителя, первую дозу Тревикты можно ввести пациенту в пределах до 7 дней до или после того дня, когда по графику должно было бы состояться введение очередной ежемесячной дозы Ксеплиона (ИМП Тревикта, 2017).
Рекомендованные производителем дозы Тревикты для 1-й инъекции составляют 175, 263, 350 или 525 мг-экв и должны соответствовать предшествующей дозе Ксеплиона, умноженной на 3,5 (B. Carpiniello, F. Pinna, 2016). В дальнейшем при необходимости корректировку дозы Тревикты можно проводить каждые 3 мес, ориентируясь на установленные производителем «ступени» эскалации или снижения доз, на таблицы пересчета доз Ксеплиона в дозы Тревикты, а также на клинический эффект и переносимость препарата. Поддерживающие дозы Тревикты, начиная со 2-й инъекции и далее, могут варьироваться в диапазоне от 175 до 525 мг-экв (ИМП Тревикта, 2017).
Важно иметь в виду, что из-за очень большого T1/2, свойственного препарату Тревикта, как желаемый терапевтический эффект от повышения дозы Тревикты, так и проявление или усиление ее ПЭ при чрезмерно большой дозе препарата могут наблюдаться только через несколько месяцев после повышения дозы Тревикты. Аналогично замедленным, отсроченным до нескольких месяцев может быть уменьшение или исчезновение ПЭ после снижения дозы Тревикты (ИМП Тревикта, 2017).
В свете этого авторитетный психофармаколог Стивен Шталь рекомендует в случае дестабилизации состояния или рецидива психоза осуществлять временный обратный перевод на Ксеплион (введение фармакокинетически эквивалентной 1-месячной дозы Ксеплиона вместо очередной 3-месячной инъекции Тревикты или введение Ксеплиона досрочно, в случае острого состояния). Эффект от маневрирования дозой Ксеплиона проявляется быстрее, чем эффект от изменения дозы Тревикты, и это является важным его преимуществом при купировании обострений. Обратный же переход на Тревикту он рекомендует предпринимать, как и в случае первого перевода, только спустя несколько месяцев стабильного состояния на подобранной дозе Ксеплиона (S. Stahl, 2013; 2017).
Как и в случае применения любых других ПАП при применении Тревикты настоятельно рекомендуется, чтобы пациенты строго соблюдали график инъекций препарата и, во всяком случае, не пропускали очередные инъекции.
Инъекции Тревикты делаются 1 раз в 3 мес (примерно 4 инъекции в год). Однако этот график не является абсолютно жестким. При необходимости очередная инъекция
Тревикты может быть перенесена на срок до 2 нед до или после запланированной календарной даты. При таком варьировании времени очередного введения Тревикты (в пределах 2 нед) средняя концентрация палиперидона в плазме крови, по данным популяционных фармакокинетических исследований, меняется мало, и это изменение клинически незначимо (ИМП Тревикта, 2017; Е.В. Оленева и соавт., 2017).
Если с момента последней инъекции Тревикты прошло более 3 мес, но не более 3,5–4 мес, то очередную дозу Тревикты следует ввести как можно скорее, во избежание рецидива психоза (ИМП Тревикта, 2017).
Если же с момента последней инъекции Тревикты прошло более 4 мес, но меньше 9 мес, то не следует сразу возобновлять терапию Тревиктой, так как она начинает действовать медленно, медленно достигает Cmax, и может «не успеть» предотвратить рецидив психоза в этот промежуток времени. Вместе с тем, если интервал между инъекциями Тревикты составил менее 9 мес, то повторный период стабилизации на Ксеплионе перед переводом на Тревикту не нужен. Достаточно ввести положенную по пересчету «нагрузочную» дозу Ксеплиона глубоко в дельтовидную мышцу двумя инъекциями в дни 1 и 8. Через 1 мес после этого можно продолжить поддерживающую терапию Тревиктой в прежней дозе (в той же дозе, которая предшествовала пропущенной инъекции Тревикты) [S. Stahl, 2013; 2017; ИМП Тревикта, 2017; Е.В. Оленева и соавт., 2017].
В дальнейшем после пропуска одной инъекции Тревикты на срок до 9 мес и возобновления терапии по указанному выше алгоритму, инъекции Тревикты повторяют, как обычно, каждые 3 мес (S. Stahl, 2013; 2017; ИМП Тревикта, 2017; Оленева и соавт., 2017).
Если же с момента последней инъекции Тревикты прошло более 9 мес, то необходима повторная предварительная стабилизация пациента на Ксеплионе в течение не менее чем 4 мес перед тем, как снова предпринять попытку перевода пациента на Тревикту. Лечение после такого длительного перерыва возобновляют с использованием стандартного режима начальной терапии Ксеплионом (при необходимости, когда имеется высокий риск рецидива психоза в ближайшее время – с использованием принципа «нагрузочной дозы» в первых двух инъекциях Ксеплиона в дни 1 и 8) [S. Stahl, 2013; 2017; ИМП Тревикта, 2017; Е.В. Оленева с соавт, 2017].
Инструкция производителя указывает, что у пациентов с начальными или легкими степенями почечной недостаточности (клиренс креатинина от 50 до 80 мл/мин) начальная доза Ксеплиона должна быть снижена на 25%.
В дальнейшем при переводе таких пациентов с подобранной дозы Ксеплиона на Тревикту пересчет дозы Ксеплиона в дозу Тревикты, как и у пациентов с нормальной функцией почек, осуществляется тоже с коэффициентом умножения 3,5. Однако при этом рассчитанная доза Тревикты у пациентов с начальной или легкой степенью почечной недостаточности не должна превышать 350 мг-экв. Такая же корректировка доз Ксеплиона и Тревикты рекомендуется и у пожилых пациентов со сниженной функцией почек (ИМП Тревикта, 2017).
У пациентов любого возраста с умеренной или тяжелой степенью почечной недостаточности, а также с тяжелой печеночной недостаточностью, инструкция производителя не рекомендует применение препарата Тревикта вообще (B. Carpiniello, F. Pinna, 2016; ИМП Тревикта, 2017).
Вместе с тем коррекция дозы препарата Тревикта у пациентов любого возраста с легкими или умеренными степенями печеночной недостаточности или у пожилых пациентов с нормальной функцией почек, как правило, не требуется (B. Carpiniello, F. Pinna, 2016; ИМП Тревикта, 2017).
Процедура инъекции Тревикты
Согласно инструкции производителя препарат Тревикта следует вводить глубоко в дельтовидную или глубоко в ягодичную мышцу с использованием длинной 1,5-дюймовой иглы, с достаточно большим для прохождения кристаллов суспензии Тревикты просветом (22G). Пациентам с массой тела более 90 кг не рекомендуется введение препарата Тревикта в ягодичную мышцу. У таких пациентов следует выбрать метод введения Тревикты строго в дельтовидную мышцу. Это обусловлено тем, что при введении препарата в ягодичную мышцу у таких пациентов существует риск попасть не в мышцу, а в подкожную жировую клетчатку (ИМП Тревикта, 2017; Е.Б. Любов, 2017).
Непосредственно перед введением суспензии препарата Тревикта шприц следует энергично встряхивать в течение как минимум 15 с, держа его колпачком вверх. Это нужно сделать не позднее чем за 5 мин до самой инъекции (т.е. нельзя держать приготовленную и хорошо взболтанную суспензию Тревикты более 5 мин – это чревато повторным оседанием кристаллов суспензии). Поскольку Тревикта содержит более крупные кристаллы, чем Ксеплион, то важным различием между процедурами приготовления Ксеплиона и Тревикты является сила и продолжительность встряхивания шприца, которое необходимо для правильного приготовления гомогенной суспензии (P. Ravenstijn и соавт., 2016).
Неправильное (недостаточно энергичное или недостаточно продолжительное) встряхивание шприца с суспензией Тревикты может привести к образованию мелких комочков из слипшихся кристаллов палиперидона пальмитата. В результате этого может не получиться ввести пациенту все содержимое цилиндра шприца. Если это все-таки произошло, то рекомендуется тщательное наблюдение за состоянием пациента на предмет возможного рецидива симптомов психоза до следующей инъекции Тревикты (Е.В. Оленева и соавт., 2017).
Вопросы комплаентности, переносимости и безопасности применения
Имеющиеся данные о безопасности и переносимости препарата Тревикта позволяют утверждать, что Тревикта в целом хорошо переносится и безопасна при длительном поддерживающем лечении шизофрении. Наблюдавшиеся как в ходе РКИ, так и в ходе постмаркетингового клинического применения препарата Тревикта ПЭ были достаточно редкими, и соответствуют тем, которые ранее описаны для препарата Ксеплион и для перорального палиперидона (препарат Инвега) [R. Herold, 2017].
Важным преимуществом Тревикты перед Ксеплионом и Инвегой является то, что благодаря более редкому режиму дозирования она создает меньшее количество пиков концентрации в крови вскоре после введения, а также дает менее резкий спад концентрации перед очередным введением. Тревикта характеризуется более плавной кривой концентрации в крови. Это, в свою очередь, транслируется в меньшее количество и меньший риск «пиковых» ПЭ вскоре после введения, на фоне пика концентрации препарата в крови (это, например, такие ПЭ, как острые ЭПС, острая акатизия, чрезмерная сонливость и седация, ортостатическая гипотензия), а также в меньший риск так называемых «ПЭ отмены» (акатизия отмены, дискинезии отмены, кратковременные «прорывы» психопатологической симптоматики) на фоне снижения концентрации в крови накануне очередной инъекции (R. Herold, 2017).
По данным РКИ, наиболее часто (с частотой 5% и более) при применении Тревикты регистрировались следующие ПЭ: местные постинъекционные реакции, прибавка массы тела, головные боли, повышение частоты инфекций верхних дыхательных путей, акатизия, лекарственный паркинсонизм (ИМП Тревикта, 2017). Кроме того, иногда отмечались также такие ПЭ, как ортостатическая гипотензия и тахикардия, тошнота и рвота, тревога, беспокойство, нарушения сна (возможно, связанные с возникновением акатизии), депрессия, неблагоприятные изменения в метаболическом профиле крови (гиперинсулинемия, гипертриглицеридемия, гиперхолестеринемия, дислипидемия), повышение пролактина в крови и связанные с этим ПЭ (нарушения либидо и сексуальной функции, гинекомастия у мужчин, аменорея или нарушения менструального цикла, галакторея у женщин) [ИМП Тревикта, 2017].
В двойном слепом плацебо-контролируемом РКИ, опубликованном в 2015 г., одна группа авторов предприняла сравнение эффективности, безопасности и переносимости препарата Тревикта с плацебо при длительном поддерживающем лечении шизофрении. Авторами этого РКИ показано, что препарат Тревикта в целом хорошо переносится и безопасен при применении по данному показанию. Уровень ПЭ в данном РКИ был низким. Наиболее частые зарегистрированные ПЭ Тревикты в этом РКИ: прибавка массы тела более чем на 7% от исходной (10% у Тревикты против 1% у плацебо), головные боли (9% против 4%), лекарственный паркинсонизм и другие проявления ЭПС (8% против 3%), акатизия (4% против 1%), назофарингит или набухание слизистой носа, заложенность носа (6% против 1%) [J. Berwaerts и соавт., 2015].
В другом, более позднем (от 2016 г.), двойном слепом плацебо-контролируемом РКИ P. Ravenstijn и соавт. тоже изучали как эффективность, так и безопасность, и переносимость препарата Тревикта в сопоставлении с плацебо при длительном поддерживающем лечении шизофрении.
Авторам этого исследования также удалось показать, что Тревикта в целом хорошо переносится и безопасна при длительном поддерживающем лечении шизофрении. Возникновение тех или иных ПЭ или плохая переносимость Тревикты редко служили основаниями для прекращения лечения. Наиболее распространенные ПЭ Тревикты, зарегистрированные в этом РКИ: назофарингит или набухание слизистой носа, заложенность носа – у 11% пациентов, головные боли – у 9%, прибавка массы тела – у 5,2%, боли в спине – у 5,2% (P. Ravenstijn и соавт., 2016).
По данным других авторов, наиболее распространенными ПЭ, которые наблюдаются при лечении препаратом Тревикта, являются прибавка массы тела, гиперпролактинемия, иногда ЭПС или акатизия. Однако эти ПЭ отмечались, согласно наблюдениям, не более чем в 10% случаев применения Тревикты, и, как правило, были легкой или умеренной степени выраженности (B. Carpiniello, F. Pinna, 2016).
Опубликованный в 2016 г. систематический обзор и метаанализ эффективности, безопасности и переносимости препарата Тревикта при длительном поддерживающем лечении шизофрении заключил, что, согласно имеющимся данным РКИ, Тревикта безопасна и достаточно хорошо переносится больными с этой патологией, и что ее профиль ПЭ, переносимости и безопасности аналогичен таковым у препаратов Ксеплион и Инвега (Y. Lamb, G. Keating, 2016).
Отдельно авторы упомянутого метаанализа отметили, что, несмотря на достаточно частую регистрацию в РКИ повышения уровня пролактина в плазме крови при применении препарата Тревикта, частота ПЭ, связанных с гиперпролактинемией (нарушения либидо и сексуальной функции у обоих полов, гинекомастия у мужчин, аменорея или нарушения менструального цикла, галакторея у женщин), по данным тех же РКИ, оказалась достаточно низкой (Y. Lamb, G. Keating, 2016).
Важным вопросом безопасности при применении любого АП является также вопрос о его влиянии на интервал QTc и о его способности вызывать тахикардию. Конкретно для препарата Тревикта показано, что тахикардия наблюдается у 7% пациентов, получающих Тревикту, против 3% при применении плацебо. Пациенты с удлинением интервала QTc более чем на 30–60 мс от исходного (до начала РКИ) встречались с частотой от 3,2 до 6,9% среди получавших Тревикту и от 2,8 до 5,5% – среди получавших плацебо (J. Berwaerts и соавт., 2015; P. Ravenstijn и соавт., 2016).
Опубликованные на сегодняшний день данные РКИ пока не позволяют сделать однозначных и окончательных выводов о том, как поддерживающая терапия Тревиктой субъективно воспринимается пациентами с шизофренией, и действительно ли более редкие инъекции препарата Тревикта транслируются в более высокую приверженность пациентов к терапии им по сравнению с препаратом Ксеплион (B. Carpiniello, F. Pinna, 2016).
Однако в пользу того, что это действительно так и есть, и что в подавляющем проценте случаев терапия Тревиктой приводит к улучшению субъективного качества жизни пациентов с шизофренией, свидетельствует зарегистрированная в РКИ очень низкая частота отказов от продолжения лечения препаратом Тревикта – 4% (B. Carpiniello, F. Pinna, 2016).
В одном недавнем (2018 г.) двойном слепом РКИ, в котором участвовали 152 пациента с шизофренией, показано, что перевод с Ксеплиона на Тревикту ассоциируется не только с улучшением приверженности собственно противорецидивной терапии шизофрении, но и с улучшением течения и повышением приверженности терапии таких коморбидных заболеваний, как зависимость от ПАВ или злоупотребление ПАВ, сахарный диабет, гипертоническая болезнь. Возможно, этот эффект связан с общим улучшением психического состояния на фоне более высокой приверженности поддерживающей терапии, восстановлением критичности, уменьшением негативной и когнитивной симптоматики и с происходящим при этом повышением внимания пациента к своему психическому и соматическому состоянию и лечению сопутствующих заболеваний (B. Emond и соавт., 2018).
Данные этого РКИ позволяют предположить, что применение Тревикты может улучшить приверженность пациентов не только собственно поддерживающей противорецидивной терапии шизофрении, но и лечению сопутствующих заболеваний, а также результаты их лечения. Значительная экономия времени и ресурсов врача, медперсонала и самого пациента за счет более редких инъекций Тревикты (по сравнению с альтернативными АП) делает такой метод повышения приверженности терапии сопутствующих заболеваний экономически выгодным (B. Emond и соавт., 2018).
Учитывая, что Тревикта является еще достаточно новым на рынке препаратом, по которому пока существует лишь небольшое количество РКИ, в будущем можно ожидать появления дополнительной информации как из новых РКИ, так и из открытых натуралистических исследований, описывающих приверженность терапии, эффективность, безопасность и переносимость препарата в реальной клинической практике, в том числе среди подгрупп пациентов с шизофренией, отягощенной коморбидными соматическими и психическими патологиями, а также с коморбидным злоупотреблением ПАВ или зависимостью от ПАВ (D. Taylor и соавт. 2014; A. Schreiner и соавт., 2014; L. Hargarter и соавт., 2015).
Подобные натуралистические данные, подтверждающие высокую эффективность и безопасность, хорошую переносимость и высокий уровень приверженности терапии не только в РКИ, но и в реальной клинической практике, в том числе у пациентов с различными соматическими, психическими и наркологическими коморбидностями, на сегодняшний день уже имеются для препарата Ксеплион (D. Taylor и соавт., 2014; A. Schreiner и соавт., 2014; L. Hargarter и соавт., 2015).
Эффективность и безопасность препарата Тревикта в длительном поддерживающем лечении шизофрении
Согласно инструкции производителя препарат Тревикта предназначен для длительного поддерживающего лечения шизофрении у клинически стабильных пациентов, которые до этого получали лечение препаратом Ксеплион в течение как минимум 4 мес и за это время продемонстрировали хорошую или удовлетворительную терапевтическую эффективность и переносимость Ксеплиона (ИМП Тревикта, 2017).
Поскольку препарат Тревикта медленно всасывается, то он не предназначен для лечения пациентов с острыми психотическими состояниями. Кроме того, из-за медленного (в течение 3 мес) выведения препарата Тревикта его нельзя применять у пациентов, у которых непосредственно перед этим не была продемонстрирована хорошая или удовлетворительная эффективность и переносимость препарата Ксеплион (1-месячного палиперидона пальмитата). Таким образом, препарат Тревикта нельзя применять для непосредственного перевода с любых других АП, неважно – пероральных или инъекционных. До перевода на Тревикту пациент должен быть переведен на Ксеплион и стабилизирован на нем в течение как минимум 4 мес
(Е.В. Оленева и соавт., 2017).
Сопоставление эффективности и безопасности применения Тревикты с плацебо при длительной поддерживающей терапии шизофрении
Кроме того, клиническое улучшение при применении Тревикты ассоциировалось также со статистически достоверным по сравнению с плацебо улучшением общего качества жизни, показателей когнитивного, личностного и социального функционирования больных шизофренией, в частности среднего балла по шкале PSP. Важно, что это улучшение носило прогрессивный характер, т.е. развертывалось постепенно в течение всего срока лечения Тревиктой
(12 мес) [J. Berwaerts и соавт., 2015].
У пациентов, которым не была показана пожизненная терапия АП (согласно рекомендациям ВОЗ после 1-го психотического эпизода рекомендуется поддерживающее лечение АП в течение минимум 2 лет, после 2-го – в течение минимум 5 лет, и только после 3-го эпизода однозначно рекомендуется пожизненная терапия), после прекращения лечения Тревиктой в значительно большем проценте случаев (46%) сохранялся высокий уровень социального и личностного функционирования (общий балл по шкале личностного и социального функционирования PSP выше 70), чем у пациентов, получавших плацебо (J. Berwaerts и соавт., 2015).
Это позволяет утверждать, что лечение Тревиктой не только эффективно профилактирует рецидивы шизофрении, но и способно тормозить прогрессирование болезни, нарастание эмоционально-волевого и когнитивного дефицита, способствует восстановлению и поддержанию социального и личностного функционирования больных шизофренией. Этот эффект может сохраняться даже после прекращения лечения, по крайней мере, у пациентов с благоприятным течением болезни и малым количеством рецидивов (J. Berwaerts и соавт., 2015).
Такая способность в целом характерна для АП-2П и АП-3П, в сравнении с АП-1П (S. Stahl, 2013; 2015).
В 2016 г. опубликованы результаты еще одного крупного многоцентрового (в общей сложности 506 пациентов с разными формами шизофрении обоего пола в возрасте от 18 до 70 лет из 8 разных стран) двойного слепого плацебо-контролируемого РКИ по изучению эффективности и безопасности применения препарата Тревикта в длительном поддерживающем лечении шизофрении (B. Carpiniello, F. Pinna, 2016).
Из общего числа участников данного РКИ 462 (91%) пациента уже получали ранее, до начала исследования и перевода на Ксеплион, а затем рандомизации либо к переводу на Тревикту, либо к получению плацебо, какие-либо АП. В частности, 318 (63%) человек до начала исследования получали пероральные АП-2П или АП-3П, 118 (23%) человек – пероральные АП-1П, и 89 (18%) человек – какие-либо ПАП, в том числе 36 из них (7% от общего числа участников) – Ксеплион [B. Carpiniello, F. Pinna, 2016].
Авторами этого РКИ убедительно продемонстрирована высокая эффективность, безопасность и хорошая переносимость препарата Тревикта в сопоставлении с плацебо при длительном противорецидивном лечении шизофрении. Кроме того, при ретроспективном сравнении результатов лечения препаратом Тревикта с результатами лечения АП, которые пациенты получали до включения в исследование, выявлено преимущество препарата Тревикта над всеми ранее применявшимися АП по таким параметрам, как эффективность профилактики рецидивов, уровень комплаентности больных к продолжению терапии, общее качество жизни (B. Carpiniello, F. Pinna, 2016).
Особенно значительным было преимущество препарата Тревикта над пероральными АП, а также над ПАП-1П, что не должно вызывать удивления (B. Carpiniello, F. Pinna, 2016).
В 2017 г. опубликован систематический обзор и метаанализ двойных слепых плацебо-контролируемых РКИ, посвященных изучению эффективности, безопасности и переносимости препарата Тревикта при длительной поддерживающей терапии шизофрении в сопоставлении с плацебо. Автор этого обзора заключил, что применение препарата Тревикта значительно снижает частоту, тяжесть и длительность рецидивов шизофрении по сравнению с плацебо, и что Тревикта в целом хорошо переносится и является безопасным методом противорецидивного лечения шизофрении (R. Herold, 2017).
Кроме того, R. Herold также сделал вывод о том, что сопоставление данных из этих РКИ с данными из РКИ Ксеплиона позволяет заключить, что эффективность, безопасность и переносимость применения Тревикты в качестве противорецидивного лечения шизофрении как минимум эквивалентны таковым у Ксеплиона или даже несколько лучше, чем у Ксеплиона (R. Herold, 2017).
Высокая эффективность, безопасность и хорошая переносимость препарата Тревикта, в сопоставлении с плацебо, при длительном поддерживающем лечении шизофрении убедительно продемонстрирована в ряде методологически безупречных, хорошо спланированных двойных слепых плацебо-контролируемых РКИ III фазы. После этого Тревикта получила регистрацию FDA (Y. Lamb, G. Keating, 2016).
В упомянутых предрегистрационных двойных слепых РКИ III фазы показано не только то, что Тревикта эффективнее плацебо в отношении удлинения времени до появления первых признаков рецидива шизофрении, в отношении снижения частоты, тяжести и длительности рецидивов, но и то, что противорецидивная активность Тревикты как минимум не уступает таковой у Ксеплиона или даже несколько превосходит последнюю (Y. Lamb, G. Keating, 2016).
Кроме того, в РКИ III фазы также показано, что Тревикта эффективнее плацебо в отношении стабилизации ремиссии и повышения ее качества (уменьшения резидуальной симптоматики шизофрении в межприступный период по шкале PANSS), улучшения общего клинического впечатления по шкале CGI, в отношении улучшения общего качества жизни больных шизофренией, а также в отношении улучшения показателей функционального восстановления пациентов (их социального, когнитивного и личностного функционирования). Вместе с тем по этим параметрам Тревикта существенно не отличалась от Ксеплиона, но характеризовалась более высокой комплаентностью (приверженностью лечению), чем Ксеплион (Y. Lamb, G. Keating, 2016).
Сопоставление эффективности и безопасности применения Ксеплиона и Тревикты при длительной поддерживающей терапии шизофрении
В 2016 г. международная исследовательская группа предприняла двойное слепое многоцентровое сравнительное РКИ с целью прямого сопоставления эффективности и безопасности длительной поддерживающей терапии шизофрении Тревиктой и Ксеплионом. Это РКИ было очень крупным по масштабам выборки. В нем приняли участие в общей сложности 1016 пациентов обоего пола с разными формами шизофрении, которые ранее были успешно стабилизированы на Ксеплионе (A. Savitz и соавт., 2016).
После проведения первичного скрининга и 17-недельной открытой фазы стабилизации с гибким подбором дозы Ксеплиона все пациенты, достигшие клинически стабильного состояния, рандомизированы либо к продолжению терапии Ксеплионом в подобранной на первом этапе дозировке (которая в дальнейшем оставалась фиксированной на протяжении всего второго этапа исследования; 50, 75, 100 или 150 мг-экв в дельтовидную или ягодичную мышцу, 1 раз в месяц), либо к переводу на Тревикту в дозе, эквивалентной ранее подобранной дозе Ксеплиона (также фиксированной на протяжении всего второго этапа исследования; 175, 263, 350 или 525 мг-экв в дельтовидную или ягодичную мышцы, 1 раз в 3 мес; с целью недопущения распознавания пациентом факта перевода на Тревикту пациенты, рандомизированные к переводу на нее, в промежутках между трехмесячными инъекциями Тревикты получали ежемесячные инъекции нейтральной суспензии, не содержащей активного вещества) [A. Savitz и соавт., 2016].
Вторая (двойная слепая) фаза упомянутого РКИ длилась 48 нед. При этом показано, что Тревикта как минимум не уступает Ксеплиону по общей противорецидивной активности и по способности стабилизировать и поддерживать ремиссию при шизофрении. Частота рецидивов (повторных эпизодов психоза) была приблизительно равной в группах Тревикты и Ксеплиона. Примерно сходны в обеих группах были также изменения суммарного балла по шкале PANSS и баллов по отдельным подшкалам (позитивной, негативной, когнитивной и аффективной симптоматики), а также изменения по шкале оценки качества жизни и по шкале CGI (A. Savitz и соавт., 2016).
Кроме того, авторы вышеупомянутого исследования также доказали, что Тревикта и Ксеплион в эквивалентных дозах являются фармакокинетически эквивалентными (характеризуются сопоставимыми уровнями палиперидона в плазме крови в течение всего срока действия инъекции).
В обеих группах больных (как в группе Ксеплиона, так и в группе Тревикты) также наблюдались сходные профили переносимости и безопасности препаратов, сходный уровень ПЭ. Поскольку в этом РКИ пациенты, рандомизированные к получению Тревикты, в промежутках между 3-месячными инъекциями Тревикты получали ежемесячные инъекции нейтральной суспензии, то примерно одинаковым в обеих группах был и уровень местных постинъекционных реакций (A. Savitz и соавт., 2016).
Самым частым ПЭ в обеих группах (как в группе Ксеплиона, так и в группе Тревикты) в данном РКИ была прибавка массы тела (A. Savitz и соавт., 2016).
В дальнейшем авторы упомянутого РКИ провели более детальный анализ сравнительной эффективности Ксеплиона и Тревикты на той же выборке пациентов по показателям достижения симптоматической ремиссии (исчезновения симптомов шизофрении или уменьшения их до уровня «ниже порога, необходимого для синдромальной диагностики») и функциональной ремиссии (восстановления когнитивного, социального, семейно-бытового и профессионального функционирования больных) [A. Savitz и соавт., 2017].
Упомянутый анализ показал, что Тревикта и Ксеплион эквивалентны также и по параметрам достижения как симптоматической (клинической), так и функциональной ремиссии. Так, в группе Тревикты симптоматическая клиническая ремиссия достигнута в 50,3% против 50,8% случаев в группе Ксеплиона. Функциональная же ремиссия, характеризующаяся более или менее полным восстановлением всех аспектов функционирования больного, достигнута у 42,5% пациентов в группе Тревикты и у 43,9% – в группе Ксеплиона (A. Savitz и соавт., 2017).
Большой клинический интерес представляет также анализ сравнительной эффективности терапии различными АП в тех этнических субпопуляциях, про которые уже известно, что они имеют значительные фармакогенетические отличия от «среднего по человечеству» или от субпопуляции белых людей (например, отличия в распространенности в данной этнической субпопуляции тех или иных полиморфизмов генов ферментов системы цитохрома P450 или полиморфизмов гена насосного белка ГЭБ P-gp) [A. Savitz и соавт., 2017].
Для того чтобы прояснить этот интересный вопрос, той же группой авторов выполнен отдельный анализ подвыборки пациентов из упомянутого исследования, принадлежащих к этническим подгруппам выходцев или жителей Восточной Азии (Китай, Япония) и Юго-Восточной Азии (Корея, Индонезия и др.). Эта подвыборка составила в общей сложности 510 пациентов обоего пола с разными формами шизофрении (A. Savitz и соавт., 2017).
Опять-таки этот анализ показал, что и в данной особой этнической подвыборке пациентов с шизофренией препараты Тревикта и Ксеплион характеризуются сходной эффективностью в уменьшении симптомов шизофрении, профилактике рецидивов (повторных эпизодов психоза), стабилизации ремиссии и улучшении общего качества жизни больных шизофренией, в восстановлении их социального, семейно-бытового и профессионального функционирования. Кроме того, оба препарата, как Ксеплион, так и Тревикта, также характеризуются сходными профилями переносимости и безопасности, сходным уровнем ПЭ в данных особых этнических подгруппах (A. Savitz и соавт., 2017).
Так, в частности, процент пациентов с рецидивом шизофрении на фоне продолжения поддерживающей терапии в данных этнических подгруппах был примерно одинаковым в группе Тревикты (10,2%) и в группе Ксеплиона (11,8%). Примерно одинаковыми в обеих группах препаратов – Ксеплиона и Тревикты – на данной этнической подвыборке оказалось и среднее снижение общего балла симптоматики шизофрении по шкале PANSS, а также баллов по ее отдельным субдоменам (позитивной, негативной, когнитивной и аффективной симптоматики), и среднее улучшение общего качества жизни, и среднее улучшение показателей по шкале CGI (A. Savitz и соавт., 2017).
Сопоставимыми в обеих группах препаратов – Ксеплиона и Тревикты – на данной этнической подвыборке оказались также показатели частоты достижения симптоматической (клинической) и функциональной ремиссии шизофрении (A. Savitz и соавт., 2017).
В 2017 г. опубликован метаобзор, в котором авторы предприняли попытку сопоставить эффективность противорецидивного лечения при шизофрении с применением перорального палиперидона (препарат Инвега) с применением 1-месячного палиперидона пальмитата (препарат Ксеплион) и с применением 3-месячного палиперидона пальмитата (препарат Тревикта). Эффективность противорецидивного лечения оценивалась как среднее время до момента рецидива психоза после прекращения лечения тем или иным препаратом. При этом, что особенно важно для интерпретации полученных данных, под моментом прекращения лечения, в случае применения пролонгированных форм палиперидона, подразумевался не просто момент пропуска очередной инъекции, а момент ожидаемого, согласно фармакокинетике препарата, его полного или почти полного выведения (P. Weiden и соавт., 2017).
В упомянутый метаобзор вошли данные из трех методологически корректных двойных слепых плацебо-контролируемых РКИ по поддерживающей терапии шизофрении с применением указанных трех форм выпуска палиперидона – пероральной (препарат Инвега), пролонгированной 1-месячной (препарат Ксеплион) и пролонгированной 3-месячной (препарат Тревикта). Суммарное число участников всех трех вошедших в данный метаобзор РКИ составило 449 человек (P. Weiden и соавт., 2017).
Авторами данного метаобзора убедительно показано, что лечение Тревиктой способствует более эффективной профилактике рецидивов шизофрении по сравнению как с лечением пероральной Инвегой, так и с лечением Ксеплионом, и что противорецидивный эффект Тревикты после прекращения лечения ею, даже после полного выведения препарата, сохраняется значительно дольше, чем противорецидивный эффект Ксеплиона и тем более Инвеги (P. Weiden и соавт., 2017).
В самом деле, медианное время до появления первых признаков рецидива психоза после прекращения лечения составило всего 58 дней (диапазон от 42 до 114 дней) в случае применения перорального палиперидона (Инвега), но 172 дня (диапазон от 134 до 222 дней) – в случае применения 1-месячных инъекций палиперидона пальмитата (Ксеплион) и 395 дней (диапазон от 274 дней до «рецидива не случилось за все время исследования» – 2 года) – в случае применения Тревикты; доверительный интервал 95%, p<0,0001 (P. Weiden и соавт., 2017).
Резюмируя все приведенные данные как из предрегистрационных РКИ III фазы по Тревикте, так и из постмаркетинговых РКИ, можно сделать вывод, что препарат Тревикта имеет сопоставимую с Ксеплионом эффективность, безопасность и переносимость в длительном поддерживающем лечении шизофрении. При этом Тревикта удобнее Ксеплиона и альтернативных ПАП в применении для пациентов и их родственников, врачей и среднего медицинского персонала поскольку не требует частых ежемесячных инъекций (достаточно всего 4 инъекций в год).
Это транслируется и в более высокую приверженность пациентов длительной поддерживающей терапии Тревиктой по сравнению с Ксеплионом или альтернативными ПАП и в меньшую частоту местных постинъекционных осложнений (инфильтратов и абсцессов мягких тканей) при лечении Тревиктой по сравнению с Ксеплионом и альтернативными ПАП. Кроме того, меньшая частота инъекций, необходимая при лечении Тревиктой по сравнению с Ксеплионом и с альтернативными ПАП, означает существенную экономию времени и ресурсов врачей, медперсонала и самих пациентов при применении Тревикты.
Все это в сумме приводит к позитивному экономическому эффекту от перевода пациентов с поддерживающего лечения Ксеплионом на лечение Тревиктой.
Заключение
Как видно из приведенных нами данных литературы, препарат Тревикта (пролонгированная форма палиперидона пальмитата, позволяющая обходиться всего 4 инъекциями в год) является высокоэффективным, удобным и безопасным средством для поддерживающей терапии шизофрении.
Исследования свидетельствуют, что поддерживающая терапия препаратом Тревикта, вводимым 1 раз в 3 мес, как минимум не уступает по противорецидивной эффективности поддерживающей терапии препаратом Ксеплион, вводимым 1 раз в месяц, но при этом удобнее для пациентов и их родственников. Это позволяет повысить комплаентность длительной поддерживающей терапии пациентов с шизофренией. Такая терапия также экономит время и ресурсы врача, среднего медперсонала и медицинской системы в целом.
Кроме того, терапия препаратом Тревикта может быть более экономически выгодной для пациентов с ограниченным доступом к ресурсам медицинской системы, ограниченным временем или финансовыми ограничениями (во многих странах стоимость обращения к врачу значительно выше стоимости самого лекарства).
Не следует забывать и о том, что внутримышечные инъекции, при всей их кажущейся простоте, все же являются инвазивным методом лечения, который сам по себе способен вызывать осложнения. Даже при строгом соблюдении стерильности, частые внутримышечные инъекции ассоциируются с повышенным риском возникновения местных инфильтратов и даже абсцессов. В свете этого лечение препаратом Тревикта еще и более безопасно для пациентов, чем лечение альтернативными ПАП, требующими ежемесячного введения, особенно с учетом того, что это лечение, как правило, многолетнее.
Сведения об авторах
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве

