Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
R.U. Ahtemov, D.V. Solomko, U.M. Seitmemetova, N.S. Ibragimov, L.A. Macukatova, P.A. Panova, N.V. Leonova,
S.Z. Tleuzheva, A.I. Voronko , S.O. Tjuhlov
V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky" (Kuryanov Vladimir Olegovich, rector of KFU), Department of Basic and Clinical Pharmacology, Simferopol, Russia
е-mail: denisevil@gmail.com
Abstract
Chronic fatigue syndrome/myalgic encephalomyelitis is a heterogeneous disease with multiple manifestations. The gut microbiome has received increasing attention in various refractory diseases, including chronic fatigue syndrome/myalgic encephalomyelitis. This study aims to advance our understanding of the relationship between the gut microbiome and chronic fatigue syndrome/myalgic encephalomyelitis through analysis of data from various clinical studies. We searched the literature in 4 databases: PubMed, Cochrane Library, Web of Science and Google Scholar up to May 31, 2023. Our analysis included 11 clinical studies involving 553 patients with chronic fatigue syndrome/myalgic encephalomyelitis and 480 healthy controls. Comparative metadata analysis revealed a significant reduction in α-diversity and a marked change in β-diversity in the gut microbiome of patients with chronic fatigue syndrome/myalgic encephalomyelitis compared with healthy controls. The ratio of Firmicutes to Bacteroides decreased by 2.3-fold, and there was also a significant reduction in the production of microbial metabolites such as acetate, butyrate, isobutyrate and some amino acids (alanine, serine and hypoxanthine) observed in patients with chronic fatigue syndrome/myalgic encephalomyelitis. This review provides a comprehensive analysis of recent advances in understanding the role of the gut microbiome in patients with chronic fatigue syndrome/myalgic encephalomyelitis. In addition, we also highlighted the potential of using several microbiome-related interventions to alleviate the symptoms of chronic fatigue syndrome/myalgic encephalomyelitis.
Key words: chronic fatigue syndrome, myalgic encephalomyelitis, intestinal microbiota, metabolites, disorder.
For citation: Useinova A.N., Kovtunovich D.O., Vetrova E.Yu., Savshak M.V., Izetova N.A., Asanova U.R., Mamutova F.M., Ahtemov R.U., Solomko D.V., Seitmemetova U.M., Ibragimov N.S., Macukatova L. A., Panova P.A., Leonova N.V., Tleuzheva S.Z., Voronko A.I., Tjuhlov S.O. The link between chronic fatigue syndrome and gut microbiome (A Literature Review). Psychiatry and psychopharmacotherapy. 2024; 4: 48–53. DOI: 10.62202/2075-1761-2024-26-4-48-53.
Данное заболевание могут вызывать вирусная инфекция, иммунная дисфункция, нейроэндокринный дисбаланс, генетическая предрасположенность, психологические факторы и многое другое [3]. Однако истинная причина патофизиологии MЭ/CХУ еще не установлена, что затрудняет понимание звеньев проявлений, установление диагноза и последующее лечение [4]. Недавние обширные исследования хронических метаболических заболеваний, психических расстройств и MЭ/CХУ выявили потенциальное участие аномального функционирования микробиома кишечника при этих расстройствах [5]. Исследователи попытались найти новые сведения о MЭ/CХУ через микробиом кишечника и его метаболиты [6]. В клинике значительное количество пациентов с МЭ/СХУ также испытывают синдром раздраженного кишечника, а более 70% пациентов с МЭ/СХУ сообщают о других различных желудочно-кишечных расстройствах, что указывает на потенциальную связь между измененным микробиомом кишечника и патофизиологией MЭ/CХУ [7].
Оценка качества каждого исследования проводилась с использованием 6 видов инструментов, которые включают генерацию случайных последовательностей, сокрытие распределения, ослепление участников, ослепление оценки результатов, неполные данные о результатах, выборочную отчетность. Риск систематической ошибки для каждой области оценивался и классифицировался как «низкий», «неясный» или «высокий». В данном исследовании метаанализ был проведен с использованием статистического программного обеспечения RevMan 5.4 от Cochrane. Результаты выражали в виде стандартизированной разности средних с 95% доверительным интервалом. На основе оценки гетерогенности с использованием I2 мы применили модель случайных эффектов для случаев с гетерогенностью 50% и выше. Статистическую значимость определяли при значениях p менее 0,05.
 В конечном итоге мы выбрали 11 клинических исследований, которые соответствовали критериям включения и исключения для данного обзора. Отобранные исследования были проведены в шести странах (63,6% в США) на 4 континентах и были опубликованы в течение последнего десятилетия. Данные исследования отражены в списке литературы.
В конечном итоге мы выбрали 11 клинических исследований, которые соответствовали критериям включения и исключения для данного обзора. Отобранные исследования были проведены в шести странах (63,6% в США) на 4 континентах и были опубликованы в течение последнего десятилетия. Данные исследования отражены в списке литературы.
В общей сложности 1033 участника (23,4% мужчин и 76,6% женщин), в том числе 480 здоровых (46,5%) и 553 человека с MЭ/CХУ (53,5%) в 11 исследованиях из шести стран, средний возраст всех участников составил около 44,5 лет. Средний индекс массы тела у всех участников был ниже 25, при этом особых различий между здоровыми (контрольной группой, 24,5± 1,8) и больными (MЭ/CХУ (24,3± 2,2) соответственно не было. В отобранных исследованиях участники с MЭ/CХУ и здоровые контрольные группы в одинаковых возрастных диапазонах (больные: 45,0±6,7 лет и здоровые контрольные группы: 43,9±6,8 лет).
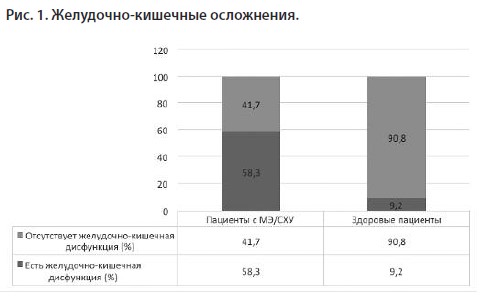
В 11 рассмотренных исследованиях использовались 3 варианта для постановки диагноза MЭ/CХУ: с использованием критериев Фукуды, исключительно с использованием Канадских консенсусных критериев и комбинация из этих критериев. Что касается желудочно-кишечных осложнений, у 58,3% пациентов с MЭ/CХУ наблюдалась желудочно-кишечная дисфункция, в отличие от 9,2% здоровых субъектов.
Во всех 11 отобранных исследованиях анализировался микробиом кишечника с использованием секвенирования следующего поколения (10 исследований) или метода анаэробного культивирования in vitro (1 исследование) в образцах кала. Однако только в 5 исследованиях был проведен сравнительный анализ метаболитов кишечных микроорганизмов в моче и сыворотке/плазме. Кроме того, в 8 из 11 отобранных исследований упоминалось, что испытуемые, принимавшие какие-либо антибиотики в течение предыдущих 2 или 4 недель, были исключены. Из 11 исследований в 7 сообщалось об α-разнообразии кишечного микробиома, в 3 – о значительном его снижении, в 4 исследованиях – об отсутствии существенных различий. Результат показал значительное снижение α-разнообразия кишечного микробиома (на 34%) у пациентов с МЭ/СХУ по сравнению со здоровыми контрольными группами (p<0,00001).
Среди 11 исследований в 6 исследованиях сообщалось о β-разнообразии микробиома кишечника. За исключением 1 исследования, которое не выявило заметных изменений в β-разнообразии кишечного микробиома (p>0,05), остальные 5 исследований постоянно указывали на значительные различия в общей структуре кишечного микробиома у пациентов с MЭ/CХУ по сравнению со здоровыми людьми из контрольной группы (p< 0,05, 0,01 или 0,001).
Во всех 11 исследованиях сравнивали таксономические изменения в микробиоме кишечника с использованием секвенирования 16s рРНК (6 исследований), метагеномного секвенирования всего генома (3 исследования), секвенирования 18s рРНК (1 исследование) и секвенирования анаэробной культуры (1 исследование).
Были обобщены изменения микробиома кишечника по трем уровням таксономической классификации из 10 исследований. На уровне А у пациентов с MЭ/CХУ наблюдалось значительное увеличение количества Bacteroidetes наряду с заметным снижением количества Firmicutes по сравнению со здоровой контрольной группой (p< 0,01). Интересно, что некоторые потенциально полезные роды, такие как Bifidobacterium, Roseburia и Faecalibacterium, заметно снижены у больных пациентов по сравнению со здоровыми людьми (p <0,05 или p<0,01). Количество Firmicutes заметно снижается, однако количество некоторых родов, принадлежащих к Firmicutes, таких как Phascolarctobacterium, Blautia, Coprobacillus, Oscillospira, Lactococus, Anaerotruncus, значительно увеличивается (p<0,05 или p<0,01).
Кроме того, 4 исследования показали значительное увеличение количества некоторых условно-патогенных видов бактерий среди пациентов с МЭ/СХУ, включая Erysipelatoclostridium ramosum, Enterocloster citroniae, Hungatella hathewayi, Eggerthella lenta и т. д. И наоборот, количество некоторых молочнокислых бактерий и других полезных видов заметно уменьшилось при МЭ/СХУ, а именно Faecalibacterium prausnitzii, Bifidobacterium angulatum, Lactobacillus ruminis, Roseburia intestinalis и т.д.
Всего в 5 исследованиях сообщалось о различиях в метаболитах между пациентами MЭ/CХУ и здоровыми людьми из контрольной группы при оценке кала (4 исследования), сыворотки/плазмы (3 исследования) и мочи (1 исследование). Содержание как короткоцепочечных жирных кислот (КЦЖК, таких как бутират, ацетат), так и разветвленных КЦЖК (изобутират), было значительно снижено в кале, крови и моче пациентов с MЭ/CХУ. Наблюдались заметные различия в метаболитах, относящихся к аминокислотам и липидным молекулам, на которые прямо или косвенно влияет микробиом кишечника. Также у пациентов с MЭ/CХУ по сравнению со здоровыми людьми из контрольной группы наблюдалось значительное снижение сывороточного альфа-токоферола (витамин E, p<0,05) – витамина-антиоксиданта, который может метаболизироваться некоторыми кишечными микробами.
 В последнее время все больше исследований подчеркивает важность микробиома кишечника при различных клинических состояниях, включая синдром раздраженного кишечника и психические расстройства [13]. Стоит отметить, что типичные симптомы MЭ/CХУ, такие как расстройства пищеварения, депрессия и когнитивные проблемы, также считаются тесно связанными с дисбактериозом кишечного микробиома [14]. Чтобы осветить звенья патогенеза MЭ/CХУ, мы всесторонне проанализировали последние клинические данные, касающиеся микробиома и связанных с ним метаболитов.
В последнее время все больше исследований подчеркивает важность микробиома кишечника при различных клинических состояниях, включая синдром раздраженного кишечника и психические расстройства [13]. Стоит отметить, что типичные симптомы MЭ/CХУ, такие как расстройства пищеварения, депрессия и когнитивные проблемы, также считаются тесно связанными с дисбактериозом кишечного микробиома [14]. Чтобы осветить звенья патогенеза MЭ/CХУ, мы всесторонне проанализировали последние клинические данные, касающиеся микробиома и связанных с ним метаболитов.
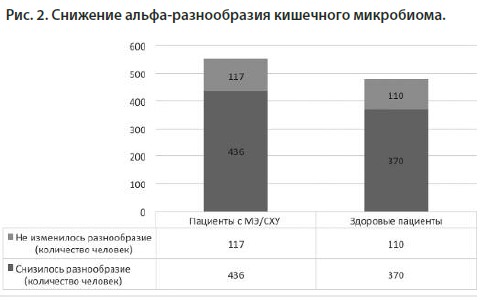
В конечном итоге были отобраны 11 исследований, которые соответствовали нашим критериям, включающих 553 человека с MЭ/CХУ и 480 здоровых людей из контрольной группы. При анализе микробиома обычно используются сравнения α-разнообразия и β-разнообразия [15]. В 6 исследованиях (436 пациентов с MЭ/CХУ и 370 здоровых людей из контрольной группы) мы наблюдали значительное снижение альфа-разнообразия кишечного микробиома у больных по сравнению со здоровой контрольной группой. Хоть это и не является окончательным мнением, но многие ученые предполагают, что здоровый человек обычно содержит примерно от 500 до 1000 различных видов бактерий в кишечнике [16]. Наши данные отразили снижение примерно на 34% количество видов кишечного микробиома у пациентов с MЭ/CХУ по сравнению со здоровыми людьми из контрольной группы (p< 0,00001). В целом, у здоровых людей в кишечнике обитает большее разнообразие различных представителей микробиома, и это разнообразие вносит значительный вклад в общее состояние здоровья человека [17]. Примечательно, что снижение α-разнообразия обычно наблюдается не только при МЭ/СХУ, но и при многих других патологических состояниях и заболеваниях, таких как ожирение, диабет, воспалительные заболевания кишечника и психические расстройства [18]. Также при старении происходят аналогичные изменения в микробиоме кишечника [19].
В отличие от α-разнообразия, β-разнообразие указывает на степень различия в составе видов кишечных микробов между двумя группами [20]. Когда мы проанализировали β-разнообразие в 6 исследованиях, за исключением 1 исследования без существенной разницы (p>0,05), 5 исследований подтвердили заметное различие в структуре микробиома кишечника между больными и здоровыми людьми (p<0,05, 0,01). Как и в α-разнообразии, различие микробных сообществ β-разнообразия наблюдается не только при MЭ/CХУ, а также при вышеупомянутых заболеваниях [21]. Однако необходимы дальнейшие исследования, чтобы в будущем напрямую сравнить β-разнообразие микробиома кишечника между больными с MЭ/CХУ и другими подобными заболеваниями, такими как фибромиалгия, постковидный синдром и аутоиммунные заболевания.
Существенные изменения в составе микробиома кишечника могут повлиять на метаболизм человека в целом, что, как следствие, приведет к ряду изменений в кишечных метаболитах [22]. 1 исследование показало, что чем дольше человек был болен, тем больше становились изменения в кишечных метаболитах. Заметные изменения были обнаружены в 11 метаболитах в кале, 10 в сыворотке/плазме и 7 в моче. Среди этих изменений самое значительное снижение было в уровне бутирата у пациентов с MЭ/CХУ. Это связано с общим снижением количества бактерий, которые его продуцируют [23]. Также у пациентов с МЭ/СХУ наблюдалось заметное снижение содержания других метаболитов, продуцируемых бактериями, которые служат источниками энергии (таких как ацетат и изовалерат) и проявляют противомикробные свойства (такие как лактат и бензоат) [24]. Было продемонстрировано, что сфинголипиды, полученные из кишечного микробиома, изменяют метаболизм липидов хозяина [25]. В частности, Bacteroides spp. с геном серинпальмитоилтрансферазы обладают способностью продуцировать сфинголипиды. Это может объяснить повышенный уровень липидов в сыворотке и высокий уровень Bacteroidetes, которые были обнаружены у длительно болеющих пациентов.
Многочисленные исследования выявили потенциальную роль витамина Е в улучшении психического здоровья, особенно когнитивных функций [26]. Некоторые кишечные микробы, такие как Bacteroides и Clostridium, обладают потенциальной способностью метаболизировать витамин Е в кишечном тракте [27]. Следовательно, мы предполагаем, что когнитивные нарушения, наблюдаемые у пациентов с MЭ/CХУ, могут быть связаны со специфическими изменениями в микробиоме кишечника и значительным снижением уровня витамина Е.
Триптофан, служащий предшественником серотонина, может видоизменяться определенными бактериями, что приводит к влиянию на уровни серотонина и функцию мозга и даже на патофизиологию MЭ/CХУ [28]. К сожалению, ни в одном из 11 исследований, включенных в текущий обзор, не проводился анализ метаболитов триптофана. Анализ исследований показал, что пациенты с тяжелым MЭ/CХУ имеют избыточное количество антител против флагеллинов, особенно в виде патоген-ассоциированного молекулярного паттерна из Lachnospiraceae, по сравнению со здоровыми людьми из контрольной группы. Эти данные позволяют предположить, что микробиом может быть непосредственно вовлечен в патогенез MЭ/CХУ.
Что касается терапевтического аспекта, клиническое исследование продемонстрировало эффективность введения пробиотиков (штамм Lactobacillus Casei Shirota и Bifidobacterium infantis) в снижении тревожности и воспалительных биомаркеров у пациентов с MЭ/CХУ [29]. Все большее число клиницистов полагают, что управление микробиомом кишечника посредством трансплантации фекального микробиома может быть эффективным терапевтическим средством для лечения некоторых заболеваний, включая MЭ/CХУ [30]. Следовательно, применение трансплантации на моделях животных, которым до этого вводились антибиотики, можно считать перспективным подходом для дальнейшего изучения этиологии и патогенеза MЭ/CХУ.
Если говорить о распространенности данного заболевания среди женщин, текущее исследование показало, что 83% участников с данным диагнозом – женщины [31]. Различия в микробиоме кишечника были обнаружены между полами из-за генетических факторов, гормональных влияний и физиологических различий [32]. Ограничением в данном обзоре является то, что ни в одном из исследований не анализировались различия микробиома кишечника с учетом пола. Кроме того, микробиом кишечника включает не только бактерии, а также грибы, вирусы, простейшие и т. д. Однако текущий обзор фокусируется только на бактериях из-за очень небольшого количества исследований, в которых изучались другие представители, помимо бактерий.
Конфликт интересов.
Авторы заявляют, что данная работа, её тема, предмет и содержание не затрагивают конкурирующих интересов.
Сведения об авторах:
Асие Наримановна Усеинова – кандидат медицинских наук, доцент кафедры базисной и клинической фармакологии ОТКЗ медицинского института им. С. И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского», 295051, Российская Федерация, Республика Крым, г.Симферополь, бул. Ленина 5/7; Тел. +79788221819; E-mail: mametova.as@mail.ru; ORCID: 0000-0003-0725-5455; SPIN-код: 9031-2079ю
Денис Олегович Ковтунович, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788155732, denisevil628@gmail.com, https://orcid.org/0009-0003-6677-0251
Екатерина Юрьевна Ветрова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785648554, kkunicina@rambler.ru, https://orcid.org/0009-0004-4519-8134
Марк Валерьевич Савшак, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785066842,
marsasramarsasram@gmail.com, https://orcid.org/0009-0004-4324-1960
Нилюфер Азизовна Изетова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788482910, izetova.n2001@gmail.com, https://orcid.org/0009-0008-1884-1488
Ульвие Раимовна Асанова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785140598, ulvie-asanova@mail.ru, https://orcid. org/0009-0005-9635-2506
Фатма Мусаевна Мамутова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785130303, mamut398@mail.ru, https://orcid.org/0009-0000-2019-6504
Ремзи Усеинович Ахтемов, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785043664, rema654888@icloud.com, https://orcid.org/my-orcid?orcid=0009-0002-2590-5490
Дарья Владимировна Соломко, студент 5 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79129166197, DSolomko2002@gmail.com, https://orcid.org/0009-0001-7328-680X
Усние Марленовна Сеитмеметова, студент 5 курса 2-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79787618450, seitmemetova2002@mail.ru, https://orcid.org/0009-0005-7957-9004
Нафе Сулаймон оглу Ибрагимов, студент 4 курса 2-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79780153417, Nafeibragimov@gmail.com, https://orcid.org/0009-0006-3054-983X
Любовь Александровна Мацукатова, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788329505, Lubov_alex@icloud.com, https://orcid.org/0009- 0009-8905-7778
Полина Антоновна Панова, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79787691504, panova-polina@list.ru, https://orcid.org/0009-0009-2155-8701
Наталия Валериевна Леонова, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788058454, Leonova.yalta@yandex.ru, https://orcid.org/0009-0006-0259-3024
Сталина Заурбековна Тлеужева, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79782402638, tleuzheva.s@bk.ru, https://orcid.org/0009-0007-5300-6106
Антон Игоревич Воронко, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79787866172, voronko473@gmail.com, https://orcid.org/0009-0000-1362-7580
Сергей Олегович Тюхлов, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788160915, Tuhlovsergey@gmail.com, https://orcid.org/0009-0003-6911-732X
Information about author:
Asie Narimanovna Useinova – Candidate of Medical Sciences, Associate Professor of the Department of Basic and Clinical Pharmacology of the S. I. Georgievsky OTKZ Medical Institute, V.I. Vernadsky KFU, 295051, Russian Federation, Republic of Crimea, Simferopol, blvd. Lenin 5/7; Tel. +79788221819; E-mail: mametova.as@mail.ru ; ORCID: 0000-0003-0725-5455; SPIN code: 9031-2079y
Denis Olegovich Kovtunovich, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788155732, denisevil628@gmail.com, https://orcid.org/0009-0003-6677-0251;
Ekaterina Yurievna Vetrova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785648554, kkunicina@rambler.ru, https://orcid.org/0009-0004-4519-8134;
Mark Valer'evich Savshak, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785066842, marsasramarsasram@gmail.com, https://orcid. org/0009-0004-4324-1960;
Niljufer Azizovna Izetova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788482910, izetova.n2001@gmail.com, https://orcid.org/ 0009-0008-1884-1488
Ul'vie Raimovna Asanova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785140598, ulvie-asanova@mail.ru, https://orcid.org/0009-0005-9635-2506
Fatma Musaevna Mamutova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785130303, mamut398@mail.ru, https://orcid.org/0009-0000-2019-6504;
Remzi Useinovich Ahtemov, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051+79785043664, rema654888@icloud.com, https://orcid.org/my-orcid?orcid=0009-0002-2590-5490;
Dar'ja Vladimirovna Solomko, 5th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79129166197, DSolomko2002@gmail.com, https://orcid. org/0009-0001-7328-680X;
Usnie Marlenovna Seitmemetova, 5th year student of the 2st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79787618450, seitmemetova2002@mail.ru, https://orcid. org/0009-0005-7957-9004;
Nafe Sulajmon oglu Ibragimov, 4th year student of the 2nd Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79780153417, Nafeibragimov@gmail.com, https://orcid. org/0009-0006-3054-983X;
Ljubov' Aleksandrovna Macukatova, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788329505, Lubov_alex@icloud.com, https://orcid. org/0009- 0009-8905-7778;
Polina Antonovna Panova, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79787691504, panova-polina@list.ru, https://orcid.org/0009-0009-2155-8701;
Natalija Valerievna Leonova, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788058454, Leonova.yalta@yandex.ru, https://orcid.org/0009-0006-0259-3024;
Stalina Zaurbekovna Tleuzheva, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79782402638, tleuzheva.s@bk.ru, https://orcid.org/0009-0007-5300-6106;
Anton Igorevich Voronko, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79787866172, voronko473@gmail.com, https://orcid.org/0009-0000-1362-7580;
Sergej Olegovich Tjuhlov, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788160915, Tuhlovsergey@gmail.com, https://orcid.org/0009-0003-6911-732X.
Дата поступления: 10.04.2024
Received: 10.04.2024
Принята к печати: 25.07.2024
Accepted: 25.07.2024
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2024
Взаимосвязь синдрома хронической усталости и состояния кишечного микробиома (обзор литературы) №04 2024
Номера страниц в выпуске:48-53
Резюме
Синдром хронической усталости/Миалгический энцефаломиелит – это гетерогенное заболевание с множественными проявлениями. Кишечному микробиому уделяется все больше внимания при различных рефрактерных заболеваниях, включая синдром хронической усталости/миалгический энцефаломиелит. Данное исследование направлено на углубление нашего понимания взаимосвязи между микробиомом кишечника и синдромом хронической усталости/миалгическим энцефаломиелитом посредством анализа данных различных клинических исследований. Мы провели поиск литературы в 4 базах данных, таких как: PubMed, Cochrane Library, Web of Science и Google Scholar, по состоянию на 31 мая 2023 г. Наш анализ охватил 11 клинических исследований с участием 553 пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом и 480 здоровых лиц контрольной группы. Сравнительный анализ метаданных выявил значительное снижение α-разнообразия и заметное изменение β-разнообразия в микробиоме кишечника пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом по сравнению со здоровыми людьми. Соотношение Firmicutes и Bacteroides уменьшилось в 2,3 раза, а также наблюдалось значительное снижение выработки микробных метаболитов, таких как ацетат, бутират, изобутират и некоторые аминокислоты (аланин, серин и гипоксантин), наблюдаемое у пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом. В этом обзоре представлен всесторонний анализ последних достижений в понимании роли микробиома кишечника у пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом. Кроме того, мы также осветили возможности использования некоторых вмешательств, связанных с микробиомом, для облегчения симптомов синдрома хронической усталости/миалгического энцефаломиелита.
Ключевые слова: синдром хронической усталости, миалгический энцефаломиелит, микробиота кишечника, метаболиты, расстройство.
Для цитирования: Усеинова А.Н., Ковтунович Д.О., Ветрова Е.Ю., Савшак М.В., Изетова Н.А., Асанова У.Р., Мамутова Ф.М., Ахтемов Р.У., Соломко Д.В., Сеитмеметова У.М., Ибрагимов Н.С., Мацукатова Л.А., Панова П.А., Леонова Н.В., Тлеужева С.О., Воронко А.И., Тюхлов С.О. Взаимосвязь синдрома хронической усталости и состояния кишечного микробиома (обзор литературы). Психиатрия и психофармакотерапия. 2024; 4: 48–53. DOI: 10.62202/2075-1761-2024-26-4-48-53.
Синдром хронической усталости/Миалгический энцефаломиелит – это гетерогенное заболевание с множественными проявлениями. Кишечному микробиому уделяется все больше внимания при различных рефрактерных заболеваниях, включая синдром хронической усталости/миалгический энцефаломиелит. Данное исследование направлено на углубление нашего понимания взаимосвязи между микробиомом кишечника и синдромом хронической усталости/миалгическим энцефаломиелитом посредством анализа данных различных клинических исследований. Мы провели поиск литературы в 4 базах данных, таких как: PubMed, Cochrane Library, Web of Science и Google Scholar, по состоянию на 31 мая 2023 г. Наш анализ охватил 11 клинических исследований с участием 553 пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом и 480 здоровых лиц контрольной группы. Сравнительный анализ метаданных выявил значительное снижение α-разнообразия и заметное изменение β-разнообразия в микробиоме кишечника пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом по сравнению со здоровыми людьми. Соотношение Firmicutes и Bacteroides уменьшилось в 2,3 раза, а также наблюдалось значительное снижение выработки микробных метаболитов, таких как ацетат, бутират, изобутират и некоторые аминокислоты (аланин, серин и гипоксантин), наблюдаемое у пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом. В этом обзоре представлен всесторонний анализ последних достижений в понимании роли микробиома кишечника у пациентов с синдромом хронической усталости/миалгическим энцефаломиелитом. Кроме того, мы также осветили возможности использования некоторых вмешательств, связанных с микробиомом, для облегчения симптомов синдрома хронической усталости/миалгического энцефаломиелита.
Ключевые слова: синдром хронической усталости, миалгический энцефаломиелит, микробиота кишечника, метаболиты, расстройство.
Для цитирования: Усеинова А.Н., Ковтунович Д.О., Ветрова Е.Ю., Савшак М.В., Изетова Н.А., Асанова У.Р., Мамутова Ф.М., Ахтемов Р.У., Соломко Д.В., Сеитмеметова У.М., Ибрагимов Н.С., Мацукатова Л.А., Панова П.А., Леонова Н.В., Тлеужева С.О., Воронко А.И., Тюхлов С.О. Взаимосвязь синдрома хронической усталости и состояния кишечного микробиома (обзор литературы). Психиатрия и психофармакотерапия. 2024; 4: 48–53. DOI: 10.62202/2075-1761-2024-26-4-48-53.
The link between chronic fatigue syndrome and gut microbiome (A Literature Review)
A.N. Useinova, D.O. Kovtunovich, E.Yu. Vetrova, M.V. Savshak, N.A. Izetova, U.R. Asanova, F.M. Mamutova,R.U. Ahtemov, D.V. Solomko, U.M. Seitmemetova, N.S. Ibragimov, L.A. Macukatova, P.A. Panova, N.V. Leonova,
S.Z. Tleuzheva, A.I. Voronko , S.O. Tjuhlov
V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky" (Kuryanov Vladimir Olegovich, rector of KFU), Department of Basic and Clinical Pharmacology, Simferopol, Russia
е-mail: denisevil@gmail.com
Abstract
Chronic fatigue syndrome/myalgic encephalomyelitis is a heterogeneous disease with multiple manifestations. The gut microbiome has received increasing attention in various refractory diseases, including chronic fatigue syndrome/myalgic encephalomyelitis. This study aims to advance our understanding of the relationship between the gut microbiome and chronic fatigue syndrome/myalgic encephalomyelitis through analysis of data from various clinical studies. We searched the literature in 4 databases: PubMed, Cochrane Library, Web of Science and Google Scholar up to May 31, 2023. Our analysis included 11 clinical studies involving 553 patients with chronic fatigue syndrome/myalgic encephalomyelitis and 480 healthy controls. Comparative metadata analysis revealed a significant reduction in α-diversity and a marked change in β-diversity in the gut microbiome of patients with chronic fatigue syndrome/myalgic encephalomyelitis compared with healthy controls. The ratio of Firmicutes to Bacteroides decreased by 2.3-fold, and there was also a significant reduction in the production of microbial metabolites such as acetate, butyrate, isobutyrate and some amino acids (alanine, serine and hypoxanthine) observed in patients with chronic fatigue syndrome/myalgic encephalomyelitis. This review provides a comprehensive analysis of recent advances in understanding the role of the gut microbiome in patients with chronic fatigue syndrome/myalgic encephalomyelitis. In addition, we also highlighted the potential of using several microbiome-related interventions to alleviate the symptoms of chronic fatigue syndrome/myalgic encephalomyelitis.
Key words: chronic fatigue syndrome, myalgic encephalomyelitis, intestinal microbiota, metabolites, disorder.
For citation: Useinova A.N., Kovtunovich D.O., Vetrova E.Yu., Savshak M.V., Izetova N.A., Asanova U.R., Mamutova F.M., Ahtemov R.U., Solomko D.V., Seitmemetova U.M., Ibragimov N.S., Macukatova L. A., Panova P.A., Leonova N.V., Tleuzheva S.Z., Voronko A.I., Tjuhlov S.O. The link between chronic fatigue syndrome and gut microbiome (A Literature Review). Psychiatry and psychopharmacotherapy. 2024; 4: 48–53. DOI: 10.62202/2075-1761-2024-26-4-48-53.
Введение
Миалгический энцефаломиелит/синдром хронической усталости (МЭ/СХУ) является репрезентативным гетерогенным заболеванием, распространенность которого составляет 0,89% во всем мире [1]. Лица с MЭ/CХУ страдают от необъяснимой сильной усталости, продолжающейся более 6 месяцев, с ключевыми симптомами сильного недомогания после физической нагрузки, непродолжительного сна, а также имеющихся когнитивных проблем [2].Данное заболевание могут вызывать вирусная инфекция, иммунная дисфункция, нейроэндокринный дисбаланс, генетическая предрасположенность, психологические факторы и многое другое [3]. Однако истинная причина патофизиологии MЭ/CХУ еще не установлена, что затрудняет понимание звеньев проявлений, установление диагноза и последующее лечение [4]. Недавние обширные исследования хронических метаболических заболеваний, психических расстройств и MЭ/CХУ выявили потенциальное участие аномального функционирования микробиома кишечника при этих расстройствах [5]. Исследователи попытались найти новые сведения о MЭ/CХУ через микробиом кишечника и его метаболиты [6]. В клинике значительное количество пациентов с МЭ/СХУ также испытывают синдром раздраженного кишечника, а более 70% пациентов с МЭ/СХУ сообщают о других различных желудочно-кишечных расстройствах, что указывает на потенциальную связь между измененным микробиомом кишечника и патофизиологией MЭ/CХУ [7].
Цель
Известно, что изменения в микробиоме кишечника влияют на функцию мозга через нарушение регуляции оси кишечник-мозг [8]. Дисбаланс микробиома связан с повышенной проницаемостью кишечника, что приводит к постепенному увеличению воспаления во многих системах органов, включая мозг [9]. Во многих исследованиях также сообщается о связи между дисбактериозом и депрессией [10]. Изменения в производных метаболитах и самом микробиоме кишечника могут способствовать развитию данного заболевания [11]. Тем не менее, многие важные вопросы остаются без ответа, в том числе, постоянно ли у пациентов с MЭ/CХУ наблюдаются изменения в микробиоме кишечника и связанных с ним метаболитах, и если да, то как эти изменения связаны с прогрессированием заболевания? Чтобы ответить на эти вопросы, мы провели комплексный анализ, основанный на недавних исследованиях, в которых сравнивались изменения в микробиоме и связанных с ним метаболитах у пациентов с MЭ/CХУ и здоровых людей из контрольной группы.Методы
Соответствующая литература была исследована в 4 базах данных биомедицинской литературы, включая PubMed, Cochrane, Web of Science и Google Scholar. Мы отобрали исследования со здоровыми контрольными группами на основе включения в них анализа, связанного с микробиомом кишечника и влияния на MЭ/CХУ. В выбранных статьях были представлены данные о различных параметрах, включая количество участников, средний возраст, расу/этническую принадлежность, метод определения микробиома, используемые инструменты, диагностические критерии MЭ/CХУ, оценку утомляемости, желудочно-кишечные осложнения, разнообразие α и β микробиома, микробные метаболиты и численность бактерий. Альфа-разнообразие – это множество разных видов в пределах биологического образца, что определяется индексами Чао 1, Шеннона, Симпсона. Бета-разнообразие – разнообразие видов между двумя биологическими образцами. Индекс Чао 1 – мера наблюдаемого/скрытого разнообразия; индекс Шеннона – мера разнообразия и плавности микробиома, где более высокий индекс соответствует большему разнообразию; индекс Симпсона - мера доминирования вида в образце [12].Оценка качества каждого исследования проводилась с использованием 6 видов инструментов, которые включают генерацию случайных последовательностей, сокрытие распределения, ослепление участников, ослепление оценки результатов, неполные данные о результатах, выборочную отчетность. Риск систематической ошибки для каждой области оценивался и классифицировался как «низкий», «неясный» или «высокий». В данном исследовании метаанализ был проведен с использованием статистического программного обеспечения RevMan 5.4 от Cochrane. Результаты выражали в виде стандартизированной разности средних с 95% доверительным интервалом. На основе оценки гетерогенности с использованием I2 мы применили модель случайных эффектов для случаев с гетерогенностью 50% и выше. Статистическую значимость определяли при значениях p менее 0,05.
Результаты
 В конечном итоге мы выбрали 11 клинических исследований, которые соответствовали критериям включения и исключения для данного обзора. Отобранные исследования были проведены в шести странах (63,6% в США) на 4 континентах и были опубликованы в течение последнего десятилетия. Данные исследования отражены в списке литературы.
В конечном итоге мы выбрали 11 клинических исследований, которые соответствовали критериям включения и исключения для данного обзора. Отобранные исследования были проведены в шести странах (63,6% в США) на 4 континентах и были опубликованы в течение последнего десятилетия. Данные исследования отражены в списке литературы.В общей сложности 1033 участника (23,4% мужчин и 76,6% женщин), в том числе 480 здоровых (46,5%) и 553 человека с MЭ/CХУ (53,5%) в 11 исследованиях из шести стран, средний возраст всех участников составил около 44,5 лет. Средний индекс массы тела у всех участников был ниже 25, при этом особых различий между здоровыми (контрольной группой, 24,5± 1,8) и больными (MЭ/CХУ (24,3± 2,2) соответственно не было. В отобранных исследованиях участники с MЭ/CХУ и здоровые контрольные группы в одинаковых возрастных диапазонах (больные: 45,0±6,7 лет и здоровые контрольные группы: 43,9±6,8 лет).
В 11 рассмотренных исследованиях использовались 3 варианта для постановки диагноза MЭ/CХУ: с использованием критериев Фукуды, исключительно с использованием Канадских консенсусных критериев и комбинация из этих критериев. Что касается желудочно-кишечных осложнений, у 58,3% пациентов с MЭ/CХУ наблюдалась желудочно-кишечная дисфункция, в отличие от 9,2% здоровых субъектов.
Во всех 11 отобранных исследованиях анализировался микробиом кишечника с использованием секвенирования следующего поколения (10 исследований) или метода анаэробного культивирования in vitro (1 исследование) в образцах кала. Однако только в 5 исследованиях был проведен сравнительный анализ метаболитов кишечных микроорганизмов в моче и сыворотке/плазме. Кроме того, в 8 из 11 отобранных исследований упоминалось, что испытуемые, принимавшие какие-либо антибиотики в течение предыдущих 2 или 4 недель, были исключены. Из 11 исследований в 7 сообщалось об α-разнообразии кишечного микробиома, в 3 – о значительном его снижении, в 4 исследованиях – об отсутствии существенных различий. Результат показал значительное снижение α-разнообразия кишечного микробиома (на 34%) у пациентов с МЭ/СХУ по сравнению со здоровыми контрольными группами (p<0,00001).
Среди 11 исследований в 6 исследованиях сообщалось о β-разнообразии микробиома кишечника. За исключением 1 исследования, которое не выявило заметных изменений в β-разнообразии кишечного микробиома (p>0,05), остальные 5 исследований постоянно указывали на значительные различия в общей структуре кишечного микробиома у пациентов с MЭ/CХУ по сравнению со здоровыми людьми из контрольной группы (p< 0,05, 0,01 или 0,001).
Во всех 11 исследованиях сравнивали таксономические изменения в микробиоме кишечника с использованием секвенирования 16s рРНК (6 исследований), метагеномного секвенирования всего генома (3 исследования), секвенирования 18s рРНК (1 исследование) и секвенирования анаэробной культуры (1 исследование).
Были обобщены изменения микробиома кишечника по трем уровням таксономической классификации из 10 исследований. На уровне А у пациентов с MЭ/CХУ наблюдалось значительное увеличение количества Bacteroidetes наряду с заметным снижением количества Firmicutes по сравнению со здоровой контрольной группой (p< 0,01). Интересно, что некоторые потенциально полезные роды, такие как Bifidobacterium, Roseburia и Faecalibacterium, заметно снижены у больных пациентов по сравнению со здоровыми людьми (p <0,05 или p<0,01). Количество Firmicutes заметно снижается, однако количество некоторых родов, принадлежащих к Firmicutes, таких как Phascolarctobacterium, Blautia, Coprobacillus, Oscillospira, Lactococus, Anaerotruncus, значительно увеличивается (p<0,05 или p<0,01).
Кроме того, 4 исследования показали значительное увеличение количества некоторых условно-патогенных видов бактерий среди пациентов с МЭ/СХУ, включая Erysipelatoclostridium ramosum, Enterocloster citroniae, Hungatella hathewayi, Eggerthella lenta и т. д. И наоборот, количество некоторых молочнокислых бактерий и других полезных видов заметно уменьшилось при МЭ/СХУ, а именно Faecalibacterium prausnitzii, Bifidobacterium angulatum, Lactobacillus ruminis, Roseburia intestinalis и т.д.
Всего в 5 исследованиях сообщалось о различиях в метаболитах между пациентами MЭ/CХУ и здоровыми людьми из контрольной группы при оценке кала (4 исследования), сыворотки/плазмы (3 исследования) и мочи (1 исследование). Содержание как короткоцепочечных жирных кислот (КЦЖК, таких как бутират, ацетат), так и разветвленных КЦЖК (изобутират), было значительно снижено в кале, крови и моче пациентов с MЭ/CХУ. Наблюдались заметные различия в метаболитах, относящихся к аминокислотам и липидным молекулам, на которые прямо или косвенно влияет микробиом кишечника. Также у пациентов с MЭ/CХУ по сравнению со здоровыми людьми из контрольной группы наблюдалось значительное снижение сывороточного альфа-токоферола (витамин E, p<0,05) – витамина-антиоксиданта, который может метаболизироваться некоторыми кишечными микробами.
Обсуждение
 В последнее время все больше исследований подчеркивает важность микробиома кишечника при различных клинических состояниях, включая синдром раздраженного кишечника и психические расстройства [13]. Стоит отметить, что типичные симптомы MЭ/CХУ, такие как расстройства пищеварения, депрессия и когнитивные проблемы, также считаются тесно связанными с дисбактериозом кишечного микробиома [14]. Чтобы осветить звенья патогенеза MЭ/CХУ, мы всесторонне проанализировали последние клинические данные, касающиеся микробиома и связанных с ним метаболитов.
В последнее время все больше исследований подчеркивает важность микробиома кишечника при различных клинических состояниях, включая синдром раздраженного кишечника и психические расстройства [13]. Стоит отметить, что типичные симптомы MЭ/CХУ, такие как расстройства пищеварения, депрессия и когнитивные проблемы, также считаются тесно связанными с дисбактериозом кишечного микробиома [14]. Чтобы осветить звенья патогенеза MЭ/CХУ, мы всесторонне проанализировали последние клинические данные, касающиеся микробиома и связанных с ним метаболитов.В конечном итоге были отобраны 11 исследований, которые соответствовали нашим критериям, включающих 553 человека с MЭ/CХУ и 480 здоровых людей из контрольной группы. При анализе микробиома обычно используются сравнения α-разнообразия и β-разнообразия [15]. В 6 исследованиях (436 пациентов с MЭ/CХУ и 370 здоровых людей из контрольной группы) мы наблюдали значительное снижение альфа-разнообразия кишечного микробиома у больных по сравнению со здоровой контрольной группой. Хоть это и не является окончательным мнением, но многие ученые предполагают, что здоровый человек обычно содержит примерно от 500 до 1000 различных видов бактерий в кишечнике [16]. Наши данные отразили снижение примерно на 34% количество видов кишечного микробиома у пациентов с MЭ/CХУ по сравнению со здоровыми людьми из контрольной группы (p< 0,00001). В целом, у здоровых людей в кишечнике обитает большее разнообразие различных представителей микробиома, и это разнообразие вносит значительный вклад в общее состояние здоровья человека [17]. Примечательно, что снижение α-разнообразия обычно наблюдается не только при МЭ/СХУ, но и при многих других патологических состояниях и заболеваниях, таких как ожирение, диабет, воспалительные заболевания кишечника и психические расстройства [18]. Также при старении происходят аналогичные изменения в микробиоме кишечника [19].
В отличие от α-разнообразия, β-разнообразие указывает на степень различия в составе видов кишечных микробов между двумя группами [20]. Когда мы проанализировали β-разнообразие в 6 исследованиях, за исключением 1 исследования без существенной разницы (p>0,05), 5 исследований подтвердили заметное различие в структуре микробиома кишечника между больными и здоровыми людьми (p<0,05, 0,01). Как и в α-разнообразии, различие микробных сообществ β-разнообразия наблюдается не только при MЭ/CХУ, а также при вышеупомянутых заболеваниях [21]. Однако необходимы дальнейшие исследования, чтобы в будущем напрямую сравнить β-разнообразие микробиома кишечника между больными с MЭ/CХУ и другими подобными заболеваниями, такими как фибромиалгия, постковидный синдром и аутоиммунные заболевания.
Существенные изменения в составе микробиома кишечника могут повлиять на метаболизм человека в целом, что, как следствие, приведет к ряду изменений в кишечных метаболитах [22]. 1 исследование показало, что чем дольше человек был болен, тем больше становились изменения в кишечных метаболитах. Заметные изменения были обнаружены в 11 метаболитах в кале, 10 в сыворотке/плазме и 7 в моче. Среди этих изменений самое значительное снижение было в уровне бутирата у пациентов с MЭ/CХУ. Это связано с общим снижением количества бактерий, которые его продуцируют [23]. Также у пациентов с МЭ/СХУ наблюдалось заметное снижение содержания других метаболитов, продуцируемых бактериями, которые служат источниками энергии (таких как ацетат и изовалерат) и проявляют противомикробные свойства (такие как лактат и бензоат) [24]. Было продемонстрировано, что сфинголипиды, полученные из кишечного микробиома, изменяют метаболизм липидов хозяина [25]. В частности, Bacteroides spp. с геном серинпальмитоилтрансферазы обладают способностью продуцировать сфинголипиды. Это может объяснить повышенный уровень липидов в сыворотке и высокий уровень Bacteroidetes, которые были обнаружены у длительно болеющих пациентов.
Многочисленные исследования выявили потенциальную роль витамина Е в улучшении психического здоровья, особенно когнитивных функций [26]. Некоторые кишечные микробы, такие как Bacteroides и Clostridium, обладают потенциальной способностью метаболизировать витамин Е в кишечном тракте [27]. Следовательно, мы предполагаем, что когнитивные нарушения, наблюдаемые у пациентов с MЭ/CХУ, могут быть связаны со специфическими изменениями в микробиоме кишечника и значительным снижением уровня витамина Е.
Триптофан, служащий предшественником серотонина, может видоизменяться определенными бактериями, что приводит к влиянию на уровни серотонина и функцию мозга и даже на патофизиологию MЭ/CХУ [28]. К сожалению, ни в одном из 11 исследований, включенных в текущий обзор, не проводился анализ метаболитов триптофана. Анализ исследований показал, что пациенты с тяжелым MЭ/CХУ имеют избыточное количество антител против флагеллинов, особенно в виде патоген-ассоциированного молекулярного паттерна из Lachnospiraceae, по сравнению со здоровыми людьми из контрольной группы. Эти данные позволяют предположить, что микробиом может быть непосредственно вовлечен в патогенез MЭ/CХУ.
Что касается терапевтического аспекта, клиническое исследование продемонстрировало эффективность введения пробиотиков (штамм Lactobacillus Casei Shirota и Bifidobacterium infantis) в снижении тревожности и воспалительных биомаркеров у пациентов с MЭ/CХУ [29]. Все большее число клиницистов полагают, что управление микробиомом кишечника посредством трансплантации фекального микробиома может быть эффективным терапевтическим средством для лечения некоторых заболеваний, включая MЭ/CХУ [30]. Следовательно, применение трансплантации на моделях животных, которым до этого вводились антибиотики, можно считать перспективным подходом для дальнейшего изучения этиологии и патогенеза MЭ/CХУ.
Если говорить о распространенности данного заболевания среди женщин, текущее исследование показало, что 83% участников с данным диагнозом – женщины [31]. Различия в микробиоме кишечника были обнаружены между полами из-за генетических факторов, гормональных влияний и физиологических различий [32]. Ограничением в данном обзоре является то, что ни в одном из исследований не анализировались различия микробиома кишечника с учетом пола. Кроме того, микробиом кишечника включает не только бактерии, а также грибы, вирусы, простейшие и т. д. Однако текущий обзор фокусируется только на бактериях из-за очень небольшого количества исследований, в которых изучались другие представители, помимо бактерий.
Заключение
В заключение, наши результаты подтверждают значительное сокращение видов кишечного микробиома (α-разнообразия и β-разнообразия) среди пациентов с MЭ/CХУ по сравнению со здоровыми людьми. Хотя наблюдаемые изменения в кишечном микробиоме и связанных с ним метаболитах, особенно в витамине Е и короткоцепочечных жирных кислотах, частично идентифицированы, точные механизмы, связывающие MЭ/CХУ и кишечный микробиом, до сих пор остаются неясными. Таким образом, необходимы дальнейшие исследования для подтверждения причинно-следственной связи изменения кишечного микробиома при MЭ/CХУ. Эти исследования дадут ценную информацию об этиологии, механизме, диагностике, лечении, профилактике и прогнозе данного заболевания.Конфликт интересов.
Авторы заявляют, что данная работа, её тема, предмет и содержание не затрагивают конкурирующих интересов.
Сведения об авторах:
Асие Наримановна Усеинова – кандидат медицинских наук, доцент кафедры базисной и клинической фармакологии ОТКЗ медицинского института им. С. И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского», 295051, Российская Федерация, Республика Крым, г.Симферополь, бул. Ленина 5/7; Тел. +79788221819; E-mail: mametova.as@mail.ru; ORCID: 0000-0003-0725-5455; SPIN-код: 9031-2079ю
Денис Олегович Ковтунович, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788155732, denisevil628@gmail.com, https://orcid.org/0009-0003-6677-0251
Екатерина Юрьевна Ветрова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785648554, kkunicina@rambler.ru, https://orcid.org/0009-0004-4519-8134
Марк Валерьевич Савшак, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785066842,
marsasramarsasram@gmail.com, https://orcid.org/0009-0004-4324-1960
Нилюфер Азизовна Изетова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788482910, izetova.n2001@gmail.com, https://orcid.org/0009-0008-1884-1488
Ульвие Раимовна Асанова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785140598, ulvie-asanova@mail.ru, https://orcid. org/0009-0005-9635-2506
Фатма Мусаевна Мамутова, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785130303, mamut398@mail.ru, https://orcid.org/0009-0000-2019-6504
Ремзи Усеинович Ахтемов, студент 6 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79785043664, rema654888@icloud.com, https://orcid.org/my-orcid?orcid=0009-0002-2590-5490
Дарья Владимировна Соломко, студент 5 курса 1-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79129166197, DSolomko2002@gmail.com, https://orcid.org/0009-0001-7328-680X
Усние Марленовна Сеитмеметова, студент 5 курса 2-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79787618450, seitmemetova2002@mail.ru, https://orcid.org/0009-0005-7957-9004
Нафе Сулаймон оглу Ибрагимов, студент 4 курса 2-го медицинского факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79780153417, Nafeibragimov@gmail.com, https://orcid.org/0009-0006-3054-983X
Любовь Александровна Мацукатова, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788329505, Lubov_alex@icloud.com, https://orcid.org/0009- 0009-8905-7778
Полина Антоновна Панова, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79787691504, panova-polina@list.ru, https://orcid.org/0009-0009-2155-8701
Наталия Валериевна Леонова, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788058454, Leonova.yalta@yandex.ru, https://orcid.org/0009-0006-0259-3024
Сталина Заурбековна Тлеужева, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79782402638, tleuzheva.s@bk.ru, https://orcid.org/0009-0007-5300-6106
Антон Игоревич Воронко, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79787866172, voronko473@gmail.com, https://orcid.org/0009-0000-1362-7580
Сергей Олегович Тюхлов, студент 5 курса стоматологического факультета, Институт «Медицинская академия имени С. И. Георгиевского», ФГАОУ ВО «Крымский федеральный университет имени В. И. Вернадского», кафедра базисной и клинической фармакологии, бульвар Ленина, 5/7, Симферополь, Россия, 295051, +79788160915, Tuhlovsergey@gmail.com, https://orcid.org/0009-0003-6911-732X
Information about author:
Asie Narimanovna Useinova – Candidate of Medical Sciences, Associate Professor of the Department of Basic and Clinical Pharmacology of the S. I. Georgievsky OTKZ Medical Institute, V.I. Vernadsky KFU, 295051, Russian Federation, Republic of Crimea, Simferopol, blvd. Lenin 5/7; Tel. +79788221819; E-mail: mametova.as@mail.ru ; ORCID: 0000-0003-0725-5455; SPIN code: 9031-2079y
Denis Olegovich Kovtunovich, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788155732, denisevil628@gmail.com, https://orcid.org/0009-0003-6677-0251;
Ekaterina Yurievna Vetrova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785648554, kkunicina@rambler.ru, https://orcid.org/0009-0004-4519-8134;
Mark Valer'evich Savshak, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785066842, marsasramarsasram@gmail.com, https://orcid. org/0009-0004-4324-1960;
Niljufer Azizovna Izetova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788482910, izetova.n2001@gmail.com, https://orcid.org/ 0009-0008-1884-1488
Ul'vie Raimovna Asanova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785140598, ulvie-asanova@mail.ru, https://orcid.org/0009-0005-9635-2506
Fatma Musaevna Mamutova, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79785130303, mamut398@mail.ru, https://orcid.org/0009-0000-2019-6504;
Remzi Useinovich Ahtemov, 6th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051+79785043664, rema654888@icloud.com, https://orcid.org/my-orcid?orcid=0009-0002-2590-5490;
Dar'ja Vladimirovna Solomko, 5th year student of the 1st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79129166197, DSolomko2002@gmail.com, https://orcid. org/0009-0001-7328-680X;
Usnie Marlenovna Seitmemetova, 5th year student of the 2st Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79787618450, seitmemetova2002@mail.ru, https://orcid. org/0009-0005-7957-9004;
Nafe Sulajmon oglu Ibragimov, 4th year student of the 2nd Faculty of Medicine, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79780153417, Nafeibragimov@gmail.com, https://orcid. org/0009-0006-3054-983X;
Ljubov' Aleksandrovna Macukatova, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788329505, Lubov_alex@icloud.com, https://orcid. org/0009- 0009-8905-7778;
Polina Antonovna Panova, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79787691504, panova-polina@list.ru, https://orcid.org/0009-0009-2155-8701;
Natalija Valerievna Leonova, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788058454, Leonova.yalta@yandex.ru, https://orcid.org/0009-0006-0259-3024;
Stalina Zaurbekovna Tleuzheva, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79782402638, tleuzheva.s@bk.ru, https://orcid.org/0009-0007-5300-6106;
Anton Igorevich Voronko, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79787866172, voronko473@gmail.com, https://orcid.org/0009-0000-1362-7580;
Sergej Olegovich Tjuhlov, 5th year student of the Faculty of Dentistry, V.I. Vernadsky Crimean Federal University, Institute "Medical Academy named after S.I. Georgievsky", Department of Basic and Clinical Pharmacology, Simferopol, Russia, 295051, +79788160915, Tuhlovsergey@gmail.com, https://orcid.org/0009-0003-6911-732X.
Дата поступления: 10.04.2024
Received: 10.04.2024
Принята к печати: 25.07.2024
Accepted: 25.07.2024
Список исп. литературыСкрыть список1. Lim EJ, Ahn YC, Jang ES, Lee SW, Lee SH, Son CG. Systematic review and meta-analysis of the prevalence of chronic fatigue syndrome/myalgic encephalomyelitis (CFS/ME) J Transl Med. 2020;18:100. doi: 10.1186/s12967-020-02269-0.
2. Lim EJ, Son CG. Review of case definitions for myalgic encephalomyelitis/ chronic fatigue syndrome (ME/CFS) J Transl Med. 2020;18:289. doi: 10.1186/s12967-020-02455-0.
3. Wirth KJ, Löhn M. Myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS) and comorbidities: linked by vascular pathomechanisms and vasoactive mediators? Medicina. 2023 doi: 10.3390/medicina59050978.
4. Grach SL, Seltzer J, Chon TY, Ganesh R. Diagnosis and management of myalgic encephalomyelitis/chronic fatigue syndrome. Mayo Clin Proc. 2023;98:1544–1551.
5. Lim D-W, Wang J-H. Gut microbiome: the interplay of an “invisible organ” with herbal medicine and its derived compounds in chronic metabolic disorders. In Int J Environ Res Publ Health. 2022 doi: 10.3390/ ijerph192013076.
6. Xiong R, Gunter C, Fleming E, Vernon SD, Bateman L, Unutmaz D, Oh J. Multi-'omics of gut microbiome-host interactions in short- and long-term myalgic encephalomyelitis/chronic fatigue syndrome patients. Cell Host Microbe. 2023;31(273–287):e275.
7. Chu L, Valencia IJ, Garvert DW, Montoya JG. Onset patterns and course of myalgic encephalomyelitis/chronic fatigue syndrome. Front Pediatr. 2019;7:12. doi: 10.3389/fped.2019.00012.
8. Maiuolo J, Gliozzi M, Musolino V, Carresi C, Scarano F, Nucera S, Scicchitano M, Oppedisano F, Bosco F, Ruga S, et al. The contribution of gut microbiota-brain axis in the development of brain disorders. Front Neurosci. 2021 doi: 10.3389/fnins.2021.616883.
9. Mou Y, Du Y, Zhou L, Yue J, Hu X, Liu Y, Chen S, Lin X, Zhang G, Xiao H, et al. Gut microbiota interact with the brain through systemic chronic inflammation: implications on neuroinflammation, neurodegeneration, and aging. Front Immunol. 2022 doi: 10.3389/fimmu.2022.796288.
10. Liu L, Wang H, Chen X, Zhang Y, Zhang H, Xie P. Gut microbiota and its metabolites in depression: from pathogenesis to treatment. EBioMedicine. 2023;90:104527. doi: 10.1016/j.ebiom.2023.104527.
11. Guo C, Che X, Briese T, Ranjan A, Allicock O, Yates RA, Cheng A, March D, Hornig M, Komaroff AL, et al. Deficient butyrate-producing capacity in the gut microbiome is associated with bacterial network disturbances and fatigue symptoms in ME/CFS. Cell Host Microbe. 2023;31:288–304.e288. doi: 10.1016/j.chom.2023.01.004.
12. Morgan X.C., Segata N., Huttenhower C. Biodiversity and functional genomics in the human microbiome // Trends Genet. 2013. Vol. 29, N 1. P. 51-58.
13. Andrioaie IM, Duhaniuc A, Nastase EV, Iancu LS, Luncă C, Trofin F, Anton-Păduraru DT, Dorneanu OS. The role of the gut microbiome in psychiatric disorders. Microorganisms. 2022 doi: 10.3390/microorganisms10122436.
14. Shan Y, Lee M, Chang EB. The gut microbiome and inflammatory bowel diseases. Annu Rev Med. 2022;73:455–468. doi: 10.1146/annurev-med-042320-021020.
15. Kers JG, Saccenti E. The power of microbiome studies: some considerations on which alpha and beta metrics to use and how to report results. Front Microbiol. 2022 doi: 10.3389/fmicb.2021.796025.
16. Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. Current understanding of the human microbiome. Nat Med. 2018;24:392–400. doi: 10.1038/nm.4517.
17. Manor O, Dai CL, Kornilov SA, Smith B, Price ND, Lovejoy JC, Gibbons SM, Magis AT. Health and disease markers correlate with gut microbiome composition across thousands of people. Nat Commun. 2020;11:5206. doi: 10.1038/s41467-020-18871-1.
18. Li Z, Zhou J, Liang H, Ye L, Lan L, Lu F, Wang Q, Lei T, Yang X, Cui P, et al. Differences in alpha diversity of gut microbiota in neurological diseases. Front Neurosci. 2022 doi: 10.3389/fnins.2022.879318.
19. Leite G, Pimentel M, Barlow GM, Chang C, Hosseini A, Wang J, Parodi G, Sedighi R, Rezaie A, Mathur R. Age and the aging process significantly alter the small bowel microbiome. Cell Rep. 2021;36:109765. doi: 10.1016/j.celrep.2021.109765.
20. Su X. Elucidating the beta-diversity of the microbiome: from global alignment to local alignment. mSystems. 2021 doi: 10.1128/msystems.00363-00321.
21. Teofani A, Marafini I, Laudisi F, Pietrucci D, Salvatori S, Unida V, Biocca S, Monteleone G, Desideri A. intestinal taxa abundance and diversity in inflammatory bowel disease patients: an analysis including covariates and confounders. Nutrients. 2022 doi: 10.3390/nu14020260.
22. Visconti A, Le Roy CI, Rosa F, Rossi N, Martin TC, Mohney RP, Li W, de Rinaldis E, Bell JT, Venter JC, et al. Interplay between the human gut microbiome and host metabolism. Nat Commun. 2019;10:4505. doi: 10.1038/s41467-019-12476-z.
23. Lupo GFD, Rocchetti G, Lucini L, Lorusso L, Manara E, Bertelli M, Puglisi E, Capelli E. Potential role of microbiome in chronic fatigue syndrome/myalgic encephalomyelits (CFS/ME) Sci Rep. 2021;11:7043. doi: 10.1038/s41598-021-86425-6.
24. Armstrong CW, McGregor NR, Lewis DP, Butt HL, Gooley PR. The association of fecal microbiota and fecal, blood serum and urine metabolites in myalgic encephalomyelitis/chronic fatigue syndrome. Metabolomics. 2016;13:8. doi: 10.1007/s11306-016-1145-z.
25. Johnson EL, Heaver SL, Waters JL, Kim BI, Bretin A, Goodman AL, Gewirtz AT, Worgall TS, Ley RE. Sphingolipids produced by gut bacteria enter host metabolic pathways impacting ceramide levels. Nat Commun. 2020;11:2471. doi: 10.1038/s41467-020-16274-w.
26. Huang AA, Huang SY. Quantification of the effect of vitamin e intake on depressive symptoms in united states adults using restricted cubic splines. Current Develop Nutr. 2023;7:100038. doi: 10.1016/j.cdnut.2023.100038.
27. Gothandapani D, Makpol S. Effects of vitamin E on the gut microbiome in ageing and its relationship with age-related diseases: a review of the current literature. In Int J Mol Sci. 2023 doi: 10.3390/ijms241914667.
28. Lee JS, Kang JY, Park SY, Hwang SJ, Bae SJ, Son CG. Central 5-HTergic hyperactivity induces myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS)-like pathophysiology. J Transl Med. 2024;22:34. doi: 10.1186/s12967-023-04808-x.
29. Roman P, Carrillo-Trabalon F, Sanchez-Labraca N, Canadas F, Estevez AF, Cardona D. Are probiotic treatments useful on fibromyalgia syndrome or chronic fatigue syndrome patients? Syst Rev Benef Microbes. 2018;9:603–611. doi: 10.3920/BM2017.0125.
30. Ser HL, Letchumanan V, Goh BH, Wong SH, Lee LH. The Use of fecal microbiome transplant in treating human diseases: too early for poop? Front Microbiol. 2021;12:519836. doi: 10.3389/fmicb.2021.519836.
31. Lacerda EM, Geraghty K, Kingdon CC, Palla L, Nacul L. A logistic regression analysis of risk factors in ME/CFS pathogenesis. BMC Neurol. 2019;19:275. doi: 10.1186/s12883-019-1468-2.
32. Fransen F, van Beek AA, Borghuis T, Meijer B, Hugenholtz F, van der Gaast-de Jongh C, Savelkoul HF, de Jonge MI, Faas MM, Boekschoten MV, et al. The impact of gut microbiota on gender-specific differences in immunity. Front Immunol. 2017;8:754. doi: 10.3389/fimmu.2017.00754

