Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2012
Эффективность применения Вальдоксана в восстановительном периоде инфаркта миокарда у пациентов с сахарным диабетом типа 2 и тревожно-депрессивными расстройствами №06 2012
Номера страниц в выпуске:8-13
В результате проведенного исследования было установлено, что назначение Вальдоксана 25 мг/сут в восстановительном периоде инфаркта миокарда у больных сахарным диабетом типа 2 с автономной кардиальной нейропатией эффективно устраняет аффективные расстройства, уменьшает выраженность психологического стресса. На фоне комбинированной терапии с включением Вальдоксана у пациентов достоверно снизилась частота приступов стенокардии, увеличилась толерантность к физическим нагрузкам, уменьшились проявления вегетативной дисфункции, улучшились показатели вариабельности ритма сердца.
Резюме. В результате проведенного исследования было установлено, что назначение Вальдоксана 25 мг/сут в восстановительном периоде инфаркта миокарда у больных сахарным диабетом типа 2 с автономной кардиальной нейропатией эффективно устраняет аффективные расстройства, уменьшает выраженность психологического стресса. На фоне комбинированной терапии с включением Вальдоксана у пациентов достоверно снизилась частота приступов стенокардии, увеличилась толерантность к физическим нагрузкам, уменьшились проявления вегетативной дисфункции, улучшились показатели вариабельности ритма сердца.
Ключевые слова: Вальдоксан, аффективные расстройства, сахарный диабет типа 2, автономная кардиальная нейропатия, восстановительный период инфаркта миокарда, вариабельность ритма сердца.
The efficiency of Valdoxan use in the rehabilitation period after myocardial infarction
in patients with type 2 diabetes mellitus and anxiety-depressive disorders
M.E.Statsenko, N.N.Shilina, S.V.Turkina
Volgograd State Medical University, Ministry of Health of the Russian Federation
Summary. The performed investigation has established that the use of Valdoxan 25 mg/day in the rehabilitation period after myocardial infarction in type 2 diabetes mellitus patients with cardiac autonomic neuropathy eliminates affective disorders effectively and reduces the magnitude of psychological stress. The frequency of angina attacks was significantly decreased, exercise tolerance increased, the manifestations of autonomic dysfunction reduced, and heart rhythm variability improved in the patients receiving combination therapy comprising Valdoxan.
Key words: Valdoxane, affective disorders, type 2 diabetes mellitus, cardiac autonomic neuropathy, rehabilitation period after myocardial infarction, heart rhythm variability.
Заболеваемость ишемической болезнью сердца (ИБС), инфарктом миокарда (ИМ) у больных сахарным диабетом (СД) типа 2 намного выше, чем у лиц без СД [16, 17]. Основной причиной смерти больных СД типа 2 почти в 50% случаев является ИМ [18].
Негативное влияние СД не только на развитие ИБС, но и на течение и прогноз заболевания отмечено во многих исследованиях [8, 25, 26]. Автономная кардиальная нейропатия (АКН) у больных СД имеет патогенетическое значение в удлинении интервала Q–T и селективном уменьшении вагальной чувствительности (повышение симпатической активности). Эти два фактора могут обусловить развитие смертельных аритмий [25, 26]. Смертность у больных диабетической АКН в течение 5 лет составляет около 50%, а ее причинами чаще всего являются внезапная остановка сердца, нарушения ритма и апноэ во сне. У пациентов с диабетической АКН наблюдается также нарушение адаптации к физическим нагрузкам [19].
В последние годы накапливается все больше доказательств того, что независимыми факторами риска ИБС являются также депрессия и другие психологические факторы [10, 11, 20]. Больные c депрессией имеют повышенный риск коронарной смерти [6]. В основе негативного влияния аффективных расстройств на сердечно-сосудистую систему лежит активация симпатико-адреналовой системы, изменение активности серотонинергических процессов, увеличение секреции кортизола, повышение агрегации тромбоцитов и нарушение баланса симпатического и парасимпатического звеньев вегетативной нервной системы (ВНС), выражающиеся, в частности, в снижении вариабельности ритма сердца (ВРС) у таких пациентов [3]. В недавно законченных исследованиях у больных с депрессиями было выявлено снижение ВРС [30, 31, 33, 37, 39, 42, 44–46]. Это имеет важное прогностическое значение, так как низкая ВРС является мощным предиктором внезапной сердечной смерти [34–36, 38, 43, 47]. Снижение основных показателей ВРС у постинфарктных больных с сопутствующим депрессивным расстройством по сравнению с пациентами без депрессии может объяснить вероятный механизм взаимосвязи депрессии и роста сердечно-сосудистой смертности в восстановительном периоде ИМ [21, 32].
Представленные данные, свидетельствующие об ухудшении прогноза заболевания, диктуют необходимость своевременного распознавания и лечения депрессии в восстановительном периоде ИМ у пациентов с СД типа 2. Ранее было установлено, что назначение Вальдоксана (SERVIER, Франция) дополнительно к базисной терапии ИМ купирует проявления депрессии и тревоги, нормализует сон, достоверно улучшает клиническое состояние и структурно-функциональное состояние сердца в постинфарктном периоде у больных СД типа 2 [24].
Вальдоксан (агомелатин) является мощным лигандом мелатониновых рецепторов со свойством агониста к МТ1- и МТ2-мелатониновым рецепторам, что определяет инновационный механизм действия препарата, который реализуется путем ресинхронизации нарушенных циркадианных ритмов. Вальдоксан является также антагонистом
5НТ2С-серотониновых рецепторов [29, 41]. При этом отсутствует значимый аффинитет к другим центральным рецепторам или переносчикам моноаминов и отсутствуют другие механизмы, влияющие на уровни серотонина в синаптической щели [40]. Благодаря синергизму действия на МТ1-, МТ2- и 5НТ2С-рецепторы Вальдоксан обладает не только выраженным антидепрессивным эффектом, редуцируя колебания гипотимии в течение суток, но и способностью быстро восстанавливать нормальный сон, а также дневную активность и работоспособность.
Однако в литературе мы не встретили работ, в которых было бы всесторонне изучено влияние Вальдоксана как на проявления аффективных расстройств, так и на симптомы вегетативной дисфункции, ВРС в восстановительном периоде ИМ у больных СД типа 2.
Цель исследования – изучить влияние терапии Вальдоксаном на выраженность депрессии, тревоги, стресса, вегетативные нарушения и клинические особенности течения восстановительного периода ИМ у больных СД типа 2.
Материалы и методы
Больные с установленным диагнозом ИМ, СД типа 2 и признаками аффективных расстройств отобраны в соответствии с критериями включения и исключения. На проведение исследования было получено разрешение регионального этического комитета.
Критерии включения: больные СД типа 2 с признаками тревожно-депрессивных расстройств на 3–4-й неделе после перенесенного ИМ. У всех пациентов ИМ осложнился наличием хронической сердечной недостаточности (ХСН) II–III функционального класса (ФК) согласно классификации Общества специалистов по сердечной недостаточности (ОССН). У всех больных была диагностирована диабетическая АКН [27]. Пациенты были рандомизированы на 2 группы (по 30 человек). Группы больных достоверно не различались по полу, возрасту, тяжести перенесенного ИМ, наличию гипертонической болезни (ГБ), основным показателям гемодинамики и углеводного обмена.
Критерии исключения: тяжелые, декомпенсированные или нестабильные сопутствующие соматические заболевания и состояния, которые непосредственно угрожают жизни больного; острые психические состояния; органическое психическое расстройство (деменция или эпилепсия); эндогенные психические заболевания; злоупотребление алкоголем; одновременный или менее чем за 14 дней прием лекарственных средств, обладающих снотворным эффектом; индивидуальная непереносимость Вальдоксана.
1-я группа – основная (n=30) – пациенты, которым в дополнение к базисной терапии восстановительного периода ИМ (b-адреноблокатор – бисопролол, ингибитор ангиотензинпревращающего фермента – эналаприл, антиагреганты – ацетилсалициловая кислота и клопидогрел, статин – симвастатин, при необходимости диуретики и нитраты) и пероральной гипогликемической терапии СД типа 2 (гликлазид МВ + метформин) назначался Вальдоксан 1-кратно на ночь в дозе 25 мг в течение 12 нед.
2-я группа – контрольная (n=30) – пациенты, которые получали только базисную терапию в течение 12 нед. Для коррекции аффективных расстройств применялось немедикаментозное воздействие (аутотренинг, психотерапия).
Средние дозировки препаратов базисной терапии ИМ в 2 группах больных с ХСН и СД типа 2 достоверно не различались.
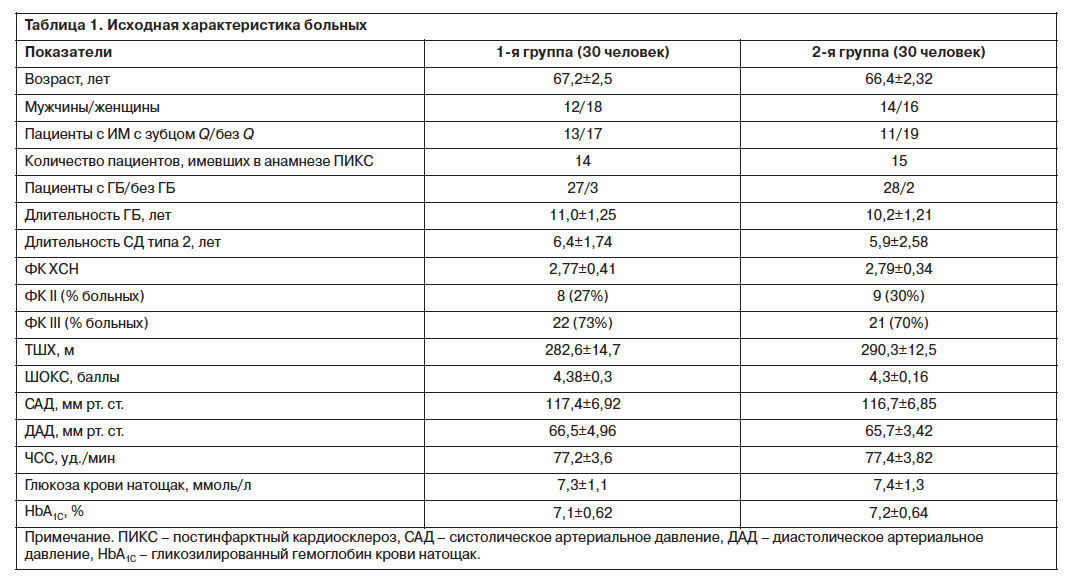
Исходная характеристика групп больных представлена в табл. 1.
Наблюдение за пациентами, а также оценка безопасности проводимой терапии осуществлялись на протяжении 3 мес. Предусматривалось сравнение динамики изучаемых параметров исходно, на контрольных визитах через 4 и 12 нед исследования.
Объективные данные о состоянии пациентов были получены при физикальном исследовании, с помощью эхокардиографии [28] на аппарате SIEMENS SONOLINE G50 (Германия) с допплеровским датчиком и электрокардиографии (ЭКГ), а также с помощью шкалы оценки клинического состояния (ШОКС) больного с ХСН (модификация В.Ю.Мареева, 2000 г.) [4], ФК ХСН устанавливался согласно классификации ОССН и теста 6-минутной ходьбы (ТШХ) [22], также проводилось измерение частоты сердечных сокращений (ЧСС) и уровня артериального давления (АД) [9].
Для оценки психоэмоционального состояния изучались жалобы больных, а также использовались специфические опросники и шкалы: госпитальная шкала тревоги и депрессии (HADS) и опросник депрессии Бека (Beck Depression Inventory, BDI) [1]. Уровень стресса оценивали по результатам шкалы психологического стресса Ридера [7, 13].
Для определения состояния ВНС у пациентов оценивался исходный вегетативный тонус с помощью опросника для выявления признаков вегетативных изменений [5], проводился расчет вегетативного индекса Кердо [5], а вегетативную реактивность определяли с помощью пробы, предложенной Р.М.Баевским [2].
Параметры ВРС определялись на коротких участках записи ЭКГ в течение 5 мин с использованием аппаратно-программного комплекса ВАРИКАРД-1,41 (Россия). Учитывались следующие показатели ВРС: MxDMn – разность между максимальным и минимальным значением интервала R–R, SDNN – среднеквадратичное отклонение, CV – коэффициент вариации, SI – индекс напряжения, TR – суммарная мощность спектра, HF – высокочастотная составляющая, LF – низкочастотная составляющая (медленные волны), VLF – очень низкочастотные колебания (медленные волны 2 и 3-го порядка), IC – индекс централизации [2, 15].
Для оценки вегетативной реактивности обоих отделов ВНС проводили пробу, предложенную Р.М.Баевским [2]. Исходный вегетативный тонус (ваготония, нормотония, симпатикотония, гиперсимпатикотония) анализировали по фоновой пробе в положении лежа путем расчета индекса напряжения (ИН). Вегетативную реактивность оценивали с помощью отношения показателя ИН во время ортопробы к фоновому ИН с учетом значения фонового ИН. При этом выделяли нормальную, гиперсимпатикотоническую и асимпатикотоническую вегетативную реактивность [2].
Для оценки безопасности проводимой терапии были использованы: анкета для скрининга синдрома апноэ во сне, расчет продолжительности основных кардиоинтервалов – P–Q, QRS, Q–T (по данным ЭКГ), данные клинических, лабораторных параметров, а также регистрировали нежелательные эффекты терапии.
При возникновении нежелательных лекарственных явлений пациент имел возможность нанести незапланированный визит к врачу для решения вопроса о дальнейшем продолжении терапии, поддерживалась постоянная телефонная связь с пациентами. Во время визитов на 4 и 12-й неделе наблюдения проводилась оценка нежелательных лекарственных явлений исследователем.
Обработку результатов исследования проводили методами параметрической и непараметрической статистики. Использовали встроенный пакет статистического анализа Microsoft Excel для Windows XP 2002. Для оценки достоверности полученных результатов применяли t-критерий Стьюдента, критерий знаков, а для вычисления значимости различий процентных долей – метод углового преобразования Фишера. Статистически значимые изменения определяли при p<0,05.
Результаты и обсуждение
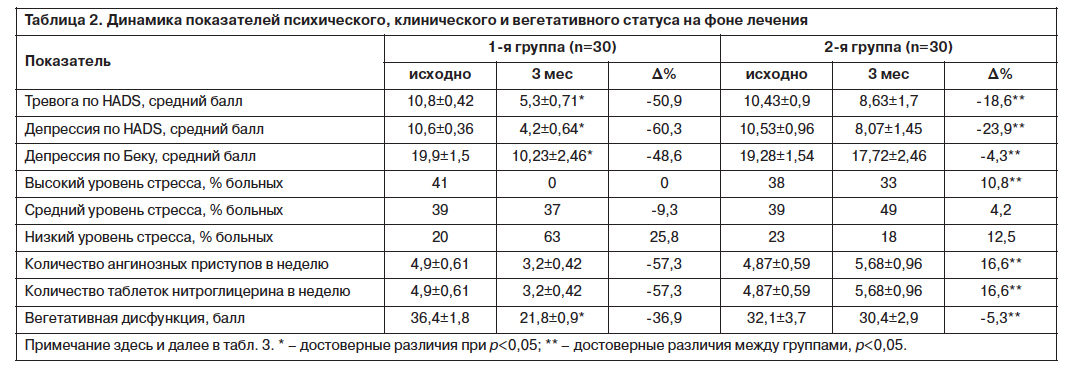
В конце 3-месячной терапии Вальдоксаном в дозировке 25 мг/сут у больных 1-й группы в отличие от пациентов 2-й группы наблюдалась редукция тревоги и депрессии, уменьшился уровень психологического стресса (табл. 2). Ранее эффективность Вальдоксана в терапии депрессий у больных со стабильной стенокардией без сопутствующего СД типа 2 подтверждена также в российских многоцентровых исследованиях РИТМ [23] и ХРОНОС [12].
В 1-й группе к концу 3-месячного приема Вальдоксана у всех больных отмечена редукция тревожно-депрессивной симптоматики – 100% респондеров.
Включение в базисную терапию Вальдоксана оказывает благоприятное влияние на клинические проявления восстановительного периода ИМ. Отмечена достоверная динамика увеличения толерантности к физическим нагрузкам, подтвержденная дистанцией ТШХ у пациентов 1-й группы, что нашло отражение и в уменьшении ФК ХСН. Так, в 1-й группе больных к 12-й неделе исследования ФК ХСН снизился на 24,19%, во 2-й группе без медикаментозной коррекции аффективных расстройств – на 8,3%. Различия между группами по процентным долям в конце исследования достоверны. У пациентов 1-й группы, принимавших Вальдоксан, по сравнению с больными 2-й группы к 12-й неделе исследования достоверно снизился средний балл по ШОКС (3,4±0,13 против 3,86±0,2) и достоверно увеличилась дистанция ТШХ (381±12,9 против 312±14,7). Суммарно к 12-й неделе средний балл по ШОКС в 1-й группе уменьшился на 20,47%, дистанция ТШХ возросла на 34,15%; во 2-й группе средний балл по ШОКС снизился на 10,2%, дистанция ТШХ увеличилась на 7,5%. Также в 1-й группе в отличие от 2-й отмечено достоверное уменьшение количества и интенсивности приступов стенокардии, а также достоверно снизилась потребность в дополнительном приеме таблеток нитроглицерина на фоне комбинированной терапии с включением Вальдоксана (см. табл. 2). Благоприятное влияние Вальдоксана в составе базисной терапии у пациентов с ИБС на частоту и продолжительность приступов стенокардии отмечено также и в исследовании, проведенном В.Э.Медведевым и А.В.Епифановым [14].
Поскольку у больных с тревожно-депрессивными расстройствами нарушен баланс между симпатическим и парасимпатическим отделами ВНС, мы провели оценку вегетативного статуса пациентов с помощью шкалы балльной оценки проявлений вегетативной дистонии. На момент включения в исследование у пациентов 1-й группы уровень проявлений вегетативной дисфункции был несколько выше, чем во 2-й, однако различие между группами было статистически незначимо (см. табл. 2). На фоне применения Вальдоксана в составе базисной терапии в постинфарктном периоде уровень вегетативной дисфункции в 1-й группе снизился на 36,9% (р<0,05), а во 2-й группе (прием только базисных препаратов) – на 5,3% (межгрупповые различия высокодостоверны, р<0,01). Таким образом, нами впервые установлено наличие у Вальдоксана благоприятного вегетокорригирующего эффекта у пациентов с СД типа 2 и АКН в восстановительном периоде ИМ.
Значимо уменьшился индекс Кердо у пациентов, принимавших Вальдоксан, со значений 22,6±3,7 до 11,53±2,59 (∆%=-48,98), что свидетельствует об уменьшении симпатических влияний. Во 2-й группе пациентов значения индекса Кердо достоверно не изменились: с 21,8±3,4 до 18,53±3,68 (∆%=-15). Различия между группами по конечному результату достоверны.
При изучении показателей ВРС исходно у пациентов 2 групп выявлено снижение среднего квадратического отклонения (SDNN) менее 50 мс, что указывает на повышение активности симпатического отдела ВНС и является прогностически неблагоприятным признаком (свидетельствует о высоком риске возникновения опасных аритмий и внезапной коронарной смерти) [2] (табл. 3).
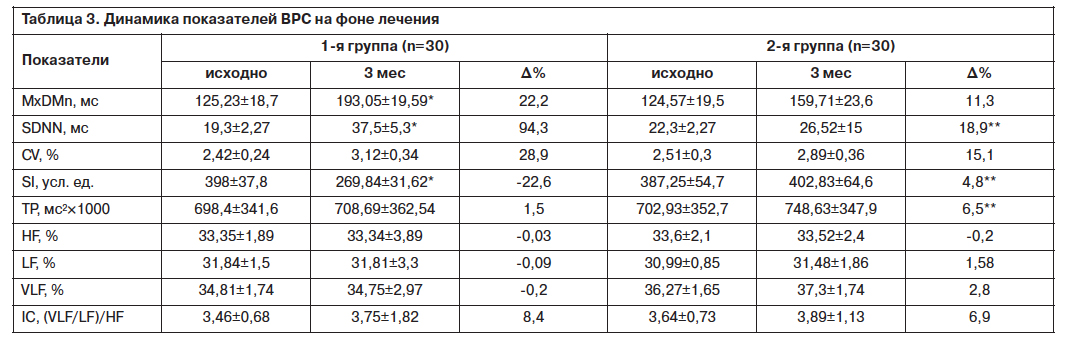
Включение Вальдоксана 25 мг/сут в состав базисной терапии ИМ у больных СД типа 2 в раннем постинфарктном периоде сопровождалось достоверным увеличением как средних значений SDNN, так и процента больных с SDNN>50 мс. Различия по конечному результату по двум показателям в 1 и 2-й группах статистически значимы.
Установлено, что у больных СД типа 2 в раннем постинфарктном периоде отмечалась выраженная централизация управлением ритма сердца. Это нашло отражение в увеличении средних значений ИН и индекса централизации (IC) в основной и контрольной группах. В то же время показатели суммарной мощности спектра в 2 группах оказались сниженными за счет относительного увеличения вклада мощностей волн низкой и очень низкой частот (LF и VLF%) и относительного снижения вклада мощности волн высокой частоты (HF%). Терапия Вальдоксаном в составе комбинированной терапии больных ХСН с СД типа 2 сопровождалась уменьшением индекса централизации, в то время как в группе контроля отмечался рост этого показателя. Различия по конечному результату в 2 группах статистически значимы. Данные изменения свидетельствуют о стабилизации сердечного ритма с переходом его регуляции с рефлекторного уровня вегетативного руководства на гуморально-метаболический [2]. Это позитивно отражается на клиническом течении ИМ и способствует уменьшению проявлений диабетической АКН.
В основной и контрольной группах по завершении исследования выявлено снижение ИН, но достоверно лишь в 1-й группе (р<0,05 по конечному результату), что также может говорить об уменьшении проявлений диабетической АКН у больных СД типа 2 в постинфарктном периоде на фоне коррекции аффективных расстройств Вальдоксаном.
При анализе результатов пробы на вегетативную реактивность исходно в 2 группах преобладали пациенты с асимпатикотонической и гиперсимпатикотонической вегетативной реактивностью (табл. 4). К концу исследования в 1-й группе стал преобладать нормальный тип вегетативной реактивности: доля пациентов с гиперсимпатикотонией и асимпатикотонией уменьшилась, процент больных с нормальной вегетативной реактивностью увеличился.
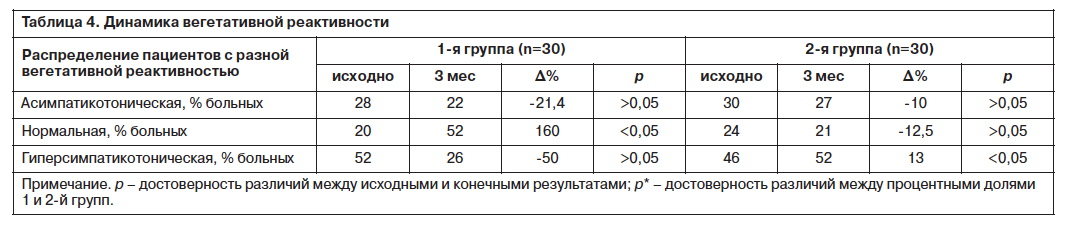
Во 2-й группе к концу исследования гиперсимпатикотонический тип вегетативной реактивности стал преобладающим.
В конце исследования выявлены достоверные различия между группами по количеству пациентов с гиперсимпатикотоническим типом вегетативной реактивности.
Полученные данные говорят о влиянии Вальдоксана на исходный вегетативный тонус, уменьшении симпатических влияний на деятельность сердца у больных СД типа 2 в восстановительном периоде ИМ.
За все время наблюдения признаков неблагоприятного лекарственного взаимодействия Вальдоксана с препаратами базисной терапии не обнаружено. При анализе основных кардиоинтервалов ЭКГ (P, P–Q, Q–T) значимых изменений не выявлено. У пациентов, принимавших Вальдоксан, не отмечалось негативных изменений со стороны общих клинических анализов крови и мочи, а также не обнаружено значимых изменений при исследовании функционального состояния печени (общего билирубина и его фракций, аланинаминотрансферазы и аспартатаминотрансферазы) и почек (уровня креатинина и мочевины крови). Случаев отмены Вальдоксана из-за нежелательных явлений не было.
Выводы
Сведения об авторе
Н.Н.Шилина – канд. мед. наук, председатель комиссии по охране здоровья студентов ГБОУ ВПО ВолгГМУ Минздрава РФ.
E-mail: shilina2010@yandex.ru
Ключевые слова: Вальдоксан, аффективные расстройства, сахарный диабет типа 2, автономная кардиальная нейропатия, восстановительный период инфаркта миокарда, вариабельность ритма сердца.
The efficiency of Valdoxan use in the rehabilitation period after myocardial infarction
in patients with type 2 diabetes mellitus and anxiety-depressive disorders
M.E.Statsenko, N.N.Shilina, S.V.Turkina
Volgograd State Medical University, Ministry of Health of the Russian Federation
Summary. The performed investigation has established that the use of Valdoxan 25 mg/day in the rehabilitation period after myocardial infarction in type 2 diabetes mellitus patients with cardiac autonomic neuropathy eliminates affective disorders effectively and reduces the magnitude of psychological stress. The frequency of angina attacks was significantly decreased, exercise tolerance increased, the manifestations of autonomic dysfunction reduced, and heart rhythm variability improved in the patients receiving combination therapy comprising Valdoxan.
Key words: Valdoxane, affective disorders, type 2 diabetes mellitus, cardiac autonomic neuropathy, rehabilitation period after myocardial infarction, heart rhythm variability.
Заболеваемость ишемической болезнью сердца (ИБС), инфарктом миокарда (ИМ) у больных сахарным диабетом (СД) типа 2 намного выше, чем у лиц без СД [16, 17]. Основной причиной смерти больных СД типа 2 почти в 50% случаев является ИМ [18].
Негативное влияние СД не только на развитие ИБС, но и на течение и прогноз заболевания отмечено во многих исследованиях [8, 25, 26]. Автономная кардиальная нейропатия (АКН) у больных СД имеет патогенетическое значение в удлинении интервала Q–T и селективном уменьшении вагальной чувствительности (повышение симпатической активности). Эти два фактора могут обусловить развитие смертельных аритмий [25, 26]. Смертность у больных диабетической АКН в течение 5 лет составляет около 50%, а ее причинами чаще всего являются внезапная остановка сердца, нарушения ритма и апноэ во сне. У пациентов с диабетической АКН наблюдается также нарушение адаптации к физическим нагрузкам [19].
В последние годы накапливается все больше доказательств того, что независимыми факторами риска ИБС являются также депрессия и другие психологические факторы [10, 11, 20]. Больные c депрессией имеют повышенный риск коронарной смерти [6]. В основе негативного влияния аффективных расстройств на сердечно-сосудистую систему лежит активация симпатико-адреналовой системы, изменение активности серотонинергических процессов, увеличение секреции кортизола, повышение агрегации тромбоцитов и нарушение баланса симпатического и парасимпатического звеньев вегетативной нервной системы (ВНС), выражающиеся, в частности, в снижении вариабельности ритма сердца (ВРС) у таких пациентов [3]. В недавно законченных исследованиях у больных с депрессиями было выявлено снижение ВРС [30, 31, 33, 37, 39, 42, 44–46]. Это имеет важное прогностическое значение, так как низкая ВРС является мощным предиктором внезапной сердечной смерти [34–36, 38, 43, 47]. Снижение основных показателей ВРС у постинфарктных больных с сопутствующим депрессивным расстройством по сравнению с пациентами без депрессии может объяснить вероятный механизм взаимосвязи депрессии и роста сердечно-сосудистой смертности в восстановительном периоде ИМ [21, 32].
Представленные данные, свидетельствующие об ухудшении прогноза заболевания, диктуют необходимость своевременного распознавания и лечения депрессии в восстановительном периоде ИМ у пациентов с СД типа 2. Ранее было установлено, что назначение Вальдоксана (SERVIER, Франция) дополнительно к базисной терапии ИМ купирует проявления депрессии и тревоги, нормализует сон, достоверно улучшает клиническое состояние и структурно-функциональное состояние сердца в постинфарктном периоде у больных СД типа 2 [24].
Вальдоксан (агомелатин) является мощным лигандом мелатониновых рецепторов со свойством агониста к МТ1- и МТ2-мелатониновым рецепторам, что определяет инновационный механизм действия препарата, который реализуется путем ресинхронизации нарушенных циркадианных ритмов. Вальдоксан является также антагонистом
5НТ2С-серотониновых рецепторов [29, 41]. При этом отсутствует значимый аффинитет к другим центральным рецепторам или переносчикам моноаминов и отсутствуют другие механизмы, влияющие на уровни серотонина в синаптической щели [40]. Благодаря синергизму действия на МТ1-, МТ2- и 5НТ2С-рецепторы Вальдоксан обладает не только выраженным антидепрессивным эффектом, редуцируя колебания гипотимии в течение суток, но и способностью быстро восстанавливать нормальный сон, а также дневную активность и работоспособность.
Однако в литературе мы не встретили работ, в которых было бы всесторонне изучено влияние Вальдоксана как на проявления аффективных расстройств, так и на симптомы вегетативной дисфункции, ВРС в восстановительном периоде ИМ у больных СД типа 2.
Цель исследования – изучить влияние терапии Вальдоксаном на выраженность депрессии, тревоги, стресса, вегетативные нарушения и клинические особенности течения восстановительного периода ИМ у больных СД типа 2.
Материалы и методы
Больные с установленным диагнозом ИМ, СД типа 2 и признаками аффективных расстройств отобраны в соответствии с критериями включения и исключения. На проведение исследования было получено разрешение регионального этического комитета.
Критерии включения: больные СД типа 2 с признаками тревожно-депрессивных расстройств на 3–4-й неделе после перенесенного ИМ. У всех пациентов ИМ осложнился наличием хронической сердечной недостаточности (ХСН) II–III функционального класса (ФК) согласно классификации Общества специалистов по сердечной недостаточности (ОССН). У всех больных была диагностирована диабетическая АКН [27]. Пациенты были рандомизированы на 2 группы (по 30 человек). Группы больных достоверно не различались по полу, возрасту, тяжести перенесенного ИМ, наличию гипертонической болезни (ГБ), основным показателям гемодинамики и углеводного обмена.
Критерии исключения: тяжелые, декомпенсированные или нестабильные сопутствующие соматические заболевания и состояния, которые непосредственно угрожают жизни больного; острые психические состояния; органическое психическое расстройство (деменция или эпилепсия); эндогенные психические заболевания; злоупотребление алкоголем; одновременный или менее чем за 14 дней прием лекарственных средств, обладающих снотворным эффектом; индивидуальная непереносимость Вальдоксана.
1-я группа – основная (n=30) – пациенты, которым в дополнение к базисной терапии восстановительного периода ИМ (b-адреноблокатор – бисопролол, ингибитор ангиотензинпревращающего фермента – эналаприл, антиагреганты – ацетилсалициловая кислота и клопидогрел, статин – симвастатин, при необходимости диуретики и нитраты) и пероральной гипогликемической терапии СД типа 2 (гликлазид МВ + метформин) назначался Вальдоксан 1-кратно на ночь в дозе 25 мг в течение 12 нед.
2-я группа – контрольная (n=30) – пациенты, которые получали только базисную терапию в течение 12 нед. Для коррекции аффективных расстройств применялось немедикаментозное воздействие (аутотренинг, психотерапия).
Средние дозировки препаратов базисной терапии ИМ в 2 группах больных с ХСН и СД типа 2 достоверно не различались.
Исходная характеристика групп больных представлена в табл. 1.

Наблюдение за пациентами, а также оценка безопасности проводимой терапии осуществлялись на протяжении 3 мес. Предусматривалось сравнение динамики изучаемых параметров исходно, на контрольных визитах через 4 и 12 нед исследования.
Объективные данные о состоянии пациентов были получены при физикальном исследовании, с помощью эхокардиографии [28] на аппарате SIEMENS SONOLINE G50 (Германия) с допплеровским датчиком и электрокардиографии (ЭКГ), а также с помощью шкалы оценки клинического состояния (ШОКС) больного с ХСН (модификация В.Ю.Мареева, 2000 г.) [4], ФК ХСН устанавливался согласно классификации ОССН и теста 6-минутной ходьбы (ТШХ) [22], также проводилось измерение частоты сердечных сокращений (ЧСС) и уровня артериального давления (АД) [9].
Для оценки психоэмоционального состояния изучались жалобы больных, а также использовались специфические опросники и шкалы: госпитальная шкала тревоги и депрессии (HADS) и опросник депрессии Бека (Beck Depression Inventory, BDI) [1]. Уровень стресса оценивали по результатам шкалы психологического стресса Ридера [7, 13].
Для определения состояния ВНС у пациентов оценивался исходный вегетативный тонус с помощью опросника для выявления признаков вегетативных изменений [5], проводился расчет вегетативного индекса Кердо [5], а вегетативную реактивность определяли с помощью пробы, предложенной Р.М.Баевским [2].
Параметры ВРС определялись на коротких участках записи ЭКГ в течение 5 мин с использованием аппаратно-программного комплекса ВАРИКАРД-1,41 (Россия). Учитывались следующие показатели ВРС: MxDMn – разность между максимальным и минимальным значением интервала R–R, SDNN – среднеквадратичное отклонение, CV – коэффициент вариации, SI – индекс напряжения, TR – суммарная мощность спектра, HF – высокочастотная составляющая, LF – низкочастотная составляющая (медленные волны), VLF – очень низкочастотные колебания (медленные волны 2 и 3-го порядка), IC – индекс централизации [2, 15].
Для оценки вегетативной реактивности обоих отделов ВНС проводили пробу, предложенную Р.М.Баевским [2]. Исходный вегетативный тонус (ваготония, нормотония, симпатикотония, гиперсимпатикотония) анализировали по фоновой пробе в положении лежа путем расчета индекса напряжения (ИН). Вегетативную реактивность оценивали с помощью отношения показателя ИН во время ортопробы к фоновому ИН с учетом значения фонового ИН. При этом выделяли нормальную, гиперсимпатикотоническую и асимпатикотоническую вегетативную реактивность [2].
Для оценки безопасности проводимой терапии были использованы: анкета для скрининга синдрома апноэ во сне, расчет продолжительности основных кардиоинтервалов – P–Q, QRS, Q–T (по данным ЭКГ), данные клинических, лабораторных параметров, а также регистрировали нежелательные эффекты терапии.
При возникновении нежелательных лекарственных явлений пациент имел возможность нанести незапланированный визит к врачу для решения вопроса о дальнейшем продолжении терапии, поддерживалась постоянная телефонная связь с пациентами. Во время визитов на 4 и 12-й неделе наблюдения проводилась оценка нежелательных лекарственных явлений исследователем.
Обработку результатов исследования проводили методами параметрической и непараметрической статистики. Использовали встроенный пакет статистического анализа Microsoft Excel для Windows XP 2002. Для оценки достоверности полученных результатов применяли t-критерий Стьюдента, критерий знаков, а для вычисления значимости различий процентных долей – метод углового преобразования Фишера. Статистически значимые изменения определяли при p<0,05.
Результаты и обсуждение
В конце 3-месячной терапии Вальдоксаном в дозировке 25 мг/сут у больных 1-й группы в отличие от пациентов 2-й группы наблюдалась редукция тревоги и депрессии, уменьшился уровень психологического стресса (табл. 2). Ранее эффективность Вальдоксана в терапии депрессий у больных со стабильной стенокардией без сопутствующего СД типа 2 подтверждена также в российских многоцентровых исследованиях РИТМ [23] и ХРОНОС [12].

В 1-й группе к концу 3-месячного приема Вальдоксана у всех больных отмечена редукция тревожно-депрессивной симптоматики – 100% респондеров.
Включение в базисную терапию Вальдоксана оказывает благоприятное влияние на клинические проявления восстановительного периода ИМ. Отмечена достоверная динамика увеличения толерантности к физическим нагрузкам, подтвержденная дистанцией ТШХ у пациентов 1-й группы, что нашло отражение и в уменьшении ФК ХСН. Так, в 1-й группе больных к 12-й неделе исследования ФК ХСН снизился на 24,19%, во 2-й группе без медикаментозной коррекции аффективных расстройств – на 8,3%. Различия между группами по процентным долям в конце исследования достоверны. У пациентов 1-й группы, принимавших Вальдоксан, по сравнению с больными 2-й группы к 12-й неделе исследования достоверно снизился средний балл по ШОКС (3,4±0,13 против 3,86±0,2) и достоверно увеличилась дистанция ТШХ (381±12,9 против 312±14,7). Суммарно к 12-й неделе средний балл по ШОКС в 1-й группе уменьшился на 20,47%, дистанция ТШХ возросла на 34,15%; во 2-й группе средний балл по ШОКС снизился на 10,2%, дистанция ТШХ увеличилась на 7,5%. Также в 1-й группе в отличие от 2-й отмечено достоверное уменьшение количества и интенсивности приступов стенокардии, а также достоверно снизилась потребность в дополнительном приеме таблеток нитроглицерина на фоне комбинированной терапии с включением Вальдоксана (см. табл. 2). Благоприятное влияние Вальдоксана в составе базисной терапии у пациентов с ИБС на частоту и продолжительность приступов стенокардии отмечено также и в исследовании, проведенном В.Э.Медведевым и А.В.Епифановым [14].
Поскольку у больных с тревожно-депрессивными расстройствами нарушен баланс между симпатическим и парасимпатическим отделами ВНС, мы провели оценку вегетативного статуса пациентов с помощью шкалы балльной оценки проявлений вегетативной дистонии. На момент включения в исследование у пациентов 1-й группы уровень проявлений вегетативной дисфункции был несколько выше, чем во 2-й, однако различие между группами было статистически незначимо (см. табл. 2). На фоне применения Вальдоксана в составе базисной терапии в постинфарктном периоде уровень вегетативной дисфункции в 1-й группе снизился на 36,9% (р<0,05), а во 2-й группе (прием только базисных препаратов) – на 5,3% (межгрупповые различия высокодостоверны, р<0,01). Таким образом, нами впервые установлено наличие у Вальдоксана благоприятного вегетокорригирующего эффекта у пациентов с СД типа 2 и АКН в восстановительном периоде ИМ.
Значимо уменьшился индекс Кердо у пациентов, принимавших Вальдоксан, со значений 22,6±3,7 до 11,53±2,59 (∆%=-48,98), что свидетельствует об уменьшении симпатических влияний. Во 2-й группе пациентов значения индекса Кердо достоверно не изменились: с 21,8±3,4 до 18,53±3,68 (∆%=-15). Различия между группами по конечному результату достоверны.
При изучении показателей ВРС исходно у пациентов 2 групп выявлено снижение среднего квадратического отклонения (SDNN) менее 50 мс, что указывает на повышение активности симпатического отдела ВНС и является прогностически неблагоприятным признаком (свидетельствует о высоком риске возникновения опасных аритмий и внезапной коронарной смерти) [2] (табл. 3).

Включение Вальдоксана 25 мг/сут в состав базисной терапии ИМ у больных СД типа 2 в раннем постинфарктном периоде сопровождалось достоверным увеличением как средних значений SDNN, так и процента больных с SDNN>50 мс. Различия по конечному результату по двум показателям в 1 и 2-й группах статистически значимы.
Установлено, что у больных СД типа 2 в раннем постинфарктном периоде отмечалась выраженная централизация управлением ритма сердца. Это нашло отражение в увеличении средних значений ИН и индекса централизации (IC) в основной и контрольной группах. В то же время показатели суммарной мощности спектра в 2 группах оказались сниженными за счет относительного увеличения вклада мощностей волн низкой и очень низкой частот (LF и VLF%) и относительного снижения вклада мощности волн высокой частоты (HF%). Терапия Вальдоксаном в составе комбинированной терапии больных ХСН с СД типа 2 сопровождалась уменьшением индекса централизации, в то время как в группе контроля отмечался рост этого показателя. Различия по конечному результату в 2 группах статистически значимы. Данные изменения свидетельствуют о стабилизации сердечного ритма с переходом его регуляции с рефлекторного уровня вегетативного руководства на гуморально-метаболический [2]. Это позитивно отражается на клиническом течении ИМ и способствует уменьшению проявлений диабетической АКН.
В основной и контрольной группах по завершении исследования выявлено снижение ИН, но достоверно лишь в 1-й группе (р<0,05 по конечному результату), что также может говорить об уменьшении проявлений диабетической АКН у больных СД типа 2 в постинфарктном периоде на фоне коррекции аффективных расстройств Вальдоксаном.
При анализе результатов пробы на вегетативную реактивность исходно в 2 группах преобладали пациенты с асимпатикотонической и гиперсимпатикотонической вегетативной реактивностью (табл. 4). К концу исследования в 1-й группе стал преобладать нормальный тип вегетативной реактивности: доля пациентов с гиперсимпатикотонией и асимпатикотонией уменьшилась, процент больных с нормальной вегетативной реактивностью увеличился.

Во 2-й группе к концу исследования гиперсимпатикотонический тип вегетативной реактивности стал преобладающим.
В конце исследования выявлены достоверные различия между группами по количеству пациентов с гиперсимпатикотоническим типом вегетативной реактивности.
Полученные данные говорят о влиянии Вальдоксана на исходный вегетативный тонус, уменьшении симпатических влияний на деятельность сердца у больных СД типа 2 в восстановительном периоде ИМ.
За все время наблюдения признаков неблагоприятного лекарственного взаимодействия Вальдоксана с препаратами базисной терапии не обнаружено. При анализе основных кардиоинтервалов ЭКГ (P, P–Q, Q–T) значимых изменений не выявлено. У пациентов, принимавших Вальдоксан, не отмечалось негативных изменений со стороны общих клинических анализов крови и мочи, а также не обнаружено значимых изменений при исследовании функционального состояния печени (общего билирубина и его фракций, аланинаминотрансферазы и аспартатаминотрансферазы) и почек (уровня креатинина и мочевины крови). Случаев отмены Вальдоксана из-за нежелательных явлений не было.
Выводы
- Назначение Вальдоксана 25 мг/сут в восстановительном периоде ИМ у больных ХСН и СД типа 2 с тревожно-депрессивными расстройствами эффективно устраняет проявления депрессии и тревоги, что сопровождается снижением уровня психологического стресса.
- Трехмесячная комбинированная терапия больных с ХСН и СД типа 2, перенесших ИМ, с включением 25 мг/сут Вальдоксана сопровождается достоверным увеличением толерантности к физическим нагрузкам, снижением ФК ХСН, а также уменьшением частоты приступов стенокардии и количества принимаемых таблеток нитроглицерина.
- Комбинированная терапия с включением Вальдоксана на фоне редукции тревожно-депрессивной симптоматики у больных СД типа 2 с диабетической АКН сопровождается уменьшением симпатических влияний на деятельность сердца, способствует нормализации вегетативной реактивности.
- Включение Вальдоксана в базисную терапию восстановительного периода ИМ у пациентов с СД типа 2 является безопасным, так как не оказывает неблагоприятного влияния на основные кардиоинтервалы, а также не выявлено признаков нежелательного взаимодействия с препаратами базисной терапии.
Сведения об авторе
Н.Н.Шилина – канд. мед. наук, председатель комиссии по охране здоровья студентов ГБОУ ВПО ВолгГМУ Минздрава РФ.
E-mail: shilina2010@yandex.ru
Список исп. литературыСкрыть список1. Андрющенко А.В., Дробижев М.Ю., Добровольский А.В. Сравнительная оценка шкал CES-D, BDI и HADS (d) в диагностике депрессий в общемедицинской практике. Журн. неврол. и психиатр. им С.С.Корсакова. 2003; 103: 11–8.
2. Бабунц И.В., Мириджанян Э.М., Машаех Ю.А. Азбука анализа вариабельности сердечного ритма. Ставрополь: Принтмастер, 2002.
3. Балукова Е.В., Успенский Ю.П., Ткаченко Е.И. Тревожные расстройства у больных терапевтического профиля. Терапевт. арх. 2007; 6: 85–8.
4. Беленков Ю.Н. Определение качества жизни у больных с хронической сердечной недостаточностью. Кардиология. 1993; 2: 85–8.
5. Вейн А.М. Вегетативные расстройства: клиника, лечение, диагностика. М.: Мед. информ. агентство, 2006.
6. Гафаров В.В., Громова Е.А., Гагулин И.В., Гафарова А.В. Восьмилетнее изучение влияния депрессии на риск возникновения инфаркта миокарда в популяции мужчин 25–64 лет (эпидемиологическое исследование на основе программы ВОЗ MONIKA). Терапевт. арх. 2005; 9: 60–4.
7. Гоштаутас А.А. Изучение особенностей личности в профилактических исследованиях ишемической болезни сердца. Первичная психологическая профилактика и реабилитация больных ИБС. Вильнюс, 1982; с. 25–36.
8. Джахангиров Т.Ш. Сахарный диабет как проблема современной кардиологии. Кардиология. 2005; 10: 55–61.
9. Диагностика и лечение артериальной гипертензии. Российские рекомендации (3-й пересмотр) разработаны Комитетом экспертов РМОАГ и ВНОК. М., 2008.
10. Дробижев М.Ю. Депрессия как общемедицинская проблема. Психиатр. и психофармакотер. 2006; 8 (2): 57–61.
11. Дробижев М.Ю., Арутюнов А.Т., Макух Е.А., Кикта С.В. К проблеме выявления депрессий, наблюдающихся в общей медицине. Трудный пациент. 2007; 5 (8): 41–5.
12. Иванов С.В. Вальдоксан (агомелатин) при терапии умеренных и тяжелых депрессий непсихотического уровня в амбулаторной и госпитальной практике (результаты российского многоцентрового исследования ХРОНОС). Психиатр. и психофармакотер. 2009; 6: 14–7.
13. Копина О.С. и др. Показатели психосоциального стресса при стенокардии и артериальной гипертонии. Материалы Всесоюзного симпозиума «Многофакторная профилактика ИБС». Томск, 1989.
14. Медведев В.Э., Епифанов А.В. Инновационный метод терапии депрессии у пациентов с ишемической болезнью сердца. Обозрение психиатрии и мед. психологии им. В.М.Бехтерева. 2010; 3: 46–50.
15. Михайлов В.М. Вариабельность ритма сердца. Иваново: Ивановская гос. мед. академия, 2002.
16 Мкртумян А.М., Давыдов А.Л., Подачина С.В. Влияние нарушений углеводного обмена на сосудистые осложнения сахарного диабета и возможность их предупреждения. Сердце. 2008; 39 (1): 4–8.
17. Мычка В.Б., Горностаев В.В., Чазова И.Е. Сердечно-сосудистые осложнения сахарного диабета типа 2. Кардиология. 2002; 4: 73–7.
18. Мычка В.Б., Чазова И.Е. Сердечно-сосудистые осложнения сахарного диабета типа 2. Cons. Med. 2003; 5 (9).
19. Недогода С.В., Капустин И.О. Диагностика и лечение диабетической кардионейропатии. Лекарственный вестн. 2005; 3 (4): 17–27.
20. Осипова И.В., Погосова Г.В., Соколова Я.В. Депрессивные нарушения у пожилых больных с хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2007; 6 (6): 34–9.
21. Арборишвили Г.Н., Орлова Я.А., Мареев В.Ю., Беленков Ю.Н. Прогностическая роль оценки вариабельности ритма сердца у пациентов с хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2005; 4 (4): 361.
22. Российские национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (3-й пересмотр). Сердечная недостаточность. 2009; 2 (52): 64–110.
23. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Терапия непсихотических депрессий антидепрессантом агомелатином (Вальдоксан): результаты наблюдательного многоцентрового исследования РИТМ. Психиатр. и психофармакотер. 2010; с. 4–11.
24. Стаценко М.Е., Шилина Н.Н. Терапия после инфаркта миокарда у пациентов с аффективными расстройствами и СД типа 2. Врач. 2012; 4: 94–8.
25. Терещенко С.Н., Голубев А.В. Клинические аспекты поражения сердца при сахарном диабете (диабетическая болезнь сердца). Кардиология. 2003; 11: 106–10.
26. Терещенко С.Н., Косицына И.В., Голубев А.В. Сахарный диабет и ИБС. Сердце. 2008; 39 (1): 13–6.
27. Ткачева О.Н., Верткин А.Л. Диабетическая автономная нейропатия: руководство для врачей. М.: ГЭОТАР-Медиа, 2009.
28. Фейгенбаум Х. Эхокардиография. Пер. с англ. Под ред. В.В.Митькова. М.: Видар, 1999.
29. Audinot V, Mailliet E, Labaye-Brasseur C et at. New selective ligands of human cloned melatonin MT1- and MT2-receptors. Naunyn Schmiedebergs Arch Pharmacol 2003; 367: 553–61.
30. Carney RM, Freedland KE, Steinetal PK. Change in heart rate and heart rate variability during treatment for depression in patients with coronary heart disease. Psychosom Med 2000; 62: 639–47.
31. Carney RM, Blumenthal JA, Freedland KE et al. Depression and late mortality after myocardial infarction in the Enhancing Recovery in Coronary Heart Disease (ENRICHD) study. Psychosom Med 2004; 66: 466–74.
32. Carney RM, Blumenthal JA, Stein PK et al. Depression, heart rate variability, and acute myocardial infarction. Circulation 2001; 104: 2024–8.
33. Kleiger RE, Miller JP, Bigger JT, Moss AJ. Decreased heart rate variability and its association with mortality after myocardial infarction. Am J Cardiol 1987; 113: 256–62.
34. Pitzalis MV, Lacoviello M, Todarello O et al. Depression but not anxiety influences the autonomic control of heart rate after myocardial infarction. Am Heart J 2001; 141: 765–71.
35. Vaccario V, Kasl S, Abramson J, Krumholz H. Depressiv symptoms and risk of functional decline and death in patients with heart failure. Am Coll Cardiol 2001; 38: 199–205.
36. Bigger JT, Fleiss JL, Rolnitzky LM, Steinman RC. Frequency domain measures of heart period variability to assess risk late after myocardial infarction. J Am Coll Cardiol 1993; 21: 729–36.
37. Gorman JM, Sloan RP. Heart rate variability in depressive and anxiety disorders. Am Heart J 2000; 140: 77–83.
38. Seccareccia F, Pannozzo F, Dima F et al. Heart rate as a predictor of mortality: the MATISS Project. Am J Public Health 2001; 91: 1258–63.
39. Koizumi K, Terui N, Kollai M. Effect of cardiac vagal and sympathetic nerve activity on heart rate in rhythmic fluctuations. J Autonom Nerv Syst 1985; 12: 251–9.
40. Lader M. Pharmacotherapy of mood disorders and treatment discontinuation. Drugs 2007; 67: 1657–63.
41. Millan MJ, Gobert A, Lejeune F at al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydro-xytryptamine2C-receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. Pharmacol Exp Ther 2003; 306: 954–64.
42. Piwonski J, Szczesniewska D. Low social support and high anxiety level (type D) and coronary heart disease symptoms in Warsaw Pol-MONICA population. Eur Heart J 1997; 18: 108.
43. Vaishnav S, Stevenson R, Merchant В et al. Relation between heart rate variability early after acute myocardial infarction and long-term mortality. Am J Cardiol 1994; 73: 653–7.
44. Vigo DE, Siri LN, Guevara SL et al. Relation of depression to heart rate nonlinear dynamics in patients >60 years of age with recent unstable angina pectoris or acute myocardial infarction. Am J Cardiol 2004; 93: 756–60.
45. van Melle J, de Jonge P, Ormej J et al. Relationship between left ventricular dysfunction and depression following myocardial infarction: data from the MIND-IT. Eur Heart J 2005; 26 (2): 50–6.
46. Agelink MW, Boz C, Ullrich H et al. Relationship between major depression and heart rate variability. Clinical consequences and implications for antidepressive treatment. Psychiat Res 2002; 113: 139–49.
47. Bigger JT, Fleiss JL, Rolnitzky LM et al. The ability of several short-term measures of RR variability to predict mortality after myocardial infarction. Circulation 1993; 88: 927–34.
1 июня 2012
Количество просмотров: 6414

