Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2012
Нарушения одноуглеродного метаболизма при шизофрении №06 2012
Номера страниц в выпуске:41-46
В статье приведены сведения о частоте встречаемости отдельных нарушений одноуглеродного метаболизма (гипергомоцистеинемии, дефицита фолатов, полиморфизма гена MTHFR677TT) у пациентов с шизофренией. Представлены современные взгляды на каузальные взаимоотношения одноуглеродного метаболизма и шизофрении, обсуждаются биохимические механизмы влияния дефицита фолатов на функционирование головного мозга, которые могут иметь отношение к патогенезу шизофрении, в частности избыток гомоцистеина и дефицита метионина. Приведен обзор клинических исследований фолатов в качестве аугментации терапии шизофрении антипсихотиками. Обсуждаются перспективы дальнейших исследований роли нарушений одноуглеродного метаболизма в этиологии, патогенезе и лечении шизофрении.
Резюме. В статье приведены сведения о частоте встречаемости отдельных нарушений одноуглеродного метаболизма (гипергомоцистеинемии, дефицита фолатов, полиморфизма гена MTHFR677TT) у пациентов с шизофренией. Представлены современные взгляды на каузальные взаимоотношения одноуглеродного метаболизма и шизофрении, обсуждаются биохимические механизмы влияния дефицита фолатов на функционирование головного мозга, которые могут иметь отношение к патогенезу шизофрении, в частности избыток гомоцистеина и дефицита метионина. Приведен обзор клинических исследований фолатов в качестве аугментации терапии шизофрении антипсихотиками. Обсуждаются перспективы дальнейших исследований роли нарушений одноуглеродного метаболизма в этиологии, патогенезе и лечении шизофрении.
Ключевые слова: шизофрения, дефицит фолатов, аугментация терапии шизофрении, гипергомоцистеинемия, генетический полиморфизм MTHFR677TT.
Disturbances of one-carbon metabolism in schizophrenia
T.V.Zhilyaeva
Nizhniy Novgorod State Medical Academy
Summary. The article provides data on the incidence of certain disturbances of one-carbon metabolism (hyperhomocysteinemia, folate deficiency, polymorphism MTHFR677TT) in patients with schizophrenia. Current views on the causal relationships between one-carbon metabolism and schizophrenia are presented. Biochemical mechanisms of influence of folate deficiency on brain functioning, which may be related to the pathogenesis of schizophrenia (in particular, an excess homocysteine and methionine deficiency), are discussed. The review of clinical trials of folate as the augmentation of antipsychotic treatment of schizophrenia is provided. The perspectives of the research on the role of disturbances of one-carbon metabolism in the etiology, pathogenesis and treatment of schizophrenia are discussed.
Key words: schizophrenia, folate deficiency, augmentation of therapy in schizophrenia, hyperhomocysteinemia, genetic polymorphism of MTHFR677TT.
В 60–70-е годы прошлого столетия в учении об этиопатогенезе шизофрении весомое место занимала гипотеза аутоинтоксикации. Было доказано наличие токсических факторов в биологических жидкостях больных шизофренией, однако проблема оставалась в невозможности установить конкретные вещества-токсины. Кроме того, было неясно, являются ли токсические свойства биологических жидкостей больных следствием болезни или ее причиной (M.Е.Вартанян, 1970) [1]. В дальнейшем теория аутоинтоксикации отошла на задний план на фоне нейротрансмиттерных гипотез. Однако новые данные в нейронауках открывают следующий виток в учении об этиопатогенезе шизофрении и возвращают к прежним гипотезам с более глубоких позиций. В частности, стало возможным устанавливать и изучать отдельные токсические агенты биологических жидкостей пациентов во взаимодействии с рецепторами и нейромедиаторами головного мозга. Так, теория нарушений одноуглеродного метаболизма (ОУМ) является одной из биохимических гипотез этиопатогенеза шизофрении, активно изучаемых в настоящее время, которая служит примером аутоинтоксикации при шизофрении. Интерес к этой теории появился прежде всего в связи с высокой частотой выявления отдельных нарушений одноуглеродного обмена у пациентов с шизофренией.
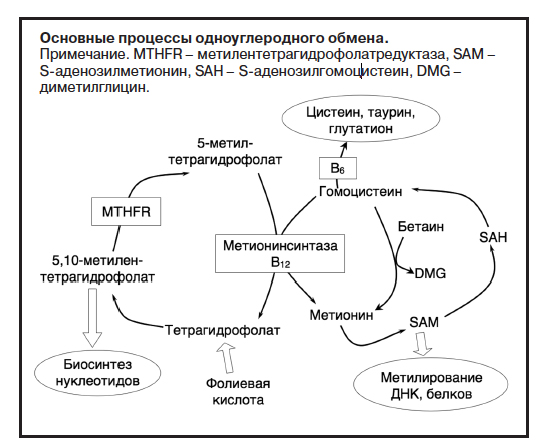
ОУМ представляет собой несколько взаимосвязанных биохимических циклов, основной сутью которых является перенос одноуглеродных (метильных) групп с одних веществ на другие, благодаря чему происходит синтез нуклеиновых кислот, отдельных аминокислот, фосфолипидов и других важных соединений (см. рисунок). Субстратом ОУМ являются поступающие с пищей фолаты, которые в печени восстанавливаются до тетрагидрофолата. Одно из производных тетрагидрофолата, 5,10-метилентетрагидрофолат, идет на биосинтез нуклеотидов, необходимых для построения ДНК и РНК. Другое производное, 5-метилтетрагидрофолат, является источником метильных групп для восстановления гомоцистеина в метионин. Последние две аминокислоты постоянно превращаются друг в друга в замкнутом цикле, работа которого возможна только благодаря поступлению метильных групп из цикла обмена фолатов (см. рисунок). Метионин поступает в организм с пищей, он служит источником метильных групп для процессов метилирования – синтеза ряда биологически важных веществ, защиты ДНК от мутаций. Гомоцистеин образуется из метионина после того, как метионин отдает свою метильную группу в реакциях метилирования. Самостоятельной биологической роли гомоцистеин не имеет, он не входит в состав белков, а при накоплении в количествах, превышающих физиологические нормы, становится токсичным. Поэтому в организме существует несколько путей его утилизации, среди которых важную роль играет как раз перенос метильной группы с производных фолатов и превращение в метионин [2]. При дефиците фолатов или нарушении их обмена процесс превращения гомоцистеина в метионин нарушается, и это приводит к тому, что метионин, отработав в реакциях метилирования, превращается в гомоцистеин, а возможности к восстановлению не имеет. При этом гомоцистеин накапливается в избыточных количествах и оказывает токсические эффекты на целый ряд тканей в организме, а метионина, необходимого для большого количества биологически важных процессов, становится недостаточно.
Нарушения ОУМ широко изучаются в настоящее время в клинической медицине в связи с тем, что они вовлечены в патогенез большого спектра соматических расстройств (сердечно-сосудистых, онкологических, акушерско-гинекологических и др.). При этом пристальное внимание ученых приковано к следующим аспектам нарушений ОУМ:
У больных шизофренией к настоящему времени обнаружены все перечисленные выше аспекты нарушений ОУМ. Первоначальные работы, направленные на выявление дефицита фолатов (в пищевом рационе и в сыворотке крови) у эндогенных больных, оказались противоречивыми в отношении шизофрении: в ряде работ были получены сведения о дефиците фолатов у больных шизофренией, в других работах эти результаты не подтверждались. Поэтому J.Muntjewerff и H.Blom в 2005 г. предложили больше внимания обратить не на дефицит фолатов, а на нарушения их обмена в организме у пациентов, в том числе на нарушения в генах, контролирующих фолатный обмен [3].
И действительно, в течение последних двух десятилетий в многочисленных исследованиях в разных странах было показано, что среди больных шизофренией полиморфизм гена MTHFR 677TT и, как следствие, гипергомоцистеинемия встречаются чаще, чем в общей популяции [4–7]. E.Tan и соавт. показали, что в исследованной ими популяции (потомки китайцев, проживающие в США) носители T-аллеля имеют больший риск по заболеваемости шизофренией [8]. В японской и турецкой популяциях гомозиготное носительство ТТ-генотипа достоверно чаще встречается среди больных шизофренией, чем среди здорового контроля (OR 1,9 и OR 2,5 соответственно) [9, 10]. В скандинавской и китайской популяциях носительство T-аллеля приводит к более раннему началу шизофрении по сравнению с носителями дикого аллеля, поэтому, по мнению авторов, полиморфизм MTHFR С677T может играть роль фактора-модификатора возраста начала шизофрении [11].
Согласно метаанализу J.Muntjewerff и соавт. при наличии ТТ-генотипа вероятность заболевания шизофренией на 36% выше по сравнению с носителями СС-генотипа [12]. O.Peerbooms и соавт. в своем метаанализе также получили данные о том, что TT-генотип значимо чаще встречается среди пациентов с эндогенными психическими расстройствами (шизофренией, биполярным расстройством и эндогенной депрессией), чем в популяции здорового контроля [13]. Другие недавние метаанализы включают полиморфизм MTHFR 677TT в список 16 генов, которые являются генетическими факторами риска шизофрении.
И что наиболее важно, MTHFR находится в списке 4 генов, которые имеют «сильную степень эпидемиологической вероятности» в отношении шизофрении [14, 15].
Если в исследованиях учитываются несколько полиморфизмов в MTHFR и других генах, контролирующих ОУМ, то их суммарная связь с таким показателем, как выраженность негативной симптоматики при шизофрении, сильнее, чем у одного MTHFR C677T (J.Roffman и соавт., [16]). Причем влияние этих полиморфизмов на негативную симптоматику реализуется только при дефиците фолатов в плазме. Согласно авторам взаимоотношения между уровнем фолатов и выраженностью негативной симптоматики у пациентов с генетической уязвимостью биологически вполне убедительны и предполагают полезность аугментации фолатами у этих пациентов.
В корейском исследовании среди женщин, больных шизофренией, гипергомоцистеинемия отмечалась в 33,8% случаев, среди мужчин – в 51,5% [19], а низкий уровень фолатов сыворотки отмечался у 66,2% пациентов обоих полов. N.Petronijević и соавт. показали, что у пациентов при поступлении в стационар при экзацербации шизофрении уровень гомоцистеина значимо выше, чем в группе контроля, а уровень фолатов и кобаламина от контроля не отличается. Причем уровень гомоцистеина коррелировал с выраженностью негативной симптоматики. У всех пациентов через месяц лечения в период стабилизации состояния уровень гомоцистеина заметно снизился (2,68±1,57 мкмоль/л), но корреляция с выраженностью негативной симптоматики по-прежнему сохранялась (пациенты не получали витамины дополнительно к терапии) [20].
T.Kim и S.Moon (2011 г.) обнаружили отличия в гендерной представленности нарушений ОУМ: среди мужчин пациентов с гипергомоцистеинемией достоверно больше, чем среди женщин [21]. A.Sazci и соавт. также выявили, что мутантные аллели MTHFR 677T, генотипы T677T, C1298C и составные генотипы T677T/A1298A, C677C/C1298C достоверно чаще встречаются среди мужчин, больных шизофренией, по сравнению со здоровым контролем, у женщин же достоверной разницы между больными и здоровыми в представленности этих генотипов не обнаружено [21]. Похожие данные получили J.Levine и соавт.: в популяции больных шизофренией и биполярным расстройством уровень гомоцистеина оказался значительно выше, чем среди здорового контроля, и практически полностью за счет молодых пациентов-мужчин [22, 23]. Однако другие недавние исследования демонстрируют, что у больных шизофренией обоих полов уровень гомоцистеина плазмы выше, чем в контрольных группах здоровых [24].
Согласно E.Zintzaras (2006 г.) ассоциация дефекта гена MTHFR с шизофренией более выражена среди представителей монголоидной расы, чем европеоидной. Исследования, проведенные в Скандинавии, вообще не подтвердили связи между генотипом MTHFR и заболеваемостью шизофренией и биполярным расстройством [25]. Японские исследователи получили противоречивые результаты и сообщают, что требуются дальнейшие исследования в этой области [26]. Таким образом, имеются географические особенности рассматриваемых взаимодействий.
Можно было бы предположить, что шизофрения, ассоциированная с нарушениями ОУМ, имеет какие-то клинические психопатологические закономерности. Однако H.Mabrouk и соавт. (2011 г.) в специальном исследовании не обнаружили каких-либо клинических особенностей у больных шизофренией с гипергомоцистеинемией, за исключением отсутствия в семейном анамнезе психических расстройств, по сравнению с другими больными шизофренией [19]. Аналогичные результаты были получены T.Kim и S.Moon (2011 г.): каких-либо клинических отличий пациентов с гипергомоцистеинемией от пациентов с нормальным уровнем гомоцистеина обнаружено не было [21].
Вместе с тем J.Roffman и соавт. показали, что носительство T-аллеля MTHFR 677 ассоциировано с тяжестью негативной симптоматики при шизофрении [27, 28], а позитивная симптоматика у носителей этого аллеля менее выражена. У пациентов с MTHFR 677TT выраженность негативной симптоматики была обратно пропорциональна уровню фолатов плазмы [9]. J.Roffman и соавт. также продемонстрировали, что носительство Т-аллеля ассоциировано с выраженностью нарушений исполнительного функционирования при шизофрении [29].
Согласно R.Joober и соавт. Т-аллель и ТТ-генотип значимо чаще встречаются среди пациентов-респондеров к нейролептикам с хорошим прогнозом заболевания, а среди пациентов-нонреспондеров к нейролептикам встречаются не чаще, чем у здорового контроля [30]. Авторы заключают, что ген MTHFR вовлечен в патогенез разновидности шизофрении, отличающейся быстрым и устойчивым терапевтическим ответом на типичные нейролептики с хорошим долговременным прогнозом и благоприятным терапевтическим результатом.
Были получены данные о корреляции уровня гомоцистеина с выраженностью отдельных симптомов (враждебность, когнитивный дефицит). В популяции здоровых людей было проведено исследование, согласно которому уровень гомоцистеина плазмы положительно и значимо коррелирует с выраженностью враждебности (Cook-Medley hostility questionnaire) [31]. Кроме того, в разных популяциях (здоровые люди пожилого возраста, пациенты с сосудистыми заболеваниями головного мозга) была показана ассоциация уровня гомоцистеина плазмы с когнитивным дефицитом [32].
Необходимо заметить, что при гомоцистинурии (врожденном заболевании с тяжелой гипергомоцистеинемией) часто отмечается умственная отсталость, а психотические эпизоды отмечаются лишь у небольшой доли пациентов. Вероятно, это объясняется разницей в концентрации гомоцистеина: при шизофрении у пациентов выявляется умеренная гипергомоцистеинемия – до 100 ммоль/л, а при гомоцистинурии – более 100 ммоль/л.
Механизмы влияния нарушений ОУМ на этиопатогенетические процессы при шизофрении изучаются в нескольких направлениях. Наиболее часто в качестве ключевого патогенетического звена рассматривается гипергомоцистеинемия. К настоящему времени проведен целый ряд исследований, который демонстрирует нейротропную активность и нейротоксичность гомоцистеина. Уже в 1990-е годы было высказано предположение, что серосодержащие аминокислоты, к которым относятся гомоцистеин и его дериваты (легко образующиеся из гомоцистеина путем самоокисления), являются возбуждающими нейротрансмиттерами у млекопитающих, аналогичными глутамату [33].
S.Lipton и соавт. продемонстрировали, что гомоцистеин проявляет функции парциального антагониста глицинового сайта NMDA-рецепторов и, таким образом, обладает ингибирующим влиянием на глутаматергическую передачу в нормальных условиях (при нормальных концентрациях глицина) [34]. Это прямым образом соотносится с гипотезой NMDA-рецепторной гипофункции в качестве патогенетического фактора шизофрении [35]. Кроме того, авторы показали, что в условиях сосудистой катастрофы или травмы головного мозга, а также в концентрациях более 300–400 мкмоль гомоцистеин начинает действовать как агонист NMDA-рецепторов и начинает проявлять нейротоксические свойства. Требуются дальнейшие исследования, которые позволят понять, является ли анти-NMDA-рецепторная активность гомоцистеина клинически значимой у больных шизофренией.
Shi и соавт. обнаружили, что гомоцистеин и его дериваты, легко образующиеся в организме в процессе окисления, в высоких концентрациях избирательно и мощно модулируют активность метаботропных глутаматергических рецепторов и, таким образом, регулируют внутриклеточные процессы и нейротрансмиссию в головном мозге [36]. Сложность понимания процессов влияния гомоцистеина на метаботропные Glu-рецепторы заключается в том, что различные дериваты гомоцистеина по-разному (в плане избирательности и мощности) действуют на разные подтипы глутаматных метаботропных рецепторов. При этом известно, что различные типы метаботропных рецепторов (8 типов) по-разному влияют на активность NMDA-рецепторов. Поэтому к настоящему моменту можно считать доказанным, что гомоцистеин и его непосредственные метаболиты играют роль в модуляции активности глутаматергической системы головного мозга путем воздействия на метаботропные Glu-рецепторы, но каким именно образом это происходит и как именно это относится к патогенезу нервно-психических расстройств, пока остается неизученным [32]. Действительно, в отдельных исследованиях показано, что гомоцистеин нарушает нейрональный гомеостаз различными дивергентными путями [37].
В отношении гомоцистеина проведен ряд исследований, согласно которым он участвует в патогенезе нейродегенеративных заболеваний, в частности болезни Альцгеймера [38]. Учитывая, что теория нейродегенерации занимает весомое место в современном понимании патогенеза шизофрении [35], возможно, именно способность гомоцистеина вызывать нейродегенеративные процессы в головном мозге имеет отношение к патогенезу шизофрении. По результатам ряда исследований гомоцистеин запускает в нейроне ряд процессов, приводящих клетку к апоптозу. Величина и скорость эффекта в эксперименте зависела от концентрации гомоцистеина: при концентрации 250 мкмоль/л гомоцистеин вызывал апоптоз почти всех нейронов гиппокампа в культуре клеток in vitro в течение 28 ч, а при концентрации 0,5 мкмоль/л (что является нормой in vivo!) в том же эксперименте происходил отставленный апоптоз около 40% нейронов в течение 4–6 сут [39]. M.Linnebank и соавт. обнаружили, что гомоцистеин связывает ионы Cu2+, которые являются кофактором цитохром-С-оксидазы в митохондриях, что приводит к инактивации этого фермента, оксидативному стрессу и апоптотической гибели нейронов [40]. В культуре гранулярных нейронов мозжечка гомоцистеин (в дозе более 300 мкмоль/л в течение 16–22 ч) также вызывал гибель нейронов, опосредованную воздействием на NMDA-рецепторы и продукцией свободных радикалов [41].
В исследовании K.Imamura и соавт. была продемонстрирована дозозависимая токсичность гомоцистеина (0–50 ммоль/л) в отношении мезенцефальных дофаминергических нейронов в культуре клеток. Причем внутриклеточный дофамин усиливал цитотоксичность гомоцистеина.
В этом же эксперименте было показано, что изучаемые эффекты ассоциированы с оксидативным стрессом [42]. Эти результаты, безусловно, нельзя переносить на ситуацию in vivo хотя бы потому, что вряд ли могут нормальные концентрации гомоцистеина вызывать гибель нейронов (существуют данные о наличии in vivo протекторных веществ, таких как карнозин, параоксоназа-1, нейтрализующих действие гомоцистеина на нервную ткань [40, 43]). Тем не менее они демонстрируют наличие токсичности гомоцистеина в отношении нервной ткани. И если гомоцистеин в концентрациях более 100 мкмоль/л вызывает гибель нейрона через воздействие на NMDA-рецепторы, то в дозах менее 100 мкмоль/л воздействие на NMDA-рецепторы, возможно, имеет другие последствия, что требует дальнейшего изучения.
Кратковременное влияние гомоцистеина на когнитивные функции головного мозга изучалось на здоровых молодых добровольцах. Было показано, что статистически значимое повышение уровня гомоцистеина в течение суток, вызванное алиментарным путем, не вызывает когнитивных нарушений у обследованных [47]. Вероятно, нужны другие эксперименты с более длительными нарушениями ОУМ, вызванными другими способами, что вряд ли допустимо на человеке.
В исследовании на мышах было показано, что лишь
8-кратное повышение гомоцистеина крови, вызванное алиментарным путем к 5-му месяцу эксперимента, приводит к статистически значимым умеренным поведенческим дефектам, обнаруживаемым с помощью теста водного лабиринта Морриса (Morris Water Maze test) [23].
Помимо механизмов, опосредованных гипергомоцистеинемией, нарушения ОУМ могут оказывать влияние на развитие шизофрении из-за дефицита метионина и нарушения процессов метилирования. Так, согласно Roffman и соавт., носительство MTHFR 677 T-аллеля вовлечено в эпигенетические механизмы развития шизофрении, такие как метилирование ДНК и ремоделирование хроматина. Эти механизмы, в частности, приводят к нарушению у носителей TT-генотипа способности учиться на собственных ошибках и препятствуют формированию гибкого, адаптивного поведения (морфологическим субстратом является передняя поясная кора) [48].
Негативное влияние дефицита фолатов на нейрохимию при шизофрении может быть опосредовано недостаточным синтезом глицина из серина, так как в этом процессе фолаты играют роль донора метильной группы [49].
Производное метионина – S-аденозилметионин (SAM) является донором метильной группы в процессах синтеза дофамина, норадреналина и серотонина [46], поэтому Spiro и соавт. предположили, что именно дефицит метионина вовлечен в патогенез шизофрении у ряда пациентов [50]. Затем они обнаружили в собственном исследовании, что дополнительный прием метионина пациентами с шизофренией приводит к аггравации симптомов заболевания [51]. Назначение другого метильного донора, бетаина, также приводило к аггравации симптомов шизофрении [52].
В настоящее время, зная отдельные особенности ОУМ и нейрохимии шизофрении, с некоторой осторожностью можно предположить, что прием извне дополнительного метионина приводит к увеличению синтеза дофамина и усилению дофаминовой нейротрансмиссии в мезолимбической системе, что приводит к нарастанию продукции. Кроме того, при добавлении извне метионина увеличивается концентрация его непосредственного продукта переработки – гомоцистеина, и патологическое влияние последнего тоже усиливается.
В генетических исследованиях показано, что генетические полиморфизмы MTHFR и COMT действуют синергически в отношении нарушений исполнительного функционирования (Wisconsin Card Sorting Task, WCST) у больных шизофренией. Аллели MTHFR T и COMT Val оказывают кумулятивный эффект на внутриклеточный профиль метилирования и префронтальную дофаминовую трансмиссию, что взаимно усиливает эффект на персеверативные ошибки в WCST [53]. Аналогичные результаты о синергичном взаимодействии генетических аллелей MTHFR T и COMT Val получены в отношении нарушений рабочей памяти, которые также являются результатом нарушения дофаминовой трансмиссии в префронтальной коре. Объяснить эти результаты авторы могут пока гипотетически. Так, возможно, T-аллель приводит к гипометилированию гена-промоутера COMT, что в свою очередь приводит к усилению экспрессии COMT и нарушениям дофаминовой передачи в дорсолатеральной префронтальной коре [54].
Если описанные выше результаты исследований справедливы в отношении этиопатогенеза шизофрении, то прямым выводом будет необходимость более пристального внимания к нарушениям ОУМ при шизофрении и аугментации фолатами психофармакотерапии шизофрении при наличии у пациента гипергомоцистеинемии, так как дополнительный прием фолатов компенсирует нарушения ОУМ даже при наличии генетического полиморфизма MTHFR 677TT. Клинических исследований по этой теме к настоящему времени проведено мало, однако их результаты внушают оптимизм.
Впервые в 1975 г. Mudd и соавт. доложили, что у 1 из 3 пациентов с шизофренией с дефектом фермента MTHFR в результате приема фолатов улучшается состояние [55].
В 1997 г. B.Regland и соавт. показали, что у пациентов с шизофренией гипергомоцистеинемия, ассоциированная с носительством TT-генотипа, хорошо купируется фолатами (и не купируется витамином В12) [4].
В двойном слепом плацебо-контролируемом исследовании Godfrey и соавт. стандартная психотропная терапия успешно дополнялась метилфолатом (15 мг) в течение
6 мес: значительно ускорялось клиническое и социальное выздоровление по сравнению с плацебо, причем с течением времени различия с плацебо увеличивались (n=41) [56].
M.Hill и соавт. в двойном слепом плацебо-контролируемом исследовании назначения фолатов (2 мг/сут) амбулаторным пациентам с шизофренией показали, что дополнение терапии фолатами во всей выборке не оказывает значимого эффекта на негативную симптоматику. Однако у тех пациентов, кто был носителем хотя бы одного Т-аллеля MTHFR, терапия фолатами позволила добиться значимых изменений негативной симптоматики, причем этот эффект был опосредован нарастанием уровня фолатов плазмы у этих больных. Однако выборка данного исследования (n=28) позволяет лишь сказать, что требуются дальнейшие работы в этом направлении [57].
J.Levine и соавт. назначали 42 пациентам с шизофренией, у которых уровень гомоцистеина был выше 15 мкмоль/л, витамины группы В: фолиевую кислоту, пиридоксин и витамин В12 (двойное слепое рандомизированное плацебо-контролируемое исследование). Пациенты, получавшие витамины, через 3 мес продемонстрировали значительное улучшение состояния по сравнению с группой плацебо (PANSS, WCS и другие нейропсихологические тесты) [58].
Таким образом, к настоящему времени получено большое количество доказательств наличия нарушений ОУМ среди больных шизофренией, намечены основные перспективы для изучения патогенетических взаимоотношений между нарушениями ОУМ и шизофренией и даже получены отдельные разрозненные данные об эффективности аугментации фолатами терапии больных шизофренией. Все это говорит о необходимости дальнейших целенаправленных исследований, как клинических, так и нейрохимических. Гипотетически правильно разработанная система аугментации фолатами может не только повысить эффективность психофармакотерапии больных шизофренией и таким образом снизить затраты на лечение и реабилитацию больных (S.Gilbody и соавт., 2007) [6], но и может способствовать профилактике шизофрении в отдельных группах риска (S.Zammit и соавт., 2007) [59].
Исходя из полученных к настоящему времени сведений, представляется целесообразным проведение отбора среди больных шизофренией пациентов с нарушениями ОУМ, для того чтобы оптимизировать их лечение и нивелировать влияние дефицита фолатов на негативную и когнитивную симптоматику при шизофрении. Поскольку биохимические лабораторные тесты выявления гипергомоцистеинемии, гипофолатемии и генетических полиморфизмов достаточно дорогостоящи и не всегда доступны в практической психиатрии, возможно, было бы полезно разработать скрининговый тест-опросник на предмет выявления признаков нарушений ОУМ у пациента. Учитывая имеющиеся в литературе сведения, приведенные выше, при выявлении больных шизофренией с нарушениями ОУМ необходимо обратить внимание на пациентов-мужчин с выраженными негативными и когнитивными симптомами, но без яркой продуктивной симптоматики (что наиболее соответствует простой форме шизофрении). Кроме того, важную информацию могут дать сведения о наличии коморбидных расстройств, ассоциированных с нарушениями ОУМ, у пациента и его ближайших родственников. В дальнейшем также необходимо изучить гендерные и географические особенности применительно к российской популяции больных шизофренией. Наконец, аугментация фолатами требует разработки адекватной схемы дозирования и длительности применения фолатов у пациентов и в группах риска.
Сведения об авторе
Жиляева Татьяна Владимировна – канд. мед. наук, ассистент каф. психиатрии и медицинской психологии ГБОУ ВПО
Нижегородская государственная медицинская академия Минздрава РФ. E-mail: bizet@inbox.ru
Ключевые слова: шизофрения, дефицит фолатов, аугментация терапии шизофрении, гипергомоцистеинемия, генетический полиморфизм MTHFR677TT.
Disturbances of one-carbon metabolism in schizophrenia
T.V.Zhilyaeva
Nizhniy Novgorod State Medical Academy
Summary. The article provides data on the incidence of certain disturbances of one-carbon metabolism (hyperhomocysteinemia, folate deficiency, polymorphism MTHFR677TT) in patients with schizophrenia. Current views on the causal relationships between one-carbon metabolism and schizophrenia are presented. Biochemical mechanisms of influence of folate deficiency on brain functioning, which may be related to the pathogenesis of schizophrenia (in particular, an excess homocysteine and methionine deficiency), are discussed. The review of clinical trials of folate as the augmentation of antipsychotic treatment of schizophrenia is provided. The perspectives of the research on the role of disturbances of one-carbon metabolism in the etiology, pathogenesis and treatment of schizophrenia are discussed.
Key words: schizophrenia, folate deficiency, augmentation of therapy in schizophrenia, hyperhomocysteinemia, genetic polymorphism of MTHFR677TT.
В 60–70-е годы прошлого столетия в учении об этиопатогенезе шизофрении весомое место занимала гипотеза аутоинтоксикации. Было доказано наличие токсических факторов в биологических жидкостях больных шизофренией, однако проблема оставалась в невозможности установить конкретные вещества-токсины. Кроме того, было неясно, являются ли токсические свойства биологических жидкостей больных следствием болезни или ее причиной (M.Е.Вартанян, 1970) [1]. В дальнейшем теория аутоинтоксикации отошла на задний план на фоне нейротрансмиттерных гипотез. Однако новые данные в нейронауках открывают следующий виток в учении об этиопатогенезе шизофрении и возвращают к прежним гипотезам с более глубоких позиций. В частности, стало возможным устанавливать и изучать отдельные токсические агенты биологических жидкостей пациентов во взаимодействии с рецепторами и нейромедиаторами головного мозга. Так, теория нарушений одноуглеродного метаболизма (ОУМ) является одной из биохимических гипотез этиопатогенеза шизофрении, активно изучаемых в настоящее время, которая служит примером аутоинтоксикации при шизофрении. Интерес к этой теории появился прежде всего в связи с высокой частотой выявления отдельных нарушений одноуглеродного обмена у пациентов с шизофренией.
ОУМ представляет собой несколько взаимосвязанных биохимических циклов, основной сутью которых является перенос одноуглеродных (метильных) групп с одних веществ на другие, благодаря чему происходит синтез нуклеиновых кислот, отдельных аминокислот, фосфолипидов и других важных соединений (см. рисунок). Субстратом ОУМ являются поступающие с пищей фолаты, которые в печени восстанавливаются до тетрагидрофолата. Одно из производных тетрагидрофолата, 5,10-метилентетрагидрофолат, идет на биосинтез нуклеотидов, необходимых для построения ДНК и РНК. Другое производное, 5-метилтетрагидрофолат, является источником метильных групп для восстановления гомоцистеина в метионин. Последние две аминокислоты постоянно превращаются друг в друга в замкнутом цикле, работа которого возможна только благодаря поступлению метильных групп из цикла обмена фолатов (см. рисунок). Метионин поступает в организм с пищей, он служит источником метильных групп для процессов метилирования – синтеза ряда биологически важных веществ, защиты ДНК от мутаций. Гомоцистеин образуется из метионина после того, как метионин отдает свою метильную группу в реакциях метилирования. Самостоятельной биологической роли гомоцистеин не имеет, он не входит в состав белков, а при накоплении в количествах, превышающих физиологические нормы, становится токсичным. Поэтому в организме существует несколько путей его утилизации, среди которых важную роль играет как раз перенос метильной группы с производных фолатов и превращение в метионин [2]. При дефиците фолатов или нарушении их обмена процесс превращения гомоцистеина в метионин нарушается, и это приводит к тому, что метионин, отработав в реакциях метилирования, превращается в гомоцистеин, а возможности к восстановлению не имеет. При этом гомоцистеин накапливается в избыточных количествах и оказывает токсические эффекты на целый ряд тканей в организме, а метионина, необходимого для большого количества биологически важных процессов, становится недостаточно.

Нарушения ОУМ широко изучаются в настоящее время в клинической медицине в связи с тем, что они вовлечены в патогенез большого спектра соматических расстройств (сердечно-сосудистых, онкологических, акушерско-гинекологических и др.). При этом пристальное внимание ученых приковано к следующим аспектам нарушений ОУМ:
- Дефицит фолатов (витамина В9), витаминов В12 и В6 – экзогенная, прежде всего алиментарная причина нарушений ОУМ. Эти витамины являются субстратами и кофакторами ферментов в циклах ОУМ (см. рисунок), и без них невозможна нормальная работа этих циклов.
- Полиморфизмы генов обмена фолатов, в частности полиморфизм гена метилентетрагидрофолатредуктазы (MTHFR) С677T, – эндогенная, наследственно обусловленная причина нарушений ОУМ. При наличии полиморфизма гена MTHFR С677T в гомозиготном варианте (677TT) работа фермента MTHFR снижается на 60% от нормы, в гетерозиготном варианте – на 35% от нормы (см. рисунок). В общей популяции гомозиготных носителей этой мутации около 10–15% (по данным разных авторов), гетерозиготных – около 40–50%. Причем у представителей разных рас эти цифры значительно различаются: чаще этот полиморфизм встречается у европейцев, реже – у афроамериканцев. Кроме этого, стали известны и другие генетические полиморфизмы и мутации, влияющие на нарушения ОУМ: в гене MTHFR к настоящему времени обнаружено 9 различных полиморфизмов, во всех генах ОУМ – не менее 20.
- Гипергомоцистеинемия и дефицит метионина – патогенетические звенья, отвечающие за развитие патологических процессов в разных органах и тканях. Доля участия гомоцистеина или метионина в различных патологических процессах к настоящему времени часто является предметом дискуссии и пристального изучения. Кроме того, гипергомоцистеинемия является универсальным надежным биохимическим маркером нарушений ОУМ независимо от их причины и доступна к измерению в большом количестве лабораторий.
У больных шизофренией к настоящему времени обнаружены все перечисленные выше аспекты нарушений ОУМ. Первоначальные работы, направленные на выявление дефицита фолатов (в пищевом рационе и в сыворотке крови) у эндогенных больных, оказались противоречивыми в отношении шизофрении: в ряде работ были получены сведения о дефиците фолатов у больных шизофренией, в других работах эти результаты не подтверждались. Поэтому J.Muntjewerff и H.Blom в 2005 г. предложили больше внимания обратить не на дефицит фолатов, а на нарушения их обмена в организме у пациентов, в том числе на нарушения в генах, контролирующих фолатный обмен [3].
И действительно, в течение последних двух десятилетий в многочисленных исследованиях в разных странах было показано, что среди больных шизофренией полиморфизм гена MTHFR 677TT и, как следствие, гипергомоцистеинемия встречаются чаще, чем в общей популяции [4–7]. E.Tan и соавт. показали, что в исследованной ими популяции (потомки китайцев, проживающие в США) носители T-аллеля имеют больший риск по заболеваемости шизофренией [8]. В японской и турецкой популяциях гомозиготное носительство ТТ-генотипа достоверно чаще встречается среди больных шизофренией, чем среди здорового контроля (OR 1,9 и OR 2,5 соответственно) [9, 10]. В скандинавской и китайской популяциях носительство T-аллеля приводит к более раннему началу шизофрении по сравнению с носителями дикого аллеля, поэтому, по мнению авторов, полиморфизм MTHFR С677T может играть роль фактора-модификатора возраста начала шизофрении [11].
Согласно метаанализу J.Muntjewerff и соавт. при наличии ТТ-генотипа вероятность заболевания шизофренией на 36% выше по сравнению с носителями СС-генотипа [12]. O.Peerbooms и соавт. в своем метаанализе также получили данные о том, что TT-генотип значимо чаще встречается среди пациентов с эндогенными психическими расстройствами (шизофренией, биполярным расстройством и эндогенной депрессией), чем в популяции здорового контроля [13]. Другие недавние метаанализы включают полиморфизм MTHFR 677TT в список 16 генов, которые являются генетическими факторами риска шизофрении.
И что наиболее важно, MTHFR находится в списке 4 генов, которые имеют «сильную степень эпидемиологической вероятности» в отношении шизофрении [14, 15].
Если в исследованиях учитываются несколько полиморфизмов в MTHFR и других генах, контролирующих ОУМ, то их суммарная связь с таким показателем, как выраженность негативной симптоматики при шизофрении, сильнее, чем у одного MTHFR C677T (J.Roffman и соавт., [16]). Причем влияние этих полиморфизмов на негативную симптоматику реализуется только при дефиците фолатов в плазме. Согласно авторам взаимоотношения между уровнем фолатов и выраженностью негативной симптоматики у пациентов с генетической уязвимостью биологически вполне убедительны и предполагают полезность аугментации фолатами у этих пациентов.
В корейском исследовании среди женщин, больных шизофренией, гипергомоцистеинемия отмечалась в 33,8% случаев, среди мужчин – в 51,5% [19], а низкий уровень фолатов сыворотки отмечался у 66,2% пациентов обоих полов. N.Petronijević и соавт. показали, что у пациентов при поступлении в стационар при экзацербации шизофрении уровень гомоцистеина значимо выше, чем в группе контроля, а уровень фолатов и кобаламина от контроля не отличается. Причем уровень гомоцистеина коррелировал с выраженностью негативной симптоматики. У всех пациентов через месяц лечения в период стабилизации состояния уровень гомоцистеина заметно снизился (2,68±1,57 мкмоль/л), но корреляция с выраженностью негативной симптоматики по-прежнему сохранялась (пациенты не получали витамины дополнительно к терапии) [20].
T.Kim и S.Moon (2011 г.) обнаружили отличия в гендерной представленности нарушений ОУМ: среди мужчин пациентов с гипергомоцистеинемией достоверно больше, чем среди женщин [21]. A.Sazci и соавт. также выявили, что мутантные аллели MTHFR 677T, генотипы T677T, C1298C и составные генотипы T677T/A1298A, C677C/C1298C достоверно чаще встречаются среди мужчин, больных шизофренией, по сравнению со здоровым контролем, у женщин же достоверной разницы между больными и здоровыми в представленности этих генотипов не обнаружено [21]. Похожие данные получили J.Levine и соавт.: в популяции больных шизофренией и биполярным расстройством уровень гомоцистеина оказался значительно выше, чем среди здорового контроля, и практически полностью за счет молодых пациентов-мужчин [22, 23]. Однако другие недавние исследования демонстрируют, что у больных шизофренией обоих полов уровень гомоцистеина плазмы выше, чем в контрольных группах здоровых [24].
Согласно E.Zintzaras (2006 г.) ассоциация дефекта гена MTHFR с шизофренией более выражена среди представителей монголоидной расы, чем европеоидной. Исследования, проведенные в Скандинавии, вообще не подтвердили связи между генотипом MTHFR и заболеваемостью шизофренией и биполярным расстройством [25]. Японские исследователи получили противоречивые результаты и сообщают, что требуются дальнейшие исследования в этой области [26]. Таким образом, имеются географические особенности рассматриваемых взаимодействий.
Можно было бы предположить, что шизофрения, ассоциированная с нарушениями ОУМ, имеет какие-то клинические психопатологические закономерности. Однако H.Mabrouk и соавт. (2011 г.) в специальном исследовании не обнаружили каких-либо клинических особенностей у больных шизофренией с гипергомоцистеинемией, за исключением отсутствия в семейном анамнезе психических расстройств, по сравнению с другими больными шизофренией [19]. Аналогичные результаты были получены T.Kim и S.Moon (2011 г.): каких-либо клинических отличий пациентов с гипергомоцистеинемией от пациентов с нормальным уровнем гомоцистеина обнаружено не было [21].
Вместе с тем J.Roffman и соавт. показали, что носительство T-аллеля MTHFR 677 ассоциировано с тяжестью негативной симптоматики при шизофрении [27, 28], а позитивная симптоматика у носителей этого аллеля менее выражена. У пациентов с MTHFR 677TT выраженность негативной симптоматики была обратно пропорциональна уровню фолатов плазмы [9]. J.Roffman и соавт. также продемонстрировали, что носительство Т-аллеля ассоциировано с выраженностью нарушений исполнительного функционирования при шизофрении [29].
Согласно R.Joober и соавт. Т-аллель и ТТ-генотип значимо чаще встречаются среди пациентов-респондеров к нейролептикам с хорошим прогнозом заболевания, а среди пациентов-нонреспондеров к нейролептикам встречаются не чаще, чем у здорового контроля [30]. Авторы заключают, что ген MTHFR вовлечен в патогенез разновидности шизофрении, отличающейся быстрым и устойчивым терапевтическим ответом на типичные нейролептики с хорошим долговременным прогнозом и благоприятным терапевтическим результатом.
Были получены данные о корреляции уровня гомоцистеина с выраженностью отдельных симптомов (враждебность, когнитивный дефицит). В популяции здоровых людей было проведено исследование, согласно которому уровень гомоцистеина плазмы положительно и значимо коррелирует с выраженностью враждебности (Cook-Medley hostility questionnaire) [31]. Кроме того, в разных популяциях (здоровые люди пожилого возраста, пациенты с сосудистыми заболеваниями головного мозга) была показана ассоциация уровня гомоцистеина плазмы с когнитивным дефицитом [32].
Необходимо заметить, что при гомоцистинурии (врожденном заболевании с тяжелой гипергомоцистеинемией) часто отмечается умственная отсталость, а психотические эпизоды отмечаются лишь у небольшой доли пациентов. Вероятно, это объясняется разницей в концентрации гомоцистеина: при шизофрении у пациентов выявляется умеренная гипергомоцистеинемия – до 100 ммоль/л, а при гомоцистинурии – более 100 ммоль/л.
Механизмы влияния нарушений ОУМ на этиопатогенетические процессы при шизофрении изучаются в нескольких направлениях. Наиболее часто в качестве ключевого патогенетического звена рассматривается гипергомоцистеинемия. К настоящему времени проведен целый ряд исследований, который демонстрирует нейротропную активность и нейротоксичность гомоцистеина. Уже в 1990-е годы было высказано предположение, что серосодержащие аминокислоты, к которым относятся гомоцистеин и его дериваты (легко образующиеся из гомоцистеина путем самоокисления), являются возбуждающими нейротрансмиттерами у млекопитающих, аналогичными глутамату [33].
S.Lipton и соавт. продемонстрировали, что гомоцистеин проявляет функции парциального антагониста глицинового сайта NMDA-рецепторов и, таким образом, обладает ингибирующим влиянием на глутаматергическую передачу в нормальных условиях (при нормальных концентрациях глицина) [34]. Это прямым образом соотносится с гипотезой NMDA-рецепторной гипофункции в качестве патогенетического фактора шизофрении [35]. Кроме того, авторы показали, что в условиях сосудистой катастрофы или травмы головного мозга, а также в концентрациях более 300–400 мкмоль гомоцистеин начинает действовать как агонист NMDA-рецепторов и начинает проявлять нейротоксические свойства. Требуются дальнейшие исследования, которые позволят понять, является ли анти-NMDA-рецепторная активность гомоцистеина клинически значимой у больных шизофренией.
Shi и соавт. обнаружили, что гомоцистеин и его дериваты, легко образующиеся в организме в процессе окисления, в высоких концентрациях избирательно и мощно модулируют активность метаботропных глутаматергических рецепторов и, таким образом, регулируют внутриклеточные процессы и нейротрансмиссию в головном мозге [36]. Сложность понимания процессов влияния гомоцистеина на метаботропные Glu-рецепторы заключается в том, что различные дериваты гомоцистеина по-разному (в плане избирательности и мощности) действуют на разные подтипы глутаматных метаботропных рецепторов. При этом известно, что различные типы метаботропных рецепторов (8 типов) по-разному влияют на активность NMDA-рецепторов. Поэтому к настоящему моменту можно считать доказанным, что гомоцистеин и его непосредственные метаболиты играют роль в модуляции активности глутаматергической системы головного мозга путем воздействия на метаботропные Glu-рецепторы, но каким именно образом это происходит и как именно это относится к патогенезу нервно-психических расстройств, пока остается неизученным [32]. Действительно, в отдельных исследованиях показано, что гомоцистеин нарушает нейрональный гомеостаз различными дивергентными путями [37].
В отношении гомоцистеина проведен ряд исследований, согласно которым он участвует в патогенезе нейродегенеративных заболеваний, в частности болезни Альцгеймера [38]. Учитывая, что теория нейродегенерации занимает весомое место в современном понимании патогенеза шизофрении [35], возможно, именно способность гомоцистеина вызывать нейродегенеративные процессы в головном мозге имеет отношение к патогенезу шизофрении. По результатам ряда исследований гомоцистеин запускает в нейроне ряд процессов, приводящих клетку к апоптозу. Величина и скорость эффекта в эксперименте зависела от концентрации гомоцистеина: при концентрации 250 мкмоль/л гомоцистеин вызывал апоптоз почти всех нейронов гиппокампа в культуре клеток in vitro в течение 28 ч, а при концентрации 0,5 мкмоль/л (что является нормой in vivo!) в том же эксперименте происходил отставленный апоптоз около 40% нейронов в течение 4–6 сут [39]. M.Linnebank и соавт. обнаружили, что гомоцистеин связывает ионы Cu2+, которые являются кофактором цитохром-С-оксидазы в митохондриях, что приводит к инактивации этого фермента, оксидативному стрессу и апоптотической гибели нейронов [40]. В культуре гранулярных нейронов мозжечка гомоцистеин (в дозе более 300 мкмоль/л в течение 16–22 ч) также вызывал гибель нейронов, опосредованную воздействием на NMDA-рецепторы и продукцией свободных радикалов [41].
В исследовании K.Imamura и соавт. была продемонстрирована дозозависимая токсичность гомоцистеина (0–50 ммоль/л) в отношении мезенцефальных дофаминергических нейронов в культуре клеток. Причем внутриклеточный дофамин усиливал цитотоксичность гомоцистеина.
В этом же эксперименте было показано, что изучаемые эффекты ассоциированы с оксидативным стрессом [42]. Эти результаты, безусловно, нельзя переносить на ситуацию in vivo хотя бы потому, что вряд ли могут нормальные концентрации гомоцистеина вызывать гибель нейронов (существуют данные о наличии in vivo протекторных веществ, таких как карнозин, параоксоназа-1, нейтрализующих действие гомоцистеина на нервную ткань [40, 43]). Тем не менее они демонстрируют наличие токсичности гомоцистеина в отношении нервной ткани. И если гомоцистеин в концентрациях более 100 мкмоль/л вызывает гибель нейрона через воздействие на NMDA-рецепторы, то в дозах менее 100 мкмоль/л воздействие на NMDA-рецепторы, возможно, имеет другие последствия, что требует дальнейшего изучения.
Кратковременное влияние гомоцистеина на когнитивные функции головного мозга изучалось на здоровых молодых добровольцах. Было показано, что статистически значимое повышение уровня гомоцистеина в течение суток, вызванное алиментарным путем, не вызывает когнитивных нарушений у обследованных [47]. Вероятно, нужны другие эксперименты с более длительными нарушениями ОУМ, вызванными другими способами, что вряд ли допустимо на человеке.
В исследовании на мышах было показано, что лишь
8-кратное повышение гомоцистеина крови, вызванное алиментарным путем к 5-му месяцу эксперимента, приводит к статистически значимым умеренным поведенческим дефектам, обнаруживаемым с помощью теста водного лабиринта Морриса (Morris Water Maze test) [23].
Помимо механизмов, опосредованных гипергомоцистеинемией, нарушения ОУМ могут оказывать влияние на развитие шизофрении из-за дефицита метионина и нарушения процессов метилирования. Так, согласно Roffman и соавт., носительство MTHFR 677 T-аллеля вовлечено в эпигенетические механизмы развития шизофрении, такие как метилирование ДНК и ремоделирование хроматина. Эти механизмы, в частности, приводят к нарушению у носителей TT-генотипа способности учиться на собственных ошибках и препятствуют формированию гибкого, адаптивного поведения (морфологическим субстратом является передняя поясная кора) [48].
Негативное влияние дефицита фолатов на нейрохимию при шизофрении может быть опосредовано недостаточным синтезом глицина из серина, так как в этом процессе фолаты играют роль донора метильной группы [49].
Производное метионина – S-аденозилметионин (SAM) является донором метильной группы в процессах синтеза дофамина, норадреналина и серотонина [46], поэтому Spiro и соавт. предположили, что именно дефицит метионина вовлечен в патогенез шизофрении у ряда пациентов [50]. Затем они обнаружили в собственном исследовании, что дополнительный прием метионина пациентами с шизофренией приводит к аггравации симптомов заболевания [51]. Назначение другого метильного донора, бетаина, также приводило к аггравации симптомов шизофрении [52].
В настоящее время, зная отдельные особенности ОУМ и нейрохимии шизофрении, с некоторой осторожностью можно предположить, что прием извне дополнительного метионина приводит к увеличению синтеза дофамина и усилению дофаминовой нейротрансмиссии в мезолимбической системе, что приводит к нарастанию продукции. Кроме того, при добавлении извне метионина увеличивается концентрация его непосредственного продукта переработки – гомоцистеина, и патологическое влияние последнего тоже усиливается.
В генетических исследованиях показано, что генетические полиморфизмы MTHFR и COMT действуют синергически в отношении нарушений исполнительного функционирования (Wisconsin Card Sorting Task, WCST) у больных шизофренией. Аллели MTHFR T и COMT Val оказывают кумулятивный эффект на внутриклеточный профиль метилирования и префронтальную дофаминовую трансмиссию, что взаимно усиливает эффект на персеверативные ошибки в WCST [53]. Аналогичные результаты о синергичном взаимодействии генетических аллелей MTHFR T и COMT Val получены в отношении нарушений рабочей памяти, которые также являются результатом нарушения дофаминовой трансмиссии в префронтальной коре. Объяснить эти результаты авторы могут пока гипотетически. Так, возможно, T-аллель приводит к гипометилированию гена-промоутера COMT, что в свою очередь приводит к усилению экспрессии COMT и нарушениям дофаминовой передачи в дорсолатеральной префронтальной коре [54].
Если описанные выше результаты исследований справедливы в отношении этиопатогенеза шизофрении, то прямым выводом будет необходимость более пристального внимания к нарушениям ОУМ при шизофрении и аугментации фолатами психофармакотерапии шизофрении при наличии у пациента гипергомоцистеинемии, так как дополнительный прием фолатов компенсирует нарушения ОУМ даже при наличии генетического полиморфизма MTHFR 677TT. Клинических исследований по этой теме к настоящему времени проведено мало, однако их результаты внушают оптимизм.
Впервые в 1975 г. Mudd и соавт. доложили, что у 1 из 3 пациентов с шизофренией с дефектом фермента MTHFR в результате приема фолатов улучшается состояние [55].
В 1997 г. B.Regland и соавт. показали, что у пациентов с шизофренией гипергомоцистеинемия, ассоциированная с носительством TT-генотипа, хорошо купируется фолатами (и не купируется витамином В12) [4].
В двойном слепом плацебо-контролируемом исследовании Godfrey и соавт. стандартная психотропная терапия успешно дополнялась метилфолатом (15 мг) в течение
6 мес: значительно ускорялось клиническое и социальное выздоровление по сравнению с плацебо, причем с течением времени различия с плацебо увеличивались (n=41) [56].
M.Hill и соавт. в двойном слепом плацебо-контролируемом исследовании назначения фолатов (2 мг/сут) амбулаторным пациентам с шизофренией показали, что дополнение терапии фолатами во всей выборке не оказывает значимого эффекта на негативную симптоматику. Однако у тех пациентов, кто был носителем хотя бы одного Т-аллеля MTHFR, терапия фолатами позволила добиться значимых изменений негативной симптоматики, причем этот эффект был опосредован нарастанием уровня фолатов плазмы у этих больных. Однако выборка данного исследования (n=28) позволяет лишь сказать, что требуются дальнейшие работы в этом направлении [57].
J.Levine и соавт. назначали 42 пациентам с шизофренией, у которых уровень гомоцистеина был выше 15 мкмоль/л, витамины группы В: фолиевую кислоту, пиридоксин и витамин В12 (двойное слепое рандомизированное плацебо-контролируемое исследование). Пациенты, получавшие витамины, через 3 мес продемонстрировали значительное улучшение состояния по сравнению с группой плацебо (PANSS, WCS и другие нейропсихологические тесты) [58].
Таким образом, к настоящему времени получено большое количество доказательств наличия нарушений ОУМ среди больных шизофренией, намечены основные перспективы для изучения патогенетических взаимоотношений между нарушениями ОУМ и шизофренией и даже получены отдельные разрозненные данные об эффективности аугментации фолатами терапии больных шизофренией. Все это говорит о необходимости дальнейших целенаправленных исследований, как клинических, так и нейрохимических. Гипотетически правильно разработанная система аугментации фолатами может не только повысить эффективность психофармакотерапии больных шизофренией и таким образом снизить затраты на лечение и реабилитацию больных (S.Gilbody и соавт., 2007) [6], но и может способствовать профилактике шизофрении в отдельных группах риска (S.Zammit и соавт., 2007) [59].
Исходя из полученных к настоящему времени сведений, представляется целесообразным проведение отбора среди больных шизофренией пациентов с нарушениями ОУМ, для того чтобы оптимизировать их лечение и нивелировать влияние дефицита фолатов на негативную и когнитивную симптоматику при шизофрении. Поскольку биохимические лабораторные тесты выявления гипергомоцистеинемии, гипофолатемии и генетических полиморфизмов достаточно дорогостоящи и не всегда доступны в практической психиатрии, возможно, было бы полезно разработать скрининговый тест-опросник на предмет выявления признаков нарушений ОУМ у пациента. Учитывая имеющиеся в литературе сведения, приведенные выше, при выявлении больных шизофренией с нарушениями ОУМ необходимо обратить внимание на пациентов-мужчин с выраженными негативными и когнитивными симптомами, но без яркой продуктивной симптоматики (что наиболее соответствует простой форме шизофрении). Кроме того, важную информацию могут дать сведения о наличии коморбидных расстройств, ассоциированных с нарушениями ОУМ, у пациента и его ближайших родственников. В дальнейшем также необходимо изучить гендерные и географические особенности применительно к российской популяции больных шизофренией. Наконец, аугментация фолатами требует разработки адекватной схемы дозирования и длительности применения фолатов у пациентов и в группах риска.
Сведения об авторе
Жиляева Татьяна Владимировна – канд. мед. наук, ассистент каф. психиатрии и медицинской психологии ГБОУ ВПО
Нижегородская государственная медицинская академия Минздрава РФ. E-mail: bizet@inbox.ru
Список исп. литературыСкрыть список1. Тиганов A.C., Снежневский А.В., Орловская Д.Д. и др. Руководство по психиатрии. В 2 т. Т. 1. Под ред. А.С.Тиганова. М.: Медицина, 1999; с. 514–5.
2. Sunden SL, Renduchintala MS, Park EI et al. Betaine-homocysteine methyltransferase expression in porcine and human tissues and chromosomal localization of the human gene. Arch Biochem Biophys 1997; 345 (1): 171–4.
3. Muntjewerff JW, Blom HJ. Aberrant folate status in schizophrenic patients: what is the evidence? Prog Neuropsychopharmacol Biol Psychiat 2005; 29 (7): 1133–9.
4. Zintzaras E. C677T and A1298C methylenetetrahydrofolate reductase gene polymorphisms in schizophrenia, bipolar disorder and depression: a meta-analysis of genetic association studies. Psychiat Gen 2006; 16 (3): 105–15.
5. Muntjewerff JW, Kahn RS, Blom HJ, den Heijer M. Homocysteine, methylenetetrahydrofolate reductase and risk of schizophrenia: a meta-analysis. Mol Psychiat 2006; 11 (2): 143–9.
6. Gilbody S, Lewis S, Lightfoot T. Methylenetetrahydrofolate reductase (MTHFR) genetic polymorphisms and psychiatric disorders: a HuGE review. Am J Epid 2007; 165: 1–13.
7. Regland B, Germgård T, Gottfries CG et al. Homozygous thermolabile methylenetetrahydrofolate reductase in schizophrenia-like psychosis. J Neural Transm 1997; 104 (8–9): 931–41.
8. Tan EC, Chong SA, Lim LC et al. Genetic analysis of the thermolabile methylenetetrahydrofolate reductase variant in schizophrenia and mood disorders. Psychiat Gen 2004; 14 (4): 227–31.
9. Arinami T, Yamada N, Yamakawa-Kobayashi K et al. Methylenetetrahydrofolate reductase variant and schizophrenia/depression. Am J Med Gen 1997; 74 (5): 526–8.
10. Sazci A, Ergül E, Güzelhan Y et al. Methylenetetrahydrofolate reductase gene polymorphisms in patients with schizophrenia. Brain Res Mol Brain Res 2003; 117 (1): 104–7.
11. Vares M, Saetre P, Deng H et al. Association between methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism and age of onset in schizophrenia. Am J Med Gen B Neuropsychiat Gen 2009.
12. Muntjewerff J, Kahn R, Blom H, den Heijer M. Homocysteine, methylenetetrahydrofolate reductase and risk of schizophrenia: a meta-analysis secular. Psychiat 2006; 11: 143–9.
13. Peerbooms OL, van Os J, Drukker M et al. Meta-analysis of MTHFR gene variants in schizophrenia, bipolar disorder and unipolar depressive disorder: evidence for a common genetic vulnerability? Brain Behav Immun 2011; 25 (8): 1530–43.
14. Allen NC, Bagade S, McQueen MB et al. Systematic meta-analyses and field synopsis of genetic association studies in schizophrenia: the SzGene database. Nature 2008; 40: 827–34.
15. Maarten van den buuse modeling the positive symptoms of schizophrenia in genetically modified mice: pharmacology and methodology aspects. Schizophr Bull 2010; 36 (2): 246–70.
16. Roffman JL, Brohawn DG, Nitenson AZ et al. Genetic variation throughout the folate metabolic pathway influences negative symptom severity in schizophrenia. Schizophr Bull 2011.
17. Regland B, Johansson BV, Grenfeldt B et al. Homocysteinemia is a common feature of schizophrenia. J Neural Transm Gen Sect 1995; 100 (2): 165–9.
18. Mabrouk H, Douki W, Mechri A et al. Hyperhomocysteinemia and schizophrenia: case control study. Hyperhomocysteinemia and schizophrenia: case control study. Encephale 2011; 37 (4): 308–13.
19. Kim TH, Moon SW. Serum homocysteine and folate levels in Korean schizophrenic patients. Psychiat Invest 2011; 8 (2): 134–40.
20. Petronijević ND, Radonjić NV, Ivković MD et al. Plasma homocysteine levels in young male patients in the exacerbation and remission phase of schizophrenia. Prog Neuropsychopharmacol Biol Psychiat 2008; 32 (8): 1921–6.
21. Sazci A, Ergul E, Kucukali I et al. Association of the C677T and A1298C polymorphisms of methylenetetrahydrofolate reductase gene with schizophrenia: association is significant in men but not in women. Prog Neuropsychopharmacol Biol Psychiat 2005; 29 (7): 1113–23.
22. Levine J, Sela BA, Osher Y, Belmaker RH. High homocysteine serum levels in young male schizophrenia and bipolar patients and in an animal model. Prog Neuropsychopharmacol Biol Psychiat 2005; 29 (7): 1181–91.
23. Applebaum J, Shimon H, Sela BA et al. Homocysteine levels in newly admitted schizophrenic patients. J Psychiat Res 2004; 38 (4): 413–6.
24. Haidemenos A, Kontis D, Gazi A et al. Plasma homocysteine, folate and B12 in chronic schizophrenia. Prog Neuropsychopharmacol Biol Psychiat 2007; 31 (6): 1289–96.
25. Jönsson EG, Larsson K, Vares M et al. Two methylenetetrahydrofolate reductase gene (MTHFR) polymorphisms, schizophrenia and bipolar disorder: an association study. Am J Med Gen B Neuropsychiat Gen 2008; 147 (6): 976–82.
26. Yoshimi A, Aleksic B, Kawamura Y et al. Gene-wide association study between the methylenetetrahydrofolate reductase gene (MTHFR) and schizophrenia in the Japanese population, with an updated meta-analysis on currently available data. Schizophr Res 2010.
27. Roffman JL, Weiss AP, Purcell S et al. Contribution of methylenetetrahydrofolate reductase (MTHFR) polymorphisms to negative symptoms in schizophrenia. Biol Psychiat 2008; 63 (1): 42–8.
28. Roffman JL, Brohawn DG, Friedman JS et al. MTHFR 677C>T effects on anterior cingulate structure and function during response monitoring in schizophrenia: a preliminary study. Brain Imag Behav 2011; 5 (1): 65–75.
29. Roffman JL, Weiss AP, Deckersbach T et al. Effects of the methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism on executive function in schizophrenia. Schizophr Res 2007; 92 (1–3): 181–8.
30. Joober R, Benkelfat C, Lal S et al. Association between the methylenetetrahydrofolate reductase 677C>T missense mutation and schizophrenia. Mol Psychiat 2000; 5 (3): 323–6.
31. Stoney CM, Engebretson TO. Plasma homocysteine concentrations are positively associated with hostility and anger. Life Sci 2000; 66 (23): 2267–75.
32. Tucker KL, Qiao N, Scott T et al. High homocysteine and low B vitamins predict cognitive decline in aging men: the veterans affairs normative aging study. Am J Clin Nutr 2005; 82 (3): 627–35.
33. Thompson GA, Kilpatrick IC. The neurotransmitter candidature of sulphur-containing excitatory amino acids in the mammalian central nervous system. Pharmacol Ther 1996; 72: 25–36.
34. Lipton SA, Kim WK, Choi YB et al. Neurotoxicity associated with dual actions of homocysteine at the N-methyl-d-aspartate receptor. Proc Natl Acad Sci USA 1997; 94 (11): 5923–8.
35. Stahl SM. Stahl’s essential psychopharmacology: neuroscientific basis and practical applications 2008; p. 287–98.
36. Shi Q, Savage JE, Hufeisen SJ et al. l-Homocysteine sulfinic acid and other acidic homocysteine derivatives are potent and selective metabotropic glutamate receptor agonists. J Pharmacol Exp Ther 2003; 305: 131–42.
37. Ho PI, Ortiz D, Rogers E, Shea TB. Multiple aspects of homocysteine neurotoxicity: glutamate excitotoxicity, kinase hyperactivation and DNA damage. J Neurosci Res 2002; 70 (5): 694–702.
38. Ho PI, Ashline D, Dhitavat S et al. Folate deprivation induces neurodegeneration: roles of oxidative stress and increased homocysteine. Neurobiol Dis 2003; 14 (1): 32–42.
39. Kruman II, Culmsee C, Sic L et al. Mattson homocysteine elicits a DNA damage response in neurons that promotes apoptosis and hypersensitivity to excitotoxicity. J Neuroscience 2000; 20 (18): 6920–6.
40. Linnebank M, Lutz H, Jarre E et al. Binding of copper is a mechanism of homocysteine toxicity leading to COX deficiency and apoptosis in primary neurons, PC12 and SHSY-5Y cells. Neurobiol Dis 2006; 23 (3): 725–30.
41. Kim WK, Pae YS. Involvement of N-methyl-d-aspartate receptor and free radical in homocysteine-mediated toxicity on rat cerebellar granule cells in culture. Neurosci Lett 1996; 216 (2): 117–20.
42. Imamura K, Takeshima T, Nakaso K, Nakashima K. Homocysteine is toxic for dopaminergic neurons in primary mesencephalic culture. Neuroreport 2007; 18 (13): 1319–22.
43. Borowczyk K, Shih DM, Jakubowski H. Metabolism and neurotoxicity of homocysteine thiolactone in mice: evidence for a protective role of paraoxonase. J Alzheimers Dis 2012; 30 (2): 225–31.
44. Görtz P, Hoinkes A, Fleischer W et al. Implications for hyperhomocysteinemia: not homocysteine but its oxidized forms strongly inhibit neuronal network activity. J Neurol Sci 2004; 218 (1–2): 109–14.
45. Арзуманян Е.С., Степанова М.С. Механизмы токсического действия гомоцистеиновой кислоты на нейрональные клетки. Нейрохимия. 2010; 27 (3): 251–6.
46. Boldyrev AA. Molecular mechanisms of homocysteine toxicity. Biochemist (Mosc) 2009; 74 (6): 589–98.
47. Alexopoulos P, Lehrl S, Richter-Schmidinger T et al. Short-term influence of elevation of plasma homocysteine levels on cognitive function in young healthy adults. J Nutr Health Aging 2010; 14 (4): 283–7.
48. Roffman JL, Nitenson AZ, Agam Y et al. Hypomethylating variant of MTHFR, 677C>T, blunts the neural response to errors in patients with schizophrenia and healthy individuals. PLoS One 2011; 6 (9): e25 253.
49. Goff DC, Bottiglieri T, Arning E et al. Homocysteine and negative symptoms in schizophrenia. Am J Psychiat 2004; 161: 1705–8.
50. Spiro HR, Schimke RN, Welch JP. Schizophrenia in a patient with a defect in methionine metabolism. J Nerv Ment Dis 1965; 141: 285–90.
51. Cohen SM, Nichols A, Wyatt R, Pollin W. The administration of methionine to schizophrenic patients: a review of ten studies. Biol Psychiat 1974; 8: 209–25.
52. Brune GG, Himwich HE. Effects of methionine loading on behavior of schizophrenic patients. J Nerv Ment Dis 1962; 134: 447–50.
53. Roffman JL, Weiss AP, Deckersbach T et al. Interactive effects of COMT Val108/158 Met and MTHFR C677T on executive function in schizophrenia. Am J Med Gen B Neuropsychiat Gen 2008; 147 (6): 990–5.
54. Roffman JL, Gollub RL, Calhoun VD et al. MTHFR 677C>T genotype disrupts prefrontal function in schizophrenia through an interaction with COMT 158Val>Met Proc Natl Acad Sci USA 2008; 105 (45): 17 573–8.
55. Mudd SH, Freeman JM. N-5,10-methylenetetrahydrofolate reductase deficiency and schizophrenia: a working hypothesis. J Psychiat Res 1974; 11: 259–62.
56. Godfrey PS, Toone BK, Carney MW et al. Enhancement of recovery from psychiatric illness by methylfolate. Lancet 1990; 336: 392–5.
57. Hill M, Shannahan K, Jasinski S et al. Folate supplementation in schizophrenia: a possible role for MTHFR genotype. Schizophr Res 2011.
58. Levine J, Stahl Z, Sela BA et al. Homocysteine-reducing strategies improve symptoms in chronic schizophrenic patients with hyperhomocysteinemia. Biol Psychiat 2006; 60 (3): 265–9.
59. Zammit S, Lewis S, Gunnell D, Smith GD. Schizophrenia and neural tube defects: comparisons from an epidemiological perspective. Schizophr Bull 2007; 33 (4): 853–8.

