Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2020
Тестостерон и его роль при депрессии. Обзор литературы №01 2020
Номера страниц в выпуске:28-35
Аннотация
В статье проводится обзор литературы о роли тестостерона в регуляции аффективной сферы и его вовлеченности в механизмы формирования депрессии. Подробно рассматривается проблема гипогонадизма и его возможная роль как этиологического фактора в развитии депрессии и у мужчин, и у женщин. Отдельный раздел посвящен методам терапии, в том числе заместительной терапии тестостероном, депрессий, вызванных сниженным уровнем тестостерона.
Ключевые слова: депрессия, тестостерон, гендерные особенности, гипогонадизм.
Для цитирования: Осадший Ю.Ю., Солдаткин В.А., Крючкова М.Н. и др. Тестостерон и его роль при депрессии. Обзор литературы. Психиатрия и психофармакотерапия. 2020; 22 (1): 28–35.
В статье проводится обзор литературы о роли тестостерона в регуляции аффективной сферы и его вовлеченности в механизмы формирования депрессии. Подробно рассматривается проблема гипогонадизма и его возможная роль как этиологического фактора в развитии депрессии и у мужчин, и у женщин. Отдельный раздел посвящен методам терапии, в том числе заместительной терапии тестостероном, депрессий, вызванных сниженным уровнем тестостерона.
Ключевые слова: депрессия, тестостерон, гендерные особенности, гипогонадизм.
Для цитирования: Осадший Ю.Ю., Солдаткин В.А., Крючкова М.Н. и др. Тестостерон и его роль при депрессии. Обзор литературы. Психиатрия и психофармакотерапия. 2020; 22 (1): 28–35.
Аннотация
В статье проводится обзор литературы о роли тестостерона в регуляции аффективной сферы и его вовлеченности в механизмы формирования депрессии. Подробно рассматривается проблема гипогонадизма и его возможная роль как этиологического фактора в развитии депрессии и у мужчин, и у женщин. Отдельный раздел посвящен методам терапии, в том числе заместительной терапии тестостероном, депрессий, вызванных сниженным уровнем тестостерона.
Ключевые слова: депрессия, тестостерон, гендерные особенности, гипогонадизм.
Для цитирования: Осадший Ю.Ю., Солдаткин В.А., Крючкова М.Н. и др. Тестостерон и его роль при депрессии. Обзор литературы. Психиатрия и психофармакотерапия. 2020; 22 (1): 28–35.
1Rostov State Medical University, Rostov-on-Don, Russia;
2Volgograd State Medical University, Volgograd, Russia;
3Volgograd State Psychiatry Hospital №2, Volgograd, Russia
Abstract
The article provides an literature review of the role of testosterone in the regulation of the emotions and its involvement in the mechanism of depression. The problems of hypogonadism and its possible role as an etiological factor in the development of depression in both men and women are available in detail. Then we discusses the methods of treating depression caused by a decrease in testosterone levels, including testosterone replacement therapy.
Key words: depression, testosterone, gender differences, hypogonadism, low “T”.
For citation: Osadshiy Y.Y., Soldatkin V.A., Kryuchkova M.N. et al. Testosterone and its role in depression. Literature review. Psychiatry and Psychopharmacotherapy. 2020; 22 (1): 28-35.
Изучение депрессии в течение последних лет позволило обнаружить множество особенностей и различий течения заболевания в зависимости от разнообразных факторов [2]. Одним из факторов, который может повлиять на клинику, лечение и профилактику мужской депрессии, бесспорно, является состояние эндокринной системы мужчины и в частности уровень тестостерона [3], снижение которого сопровождается целым комплексом различных симптомов. Принимая во внимание разнообразность проявлений снижения уровня тестостерона, пациенты могут обращаться к различным специалистам – урологам, эндокринологам, кардиологам и психиатрам.
Учитывая, что проявления депрессии относятся к неспецифическим симптомам дефицита тестостерона, внимания среди урологов и эндокринологов этим симптомам зачастую уделяется меньше, что приводит к акценту в терапии именно на коррекции сексуальной дисфункции и метаболических нарушений без определения природы расстройств настроения. В то же время снижение либидо и эректильная дисфункция являются возможными симптомами депрессии как самостоятельной нозологии. Но это необязательный симптом депрессии, и врачами-психиатрами он также не рассматривается детально, что приводит к смещению акцентов в терапии на коррекцию настроения без учета возможного дефицита тестостерона как этиологического фактора.
Целью настоящего обзора является попытка систематизировать научные данные о возможной роли тестостерона в проблеме депрессий, его влиянии на клиническую картину и возможные терапевтические алгоритмы.
Учитывая, что различия в распространенности депрессии в большинстве случаев не обнаруживаются до подросткового возраста, исследователи предполагают, что это может быть объяснено отличиями в работе эндокринной системы мужчины и женщины, придавая большое значение тестостерону [10, 11].
Тестостерон – это стероидный гормон, относящийся к группе андрогенов [12], один из основных мужских гормонов.
Андрогены для мужчин имеют большое значение для развития и поддержания сексуальной и репродуктивной функций. Они влияют на активность простаты, придатков яичек и полового члена. Андрогены участвуют в формировании вторичных половых признаков и мужского фенотипа. Они необходимы для развития мышечной массы, строения тела, минерализации костей, метаболизма жировой ткани, увеличения мышечной силы, роста волос [13].
Тестостерон является главным и основным циркулирующим андрогеном в сыворотке крови, более 95% которого секретируется клетками Лейдига в тестикулах, а 5% – клетками сетчатой зоны коры надпочечников, клетками предстательной железы и головного мозга. В общей сложности в сутки синтезируется примерно 5–10 мг тестостерона [14, 15].
Общий тестостерон крови делится на 3 вида: тестостерон свободный (1–4% от общего), тестостерон, соединенный с глобулином, связывающим половые гормоны – ГСПГ (60–70%), и тестостерон, связанный с альбумином (слабосвязанный тестостерон, 25–40%). Свободная и слабосвязанная формы – это биодоступный тестостерон, т. е. обладающий биологической активностью. Связанный тестостерон, в свою очередь, не является активным.
Уровень свободного тестостерона не зависит от изменений концентрации ГСПГ. Поэтому, если ГСПГ повышен (при гипертиреоидизме, циррозе, приеме пероральных контрацептивов и противоэпилептических средств, гиперэстрогенных состояниях, в том числе беременности) или снижен (при гипотиреоидизме, ожирении, избытке андрогенов, нефритическом синдроме), тест на свободный тестостерон будет более информативным, чем на общий.
Андрогеновые и эстрогеновые рецепторы присутствуют практически во всем организме человека. И поэтому не удивительно, что дефицит тестостерона у мужчин связан со многими симптомами и проявляется не только снижением либидо и эректильной дисфункцией, но и остеопорозом, снижением мышечной силы, утомляемостью, нарушением сна, раздражительностью и депрессией [12].
Само понятие «гипогонадизм» у мужчин (снижение уровня тестостерона) описано более 100 лет назад [16] и сначала рассматривалось как симптомокомплекс, возникающий в результате нарушения работы гипоталамуса и гипофиза, например опухолей или травм. В последнее время такие формы гипогонадизма (с однозначной этиологией) получили название «классических». Однако распространенность подобных форм незначительна.
В то же время исследования последних лет выявили, что после 30–40 лет у мужчин уровень сывороточного тестостерона ежегодно снижается на 0,4–2% [17], приводя цифры распространенности дефицита тестостерона у мужчин старше 45 лет до 40% [18].
Объяснить снижение уровня тестостерона, происходящее с возрастом, возможно морфологическими изменениями в тестикулах. С возрастом обнаруживается почти двукратное снижение клеток Сертоли и Лейдига, также происходит повышение концентрации полового гормона, связывающего глобулин, что снижает соотношение свободного тестостерона даже больше, чем уровень общего тестостерона [19].
В дополнение к независимым возрастным факторам уровень тестостерона снижается при ряде возрастных состояний, включая увеличение массы тела, диабет, гипертензию, почечную и печеночную недостаточность, хроническую обструктивную болезнь легких. Повышение индекса массы тела (ИМТ) имеет даже более выраженный эффект на уровень тестостерона, чем возраст. Например, мужчины с ИМТ > 30 кг/м2 имеют показатели тестостерона в среднем на 30% ниже, чем мужчины с ИМТ < 25 кг/м2 [19].
Следует помнить, что основой диагностики являются лабораторные показатели тестостерона. И хотя существуют различные нормативные значения, большинство медицинских сообществ разных стран придерживаются единого мнения, а именно: средний показатель уровня общего тестостерона должен составлять более 12,1 нмоль/л, а свободного – 243 пмоль/л. К сожалению, методы оценки свободного тестостерона, используемые в широкой клинической практике, малодостоверны. Поэтому рекомендовано определение лабораторных показателей общего тестостерона, ГСПГ и альбумина с последующим расчетом свободного тестостерона по соответствующим формулам. В некоторых рекомендациях предлагается проведение исследования ГСПГ и альбумина только при показателях общего тестостерона менее 12,1 нмоль/л, в то время как ряд специалистов говорят о необходимости учитывать эти показатели даже при нормативных значениях тестостерона, особенно в группе пожилых пациентов [12, 20].
Однако сами симптомы снижения уровня тестостерона не являются специфическими, поэтому зачастую возникают трудности в первичной клинической диагностике. Урологами и эндокринологами предлагается следующая классификация симптомов гипогонадизма (см. таблицу) [20].
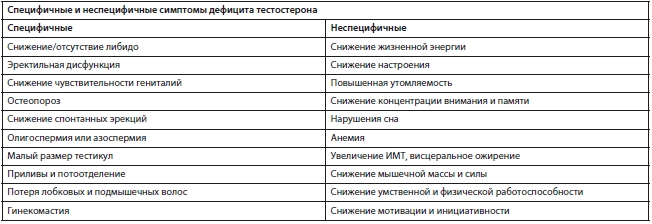
Следует обратить внимание, что симптомы, чаще проявляющиеся во время депрессии (снижение настроения, энергетического потенциала, утомляемость, нарушения сна, когнитивные нарушения, апатия и т. д.), относятся к неспецифическим симптомам дефицита тестостерона и не рассматриваются врачами-урологами как симптомы, требующие дополнительной консультации психиатра. А врачи-психиатры чаще всего не направляют на дополнительную диагностику к эндокринологу или урологу при наличии у пациента депрессии и снижении либидо. При этом современные антидепрессанты могут снижать уровень тестостерона и еще в большей степени нарушать сексуальную функцию [21, 22], а недостаточная коррекция нарушений настроения может мешать урологам в нормализации сексуальной функции. Все это приводит к снижению качества оказания медицинской помощи мужчинам как со стороны психиатров, так и со стороны урологов и эндокринологов.
Имеющиеся исследования показывают значимую взаимосвязь депрессии и уровня тестостерона. Так, большинство данных свидетельствовало об увеличении риска развития депрессии у пациентов со сниженным уровнем тестостерона [25, 26]. Однако в них остается некоторая неопределенность. Например, ряд авторов указывают на взаимосвязь низкого уровня тестостерона только с отдельными подтипами депрессий. Так, пациенты с атипичной депрессией продемонстрировали более низкие показатели тестостерона по сравнению с пациентами, страдающими меланхолической депрессией [27]. Не существует и единого мнения относительно того, какие именно показатели тестостерона следует оценивать. Например, A. Ford и соавт. обнаружили, что низкий уровень общего тестостерона связан с более высоким риском развития депрессии, причем эти различия сохранялись после поправок на возраст и коморбидную патологию, а увеличение риска депрессии сохранялось в течение 9,4 года, однако уровень дигидротестостерона или количество свободного тестостерона такой взаимосвязи не показали [28]. В то время как другие авторы сообщают об изменениях при депрессии уровня как раз свободного тестостерона [29].
Влияние тестостерона на различные аспекты настроения достоверно подтверждено, но механизм действия до конца не изучен. Не исключено, что некоторые симптомы депрессии (например, снижение сексуальной и физической активности) могут приводить к снижению тестостерона [30], но в большей степени снижение тестостерона может быть связано с изменениями активности гипоталамо-гипофизарно-надпочечниковой системы в результате депрессии [31]. Однако известно, что сами стероидные гормоны оказывают модулирующее влияние на нейротрансмиттеры и ассоциированные рецепторы, вовлеченные в патофизиологию депрессивного расстройства. Так, тестостерон оказывает влияние на дофамин, увеличивая его выброс в мезолимбической системе, полосатом теле и прилежащем ядре [31], также назначение тестостерона увеличивает плотность доступных для связывания серотониновых рецепторов [32]. При этом пациенты, принимающие антидепрессанты из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) для терапии депрессии, имели в слюне выше уровень тестостерона, в сравнении с пациентами, не принимающими препараты данной группы [33]. Возможное влияние тестостерона на механизмы депрессии также продемонстрировано на пациентах-трансгендерах. Так, выявлено увеличение способности связывания серотониновых рецепторов у трансгендеров уже через 1 мес. после начала заместительной терапии тестостероном, в то время как антиандрогеновая терапия снижала этот показатель [32].
Тестостерон также обладает анксиолитическим воздействием через систему g-аминомаслянной кислоты (ГАМК), назначение антагонистов ГАМК-А блокирует анксиолитический эффект тестостерона, указывая на его схожее с бензодиазепинами влияние на эту систему. Кроме этого, антидепрессивный и противотревожный эффект тестостерона и его активного метаболита эстрадиола объясняется их действиями в области зубчатой извилины и изменением экспрессии генов и синаптической пластичности в гиппокампальной области, которая демонстрирует одно из ключевых значений при тревоге, депрессии и стрессиндуцированных расстройствах [34]. Следует обратить внимание, что основная локализация нейростероидогенеза с нейроанатомической перспективы расположена в области коры, амигдалы и гиппокампа [4], также фМРТ-исследования указывают на то, что именно гиппокамп и амигдала являются ключевыми областями активности тестостерона во время эмоциональной и социальной стимуляции [35]. И именно эти зоны в последнее время считаются наиболее важными в механизмах эмоционального регулирования, возникновении тревоги, депрессии и реакции на стресс.
M. Shores и соавт. проанализировали данные 278 мужчин старше 45 лет без случаев диагностированной депрессии. Наблюдение в течение 2 лет показало, что у мужчин с уровнем тестостерона ниже 280 нг/дл количество эпизодов депрессии было выше по сравнению с теми, у кого уровень тестостерона превышал эти значения. Риск развития депрессии зависел от уровня тестостерона, и чем ниже были показатели тестостерона, тем выше был риск развития депрессии. Так, при показателях тестостерона менее 150 нг/дл риск депрессии составлял 30%. Эти данные сохранялись при поправке на рак предстательной железы, другие медицинские состояния, национальность и уровень сексуальной дисфункции [36, 37].
В 2016 г. A. Ford и соавт. опубликовали большое проспективное исследование, целью которого также было исследование связи уровня тестостерона и депрессий. Исследование включало пациентов только с впервые выявленным депрессивным эпизодом. По результатам 9-летних наблюдений риск развития депрессии у мужчин со сниженным уровнем тестостерона в начале исследования был почти в 2 раза выше, чем у пациентов с нормальными показателями. Эти показатели также не изменились при поправке на образ жизни, возраст и медицинскую коморбидность [28].
В другом исследовании у мужчин, получавших андрогендепривационную терапию при раке простаты, показана взаимосвязь уровня тестостерона и расстройств настроения. Такие пациенты имели выше риск развития не только депрессивных, но и тревожных расстройств по сравнению с пациентами, которым не проводилась терапия, направленная на снижение уровня андрогенов [38]. Эти данные подтвердили и в более поздних эпидемиологических исследованиях, которые продемонстрировали увеличение риска развития депрессивных симптомов, диагноза «депрессия» и получения терапии антидепрессантами у пациентов, получающих андрогендепривационную терапию [39, 40].
Крупный многонациональный проект (n = 3369, мужчины в возрасте от 40 до 79 лет), цель которого – определение и оценка симптомов, нарушений функций и биохимических изменений, ассоциированных со старением (The European Male Aging Study), также продемонстрировал, что депрессия, нарушение сексуальных функций, снижение повседневной активности и слабость были существенно взаимосвязаны с уровнем тестостерона. Снижение уровня общего тестостерона ниже 160 пмоль/л было ассоциировано со сниженным настроением и слабостью. В то время как снижение уровня свободного тестостерона больше ассоциировалось с нарушением сексуальной функции и повседневной активностью [41].
Несмотря на то что 17% мужчин старше 40 лет в этом исследовании имели биохимические показатели уровня тестостерона ниже референсных значений, только 2,1% имели 3 симптома сексуальной дисфункции и соответствовали критериям гипогонадизма. Большинство же пациентов с пограничным значением или сниженным уровнем тестостерона не демонстрировали какой-либо симптоматики. При этом некоторые авторы вводят отдельный термин «функциональный гипогонадизм» для обозначения синдрома андрогенного дефицита и снижения уровня тестостерона при отсутствии врожденных или структурных нарушений в гипоталамо-гипофизарной оси [42].
Таким образом, тестостерон может служить естественной защитой мужчин от депрессивных расстройств, однако при его снижении эта защита теряется, что может приводить к увеличению риска развития депрессии, которая может потребовать заместительной терапии тестостероном.
В экспериментах на животных инъекции дегидротестостерона самкам крыс снижали уровень тревоги и улучшали выполнение некоторых экспериментальных заданий [43, 44], также положительно влияя на паттерны депрессивного поведения, показывая схожий эффект с флуоксетином [45].
Однако не все исследования на животных показывают подобное гендерное положительное влияние тестостерона. N. Carrier и M. Kabbaj (2012 г.) в своем исследовании использовали социальную изоляцию крыс как модель для формирования тревоги и депрессии. Назначение тестостерона и имипрамина имело схожий антидепрессивный и противотревожный эффект у самцов, но не обнаруживало подобного у самок. Также авторы делают вывод о том, что тестостерон усиливал эффект имипрамина на пролиферацию клеток в гиппокампе у самцов, но не у самок [46].
Возможные изменения уровня тестостерона при депрессии у женщин продемонстрированы рядом исследований. E. Giltay и соавт. обнаружили, что у женщин с большим депрессивным расстройством, тревожными расстройствами, включая генерализованное тревожное расстройство, социофобию и агорафобию, отмечалось снижение уровня тестостерона в слюне по сравнению с психически здоровыми женщинами [33].
Несмотря на то что клинические исследования терапии тестостероном у женщин ограничены, существует ряд исследований, показывающих его антидепрессивный и анксиолитический эффект в этой когорте пациентов [34].
Так, назначение низких доз тестостерона у женщин с фармакорезистентной депрессией значительно снижало степень выраженности симптомов по сравнению с терапией плацебо [47]. J. Shifren и соавт. обнаружили, что увеличение числа случаев депрессии у пациенток после оофорэктомии можно снизить назначением тестостерона [48], а однократное назначение тестостерона у женщин снижает тревогу и стартл-рефлекс [49]. У женщин с возрастным снижением андрогенов назначение тестостерона значительно улучшало настроение и качество жизни по сравнению с плацебо [50].
И хотя заместительная терапия эстрогеном может оказать существенное положительное влияние на симптомы тревоги и депрессии у женщин в период менопаузы [51, 52], существуют и обратные данные, свидетельствующие об увеличении риска депрессии при проведении подобной терапии [53], что делает необходимым изучение других возможных механизмов.
В постменопаузе у женщин яичники продолжают продуцировать тестостерон, но в значительно меньшем количестве, а терапия эстрогенами снижает количество циркулирующего свободного тестостерона [54]. В одном из официальных заявлений Североамериканского общества по менопаузе (The North American Menopause Society) говорится, что женщины в период постменопаузы со снижением сексуального влечения, связанным с дистрессом, могут рассматриваться как кандидаты на заместительную терапию препаратами тестостерона. Однако данный вид терапии является лишь дополнительным к заместительной терапии эстрогеном. Перед началом терапии рекомендуется исключить другие возможные причины, не связанные с уровнем тестостерона (физические факторы, лекарственные средства и т. д.). При этом лабораторная диагностика проводится перед началом терапии и во время нее, для того чтобы исключить повышенные показатели тестостерона, но не для диагностики дефицита тестостерона. Заместительная терапия тестостероном противопоказана женщинам с раком груди или матки, кардиоваскулярной патологией и болезнями печени. Назначения тестостерона для женщин рекомендуются в минимальной дозе и на минимальный период, соответствующий целям терапии [54].
Однако терапия тестостероном у женщин не ограничивается периодом постменопаузы, и в ряде работ он используется как аугментирующий агент при терапии фармакорезистентных депрессий. Так, в открытом исследовании, проведенном K. Miller и соавт. (2009 г.), трансдермальное назначение низких доз тестостерона (300 мкг в день) женщинам с фармакорезистентной депрессией позволило существенно улучшить показатели в соответствии со шкалой MADRS уже ко 2-й недели терапии. Достигли ответа на терапию 2/3 пациенток (редукция более 50% от первоначальных показателей) и 1/3 – ремиссии (оценка по MADRS < 10). И хотя результаты исследования кажутся достаточно обнадеживающими, следует обратить внимание на небольшую выборку и отсутствие плацебо-контроля [47]. В то же время исследование тестостерона как аугментирующего агента при терапии фармакорезистентной депрессии у мужчин не показало существенного результата [55], что объясняется большей чувствительностью женщин к андрогенам [56].
Однако не все исследования так однозначны в оценке положительного влияния тестостерона в терапии женских депрессий. Некоторые из них указывают на возможное негативное влияние терапии тестостероном, вплоть до возможного увеличения риска депрессивных эпизодов [57].
А исследования взаимосвязи уровня тестостерона и биполярного аффективного расстройства (БАР) показали, что чем выше показатели тестостерона были у женщин, тем выше риск диагноза «БАР» у них обнаруживался. В то время как у мужчин риск диагноза связан с пониженным уровнем тестостерона. Проспективные исследования этой когорты показали, что высокие показатели тестостерона увеличивали риск суицида среди женщин с диагнозом «БАР», но не среди мужчин [26].
Таким образом, тестостерон может оказывать значительное влияние и на психическое здоровье женщин. Однако необходимы дальнейшие исследования для понимания роли тестостерона в диагностике, патофизиологии и терапии депрессий у женщин.
Исследования показывают, что нарушения сексуальной функции у пациентов, принимающих СИОЗС, встречаются до 50% случаев [59], но гендерная распространенность этого побочного эффекта неодинакова. Так, S. Kennedy и соавт. показали, что до 50% мужчин испытывали нарушения либидо во время приема СИОЗС, в то время как среди женщин этот побочный эффект отмечался у 32%. Авторы также отмечают, что если в группе мужчин не было связи конкретного антидепрессанта с частотой этого побочного эффекта, то у женщин нарушение сексуальных функций чаще отмечалось в группе сертралина и пароксетина [60]. Эти данные лишний раз подчеркивают необходимость учета пола не только в вопросах диагностики депрессивных расстройств, но и в вопросах их терапии и возможных побочных эффектов.
Нарушение сексуальной функции в результате приема СИОЗС всегда расценивалось как обратимый побочный эффект, однако в последнее время появляются исследования, свидетельствующие о возможном существовании отдаленных нарушений сексуальной функции после приема этой группы препаратов [61], что может быть значимым фактором в терапии пациентов со сниженным уровнем тестостерона. Принимая во внимание, что сексуальные нарушения являются специфическими симптомами дефицита тестостерона и одной из основных жалоб, с которой обращаются мужчины за помощью, необходимо учитывать, насколько терапия антидепрессантами у пациентов с депрессией на фоне сниженного уровня тестостерона может ухудшать или улучшать этот симптомокомплекс и стероидогенез в целом.
И хотя существует достаточное количество работ, указывающих на снижение уровня тестостерона у пациентов с депрессивными и тревожными расстройствами [62, 63], нет четкого понимания влияния самих антидепрессантов на стероидогенез и уровень тестостерона.
Данная проблема освещалась в исследованиях in vitro и в значительно меньшей степени in vivo. Так, в работе, исследующей 5 антидепрессантов из группы СИОЗС (циталопрам, сертралин, флуоксетин, флувоксамин, пароксетин), все 5 препаратов влияли на стероидогенез снижением продукции тестостерона. Среди исследуемых препаратов влияние было неравномерным и наименьшую активность в отношении влияния на синтез стероидов показали сертралин и флувоксамин [64]. Эти результаты подтверждены и C. Hansen и соавт., которые показали, что все 6 исследуемых ими СИОЗС снижали количество андрогенов от 30 до 80% в зависимости от антидепрессанта, что компенсаторно увеличивало количество эстрогенов, заставляя сделать вывод авторов о необходимости более взвешенного использования препаратов этой группы в терапии депрессий у мужчин. В отличие от исследования
N. Jacobsen и соавт. (2015 г.), C. Hansen и соавт. (2017 г.) обнаружили, что флувоксамин и флуоксетин, наоборот, имеют наибольшее влияние на стероидогенез, снижая его в больше степени, чем сертралин, пароксетин, циталопрам и эсциталопрам [65].
В исследованиях на крысах обнаружено, что после 60 дней терапии флуоксетином отмечалось статистически значимое снижение массы половых органов по сравнению с крысами, получавшими плацебо, также обнаружено снижение подвижности сперматозоидов и снижение концентрации фолликулостимулирующего гормона и тестостерона [66]. В другом исследовании у крыс, получавших флуоксетин, обнаружено увеличение эстрогензависимой массы органов, что авторы объяснили повышением эстрогена в результате назначения СИОЗС [67].
В исследованиях на людях также обнаружено влияние приема антидепрессантов на уровень тестостерона. Так, 5-недельный курс пароксетина в дозе от 10 до 30 мг у 35 здоровых мужчин в возрасте от 18 до 65 лет приводил к значительным изменениям во фрагментации ДНК сперматозоида и снижению уровня тестостерона и эстрогена. Существенным недостатком этого исследования являлось отсутствие плацебо-контроля [68].
Однако существуют и противоположные результаты. Так, в одном из исследований страдающие депрессией пациенты, получавшие СИОЗС-терапию, имели концентрацию тестостерона в слюне выше, чем пациенты, не получавшие терапию антидепрессантами. Примечательно, что эти результаты были характерны как для мужчин, так и для женщин [33]. Возможное повышение уровня тестостерона авторы связывают с увеличением социальной активности и стресслимитирующим действием серотонина, позволяя антидепрессантам разбить порочный круг: снижение тестостерона – снижение стрессоустойчивости – еще большее снижение тестостерона. Сами же побочные эффекты СИОЗС, влияющие на сексуальную сферу, можно объяснить не их влиянием на уровень тестостерона, а в большей степени тем, что связывание серотонина с серотониновыми рецепторами головного мозга (5-HT2) напрямую снижает либидо [69], а также тем, что повышение серотонина на периферии ингибирует уровень оксида азота [60].
Авторы одного из последних обзоров о влиянии антидепрессантов из группы СИОЗС на фертильность у мужчин делают вывод, что возможные негативные последствия нелеченой депрессии значительно выше, чем возможные риски побочных эффектов антидепрессантов, но необходимо учитывать влияние этой группы препаратов на мужское здоровье. Требуется большее количество рандомизированных клинических исследований (РКИ) для получения более точных данных о возможном влиянии антидепрессантов в целом на показатели мужского здоровья и в частности у пациентов со сниженным уровнем тестостерона [70].
Таким образом, нет однозначного понимания влияния антидепрессантов при терапии депрессий у пациентов со сниженным уровнем тестостерона, их возможного влияния на уровень тестостерона и симптомы депрессии. Но учитывая тот факт, что лежащие в основе депрессии у мужчин со сниженным уровнем тестостерона патофизиологические механизмы могут в значительной степени отличаться от таковых у пациентов с депрессией на фоне нормальных показателей тестостерона, а именно дефицит тестостерона может быть основным патогенетическим звеном, требующим фармакологического воздействия, встает вопрос об эффективности заместительной терапии тестостероном в отношении симптомов депрессии у этой группы больных и возможном включении тестостерона в алгоритм депрессий при подобных состояниях.
Недавний метаанализ (n = 944) показал статистически значимое влияние терапии тестостероном на настроение у лиц моложе 60 лет, в то время как у лиц старше 60 лет статистической значимости обнаружить не удалось. Также эффективность терапии тестостероном выше у пациентов с гипогонадизмом, эугонодальные пациенты не обнаружили статистически значимых изменений в симптомах депрессии. Следует отметить, что в большей степени тестостерон был эффективен у пациентов при субпороговых и легких формах депрессивных проявлений, чем у страдающих большим депрессивным эпизодом. Также на величину эффекта влияла длительность терапии тестостероном, обнаруживая более значимый результат в исследованиях от 8 до 24 нед. На основании полученных данных авторы делают вывод о возможности использовать у пациентов до 60 лет со сниженным уровнем тестостерона с легкой формой депрессии заместительную монотерапию тестостероном, в то время как наличие большого депрессивного эпизода требует назначения антидепрессантов и тестостерона как аугментирующего агента [25].
Авторы другого исследования рассматривают тестостерон как аугментирующего агента при большом депрессивном эпизоде на фоне сниженного уровня тестостерона [72]. При этом, описывая результаты исследования, для обозначения эффекта тестостерона на симптомы депрессии они используют термин «драматический», показывая снижение средней оценки по шкале Гамильтона с 19,2 до 7,2 балла ко 2-й неделе и до 4,0 балла – к концу 8-й недели терапии [72]. Однозначность подобных изменений вызывает некоторые сомнения, особенно с учетом того, что в исследование включены лишь 5 человек.
В 2017 г. J. Elliott и соавт. опубликован наиболее обширный метаанализ заместительной терапии тестостероном у пациентов с гипогонадизмом (87 РКИ и 51 нерандомизированное исследование), который ставил целью максимальный анализ различных симптомов, сопровождающих снижение уровня тестостерона. Следует отметить, что в самом начале работы авторы делают акцент на низком качестве исследований, которые были включены в метаанализ. Большинство из них имели неясный или высокий уровень предвзятости с коротким периодом наблюдения [73]. Из всех включенных в метаанализ исследований 12 РКИ (11 плацебо-контролируемых и 1 с активным контролем) затрагивали симптомы депрессии. Анализ этих работ продемонстрировал, что использование тестостерона эффективнее плацебо в отношении симптомов депрессии. Но при исключении пациентов с выраженной коморбидностью статистическая значимость этих различий исчезала. Подводя итог всего метаанализа, авторы делают вывод, что, несмотря на эффективность класса в целом, в отношении качества жизни, депрессии, эректильной дисфункции и либидо значимых улучшений обнаружено не было [73].
И хотя идеи эффективности тестостерона как антидепрессанта у больных с большим депрессивным расстройством на фоне нормальных показателей тестостерона не получили широкого подтверждения, многие авторы высказывают мнение, что в отношении депрессий тестостерон эффективен лишь в определенных популяциях: у мужчин с дефицитом тестостерона, в случаях фармакорезистентных депрессий, у мужчин с ранним началом депрессии и ВИЧ-инфицированных мужчин [74].
Следует отметить, что одна из проблем, которая сопровождает исследования терапии депрессий тестостероном у пациентов со сниженным уровнем тестостерона и не всегда позволяет однозначно оценивать полученные результаты, – это существенные недочеты и недостатки дизайна большинства исследований. Так, во многих исследованиях используются самоопросники или медицинские записи, не соответствующие диагнозу депрессивного эпизода по критериям Международной классификации болезней [75]. В исследованиях часто отсутствует плацебо-контроль, определяется высокий уровень предвзятости, а также исследуется короткий период наблюдения, отсутствует follow-up, включается небольшое число участников. Результаты РКИ и обзоров часто противоречат друг другу и не дают однозначного ответа на поставленные вопросы.
Учитывая, что тема сниженного уровня тестостерона чаще исследуется врачами-урологами и эндокринологами, а не психиатрами, это приводит к сдвигу акцентов при разработке дизайна исследования. При оценке симптомов депрессии чаще используются недостаточно эффективные методы, различные самоопросники и нестандартизированные тесты, а диагноз ставится без использования общепринятых критериев в психиатрии, что также затрудняет понимание истинной проблемы депрессивных расстройств у пациентов со сниженным уровнем тестостерона.
Таким образом, проблема депрессий на фоне сниженного уровня тестостерона требует более пристального внимания врачей-психиатров и дальнейшей разработки алгоритмов диагностики и лечения, основанных на нейрофизиологических, психологических, эндокринологических и клинических особенностях депрессий у данной группы пациентов.
Работа выполнена в рамках государственного задания Минздрава России по теме «Клинико-психопатологическая оценка урологического варианта синдрома хронической тазовой боли у мужчин».
Сведения об авторах
Осадший Юрий Юрьевич – мл. науч. сотр. ФГБОУ ВО РостГМУ. E-mail: osadshiy@mail.ru
Солдаткин Виктор Александрович – д-р мед. наук, доц., зав. каф. психиатрии и наркологии ФПК и ППС ФГБОУ ВО РостГМУ. E-mail: sva-rostov@mail.ru
Крючкова Марина Николаевна – канд. мед. наук, ассистент каф. психиатрии и наркологии ФПК и ППС ФГБОУ ВО РостГМУ. E-mail: marina.gemchugina@yandex.ru
Барыкина Ирина Николаевна – канд. мед. наук, доц. каф. терапии и эндокринологии ФУВ ФГБОУ ВО ВолгГМУ. E-mail: irinbarykin@yandex.ru
Баканов Станислав Михайлович – врач-психиатр, зав. 2-м отд-нием ГБУЗ ВОКПБ № 2. E-mail: lbakanovl@gmail.com
В статье проводится обзор литературы о роли тестостерона в регуляции аффективной сферы и его вовлеченности в механизмы формирования депрессии. Подробно рассматривается проблема гипогонадизма и его возможная роль как этиологического фактора в развитии депрессии и у мужчин, и у женщин. Отдельный раздел посвящен методам терапии, в том числе заместительной терапии тестостероном, депрессий, вызванных сниженным уровнем тестостерона.
Ключевые слова: депрессия, тестостерон, гендерные особенности, гипогонадизм.
Для цитирования: Осадший Ю.Ю., Солдаткин В.А., Крючкова М.Н. и др. Тестостерон и его роль при депрессии. Обзор литературы. Психиатрия и психофармакотерапия. 2020; 22 (1): 28–35.
Testosterone and its role in depression. Literature review
Y.Y. Osadshiy1, V.A. Soldatkin1, M.N. Kryuchkova1, I.N. Barykina2, S.M. Bakanov31Rostov State Medical University, Rostov-on-Don, Russia;
2Volgograd State Medical University, Volgograd, Russia;
3Volgograd State Psychiatry Hospital №2, Volgograd, Russia
Abstract
The article provides an literature review of the role of testosterone in the regulation of the emotions and its involvement in the mechanism of depression. The problems of hypogonadism and its possible role as an etiological factor in the development of depression in both men and women are available in detail. Then we discusses the methods of treating depression caused by a decrease in testosterone levels, including testosterone replacement therapy.
Key words: depression, testosterone, gender differences, hypogonadism, low “T”.
For citation: Osadshiy Y.Y., Soldatkin V.A., Kryuchkova M.N. et al. Testosterone and its role in depression. Literature review. Psychiatry and Psychopharmacotherapy. 2020; 22 (1): 28-35.
Введение
Мужское здоровье и депрессия – понятия, которые чаще всего не ассоциируются друг с другом и скорее воспринимаются как исключение, в то время как мужское здоровье и тестостерон за последнее время стали практически синонимами. Однако появление все большего количества научных данных заставляет нас признать, что мужское здоровье, тестостерон и депрессия тесно связаны между собой [1].Изучение депрессии в течение последних лет позволило обнаружить множество особенностей и различий течения заболевания в зависимости от разнообразных факторов [2]. Одним из факторов, который может повлиять на клинику, лечение и профилактику мужской депрессии, бесспорно, является состояние эндокринной системы мужчины и в частности уровень тестостерона [3], снижение которого сопровождается целым комплексом различных симптомов. Принимая во внимание разнообразность проявлений снижения уровня тестостерона, пациенты могут обращаться к различным специалистам – урологам, эндокринологам, кардиологам и психиатрам.
Учитывая, что проявления депрессии относятся к неспецифическим симптомам дефицита тестостерона, внимания среди урологов и эндокринологов этим симптомам зачастую уделяется меньше, что приводит к акценту в терапии именно на коррекции сексуальной дисфункции и метаболических нарушений без определения природы расстройств настроения. В то же время снижение либидо и эректильная дисфункция являются возможными симптомами депрессии как самостоятельной нозологии. Но это необязательный симптом депрессии, и врачами-психиатрами он также не рассматривается детально, что приводит к смещению акцентов в терапии на коррекцию настроения без учета возможного дефицита тестостерона как этиологического фактора.
Целью настоящего обзора является попытка систематизировать научные данные о возможной роли тестостерона в проблеме депрессий, его влиянии на клиническую картину и возможные терапевтические алгоритмы.
Тестостерон и его снижение
Тот факт, что распространенность депрессии в 2 раза выше среди женщин [4–7], чем среди мужчин, привел к тому, что большинство научных исследований в этой сфере сфокусированы на вопросе – почему женщины находятся в группе высокого риска [8]. Однако эта ориентированность на объяснение высокой распространенности депрессии среди женщин привела к тому, что из поля зрения выпали мужчины, особенности их физиологических и психологических процессов, которые могут изменять клинику заболевания. При этом работы последних лет указывали на то, что мужчины имеют «альтернативные» симптомы депрессии, при поправке на которые разница в распространенности существенно снижается. Так, F. Zierrau и соавт., используя Готландскую шкалу мужской депрессии, обнаружили, что если дополнительно учитывать симптомы депрессии, характерные для мужчин, то предположительный диагноз можно выставить в 39%, в то время как при использовании стандартных опросников лишь 17% мужчин имели признаки депрессии [9].Учитывая, что различия в распространенности депрессии в большинстве случаев не обнаруживаются до подросткового возраста, исследователи предполагают, что это может быть объяснено отличиями в работе эндокринной системы мужчины и женщины, придавая большое значение тестостерону [10, 11].
Тестостерон – это стероидный гормон, относящийся к группе андрогенов [12], один из основных мужских гормонов.
Андрогены для мужчин имеют большое значение для развития и поддержания сексуальной и репродуктивной функций. Они влияют на активность простаты, придатков яичек и полового члена. Андрогены участвуют в формировании вторичных половых признаков и мужского фенотипа. Они необходимы для развития мышечной массы, строения тела, минерализации костей, метаболизма жировой ткани, увеличения мышечной силы, роста волос [13].
Тестостерон является главным и основным циркулирующим андрогеном в сыворотке крови, более 95% которого секретируется клетками Лейдига в тестикулах, а 5% – клетками сетчатой зоны коры надпочечников, клетками предстательной железы и головного мозга. В общей сложности в сутки синтезируется примерно 5–10 мг тестостерона [14, 15].
Общий тестостерон крови делится на 3 вида: тестостерон свободный (1–4% от общего), тестостерон, соединенный с глобулином, связывающим половые гормоны – ГСПГ (60–70%), и тестостерон, связанный с альбумином (слабосвязанный тестостерон, 25–40%). Свободная и слабосвязанная формы – это биодоступный тестостерон, т. е. обладающий биологической активностью. Связанный тестостерон, в свою очередь, не является активным.
Уровень свободного тестостерона не зависит от изменений концентрации ГСПГ. Поэтому, если ГСПГ повышен (при гипертиреоидизме, циррозе, приеме пероральных контрацептивов и противоэпилептических средств, гиперэстрогенных состояниях, в том числе беременности) или снижен (при гипотиреоидизме, ожирении, избытке андрогенов, нефритическом синдроме), тест на свободный тестостерон будет более информативным, чем на общий.
Андрогеновые и эстрогеновые рецепторы присутствуют практически во всем организме человека. И поэтому не удивительно, что дефицит тестостерона у мужчин связан со многими симптомами и проявляется не только снижением либидо и эректильной дисфункцией, но и остеопорозом, снижением мышечной силы, утомляемостью, нарушением сна, раздражительностью и депрессией [12].
Само понятие «гипогонадизм» у мужчин (снижение уровня тестостерона) описано более 100 лет назад [16] и сначала рассматривалось как симптомокомплекс, возникающий в результате нарушения работы гипоталамуса и гипофиза, например опухолей или травм. В последнее время такие формы гипогонадизма (с однозначной этиологией) получили название «классических». Однако распространенность подобных форм незначительна.
В то же время исследования последних лет выявили, что после 30–40 лет у мужчин уровень сывороточного тестостерона ежегодно снижается на 0,4–2% [17], приводя цифры распространенности дефицита тестостерона у мужчин старше 45 лет до 40% [18].
Объяснить снижение уровня тестостерона, происходящее с возрастом, возможно морфологическими изменениями в тестикулах. С возрастом обнаруживается почти двукратное снижение клеток Сертоли и Лейдига, также происходит повышение концентрации полового гормона, связывающего глобулин, что снижает соотношение свободного тестостерона даже больше, чем уровень общего тестостерона [19].
В дополнение к независимым возрастным факторам уровень тестостерона снижается при ряде возрастных состояний, включая увеличение массы тела, диабет, гипертензию, почечную и печеночную недостаточность, хроническую обструктивную болезнь легких. Повышение индекса массы тела (ИМТ) имеет даже более выраженный эффект на уровень тестостерона, чем возраст. Например, мужчины с ИМТ > 30 кг/м2 имеют показатели тестостерона в среднем на 30% ниже, чем мужчины с ИМТ < 25 кг/м2 [19].
Следует помнить, что основой диагностики являются лабораторные показатели тестостерона. И хотя существуют различные нормативные значения, большинство медицинских сообществ разных стран придерживаются единого мнения, а именно: средний показатель уровня общего тестостерона должен составлять более 12,1 нмоль/л, а свободного – 243 пмоль/л. К сожалению, методы оценки свободного тестостерона, используемые в широкой клинической практике, малодостоверны. Поэтому рекомендовано определение лабораторных показателей общего тестостерона, ГСПГ и альбумина с последующим расчетом свободного тестостерона по соответствующим формулам. В некоторых рекомендациях предлагается проведение исследования ГСПГ и альбумина только при показателях общего тестостерона менее 12,1 нмоль/л, в то время как ряд специалистов говорят о необходимости учитывать эти показатели даже при нормативных значениях тестостерона, особенно в группе пожилых пациентов [12, 20].
Однако сами симптомы снижения уровня тестостерона не являются специфическими, поэтому зачастую возникают трудности в первичной клинической диагностике. Урологами и эндокринологами предлагается следующая классификация симптомов гипогонадизма (см. таблицу) [20].

Следует обратить внимание, что симптомы, чаще проявляющиеся во время депрессии (снижение настроения, энергетического потенциала, утомляемость, нарушения сна, когнитивные нарушения, апатия и т. д.), относятся к неспецифическим симптомам дефицита тестостерона и не рассматриваются врачами-урологами как симптомы, требующие дополнительной консультации психиатра. А врачи-психиатры чаще всего не направляют на дополнительную диагностику к эндокринологу или урологу при наличии у пациента депрессии и снижении либидо. При этом современные антидепрессанты могут снижать уровень тестостерона и еще в большей степени нарушать сексуальную функцию [21, 22], а недостаточная коррекция нарушений настроения может мешать урологам в нормализации сексуальной функции. Все это приводит к снижению качества оказания медицинской помощи мужчинам как со стороны психиатров, так и со стороны урологов и эндокринологов.
Роль тестостерона в регуляции аффективной сферы
Широко известно, что гонадотропные гормоны и тестостерон, в частности, влияют на регуляцию эмоциональных реакций и настроения, и это может быть объяснением половых различий в эмоциональном статусе мужчин и женщин. V. Honk и соавт. показали положительные корреляции и у мужчин, и у женщин между уровнем тестостерона и восприимчивостью к изображениям лиц с выражением агрессии [23], а также отметили, что тестостерон является предиктором агрессивного и доминирующего поведения [24].Имеющиеся исследования показывают значимую взаимосвязь депрессии и уровня тестостерона. Так, большинство данных свидетельствовало об увеличении риска развития депрессии у пациентов со сниженным уровнем тестостерона [25, 26]. Однако в них остается некоторая неопределенность. Например, ряд авторов указывают на взаимосвязь низкого уровня тестостерона только с отдельными подтипами депрессий. Так, пациенты с атипичной депрессией продемонстрировали более низкие показатели тестостерона по сравнению с пациентами, страдающими меланхолической депрессией [27]. Не существует и единого мнения относительно того, какие именно показатели тестостерона следует оценивать. Например, A. Ford и соавт. обнаружили, что низкий уровень общего тестостерона связан с более высоким риском развития депрессии, причем эти различия сохранялись после поправок на возраст и коморбидную патологию, а увеличение риска депрессии сохранялось в течение 9,4 года, однако уровень дигидротестостерона или количество свободного тестостерона такой взаимосвязи не показали [28]. В то время как другие авторы сообщают об изменениях при депрессии уровня как раз свободного тестостерона [29].
Влияние тестостерона на различные аспекты настроения достоверно подтверждено, но механизм действия до конца не изучен. Не исключено, что некоторые симптомы депрессии (например, снижение сексуальной и физической активности) могут приводить к снижению тестостерона [30], но в большей степени снижение тестостерона может быть связано с изменениями активности гипоталамо-гипофизарно-надпочечниковой системы в результате депрессии [31]. Однако известно, что сами стероидные гормоны оказывают модулирующее влияние на нейротрансмиттеры и ассоциированные рецепторы, вовлеченные в патофизиологию депрессивного расстройства. Так, тестостерон оказывает влияние на дофамин, увеличивая его выброс в мезолимбической системе, полосатом теле и прилежащем ядре [31], также назначение тестостерона увеличивает плотность доступных для связывания серотониновых рецепторов [32]. При этом пациенты, принимающие антидепрессанты из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) для терапии депрессии, имели в слюне выше уровень тестостерона, в сравнении с пациентами, не принимающими препараты данной группы [33]. Возможное влияние тестостерона на механизмы депрессии также продемонстрировано на пациентах-трансгендерах. Так, выявлено увеличение способности связывания серотониновых рецепторов у трансгендеров уже через 1 мес. после начала заместительной терапии тестостероном, в то время как антиандрогеновая терапия снижала этот показатель [32].
Тестостерон также обладает анксиолитическим воздействием через систему g-аминомаслянной кислоты (ГАМК), назначение антагонистов ГАМК-А блокирует анксиолитический эффект тестостерона, указывая на его схожее с бензодиазепинами влияние на эту систему. Кроме этого, антидепрессивный и противотревожный эффект тестостерона и его активного метаболита эстрадиола объясняется их действиями в области зубчатой извилины и изменением экспрессии генов и синаптической пластичности в гиппокампальной области, которая демонстрирует одно из ключевых значений при тревоге, депрессии и стрессиндуцированных расстройствах [34]. Следует обратить внимание, что основная локализация нейростероидогенеза с нейроанатомической перспективы расположена в области коры, амигдалы и гиппокампа [4], также фМРТ-исследования указывают на то, что именно гиппокамп и амигдала являются ключевыми областями активности тестостерона во время эмоциональной и социальной стимуляции [35]. И именно эти зоны в последнее время считаются наиболее важными в механизмах эмоционального регулирования, возникновении тревоги, депрессии и реакции на стресс.
M. Shores и соавт. проанализировали данные 278 мужчин старше 45 лет без случаев диагностированной депрессии. Наблюдение в течение 2 лет показало, что у мужчин с уровнем тестостерона ниже 280 нг/дл количество эпизодов депрессии было выше по сравнению с теми, у кого уровень тестостерона превышал эти значения. Риск развития депрессии зависел от уровня тестостерона, и чем ниже были показатели тестостерона, тем выше был риск развития депрессии. Так, при показателях тестостерона менее 150 нг/дл риск депрессии составлял 30%. Эти данные сохранялись при поправке на рак предстательной железы, другие медицинские состояния, национальность и уровень сексуальной дисфункции [36, 37].
В 2016 г. A. Ford и соавт. опубликовали большое проспективное исследование, целью которого также было исследование связи уровня тестостерона и депрессий. Исследование включало пациентов только с впервые выявленным депрессивным эпизодом. По результатам 9-летних наблюдений риск развития депрессии у мужчин со сниженным уровнем тестостерона в начале исследования был почти в 2 раза выше, чем у пациентов с нормальными показателями. Эти показатели также не изменились при поправке на образ жизни, возраст и медицинскую коморбидность [28].
В другом исследовании у мужчин, получавших андрогендепривационную терапию при раке простаты, показана взаимосвязь уровня тестостерона и расстройств настроения. Такие пациенты имели выше риск развития не только депрессивных, но и тревожных расстройств по сравнению с пациентами, которым не проводилась терапия, направленная на снижение уровня андрогенов [38]. Эти данные подтвердили и в более поздних эпидемиологических исследованиях, которые продемонстрировали увеличение риска развития депрессивных симптомов, диагноза «депрессия» и получения терапии антидепрессантами у пациентов, получающих андрогендепривационную терапию [39, 40].
Крупный многонациональный проект (n = 3369, мужчины в возрасте от 40 до 79 лет), цель которого – определение и оценка симптомов, нарушений функций и биохимических изменений, ассоциированных со старением (The European Male Aging Study), также продемонстрировал, что депрессия, нарушение сексуальных функций, снижение повседневной активности и слабость были существенно взаимосвязаны с уровнем тестостерона. Снижение уровня общего тестостерона ниже 160 пмоль/л было ассоциировано со сниженным настроением и слабостью. В то время как снижение уровня свободного тестостерона больше ассоциировалось с нарушением сексуальной функции и повседневной активностью [41].
Несмотря на то что 17% мужчин старше 40 лет в этом исследовании имели биохимические показатели уровня тестостерона ниже референсных значений, только 2,1% имели 3 симптома сексуальной дисфункции и соответствовали критериям гипогонадизма. Большинство же пациентов с пограничным значением или сниженным уровнем тестостерона не демонстрировали какой-либо симптоматики. При этом некоторые авторы вводят отдельный термин «функциональный гипогонадизм» для обозначения синдрома андрогенного дефицита и снижения уровня тестостерона при отсутствии врожденных или структурных нарушений в гипоталамо-гипофизарной оси [42].
Таким образом, тестостерон может служить естественной защитой мужчин от депрессивных расстройств, однако при его снижении эта защита теряется, что может приводить к увеличению риска развития депрессии, которая может потребовать заместительной терапии тестостероном.
Роль тестостерона в проблеме женских депрессий
И хотя исследования влияния тестостерона на психическое здоровье женщин ограничены, существуют доказательства, поддерживающие теорию о его возможной роли.В экспериментах на животных инъекции дегидротестостерона самкам крыс снижали уровень тревоги и улучшали выполнение некоторых экспериментальных заданий [43, 44], также положительно влияя на паттерны депрессивного поведения, показывая схожий эффект с флуоксетином [45].
Однако не все исследования на животных показывают подобное гендерное положительное влияние тестостерона. N. Carrier и M. Kabbaj (2012 г.) в своем исследовании использовали социальную изоляцию крыс как модель для формирования тревоги и депрессии. Назначение тестостерона и имипрамина имело схожий антидепрессивный и противотревожный эффект у самцов, но не обнаруживало подобного у самок. Также авторы делают вывод о том, что тестостерон усиливал эффект имипрамина на пролиферацию клеток в гиппокампе у самцов, но не у самок [46].
Возможные изменения уровня тестостерона при депрессии у женщин продемонстрированы рядом исследований. E. Giltay и соавт. обнаружили, что у женщин с большим депрессивным расстройством, тревожными расстройствами, включая генерализованное тревожное расстройство, социофобию и агорафобию, отмечалось снижение уровня тестостерона в слюне по сравнению с психически здоровыми женщинами [33].
Несмотря на то что клинические исследования терапии тестостероном у женщин ограничены, существует ряд исследований, показывающих его антидепрессивный и анксиолитический эффект в этой когорте пациентов [34].
Так, назначение низких доз тестостерона у женщин с фармакорезистентной депрессией значительно снижало степень выраженности симптомов по сравнению с терапией плацебо [47]. J. Shifren и соавт. обнаружили, что увеличение числа случаев депрессии у пациенток после оофорэктомии можно снизить назначением тестостерона [48], а однократное назначение тестостерона у женщин снижает тревогу и стартл-рефлекс [49]. У женщин с возрастным снижением андрогенов назначение тестостерона значительно улучшало настроение и качество жизни по сравнению с плацебо [50].
И хотя заместительная терапия эстрогеном может оказать существенное положительное влияние на симптомы тревоги и депрессии у женщин в период менопаузы [51, 52], существуют и обратные данные, свидетельствующие об увеличении риска депрессии при проведении подобной терапии [53], что делает необходимым изучение других возможных механизмов.
В постменопаузе у женщин яичники продолжают продуцировать тестостерон, но в значительно меньшем количестве, а терапия эстрогенами снижает количество циркулирующего свободного тестостерона [54]. В одном из официальных заявлений Североамериканского общества по менопаузе (The North American Menopause Society) говорится, что женщины в период постменопаузы со снижением сексуального влечения, связанным с дистрессом, могут рассматриваться как кандидаты на заместительную терапию препаратами тестостерона. Однако данный вид терапии является лишь дополнительным к заместительной терапии эстрогеном. Перед началом терапии рекомендуется исключить другие возможные причины, не связанные с уровнем тестостерона (физические факторы, лекарственные средства и т. д.). При этом лабораторная диагностика проводится перед началом терапии и во время нее, для того чтобы исключить повышенные показатели тестостерона, но не для диагностики дефицита тестостерона. Заместительная терапия тестостероном противопоказана женщинам с раком груди или матки, кардиоваскулярной патологией и болезнями печени. Назначения тестостерона для женщин рекомендуются в минимальной дозе и на минимальный период, соответствующий целям терапии [54].
Однако терапия тестостероном у женщин не ограничивается периодом постменопаузы, и в ряде работ он используется как аугментирующий агент при терапии фармакорезистентных депрессий. Так, в открытом исследовании, проведенном K. Miller и соавт. (2009 г.), трансдермальное назначение низких доз тестостерона (300 мкг в день) женщинам с фармакорезистентной депрессией позволило существенно улучшить показатели в соответствии со шкалой MADRS уже ко 2-й недели терапии. Достигли ответа на терапию 2/3 пациенток (редукция более 50% от первоначальных показателей) и 1/3 – ремиссии (оценка по MADRS < 10). И хотя результаты исследования кажутся достаточно обнадеживающими, следует обратить внимание на небольшую выборку и отсутствие плацебо-контроля [47]. В то же время исследование тестостерона как аугментирующего агента при терапии фармакорезистентной депрессии у мужчин не показало существенного результата [55], что объясняется большей чувствительностью женщин к андрогенам [56].
Однако не все исследования так однозначны в оценке положительного влияния тестостерона в терапии женских депрессий. Некоторые из них указывают на возможное негативное влияние терапии тестостероном, вплоть до возможного увеличения риска депрессивных эпизодов [57].
А исследования взаимосвязи уровня тестостерона и биполярного аффективного расстройства (БАР) показали, что чем выше показатели тестостерона были у женщин, тем выше риск диагноза «БАР» у них обнаруживался. В то время как у мужчин риск диагноза связан с пониженным уровнем тестостерона. Проспективные исследования этой когорты показали, что высокие показатели тестостерона увеличивали риск суицида среди женщин с диагнозом «БАР», но не среди мужчин [26].
Таким образом, тестостерон может оказывать значительное влияние и на психическое здоровье женщин. Однако необходимы дальнейшие исследования для понимания роли тестостерона в диагностике, патофизиологии и терапии депрессий у женщин.
Особенности терапии депрессии на фоне сниженного уровня тестостерона
Следует отметить, что практически все психиатрические препараты оказывают влияние на гипоталамо-гипофизарно-гонадную систему на многих уровнях. Дофамин, серотонин, ГАМК чаще других подвергаются воздействию психотропных средств, и именно они вовлечены в регуляцию сексуальной сферы. Лекарственные средства, применяемые в психиатрии, могут изменять уровень половых гормонов, а также метаболизм различных протеинов, участвующих в связывании этих гормонов. Через влияние на симпатическую и парасимпатическую нервную систему они могут влиять на сексуальное влечение, эрекцию, эякуляцию и оргазм [58]. Это представляет собой одну из проблем терапии депрессий у мужчин со сниженным уровнем тестостерона, у которых нарушение этих функций может выступать как симптом сниженного уровня тестостерона, депрессии или побочных действий лекарственных средств, что будет требовать различных терапевтических алгоритмов.Исследования показывают, что нарушения сексуальной функции у пациентов, принимающих СИОЗС, встречаются до 50% случаев [59], но гендерная распространенность этого побочного эффекта неодинакова. Так, S. Kennedy и соавт. показали, что до 50% мужчин испытывали нарушения либидо во время приема СИОЗС, в то время как среди женщин этот побочный эффект отмечался у 32%. Авторы также отмечают, что если в группе мужчин не было связи конкретного антидепрессанта с частотой этого побочного эффекта, то у женщин нарушение сексуальных функций чаще отмечалось в группе сертралина и пароксетина [60]. Эти данные лишний раз подчеркивают необходимость учета пола не только в вопросах диагностики депрессивных расстройств, но и в вопросах их терапии и возможных побочных эффектов.
Нарушение сексуальной функции в результате приема СИОЗС всегда расценивалось как обратимый побочный эффект, однако в последнее время появляются исследования, свидетельствующие о возможном существовании отдаленных нарушений сексуальной функции после приема этой группы препаратов [61], что может быть значимым фактором в терапии пациентов со сниженным уровнем тестостерона. Принимая во внимание, что сексуальные нарушения являются специфическими симптомами дефицита тестостерона и одной из основных жалоб, с которой обращаются мужчины за помощью, необходимо учитывать, насколько терапия антидепрессантами у пациентов с депрессией на фоне сниженного уровня тестостерона может ухудшать или улучшать этот симптомокомплекс и стероидогенез в целом.
И хотя существует достаточное количество работ, указывающих на снижение уровня тестостерона у пациентов с депрессивными и тревожными расстройствами [62, 63], нет четкого понимания влияния самих антидепрессантов на стероидогенез и уровень тестостерона.
Данная проблема освещалась в исследованиях in vitro и в значительно меньшей степени in vivo. Так, в работе, исследующей 5 антидепрессантов из группы СИОЗС (циталопрам, сертралин, флуоксетин, флувоксамин, пароксетин), все 5 препаратов влияли на стероидогенез снижением продукции тестостерона. Среди исследуемых препаратов влияние было неравномерным и наименьшую активность в отношении влияния на синтез стероидов показали сертралин и флувоксамин [64]. Эти результаты подтверждены и C. Hansen и соавт., которые показали, что все 6 исследуемых ими СИОЗС снижали количество андрогенов от 30 до 80% в зависимости от антидепрессанта, что компенсаторно увеличивало количество эстрогенов, заставляя сделать вывод авторов о необходимости более взвешенного использования препаратов этой группы в терапии депрессий у мужчин. В отличие от исследования
N. Jacobsen и соавт. (2015 г.), C. Hansen и соавт. (2017 г.) обнаружили, что флувоксамин и флуоксетин, наоборот, имеют наибольшее влияние на стероидогенез, снижая его в больше степени, чем сертралин, пароксетин, циталопрам и эсциталопрам [65].
В исследованиях на крысах обнаружено, что после 60 дней терапии флуоксетином отмечалось статистически значимое снижение массы половых органов по сравнению с крысами, получавшими плацебо, также обнаружено снижение подвижности сперматозоидов и снижение концентрации фолликулостимулирующего гормона и тестостерона [66]. В другом исследовании у крыс, получавших флуоксетин, обнаружено увеличение эстрогензависимой массы органов, что авторы объяснили повышением эстрогена в результате назначения СИОЗС [67].
В исследованиях на людях также обнаружено влияние приема антидепрессантов на уровень тестостерона. Так, 5-недельный курс пароксетина в дозе от 10 до 30 мг у 35 здоровых мужчин в возрасте от 18 до 65 лет приводил к значительным изменениям во фрагментации ДНК сперматозоида и снижению уровня тестостерона и эстрогена. Существенным недостатком этого исследования являлось отсутствие плацебо-контроля [68].
Однако существуют и противоположные результаты. Так, в одном из исследований страдающие депрессией пациенты, получавшие СИОЗС-терапию, имели концентрацию тестостерона в слюне выше, чем пациенты, не получавшие терапию антидепрессантами. Примечательно, что эти результаты были характерны как для мужчин, так и для женщин [33]. Возможное повышение уровня тестостерона авторы связывают с увеличением социальной активности и стресслимитирующим действием серотонина, позволяя антидепрессантам разбить порочный круг: снижение тестостерона – снижение стрессоустойчивости – еще большее снижение тестостерона. Сами же побочные эффекты СИОЗС, влияющие на сексуальную сферу, можно объяснить не их влиянием на уровень тестостерона, а в большей степени тем, что связывание серотонина с серотониновыми рецепторами головного мозга (5-HT2) напрямую снижает либидо [69], а также тем, что повышение серотонина на периферии ингибирует уровень оксида азота [60].
Авторы одного из последних обзоров о влиянии антидепрессантов из группы СИОЗС на фертильность у мужчин делают вывод, что возможные негативные последствия нелеченой депрессии значительно выше, чем возможные риски побочных эффектов антидепрессантов, но необходимо учитывать влияние этой группы препаратов на мужское здоровье. Требуется большее количество рандомизированных клинических исследований (РКИ) для получения более точных данных о возможном влиянии антидепрессантов в целом на показатели мужского здоровья и в частности у пациентов со сниженным уровнем тестостерона [70].
Таким образом, нет однозначного понимания влияния антидепрессантов при терапии депрессий у пациентов со сниженным уровнем тестостерона, их возможного влияния на уровень тестостерона и симптомы депрессии. Но учитывая тот факт, что лежащие в основе депрессии у мужчин со сниженным уровнем тестостерона патофизиологические механизмы могут в значительной степени отличаться от таковых у пациентов с депрессией на фоне нормальных показателей тестостерона, а именно дефицит тестостерона может быть основным патогенетическим звеном, требующим фармакологического воздействия, встает вопрос об эффективности заместительной терапии тестостероном в отношении симптомов депрессии у этой группы больных и возможном включении тестостерона в алгоритм депрессий при подобных состояниях.
Возможное место тестостерона в терапии мужской депрессии
В последнее время появилось достаточно большое количество работ, свидетельствующих о положительном влиянии заместительной терапии тестостероном на симптомы депрессии, тревоги и снижение энергетического потенциала [37, 71].Недавний метаанализ (n = 944) показал статистически значимое влияние терапии тестостероном на настроение у лиц моложе 60 лет, в то время как у лиц старше 60 лет статистической значимости обнаружить не удалось. Также эффективность терапии тестостероном выше у пациентов с гипогонадизмом, эугонодальные пациенты не обнаружили статистически значимых изменений в симптомах депрессии. Следует отметить, что в большей степени тестостерон был эффективен у пациентов при субпороговых и легких формах депрессивных проявлений, чем у страдающих большим депрессивным эпизодом. Также на величину эффекта влияла длительность терапии тестостероном, обнаруживая более значимый результат в исследованиях от 8 до 24 нед. На основании полученных данных авторы делают вывод о возможности использовать у пациентов до 60 лет со сниженным уровнем тестостерона с легкой формой депрессии заместительную монотерапию тестостероном, в то время как наличие большого депрессивного эпизода требует назначения антидепрессантов и тестостерона как аугментирующего агента [25].
Авторы другого исследования рассматривают тестостерон как аугментирующего агента при большом депрессивном эпизоде на фоне сниженного уровня тестостерона [72]. При этом, описывая результаты исследования, для обозначения эффекта тестостерона на симптомы депрессии они используют термин «драматический», показывая снижение средней оценки по шкале Гамильтона с 19,2 до 7,2 балла ко 2-й неделе и до 4,0 балла – к концу 8-й недели терапии [72]. Однозначность подобных изменений вызывает некоторые сомнения, особенно с учетом того, что в исследование включены лишь 5 человек.
В 2017 г. J. Elliott и соавт. опубликован наиболее обширный метаанализ заместительной терапии тестостероном у пациентов с гипогонадизмом (87 РКИ и 51 нерандомизированное исследование), который ставил целью максимальный анализ различных симптомов, сопровождающих снижение уровня тестостерона. Следует отметить, что в самом начале работы авторы делают акцент на низком качестве исследований, которые были включены в метаанализ. Большинство из них имели неясный или высокий уровень предвзятости с коротким периодом наблюдения [73]. Из всех включенных в метаанализ исследований 12 РКИ (11 плацебо-контролируемых и 1 с активным контролем) затрагивали симптомы депрессии. Анализ этих работ продемонстрировал, что использование тестостерона эффективнее плацебо в отношении симптомов депрессии. Но при исключении пациентов с выраженной коморбидностью статистическая значимость этих различий исчезала. Подводя итог всего метаанализа, авторы делают вывод, что, несмотря на эффективность класса в целом, в отношении качества жизни, депрессии, эректильной дисфункции и либидо значимых улучшений обнаружено не было [73].
И хотя идеи эффективности тестостерона как антидепрессанта у больных с большим депрессивным расстройством на фоне нормальных показателей тестостерона не получили широкого подтверждения, многие авторы высказывают мнение, что в отношении депрессий тестостерон эффективен лишь в определенных популяциях: у мужчин с дефицитом тестостерона, в случаях фармакорезистентных депрессий, у мужчин с ранним началом депрессии и ВИЧ-инфицированных мужчин [74].
Следует отметить, что одна из проблем, которая сопровождает исследования терапии депрессий тестостероном у пациентов со сниженным уровнем тестостерона и не всегда позволяет однозначно оценивать полученные результаты, – это существенные недочеты и недостатки дизайна большинства исследований. Так, во многих исследованиях используются самоопросники или медицинские записи, не соответствующие диагнозу депрессивного эпизода по критериям Международной классификации болезней [75]. В исследованиях часто отсутствует плацебо-контроль, определяется высокий уровень предвзятости, а также исследуется короткий период наблюдения, отсутствует follow-up, включается небольшое число участников. Результаты РКИ и обзоров часто противоречат друг другу и не дают однозначного ответа на поставленные вопросы.
Учитывая, что тема сниженного уровня тестостерона чаще исследуется врачами-урологами и эндокринологами, а не психиатрами, это приводит к сдвигу акцентов при разработке дизайна исследования. При оценке симптомов депрессии чаще используются недостаточно эффективные методы, различные самоопросники и нестандартизированные тесты, а диагноз ставится без использования общепринятых критериев в психиатрии, что также затрудняет понимание истинной проблемы депрессивных расстройств у пациентов со сниженным уровнем тестостерона.
Выводы
Проведенный анализ литературы показывает, что, несмотря на доказанную вовлеченность тестостерона в процесс регуляции эмоций и взаимосвязь его снижения с появлением депрессии у мужчин, в настоящее время отсутствуют четкие диагностические критерии депрессии на фоне сниженного уровня тестостерона, нет единых алгоритмов диагностики и понимания объема фармакологической помощи.Таким образом, проблема депрессий на фоне сниженного уровня тестостерона требует более пристального внимания врачей-психиатров и дальнейшей разработки алгоритмов диагностики и лечения, основанных на нейрофизиологических, психологических, эндокринологических и клинических особенностях депрессий у данной группы пациентов.
Работа выполнена в рамках государственного задания Минздрава России по теме «Клинико-психопатологическая оценка урологического варианта синдрома хронической тазовой боли у мужчин».
Сведения об авторах
Осадший Юрий Юрьевич – мл. науч. сотр. ФГБОУ ВО РостГМУ. E-mail: osadshiy@mail.ru
Солдаткин Виктор Александрович – д-р мед. наук, доц., зав. каф. психиатрии и наркологии ФПК и ППС ФГБОУ ВО РостГМУ. E-mail: sva-rostov@mail.ru
Крючкова Марина Николаевна – канд. мед. наук, ассистент каф. психиатрии и наркологии ФПК и ППС ФГБОУ ВО РостГМУ. E-mail: marina.gemchugina@yandex.ru
Барыкина Ирина Николаевна – канд. мед. наук, доц. каф. терапии и эндокринологии ФУВ ФГБОУ ВО ВолгГМУ. E-mail: irinbarykin@yandex.ru
Баканов Станислав Михайлович – врач-психиатр, зав. 2-м отд-нием ГБУЗ ВОКПБ № 2. E-mail: lbakanovl@gmail.com
Список исп. литературыСкрыть список1. Reddy DS. Neurosteroids: endogenous role in the human brain and therapeutic potentials. Prog Brain Res 2010; 186: 113–37.
2. Азаматова В.В., Анцыборов А.В., Бойко Е.О. и др. Краткий курс психиатрии. Учебник для последипломного образования. Ростов-на-Дону, 2019. / Azamatova V.V., Antsyborov A.V., Boiko E.O. i dr. Kratkii kurs psikhiatrii. Uchebnik dlia poslediplomnogo obrazovaniia. Rostov-na-Donu, 2019. [in Russian]
3. Крючкова М.Н., Солдаткин В.А. Синдром хронической тазовой боли: психопатологические аспекты. Вестн. урологии. 2017; 5 (1): 52–63. / Kriuchkova M.N., Soldatkin V.A. Sindrom khronicheskoi tazovoi boli: psikhopatologicheskie aspekty. Vestn. urologii. 2017; 5 (1): 52–63. [in Russian]
4. Тювина Н.А. Депрессия у женщин. М.: Кафедра психиатрии и медицинской психоневрологии ММА им. И.М.Сеченова, 2003; с. 32–62. / Tiuvina N.A. Depressiia u zhenshchin. M.: Kafedra psikhiatrii i meditsinskoi psikhonevrologii MMA im. I.M.Sechenova, 2003; s. 32–62. [in Russian]
5. Краснов В.Н. Расстройства аффективного спектра. М.: Практическая медицина, 2010; с. 47–8. / Krasnov V.N. Rasstroistva affektivnogo spektra. M.: Prakticheskaia meditsina, 2010; s. 47–8. [in Russian]
6. Nolen-Hoeksema S. Gender differences in coping with depression across the lifespan. Depression 1998; 3: 81–90.
7. Агибалова Т.В., Александровский Ю.А., Бочеева Е.А. и др. Посттравматическое стрессовое расстройство. Международная (Россия – Армения – Беларусь – Украина) коллективная монография. Ростов-на-Дону, 2015. / Agibalova T.V., Aleksandrovskii Iu.A., Bocheeva E.A. i dr. Posttravmaticheskoe stressovoe rasstroistvo. Mezhdunarodnaia (Rossiia – Armeniia – Belarus' – Ukraina) kollektivnaia monografiia. Rostov-na-Donu, 2015. [in Russian]
8. Martin LA, Neighbors HW, Griffith DM. The experience of symptoms of depression in men vs women: analysis of the National Comorbidity Survey Replication. JAMA Psychiatry 2013; 70: 1100–6.
9. Zierau F, Bille A, Rutz W, Bech P. The Gotland Male Depression Scale: a validity study in patients with alcohol use disorders. Nordic J Psychiatry 2002; 56: 265–71.
10. Тювина Н.А. Депрессии у женщин. М.: Сервье, 2006. / Tiuvina N.A. Depressii u zhenshchin. M.: Serv'e, 2006. [in Russian]
11. Тювина Н.А., Балабанова В.В., Воронина Е.О. Депрессии у женщин, манифестирующие в период климактерия. Журн. неврологии и психиатрии. 2017; 3: 22–7. / Tiuvina N.A., Balabanova V.V., Voronina E.O. Depressii u zhenshchin, manifestiruiushchie v period klimakteriia. Zhurn. nevrologii i psikhiatrii. 2017; 3: 22–7. [in Russian]
12. Коган М.И., Ибишев Х.С., Васильев О.Н. Возрастной андрогенный дефицит. Этиология, диагностика, лечение: учебно-методическое пособие. Ростов на Дону, 2010. / Kogan M.I., Ibishev Kh.S., Vasil'ev O.N. Vozrastnoi androgennyi defitsit. Etiologiia, diagnostika, lechenie: uchebno-metodicheskoe posobie. Rostov na Donu, 2010. [in Russian]
13. Nieschlag E, Behre HM. Testosterone: Action. Deficiency. Substitution. 4th ed. Cambridge: Cambridge University Press, 2012.
14. Baulieu EE. Neurosteroids: of the nervous system, by the nervous system, for the nervous system. Recent Prog Horm Res 1997; 52: 1–32.
14. Banerjee PP, Banerjee S, Brown TR, Zirkin BR. Androgen action in prostate function and disease. Am J Clin Exp Urol 2018; 6 (2): 62–77.
16. Андрология. Мужское здоровье и дисфункция репродуктивной системы. Под общ. ред. Э. Нишлага, Г.М. Бере. М., 2005. / Andrologiia. Muzhskoe zdorov'e i disfunktsiia reproduktivnoi sistemy. Pod obshch. red. E. Nishlaga, G.M. Bere. M., 2005. [in Russian]
17. Kaufman JM. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocr Rev 2005; 26 (6): 833–76. DOI: 10.1210/er.2004-0013
18. Mulligan T et al. Prevalence of hypogonadism in males aged at least 45years: the HIM study. Int J Clin Pract 2006; 6: 762–9.
19. Huhtaniemi I. Late-onset hypogonadism: current concepts and controversies of pathogenesis, diagnosis, and treatment. Asian J Androl 2014; 16: 192–202.
20. Коган М.И. и др. Тестостерон: от сексуальности к метаболическому контролю: монография. Ростов на Дону: Феникс, 2017. / Kogan M.I. i dr. Testosteron: ot seksual'nosti k metabolicheskomu kontroliu: monografiia. Rostov na Donu: Feniks, 2017. [in Russian]
21. Higgins A, Nash M, Lynch AM. Antidepressant-associated sexual dysfunction: impact, effects, and treatment. Drug Healthc Patient Saf 2010; 2: 141–50.
22. Safarineiad MR. Evaluation of endocrine profile and hypothalamic-pituitary-testis axis in selective serotonin reuptake inhibitor-induced male sexual dysfunction. J Clin Psychopharmacol 2008; 28: 418–23.
23. Van Honk J, Tuiten A, Verbaten R et al. Correlations among salivary testosterone, mood, and selective attention to threat in humans. Horm Behav 1999; 36 (1): 17–24.
24. Van Honk J, Schutter DJ. Testosterone reduces conscious detection of signals serving social correction: Implications for antisocial behavior. Psychol Sci 2007; 18 (8): 663–7.
25. Amanatkar HR, Chibnall JT, Seo BW, et al. Impact of exogenous testosterone on mood: a systematic review and meta-analysis of randomized placebo-controlled trials. Ann Clin Psychiatry 2014; 26 (1): 19–32.
26. Wooderson SC, Gallagher P, Watson S, Young AH. An exploration of testosterone levels in patients with bipolar disorder. BJPsych Open 2015; 1 (2): 136–8. Doi: 10.1192/bjpo.bp.115.001008
27. Rodgers S, Holtforth M, Hengartner M et al. Serum Testosterone Levels and Symptom-Based Depression Subtypes in Men. Front Psychiatry 2015; 6: 61. DOI: 10.3389/fpsyt.2015.00061
28. Ford AH, Yeap BB, Flicker L et al. Prospective longitudinal study of testosterone and incident depression in older men: The Health In Men Study. Psychoneuroendocrinology 2016; 64: 57–65. DOI: 10.1016/j. psyneuen.2015.11.012
29. Westley CJ, Amdur RL, Irwig MS. High Rates of Depression and Depressive Symptoms among Men Referred for Borderline Testosterone Levels. J Sex Med 2015; 12 (8): 1753–60. DOI: 10.1111/jsm.12937
30. Hsu B, Cumming RG, Blyth FM et al. The longitudinal relationship of sexual function and androgen status in older men: the Concord Health and Ageing in Men Project. J Clin Endocrinol Metab 2015; 100 (4): 1350–8. DOI: 10.1210/jc.2014-4104
31. Oyola MG, Handa RJ. Hypothalamic–pituitary–adrenal and hypothalamic–pituitary–gonadal axes: sex differences in regulation of stress responsivity. Stress (Amsterdam, Netherlands) 2017; 20 (5): 476–94. DOI: 10.1080/10253890.2017.1369523
32. Kranz GS, Wadsak W, Kaufmann U et al. High-Dose Testosterone Treatment Increases Serotonin Transporter Binding in Transgender People. Biol Psychiatry 2015; 78 (8): 525–33. DOI: 10.1016/j.biopsych.2014.09.010
33. Giltay EJ, Enter D, Zitman FG et al. Salivary testosterone: associations with depression, anxiety disorders, and antidepressant use in a large cohort study. J Psychosom Res 2012; 72 (3): 205–13. DOI: 10.1016/j.jpsychores.2011.11.014
34. McHenry J, Carrier N, Hull E, Kabbaj M. Sex Differences in Anxiety and Depression: Role of Testosterone. Front Neuroendocrinol 2014; 35 (1): 42–57. DOI: 10.1016/j.yfrne.2013.09.001
35. Heany SJ, van Honk J, Stein DJ et al. A quantitative and qualitative review of the effects of testosterone on the function and structure of the human social-emotional brain. Metab Brain Dis 2016; 31: 157–67.
36. Shores MM, Sloan KL, Matsumoto AM et al. Increased incidence of diagnosed depressive illness in hypogonadal older men. Arch Gen Psychiatry 2004; 61: 162–7.
37. Zarrouf FA, Artz S, Griffith, J et al. Testosterone and depression: systematic review and meta-analysis. J Psychiatr Pract 2009; 15: 289–305.
38. Di Blasio CJ, Hammett J, Malcolm JB et al. Prevalence and predictive factors for the development of de novo psychiatric illness in patients receiving androgen deprivation therapy for prostate cancer. Can J Urol 2008; 15: 4249–56.
39. Chung SD, Kao LT, Lin HC et al. Patients receiving androgen deprivation therapy for prostate cancer have an increased risk of depressive disorder. PLoS One 2017; 12: e0173266.
40. Dinh KT, Reznor G, Muralidhar V et al. Association of androgen deprivation therapy with depression in localized prostate cancer. J Clin Oncol 2016; 34: 1905–12.
41. Wu F, Tajar A, Beynon JM et al. Identification of late-onset hypogonadism in middle-aged and elderly men. N Engl J Med 2010; 363: 123–35.
42. Grossmann M, Matsumoto A. A perspective on middle-aged and older men with functional hypogonadism: focus on holistic management. J Clin Endocrinol Metab 2017; 102: 1067–75.
43. Frye CA, Lacey EH. Posttraining androgens’ enhancement of cognitive performance is temporally distinct from androgens’ increases in affective behavior. Cogn Affect Behav Neurosci 2001; 1: 172–82.
44. Gutierrez-Garcia AG, Contreras CM, Vasquez-Hernandez DI et al. Testosterone reduces cumulative burying in female Wistar rats with minimal participation of estradiol. Pharmacol Biochemistry Behavior 2009; 93: 406–12.
45. Estrada-Camarena E, Fernandez-Guasti A, Lopez-Rubalcava C. Antidepressant-like effect of different estrogenic compounds in the forced swimming test. Neuropsychopharmacology 2003; 28: 830–8.
46. Carrier N, Kabbaj M. Testosterone and imipramine have antidepressant effects in socially isolated male but not female rats. Horm Behav 2012; 61 (5): 678–85. DOI: 10.1016/j.yhbeh.2012.03.001
47. Miller KK, Perlis RH, Papakostas GI et al. Low-dose transdermal testosterone augmentation therapy improves depression severity in women. CNS Spectr 2009; 14: 688–94.
48. Shifren JL, Braunstein GD, Simon JA et al. Transdermal testosterone treatment in women with impaired sexual function after oophorectomy. N Engl J Med 2000; 343: 682–8.
49. Hermans EJ, Putman P, Baas JM et al. Exogenous testosterone attenuates the integrated central stress response in healthy young women. Psychoneuroendocrinology 2007; 32: 1052–61.
50. Goldstat R, Briganti E, Tran J et al. Transdermal testosterone therapy improves wellbeing, mood, and sexual function in premenopausal women. Menopause 2003; 10: 390–8.
51. Schmidt PJ, Nieman L, Danaceau MA et al. Estrogen replacement in perimenopause-related depression: a preliminary report. Am J Obstetrics and Gynecology 2000; 183 (2): 414–20.
52. Gleason CE, Dowling ME, Wharton W et al. Effects of hormone therapy on cognition and mood in recently postmenopausal women: findings from the randomized, controlled KEEPS-cognitive and affective study. PLoS Medicine 2015; 12 (6): e1001833.
53. Whedon JM, KizhakkeVeettil A, Rugo NA, Kieffer KA. Bioidentical estrogen for menopausal depressive symptoms: a systematic review and meta-analysis. J Womens Health 2017; 26 (1): 18–28.
54. North American Menopause Society. The role of testosterone therapy in postmenopausal women: position statement of The North American Menopause Society. Menopause 2005; 12 (5): 496–511.
55. Pope HG, Amiaz R, Brennan BP et al. Parallel-group placebo-controlled trial of testosterone gel in men with major depressive disorder displaying an incomplete response to standard antidepressant treatment. J Clin Psychopharmacology 2010; 30 (2): 126–34.
56. Chávez-Castillo M, Núñez V, Nava M et al. Depression as a Neuroendocrine Disorder: Emerging Neuropsychopharmacological Approaches beyond Monoamines. Advances Pharmacological Sci 2019; 2019: 7943481. DOI: 10.1155/2019/7943481
57. Rohr UD. The impact of testosterone imbalance on depression and women’s health. Maturitas 2002; 41 (Suppl. 1): S25–46.
58. Hendrick V, Gitlin M, Altshuler L, Korenman S. Antidepressant medications, mood and male fertility. Psychoneuroendocrinology 2000; 25 (1): 37–51.
59. Rosenber KP, Bleiberg KL, Koscis J, Gross C. A survey of sexual side effects among severely mentally ill patients taking psychotropic medications: impact on compliance. J Sex Marital Ther 2003; 29 4: 289–96.
60. Kennedy SH, Eisfeld BS, Dickens SE et al. Antidepressant-induced sexual dysfunction during treatment with moclobemide, paroxetine, sertraline, and venlafaxine. J Clin Psychiatry 2000; 61 (4): 276–81.
61. Coskuner ER, Culha MG, Ozkan B, Kaleagasi EO. Post-SSRISexual Dysfunction: Preclinical to Clinical. Is It Fact or Fiction? Sex Med Rev 2018; 6: 217–23.
62. Almeida OP, Yeap BB, Hankey GJ et al. Low free testosterone concentration as a potentially treatable cause of depressive symptoms in older men. Arch Gen Psychiatry 2008; 65: 283–9.
63. Hintikka L, Niskanen H, KoivumaaHonkanen T et al. Viinamaki Hypogonadism, decreased sexual desire, and long-term depression in middle-aged men. J Sex Med 2009; 6: 2049–57.
64. Jacobsen NW, Hansen CH, Nellemann C et al. Effects of selective serotonin reuptake inhibitors on three sex steroids in two versions of the aromatase enzyme inhibition assay and in the H295R cell assay. Toxicol In Vitro 2015; 29 (7): 1729–35. DOI: 10.1016/j.tiv.2015.07.005
65. Hansen CH, Larsen LW, Sørensen AM et al. The six most widely used selective serotonin reuptake inhibitors decrease androgens and increase estrogens in the H295R cell line. Toxicol In Vitro 2017; 41: 1–11. DOI: 10.1016/j.tiv.2017.02.001
66. Bataineh HN, Daradka T. Effects of long‐term use of fluoxetine on fertility parameters in adult male rats. Neuro Endocrinol Lett 2007; 28, 321–5.
67. Muller JC, Imazki PH, Boareto AC et al. In vivo and in vitro estrogenic activity of the antidepressant fluoxetine. Reprod Toxicol 2012; 34: 80–5.
68. Tanrikut C, Feldman AS, Altemus M et al. Adverse effect of paroxetine on sperm. Fertil Steril 2010; 94: 1021–6.
69. Ferguson JM. SSRI Antidepressant Medications: Adverse Effects and Tolerability. Prim Care Companion. J Clin Psychiatry 2001; 3 (1): 22–7.
70. Nørr L, Bennedsen B, Fedder Jens, Larsen Erik. Use of selective serotonin reuptake inhibitors reduces fertility in men. Andrology 2016; 4 (3): 389–94. DOI: 10.1111/andr.12184
71. Wang C, Alexander G, Berman N et al. Testosterone replacement therapy improves mood in hypogonadal men – a clinical research center study. J Clin Endocrinol Metab 1996; 81, 3578–83.
72. Seidman SN, Rabkin JG.Testosterone replacement therapy for hypogonadal men with SSRI-refractory depression. J Affect Disord 1998; 48 (2–3): 157–61.
73. Elliott J, Kelly SE, Millar AC et al. Testosterone therapy in hypogonadal men: a systematic review and network meta-analysis. BMJ Open 2017; 7 (11): e015284.
74. Amiaz R, Seidman SN. Testosterone and depression in men. Curr Opin Endocrinol Diabetes Obes 2008; 15 (3): 278–83. DOI: 10.1097/MED. 0b013e3282fc27eb
75. Giltay EJ, van der Mast RC, Lauwen E et al. Plasma Testosterone and the Course of Major Depressive Disorder in Older Men and Women. Am J Geriatr Psychiatry 2017; 25 (4): 425–437. DOI: 10.1016/j.jagp. 2016.12.014


