Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2020
Карипразин как социализирующий препарат при шизофрении (Обзор литературы) №02 2020
Номера страниц в выпуске:16-24
Резюме: Шизофрения является тяжелым и инвалидизирующим психическим заболеванием. Одной из главных причин долгосрочной функциональной инвалидности пациентов с этим заболеванием является выраженность негативной и когнитивной симптоматики и связанной с этим социальной дезадаптации. Между тем большинство антипсихотиков (АП), включая самые современные атипичные антипсихотики (ААП), недостаточно эффективны в отношении уменьшения негативной и когнитивной симптоматики шизофрении, а также в отношении улучшения показателей социального функционирования пациентов с этим заболеванием. Современные нейробиологические исследования указывают на возможную роль дисфункции D3 подтипа дофаминовых рецепторов в развитии негативной и когнитивной симптоматики шизофрении, а также нарушений социального функционирования при этом заболевании. Поэтому карипразин, являясь парциальным агонистом D3 и D2 дофаминовых рецепторов, с преимущественным связыванием с D3 рецепторами, может иметь теоретическое преимущество по эффективности в отношении как негативной и когнитивной симптоматики шизофрении, так и показателей социальной адаптации пациентов в реальном мире. Клинические исследования это систематически подтверждают. На наш взгляд, это может позволить назвать карипразин «социализирующим» препаратом при шизофрении.
Ключевые слова: шизофрения, негативная симптоматика, Блёйлер, аутизм, синдром социального дефицита, социализация, D3 рецепторы, карипразин, социализирующий препарат.
Для цитирования: Р. А. Беккер, Ю. В. Быков, П. В. Морозов. Карипразин как социализирующий препарат при шизофрении (Обзор литературы). Психиатрия и психофармакотерапия им. П. Б. Ганнушкина. 2020; 02, стр. 16–24.
Ключевые слова: шизофрения, негативная симптоматика, Блёйлер, аутизм, синдром социального дефицита, социализация, D3 рецепторы, карипразин, социализирующий препарат.
Для цитирования: Р. А. Беккер, Ю. В. Быков, П. В. Морозов. Карипразин как социализирующий препарат при шизофрении (Обзор литературы). Психиатрия и психофармакотерапия им. П. Б. Ганнушкина. 2020; 02, стр. 16–24.
Резюме: Шизофрения является тяжелым и инвалидизирующим психическим заболеванием. Одной из главных причин долгосрочной функциональной инвалидности пациентов с этим заболеванием является выраженность негативной и когнитивной симптоматики и связанной с этим социальной дезадаптации. Между тем большинство антипсихотиков (АП), включая самые современные атипичные антипсихотики (ААП), недостаточно эффективны в отношении уменьшения негативной и когнитивной симптоматики шизофрении, а также в отношении улучшения показателей социального функционирования пациентов с этим заболеванием. Современные нейробиологические исследования указывают на возможную роль дисфункции D3 подтипа дофаминовых рецепторов в развитии негативной и когнитивной симптоматики шизофрении, а также нарушений социального функционирования при этом заболевании. Поэтому карипразин, являясь парциальным агонистом D3 и D2 дофаминовых рецепторов, с преимущественным связыванием с D3 рецепторами, может иметь теоретическое преимущество по эффективности в отношении как негативной и когнитивной симптоматики шизофрении, так и показателей социальной адаптации пациентов в реальном мире. Клинические исследования это систематически подтверждают. На наш взгляд, это может позволить назвать карипразин «социализирующим» препаратом при шизофрении.
Ключевые слова: шизофрения, негативная симптоматика, Блёйлер, аутизм, синдром социального дефицита, социализация, D3 рецепторы, карипразин, социализирующий препарат.
Для цитирования: Р. А. Беккер, Ю. В. Быков, П. В. Морозов. Карипразин как социализирующий препарат при шизофрении (Обзор литературы). Психиатрия и психофармакотерапия им. П. Б. Ганнушкина. 2020; 02, стр. 16–24.
1 David Ben-Gurion University in Negev.8410501, Israel, Be'er Sheva;
2 Stavropol State Medical University of the Ministry of Health of the Russian Federation.355017, Russian Federation, Stavropol, ul. Mira, d. 310;
3 N.I.Pirogov Russian National Research Medical University of the Ministry of Health of the Russian Federation. 117997, Russian Federation, Moscow, ul. Ostrovitianova, d. 1.
Abstract: Schizophrenia is a severe and disabling mental illness. One of the main causes of long-term functional disability of patients with this disease is the severity of negative and cognitive symptoms and the associated social maladaptation. Meanwhile, most antipsychotics, including the most modern atypical antipsychotics, are not effective enough in reducing the negative and cognitive symptoms of schizophrenia, as well as in improving the real-world social functioning of patients with this disease. Modern neurobiological studies indicate the possible role of D3 dopamine receptor subtype dysfunction in the development of negative and cognitive symptoms of schizophrenia, as well as in the development of impaired social functioning in this disease. Therefore, cariprazine, being a partial agonist of D3 and D2 dopamine receptors, with predominant binding to D3 receptors, may have a theoretical advantage in terms of effectiveness in relation to both negative and cognitive symptoms of schizophrenia and indicators of social adaptation of patients in the real world. Clinical studies systematically confirm this. In our opinion, this may allow us to call cariprazine a “socializing” drug for schizophrenia.
Keywords: schizophrenia, negative symptoms, Bleuler, autism, social deficit syndrome, socialization, D3 receptors, cariprazine, socializing drug.
For citation: R.A.Bekker, Yu.V.Bykov, P.V.Morozov. Cariprazine as a socializing drug in schizophrenia (A Literature Review). Psychiatry and psychopharmacotherapy, 2020, 2, p. 16–24.
Согласно официальной статистике ВОЗ от 2008 года, на сегодняшний день в развитых странах шизофрения является одной из 10 ведущих причин инвалидности (утраты трудоспособности) у взрослых людей обоих полов. Степень инвалидизации и социальной дезадаптации пациентов с шизофренией по-прежнему остается чрезвычайно высокой во всем мире, несмотря на доступность сегодня различных антипсихотиков (АП) и их широкое использование для лечения этой болезни [Hegarty JD et al, 1994; WHO, 2008].
Во всем мире шизофрения ложится тяжелым социально-экономическим и психологическим бременем не только на самого пациента и на его семью или близких родственников, но также и на всю медицинскую систему, всю систему социального обеспечения, на всю экономику и на все общество. Как показывают исследования, основная часть мировых экономических и социальных потерь, связанных с шизофренией, приходится вовсе не на затраты на лечение и психосоциальную реабилитацию этих пациентов, а на потери, связанные с полной или частичной, временной или постоянной, утратой ими трудоспособности. В одних только США эти экономические потери оцениваются как превышающие 60 миллиардов долларов в год, то есть более 1000 долларов в год на каждого жителя США, включая детей [Wyatt RJ et al, 1995; Souetre E, 1997; Trauer T et al, 1998].
Несмотря на доступность во многих странах Запада лечения современными АП и специализированных программ социальной реабилитации и реадаптации пациентов с шизофренией, распространенность полной или частичной инвалидизации (полной или частичной утраты трудоспособности) при этой болезни даже в этих странах остается очень высокой. По разным оценкам, в разных странах Запада сохраняют ограниченную трудоспособность всего лишь от 12 % до 39 % от общего количества пациентов с шизофренией [Knapp M et al, 2004; Mangalore R, Knapp M, 2007; Kozma C et al, 2011; Jonsdottir A, Waghorn G, 2015].
Однако современный многофакторный статистический анализ позволил показать, что вся клиническая симптоматика шизофрении в действительности распадается не на вышеупомянутые два, а как минимум на четыре относительно независимых друг от друга домена, или кластера, симптоматики, четыре относительно независимые «оси измерения» общей тяжести симптоматики шизофрении — а именно: домен позитивной симптоматики, домен негативной симптоматики, домен когнитивных нарушений (КН) и домен аффективной (депрессивной) симптоматики [Lewis SF et al, 2017; Harvey PD et al, 2017].
Более того, в дальнейшем, при более детальном многофакторном анализе, было показано, что домен позитивной симптоматики шизофрении в действительности может быть разложен на субдомен «классической продуктивной симптоматики» (такой как бред и галлюцинации) и субдомен «дезорганизации психики и поведения» (дезорганизация мышления, психомоторное возбуждение, манерные позы и т. д.). Аналогичным образом, домен депрессивной симптоматики шизофрении при более внимательном взгляде также может быть разложен на субдомен «собственно депрессивной симптоматики» и субдомен тревожной симптоматики [Lewis SF et al, 2017; Harvey PD et al, 2017].
Таким образом, домен КН при шизофрении и домен аффективной (депрессивной) симптоматики шизофрении ныне принято выделять в отдельные от доменов негативной и позитивной симптоматики, хотя и коррелирующие с ними, клинические сущности. Вообще, легко заметить, что в современной психиатрии наблюдается тенденция ко все большей дифференциации симптомов такого гетерогенного заболевания, как шизофрения, к поиску новых способов классификации и разбиения этих симптомов на отдельные оси или субдомены симптоматики [Lewis SF et al, 2017; Harvey PD et al, 2017].
Как показали современные исследования, именно степень выраженности КН и, в меньшей мере, степень выраженности негативной и депрессивной симптоматики, в клинической картине шизофрении — гораздо сильнее и гораздо более непосредственным образом определяет долгосрочные функциональные исходы (в том числе трудоспособность пациентов, их способность к самостоятельной жизни, их социальную адаптацию), чем степень выраженности позитивной симптоматики этой болезни [Nasrallah HA et al, 2005; Juckel G, Morosini PL, 2008; Suzuki T et al, 2012].
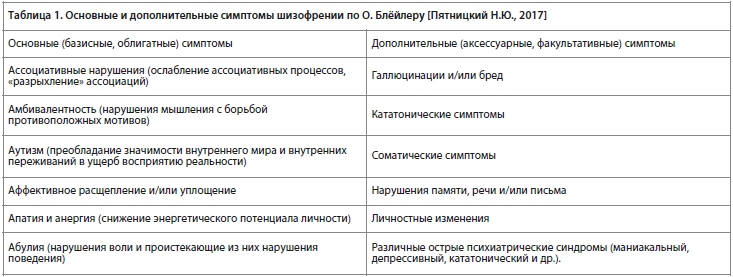
Как известно, О. Блёйлер, впервые введя в психиатрию понятие «группы шизофрений», афористически сформулировал основные симптомы этой группы заболеваний в виде «четырех основных А» — Ассоциативные нарушения, Амбивалентность, Аутизм и Аффективное расщепление и/или уплощение [Беккер Р.А. с соавт., 2019].
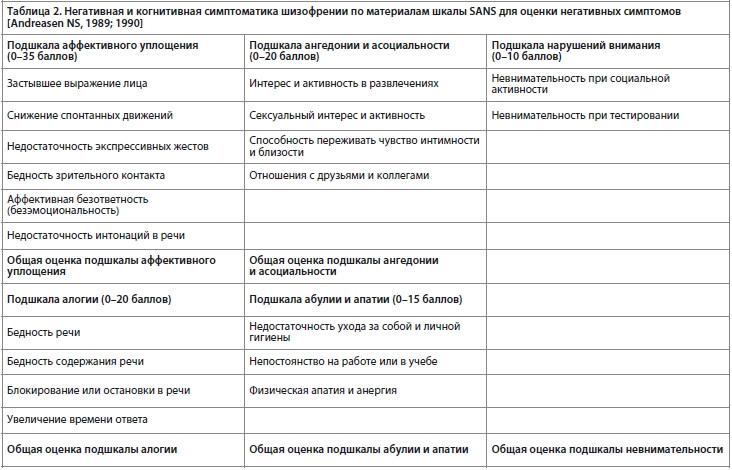
Что именно понимал О. Блёйлер под этими терминами, и как эти понятия отображаются на современные представления о том, что есть такое негативная и когнитивная симптоматика при шизофрении — хорошо иллюстрируют две приведенные нами ниже для сопоставления таблицы. В качестве примера для иллюстрации того, как понимается сегодня негативная и когнитивная симптоматика шизофрении, мы взяли предложенную Нэнси Андреасен шкалу SANS для оценки выраженности негативных симптомов [Andreasen NS, 1989; 1990].
Как легко увидеть из сравнения этих двух таблиц, представления О. Блёйлера о ключевых, облигатных симптомах шизофрении в значительной степени перекликаются с современными представлениями о негативной и когнитивной симптоматике при этой болезни. Различаются только используемые термины. В частности, представления О. Блёйлера об аутизме при шизофрении достаточно хорошо отображаются на подшкалу «ангедония — асоциальность» шкалы SANS, предложенной Нэнси Андреасен.
Концепция О. Блёйлера, включавшая в себя аутизм как один из ключевых, определяющих и патогномоничных признаков шизофрении, долгое время признавалась клинически валидной психиатрами самых разных взглядов и направлений (как биологически, так и психоаналитически ориентированными).
В 1943 году Лео Каннер впервые описал «ранний детский аутизм» (РДА) как отдельный специфический клинический синдром. Примерно в то же время Ганс Аспергер описал высокофункциональный аутизм, впоследствии названный в его честь «синдромом Аспергера». Оба этих автора рассматривали описанные ими синдромы как некую разновидность «детской шизофрении», то есть шизофрении, которая манифестирует в раннем детстве (в случае РДА) или несколько позже (в случае синдрома Аспергера) [Frye RE, 2018].
Такой взгляд на природу детского аутизма, как части шизофренического спектра, сохранялся в психиатрии до 1980 года, когда в DSM-III ввели отдельную диагностическую категорию РДА — как категорию, отличную от категории шизофрении и других психотических расстройств. Примерно с этого же времени, чтобы избежать терминологической путаницы, в западной литературе термин «аутизм» применительно к шизофрении, для описания специфической социальной отгороженности и дезадаптации, стали применять все реже, вплоть до полного отказа от его использования [Frye RE, 2018].
В 1987 году в DSM-III-R был введен термин «первазивное расстройство раннего развития, неуточненное» — для описания детей, симптоматика которых не полностью подходила под диагноз РДА, но тем не менее характеризовалась выраженным нарушением социальных навыков.
В 1994 году в DSM-IV был официально введен диагноз синдрома Аспергера [Frye RE, 2018].
В самой последней редакции DSM, DSM-5, принятой в 2013 году, часовая стрелка сделала полный оборот: отдельные диагностические категории для РДА, синдрома Аспергера и «первазивного расстройства раннего развития, неуточненного» были удалены из DSM, а вместо них введено понятие расстройств аутистического спектра (РАС), как непрерывного континуума расстройств, различающихся по степени тяжести клинической симптоматики [Frye RE, 2018].
Одновременно с этим была удалена из DSM проводившаяся ранее классификация всех симптомов РАС на нарушения речи (вербальной коммуникации), нарушения невербальной коммуникации (мимики, жестов), и нарушения социальных навыков. Все они были объединены под общим зонтичным понятием «нарушения коммуникации и социальных навыков». Обоснованием для удаления этого разделения из DSM послужило то, что в действительности очень сложно провести грань между нарушениями вербальной и невербальной коммуникации, и нарушениями прочих социальных навыков [Frye RE, 2018].
Многие авторы сегодня предлагают рассматривать РАС прежде всего как «расстройства социального взаимодействия», или как «болезни социального дефицита» (social deficit disorders) разной степени тяжести [Frye RE, 2018].
Такое своеобразное «изгнание» понятия аутизма по О. Блёйлеру из общей концепции шизофрении и перенос этого понятия исключительно в сферу ведения детской психиатрии не было всего лишь простым терминологическим изменением. Оно имело целый ряд негативных последствий. В частности, одним из важных негативных последствий такого «изгнания аутизма из концепции шизофрении» было то, что проблеме нарушений социализации больных шизофренией долгое время могло уделяться недостаточно внимания.
Между тем, если вспомнить об изначальной концепции О. Блёйлера, включавшей аутизм в число облигатных симптомов «группы шизофрений», а также о том, сколь часты на самом деле нарушения социальной адаптации при шизофрении, то становится очевидным, что эти симптомы играют очень важную роль и в клинической картине шизофрении, и во многом предопределяют инвалидизацию пациентов с этим заболеванием. Поэтому мы, признавая правомерность выделения РАС в отдельную диагностическую категорию и правомерность проведения различия между РАС и «детской шизофренией», а также целесообразность недопущения терминологической путаницы, в то же время не вполне согласны с состоявшимся де-факто «изгнанием понятия аутизма из концепции шизофрении».
Стоит заметить, что многие авторы еще с 1970-х годов предлагали рассматривать социальную дисфункцию при шизофрении как отдельный, специфический клинический синдром в рамках ее, или как отдельную ось или субдомен измерения психопатологии шизофрении [Strauss JS et al, 1974; Lezenweger MF. Dworkin RH, 1996; Mier D, Kirsch P, 2017].
А, например, в подглаве «Psychosis as a defining dimension in schizophrenia» главы о шизофрении свежего (2017 года) фундаментального руководства по психиатрии Каплана — Сэдока, среди характерных для шизофрении признаков, наряду с позитивной, негативной и когнитивной симптоматикой, отдельно через запятую упоминается социальная дисфункция [Ivleva EI, Tamminga CA, 2017].
Мы хотим предложить для социальной дисфункции при шизофрении, по аналогии с негативным, позитивным и депрессивным синдромами, а также синдромом когнитивных нарушений, наименование «синдром социального дефицита». Насколько нам известно, ранее в литературе этот термин не употреблялся.
Одной из главных причин того, что шизофрения традиционно рассматривалась и до сих пор рассматривается как тяжелое и инвалидизирующее психическое заболевание, которое обычно имеет прогноз в диапазоне от «довольно плохого» до «очень плохого», является как раз значительная выраженность при ней социальной дисфункции, то есть — стойкого и глубокого нарушения социальной адаптации и социального функционирования. Свежим доказательством этого тезиса является множество сегодняшних пациентов с шизофренией, которые, благодаря изобретению терапии АП, ныне не нуждаются в длительной или пожизненной институционализации, и могут жить на свободе, в обществе, однако при этом продолжают проявлять стойкие и выраженные нарушения социальной адаптации и признаки неудовлетворительного, низкого или очень низкого уровня социального функционирования [Moll MF, Saeki T, 2009].
Литературные данные систематически указывают на то, что социальная дисфункция при шизофрении, то есть нарушение психосоциального функционирования и социальной адаптации, характерное для пациентов с шизофренией, резко снижает их общее качество жизни. Кроме того, проявлениями (симптомами) или даже, скорее, следствиями синдрома социального дефицита являются, например, низкий уровень образования (в частности, из-за незаконченного или прерванного образования), отсутствие работы, неполная занятость или занятие неквалифицированным, низкооплачиваемым трудом, низкий уровень профессиональной квалификации, низкий социально-экономический статус, снижение или полная утрата способности к самостоятельному существованию (вплоть до утраты способности к простейшему бытовому самообслуживанию и к соблюдению личной гигиены, не говоря уже о финансовой независимости), одиночество (отсутствие супруга/супруги или интимного партнера/партнерши), бездетность, и даже бездомность (утрата жилья или бродяжничество) [Lieberman JA et al, 2008; Barnes TR et al, 2008; Saarni SI et al, 2010].
Показано, что снижение общего качества жизни и степени субъективной удовлетворенности жизнью сильнее коррелирует со степенью выраженности социальной дисфункции, чем с каким-либо другим доменом симптоматики шизофрении, включая такие ранее уже установленные сильные корреляты общего качества жизни, как степень выраженности негативной, когнитивной и депрессивной симптоматики. Кроме того, в очередной раз подтвердилось также, что снижение общего качества жизни и субъективной удовлетворенности жизнью у пациентов с шизофренией сильнее коррелирует со степенью выраженности негативной, когнитивной и депрессивной симптоматики, а также со степенью выраженности побочных эффектов (ПЭ) от терапии АП, чем со степенью выраженности позитивной (продуктивной) симптоматики [Salokangas RK et al, 2006].
Группа финских исследователей во главе с Хонканеном еще в 1996 году, при исследовании общего качества жизни и степени субъективной удовлетворенности жизнью у пациентов с шизофренией с помощью различных шкал, обратила внимание на то, что у этих пациентов в среднем значительно хуже социальное функционирование и степень социальной адаптированности, по сравнению с пациентами с любыми другими психическими заболеваниями [Koivumaa-Honkanen HT et al, 1996].
Кроме того, финские исследователи также обнаружили, что низкое общее качество жизни и неудовлетворенность жизнью у пациентов с шизофренией сильнее коррелируют с низким уровнем социального функционирования и с плохой социальной приспособленностью («неустроенностью в жизни»), чем с любым другим параметром, например, с выраженностью позитивной, негативной или депрессивной симптоматики [Koivumaa-Honkanen HT et al, 1996].
Позднее, в 2001 году, Мальм с соавторами использовали полуструктурированный опросник общего качества жизни и удовлетворенности жизнью (QOLC) для оценки данных параметров у 40 пациентов с шизофренией через 2 года после их последней госпитализации. Им удалось показать, что подавляющее большинство пациентов с шизофренией выражают сильное недовольство и неудовлетворенность практически всеми аспектами собственной жизни, но особенно — как раз именно теми аспектами, которые имеют отношение к проявлениям у них социальной дисфункции, к уровню их социального функционирования и социальной адаптации, например, одиночеством, отсутствием близких друзей, бездетностью, конфликтной и неблагополучной семейной жизнью, проблемами во взаимоотношениях с родственниками, соседями, друзьями, сотрудниками и другими окружающими лицами, отсутствием работы или тяжелой и малоквалифицированной работой, собственным низким уровнем образования и квалификации, низким уровнем доходов, низким социальным статусом, финансовыми проблемами (наличием неоплаченных долгов, неумением планировать собственные расходы и сопоставлять их со своим уровнем доходов, неумением экономить и копить деньги) и т. д. [Malm U et al, 2001].
Показано, что те или иные проявления синдрома социального дефицита (то есть, выраженные в той или иной степени нарушения социального функционирования и адаптации в реальном социальном мире), так же как и специфические и неспецифические КН, и некоторые проявления негативного синдрома (негативной симптоматики шизофрении) могут наблюдаться, и действительно часто наблюдались, у пациентов, у которых впоследствии развилась шизофрения, еще в продромальном периоде болезни, или даже в преморбиде, задолго до первого манифестного психоза (то есть задолго до появления «классической» продуктивной симптоматики) [Couture SM et al, 2006; Ivleva EI, Tamminga CA, 2017].
Кроме того, эти же проявления — как социальная дисфункция, так и различные специфические и неспецифические КН, и некоторые проявления негативной симптоматики — в более мягкой форме могут также наблюдаться, и часто наблюдаются, у пациентов из так называемых «групп высокого или очень высокого клинического риска развития психоза» — high or ultra-high clinical risk of psychosis group (например, у детей, у которых один или оба родителя страдают шизофренией, или у пациентов, которые по внешним признакам находятся в продромальном периоде, но еще не развили манифестный психоз). Часть таких пациентов (от 15 % до 40–50 %, по разным оценкам) впоследствии действительно манифестирует и получает диагноз шизофрении [Couture SM et al, 2006; Ivleva EI, Tamminga CA, 2017].
Эти же проявления — как синдром социального дефицита, так и различные специфические и неспецифические КН, и некоторые проявления негативной симптоматики — также могут наблюдаться, и часто наблюдаются, в смягченной форме у родственников пациентов с шизофренией, имеющих 1-ю и даже 2-ю степень родства с пациентом, но никогда за всю жизнь так и не развивающих манифестного психоза. Эти данные указывают на то, что социальная дисфункция, так же как и нейрокогнитивный дефицит, и негативная симптоматика шизофрении, могут иметь нейробиологическую, генетическую основу, и что эти нарушения могут лежать ближе к основам этиологии и патогенеза шизофрении, чем продуктивная симптоматика, наблюдаемая в период психозов [Couture SM et al, 2006; Ivleva EI, Tamminga CA, 2017].
Показано, что умение понимать социальный контекст, рамки допустимого и недопустимого в конкретном микросоциуме поведения (социальная когниция), умение распознавать и понимать чувства и эмоции других людей (эмоциональная когниция), умение делать обоснованные предположения о том, что думают и чувствуют, или чего хотят добиться теми или иными словами или поступками другие люди (то есть, умение строить свою собственную, внутреннюю модель психического состояния других людей — self-constructed internal theory of mind), — глубоко нарушены при шизофрении [Dodell-Feder D et al, 2015; Ivleva EI, Tamminga CA, 2017].
Вследствие этого мир социальных взаимодействий, в частности, взаимодействие с другими людьми и коллективами, выстраивание межличностных и внутригрупповых отношений, — представляется пациентам с шизофренией особенно сложным, запутанным и даже пугающим. Этому способствует также свойственное шизофрении нарушение способности к отфильтровыванию значимой (в данном случае — социально и/или эмоционально значимой) информации от незначимой, проявляющееся, например, в нарушении у них процессов преимпульсного ингибирования, или в их склонности к обобщению и категоризации вещей, предметов и явлений не по важнейшим, значимым признакам, а по признакам слабым и незначимым [Dodell-Feder D et al, 2015; Ivleva EI, Tamminga CA, 2017].
Этот эффект ТАП в то время позволил огромному количеству пациентов с шизофренией, ранее фактически «приговоренных» к длительной или даже пожизненной институционализации в закрытых психиатрических стационарах, впервые выйти на свободу, вернуться в семью и общество. Этот же эффект ТАП позволил значительно снизить частоту повторных госпитализаций при шизофрении, а часть случаев шизофрении (как обострений, так и первичных манифестных психозов) вообще изначально лечить исключительно в амбулаторном режиме, полностью избежав госпитализации и ее нежелательных психологических и социально-экономических последствий. Опять-таки, данное положение справедливо и сегодня, причем для любых АП [Couture SM et al, 2006; Kane JM, Correll CU, 2017].
Тем не менее, проблема улучшения долгосрочных функциональных исходов при шизофрении, и, в частности, проблема снижения уровня инвалидизации среди пациентов с шизофренией, не была решена с помощью лечения ТАП [Priebe S, 2007; Harvey PD, Bowie CR, 2012].
Это связано с недостаточной эффективностью ТАП в отношении негативной, когнитивной и депрессивной симптоматики шизофрении, а также с тем, что ТАП сами могут вызывать так называемую «вторичную негативную симптоматику», или НИДС, а также нейролептические депрессии, нейролептик-индуцированные КН. Кроме того, ТАП также вызывают ЭПС, многие проявления которого легко спутать с негативной симптоматикой шизофрении, с депрессией или с некоторыми проявлениями КН, свойственных самой шизофрении (например, брадипсихизм и аспонтанность, вызванные лекарственным паркинсонизмом, легко спутать с брадипсихизмом и аспонтанностью, вызванными самой болезнью) [Priebe S, 2007; Harvey PD, Bowie CR, 2012; Kane JM, Correll CU, 2017].
Все это послужило основанием для создания многочисленных так называемых ААП. Препараты этой группы действительно в среднем реже вызывают ЭПС, НИДС, нейролептические депрессии, нейролептик-индуцированные КН, а если и вызывают, то в более легкой форме. Более того, по некоторым данным, ААП в целом, как класс, даже могут сами обладать некоторой (хотя, скорее всего, довольно ограниченной) эффективностью и в отношении первичной негативной и депрессивной симптоматики шизофрении, и в отношении свойственных шизофрении КН [Priebe S, 2007; Harvey PD, Bowie CR, 2012; Kane JM, Correll CU, 2017].
Тем не менее, хотя создание и внедрение ААП и было огромным шагом вперед по сравнению с ТАП, массовый переход к применению ААП вместо ТАП привел к значительно меньшему, чем ожидалось при их создании, улучшению долгосрочных функциональных исходов у пациентов с шизофренией, и в том числе — к значительно меньшему, чем ожидалось, снижению у них выраженности синдрома социального дефицита.
Поэтому, несмотря на создание и широкое применение различных ААП при лечении шизофрении, проблема улучшения ее долгосрочных функциональных исходов, и, в частности проблема преодоления или уменьшения социальной дисфункции при этой болезни, — все еще остается весьма актуальной проблемой современной психиатрии [Priebe S, 2007; Harvey PD, Bowie CR, 2012; Kane JM, Correll CU, 2017].
Показано, что проявления социальной дисфункции, свойственной шизофрении, могут практически не уменьшаться, или же лишь в незначительной степени смягчаются, при стандартном лечении АП, даже при применении большинства современных ААП [Swartz MS et al, 2007; Keefe RS et al, 2007; Drake RE et al, 2017].
В связи с этим ряд авторов предположили, что необходимо искать новые перспективные методы «социализирующей терапии» при шизофрении, новые методы лечения свойственной этой болезни негативной и когнитивной симптоматики и связанной с ними социальной дисфункции. В том числе, наряду с расширением применения при этой болезни психотерапии и мер по социальной реабилитации и реадаптации пациентов, по их интеграции в семью и общество, нужно также искать новые методы фармакологической коррекции негативной и когнитивной симптоматики и связанной с ними социальной дисфункции [Stahl SM, 2013; Dodell-Feder D et al, 2015; Kane JM, Correll CU, 2017; Drake RE et al, 2017].
Вместе с тем, известно также, что негативная (дефицитарная), депрессивная, когнитивная и диссоциальная симптоматика шизофрении гораздо хуже поддаются терапии АП [Millan MJ, 2005; Kane JM, Correll CU, 2017].
Это положение дел сохраняется и сегодня, даже при применении большинства современных ААП [Millan MJ, 2005; Kane JM, Correll CU, 2017].
Известно, что одной из самых глубоко нарушенных при шизофрении является дофаминергическая система мозга, и что все существующие на рынке АП оказывают свое антипсихотическое действие благодаря своему взаимодействию с дофаминергическими механизмами в ЦНС. В свое время установление именно этого факта привело к формулировке «дофаминовой теории шизофрении». Долгое время наибольшее значение как в этиологии и патогенезе шизофрении, так и в механизмах действия АП придавалось дофаминовым рецепторам подтипа D2. В частности, было показано, что для проявления действия как ТАП, так и большинства ААП (кроме клозапина и кветиапина) на позитивную (продуктивную) симптоматику шизофрении необходима блокада не менее 65 % от общего количества D2 рецепторов в стриатуме [Millan MJ, 2005; Stahl SM, 2013; Kane JM, Correll CU, 2017].
Между тем, рецепторов для дофамина в мозгу известно как минимум пять типов. Ученые достаточно давно понимали, что в этиологии и патогенезе разных субдоменов симптоматики шизофрении могут участвовать и активно участвуют и другие подтипы дофаминовых рецепторов, помимо D2 подтипа. Однако до недавнего времени изучению роли других четырех подтипов дофаминовых рецепторов в этиологии и патогенезе шизофрении, а также изучению их пригодности в качестве возможной терапевтической мишени для разработки новых перспективных классов АП, уделялось мало внимания [Millan MJ, 2005; Perez JM, Ghose S, 2017].
Одной из причин такого положения дел было то, что до недавнего времени у ученых не было возможности селективно визуализировать с помощью позитронно-эмиссионной томографии (ПЭТ), например, D3 или D4 дофаминовые рецепторы — для них не существовало высокоселективных радиоактивных лигандов. Это положение дел начало меняться только совсем недавно, с появлением D3 селективных радиолигандов, таких, как [11С]-PHNO, и D4 селективных радиолигандов, таких, как [11C]-NMSP [Perez JM, Ghose S, 2017].
Говоря об исследовании работы D3 дофаминовых рецепторов в живом мозге с помощью высокоселективных меченых радиолигандов, таких, как [11С]-PHNO, мы должны сделать одно важное замечание. А именно: PHNO, действительно, обладает высокой аффинностью к D3 подтипу дофаминовых рецепторов, и проявляет хорошую селективность к этому подтипу рецепторов in vitro. Однако в исследованиях in vivo его селективность к D3 подтипу дофаминовых рецепторов, к сожалению, оказывается далеко не столь хорошей. К счастью, пространственное распределение и плотность D3 и D2 подтипов дофаминовых рецепторов в разных областях мозга значительно различаются. Именно это замечательное свойство мозга позволяет ученым-исследователям, имея в руках лишь далеко не совершенные инструменты измерения — не очень D3 селективные in vivo радиолиганды, такие, как [11С]-PHNO, тем не менее успешно вычислять степень D3 селективности того или иного АП in vivo [Perez JM, Ghose S, 2017].
Это замечание важно по той причине, что в исследованиях in vitro ту или иную степень аффинности к D3 подтипу дофаминовых рецепторов, наряду с аффинностью к D2 подтипу, проявляют многие АП, если не большинство из них. Однако в исследованиях in vivo только лишь карипразин и блонансерин проявляют способность вытеснять меченый [11С]-PHNO из связи с D3 дофаминовыми рецепторами мозга [Perez JM, Ghose S, 2017].
В экспериментальных моделях шизофрении на животных было показано, что D3 подтип дофаминовых рецепторов может быть перспективной терапевтической мишенью для влияния на негативную и когнитивную симптоматику шизофрении, а также на проявления социальной дисфункции при ней. Это заставило ученых предположить, что создание новых ААП, которые бы предпочтительно блокировали D3, а не D2 подтип дофаминовых рецепторов, может дать этим новым АП терапевтические преимущества в отношении эффективности устранения негативной и когнитивной симптоматики шизофрении, а также в отношении улучшения социализации больных шизофренией [Millan MJ, 2005; Stahl SM, 2013; Perez JM, Ghose S, 2017; Takeuchi S et al, 2019].
Действительно, в экспериментальной модели шизофрении на крысах было показано, что внутрибрюшинное введение карипразина (парциального агониста D3 и D2 подтипов дофаминовых рецепторов с преимущественным связыванием с D3 подтипом) в дозах от 0,03 до 0,3 мг/кг значительно уменьшало неонатальную социальную изоляцию животных и приводило к повышению их двигательной активности [Watson DJG et al, 2016].
В другой экспериментальной модели шизофрении, вызванной введением крысам NMDA антагониста фенциклидина, было показано, что карипразин значительно эффективнее рисперидона устраняет негативную симптоматику и КН, вызванные введением фенциклидина (нарушения памяти, концентрации внимания, распознавания образов, нарушения обучаемости). В том числе, что особенно важно в контексте данной статьи, карипразин в этой модели оказался значительно эффективнее рисперидона в отношении устранения именно нарушений социальной и эмоциональной когниции у животных [Neill JC et al, 2016].
Возникает вопрос о том, насколько эти доклинические данные применимы к клинической эффективности карипразина в отношении влияния на социальное функционирование пациентов с шизофренией. Ниже мы обсудим доказательную базу по этому вопросу.
Так, в частности, в 2017 году были опубликованы результаты одного крупного (461 участник) многоцентрового двойного слепого сравнительного РКИ, посвященного сопоставлению эффективности и безопасности применения карипразина, в сравнении с рисперидоном, в лечении шизофрении, прежде всего с преобладанием негативной симптоматики [Németh G et al, 2017 (b)].
Весьма важно то, что это РКИ проводилось на протяжении достаточно длительного периода (26 недель). Это позволило авторам оценивать и сопоставлять влияние сравниваемых препаратов не только на выраженность симптомов из различных субдоменов симптоматики шизофрении, как таковых, но и на объективные параметры социального функционирования пациентов в реальном мире. После периода отмены предшествующей терапии, который составлял 2 недели, 231 пациент был рандомизирован в группу рисперидона (группу сравнения), а 230 пациентов — в группу карипразина (группу исследуемого активного лечения) [Németh G et al, 2017 (b)].
В качестве основного способа оценки и сопоставления эффективности лечения, а также в качестве первичной конечной точки (primary clinical endpoint), в этом РКИ использовалось изменение среднего балла по шкале негативной симптоматики PANSS Factor Score For Negative Symptoms (PANSS-FSNS), а также изменение среднего балла по шкале личностного и социального функционирования в реальном мире (PSP). Авторам этого РКИ удалось показать, что к сроку 26 недель снижение среднего балла по PANSS-FSNS в группе карипразина было статистически достоверно и значительно больше, чем таковое же снижение в группе рисперидона, при сопоставимой и стабильной эффективности обоих препаратов в отношении позитивной симптоматики [Németh G et al, 2017 (b)].
Однако еще более важно то, что, помимо более значительного снижения степени выраженности негативной симптоматики, пациенты, получавшие карипразин, также продемонстрировали более существенное улучшение объективных показателей шкалы PSP, по сравнению с пациентами, получавшими рисперидон. Это улучшение было зафиксировано в трех из четырех изучавшихся субдоменов личностного и социального функционирования [Németh G et al, 2017 (b)].
В другом двойном слепом сравнительном РКИ сопоставляли влияние лечения карипразином, в сравнении с лечением рисперидоном, на общую интегральную оценку качества жизни и удовлетворенности жизнью, с поправкой на годы жизни (QALY), у пациентов с шизофренией с преобладанием негативной симптоматики [Németh B et al, 2017 (a)].
Авторам этого РКИ удалось показать, что пациенты, получавшие карипразин, имели в среднем более высокую субъективную оценку общего качества своей жизни, более высокие показатели субъективной удовлетворенности своей жизнью и ее различными аспектами, а также более высокую субъективную оценку собственного состояния психического и соматического здоровья и собственного уровня социального функционирования, по сравнению с пациентами, получавшими рисперидон. Это привело к расчетному увеличению QALY на 0,029 на 1 пациента после 1 года лечения [Németh B et al, 2017 (a)].
Авторы данного исследования сделали вывод, что карипразин, в силу своего более выраженного, по сравнению с рисперидоном, положительного влияния на негативную симптоматику шизофрении, а также на объективные показатели личностного и социального функционирования и адаптации в реальном мире, и в силу более низкого, по сравнению с рисперидоном, уровня ПЭ и лучшей переносимости, может обеспечить значительное повышение общего качества жизни (QALY) при лечении пациентов с шизофренией, особенно с преобладанием негативной симптоматики [Németh B et al, 2017 (a)].
Карипразин может оказывать выраженное положительное влияние не только на измеренные по шкалам проявления негативной симптоматики шизофрении (более выраженное, чем у рисперидона), но и на объективные показатели личностного и социального функционирования и социальной адаптации в реальном мире, то есть на проявления социальной дисфункции [Németh G et al, 2017 (b); Németh B et al, 2017 (a)].
На наш взгляд, это может позволить называть карипразин «социализирующим препаратом при шизофрении».
Это теоретическое предположение подтвердилось в РКИ, показавших преимущество карипразина перед рисперидоном не только в отношении уменьшения негативной симптоматики шизофрении, но и в отношении влияния на социализацию больных шизофренией и на их общее качество жизни (которое во многом зависит от степени социальной адаптированности больного). На наш взгляд, это может позволить называть карипразин «социализирующим препаратом при шизофрении».
В свете того, сколь важное значение имеет улучшение социальной адаптации пациентов с шизофренией для их долгосрочной функциональности, это свойство карипразина может являться очень важным. Оно может предоставить новые возможности для лечения этого тяжелого заболевания и, особенно, для уменьшения инвалидизации и социальной дезадаптации пациентов с шизофренией.
Сведения об авторах:
Беккер Роман Александрович — исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве;
Быков Юрий Витальевич — ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Морозов Петр Викторович — д-р мед. наук, проф. каф. психиатрии ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: prof.morozov@gmail.com
Ключевые слова: шизофрения, негативная симптоматика, Блёйлер, аутизм, синдром социального дефицита, социализация, D3 рецепторы, карипразин, социализирующий препарат.
Для цитирования: Р. А. Беккер, Ю. В. Быков, П. В. Морозов. Карипразин как социализирующий препарат при шизофрении (Обзор литературы). Психиатрия и психофармакотерапия им. П. Б. Ганнушкина. 2020; 02, стр. 16–24.
Cariprazine as a socializing drug in schizophrenia (A Literature Review)
R.A.Bekker1, Yu.V.Bykov 2, P.V.Morozov31 David Ben-Gurion University in Negev.8410501, Israel, Be'er Sheva;
2 Stavropol State Medical University of the Ministry of Health of the Russian Federation.355017, Russian Federation, Stavropol, ul. Mira, d. 310;
3 N.I.Pirogov Russian National Research Medical University of the Ministry of Health of the Russian Federation. 117997, Russian Federation, Moscow, ul. Ostrovitianova, d. 1.
Abstract: Schizophrenia is a severe and disabling mental illness. One of the main causes of long-term functional disability of patients with this disease is the severity of negative and cognitive symptoms and the associated social maladaptation. Meanwhile, most antipsychotics, including the most modern atypical antipsychotics, are not effective enough in reducing the negative and cognitive symptoms of schizophrenia, as well as in improving the real-world social functioning of patients with this disease. Modern neurobiological studies indicate the possible role of D3 dopamine receptor subtype dysfunction in the development of negative and cognitive symptoms of schizophrenia, as well as in the development of impaired social functioning in this disease. Therefore, cariprazine, being a partial agonist of D3 and D2 dopamine receptors, with predominant binding to D3 receptors, may have a theoretical advantage in terms of effectiveness in relation to both negative and cognitive symptoms of schizophrenia and indicators of social adaptation of patients in the real world. Clinical studies systematically confirm this. In our opinion, this may allow us to call cariprazine a “socializing” drug for schizophrenia.
Keywords: schizophrenia, negative symptoms, Bleuler, autism, social deficit syndrome, socialization, D3 receptors, cariprazine, socializing drug.
For citation: R.A.Bekker, Yu.V.Bykov, P.V.Morozov. Cariprazine as a socializing drug in schizophrenia (A Literature Review). Psychiatry and psychopharmacotherapy, 2020, 2, p. 16–24.
Введение
Шизофрения является достаточно распространенным психическим заболеванием. Она поражает в среднем около 1 % человеческой популяции по всему миру. Несмотря на общеизвестные сегодня факты о значительной гетерогенности и полиморфности клинической симптоматики, течения и прогноза этой болезни — факты, которые были впервые отмечены еще Ойгеном Блёйлером при введении им понятия «группа шизофрений», — сегодня мы знаем также, что весьма нередко течение этой болезни принимает тяжелый, хронический, неуклонно прогрессирующий или же часто рецидивирующий характер. Это впервые было подмечено еще Эмилем Крепелиным, который сгруппировал все хронические психозы с подобным лонгитудинальным течением и прогнозом, например, «паранойю» и «кататонию», под общим названием «деменция прекокс». Вследствие этого шизофрения часто приводит к значительной инвалидизации и социальной дезадаптации пациентов, страдающих этим заболеванием [Tamminga CA, 2017].Согласно официальной статистике ВОЗ от 2008 года, на сегодняшний день в развитых странах шизофрения является одной из 10 ведущих причин инвалидности (утраты трудоспособности) у взрослых людей обоих полов. Степень инвалидизации и социальной дезадаптации пациентов с шизофренией по-прежнему остается чрезвычайно высокой во всем мире, несмотря на доступность сегодня различных антипсихотиков (АП) и их широкое использование для лечения этой болезни [Hegarty JD et al, 1994; WHO, 2008].
Во всем мире шизофрения ложится тяжелым социально-экономическим и психологическим бременем не только на самого пациента и на его семью или близких родственников, но также и на всю медицинскую систему, всю систему социального обеспечения, на всю экономику и на все общество. Как показывают исследования, основная часть мировых экономических и социальных потерь, связанных с шизофренией, приходится вовсе не на затраты на лечение и психосоциальную реабилитацию этих пациентов, а на потери, связанные с полной или частичной, временной или постоянной, утратой ими трудоспособности. В одних только США эти экономические потери оцениваются как превышающие 60 миллиардов долларов в год, то есть более 1000 долларов в год на каждого жителя США, включая детей [Wyatt RJ et al, 1995; Souetre E, 1997; Trauer T et al, 1998].
Несмотря на доступность во многих странах Запада лечения современными АП и специализированных программ социальной реабилитации и реадаптации пациентов с шизофренией, распространенность полной или частичной инвалидизации (полной или частичной утраты трудоспособности) при этой болезни даже в этих странах остается очень высокой. По разным оценкам, в разных странах Запада сохраняют ограниченную трудоспособность всего лишь от 12 % до 39 % от общего количества пациентов с шизофренией [Knapp M et al, 2004; Mangalore R, Knapp M, 2007; Kozma C et al, 2011; Jonsdottir A, Waghorn G, 2015].
Эволюция научных взглядов на шизофрению
Традиционно, еще со времен Э. Крепелина, все симптомы, свойственные шизофрении, было принято подразделять на позитивные (то есть приводящие к появлению в психике пациента чего-то нового, каких-то дополнительных феноменов, не свойственных здоровой психике и не свойственных этому же пациенту до манифестации болезни, — например, галлюцинации, бред, психомоторное возбуждение) и негативные (то есть приводящие к снижению или даже к полной утрате нормальных, естественных психических функций и способностей — например, апатия, абулия, ангедония, аутизация, десоциализация) [Lewis SF et al, 2017].Однако современный многофакторный статистический анализ позволил показать, что вся клиническая симптоматика шизофрении в действительности распадается не на вышеупомянутые два, а как минимум на четыре относительно независимых друг от друга домена, или кластера, симптоматики, четыре относительно независимые «оси измерения» общей тяжести симптоматики шизофрении — а именно: домен позитивной симптоматики, домен негативной симптоматики, домен когнитивных нарушений (КН) и домен аффективной (депрессивной) симптоматики [Lewis SF et al, 2017; Harvey PD et al, 2017].
Более того, в дальнейшем, при более детальном многофакторном анализе, было показано, что домен позитивной симптоматики шизофрении в действительности может быть разложен на субдомен «классической продуктивной симптоматики» (такой как бред и галлюцинации) и субдомен «дезорганизации психики и поведения» (дезорганизация мышления, психомоторное возбуждение, манерные позы и т. д.). Аналогичным образом, домен депрессивной симптоматики шизофрении при более внимательном взгляде также может быть разложен на субдомен «собственно депрессивной симптоматики» и субдомен тревожной симптоматики [Lewis SF et al, 2017; Harvey PD et al, 2017].
Таким образом, домен КН при шизофрении и домен аффективной (депрессивной) симптоматики шизофрении ныне принято выделять в отдельные от доменов негативной и позитивной симптоматики, хотя и коррелирующие с ними, клинические сущности. Вообще, легко заметить, что в современной психиатрии наблюдается тенденция ко все большей дифференциации симптомов такого гетерогенного заболевания, как шизофрения, к поиску новых способов классификации и разбиения этих симптомов на отдельные оси или субдомены симптоматики [Lewis SF et al, 2017; Harvey PD et al, 2017].
Как показали современные исследования, именно степень выраженности КН и, в меньшей мере, степень выраженности негативной и депрессивной симптоматики, в клинической картине шизофрении — гораздо сильнее и гораздо более непосредственным образом определяет долгосрочные функциональные исходы (в том числе трудоспособность пациентов, их способность к самостоятельной жизни, их социальную адаптацию), чем степень выраженности позитивной симптоматики этой болезни [Nasrallah HA et al, 2005; Juckel G, Morosini PL, 2008; Suzuki T et al, 2012].
Как известно, О. Блёйлер, впервые введя в психиатрию понятие «группы шизофрений», афористически сформулировал основные симптомы этой группы заболеваний в виде «четырех основных А» — Ассоциативные нарушения, Амбивалентность, Аутизм и Аффективное расщепление и/или уплощение [Беккер Р.А. с соавт., 2019].
Что именно понимал О. Блёйлер под этими терминами, и как эти понятия отображаются на современные представления о том, что есть такое негативная и когнитивная симптоматика при шизофрении — хорошо иллюстрируют две приведенные нами ниже для сопоставления таблицы. В качестве примера для иллюстрации того, как понимается сегодня негативная и когнитивная симптоматика шизофрении, мы взяли предложенную Нэнси Андреасен шкалу SANS для оценки выраженности негативных симптомов [Andreasen NS, 1989; 1990].
Как легко увидеть из сравнения этих двух таблиц, представления О. Блёйлера о ключевых, облигатных симптомах шизофрении в значительной степени перекликаются с современными представлениями о негативной и когнитивной симптоматике при этой болезни. Различаются только используемые термины. В частности, представления О. Блёйлера об аутизме при шизофрении достаточно хорошо отображаются на подшкалу «ангедония — асоциальность» шкалы SANS, предложенной Нэнси Андреасен.


Как поэтапно «изгоняли» понятие аутизма по Блёйлеру из общей концепции шизофрении и к чему это привело
Как мы уже упоминали выше, О. Блёйлер считал весьма важным признаком «группы шизофрений», одним из четырех определяющих это заболевание «А», так называемый аутизм. Под этим термином О. Блёйлер понимал глубокое погружение больного в себя, в мир своих болезненных переживаний и фантазий, и наблюдаемую вследствие этого оторванность пациента от внешнего мира, его десоциализацию и социальную дезадаптацию [Frye RE, 2018].Концепция О. Блёйлера, включавшая в себя аутизм как один из ключевых, определяющих и патогномоничных признаков шизофрении, долгое время признавалась клинически валидной психиатрами самых разных взглядов и направлений (как биологически, так и психоаналитически ориентированными).
В 1943 году Лео Каннер впервые описал «ранний детский аутизм» (РДА) как отдельный специфический клинический синдром. Примерно в то же время Ганс Аспергер описал высокофункциональный аутизм, впоследствии названный в его честь «синдромом Аспергера». Оба этих автора рассматривали описанные ими синдромы как некую разновидность «детской шизофрении», то есть шизофрении, которая манифестирует в раннем детстве (в случае РДА) или несколько позже (в случае синдрома Аспергера) [Frye RE, 2018].
Такой взгляд на природу детского аутизма, как части шизофренического спектра, сохранялся в психиатрии до 1980 года, когда в DSM-III ввели отдельную диагностическую категорию РДА — как категорию, отличную от категории шизофрении и других психотических расстройств. Примерно с этого же времени, чтобы избежать терминологической путаницы, в западной литературе термин «аутизм» применительно к шизофрении, для описания специфической социальной отгороженности и дезадаптации, стали применять все реже, вплоть до полного отказа от его использования [Frye RE, 2018].
В 1987 году в DSM-III-R был введен термин «первазивное расстройство раннего развития, неуточненное» — для описания детей, симптоматика которых не полностью подходила под диагноз РДА, но тем не менее характеризовалась выраженным нарушением социальных навыков.
В 1994 году в DSM-IV был официально введен диагноз синдрома Аспергера [Frye RE, 2018].
В самой последней редакции DSM, DSM-5, принятой в 2013 году, часовая стрелка сделала полный оборот: отдельные диагностические категории для РДА, синдрома Аспергера и «первазивного расстройства раннего развития, неуточненного» были удалены из DSM, а вместо них введено понятие расстройств аутистического спектра (РАС), как непрерывного континуума расстройств, различающихся по степени тяжести клинической симптоматики [Frye RE, 2018].
Одновременно с этим была удалена из DSM проводившаяся ранее классификация всех симптомов РАС на нарушения речи (вербальной коммуникации), нарушения невербальной коммуникации (мимики, жестов), и нарушения социальных навыков. Все они были объединены под общим зонтичным понятием «нарушения коммуникации и социальных навыков». Обоснованием для удаления этого разделения из DSM послужило то, что в действительности очень сложно провести грань между нарушениями вербальной и невербальной коммуникации, и нарушениями прочих социальных навыков [Frye RE, 2018].
Многие авторы сегодня предлагают рассматривать РАС прежде всего как «расстройства социального взаимодействия», или как «болезни социального дефицита» (social deficit disorders) разной степени тяжести [Frye RE, 2018].
Такое своеобразное «изгнание» понятия аутизма по О. Блёйлеру из общей концепции шизофрении и перенос этого понятия исключительно в сферу ведения детской психиатрии не было всего лишь простым терминологическим изменением. Оно имело целый ряд негативных последствий. В частности, одним из важных негативных последствий такого «изгнания аутизма из концепции шизофрении» было то, что проблеме нарушений социализации больных шизофренией долгое время могло уделяться недостаточно внимания.
Между тем, если вспомнить об изначальной концепции О. Блёйлера, включавшей аутизм в число облигатных симптомов «группы шизофрений», а также о том, сколь часты на самом деле нарушения социальной адаптации при шизофрении, то становится очевидным, что эти симптомы играют очень важную роль и в клинической картине шизофрении, и во многом предопределяют инвалидизацию пациентов с этим заболеванием. Поэтому мы, признавая правомерность выделения РАС в отдельную диагностическую категорию и правомерность проведения различия между РАС и «детской шизофренией», а также целесообразность недопущения терминологической путаницы, в то же время не вполне согласны с состоявшимся де-факто «изгнанием понятия аутизма из концепции шизофрении».
Стоит заметить, что многие авторы еще с 1970-х годов предлагали рассматривать социальную дисфункцию при шизофрении как отдельный, специфический клинический синдром в рамках ее, или как отдельную ось или субдомен измерения психопатологии шизофрении [Strauss JS et al, 1974; Lezenweger MF. Dworkin RH, 1996; Mier D, Kirsch P, 2017].
А, например, в подглаве «Psychosis as a defining dimension in schizophrenia» главы о шизофрении свежего (2017 года) фундаментального руководства по психиатрии Каплана — Сэдока, среди характерных для шизофрении признаков, наряду с позитивной, негативной и когнитивной симптоматикой, отдельно через запятую упоминается социальная дисфункция [Ivleva EI, Tamminga CA, 2017].
Мы хотим предложить для социальной дисфункции при шизофрении, по аналогии с негативным, позитивным и депрессивным синдромами, а также синдромом когнитивных нарушений, наименование «синдром социального дефицита». Насколько нам известно, ранее в литературе этот термин не употреблялся.
Распространенность и клиническая важность нарушений социального функционирования при шизофрении
Как мы уже упоминали выше, социальная дисфункция (то есть выраженные нарушения социальной адаптации и функционирования в обществе, в частности нарушения в межличностных и коллективных социальных взаимодействиях, в дружеских, супружеских или партнерских отношениях, в способности заботиться о себе и тем более заботиться о других людях) является одной из ключевых, ядерных характеристик шизофрении, имманентно присущих этому заболеванию [Bellack AS et al, 1990; Hooley JM, 2010; Robertson BR et al, 2014; Suttajit S et al, 2015].Одной из главных причин того, что шизофрения традиционно рассматривалась и до сих пор рассматривается как тяжелое и инвалидизирующее психическое заболевание, которое обычно имеет прогноз в диапазоне от «довольно плохого» до «очень плохого», является как раз значительная выраженность при ней социальной дисфункции, то есть — стойкого и глубокого нарушения социальной адаптации и социального функционирования. Свежим доказательством этого тезиса является множество сегодняшних пациентов с шизофренией, которые, благодаря изобретению терапии АП, ныне не нуждаются в длительной или пожизненной институционализации, и могут жить на свободе, в обществе, однако при этом продолжают проявлять стойкие и выраженные нарушения социальной адаптации и признаки неудовлетворительного, низкого или очень низкого уровня социального функционирования [Moll MF, Saeki T, 2009].
Литературные данные систематически указывают на то, что социальная дисфункция при шизофрении, то есть нарушение психосоциального функционирования и социальной адаптации, характерное для пациентов с шизофренией, резко снижает их общее качество жизни. Кроме того, проявлениями (симптомами) или даже, скорее, следствиями синдрома социального дефицита являются, например, низкий уровень образования (в частности, из-за незаконченного или прерванного образования), отсутствие работы, неполная занятость или занятие неквалифицированным, низкооплачиваемым трудом, низкий уровень профессиональной квалификации, низкий социально-экономический статус, снижение или полная утрата способности к самостоятельному существованию (вплоть до утраты способности к простейшему бытовому самообслуживанию и к соблюдению личной гигиены, не говоря уже о финансовой независимости), одиночество (отсутствие супруга/супруги или интимного партнера/партнерши), бездетность, и даже бездомность (утрата жилья или бродяжничество) [Lieberman JA et al, 2008; Barnes TR et al, 2008; Saarni SI et al, 2010].
Показано, что снижение общего качества жизни и степени субъективной удовлетворенности жизнью сильнее коррелирует со степенью выраженности социальной дисфункции, чем с каким-либо другим доменом симптоматики шизофрении, включая такие ранее уже установленные сильные корреляты общего качества жизни, как степень выраженности негативной, когнитивной и депрессивной симптоматики. Кроме того, в очередной раз подтвердилось также, что снижение общего качества жизни и субъективной удовлетворенности жизнью у пациентов с шизофренией сильнее коррелирует со степенью выраженности негативной, когнитивной и депрессивной симптоматики, а также со степенью выраженности побочных эффектов (ПЭ) от терапии АП, чем со степенью выраженности позитивной (продуктивной) симптоматики [Salokangas RK et al, 2006].
Группа финских исследователей во главе с Хонканеном еще в 1996 году, при исследовании общего качества жизни и степени субъективной удовлетворенности жизнью у пациентов с шизофренией с помощью различных шкал, обратила внимание на то, что у этих пациентов в среднем значительно хуже социальное функционирование и степень социальной адаптированности, по сравнению с пациентами с любыми другими психическими заболеваниями [Koivumaa-Honkanen HT et al, 1996].
Кроме того, финские исследователи также обнаружили, что низкое общее качество жизни и неудовлетворенность жизнью у пациентов с шизофренией сильнее коррелируют с низким уровнем социального функционирования и с плохой социальной приспособленностью («неустроенностью в жизни»), чем с любым другим параметром, например, с выраженностью позитивной, негативной или депрессивной симптоматики [Koivumaa-Honkanen HT et al, 1996].
Позднее, в 2001 году, Мальм с соавторами использовали полуструктурированный опросник общего качества жизни и удовлетворенности жизнью (QOLC) для оценки данных параметров у 40 пациентов с шизофренией через 2 года после их последней госпитализации. Им удалось показать, что подавляющее большинство пациентов с шизофренией выражают сильное недовольство и неудовлетворенность практически всеми аспектами собственной жизни, но особенно — как раз именно теми аспектами, которые имеют отношение к проявлениям у них социальной дисфункции, к уровню их социального функционирования и социальной адаптации, например, одиночеством, отсутствием близких друзей, бездетностью, конфликтной и неблагополучной семейной жизнью, проблемами во взаимоотношениях с родственниками, соседями, друзьями, сотрудниками и другими окружающими лицами, отсутствием работы или тяжелой и малоквалифицированной работой, собственным низким уровнем образования и квалификации, низким уровнем доходов, низким социальным статусом, финансовыми проблемами (наличием неоплаченных долгов, неумением планировать собственные расходы и сопоставлять их со своим уровнем доходов, неумением экономить и копить деньги) и т. д. [Malm U et al, 2001].
Показано, что те или иные проявления синдрома социального дефицита (то есть, выраженные в той или иной степени нарушения социального функционирования и адаптации в реальном социальном мире), так же как и специфические и неспецифические КН, и некоторые проявления негативного синдрома (негативной симптоматики шизофрении) могут наблюдаться, и действительно часто наблюдались, у пациентов, у которых впоследствии развилась шизофрения, еще в продромальном периоде болезни, или даже в преморбиде, задолго до первого манифестного психоза (то есть задолго до появления «классической» продуктивной симптоматики) [Couture SM et al, 2006; Ivleva EI, Tamminga CA, 2017].
Кроме того, эти же проявления — как социальная дисфункция, так и различные специфические и неспецифические КН, и некоторые проявления негативной симптоматики — в более мягкой форме могут также наблюдаться, и часто наблюдаются, у пациентов из так называемых «групп высокого или очень высокого клинического риска развития психоза» — high or ultra-high clinical risk of psychosis group (например, у детей, у которых один или оба родителя страдают шизофренией, или у пациентов, которые по внешним признакам находятся в продромальном периоде, но еще не развили манифестный психоз). Часть таких пациентов (от 15 % до 40–50 %, по разным оценкам) впоследствии действительно манифестирует и получает диагноз шизофрении [Couture SM et al, 2006; Ivleva EI, Tamminga CA, 2017].
Эти же проявления — как синдром социального дефицита, так и различные специфические и неспецифические КН, и некоторые проявления негативной симптоматики — также могут наблюдаться, и часто наблюдаются, в смягченной форме у родственников пациентов с шизофренией, имеющих 1-ю и даже 2-ю степень родства с пациентом, но никогда за всю жизнь так и не развивающих манифестного психоза. Эти данные указывают на то, что социальная дисфункция, так же как и нейрокогнитивный дефицит, и негативная симптоматика шизофрении, могут иметь нейробиологическую, генетическую основу, и что эти нарушения могут лежать ближе к основам этиологии и патогенеза шизофрении, чем продуктивная симптоматика, наблюдаемая в период психозов [Couture SM et al, 2006; Ivleva EI, Tamminga CA, 2017].
Показано, что умение понимать социальный контекст, рамки допустимого и недопустимого в конкретном микросоциуме поведения (социальная когниция), умение распознавать и понимать чувства и эмоции других людей (эмоциональная когниция), умение делать обоснованные предположения о том, что думают и чувствуют, или чего хотят добиться теми или иными словами или поступками другие люди (то есть, умение строить свою собственную, внутреннюю модель психического состояния других людей — self-constructed internal theory of mind), — глубоко нарушены при шизофрении [Dodell-Feder D et al, 2015; Ivleva EI, Tamminga CA, 2017].
Вследствие этого мир социальных взаимодействий, в частности, взаимодействие с другими людьми и коллективами, выстраивание межличностных и внутригрупповых отношений, — представляется пациентам с шизофренией особенно сложным, запутанным и даже пугающим. Этому способствует также свойственное шизофрении нарушение способности к отфильтровыванию значимой (в данном случае — социально и/или эмоционально значимой) информации от незначимой, проявляющееся, например, в нарушении у них процессов преимпульсного ингибирования, или в их склонности к обобщению и категоризации вещей, предметов и явлений не по важнейшим, значимым признакам, а по признакам слабым и незначимым [Dodell-Feder D et al, 2015; Ivleva EI, Tamminga CA, 2017].
Трудности устранения социальной дисфункции при шизофрении
Широкое применение при лечении шизофрении первых АП (впоследствии названных ТАП), начавшееся с внедрения в 1950-х годах хлорпромазина, позволило значительно снизить остроту и выраженность позитивной (продуктивной) симптоматики шизофрении, и прежде всего — такой проблематичной для функционирования в обществе и для безопасности как общества, так и самого пациента симптоматики, как агрессивность, психомоторное возбуждение, грубые нарушения поведения. Даже у тех пациентов, у которых, несмотря на лечение ТАП, бред и галлюцинации сохранялись, или редуцировались лишь в незначительной степени, эти симптомы начинали меньше влиять или же совсем переставали влиять на поведение, провоцировать возбуждение, агрессивность, опасное или антисоциальное поведение. Это положение справедливо для лечения шизофрении с применением любых АП и сегодня [Couture SM et al, 2006; Kane JM, Correll CU, 2017].Этот эффект ТАП в то время позволил огромному количеству пациентов с шизофренией, ранее фактически «приговоренных» к длительной или даже пожизненной институционализации в закрытых психиатрических стационарах, впервые выйти на свободу, вернуться в семью и общество. Этот же эффект ТАП позволил значительно снизить частоту повторных госпитализаций при шизофрении, а часть случаев шизофрении (как обострений, так и первичных манифестных психозов) вообще изначально лечить исключительно в амбулаторном режиме, полностью избежав госпитализации и ее нежелательных психологических и социально-экономических последствий. Опять-таки, данное положение справедливо и сегодня, причем для любых АП [Couture SM et al, 2006; Kane JM, Correll CU, 2017].
Тем не менее, проблема улучшения долгосрочных функциональных исходов при шизофрении, и, в частности, проблема снижения уровня инвалидизации среди пациентов с шизофренией, не была решена с помощью лечения ТАП [Priebe S, 2007; Harvey PD, Bowie CR, 2012].
Это связано с недостаточной эффективностью ТАП в отношении негативной, когнитивной и депрессивной симптоматики шизофрении, а также с тем, что ТАП сами могут вызывать так называемую «вторичную негативную симптоматику», или НИДС, а также нейролептические депрессии, нейролептик-индуцированные КН. Кроме того, ТАП также вызывают ЭПС, многие проявления которого легко спутать с негативной симптоматикой шизофрении, с депрессией или с некоторыми проявлениями КН, свойственных самой шизофрении (например, брадипсихизм и аспонтанность, вызванные лекарственным паркинсонизмом, легко спутать с брадипсихизмом и аспонтанностью, вызванными самой болезнью) [Priebe S, 2007; Harvey PD, Bowie CR, 2012; Kane JM, Correll CU, 2017].
Все это послужило основанием для создания многочисленных так называемых ААП. Препараты этой группы действительно в среднем реже вызывают ЭПС, НИДС, нейролептические депрессии, нейролептик-индуцированные КН, а если и вызывают, то в более легкой форме. Более того, по некоторым данным, ААП в целом, как класс, даже могут сами обладать некоторой (хотя, скорее всего, довольно ограниченной) эффективностью и в отношении первичной негативной и депрессивной симптоматики шизофрении, и в отношении свойственных шизофрении КН [Priebe S, 2007; Harvey PD, Bowie CR, 2012; Kane JM, Correll CU, 2017].
Тем не менее, хотя создание и внедрение ААП и было огромным шагом вперед по сравнению с ТАП, массовый переход к применению ААП вместо ТАП привел к значительно меньшему, чем ожидалось при их создании, улучшению долгосрочных функциональных исходов у пациентов с шизофренией, и в том числе — к значительно меньшему, чем ожидалось, снижению у них выраженности синдрома социального дефицита.
Поэтому, несмотря на создание и широкое применение различных ААП при лечении шизофрении, проблема улучшения ее долгосрочных функциональных исходов, и, в частности проблема преодоления или уменьшения социальной дисфункции при этой болезни, — все еще остается весьма актуальной проблемой современной психиатрии [Priebe S, 2007; Harvey PD, Bowie CR, 2012; Kane JM, Correll CU, 2017].
Показано, что проявления социальной дисфункции, свойственной шизофрении, могут практически не уменьшаться, или же лишь в незначительной степени смягчаются, при стандартном лечении АП, даже при применении большинства современных ААП [Swartz MS et al, 2007; Keefe RS et al, 2007; Drake RE et al, 2017].
В связи с этим ряд авторов предположили, что необходимо искать новые перспективные методы «социализирующей терапии» при шизофрении, новые методы лечения свойственной этой болезни негативной и когнитивной симптоматики и связанной с ними социальной дисфункции. В том числе, наряду с расширением применения при этой болезни психотерапии и мер по социальной реабилитации и реадаптации пациентов, по их интеграции в семью и общество, нужно также искать новые методы фармакологической коррекции негативной и когнитивной симптоматики и связанной с ними социальной дисфункции [Stahl SM, 2013; Dodell-Feder D et al, 2015; Kane JM, Correll CU, 2017; Drake RE et al, 2017].
Роль дисфункции D3 подтипа дофаминовых рецепторов в развитии социальной дисфункции при шизофрении
Как уже упоминалось выше, все АП в целом, как класс, достаточно хорошо купируют позитивную (продуктивную) симптоматику шизофрении, такую, как бред и галлюцинации. Особенно хорошо АП способны купировать такие проявления позитивной симптоматики, как психомоторное возбуждение, агрессивность, грубые нарушения поведения. Этот эффект АП может проявляться даже в тех случаях, когда их эффективность в отношении бреда и галлюцинаций оказывается недостаточной [Millan MJ, 2005; Kane JM, Correll CU, 2017].Вместе с тем, известно также, что негативная (дефицитарная), депрессивная, когнитивная и диссоциальная симптоматика шизофрении гораздо хуже поддаются терапии АП [Millan MJ, 2005; Kane JM, Correll CU, 2017].
Это положение дел сохраняется и сегодня, даже при применении большинства современных ААП [Millan MJ, 2005; Kane JM, Correll CU, 2017].
Известно, что одной из самых глубоко нарушенных при шизофрении является дофаминергическая система мозга, и что все существующие на рынке АП оказывают свое антипсихотическое действие благодаря своему взаимодействию с дофаминергическими механизмами в ЦНС. В свое время установление именно этого факта привело к формулировке «дофаминовой теории шизофрении». Долгое время наибольшее значение как в этиологии и патогенезе шизофрении, так и в механизмах действия АП придавалось дофаминовым рецепторам подтипа D2. В частности, было показано, что для проявления действия как ТАП, так и большинства ААП (кроме клозапина и кветиапина) на позитивную (продуктивную) симптоматику шизофрении необходима блокада не менее 65 % от общего количества D2 рецепторов в стриатуме [Millan MJ, 2005; Stahl SM, 2013; Kane JM, Correll CU, 2017].
Между тем, рецепторов для дофамина в мозгу известно как минимум пять типов. Ученые достаточно давно понимали, что в этиологии и патогенезе разных субдоменов симптоматики шизофрении могут участвовать и активно участвуют и другие подтипы дофаминовых рецепторов, помимо D2 подтипа. Однако до недавнего времени изучению роли других четырех подтипов дофаминовых рецепторов в этиологии и патогенезе шизофрении, а также изучению их пригодности в качестве возможной терапевтической мишени для разработки новых перспективных классов АП, уделялось мало внимания [Millan MJ, 2005; Perez JM, Ghose S, 2017].
Одной из причин такого положения дел было то, что до недавнего времени у ученых не было возможности селективно визуализировать с помощью позитронно-эмиссионной томографии (ПЭТ), например, D3 или D4 дофаминовые рецепторы — для них не существовало высокоселективных радиоактивных лигандов. Это положение дел начало меняться только совсем недавно, с появлением D3 селективных радиолигандов, таких, как [11С]-PHNO, и D4 селективных радиолигандов, таких, как [11C]-NMSP [Perez JM, Ghose S, 2017].
Говоря об исследовании работы D3 дофаминовых рецепторов в живом мозге с помощью высокоселективных меченых радиолигандов, таких, как [11С]-PHNO, мы должны сделать одно важное замечание. А именно: PHNO, действительно, обладает высокой аффинностью к D3 подтипу дофаминовых рецепторов, и проявляет хорошую селективность к этому подтипу рецепторов in vitro. Однако в исследованиях in vivo его селективность к D3 подтипу дофаминовых рецепторов, к сожалению, оказывается далеко не столь хорошей. К счастью, пространственное распределение и плотность D3 и D2 подтипов дофаминовых рецепторов в разных областях мозга значительно различаются. Именно это замечательное свойство мозга позволяет ученым-исследователям, имея в руках лишь далеко не совершенные инструменты измерения — не очень D3 селективные in vivo радиолиганды, такие, как [11С]-PHNO, тем не менее успешно вычислять степень D3 селективности того или иного АП in vivo [Perez JM, Ghose S, 2017].
Это замечание важно по той причине, что в исследованиях in vitro ту или иную степень аффинности к D3 подтипу дофаминовых рецепторов, наряду с аффинностью к D2 подтипу, проявляют многие АП, если не большинство из них. Однако в исследованиях in vivo только лишь карипразин и блонансерин проявляют способность вытеснять меченый [11С]-PHNO из связи с D3 дофаминовыми рецепторами мозга [Perez JM, Ghose S, 2017].
В экспериментальных моделях шизофрении на животных было показано, что D3 подтип дофаминовых рецепторов может быть перспективной терапевтической мишенью для влияния на негативную и когнитивную симптоматику шизофрении, а также на проявления социальной дисфункции при ней. Это заставило ученых предположить, что создание новых ААП, которые бы предпочтительно блокировали D3, а не D2 подтип дофаминовых рецепторов, может дать этим новым АП терапевтические преимущества в отношении эффективности устранения негативной и когнитивной симптоматики шизофрении, а также в отношении улучшения социализации больных шизофренией [Millan MJ, 2005; Stahl SM, 2013; Perez JM, Ghose S, 2017; Takeuchi S et al, 2019].
Действительно, в экспериментальной модели шизофрении на крысах было показано, что внутрибрюшинное введение карипразина (парциального агониста D3 и D2 подтипов дофаминовых рецепторов с преимущественным связыванием с D3 подтипом) в дозах от 0,03 до 0,3 мг/кг значительно уменьшало неонатальную социальную изоляцию животных и приводило к повышению их двигательной активности [Watson DJG et al, 2016].
В другой экспериментальной модели шизофрении, вызванной введением крысам NMDA антагониста фенциклидина, было показано, что карипразин значительно эффективнее рисперидона устраняет негативную симптоматику и КН, вызванные введением фенциклидина (нарушения памяти, концентрации внимания, распознавания образов, нарушения обучаемости). В том числе, что особенно важно в контексте данной статьи, карипразин в этой модели оказался значительно эффективнее рисперидона в отношении устранения именно нарушений социальной и эмоциональной когниции у животных [Neill JC et al, 2016].
Возникает вопрос о том, насколько эти доклинические данные применимы к клинической эффективности карипразина в отношении влияния на социальное функционирование пациентов с шизофренией. Ниже мы обсудим доказательную базу по этому вопросу.
Доказательная база по эффективности и безопасности использования карипразина для улучшения социального функционирования пациентов с шизофренией
В ряде двойных слепых сравнительных РКИ, посвященных изучению сравнительной эффективности и безопасности применения карипразина, в сопоставлении с рисперидоном, в лечении шизофрении, особенно с преобладанием негативной симптоматики, было убедительно продемонстрировано, что применение карипразина ассоциируется со статистически достоверным улучшением не только в домене негативной симптоматики, но также с улучшением объективных показателей социального функционирования пациентов, по сравнению с применением рисперидона [Debelle M et al, 2015; Németh G et al, 2016; 2017 (b)].Так, в частности, в 2017 году были опубликованы результаты одного крупного (461 участник) многоцентрового двойного слепого сравнительного РКИ, посвященного сопоставлению эффективности и безопасности применения карипразина, в сравнении с рисперидоном, в лечении шизофрении, прежде всего с преобладанием негативной симптоматики [Németh G et al, 2017 (b)].
Весьма важно то, что это РКИ проводилось на протяжении достаточно длительного периода (26 недель). Это позволило авторам оценивать и сопоставлять влияние сравниваемых препаратов не только на выраженность симптомов из различных субдоменов симптоматики шизофрении, как таковых, но и на объективные параметры социального функционирования пациентов в реальном мире. После периода отмены предшествующей терапии, который составлял 2 недели, 231 пациент был рандомизирован в группу рисперидона (группу сравнения), а 230 пациентов — в группу карипразина (группу исследуемого активного лечения) [Németh G et al, 2017 (b)].
В качестве основного способа оценки и сопоставления эффективности лечения, а также в качестве первичной конечной точки (primary clinical endpoint), в этом РКИ использовалось изменение среднего балла по шкале негативной симптоматики PANSS Factor Score For Negative Symptoms (PANSS-FSNS), а также изменение среднего балла по шкале личностного и социального функционирования в реальном мире (PSP). Авторам этого РКИ удалось показать, что к сроку 26 недель снижение среднего балла по PANSS-FSNS в группе карипразина было статистически достоверно и значительно больше, чем таковое же снижение в группе рисперидона, при сопоставимой и стабильной эффективности обоих препаратов в отношении позитивной симптоматики [Németh G et al, 2017 (b)].
Однако еще более важно то, что, помимо более значительного снижения степени выраженности негативной симптоматики, пациенты, получавшие карипразин, также продемонстрировали более существенное улучшение объективных показателей шкалы PSP, по сравнению с пациентами, получавшими рисперидон. Это улучшение было зафиксировано в трех из четырех изучавшихся субдоменов личностного и социального функционирования [Németh G et al, 2017 (b)].
В другом двойном слепом сравнительном РКИ сопоставляли влияние лечения карипразином, в сравнении с лечением рисперидоном, на общую интегральную оценку качества жизни и удовлетворенности жизнью, с поправкой на годы жизни (QALY), у пациентов с шизофренией с преобладанием негативной симптоматики [Németh B et al, 2017 (a)].
Авторам этого РКИ удалось показать, что пациенты, получавшие карипразин, имели в среднем более высокую субъективную оценку общего качества своей жизни, более высокие показатели субъективной удовлетворенности своей жизнью и ее различными аспектами, а также более высокую субъективную оценку собственного состояния психического и соматического здоровья и собственного уровня социального функционирования, по сравнению с пациентами, получавшими рисперидон. Это привело к расчетному увеличению QALY на 0,029 на 1 пациента после 1 года лечения [Németh B et al, 2017 (a)].
Авторы данного исследования сделали вывод, что карипразин, в силу своего более выраженного, по сравнению с рисперидоном, положительного влияния на негативную симптоматику шизофрении, а также на объективные показатели личностного и социального функционирования и адаптации в реальном мире, и в силу более низкого, по сравнению с рисперидоном, уровня ПЭ и лучшей переносимости, может обеспечить значительное повышение общего качества жизни (QALY) при лечении пациентов с шизофренией, особенно с преобладанием негативной симптоматики [Németh B et al, 2017 (a)].
Карипразин может оказывать выраженное положительное влияние не только на измеренные по шкалам проявления негативной симптоматики шизофрении (более выраженное, чем у рисперидона), но и на объективные показатели личностного и социального функционирования и социальной адаптации в реальном мире, то есть на проявления социальной дисфункции [Németh G et al, 2017 (b); Németh B et al, 2017 (a)].
На наш взгляд, это может позволить называть карипразин «социализирующим препаратом при шизофрении».
Заключение
Как видно из приведенных нами данных литературы, новый ААП карипразин, в силу особенностей своего рецепторного профиля (он является парциальным агонистом D3 и D2 подтипов дофаминовых рецепторов с преимущественным связыванием с D3 подтипом), имеет теоретические преимущества перед другими ААП не только в отношении эффективности устранения негативной, когнитивной и депрессивной симптоматики шизофрении, но и в отношении положительного влияния на социальное функционирование пациентов в реальном мире.Это теоретическое предположение подтвердилось в РКИ, показавших преимущество карипразина перед рисперидоном не только в отношении уменьшения негативной симптоматики шизофрении, но и в отношении влияния на социализацию больных шизофренией и на их общее качество жизни (которое во многом зависит от степени социальной адаптированности больного). На наш взгляд, это может позволить называть карипразин «социализирующим препаратом при шизофрении».
В свете того, сколь важное значение имеет улучшение социальной адаптации пациентов с шизофренией для их долгосрочной функциональности, это свойство карипразина может являться очень важным. Оно может предоставить новые возможности для лечения этого тяжелого заболевания и, особенно, для уменьшения инвалидизации и социальной дезадаптации пациентов с шизофренией.
Сведения об авторах:
Беккер Роман Александрович — исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве;
Быков Юрий Витальевич — ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Морозов Петр Викторович — д-р мед. наук, проф. каф. психиатрии ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: prof.morozov@gmail.com
Список исп. литературыСкрыть список1. Беккер Р.А., Быков Ю.В., Морозов П.В. Выдающиеся психиатры ХХ века. — М.: ИД «Городец»; 2019.
2. Пятницкий Н.Ю. «Первичные», «основные» и «вторичные» симптомы шизофрении в концепции Е. Блёйлера. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017; 117 (8): 88–97.
3. Andreasen NC. Methods for Assessing Positive and Negative Symptoms. Mod Probl Pharmacopsychiatry. 1990;24:73-88.
4. Andreasen NC. The Scale for the Assessment of Negative Symptoms (SANS): Conceptual and Theoretical Foundations. Br J Psychiatry Suppl. 1989;(7):49-58.
5. Barnes TR, Leeson VC, Mutsatsa SH et al. Duration of untreated psychosis and social function: 1-year follow-up study of first-episode schizophrenia. Br J Psychiatry. 2008;193:203-209.
6. Bellack AS, Morrison RL, Wixted JT, Mueser KT. An analysis of social competence in schizophrenia. Br J Psychiatry. 1990;156:809-818.
7. Couture SM, Penn DL, Roberts DL. The functional significance of social cognition in schizophrenia: a review. Schizophr Bull. 2006;32(Suppl 1):S44-S63.
8. Debelle M, Németh G, Szalai E et al. Cariprazine as monotherapy for the treatment of schizophrenia patients with predominant negative symptoms: a double-blind, active controlled trial. European Neuropsychopharmacology. 2015(25):S510.
9. Dodell-Feder D, Tully LM, Hooker CI. Social impairment in schizophrenia: new approaches for treating a persistent problem. Curr Opin Psychiatry. 2015;28(3):236-242.
10. Drake RE, Bond GR, Ben-Zeev D. Psychiatric Rehabilitation in Schizophrenia. In: Sadock BJ, Sadock VA, Ruiz P. Kaplan & Sadock’s Comprehensive Textbook of Psychiatry. — 2017.
11. Frye RE. Social Skills Deficits in Autism Spectrum Disorder: Potential Biological Origins and Progress in Developing Therapeutic Agents. CNS Drugs. 2018;32(8):713-734.
12. Harvey PD, Bowie CR. Cognitive enhancement in schizophrenia: Pharmacological and Cognitive Remediation Approaches. Psychiatric Clin North Am. 2012;35:683-698.
13. Harvey PD, Keefe RS, Eesley CE. Neurocognition in Schizophrenia. In: Sadock BJ, Sadock VA, Ruiz P. Kaplan & Sadock’s Comprehensive Textbook of Psychiatry. — 2017.
14. Hegarty JD, Baldessarini RJ, Tohen M et al. One hundred years of schizophrenia: a meta-analysis of the outcome literature. Am J Psychiatry. 1994;151:1409-1416.
15. Hooley JM. Social factors in schizophrenia. Curr Direct Psychol Sci. 2010;19:238-242.
16. Ivleva EI, Tamminga CA. Psychosis as a Defining Dimension in Schizophrenia. In: Sadock BJ, Sadock VA, Ruiz P. Kaplan & Sadock’s Comprehensive Textbook of Psychiatry. — 2017.
17. Jonsdottir A, Waghorn G. Psychiatric disorders and labour force activity. Ment Health Rev Jr 2015;20:13.
18. Juckel G, Morosini PL. The new approach: psychosocial functioning as a necessary outcome criterion for therapeutic success in schizophrenia. Curr Opin Psychiatry. 2008;21(6):630-639.
19. Kane JM, Correll CU. Schizophrenia: Pharmacological Treatment. In: Sadock BJ, Sadock VA, Ruiz P. Kaplan & Sadock’s Comprehensive Textbook of Psychiatry. — 2017.
20. Keefe RS, Bilder RM, Davis SM et al. Neurocognitive effects of antipsychotic medications in patients with chronic schizophrenia in the CATIE Trial. Arch Gen Psychiatry. 2007;64:633-647.
21. Knapp M, Mangalore R, Simon J. The global costs of schizophrenia. Schizophr Bull. 2004;30:279-293.
22. Koivumaa-Honkanen HT, Viinamäki H et al. Correlates of life satisfaction among psychiatric patients. Acta Psychiatr Scand. 1996;94(5):372-378.
23. Kozma C, Dirani R, Canuso C, Mao L. Change in employment status over 52 weeks in patients with schizophrenia: an observational study. Curr Med Res Opin. 2011;27:327-333.
24. Lewis SF, Escalona R, Keith SJ. Phenomenology of Schizophrenia. In: Sadock BJ, Sadock VA, Ruiz P. Kaplan & Sadock’s Comprehensive Textbook of Psychiatry. — 2017.
25. Lezenweger MF, Dworkin RH. The dimensions of schizophrenia phenomenology. Not one or two, at least three, perhaps four. Br J Psychiatry. 1996;168:432-440.
26. Lieberman JA, Drake RE, Sederer LI et al. Science and recovery in schizophrenia. Psychiatr Serv. 2008;59(5):487-496.
27. Malm U, May P, Dencker S. Evaluation of the quality of life in schizophrenic outpatients: A checklist. Schizophr Bull. 2001;7:477-486.
28. Mangalore R, Knapp M. Cost of schizophrenia in England. J Ment Health Policy Econ. 2007;10:23-41.
29. Mier D, Kirsch P. Social-Cognitive Deficits in Schizophrenia. Curr Top Behav Neurosci. 2017;30:397-409.
30. Millan MJ. [Dopamine D3 receptors as a novel target for improving the treatment of schizophrenia]. [Article in French]. Med Sci (Paris). 2005;21(4):434-442.
31. Moll MF, Saeki T. Social life of people with diagnosis of schizophrenia, attended at a psychosocial care center. Rev Lat Am Enfermagem. 2009;17(6):995-1000.
32. Nasrallah HA, Targum SD, Tandon R et al. Defining and measuring clinical effectiveness in the treatment of schizophrenia. Psychiatr Serv. 2005;56(3):273-282.
33. Neill JC, Grayson B, Kiss B et al. Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symptoms in a rodent model of schizophrenia symptomatology. Eur Neuropsychopharmacol. 2016;26(1):3-14.
34. Németh B, Molnár A, Akehurst R et al. Quality-adjusted life year difference in patients with predominant negative symptoms of schizophrenia treated with cariprazine and risperidone. J Comp Eff Res. 2017;6(8):639-648.
35. Nemeth G, Debelle M, Laszlovszky I et al. Monotherapy treatment with cariprazine for the treatment of predominant negative symptoms of patients with schizophrenia: a double-blind, active comparator-controlled trial. European Psychiatry. 2016;33:S303.
36. Németh G, Laszlovszky I, Czobor P et al. Cariprazine versus risperidone monotherapy for treatment of predominant negative symptoms in patients with schizophrenia: a randomised, double-blind, controlled trial. The Lancet. 2017;389(10074):1103-1113.
37. Perez JM, Ghose S. Cellular and Molecular Neuropathology of Schizophrenia. In: Sadock BJ, Sadock VA, Ruiz P. Kaplan & Sadock’s Comprehensive Textbook of Psychiatry. — 2017.
38. Priebe S. Social outcomes in schizophrenia. Br J Psychiatry Suppl. 2007;50:s15-20.
39. Robertson BR, Prestia D, Twamley EW et al. Social competence versus negative symptoms as predictors of real world social functioning in schizophrenia. Schizophr Res. 2014;160(1-3):136-141.
40. Saarni SI, Viertiö S, Perälä J et al. Quality of life of people with schizophrenia, bipolar disorder and other psychotic disorders. Br J Psychiatry. 2010;197:386-394.
41. Salokangas RK, Honkonen T, Stengård E, Koivisto AM. Subjective life satisfaction and living situations of persons in Finland with long-term schizophrenia. Psychiatr Serv. 2006;57(3):373-381.
42. Souetre E. Economic evaluation in schizophrenia. Neuropsychobiology. 1997;35:67-69.
43. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. Cambridge University Press. 4th Ed. 2013. ISBN 978-1-107-68646-5.
44. Strauss JS, Carpenter WT, Bartko J. The diagnosis and understanding of schizophrenia. III. Speculations on the process that underlies schizophrenic symptoms. Schizophr Bull. 1974;11:61-75.
45. Suttajit S, Arunpongpaisal S, Srisurapanont M et al. Psychosocial functioning in schizophrenia: are some symptoms or demographic characteristics predictors across the functioning domains? Neuropsychiatr Dis Treat. 2015;11:2471-2477.
46. Suzuki T, Remington G, Mulsant BH et al. Defining treatment-resistant schizophrenia and response to antipsychotics: a review and recommendation. Psychiatry Res. 2012;197(1-2):1-6.
47. Swartz MS, Perkins DO, Stroup TS et al. Effects of antipsychotic medications on psychosocial functioning in patients with chronic schizophrenia: findings from the NIMH CATIE study. Am J Psychiatry. 2007;164:428-436.
48. Takeuchi S, Hida H, Uchida M et al. Blonanserin ameliorates social deficit through dopamine-D3 receptor antagonism in mice administered phencyclidine as an animal model of schizophrenia. Neurochem Int. 2019;128:127-134.
49. Tamminga CA. Schizophrenia: Introduction and Overview. In: Sadock BJ, Sadock VA, Ruiz P. Kaplan & Sadock’s Comprehensive Textbook of Psychiatry. — 2017.
50. Trauer T, Duckmanton RA, Chiu E. Estimation of costs of public psychiatric treatment. Psychiatr Serv. 1998;49:440-442.
51. Watson DJG, King MV, Gyertyán I et al. The dopamine D₃-preferring D₂/D₃ dopamine receptor partial agonist, cariprazine, reverses behavioural changes in a rat neurodevelopmental model for schizophrenia. Eur Neuropsychopharmacol. 2016;26(2):208-224.
52. World Health Organization. The Global Burden of Disease: 2004 Update. Geneva, Switzerland: WHO Press; 2008.
53. Wyatt RJ, Henter I, Leary MC, Taylor E. An economic evaluation of schizophrenia 1991. Soc Psychiatry Psychiatr Epidemiol. 1995;30:196-205.

